Журнал неорганической химии, 2021, T. 66, № 2, стр. 149-159
Особенности кристаллизации органо-неорганического перовскита MAPbI3 при взаимодействии PbI2 с реакционными полииодидными расплавами
Н. Н. Удалова a, А. С. Тутанцев a, С. А. Фатеев a, Е. А. Жаренова a, Н. А. Белич a, Е. М. Немыгина a, А. В. Рябова b, Е. А. Гудилин a, c, А. Б. Тарасов a, c, *
a Московский государственный университет имени М.В. Ломоносова, Факультет наук о материалах
119991 Москва, Ленинские горы, 1, Россия
b Институт общей физики им. А.М. Прохорова РАН
119991 Москва, ул. Вавилова, 38, Россия
c Московский государственный университет имени М.В. Ломоносова, Химический факультет
119991 Москва, Ленинские горы, 1, Россия
* E-mail: Alexey.bor.tarasov@yandex.ru
Поступила в редакцию 28.04.2020
После доработки 25.05.2020
Принята к публикации 30.05.2020
Аннотация
Исследованы стадии формирования органо-неорганического галогенидного перовскита MAPbI3 из реакционных полииодидных расплавов метиламмония при взаимодействии с пластинчатыми кристаллами PbI2 при комнатной температуре. Установлено, что основным механизмом кристаллизации перовскита в указанных условиях является локальное растворение свинецсодержащего предшественника и кристаллизация гомогенно формирующихся зародышей. Содержание иода в реакционной смеси выступает в качестве важнейшего параметра контроля скорости и глубины протекания конверсии PbI2, что может быть использовано для разработки новых подходов к получению светопоглощающих слоев солнечных батарей с управляемой морфологией покрытия.
ВВЕДЕНИЕ
В настоящее время весьма актуальными являются разработки тонкопленочных солнечных элементов нового поколения с использованием гибридных органо-неорганических перовскитоподобных соединений на основе сложных галогенидов свинца. Указанные соединения имеют состав ABX3, где А+ – органический или неорганический однозарядный катион (метиламмоний – МА+ и др.), В2+ – катион металла (чаще всего Pb2+), X– – галогенид-анион (I–, Br–) [1], а солнечные элементы на их основе характеризуются потенциально более низкой стоимостью и простотой производства по сравнению с доминирующими сегодня на рынке кремниевыми солнечными элементами [2]. При этом перовскитные солнечные элементы (ПСЭ) демонстрируют высокие КПД (до 25.2% [3]), величины которых существенно превышают КПД органических (17.4%) и сенсибилизированных красителем “ячеек Гретцеля” (12.3%) [4]. Это связано с уникальными свойствами перовскитного светопоглощающего материала [5], а именно: с высокой оптической плотностью (~105 см–1 [6]), оптимальной шириной запрещенной зоны и возможностью ее варьирования в широких пределах [7], большой длиной свободного пробега носителей заряда (от 100 нм [8] до 1 мкм [9]) и высокой толерантностью материала к дефектам [10], что позволяет достичь больших значений плотности тока и напряжения, генерируемых ПСЭ.
Известно большое количество методов синтеза органо-неорганических свинец-галогенидных перовскитов, среди которых доминируют растворные технологии благодаря своей простоте, низкой стоимости и масштабируемости [11, 12]. Однако серьезным препятствием к масштабному технологическому нанесению тонких пленок перовскита растворным методом из стандартных апротонных растворителей (диметилсульфоксида и диметилформамида) является формирование разнообразных кристаллосольватов с молекулами растворителя [13, 14], которые зачастую ведут к ухудшению морфологии и качества пленок перовскитов [15, 16]. Двухстадийные методы синтеза, основанные на нанесении тонкой пленки свинецсодержащего соединения (чаще всего PbI2, но также используются Pb, PbO, Pb(CH3COO)2 и др.) и ее последующей конверсии молекулами иодида метиламмония (MAI) в перовскит MAPbI3, позволяют избежать побочного процесса образования кристаллосольватов, но требуют точного контроля скорости и полноты протекания реакции: MAI + PbI2 → MAPbI3 [17]. Конверсию иодида свинца можно проводить как в газовой фазе методом вакуумного термического напыления MAI, так и в растворе MAI в подходящем растворителе, например в изопропаноле. В первом случае конверсия осложнена неравномерным распределением паров MAI в вакуумной камере и частичным разложением органического галогенида [18]. Растворная конверсия PbI2 является более простым методом, реализуемым в любых лабораторных условиях. В данном случае скорость и глубина протекания конверсии зависят от начальных условий – концентрации MAI, температуры, химической природы прекурсора свинца, а также времени взаимодействия [17]. Зачастую неоптимальные условия конверсии приводят к образованию в финальных пленках примесных фаз MAI или PbI2 [19] и дефектам упаковки [20], что ухудшает функциональные свойства светопоглощающего материала, и данный метод практически неприменим для получения крупнокристаллических и монокристаллических пленок перовскита [21].
В последнее время получает развитие принципиально новый подход к синтезу органо-неорганических перовскитов, основанный на конверсии свинецсодержащих соединений реакционными полииодидными расплавами (РПР) метиламмония MAIx и/или формамидиния FAIx [22]. Конверсия металлического свинца (или солей свинца) полииодидным расплавом MAI3 не требует использования растворителей и протекает без побочных процессов согласно реакции: Pb + MAI3 → MAPbI3. При этом скорость данного процесса в несколько раз превышает аналогичную скорость конверсии свинца раствором MAI в изопропаноле [23], а размер кристаллов перовскита достигает нескольких микрометров [22]. Данным методом удалось получить ПСЭ с КПД более 17% [24], а также перовскитный модуль площадью 100 см2 [25]. Реакционные полииодидные расплавы и их растворы позволяют также получать текстурированные тонкие пленки перовскита методом графоэпитаксии в замкнутом пространстве [26], что открывает путь к разработкам методики роста монокристаллических пленок органо-неорганического перовскита c улучшенными функциональными характеристиками.
Для практического внедрения указанных методик получения органо-неорганических перовскитов с использованием РПР и их масштабирования необходимо понимание механизма кристаллизации перовскита из полииодидных расплавов. Использование в качестве модельного объекта (предшественника) пластинчатых кристаллов иодида свинца с преимущественной ориентацией ⟨001⟩ позволяет проводить анализ процесса конверсии PbI2 в условиях минимального количества дефектов и микронапряжений в прекурсоре, а также с максимально близкими значениями свободной энергии поверхности монокристаллических пластинок PbI2 в ансамбле. Аналогичное исследование механизма конверсии монокристаллических пластинок PbI2 при использовании растворов MAI в изопропаноле, а также паров MAI в вакууме было проведено в [23]. Авторы этой работы выявили различия в процессах конверсии PbI2. В растворе наблюдается преимущественно ориентированный рост MAPbI3 в направлении ⟨202⟩ через эволюцию плоскости (001) иодида свинца; в газовой фазе, напротив, не наблюдается выраженной ориентации кристаллов MAPbI3, что авторы [23] связывают с избыточной кинетической энергией ионов MA+ и I– в условиях газофазной конверсии.
В настоящей работе проведен анализ процесса конверсии монокристаллических пластинок PbI2 реакционным полииодидным расплавом MAIx разной стехиометрии при комнатной температуре, а также рассмотрено влияние разбавления РПР на характер, скорость и глубину протекания конверсии иодида свинца в органо-неорганический перовскит.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез пластинчатых кристаллов PbI2 проводили путем контролируемого охлаждения пересыщенного водного раствора PbI2 на предварительно очищенных стеклянных подложках. Виалу с раствором и подложкой нагревали до 90°С, после чего охлаждали до комнатной температуры для протекания кристаллизации. Для предотвращения образования PbI(OH) раствор подкисляли уксусной кислотой до рН < 4. В результате на подложках формировался ансамбль пластинок PbI2 размером от 10 до 50 мкм и толщиной <1 мкм. После этапа кристаллизации подложку промывали изопропанолом (ИПС) и сушили в токе инертного газа.
Конверсия пластинок PbI2 полииодидным расплавом или раствором РПР в ИПС. Реакционный полииодидный расплав MAIx (x = 3, 5, 6, 6.5, 7) готовили путем смешивания порошков иодида метиламмония (MAI) и кристаллического иода (I2) в необходимых пропорциях в стеклянных виалах при комнатной температуре. Для гомогенизации смеси расплав непрерывно перемешивали на магнитной мешалке в течение нескольких часов. Для этих целей применяли также ультразвуковую ванну.
В ряде случаев использовали раствор РПР в ИПС. Для этого брали предварительно осушенный молекулярными ситами изопропанол. Количество ИПС рассчитывали относительно массы MAI: 5 и 10 мг/мл (0.029 и 0.059 моль/л соответственно). Для исследования структуры расплава в зависимости от концентрации ИПС в РПР методом спектроскопии КР использовали добавки спирта для достижения концентрации РПР от 0.07 до 7.3 моль/л.
Конверсию пластинок PbI2 проводили в открытой и закрытой конфигурации. В первом случае расплав или смесь РПР-ИПС накапывали на подложку с пластинками PbI2, по истечении заданного времени взаимодействия подложку промывали большим количеством охлажденного безводного изопропанола. В случае закрытой системы каплю РПР прижимали сверху предметным стеклом, ограничивая тем самым испарение иода и сопутствующее изменение стехиометрии MAI-I2 в ходе конверсии.
Методы исследования. Фазовый состав порошкообразных образцов анализировали методом рентгенофазового анализа на дифрактометре Bruker Advance D8 (Германия) в геометрии Брегга–Брентано (CuKα-излучение). Анализ морфологии проводили при помощи растрового электронного микроскопа (РЭМ) Zeiss Supra 40 (Германия), оснащенного энергодисперсионным детектором X-max 80 (Oxford) для исследования образцов методом рентгеноспектрального микроанализа (РСМА). Люминесцентное картирование проводили с использованием лазерного сканирующего конфокального микроскопа LSM-710 (Carl Zeiss Microscopy, Германия). Возбуждение люминесценции осуществляли лазером с длиной волны 458 нм. Для получения двухцветных изображений люминесценцию регистрировали в диапазонах 470–590 нм (зеленый канал) и 620–760 нм (красный канал). Анализ структуры РПР и его смеси с ИПС проводили методом спектроскопии комбинационного рассеяния на спектрометре Renishaw InVia (Англия) при использовании лазерного излучения 514.5 или 633 нм и длиннофокусного 50-кратного объектива. Мощность лазера составляла 10% от максимальной, время накопления сигнала в каждой точке 30 с.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе рассмотрена модельная система на основе органо-неорганического перовскита MAPbI3, где фаза PbI2 является основной фазой-предшественником в процессе кристаллизации перовскита разными методами (газофазный синтез, конверсия Pb раствором MAI и др.). Согласно ранее опубликованному изотермическому сечению трехкомпонентной фазовой диаграммы Pb–MAI–I2 при комнатной температуре [22], смешение перовскита с иодом приводит к смещению фигуративной точки состава в сторону двух- и трехфазных полей, для которых кристаллический PbI2 и жидкий полииодидный расплав MAIx являются равновесными фазами (рис. 1а). При этом происходит перекристаллизация органо-неорганического перовскита [27], что хорошо видно на микрофотографиях (рис. 1б) по образованию кубических кристаллов перовскита размером ~10 мкм из исходной пленки, состоящей преимущественно из нитевидных кристаллов. Как видно из фазовой диаграммы, добавление в систему достаточного количества иода (точка 2 на диаграмме) позволяет перейти в область равновесия между твердым PbI2 и жидким РПР состава ~MAI7. Использование данной смеси в качестве исходной при синтезе MAPbI3 позволяет избавиться от исходной примеси перовскитной фазы, а также ввести дополнительный параметр (количество иода в системе), влияющий на скорость и глубину протекания конверсии иодида свинца в ходе постепенного изменения стехиометрии MAIx. В сравнении со стандартным подходом к конверсии PbI2 раствором MAI в ИПС наличие дополнительного параметра для контроля конверсии иодида свинца полииодидным расплавом является несомненным преимуществом с точки зрения оптимизации методик синтеза материалов на основе гибридного перовскита.
Рис. 1.
Изотермическое сечение (298 K) трехкомпонентной фазовой диаграммы Pb–MAI–I2 (а); оптические микрофотографии пленки перовскита MAPbI3 до (1), во время (2) и после (3) воздействия парами иода (б). Все три стадии обозначены на сечении фазовой диаграммы соответствующими точками.
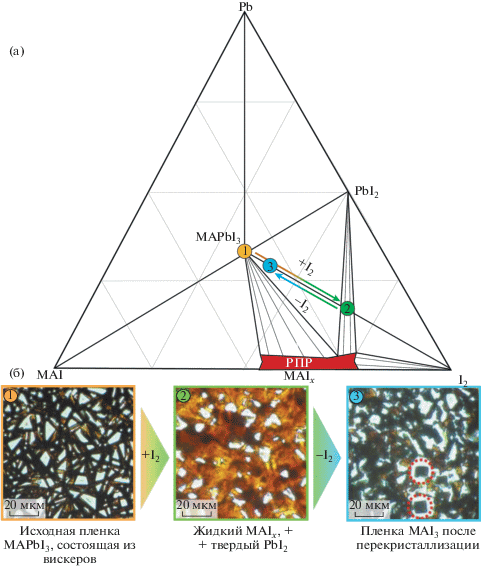
Процесс удаления иода из РПР, находящегося в контакте с PbI2, происходит самопроизвольно при комнатной температуре в условиях открытой системы. Эффективным способом удаления иода является также селективная экстракция неполярным растворителем (тетрахлористым углеродом, гептаном и др.). Во всех случаях после полного удаления избытка иода, что соответствует движению от точки 2 до точки 1 на сечении фазовой диаграммы (рис. 1а), образуется однофазный перовскит MAPbI3 без примесей PbI2 или MAI (рис. 2).
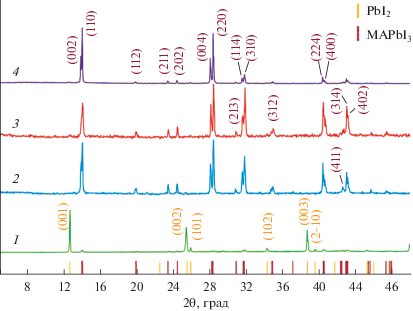
Рис. 2.
Дифрактограммы твердой фазы до испарения иода (1) (соответствует точке 2 на сечении фазовой диаграммы рис. 1) и после удаления иода при 25°С (2), при 100°С (3) и путем экстракции иода в неполярный растворитель CCl4 (4). В скобках на рисунке приведены индексы Миллера для тетрагональной структуры перовскита (бордовый цвет) и гексагональной структуры PbI2 (оранжевый цвет).
Результаты взаимодействия РПР с PbI2 и другими соединениями свинца напрямую зависят от содержания иода в расплаве согласно равновесной реакции PbI2 + MAIx ⇄ MAPbI3 + (x – 1)/2I2. На рис. 3 приведены сравнительные РЭМ-микрофотографии пластинок PbI2 после выдержки в течение 30 c в РПР с разным содержанием иода. Эксперимент проводили в закрытой системе без самопроизвольного испарения иода. Согласно полученным данным, полная конверсия PbI2 в перовскит протекает только при взаимодействии с РПР в диапазоне составов MAI5–MAI3. В пользу этого свидетельствуют кубическая форма кристаллов и соотношение I : Pb = 2.97, соответствующее стехиометрии MAPbI3, по данным РСМА. Увеличение содержания иода в РПР до MAI6 приводит к сдвигу равновесия в сторону реагентов, в результате чего конверсия иодида свинца протекает частично с локальным образованием зародышей перовскита (соотношение I : Pb = 2.27). Дальнейшее увеличение содержания иода полностью останавливает конверсию PbI2, сохраняя гексагональную форму частиц и соответствующее соотношение I : Pb ≃ 2. На микрофотографии пластин после MAI6,5 видны следы частичного растворения PbI2 преимущественно по краям частиц. По проведенным оценкам, растворимость свинца и его продуктов (PbI2, MAPbI3) в РПР при комнатной температуре составляет ~0.5 мол. % (~0.04 моль/л свинца в MAI7 и 0.035 моль/л свинца в MAI3).
Рис. 3.
Микрофотографии образцов PbI2 после выдержки в течение 30 c в РПР разного состава в закрытой системе. Соотношение I : Pb, определенное методом РСМА, указано для каждого образца.

Описанную выше зависимость скорости и глубины протекания конверсии PbI2 в перовскит от содержания иода в РПР можно объяснить высоким энтропийным вкладом жидкой фазы в свободную энергию системы при малой энергии формирования перовскитной фазы, находящейся в равновесии с расплавом. При этом переход катионов метиламмония из фазы перовскита в расплав необходим для стабилизации полииодидного расплава. Обогащение РПР иодом усиливает этот процесс. Рассматриваемую ситуацию можно представить как “разбавление” MAI в РПР, где роль “растворителя” играет I2, формирующий пространственную сетку благодаря слабым водородным связям NH⋅⋅⋅I и галоген-галогенным связям внутри полииодид-анионов [28]. В сравнении с высоким энтропийным вкладом в формирование РПР энергии образования решетки перовскита (ΔfG0 = –10.2 кДж/моль для реакции PbI2 + + MAI = MAPbI3 [29, 30]) оказывается недостаточно для ее энергетической стабилизации катионом метиламмония в рассматриваемых условиях присутствия избытка иода. Из-за низкой энергии образования фазы перовскита данный класс органо-неорганических свинец-галогенидных соединений подвержен необратимой деградации в сравнительно мягких условиях (повышенная температура от 150°С [31], относительная влажность >55% [32], солнечное излучение [33] и др.) [34, 35].
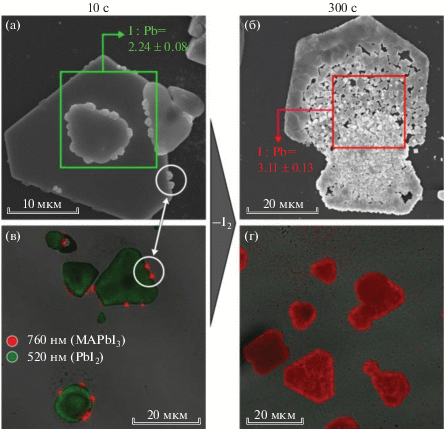
Для определения основных стадий кристаллизации органо-неорганического перовскита в условиях постепенного изменения стехиометрии MAIx в ходе удаления иода на пластинки PbI2 воздействовали полииодидным расплавом MAI7 в условиях открытой системы. В этом случае равновесие реакции PbI2 + MAIx$ \rightleftarrows $ MAPbI3 + (x – 1)/2I2↑ постепенно сдвигается в сторону ее продуктов. Выбор данного состава РПР обусловлен отсутствием в начальных равновесных условиях примеси перовскита. На рис. 4б–4г представлены микрофотографии частиц PbI2 на разных стадиях конверсии расплавом в течение 10, 30 и 300 с. После 10 с взаимодействия с РПР наблюдается большое количество зародышей перовскита, основная масса которых расположена по ребрам пластин иодида свинца, что, вероятнее всего, связано с избытком поверхностной энергии ребер, обеспечивающих расплав ионами свинца за счет их более интенсивного растворения, чем на гладкой поверхности. С увеличением времени конверсии дальнейшая кристаллизация перовскита происходит преимущественно на разупорядоченных зародышах с наследованием их ориентации, а также на ростовых дефектах кристалла (рис. 4в). Методом люминесцентного картирования доказана принадлежность зародышей на поверхности частиц PbI2 к фазе MAPbI3, обладающей максимумом люминесценции при 760 нм, в отличие от пика люминесценции при 520 нм у PbI2 (красный и зеленый каналы на рис. 5 соответственно). Из данных РСМА и люминесцентного картирования следует, что пластины иодида свинца полностью конвертируются в перовскит за 5 мин, что в разы быстрее по сравнению с временем полной конверсии аналогичных монокристаллических пластин растворами MAI в ИПС [23].
Рис. 4.
РЭМ-микрофотографии пластин PbI2 до конверсии (а) и на разных стадиях конверсии расплавом MAI7 (б–г) и смесью расплава MAI7 с изопропанолом (д–ж). Сравнение морфологии частиц на начальной стадии конверсии в течение 10 с в зависимости от концентрации MAI7 в ИПС (з).

Рис. 5.
РЭМ-микрофотографии (а, б) и изображения с конфокального люминесцентного микроскопа (в, г) частиц PbI2 после 10 и 300 c конверсии расплавом MAI7. Выделенные цветом рамки указывают на области регистрации сигнала РСМА с соответствующими значениями соотношения I : Pb для каждого образца. Окрашивание люминесцентных карт проведено по двум диапазонам: 470–590 нм (зеленый канал, соответствует пику люминесценции PbI2) и 620–760 нм (красный канал, соответствует пику люминесценции MAPbI3).
При многократном разбавлении РПР изопропанолом наблюдается значительное возрастание количества центров кристаллизации перовскита, которые равномерно покрывают всю поверхность пластин иодида свинца (рис. 4д–4ж). С увеличением времени конверсии морфология частиц практически не меняется, а размер кристаллов перовскита не превышает 1 мкм. Это объясняется сильным снижением растворимости иодида свинца в смеси РПР с изопропанолом и, как следствие, более интенсивным зародышеобразованием перовскита вблизи точки насыщения раствора. Еще более сильное разбавление РПР приводит к менее активному зародышеобразованию, что видно по сравнительным микрофотографиям пластин на начальном этапе конверсии PbI2 растворами РПР в ИПС с концентрацией MAI 10 и 5 мг/мл (рис. 4з).
Количественную оценку равновесия растворения–кристаллизации PbI2 как в РПР, так и в разбавленных растворах РПР в изопропаноле можно провести с помощью модели химического равновесия, учитывающего собственную растворимость PbI2 в изопропаноле, которое можно охарактеризовать произведением растворимости (ПР), константами комплексообразования иодоплюмбатных комплексов (K) и константой диссоциации трииодид-ионов в данной среде (Kdiss). Уравнения ключевых химических равновесий для данной системы приведены в табл. 1.
Таблица 1.
Уравнения ключевых химических равновесий
| Равновесие | Среда | Константа |
|---|---|---|
| PbI2 ↔ Pb2+ + 2I– | Изопропанол | ПР(ипс) |
| Pb2+ + (2 + x)I– ↔ [PbI2 + x]x– | Раствор I– в изопропаноле/РПР | K(ипс)/K(РПР) |
| PbI2 + xI– ↔ [PbI2 + x]x– | Раствор I– в изопропаноле/РПР | K` = K/ПР |
| [I3]– ↔ I2 + I– | Раствор РПР в изопропаноле/РПР | Kdiss(ипс), Kdiss(РПР) |
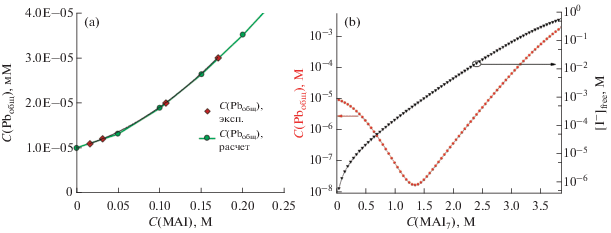
Константа диссоциации $\left[ {{\text{I}}_{{\text{3}}}^{--}} \right]$ в ИПС известна из литературных данных ($K_{{{\text{diss}}}}^{{\left( {{\text{ипс}}} \right)}}$ = 10–4.65) [36], численные значения других констант можно оценить по известным данным. Так, величину ПР иодида свинца в изопропаноле и константу реакции (3) можно найти исходя из зависимости растворимости PbI2 от концентрации MAI в ИПС, приведенной в работе [37] (рис. 6а). Поскольку концентрация ионов свинца в различных формах и концентрация иодид-иона в растворе отличаются почти на 4 порядка, величину растворимости PbI2 в чистом изопропаноле можно считать близкой к 10–5 моль/л, что позволяет оценить его ПР как 6.4 × 10–14.
Рис. 6.
Зависимость общей концентрации ионов свинца в растворе от концентрации иодида метиламмония (MAI) в изопропаноле (a) и зависимости расчетных концентраций свободного иодид-иона ([I–]free) и соответствующей концентрации ионов свинца (CPbобщ) в растворе от концентрации MAI7 в изопропаноле (б). Для построения графика (а) использованы литературные данные [37].
Даже не располагая достоверной информацией о доминирующих формах иодоплюмбатных комплексов в избыточных по иодид-анионам растворах PbI2 в изопропаноле, можно тем не менее провести расчет условной константы K '(х), отражающей отношение реальной константы комплексообразования (2) и ПР. Наилучшая аппроксимация экспериментальных значений растворимости выполняется при х = 1.5 (K ' = 2.8 × 10–4), откуда можно оценить среднюю константу устойчивости комплексов [PbI2 +х]х– в растворе изопропанола: $K_{{\left( {х{\text{ }} = {\text{1}}.{\text{5}}} \right)}}^{{\left( {{\text{ипс}}} \right)}}$ = 7 × 1010. Следует отметить, что при близких целочисленных значениях х (1, 2) не удается корректно описать зависимость растворимости PbI2, что свидетельствует о наличии в реальном растворе смеси комплексов [PbI3]– и [PbI4]2–.
Таким образом, зная значения ПР(ипс) и K ', можно найти общую концентрацию ионов свинца в смеси MAI7-ИПС в зависимости от концентрации MAI7 (рис. 6б). Примечательно, что данная зависимость имеет минимум в области CMAI7 ~ ~ 1.3 моль/л, что связано с преимущественным вкладом эффекта общего иона в снижение растворимости PbI2 при недостаточном уровне комплексообразования. Дальнейший рост концентрации I– в растворе РПР смещает равновесие в сторону образования комплексов [PbI2 +х]х–, увеличивая растворимость свинца в общей сложности на пять порядков (до 0.04 моль/л) для чистого MAI7. При использовании в экспериментах по конверсии пластин PbI2 в растворе концентраций MAI7 5 и 10 мг/мл расчетная общая концентрация ионов свинца в растворе <10–5 моль/л.
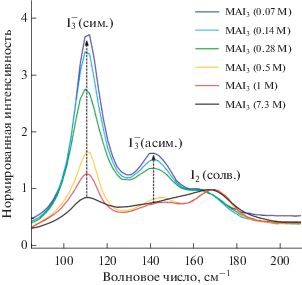
Такое существенное различие можно объяснить более высокой концентрацией свободных ионов I– в расплаве MAI7. Образование свободного I– в расплаве происходит вследствие очень высокой константы диссоциации $\left[ {{\text{I}}_{{\text{3}}}^{--}} \right]$ ионов в реакционных расплавах полииодидов. Значение $K_{{{\text{diss}}}}^{{\left( {{\text{РПР}}} \right)}}$ для расплавов состава MAI3 было оценено по данным спектроскопии КР и составляет ~0.7 (для сравнения $K_{{{\text{diss}}}}^{{\left( {{\text{ипс}}} \right)}}$ = 10–4.65). Тенденцию к стабилизации трииодид-ионов иллюстрирует серия спектров КР, снятых для различных разбавлений расплава MAI3 изопропанолом, где наблюдается существенный рост интенсивности симметричного колебания $\left[ {{\text{I}}_{{\text{3}}}^{--}} \right]$ на 114 см–1 при увеличении доли ИПС (рис. 7).
Рис. 7.
Спектры КР MAI3 с разным разбавлением изопропанолом (в скобках приведены соответствующие концентрации РПР). Сокращения (сим.) и (асим.) обозначают симметричное и асимметричное колебания аниона ${\text{I}}_{{\text{3}}}^{--},$ (солв.) – сольватирующий иод.
Приведенные расчеты подтверждают критическую роль разбавления РПР в снижении растворимости свинца, и как следствие, в изменении характера протекания конверсии PbI2 и кристаллизации фазы MAPbI3. При этом основным механизмом конверсии иодида свинца можно считать растворение–кристаллизацию, что подтверждается хаотичным расположением зародышей перовскита на поверхности пластин PbI2 и отсутствием преимущественной ориентации кристаллитов перовскита (рис. 4б–4г).
Однако в некоторых условиях конверсии PbI2 полииодидным расплавом наблюдается локальный ориентированный рост вытянутых кристаллов перовскита с тетрагонально-призматическими-пинакоидальными габитусами, как видно на микрофотографиях на рис. 8а. В данном случае конверсию проводили в закрытой системе в расплаве MAI6, в котором, как было показано выше, скорость и глубина протекания реакции с PbI2 замедлена избытком иода. Согласно микрофотографиям, все кристаллы перовскита выходят от поверхности пластины под углом, отличным от 90°. По контрасту на детекторе обратнорассеянных электронов (ESB) каждый кристаллит темнее лежащей ниже пластины иодида свинца, что указывает на наличие более тяжелых атомов в их составе. В случае соединений PbI2 и MAPbI3 большее содержание иода в структуре и создает контраст на изображении.
Рис. 8.
Микрофотографии пластины PbI2 после 30 с конверсии расплавом MAI6 в закрытой системе, зарегистрированные на три разных детектора: внутрилинзовый (InLens), вторичных электронов (SE2) и обратнорассеянных электронов (ESB) (а). Иллюстрация совмещения атомов в плоскостях решеток PbI2 (001) и MAPbI3 (202) (б). Иллюстрация совмещения плоскостей в другой проекции [23] (в).
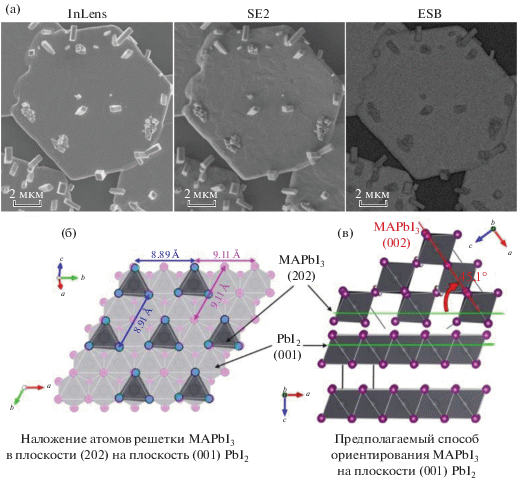
Параметры кристаллических решеток PbI2 и MAPbI3 существенно отличаются, что делает невозможным эпитаксиальный механизм роста перовскита на плоскости (001) иодида свинца. Однако возможным объяснением локального ориентированного роста кристаллов перовскита может быть “псевдоэпитаксиальное” зародышеобразование, механизм которого ранее был опубликован в работе [23] и схематично представлен на рис. 8б, 8в. Наиболее близкой по параметрам сетки связей плоскостью тетрагональной решетки перовскита к плоскости (001) PbI2 является плоскость (202). При таком способе ориентирования зародышей перовскита относительно поверхности пластины PbI2 дальнейший рост кристаллов будет происходить под углом ~45° вдоль плоскости (002) перовскита, как показано на рис. 8в.
ЗАКЛЮЧЕНИЕ
Исследован механизм кристаллизации органо-неорганического перовскита MAPbI3 из реакционного полииодидного расплава MAIx разной стехиометрии. Продемонстрирована ключевая роль содержания иода в РПР на скорость и глубину протекания конверсии: в MAI3–MAI5 полная конверсия протекает менее чем за минуту, в то время как избыточное количество иода (>MAI5) позволяет значительно замедлить этот процесс, сдвигая равновесие в сторону реагентов. Высокая растворимость иодида свинца в РПР (0.5 мол. %) определяет основной механизм конверсии PbI2 в перовскит через растворение–кристаллизацию. При этом размер кристаллов перовскита может достигать десятков микрометров в сравнении с классическими методами конверсии PbI2 раствором MAI в ИПС. Разбавление РПР изопропиловым спиртом приводит к значительному уменьшению среднего размера зерен перовскита из-за сильного снижения растворимости PbI2 в смеси РПР-ИПС, которое подтверждено теоретическими расчетами констант устойчивости иодоплюмбатных комплексов свинца и констант диссоциации трииодид-ионов в разных средах. Механизм зародышеобразования перовскита в РПР может меняться с гомогенного в условиях интенсивной кристаллизации при удалении иода из РПР на псевдоэпитаксиальный в условиях сохранения избыточного иода и, как следствие, медленной и неполной конверсии иодида свинца.
Список литературы
Perera S., Hui H., Zhao C. et al. // Nano Energy. 2016. V. 22. P. 129. https://doi.org/10.1016/j.nanoen.2016.02.020
Rong Y., Hu Y., Mei A. et al. // Science. 2018. V. 361. № 6408. P. eaat8235. https://doi.org/10.1126/science.aat8235
NREL. Best Research-Cell Efficiency Chart Electronic resource. 2020.
Миличко В.А., Шалин А.С., Мухин И.С. и др. // Успехи физ. наук. 2016. V. 59. № 8. P. 727. https://doi.org/10.3367/UFNe.2016.02.037703
Kazim S., Nazeeruddin M.K., Grätzel M., Ahmad S. // Angew. Chem. Int. Ed. 2014. V. 53. № 11. P. 2812. https://doi.org/10.1002/anie.201308719
Wehrenfennig C., Liu M., Snaith H.J. et al. // J. Phys. Chem. Lett. 2014. V. 5. № 8. P. 1300. https://doi.org/10.1021/jz500434p
Kulkarni S.A., Baikie T., Boix P.P. et al. // J. Mater. Chem. A. 2014. V. 2. № 24. P. 9221. https://doi.org/10.1039/c4ta00435c
Xing G., Mathews N., Sun S. et al. // Science. 2013. V. 342. № 6156. P. 344. https://doi.org/10.1126/science.1243167
Stranks S.D., Eperon G.E., Grancini G. et al. // Science. 2013. V. 342. № 6156. P. 341. https://doi.org/10.1126/science.1243982
Steirer K.X., Schulz P., Teeter G. et al. // ACS Energy Lett. 2016. V. 1. № 2. P. 360. https://doi.org/10.1021/acsenergylett.6b00196
Jeon N.J., Noh J.H., Kim Y.C. et al. // Nat. Mater. 2014. V. 13. № 9. P. 897. https://doi.org/10.1038/nmat4014
Li Z., Klein T.R., Kim D.H. et al. // Nat. Rev. Mater. Macmillan Publishers Limited. 2018. V. 3. № 4. P. 18 017. https://doi.org/10.1038/natrevmats.2018.17
Petrov A.A., Sokolova I.P., Belich N.A. et al. // J. Phys. Chem. C. 2017. V. 121. № 38. P. 20739. https://doi.org/10.1021/acs.jpcc.7b08468
Cao J., Jing X., Yan J. et al. // J. Am. Chem. Soc. 2016. V. 138. № 31. P. 9919. https://doi.org/10.1021/jacs.6b04924
Seok S. Il, Grätzel M., Park N.-G. // Small. 2018. V. 14. № 20. P. 1704177. https://doi.org/10.1002/smll.201704177
Hamill J.C., Schwartz J., Loo Y.-L. // ACS Energy Lett. 2018. V. 3. P. 92. https://doi.org/10.1021/acsenergylett.7b01057
Rakita Y., Gupta S., Cahen D., Hodes G. // Chem. Mater. 2017. V. 29. № 20. P. 8620. https://doi.org/10.1021/acs.chemmater.7b02314
Ávila J., Momblona C., Boix P.P. et al. // Joule. 2017. V. 1. № 3. P. 431. https://doi.org/10.1016/j.joule.2017.07.014
Hodes G., Kedem N., Shin T.J. et al. // Nat. Commun. 2018. V. 9. № 1. P. 1. https://doi.org/10.1038/s41467-018-05583-w
Ball J.M., Petrozza A. // Nat. Energy. 2016. V. 1. P. 16 149. https://doi.org/10.1038/nenergy.2016.149
Schlipf J., Docampo P., Schaffer C.J. et al. // J. Phys. Chem. Lett. 2015. V. 6. № 7. P. 1265. https://doi.org/10.1021/acs.jpclett.5b00329
Petrov A.A., Belich N.A., Grishko A.Y. et al. // Mater. Horiz. 2017. V. 4. № 4. P. 625. https://doi.org/10.1039/C7MH00201G
Brenner T.M., Rakita Y., Orr Y. et al. // Chem. Mater. 2016. V. 28. № 18. P. 6501. https://doi.org/10.1021/acs.chemmater.6b01747
Belich N.A., Petrov A.A., Rudnev P.O. et al. // ACS Appl. Mater. Interfaces. 2020. V. 12. P. 20456. DOI: https://doi.org/10.1021/acsami.0c02492. 10.1021/acsami.0c02492
Turkevych I., Kazaoui S., Belich N.A. et al. // Nat. Nanotechnol. 2019. V. 14. № 1. P. 57. https://doi.org/10.1038/s41565-018-0304-y
Grishko A.Y., Petrov A.A., Goodilin E.A., Tarasov A.B. // RSC Adv. Royal Soc. Chem. 2019. V. 9. № 63. P. 37 079.
Grishko A.Y., Tarasov A.B. // Moscow Autumn Perovskite Photovoltaics International Conference (MAPPIC-2019). 2019. P. 21.
Petrov A.A., Fateev S.A., Zubavichus Y.V. et al. // J. Phys. Chem. Lett. 2019. V. 10. P. 5776. https://doi.org/10.1021/acs.jpclett.9b02360
Brunetti B., Cavallo C., Ciccioli A. et al. // Sci. Rep. 2016. V. 6. № 1. P. 31896. https://doi.org/10.1038/srep31896
Ivanov I.L., Steparuk A.S., Bolyachkina M.S. et al. // J. Chem. Thermodyn. 2018. V. 116. P. 253. https://doi.org/10.1016/j.jct.2017.09.026
Dualeh A., Gao P., Seok S. Il et al. // Chem. Mater. 2014. V. 26. № 21. P. 6160. https://doi.org/10.1021/cm502468k
Song Z., Abate A., Watthage S.C. et al. // Adv. Energy Mater. 2016. V. 6. № 19. P. 1600846. https://doi.org/10.1002/aenm.201600846
Bryant D., Aristidou N., Pont S. et al. // Energy Environ. Sci. Royal Soc. Chem. 2016. V. 9. P. 1655. https://doi.org/10.1039/C6EE00409A
Senocrate A., Kim G.Y., Grätzel M., Maier J. // ACS Energy Lett. 2019. V. 4. № 12. P. 2859. https://doi.org/10.1021/acsenergylett.9b01605
Zhao X., Park N.-G. // Photonics. 2015. V. 2. P. 1139. https://doi.org/10.3390/photonics2041139
Vladimirov A.V., Agafonov A.V. // J. Therm. Anal. Calorim. 1998. V. 54. № 1. P. 297. https://doi.org/10.1023/A:1010118430154
Yang S., Zheng Y.C., Hou Y. et al. // Chem. Mater. 2014. V. 26. № 23. P. 6705. https://doi.org/10.1021/cm5028817
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


