Журнал неорганической химии, 2021, T. 66, № 2, стр. 187-193
Комплексные соединения никеля(II) c азагетероциклическими лигандами и 2-гидрокси-клозо-декаборатным анионом [2-B10H9OH]2–
Е. Ю. Матвеев a, b, *, И. В. Новиков a, А. С. Кубасов b, В. М. Ретивов c, К. Ю. Жижин a, b, Н. Т. Кузнецов b
a МИРЭА – Российский технологический университет (Институт тонких химических технологий
им. М.В. Ломоносова)
119571 Москва, пр-т Вернадского, 86, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
c НИЦ “Курчатовский институт” – ИРЕА”
107076 Москва, Богородский Вал, 3, Россия
* E-mail: cat1983@yandex.ru
Поступила в редакцию 09.06.2020
После доработки 27.06.2020
Принята к публикации 01.07.2020
Аннотация
Исследовано взаимодействие соли (Bu4N)2[2-B10H9OН] с хлоридом никеля(II) в присутствии азотсодержащих лигандов, в частности, 1,10-фенантролина, 2,2'-бипиридиламина, 2,2'-бипиридила и 2,6-диаминопиридина. Показано, что в ходе реакций образуются комплексные соединения никеля(II), содержащие анион [2-B10H9OН]2– в качестве противоиона. Синтезированные вещества исследованы методами элементного анализа, ИК-спектроскопии и рентгеноструктурного анализа.
ВВЕДЕНИЕ
Полиэдрические анионы бора [BnHn]2– представляют собой класс пространственно-ароматических неорганических структур, отличающихся термической стабильностью, устойчивостью к действию окислителей и склонностью к замещению экзополиэдрических атомов водорода на различные функциональные группы [1–7]. Производные анионов [B10H10]2– и [B12H12]2– с заместителями оксониевого типа могут выступать в качестве прекурсоров для дальнейшей модификации за счет реакций раскрытия циклического заместителя [8–11], позволяя получать производные, в том числе и с пендантными биологически активными группами [12–17]. Серосодержащие производные кластерных анионов бора способны вступать в реакции ацилирования и алкилирования, образуя обширный круг замещенных клозо-боратов [18–20].
Клозо-боратные анионы и их замещенные производные могут выступать как в роли “мягких” лигандов в синтезе комплексных соединений металлов [21–23], так и в роли противоионов [24–28]. Такие соединения могли бы представлять ценность для расширения теоретических знаний в координационной химии бороводородов и выступать в качестве исходных соединений для дальнейшей функционализации, в том числе для получения борсодержащих материалов с заданными свойствами [29].
Цель настоящей работы – синтез и исследование комплексных соединений никеля(II) с 2-гидроксопроизводным клозо-декаборатного аниона в присутствии различных азотсодержащих лигандов: фенантролина (phen), 2,2'-бипиридиламина (bpa), 2,2'-бипиридила (bipy), 2,6-диаминопиридина (dap).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. [2-Гидрокси]нонагидро-клозо-декаборат тетрабутиламмония (n-Bu4N)2[B10H9OН] синтезировали по разработанной ранее методике [30]. Ацетонитрил (>99.9%, Aldrich), ДМФА (>99.9%, Aldrich), NiCl2 (98%, Aldrich), 1,10-фенантролин (>99.9%, Aldrich), 2,2'-бипиридиламин (98%, Aldrich), 2,2'-бипиридил (>99.9%, Aldrich), 2,6-диаминопиридин (98%, Aldrich) использовали без дополнительной очистки.
Методы физико-химического анализа
Элементный анализ на углерод, водород и азот осуществляли на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba). Определение бора и никеля методом ICP MS выполнено на атомно-эмиссионном спектрометре с индуктивно-связанной плазмой iCAP 6300 Duo в ЦКП “Исследовательский научно-аналитический центр НИЦ “Курчатовский институт” – ИРЕА”.
ИК-спектры синтезированных соединений записывали на ИК-Фурье-спектрометре ИНФРАЛЮМ ФТ-02 (НПФ АП “Люмекс”) в таблетках KBr в области 4000–300 см–1 с разрешением 1 см–1.
Кристаллы Ia получены изотермическим упариванием соединения [Ni(phen)3][B10H9OН] (I) в ацетонитриле, кристаллы Iб – парофазным насыщением раствора I в смеси DMF/MeCN водой. Набор дифракционных отражений для кристаллов Ia, Iб получен в Центре коллективного пользования ИОНХ РАН на автоматическом дифрактометре Bruker APEX2 CCD (λMoKα, графитовый монохроматор, ω–ϕ-сканирование). Структуры расшифрованы прямым методом с последующим расчетом разностных синтезов Фурье. Все неводородные атомы катионов и атомы бора уточнены в анизотропном приближении. Неводородные атомы растворителя и экзополиэдрического заместителя аниона уточнены в изотропном приближении. Все атомы водорода уточнены по модели “наездника” с тепловыми параметрами Uизо = 1.2Uэкв (Uизо) соответствующего неводородного атома (1.5Uизо для СН3-групп).
В структуре Iб была рассчитана “маска растворителя” (solvent mask) и найдено 1476 электронов в объеме 6024 Å3 в трех пустотах на элементарную ячейку, что соответствует двум молекулам DMF и четырем молекулам MeCN на кристаллографически независимую часть элементарной ячейки.
При сборе и обработке массива отражений использовали программы APEX2, SAINT и SADABS [31]. Структура расшифрована и уточнена с помощью комплекса программ OLEX2 [32].
Основные кристаллографические данные, параметры эксперимента и характеристики уточнения структур Ia, Iб приведены в табл. 1.
Таблица 1.
Основные кристаллографические данные, параметры эксперимента и уточнения структур Ia и Iб
| Соединение | Ia | Iб |
|---|---|---|
| Брутто-формула | C37.5H36.25B10N6.75NiO1.5 | C110H102B30N19Ni3O3 |
| М | 772.29 | 2238.53 |
| T, K | 296.0 | 296 |
| Сингония | Триклинная | Моноклинная |
| Пр. гр. | P1 | C2/c |
| a, Å | 11.7405(3) | 55.945(6) |
| b, Å | 12.3388(3) | 14.1034(13) |
| c, Å | 16.2613(4) | 44.019(7) |
| α, град | 108.3530(10) | 90 |
| β, град | 102.6960(10) | 129.402(3) |
| γ, град | 102.5990(10) | 90 |
| V, Å3 | 2073.51(9) | 26838(6) |
| Z | 2 | 8 |
| ρрасч, г/см3 | 1.237 | 1.108 |
| μ, мм–1 | 0.508 | 0.468 |
| F(000) | 797.0 | 9224.0 |
| Размеры кристалла, мм | 0.9 × 0.4 × 0.4 | 0.4 × 0.4 × 0.2 |
| Излучение, λ, Å | MoKα (λ = 0.71073) | MoKα (λ = 0.71073) |
| Интервал углов 2θ, град | 4.346–56 | 3.478–50 |
| Число отражений: | ||
| измеренных независимых (N) |
18 358 9867 [Rint = 0.0471] |
108 939 22817 [Rint = 0.1220] |
| R1, wR2 по N0 | 0.0697, 0.2313 | 0.0891, 0.2409 |
| R1, wR2 по N | 0.0786, 0.2392 | 0.1361, 0.2643 |
Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDС № 1 997 920, 1 997 921).
Синтез комплексных соединений. К 2 мл ацетонитрила добавляли 0.48 г (0.77 ммоль) (n‑Bu4N)2[B10H9OН], 0.10 г (0.77 ммоль) NiCl2 и перемешивали в течение 10 мин. Далее в полученную систему добавляли раствор 1.54 ммоль азотсодержащего лиганда (0.42 г phen, 0.40 г bpa, 0.36 г bipy или 0.25 г dap) в 1 мл ацетонитрила и перемешивали еще 10 мин. Путем изотермического упаривания раствора получили кристаллическое вещество с окраской от желтой до оранжевой. Для получения кристаллов, пригодных для РСА, использовали метод парофазного насыщения растворов в DMF/MeCN водой, который увенчался успехом для соединения I.
(2-Гидрокси)нонагидро-клозо-декаборат трис(1,10- фенантролин)никеля(II) [Ni(phen)3][B10H9OН] (I). Выход 0.44 г (78%). ИК-спектр, см–1: 3633 (ν(O–H)), 2438 (ν(B–H)), 1624, 1581, 1424 (ν(C=N)), 1225 (δ(C–H)), 1148 (ν(C–O–C)), 424 (ν(Ni–N)).
| C | H | B | N | Ni | |
|---|---|---|---|---|---|
| Найдено, %: | 58.47; | 4.61; | 14.62; | 11.40; | 7.88. |
| Для C36H34B10N6NiO | |||||
| вычислено, %: | 58.94; | 4.67; | 14.73; | 11.46; | 8.00. |
(2-Гидрокси)нонагидро-клозо-декаборат трис(2,2'- бипиридиламин)никеля(II) [Ni(bpa)3][B10H9OН] (II). Выход 0.42 г (78%). ИК-спектр, см–1: 3633 (ν(O–H)), 3320, 3216, 3154 (ν(N–H)), 3026 (ν(C–H)), 2436 (ν(B–H)), 1649 (δ(N–H)), 1580 (ν(C=N)), 1144 (ν(C–O–C)), 832, 775 (δ(C–H)), 438 (ν(Ni–N)).
| C | H | B | N | Ni | |
|---|---|---|---|---|---|
| Найдено, %: | 50.42; | 5.17; | 15.17; | 17.73; | 8.24. |
| Для C30H37B10N9NiO | |||||
| вычислено, %: | 51.00; | 5.28; | 15.30; | 17.84; | 8.31. |
(2-Гидрокси)нонагидро-клозо-декаборат трис(2,2'-бипиридил)никеля(II) [Ni(bipy)3][B10H9OН] (III). Выход 0.38 г (75%). ИК-спектр, см–1: 3632 (ν(O–H)), 2438 (ν(B–H)), 1610 (ν(C=N)), 1148 (ν(C–O–C)), 1115 (ν(C–N)), 672 (ρ(C–H)py), 427 (ν(Ni–N)).
| C | H | B | N | Ni | |
|---|---|---|---|---|---|
| Найдено, %: | 54.02; | 5.12; | 16.25; | 12.63; | 8.79. |
| Для C30H34B10N6NiO | |||||
| вычислено, %: | 54.48; | 5.18; | 16.34; | 12.71; | 8.87. |
(2-Гидрокси)нонагидро-клозо-декаборат трис(2,6- диаминопиридин)никеля(II) [Ni(dap)3][B10H9OН] (IV). Выход 0.28 г (70%). ИК-спектр, см–1: 3635 (ν(O–H)), 3390, 3320, 3215 (ν(N–H)), 3115 (ν(C–H)), 2435 (ν(B–H)), 1645, 1590 (ν(C=C)), 1474 (δ(N–H)), 1147 (ν(C–O–C)), 1048 (ν(C=N)), 965, 952 (δ(C–H)), 426 (ν(Ni–N)).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
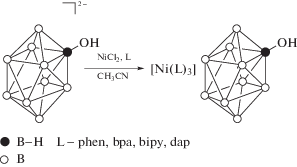
Нами были изучены реакции комплексообразования соли (n-Bu4N)2[2-B10H9OН] с хлоридом никеля(II) в присутствии азотсодержащих лигандов, в частности, 1,10-фенантролина, 2,2'-бипиридиламина, 2,2'-бипиридила и 2,6-диаминопиридина. Показано, что в ходе реакций происходит образование комплексных соединений никеля(II), содержащих анион [2-B10H9OН]2– в качестве противоиона (схема 1 ).
Схема 1 . Взаимодействие аниона [B10H9OH]2– с хлоридом никеля(II) в присутствии азотсодержащих лигандов.
Исследование строения полученных соединений проводили на основании данных ИК-спектроскопии и РСА. В ИК-спектрах продуктов реакций наблюдаются характерные изменения, позволяющие судить об образовании комплексных соединений никеля(II). Так, в спектре комплексного соединения I присутствуют полосы поглощения при 1624, 1581, 1424 (ν(C=N)) и 1225 см–1 (δ(C–H)), которые относятся к гетероциклическому лиганду. Они заметно смещены по сравнению с аналогичными полосами поглощения в спектре чистого 1,10-фенантролина. Кроме того, в спектре I присутствует интенсивная полоса поглощения при 424 см–1, которую можно отнести к валентным колебаниям связи Ni–N [33]. Интересные изменения происходят также в спектрах комплексов с азотсодержащими лигандами, содержащими связи N–H. Например, в спектре соединения II присутствуют полосы поглощения при 3320–3154 (ν(N–H)) и 1649 см–1 (δ(N–H)), в то время как аналогичные полосы поглощения в спектре 2,2'-бипиридиламина находятся при 3258–3180 и 1610 см–1 (δ (N–H)) соответственно. В спектрах соединений I–IV присутствуют полосы поглощения при 3385–3375 (ν(О–H)) и 2452–2459 см–1 (ν(B–H)), по значениям они практически не отличаются от таковых в спектре исходного соединения (Bu4N)2[2-B10H9OН]. Все это позволяет полагать, что продукты I–IV представляют собой комплексные соединения никеля(II) с гетероциклическими лигандами, а клозо-декаборат не входит в координационную сферу и выполняет роль противоиона.
По данным 11B ЯМР-спектроскопии, спектры координационных соединений практически идентичны спектрам исходного аниона [2-B10H9OН]2– [34]. Это наряду с данными ИК-спектроскопии дало нам основания полагать, что борный кластер непосредственно не вовлекается в протекающие реакции.
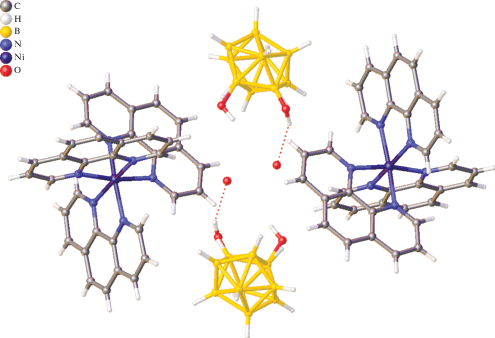
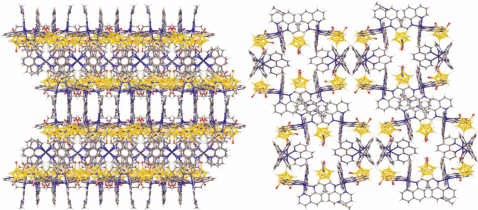
Строение комплекса I было установлено методом РСА. Кристаллографически независимая часть триклинной элементарной ячейки (рис. 1) кристалла Ia содержит комплексный катион [Ni(phen)3]2+, анион [B10H9OH]2–, 0.75 молекулы MeCN и половину молекулы воды (протоны молекулы воды были исключены из уточнения). Гидроксигруппа аниона разупорядочена по двум позициям с заселенностью 0.5 : 0.5. В элементарной ячейке два аниона располагаются между двумя катионами и связаны между собой водородными связями B10H9OH…O(H2)…HOB10H9. Аналогично подобным комплексам с анионами [B10H10]2– и [B12H12]2– [28] в координационную сферу никеля входят три практически перпендикулярные молекулы фенантролина, образуя немного искаженное октаэдрическое окружение центрального атома из шести атомов азота. Длины связей Ni–N лежат в диапазоне 2.087(3)–2.105(3) Å.
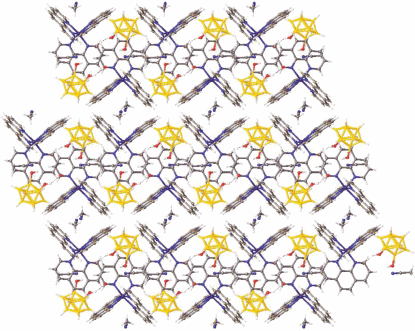
В кристалле два связанных водородными связями аниона располагаются между четырьмя катионами [Ni(phen)3]2+, образующими каналы, в которых расположены сольватные разупорядоченные молекулы растворителя. Еще одна часть молекул MeCN располагается в пустотах, расположенных между анионными парами [B10H9OH…O(H2)…HOB10H9]4– (рис. 2).
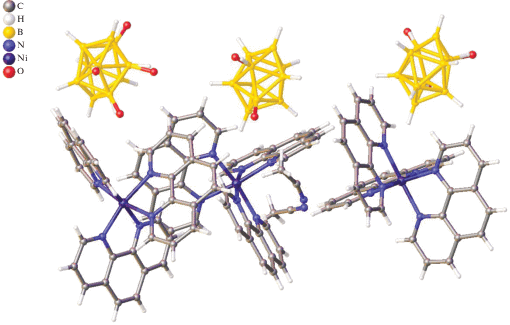
В кристаллографически независимую часть моноклинной элементарной ячейки (C2/c) Iб входят три комплексных катиона [Ni(phen)3]2+, три аниона [B10H9OH]2– и две молекулы ацетонитрила (рис. 3). Еще две молекулы DMF и четыре молекулы MeCN были удалены из уточнения, так как сильно разупорядочены. Гидроксогруппы анионов разупорядочены на две, три и четыре позиции в разных анионах кристаллографически независимой части ячейки.
Катионы [Ni(phen)3]2+ и анионы [B10H9OH]2–, упакованные в катионно-анионные слои, образуют четыре слоя (рис. 4). В одном из катионных слоев образуются каналы и пустоты большого объема, в которых располагаются молекулы растворителя, удаленные из уточнения.
ЗАКЛЮЧЕНИЕ
Исследования показали, что при взаимодействии 2-гидрокси-клозо-декаборатного аниона с катионом никеля(II) в присутствии азотсодержащих лигандов (phen, bpa, bipy, dap) происходит образование комплексных соединений, в которых анион [2-B10H9OН]2– присутствует в качестве противоиона. Полученные продукты могут представлять интерес в качестве прекурсоров для дальнейшей модификации, в том числе для получения борсодержащих материалов с заданными свойствами.
Список литературы
Sivaev I.B., Bregadze V.I., Sjöberg S. et al. // Collect. Czechoslov. Chem. Commun. 2020. V. 67. P. 679. https://doi.org/10.1135/cccc20020679
Sivaev I.B., Prikaznov A.V., Naoufal D. et al. // Collect. Czechoslov. Chem. Commun. 2010. V. 75. P. 1149. https://doi.org/10.1135/cccc2010054
Akimov S.S., Matveev E.Y., Razgonyaeva G.A. et al. // Russ. Chem. Bull. 2010. V. 59. P. 371. [Акимов С.С., Матвеев Е.Ю., Разгоняева Г.А. и др. // Изв. АН. Сер. хим. 2010. № 2. С. 364.]https://doi.org/10.1007/s11172-010-0088-1
Klyukin I.N., Zhdanov A.P., Matveev E.Y. et al. // Inorg. Chem. Commun. 2014. V. 50. P. 28. https://doi.org/10.1016/j.inoche.2014.10.008
Retivov V.M., Matveev E.Yu., Lisovskiy M.V. et al. // Russ. Chem. Bull. 2010. V. 59. P. 550. [Ретивов В.М., Матвеев Е.Ю., Лисовский М.В. и др. // Изв. АН. Сер. хим. 2010. № 3. С. 538.]https://doi.org/10.1007/s11172-010-0123-2
Matveev E.Y., Kubasov A.S., Razgonyaeva G.A. et al. // Russ. J. Inorg. Chem. 2015. V. 60. P. 776. [Матвеев Е.Ю., Кубасов А.С., Разгоняева Г.А. и др. // Журн. неорган. химии. 2015. Т. 60. № 7. С. 858.]https://doi.org/10.1134/S0036023615070104
Klyukin I.N., Kubasov A.S., Limarev I.P. et al. // Polyhedron. 2015. V. 101. P. 215. https://doi.org/10.1016/j.poly.2015.09.025
Semioshkin A.A., Sivaev I.B., Bregadze V.I. et al. // J. Chem. Soc., Dalton Trans. 2008. V. 11. P. 977. https://doi.org/10.1039/b715363e
Zhizhin K.Y., Zhdanov A.P., Kuznetsov N.T. et al. // Russ. J. Inorg. Chem. 2010. V. 55. P. 2089. https://doi.org/10.1134/S0036023610140019
Matveev E.Y., Retivov V.M., Razgonyaeva G.A. et al. // Russ. J. Inorg. Chem. 2011. V. 56. P. 1549. [Матвеев Е.Ю., Ретивов В.М., Разгоняева Г.А. и др. // Журн. неорган. химии. 2011. Т. 56. № 10. С. 1628.]https://doi.org/10.1134/S0036023611100160
Prikaznov A.V., Shmal’ko A.V., Sivaev I.B. et al. // Polyhedron. 2011. V. 30. P. 1494. https://doi.org/10.1016/j.poly.2011.02.055
Matveev E.Y., Limarev I.P., Nichugovskii A.I. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 977. [Матвеев Е.Ю., Лимарев И.П., Ничуговский А.И. и др. // Журн. неорган. химии. 2019. Т. 64. № 8. С. 811.]https://doi.org/10.1134/S0036023619080084
Laskova J., Kozlova A., Białek-Pietras M. et al. // J. Organomet. Chem. 2016. V. 807. P. 29. https://doi.org/10.1016/j.jorganchem.2016.02.009
Matveev E.Y., Akimov S.S., Kubasov A.S. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1513. [Матвеев Е.Ю., Акимов С.С., Кубасов А.С. и др. // Журн. неорган. химии. 2019. Т. 64. № 12. С. 1278.]https://doi.org/10.1134/S003602361912009X
Prikaznov A.V., Laśkova Y.N., Semioshkin A.A. et al. // Russ. Chem. Bull. 2011. V. 60. P. 2550. [Приказнов А.В., Ласкова Ю.Н., Семиошкин А.А. и др. // Изв. АН. Сер. хим. 2011. № 12. С. 2501.]https://doi.org/10.1007/s11172-011-0392-4
Laskova J., Kozlova A., Ananyev I. et al. // J. Organomet. Chem. 2017. V. 834. P. 64. https://doi.org/10.1016/j.jorganchem.2017.02.009
Matveev E.Yu., Akimov S.S., Kubasov A.S. et al. // Fine Chemical Technologies. 2019. V. 14. № 1. P. 59. [Матвеев Е.Ю., Акимов С.С., Кубасов А.С. и др. // Тонкие химические технологии. 2019. Т. 14. № 1. С. 59.]https://doi.org/10.32362/2410-6593-2019-14-1-59-65
Kubasov A.S., Turishev E.S., Polyakova I.N. et al. // J. Organomet. Chem. 2017. V. 828. P. 106. https://doi.org/10.1016/j.jorganchem.2016.11.035
Gabel D., Moller D., Harfst S. et al. // Inorg. Chem. 1993. V. 32. P. 2276. https://doi.org/10.1021/ic00063a014
Kubasov A.S., Matveev E.Y., Turyshev E.S. et al. // Inorg. Chim. Acta. 2018. V. 477. P. 277. https://doi.org/10.1016/j.ica.2018.03.013
Avdeeva V.V., Malinina E.A., Sivaev I.B. et al. // Crystals. 2016. V. 6. P. 60. https://doi.org/10.3390/cryst6050060
Malinina E.A., Avdeeva V.V., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2010. V. 55. P. 2148. https://doi.org/10.1134/S0036023610140032
Kubasov A.S., Matveev E.Yu., Retivov V.M. et al. // Russ. Chem. Bull. 2014. V. 63. P. 187. [Кубасов А.С., Матвеев Е.Ю., Ретивов В.М. и др. // Изв. АН. Сер. хим. 2014. № 1. С. 187.]https://doi.org/10.1007/s11172-014-0412-2
Avdeeva V.V., Polyakova I.N., Churakov A.V. et al. // Polyhedron. 2019. V. 162. P. 65. https://doi.org/10.1016/j.poly.2019.01.051
Avdeeva V.V., Vologzhanina A.V., Malinina E.A. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 295. [Авдеева В.В., Вологжанина А.В., Малинина Е.А. и др. // Журн. коорд. химии. 2019. Т. 45. № 4. С. 242.]https://doi.org/10.1134/S1070328419040018
Авдеева В.В., Полякова И.Н., Гоева Л.В. и др. // Коорд. химия. 2016. № 3. С 318. 10.7868/S0044457X1603003X
Avdeeva V.V., Kravchenko E.A., Gippius A.A. et al. // Polyhedron. 2017. P. 238. https://doi.org/10.1016/j.poly.2017.02.015
Avdeeva V.V., Polyakova I.N., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 7. P. 817. [Авдеева В.В., Полякова И.Н., Гоева Л.В. и др. // Журн. неорган. химии. 2015. Т. 60. № 7. С. 901.]https://doi.org/10.1134/S0036023615070037
elnikov S.A., Parshin A.P., Popov V.A. et al. // Carbon Nanomaterials in Clean Energy Hydrogen Systems. NATO Sci. Peace Secur. Ser. C Environ. Secur. PartF2. 2008. P. 449. 10.1007/978-1-4020-8898-8_5
Zhizhin K.Yu., Vovk O.O., Malinina E.A. et al. // Russ. J. Coord. Chem. 2001. V. 27. P. 613. https://doi.org/10.1023/A:1017937102647
Sheldrick G.M. // Acta Crystallogr. 2015. V. C71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Omar M.M., Abd El-Halim H.F., Eman A.M. Khalil // Appl. Organomet. Chem. 2017. V. 31. P. 3724. https://doi.org/10.1002/aoc.3724
Zhizhin K.Y., Malinina E.A., Polyakova I.N. et al. // Russ. J. Inorg. Chem. 2002. V. 47. P. 1168.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии