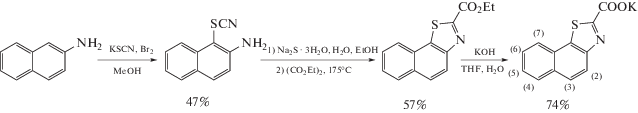Журнал неорганической химии, 2021, T. 66, № 2, стр. 168-177
Комплексы иттербия и европия с анионами нафто[1, 2]тиазол-2-карбоновой и нафто[2, 1]тиазол-2- карбоновой кислот для органических светодиодов (OLED)
Т. Ю. Чикинёва a, *, Д. С. Кошелев a, А. В. Медведько a, А. А. Ващенко b, Л. С. Лепнев b, А. С. Головешкин c, В. В. Уточникова a
a Московский государственный университет имени М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Физический институт им. П.Н. Лебедева РАН
119333 Москва, Ленинский пр-т, 53, Россия
c Иститут элементоорганической химии им. А.Н. Несмеянова РАН
119334 Москва, ул. Вавилова, 28, Россия
* E-mail: chikinevaty@gmail.com
Поступила в редакцию 12.03.2020
После доработки 22.04.2020
Принята к публикации 27.04.2020
Аннотация
Предложен подход к направленному синтезу ароматических карбоксилатов лантанидов – перспективных кандидатов в люминесцентные материалы для различного применения, в первую очередь в качестве эмиссионных слоев светоизлучающих диодов, включающий в себя варьирование длины сопряжения, введение гетероатома и нейтрального лиганда. Это позволило синтезировать новые комплексы европия и иттербия с анионами нафто[1,2]тиазол-2-карбоновой и нафто[2,1]тиазол-2-карбоновой кислот, которые были успешно использованы в светоизлучающих диодах.
ВВЕДЕНИЕ
Координационные соединения лантанидов, благодаря таким особенностям своих люминесцентных свойств, как узкие эмиссионные полосы, Стоксов сдвиг, длительное время жизни, а также высокие значения квантового выхода, нашли широкое применение в различных областях науки и техники, в том числе как люминесцентные термометры [1–5] и материалы OLED (organic light-emitting diode, органический светодиод) [6–10]. Общим требованием для люминесцентных материалов является высокий квантовый выход. Однако существуют и специфические требования к физико-химическим свойствам люминесцентных материалов. Так, для использования в качестве эмиссионного слоя в OLED необходима способность к транспорту носителей заряда и растворимость или летучесть. Поэтому все актуальнее становится не поиск, а дизайн координационных соединений лантанидов для получения материалов с заранее заданными свойствами, которых можно добиться только благодаря направленному синтезу лиганда. Ранее были обобщены наблюдаемые зависимости свойств координационных соединений (КС) лантанидов от строения лиганда. Например, основными факторами, влияющими на коэффициент молярной экстинкции, в случае ароматических соединений являются увеличение длины сопряжения ароматического ядра [11] и введение различных заместителей в ароматическое ядро. Однако заметного изменения ε получается добиться только в том случае, когда введенный заместитель участвует в сопряжении [12]; введение несопряженных алифатических и некоторых ароматических заместителей сказывается меньше и может даже снижать поглощение [13]. Кроме того, очень важно контролировать энергию триплетного возбужденного состояния лиганда. Варьирование положения триплетного уровня возможно в основном при изменении ароматического ядра и введении в ароматическое ядро заместителей и гетероатомов [14].
Ранее было показано, что введение гетероатомов азота в α-положение относительно карбоксильной группы способствует росту растворимости комплекса за счет его координации, которая способствует насыщению координационной сферы лантанида и препятствует полимеризации [15–17]. Введение гетероатомов также обеспечивает рост электронной подвижности [18], что делает гетероароматические КС лантанидов чрезвычайно перспективными и незаслуженно мало изученными соединениями.
Руководствуясь вышеперечисленными зависимостями, с целью расширения числа люминесцирующих гетероароматических карбоксилатов лантанидов в данной работе в качестве лигандов в составе КС лантанидов были выбраны анионы нафто[1,2-d]тиазол-2-карбоновой (Hntz) и нафто[2,1-d]тиазол-2-карбоновой (Hndz) кислот. Каждая из этих кислот обладает высокой степенью сопряжения и двумя гетероатомами в α-положении относительно карбоксильной группы, что должно приводить к высоким значениям коэффициента молярной экстинкции, достаточной энергии триплетного уровня для сенсибилизации люминесценции европия и иттербия, высокой растворимости и наличию электронного транспорта. Кроме того, в качестве нейтральных лигандов были выбраны трифенилфосфиноксид (TPPO) и батофенантролин (BPhen), которые хорошо сенсибилизируют люминесценцию европия, имеют высокие коэффициенты поглощения, а также обладают электронно-транспортными свойствами [1, 19–22]. Полученные однородно- и разнолигандные комплексы были протестированы в качестве электролюминесцентных материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных веществ использовали EuCl3 · 6H2О (х. ч.), YbCl3 · 6H2О (х. ч.), GdCl3 · · 6H2О (х. ч.), тетрагидрофуран (х. ч.), батофенантролин (х. ч.), трифенилфосфиноксид (х. ч.), K3Fe(CN)6 (х. ч.), NaOH (ч. д. а.), KOH (ч. д. а.), серу (ч. д. а.), хлорацетамид (х. ч.), 2-нафтиламин (х. ч.), триэтиламин (х. ч.), диметилформамид (ДМФА) (х. ч.), CDCl3, D2O, ДМСО-d6, метанол (х. ч.), этиловый спирт 96% (х. ч.).
Содержание водорода, углерода и азота определяли методом элементного микроанализа на C,H,N-анализаторе ЦКП МГУ (кафедра органической химии химического факультета МГУ).
Термогравиметрический анализ (ТГА) выполняли в атмосфере аргона на термоанализаторе STA 409 PC Luxx (Netzsch, Германия) в интервале температур 20–1000°С (скорость нагрева 10 град/мин). Состав образующейся при разложении образцов газовой фазы изучали при помощи квадрупольного масс-спектрометра QMS 403C Aеolos (Netzsch, Германия), совмещенного с термоанализатором Netzsch STA 409 PC Luxx. Масс-спектры записывали для массовых чисел 18 (Н2О), 44 (CO2) и 58 (CH3C(O)CH3).
Спектры ядерного магнитного резонанса (ЯМР) на ядрах 1Н записывали на спектрометре фирмы Avance-400 Bruker (400 МГц) в диапазоне 0–16 м.д. в ЦКП МГУ им. М.В. Ломоносова. Данные были обработаны при помощи программного пакета MestReNova 9. Химические сдвиги представлены относительно Me4Si.
Рентгенофазовый анализ (РФА) проводили на дифрактометре Bruker D8 Advance в геометрии Брегга–Брентано с одномерным детектором LynxEye с образцом, диспергированным на кремниевой вращающейся подложке (CuKα-излучение, сканирование θ/θ с изменяющимися размерами щелей в диапазоне углов 2θ от 4° до 65°, шаг 0.020°). Порошкограмма была описана с использованием программного обеспечения TOPAS 5.
Спектры поглощения измеряли в диапазоне 250–800 нм на спектрометре Perkin–Elmer Lambda 650.
Растворимость КС лантанидов измеряли при комнатной температуре в соответствии со следующей методикой: суспензию 150 мг каждого соединения в 10 мл растворителя кипятили с обратным холодильником в течение 1 ч, затем охлаждали до комнатной температуры. Далее 5 мл раствора отфильтровывали в сосуд с известной массой и растворитель выпаривали. Таким образом, изменение массы сосуда соответствовало количеству растворенного продукта.
Спектры фотолюминесценции при температурах 77 и 298 K были получены на мультиканальном спектрометре S2000 (Ocean Optics) с азотным лазером ЛГИ-21 (λex = 337 нм) в качестве источника возбуждения.
Квантовый выход определяли с помощью спектрофлуориметра Fluorolog FL3-22 (HORIBA) при комнатной температуре (возбуждение производилось через лиганд), использовали абсолютный метод в интеграционной сфере. Измерения времен жизни люминесценции проводили на том же приборе.
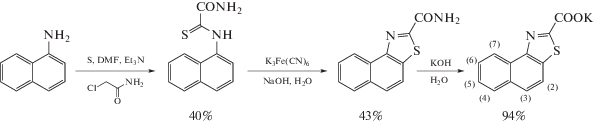
Синтез нафто[1,2-d]тиазол-2-карбоксилата калия K(ntz)
Синтез 2-(нафталин-1-иламино)-2-тиооксоацетамида. Смесь 21.08 г (147 ммоль) 1-нафтиламина, 27 мл (192 ммоль) триэтиламина и 18.75 г (586 ммоль) серы в 134 мл ДМФА перемешивали в течение 30 мин. Затем добавляли 12.44 г (133.8 ммоль) хлорацетамида и перемешивали еще 14 ч. Далее раствор разбавляли водой до 1600 мл. Выпавший осадок желтого цвета отфильтровывали, подсушивали, смывали ацетоном до бесцветного слива (∼650 мл), фильтрат упаривали досуха. Полученный порошок перекристаллизовывали из этанола. Получили 13.40 г желтых кристаллов. Выход 40%. 1H ЯМР (400 MГц, ДМСО-d6, 27°C), δ, м.д.: 7.53–7.61 (м., 4Н), 7.69–7.72 (м., 1H), 7.95 (д., 1H, 3J = 8.0 Гц), 8.15 (уш. с., 1Н), 8.17 (уш. с., 1H), 12.40 (с., 1H).
Синтез нафто[1,2-d]тиазол-2-карбоксамида. В раствор 82.40 г (250 ммоль) K3Fe(CN)6 в 152 мл воды добавляли при сильном перемешивании раствор 4.59 г (20 ммоль) 2-(нафталин-1-иламино)-2-тиооксоацетамида в 305 мл 10%-ного водного раствора NaOH. Смесь перемешивали в течение 1 ч. Выпавший осадок отфильтровывали и перекристаллизовывали из метанола. Получили 2.77 г оранжевых кристаллов. Выход 61%. 1H ЯМР (400 MГц, ДМСО-d6, 27°C), δ, м.д.: 7.68–7.72 (м., 1Н), 7.76–7.80 (м., 1Н), 8.06 (д., 1Н, 3J = 8.8 Гц), 8.12–8.14 (м., 2Н), 8.23 (д., 1Н, 3J = 8.9 Гц), 8.50 (уш.с., 2Н), 8.78 (д., 1Н, 3J = 8.2 Гц).
Синтез нафто[1,2-d]тиазол-2-карбоксилата калия. К 2.76 г (11.7 ммоль) нафто[1,2-d]тиазол-2-карбоксамида прикапывали 65 мл 10%-ного водного раствора KOH. Смесь розоватого цвета кипятили с обратным холодильником в течение 45 мин. Затем горячий раствор фильтровали, фильтрат охлаждали и отфильтровывали осадок сероватого цвета. Получили 2.71 г серых чешуек. Выход 94%. 1H ЯМР (400 MГц, D2O, 27°C), δ, м.д.: 7.55–7.59 (м., 1H), 7.63–7.67 (м., 1Н), 7.74–7.80 (м., 2Н), 7.91 (д., 1Н, 3J = 8.1 Гц), 8.53 (д., 1Н, 3J = = 8.1 Гц).
Схема 1. Схема синтеза K(ntz).
Синтез нафто[2,1-d]тиазол-2-карбоксилата калия K(ndz)
Синтез 1-тиоцианатонафталин-2-амина [23]. К раствору 1.72 г (12 ммоль) 2-аминонафталина и 2.33 г (24 ммоль) тиоцианата калия в 82 мл метанола при охлаждении до –78°С прикапывали 0.34 мл (6.4 ммоль) брома. Полученную суспензию перемешивали в течение 10 мин при 0°С, затем 20 мин при комнатной температуре. Отфильтровывали выпавший белый осадок, промывали 10 мл метанола. Осадок высушивали в вакууме и перекристаллизовывали из этанола. Получили 1.14 г белого вещества. Выход 47%. 1H ЯМР (400 MГц, ДМСО-d6, 27°C), δ, м.д.: 6.54 (уш.с., 2H), 7.12 (д., 1H, 3J = 8.9 Гц), 7.25–7.28 (м., 1H), 7.55–7.59 (м, 1H), 7.76 (д, 1Н, 3J = 7.9 Гц), 7.82 (д., 1Н, 3J = 9.0 Гц), 8.04 (д., 1Н, 3J = 8.4 Гц).
Синтез этилнафто[2,1-d]тиазол-2-карбоксилата. Навеску 0.92 г (9.5 ммоль) тригидрата сульфида натрия растворяли при небольшом нагревании в 6.2 мл воды и добавляли 2.4 мл этанола. В теплый раствор при перемешивании порциями добавляли 0.95 г (4.7 ммоль) 1-тиоцианатонафталин-2-амина и полученную смесь кипятили при перемешивании до тех пор, пока образовавшееся коричневое масло полностью не растворилось. Раствор охлаждали до комнатной температуры и нейтрализовали 5 М уксусной кислотой. Образовавшееся масло экстрагировали 20 мл хлороформа, высушивали над сульфатом натрия и упаривали досуха.
Полученное желтое масло смешивали с 1.29 мл (9.5 ммоль) диэтилоксалата и перемешивали ночь при 175°С. Зеленый раствор охлаждали до комнатной температуры и отгоняли на масляном насосе избыток диэтилоксалата. Остаток разбавляли 3 мл смеси EtOH : 3 M HCl (1 : 3). Образовался желтый раствор с зеленым липким веществом. Вещество отфильтровывали и промывали 2 мл 75%-ного этанола. Полученный черно-зеленый порошок высушивали на воздухе. Продукт очищали методом колоночной хроматографии, элюент – петролейный эфир : этилацетат (10 : 1 … 5 : 1). Получили 0.70 г оранжевого порошка. Выход 57%. 1H ЯМР (400 MГц, CDCl3, 27°C), δ, м.д.: 1.52 (т., 3Н, 3J = 7.2 Гц), 4.59 (кв., 2Н, 3J = 7.2 Гц), 7.62–7.67 (м, 2Н), 7.93 (д., 1Н, 3J = 8.9 Гц), 7.98–8.00 (м., 1Н), 8.10–8.12 (м., 1Н), 8.19 (д., 1Н, 3J = 9.0 Гц).
Синтез нафто[2,1-d]тиазол-2-карбоксилата калия. Навеску 0.54 г (2.1 ммоль) этилнафто[2,1-d]тиазол-2-карбоксилата вносили в смесь 8.8 мл ТГФ и 2.2 мл воды и добавляли 3.12 мл 0.86 М водного раствора КОН. Суспензию кипятили ночь до образования раствора. Полученный раствор упаривали. Остаток перекристаллизовывали из смеси 10 мл ТГФ и 4.1 мл воды, добавляли еще 5 мл ТГФ и охлаждали в морозильнике. Выпавшее вещество отфильтровывали, промывали 5 мл ТГФ и высушивали на воздухе. Получили 0.42 г светло-желтых иголочек. Выход 74%. 1H ЯМР (400 MГц, ДМСО-d6, 27°C), δ, м.д.: 7.57–7.66 (м., 2Н), 7.93 (д., 1Н, 3J = = 8.8 Гц), 8.03 (д., 1Н, 3J = 8.8 Гц), 8.05–8.10 (м., 2Н).
Схема 2. Схема синтеза K(ndz).
Синтез КС лантанидов
Синтез Ln(carb)3 ∙ 4H2O (Ln = Eu3+, Gd3+, Yb3+; carb = ntz–, ndz–). К раствору 0.1 г K(carb) в 5–10 мл воды приливали 5 мл водного раствора хлорида лантанида. Выпавший осадок отфильтровывали и высушивали на воздухе. Получили 0.07 г белого порошка. Выход ∼70%.
LnCl3 · 6H2O + 3K(carb) → → Ln(carb)3 · nH2O↓ + 3KCl.
Eu(ntz)3 · 4H2O:
Gd(ntz)3 · 4H2O:
| C | H | N | |
|---|---|---|---|
| Найдено, %: | 46.98; | 2.33; | 4.07. |
| Для GdC36H26N3O10S3 (M = 929.8) | |||
| вычислено, %: | 46.5; | 2.82; | 4.52. |
Yb(ntz)3 · 4H2O:
| C | H | N | |
|---|---|---|---|
| Найдено, %: | 46.55; | 2.34; | 4.89. |
| Для YbC36H26N3O10S3 (M = 914.1) | |||
| вычислено, %: | 47.3; | 2.86; | 4.59. |
Eu(ndz)3 · 4H2O:
Gd(ndz)3 · 4H2O:
| C | H | N | |
|---|---|---|---|
| Найдено, %: | 46.33; | 2.29; | 4.13. |
| Для GdC36H26N3O10S3 (M = 929.8) | |||
| вычислено, %: | 46.5; | 2.82; | 4.52. |
Yb(ndz)3 · 4H2O:
Синтез Ln(carb)3 ⋅ Q (Ln = Eu3+,Yb3+; carb = ntz–, ndz–, Q = TPPO, BPhen)
К 5 мл водного раствора хлорида лантанида в воде приливали эквимолярный раствор нейтрального лиганда в спирте, затем после продолжительного перемешивания добавляли раствор 0.1 г K(btz) в 5–10 мл воды. Выпавший осадок отфильтровывали и высушивали на воздухе. Получили 0.077 г белого порошка. Выход ∼77%.
LnCl3 · 6H2O + Q → LnCl3 · Q + 3K(carb) + + 6H2O → Ln(carb)3 · Q · xH2O↓ + 3KCl + 6H2O (x = 0–2).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Установление состава полученных соединений
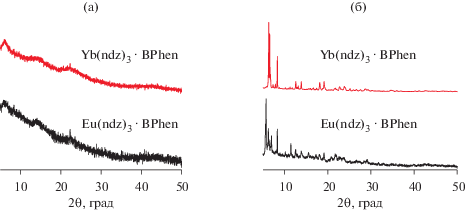
Синтез однороднолигандных карбоксилатов европия и иттербия проводили по обменной реакции между калиевой солью кислоты и хлоридом лантанидов в воде, поскольку полученные КС менее растворимы в воде, чем побочные продукты (KCl), и устойчивы в водной среде. Полученные комплексы оказались рентгеноаморфными, для получения кристаллических образцов была проведена перекристаллизация из ТГФ (рис. 1).
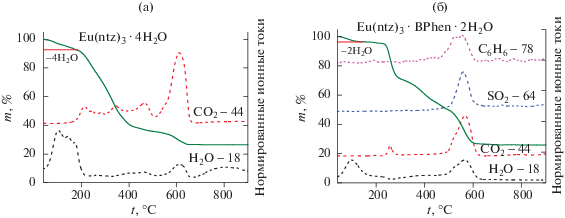
Гидратный состав полученных КС лантанидов был установлен на основании данных термогравиметрического анализа. Например, потеря массы при дегидратации составляет ∼7% при разложении Eu(ntz)3 ∙ nH2O, что соответствует потере четырех молекул воды (рис. 2а), и 3.5% при разложении Eu(ntz)3BPhen ∙ nH2O, что отвечает потере двух молекул воды (рис. 2б).
Рис. 2.
Результаты ТГА с масс-спектрометрией выделяющихся газов для Eu(ntz)3 ∙ 4H2O (а) и Eu(ntz)3 ∙ BPhen · 2H2O (б).
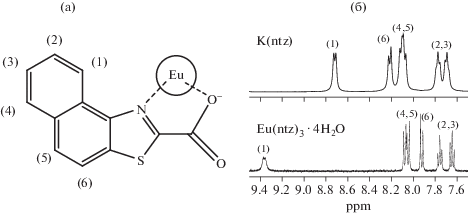
В отсутствие структурных данных косвенную информацию о строении комплексов получали с использованием 1Н ЯМР-спектроскопии в ДМСО-d6 на примере КС европия. Магнитный момент европия приводит к сдвигу и уширению сигналов протонов аниона лиганда в 1Н ЯМР-спектре КС. В случае полной диссоциации комплекса такое влияние не наблюдается вследствие отсутствия связи металл–лиганд, как мы продемонстрировали это ранее на примере бензофураната европия [24]. В результате частичной диссоциации в растворе будут находиться как связанные, так и не связанные с ионом европия ионы лиганда, следовательно, в спектре будут присутствовать и сигналы КС лантанида, и отдельно сигналы аниона кислоты. Однако в случае обратимой диссоциации со скоростью измерения ниже, чем скорость диссоциации/ассоциации аниона кислоты к лантаниду, будет наблюдаться один набор сигналов, являющийся суперпозицией обоих случаев [25, 26].
Были получены 1Н ЯМР-спектры калиевых солей и КС лантанидов. Для соединений состава Eu(ntz)3 ∙ 4H2O наблюдается наиболее заметный сдвиг сигнала протона, ближайшего к атому азота. Так, сигнал протона (1) сдвигается на 0.7 ppm, тогда как сигнал протона (6) сдвигается только на 0.3 ppm, а сигналы протонов (2–5) не сдвигаются (рис. 3), что может свидетельствовать о координации лантанидом гетероатома азота. Аналогичная ситуация наблюдается в спектрах соединений с анионом ndz–.
Растворимость полученных соединений была измерена в воде, этиловом спирте и ТГФ (табл. 1). Как и ожидалось, растворимость полученных КС очень высока по сравнению с типичной растворимостью ароматических карбоксилатов лантанидов [14, 27, 28]. Так, растворимость Eu(ntz)3 · 4H2O в воде превышает растворимость бензоата европия, содержащего всего одно бензольное кольцо в составе аниона, но не содержащего гетероатомы [26]. Кроме того, важно, что в некоторых растворителях растворимость превышает 5 г/л, что позволяет использовать их для нанесения тонких пленок из раствора [29].
Таблица 1.
Полученная растворимость КС лантанидов с выбранными лигандами (±0.04 г/л)
| Образец | Растворимость, г/л | |
|---|---|---|
| в воде | в ТГФ | |
| Eu(ntz)3 · 4H2O | 0.4 | 10.2 |
| Yb(ntz)3 · 4H2O | 0.3 | 11.1 |
| Eu(ntz)3 · TPPO | – | 6.7 |
| Yb(ntz)3 · TPPO | – | 4.4 |
| Eu(ntz)3 · BPhen | – | 4.7 |
| Yb(ntz)3 · BPhen | – | 7.3 |
| Eu(ndz)3 · 4H2O | 0.3 | 5.4 |
| Yb(ndz)3 · 4H2O | 0.2 | 3.8 |
| Eu(ndz)3 · TPPO | – | 2.8 |
| Yb(ndz)3 · TPPO | – | 2.3 |
| Eu(ndz)3 · BPhen | – | 13.6 |
| Yb(ndz)3 · BPhen | – | 14.8 |
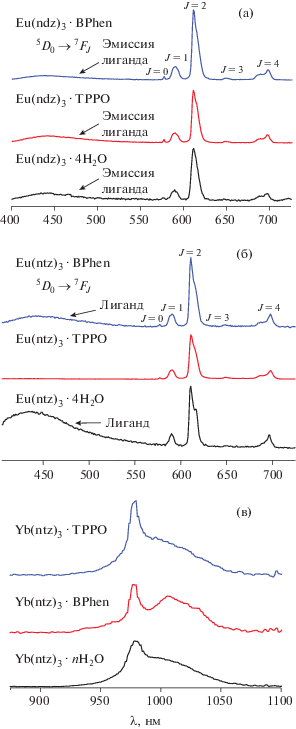
Люминесцентные свойства КС лантанидов
Для изучения фотофизических свойств полученных соединений были измерены спектры поглощения растворов солей гетероароматических кислот, для оценки энергии триплетного возбужденного состояния – спектры люминесценции КС гадолиния при температуре жидкого азота и комнатной температуре. Изучение люминесцентных свойств КС иттербия включало измерение спектров люминесценции, а в случае КС европия были также измерены спектры возбуждения, времена жизни возбужденного состояния и квантовые выходы люминесценции.
Измеренные спектры поглощения гетероароматических соединений позволили с помощью закона Бугера–Ламберта–Бера оценить их коэффициенты молярной экстинкции: 62500 (М см)–1 для K(ntz) и 62 000 (М см)–1 для K(ndz) (рис. 4а).
Рис. 4.
Спектры поглощения растворов K(ntz) и K(ndz) в H2O (а). Спектры люминесценции Gd(ntz)3 · 4H2O при 77 и 298 K (б).
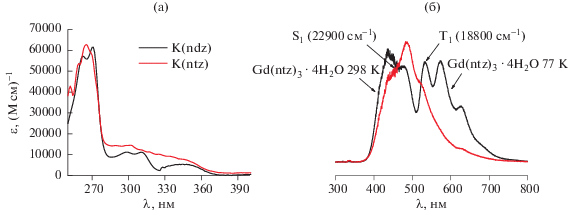
В спектрах низкотемпературной люминесценции КС гадолиния по сравнению со спектрами, зарегистрированными при комнатной температуре, наблюдается ярко выраженная полоса фосфоресценции в более длинноволновой области (рис. 5). Самый коротковолновый максимум данной полосы используется для оценки энергии триплетного возбужденного состояния [30]. Для обоих лигандов триплетный уровень составил ∼18 800 см–1, что достаточно для возбуждения и иона Eu3+, энергия возбужденного состояния которого составляет 17 200 см–1, и иона Yb3+ (10 000 см–1). Таким образом, увеличение степени сопряжения и введение гетероатома в α-положение позволяют достичь достаточной энергии триплетного возбужденного состояния.
Измерение спектров люминесценции полученных КС иттербия и европия показало, что в комплексах наблюдается яркая ионная люминесценция европия, тогда как интенсивность люминесценции иттербия довольно низкая в составе всех КС (рис. 5).
Для оценки эффективности люминесценции используется квантовый выход (QY), однако высокую интенсивность люминесценции обеспечивает большая величина произведения поглощения на квантовый выход [14, 31]:
Несмотря на низкие квантовые выходы, величина L однороднолигандных КС европия достигает 156.25 (М см)–1 для комплекса Eu(ntz)3 · 4H2O и 1550 (М см)–1 для комплекса Eu(ndz)3 · 4H2O.
Для определения факторов, лимитирующих квантовый выход, была определена эффективность сенсибилизации иона европия лигандами и квантовый выход при прямом возбуждении. Для этого были рассчитаны излучательные времена жизни иона европия из спектров люминесценции (табл. 2) [32]:
(2)
$\frac{1}{{{{\tau }_{{{\text{rad}}}}}}} = 14.65{{n}^{3}}\left( {\frac{{{{I}_{{{\text{tot}}}}}}}{{{{I}_{{{\text{MD}}}}}}}} \right)\,\,\left( {{{{\text{c}}}^{{ - 1}}}} \right),$(3)
${\text{QY}}_{{{\text{Ln}}}}^{{{\text{Ln}}}} = \frac{{{{\tau }_{{{\text{obs}}}}}}}{{{{\tau }_{{{\text{rad}}}}}}}.$Таблица 2.
Значения фотофизических характеристик полученных соединений
| Образец | Время жизни, мс | Излучательное время жизни, мс | Внутренний квантовый выход, % | Квантовый выход, % | Эффективность сенсибилизации, % |
|---|---|---|---|---|---|
| Eu(ntz)3 · 4H2O | 0.16 | 2.35 | 14.8 | 0.25 | 1.68 |
| Eu(ndz)3 · 4H2O | 0.28 | 2.65 | 9.45 | 2.5 | 26.45 |
| Eu(ntz)3 · TPPO | 0.22 | 2.09 | 9.37 | 1.5 | 16 |
| Eu(ndz)3 · TPPO | 0.34 | 2.59 | 7.55 | 5.42 | 71.78 |
| Eu(ntz)3 · BPhen | 0.31 | 3.56 | 11.45 | 2.1 | 18.34 |
| Eu(ndz)3 · BPhen | 0.46 | 2.63 | 5.68 | 5 | 88 |
Эффективность сенсибилизации рассчитывали как отношение квантовых выходов:
(4)
${{\eta }_{{{\text{sens}}}}} = \frac{{{\text{QY}}}}{{{\text{QY}}_{{{\text{Ln}}}}^{{{\text{Ln}}}}}}.$Полученные значения (табл. 2) показывают, что для разнолигандных комплексов ключевым является тушение люминесценции, а в случае однороднолигандных комплексов невысокая эффективность сенсибилизации также играет важную роль.
В качестве материала для OLED протестировали однороднолигандные КС, чтобы оценить, обеспечивает ли предложенный дизайн лиганда (рост длины сопряжения и введение гетероатома) достаточные электронные свойства. Использование разнолигандных комплексов в данном случае не позволит оценить роль анионного лиганда, поскольку выбранные нейтральные лиганды обладают электронной подвижностью [33].
Применение в качестве материалов для OLED
Получены OLED-устройства, гетероструктуры которых приведены в табл. 3. При этом в качестве составляющих слоев использовали хорошо известные стандартные слои. Для нанесения пленок КС использовали метод spin-coating, скорость вращения подложки составляла 1500 об/мин из растворов с концентрацией 5 г/л. Пленки наносили из ТГФ.
Таблица 3.
Данные о гетероструктурах полученных OLED-устройств
| Анод | HIL | HTL | EL | ETL | EIL | Катод | |
|---|---|---|---|---|---|---|---|
| OLED1 | ITO | PEDOT:PSS | PVK | Eu(ntz)3 | TAZ | – | Al |
| OLED2 | ITO | PEDOT:PSS | PVK | Eu(ndz)3 | TAZ | – | Al |
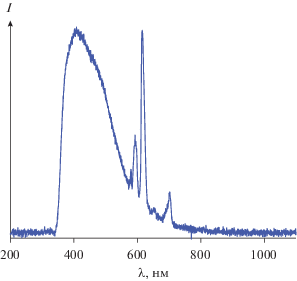
Измерение спектров электролюминесценции показало, что OLED1 не демонстрирует ионную люминесценцию европия, что связано с низким квантовым выходом. В то же время OLED2 демонстрирует электролюминесценцию, яркость которой достигает 1.2 кд/м2. В его спектре присутствует полоса эмиссии европия, что подтверждает наличие достаточной электронной подвижности этого материала, которая компенсирует даже достаточно невысокий квантовый выход (рис. 6). Широкая полоса эмиссии в синей области соответствует люминесценции дырочно-транспортного слоя PVK, это подтверждает, что Eu(ndz)3 действительно обладает электронной подвижностью.
ЗАКЛЮЧЕНИЕ
Показано, что подход к дизайну КС лантанидов, основанный на использовании в качестве анионного лиганда трициклических гетероароматических карбоксилат-анионов, приводит к получению ярко люминесцирующих растворимых соединений, обладающих подвижностью носителей заряда. Введение в состав КС лигандов, содержащих гетероатом азота в α-положении относительно карбоксильной группы, приводит к заметному увеличению растворимости, что, вероятно, связано с участием атома азота в координации ионом лантанида. Наличие обедненной электронами системы в лиганде с высокой степенью сопряжения в сочетании с фотолюминесценцией и растворимостью позволило успешно протестировать КС европия в качестве эмиссионного слоя OLED.
Список литературы
Khudoleeva V.Y., Utochnikova V.V., Kalyakina A.S. et al. // Dye. Pigment. 2017. V. 143. P. 348. https://doi.org/10.1016/j.dyepig.2017.04.058
Cadiau A., Brites C.D.S., Costa P.M.F.J. et al. // ACS Nano. 2013. V. 7. № 8. P. 7213. https://doi.org/10.1021/nn402608w
Brites C.D.S., Balabhadra S., Carlos L.D. // Adv. Opt. Mater. 2019. V. 7. № 5. P. 1 801 239. https://doi.org/10.1002/adom.201801239
Kaczmarek A.M., Maegawa Y., Abalymov A. et al. // ACS Appl. Mater. Interfaces. 2020. V. 12. № 11. P. 13 540. https://doi.org/10.1021/acsami.0c01470
Runowski M., Woźny P., Lis S. et al. // Adv. Mater. Technol. 2020. P. 1 901 091. https://doi.org/10.1002/admt.201901091
Xu H., Chen R., Sun Q. et al. // Chem. Soc. Rev. 2014. V. 43. № 10. P. 3259. https://doi.org/10.1039/C3CS60449G
Kido J., Okamoto Y. // Chem. Rev. 2002. V. 102. № 6. P. 2357. https://doi.org/10.1021/cr010448y
Kuz’mina N.P., Eliseeva S.V. // Russ. J. Inorg. Chem. 2006. V. 51. № 1. P. 73. https://doi.org/10.1134/S0036023606010141
Santos H.P., Gomes E.S., dos Santos M.V. et al. // Inorg. Chim. Acta. 2019. V. 484. P. 60. https://doi.org/10.1016/j.ica.2018.09.030
Wang L., Zhao Z., Wei C. et al. // Adv. Opt. Mater. 2019. V. 7. № 11. P. 1. https://doi.org/10.1002/adom.201801256
Kalsi P.S. 6th ed. New Age International, 2007. 652 p.
Armaroli N., Cola L. De, Balzani V. // J. Chem. Soc., Faraday Trans. 1992. V. 88. № 4. P. 553.
Hilder M., Lezhnina M., Junk P.C.C. et al. // Polyhedron. 2013. V. 52. P. 804. https://doi.org/10.1016/j.poly.2012.07.047
Utochnikova V.V., Kuzmina N.P. // Russ. J. Coord. Chem. 2016. V. 42. № 10. P. 679. https://doi.org/10.1134/S1070328416090074
Уточникова В.В., Латипов Е.В., Абрамович М. и др. Pat. 2017100582 USA. РФ, 2017.
Shul’gin V.F., Abkhairova S.V., Konnik O.V. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 6. P. 678. https://doi.org/10.1134/S0036023613060223
Konnik O.V., Shul’gin V.F., Abkhairova S.V. et al. // Russ. J. Coord. Chem. 2014. V. 40. № 1. P. 28. https://doi.org/10.1134/S1070328414010035
Koshelev D.S., Chikineva T.Y., Kozhevnikova (Khudoleeva) V.Y. et al. // Dye. Pigment. Elsevier Ltd, 2019. V. 170. P. 107604. https://doi.org/10.1016/j.dyepig.2019.107604
Utochnikova V.V., Kalyakina A.S., Lepnev L.S. et al. // J. Lumin. 2015. V. 170. P. 633. https://doi.org/10.1016/j.jlumin.2015.03.033
Bünzli J.-C.G., Comby S., Chauvin A.-S.S. et al. // J. Rare Earths. 2007. V. 25. № 3. P. 257. https://doi.org/10.1016/S1002-0721(07)60420-7
Korshunov V.M., Ambrozevich S.A., Kareva E.R. // J. Phys. Conf. Ser. 2019. V. 1348. № 1. P. 012042. https://doi.org/10.1088/17426596/1348/1/012042
Girotto E., Pereira A., Arantes C. et al. // J. Lumin. 2019. V. 208. P. 57. https://doi.org/10.1016/j.jlumin.2018.12.027
Ambrogi V., Grandolini G., Perioli L. et al. // Synthesis (Stuttg). 1992. https://doi.org/10.1055/s-1992-26191
Utochnikova V.V., Koshelev D.S., Medvedko A.V. et al. // Opt. Mater. (Amst). 2017. V. 74. P. 191. https://doi.org/10.1016/j.optmat.2017.05.038
Kalyakina A.S., Utochnikova V.V., Bushmarinov I.S. et al. // Chem. A Eur. J. 2015. V. 21. № 49. P. 17921. https://doi.org/10.1002/chem.201501816
Kalyakina A.S., Utochnikova V. V., Bushmarinov I.S. et al. // Chem. A Eur. J. 2017. V. 23. № 59. P. 14944. https://doi.org/10.1002/chem.201703543
Utochnikova V.V. // Coord. Chem. Rev. 2019. V. 398. P. 113 006. https://doi.org/10.1016/j.ccr.2019.07.003
Utochnikova V.V., Kalyakina A.S., Solodukhin N.N. et al. // Eur. J. Inorg. Chem. John Wiley & Sons, Ltd, 2019. V. 2019. № 18. P. 2320. https://doi.org/10.1002/ejic.201801561
Bünzli J.-C.G. // Luminescence of Lanthanide Ions in Coordination Compounds and Nanomaterials. Chichester, United Kingdom: John Wiley & Sons Ltd, 2014. P. 125. https://doi.org/10.1002/9781118682760.ch04
Utochnikova V.V., Grishko A.Y., Koshelev D.S. et al. // Opt. Mater. (Amst). 2017. V. 74. P. 201. https://doi.org/10.1016/j.optmat.2017.02.052
Bünzli J.-C.G. // Coord. Chem. Rev. 2015. V. 293–294. P. 19. https://doi.org/10.1016/j.ccr.2014.10.013
Binnemans K. // Coord. Chem. Rev. 2015. V. 295. P. 1. https://doi.org/10.1016/j.ccr.2015.02.015
Kozlov M.I., Aslandukov A.N., Vashchenko A.A. et al. // Dalton. Trans. 2019. https://doi.org/10.1039/c9dt03823j
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии