Журнал неорганической химии, 2021, T. 66, № 12, стр. 1754-1761
Термодинамические характеристики ниобатов цинка Zn3Nb2O8, ZnNb2O6, Zn2Nb34O87. p–x-сечение фазовой диаграммы ZnO–Nb2O5
Н. А. Грибченкова a, А. С. Смирнов a, К. Г. Сморчков a, Е. В. Белова a, А. С. Алиханян a, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: alikhan@igic.ras.ru
Поступила в редакцию 14.06.2021
После доработки 07.07.2021
Принята к публикации 12.07.2021
Аннотация
Эффузионным методом Кнудсена с масс-спектральным анализом газовой фазы исследованы процессы парообразования в системе ZnO–Nb2O5 в интервале температур 1223–1465 K. Установлено, что насыщенный пар над системой во всем диапазоне составов конденсированной фазы состоит из атомов цинка, молекул кислорода и незначительного количества молекул ZnO. Рассчитаны абсолютные величины парциальных давлений и активностей компонентов, построено р–х-сечение полной р–Т–х фазовой диаграммы при температурах 1353 и 1443 K. По 2-му и 3-му законам термодинамики найдены стандартные энтальпии ряда гетерофазных реакций и стандартные энтальпии образования ниобатов цинка: ${{\Delta }_{f}}H_{{298}}^{^\circ }$(Zn3Nb2O8) = –2992.0 ± 30.2 кДж/моль, ${{\Delta }_{f}}H_{{298}}^{^\circ }$(ZnNb2O6) = = –2292.4 ± 19.9 кДж/моль, ${{\Delta }_{f}}H_{{298}}^{^\circ }$(Zn2Nb34O87) = –33056.1 ± 15.0 кДж/моль, а также их энтальпии образования из простых оксидов: (Zn3Nb2O8) = –50.0 ± 20.0 кДж/моль, (ZnNb2O6) = –40.5 ± ± 15.0 кДж/моль, (Zn2Nb34O87) = –90.9 ± 15.0 кДж/моль.
ВВЕДЕНИЕ
Интерес к системам на основе широкозонных полупроводниковых оксидов SnO2 (3.54 эВ) и ZnO (3.37 эВ) обусловлен их оптическими, электрофизическими, каталитическими и сенсорными свойствами. Эти соединения принадлежат к группе прозрачных проводящих оксидов (Transparent conducting oxides – TCO). Пленки TCO применяются в качестве прозрачных контактных слоев для светодиодов и солнечных элементов, дисплеев, наноматериалы на основе ZnO, SnO2 обладают уникальной сенсорной и каталитической активностью, высокой фоточувствительностью к УФ-излучению, находят применение в качестве полевых транзисторов, эмиссионных дисплеев, люминесцентных материалов. Однако чистые ZnO и SnO2 имеют достаточно ограниченное применение в связи с их высоким электросопротивлением, поэтому практически всегда они легируются донорными примесями (Al, Ga, Nb, Ta и др.). Кроме повышенного интереса к физическим свойствам пленок и различных наноматериалов на основе ZnO, допированных Ta и Nb [1–9], в последнее время отмечается повышенное внимание и к системам ZnO–Ta2O5, ZnO–Nb2O5, обусловленное существованием в них смешанных оксидов ZnTa2O6, Zn3Ta2O8, ZnNb2O6 и Zn3Nb2O8. Керамики на основе перечисленных соединений являются перспективными материалами в СВЧ-электронике. Сочетание высокой диэлектрической проницаемости, электрической добротности, низкого температурного коэффициента диэлектрической проницаемости обусловливает применение керамик Zn–Nb–Ta–O в качестве материалов для подложек СВЧ-микросхем, диэлектрических резонаторов или фильтров в микроволновом диапазоне [10–13]. Соединения Zn3Ta2O8, Zn3Nb2O8 и их комбинации могут быть использованы как низковольтные катодолюминесцентные люминофоры в дисплеях с автоэлектронной эмиссией или вакуумно-люминесцентных индикаторах [14–16]. Различные составы систем ZnO–Ta2O5 и ZnO–Nb2O5 используются в органическом гетерогенном и фотокатализе при разложении токсичных органических веществ в окружающей среде [17, 18].
Физические и физико-химические свойства любого оксидного материала сильно зависят от методов и условий их получения. Существует два основных подхода к получению оксидных материалов. Первый связан с газофазными процессами, второй – с использованием растворов. “Растворные” методы, как и газофазные, часто связаны с высокими температурами (до 1400°С), так как для получения необходимых свойств материал, полученный из раствора, подвергается длительному высокотемпературному отжигу. Поэтому для контролируемого синтеза полифункциональных оксидных материалов с заданным катионным и анионным составом исключительно важным является знание их термодинамических характеристик и исследование термодинамики процессов парообразования. Необходимо подчеркнуть, что основное внимание должно уделяться исследованию состава газовой фазы, определению абсолютных величин парциальных давлений, главным образом парциальному давлению кислорода, определению стандартных энтальпий образования сложных оксидов, энергий Гиббса образования твердых растворов, построению р–х- и р–Т-сечений полных р–Т–х фазовых диаграмм оксидных систем. До настоящего времени достаточно подробно исследованы Т–х-сечения систем ZnO–Ta2O5 и ZnO–Nb2O5.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Высокотемпературные исследования процессов парообразования и термодинамических свойств системы ZnO–Nb2O5 во всем диапазоне составов выполнены эффузионным методом Кнудсена с масс-спектральным анализом состава газовой фазы на приборе МС 1301. В работе использовали кварцевые эффузионные камеры с отношением площади испарения к площади эффузии ~100. Нагрев камеры Кнудсена осуществляли печью сопротивления, температуру измеряли Pt/Pt(Rh)-термопарой и поддерживали с точностью ±1°С.
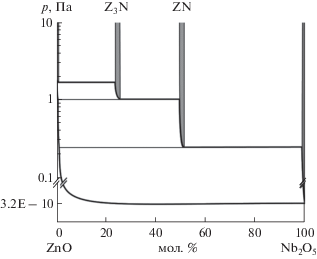
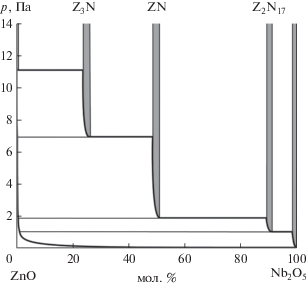
По данным работы [19], в квазибинарной системе ZnO–Nb2O5 образуются три сложных оксида: Zn3Nb2O8 (3 : 1), ZnNb2O6 (1 : 1) и Zn2Nb34O87 (2 : 17), находящихся в равновесии до 1085°С с четырьмя гетерогенными областями: [ZnO + + Zn3Nb2O8] (I), [Zn3Nb2O8 + ZnNb2O6] (II), [ZnNb2O6 + Zn2Nb34O87] (III) и [Zn2Nb34O87 + Nb2O5] (IV). Ниже температуры 1085°С соединение (2 : 17) неустойчиво, оставшиеся два соединения разделены тремя гетерогенными областями: [ZnO + + Zn3Nb2O8] (I), [Zn3Nb2O8 + ZnNb2O6] (II) и [ZnNb2O6 + Nb2O5] (V). Необходимо отметить, что соединения (1 : 1) и (3 : 1) плавятся конгруэнтно при температурах 1312 и 1405°С соответственно, а соединение (2 : 17) – инконгруэнтно с температурой перитектики 1415°С. При температуре 1350°С ниобат цинка состава (1 : 1) претерпевает полиморфное превращение – низкотемпературная модификация α-ZnNb2O6 переходит в высокотемпературную β-ZnNb2O6.
Работы по исследованию термодинамики парообразования системы ZnO–Nb2O5 до настоящего времени не проводились, в то время как парообразование индивидуальных оксидов подробно описано в многочисленных исследованиях [20–23]. Согласно этим работам, процесс парообразования оксида цинка протекает конгруэнтно, насыщенный пар состоит в основном из атомов Zn и молекул О2. Подобная природа насыщенного пара, несмотря на свою простоту, делает проблематичным использование в масс-спектральных исследованиях платиновых камер Кнудсена из-за растворения в них цинка [24–26]. Поэтому процесс парообразования оксидов и оксидных систем, содержащих в паре атомы металла, всегда сопровождается монотонным, неконтролируемым уменьшением парциального давления металла и увеличением давления кислорода [25, 26]. Однако анализ литературных данных по фазовым диаграммам систем ZnO–SiO2, Nb2O5–SiO2 и ZnO–Nb2O5–SiO2 [27, 28] показал, что при исследовании системы ZnO–Nb2O5 в интервале температур 1200–1400 K могут быть использованы кварцевые камеры Кнудсена. Постоянство измеряемых ионных токов при парообразовании в гетерогенных фазовых областях системы, а также отсутствие силиката цинка в нелетучих остатках после испарения по данным РФА, доказывает, что оксид кремния может использоваться как инертный материал относительно исследуемой системы в данном интервале температур.
Сублимация Nb2O5 в интервале температур 1100–1400°С происходит инконгруэнтно с переходом в газовую фазу молекул кислорода и образованием различных конденсированных оксидов, составы которых, по данным [29–34], находятся в области Nb12O29–Nb53O132. Более низкая летучесть оксида ниобия по сравнению с оксидом цинка позволяет рассматривать указанную систему в процессе парообразования в интервале температур 1200–1500 K в рамках двухкомпонентной системы как
(1)
${{N}_{{{\text{ZnO}}}}} + {{N}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}} = {\text{ }}1,$В работе были исследованы процессы парообразования образцов системы ZnO–Nb2O5 составов 90, 75, 60, 50, 40, 11 мол. % ZnO. Синтез первых четырех образцов проводили отжигом гомогенизированных смесей чистых оксидов ниобия и цинка в платиновых тиглях на воздухе при T = = 1173 K в течение 30 ч, чистоту и фазовый состав которых контролировали методами рентгенофазового и рентгенофлуоресцентного анализа. Образец состава 11 мол. % ZnO получен непосредственно в ходе масс-спектрального эксперимента отжигом в эффузионной камере при Т > 1360 K тщательно гомогенизированной системы ZnNb2O6 + Nb2O5 состава 88.9 мол. % Nb2O5.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Требования, предъявляемые к экспериментальной работе, выполняемой с использованием кварцевых эффузионных камер, не позволили нам методом изотермического испарения [35] в одном опыте найти величины парциальных давлений компонентов газовой фазы над всеми фазовыми областями системы ZnO–Nb2O5. Поэтому нами выполнено три изотермических эксперимента по частичной сублимации фазовых систем I, II, V при Т = 1353 K и четыре аналогичных эксперимента по фазовым системам I–IV при Т = 1443 K. Выполненная таким образом работа по исследованию процессов сублимации и знание термодинамических характеристик оксида цинка [20–23] свидетельствуют о том, что насыщенный пар над системой состоит главным образом из атомов цинка и молекул кислорода. Однако, по данным [36], в газовой фазе присутствуют молекулы ZnO, парциальное давление которых практически на три порядка ниже, чем основных компонентов. Расчет величин парциальных давлений атомов цинка и молекул кислорода был выполнен согласно уравнению Герца–Кнудсена и условию конгруэнтной сублимации оксида цинка в условиях эффузионного эксперимента:
(2)
$({{p}_{{{\text{Zn}}}}}{\text{/}}\sqrt {{{M}_{{{\text{Zn}}}}}} ){\text{/}}({{p}_{{{{{\text{O}}}_{2}}}}}{\text{/}}\sqrt {{{M}_{{\text{O}}}}_{{_{2}}}} ) = 2.$В табл. 1 и 2 приведены результаты этих расчетов. Там же представлены значения величин парциальных давлений при сублимации оксида цинка в замкнутом объеме, когда в процессе парообразования выполняется условие равенства составов газовой и конденсированной фаз:
Таблица 1.
Величины парциальных давлений компонентов газовой фазы над системой ZnO–Nb2O5, T = 1353 K
| Состав конденсированной фазы | Условие сублимации | Давление компонентов пара, атм | Общее давление, атм | Активность компонентов | |||
|---|---|---|---|---|---|---|---|
| рZn | ${{p}_{{{{{\text{O}}}_{2}}}}}$ | рZnO | aZnO | ${{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{5}}}}}$ | |||
| ZnO | Кнудсен Замкнутый объем |
1.22 × 10–5 1.08 × 10–5 |
0.43 × 10–5 0.54 × 10–5 |
7.57 × 10–10 7.51 × 10–10 |
1.65 × 10–5 1.62 × 10–5 |
1 | 0 |
| ZnO + Zn3Nb2O8 | Кнудсен Замкнутый объем |
1.22 × 10–5 1.08 × 10–5 |
0.43 × 10–5 0.54 × 10–5 |
7.57 × 10–10 7.51 × 10–10 |
1.65 × 10–5 1.62 × 10–5 |
1 | 0.016 |
| Zn3Nb2O8 + ZnNb2O6 | Кнудсен Замкнутый объем |
7.63 × 10–6 6.72 × 10–6 |
2.68 × 10–6 3.36 × 10–6 |
3.73 × 10–10 3.71 × 10–10 |
1.03 × 10–5 1.01 × 10–5 |
0.51 | 0.12 |
| ZnNb2O6 + Nb2O5 | Кнудсен Замкнутый объем |
1.91 × 10–6 1.63 × 10–6 |
0.67 × 10–6 0.82 × 10–6 |
4.48 × 10–11 4.43 × 10–11 |
2.58 × 10–6 2.45 × 10–6 |
0.062 | 1 |
При этом были использованы рассчитанные нами значения константы равновесия реакции:
по экспериментальным результатам работы [36]. По найденным таким образом величинам парциальных давлений было построено р–х-сечение полной р–Т–х фазовой диаграммы системы (рис. 1, 2) при температурах 1353 и 1443 K.Для определения стандартных энтальпий образования ниобатов цинка были рассчитаны энтальпии следующих гетерофазных реакций:
(6)
${\text{Z}}{{{\text{n}}}_{{\text{3}}}}{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{8}}}}{\text{(к}}) = {\text{ZnN}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{6}}}}{\text{(к)}} + 2{\text{Zn(г}}) + {{{\text{O}}}_{2}},$(7)
${\text{ZnN}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{6}}}}{\text{(к}}) = {\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}{\text{(к}}) + {\text{Zn(г}}) + 0.5{{{\text{O}}}_{2}},$(8)
$\begin{gathered} {\text{ZnN}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{6}}}}{\text{(к}}){\text{ }} = 1{\text{/}}17{\text{Z}}{{{\text{n}}}_{{\text{2}}}}{\text{N}}{{{\text{b}}}_{{{\text{34}}}}}{{{\text{O}}}_{{{\text{87}}}}}{\text{(к}}) + \\ + \,\,15{\text{/}}17{\text{Zn(г) }} + {\text{ }}15{\text{/}}34{{{\text{O}}}_{2}}, \\ \end{gathered} $(9)
$\begin{gathered} {\text{Z}}{{{\text{n}}}_{{\text{2}}}}{\text{N}}{{{\text{b}}}_{{{\text{34}}}}}{{{\text{O}}}_{{{\text{87}}}}}{\text{(к}}) = \\ = 17{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}{\text{(к}}) + 2{\text{Zn(г)}} + {{{\text{O}}}_{2}}. \\ \end{gathered} $Определение энтальпий реакций (5)–(9) было выполнено по 2-му и 3-му законам термодинамики. При определении по 2-му закону исследовали температурные зависимости величин, пропорциональных константам равновесий реакций (5)–(9), записанные в силу конгруэнтной сублимации оксида цинка в виде k*(5, 7) = (IZnT)1.5, k*(6, 9) = = (IZnT)3 и k*(8) = (IZnT)45/34.
Расчет стандартных энтальпий реакций (5)–(9) выполняли по уравнению изобары химической реакции методом наименьших квадратов (табл. 3).
Таблица 2.
Величины парциальных давлений компонентов газовой фазы над системой ZnO–Nb2O5, T = 1443 K
| Состав конденсированной фазы | Условие сублимации | Давление компонентов пара, атм | Общее давление, атм | Активность компонентов | |||
|---|---|---|---|---|---|---|---|
| рZn | ${{p}_{{{{{\text{O}}}_{2}}}}}$ | рZnO | aZnO | ${{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{5}}}}}$ | |||
| ZnO | Кнудсен Замкнуый объем |
8.05 × 10–5 7.14 × 10–5 |
2.83 × 10–5 3.57 × 10–5 |
9.75 × 10–9 9.70 × 10–9 |
10.90 × 10–5 10.70 × 10–5 |
1 | 0 |
| ZnO + Zn3Nb2O8 | Кнудсен Замкнутый объем |
8.05 × 10–5 7.14 × 10–5 |
2.83 × 10–5 3.57 × 10–5 |
9.75 × 10–9 9.70 × 10–9 |
10.90 × 10–5 10.70 × 10–5 |
1 | 0.016 |
| Zn3Nb2O8 + ZnNb2O6 | Кнудсен Замкнутый объем |
5.05 × 10–5 4.46 × 10–5 |
1.77 × 10–5 2.23 × 10–5 |
4.84 × 10–9 4.81 × 10–9 |
6.82 × 10–5 6.69 × 10–5 |
0.50 | 0.13 |
| ZnNb2O6 + Zn2Nb34O87 | Кнудсен Замкнутый объем |
1.38 × 10–5 1.22 × 10–5 |
0.49 × 10–5 0.61 × 10–5 |
0.69 × 10–9 0.69 × 10–9 |
1.87 × 10–5 1.83 × 10–5 |
0.071 | 0.90 |
| Zn2Nb34O87 + Nb2O5 | Кнудсен Замкнутый объем |
7.69 × 10–6 6.87 × 10–6 |
2.71 × 10–6 3.44 × 10–6 |
0.29 × 10–9 0.29 × 10–9 |
1.04 × 10–5 1.03 × 10–5 |
0.03 | 1 |
Здесь следует подчеркнуть, что приведенные значения энтальпий могут содержать определенную систематическую ошибку, связанную с обогащением поверхностного слоя исследуемой системы в процессе парообразования нелетучим оксидом ниобия Nb2O5, который может затруднять сублимацию оксида цинка. Не исключено, что в этих экспериментах пентаоксид ниобия будет сохранять свой первоначальный стехиометрический состав, так как процесс парообразования системы протекает при относительно высоком давлении кислорода (табл. 1, 2). Пересчет энтальпий реакций (5)–(9) к температуре 298.15 K был выполнен по известным теплоемкостям: $с_{р}^{^\circ }$(Znг) = = 20.79 Дж/(моль K), $с_{р}^{^\circ }$(О2г) = 29.35 Дж/(моль K), $с_{р}^{^\circ }$(ZnOк) = 40.25 Дж/(моль K) [38, 39], $с_{р}^{^\circ }$(Nb2O5к) = = 131.95 Дж/(моль K) [37, 38] и теплоемкостям смешанных оксидов, рассчитанным по правилу Неймана–Kоппа: $с_{р}^{^\circ }$(Zn3NbO8к) = 252.7 Дж/(моль K), $с_{р}^{^\circ }$(ZnNbO6к) = 172.2 Дж/(моль K), $с_{р}^{^\circ }$(Zn2Nb34O87к) = 2323.65 Дж/(моль K) в предположении их независимости от температуры. Значения стандартных энтальпий этих реакций, пересчитанные к температуре 298.15, приведены в табл. 4.
Таблица 3.
Стандартные энтальпии гетерофазных реакций, кДж/моль
| Интервал температур, K | ||||
|---|---|---|---|---|
| 1223–1398 | 1230–1363 | 1240–1340 | 1353–1443 | 1353–1465 |
| Энтальпии реакций, кДж/моль | ||||
| $\Delta Н_{T}^{^\circ }$ (5) | $\Delta Н_{T}^{^\circ }$(6) | $\Delta Н_{T}^{^\circ }$(7) | $\Delta Н_{T}^{^\circ }$(8) | $\Delta Н_{T}^{^\circ }$(9) |
| 477.0 ± 14.7 | 958.7 ± 33.1 | 506.6 ± 12.5 | 473.1 ± 26.2 | 1060.6 ± 18.4 |
| 474.8 ± 11.5 | 911.1 ± 18.1 | 505.1 ± 12.0 | 478.9 ± 21.6 | 1069.3 ± 12.2 |
| 480.2 ± 20.0 | 925.7 ± 36.1 | 501.6 ± 12.0 | 482.0 ± 17.0 | 1039.6 ± 14.9 |
| 481.6 ± 14.9 | 931.2 ± 30.2 | – | 476.0 ± 25.3 | – |
| 476.4 ± 13.6 | – | – | – | – |
| 481.9 ± 10.8 | – | – | – | – |
| Среднее значение | ||||
| 478.7 ± 14.3 | 931.7 ± 32.6 | 504.4 ± 12.3 | 477.5 ± 22.6 | 1056.5 ± 18.6 |
Стандартные энтальпии гетерофазных реакций (5)–(9) были рассчитаны также по 3-му закону термодинамики. При расчете использовали экспериментально найденные абсолютные величины парциальных давлений атомов цинка и молекул кислорода при T = 1353, 1443 K (табл. 1, 2), известные значения энтропий компонентов этих реакций при T = 298.15 K: S°(Znг) = 160.88 Дж/(моль K) [37, 38], S°(ZnОт) = 37.89 Дж/(моль K) [38, 39], S°(О2г) = = 205.03 Дж/(моль K) [37, 38], S°(Nb2О5к) = = 137.10 Дж/(моль K) [37, 38] и энтропии смешанных оксидов, рассчитанные как средние по инкрементам Келли и Латимера [39–42]: S°(Zn3Nb2O8к) = 274.0 Дж/(моль K), S°(ZnNb2O6к) = = 181.7 Дж/(моль K), S°(Zn2Nb34O87к) = = 2422.5 Дж/(моль K). Найденные таким образом стандартные энтальпии реакций (5)–(9) равны:
${{\Delta }_{r}}H_{{1353\,\,{\text{K}}}}^{^\circ }$(5) = 494.2 ± 20.0кДж/моль, ${{\Delta }_{r}}H_{{1353\,\,{\text{K}}}}^{^\circ }$(6) = 981.5 ± 25.0кДж/моль, ${{\Delta }_{r}}H_{{1353\,\,{\text{K}}}}^{^\circ }$(7) = = 524.1 ± 20.0 кДж/моль, ${{\Delta }_{r}}H_{{1443\,\,{\text{K}}}}^{^\circ }$(8) = 463.1 ± ± 20.1 кДж/моль, ${{\Delta }_{r}}H_{{1443\,\,{\text{K}}}}^{^\circ }$(9) = 1067.1 ± ± 25.0 кДж/моль. В табл. 4 приведены значения энтальпий, пересчитанные к температуре 298.15 K. Ошибка в определении энтальпий по 3-му закону термодинамики связана в основном с точностью определения констант равновесия и оценки изменения энтропий гетерофазных реакций. Термодинамический анализ показал, что вклад этих факторов примерно равнозначный. В этой же таблице приведены рекомендованные значения энтальпий реакций (5)–(9), полученные как среднеарифметические из величин, рассчитанных по 2-ому и 3-ему законам термодинамики. Связано это с тем, что в данной экспериментальной работе трудно отдать предпочтение какому-либо методу при определении значений энтальпий. Суммарная ошибка для рекомендованных значений рассчитана по закону сложения случайных величин.
Используя рекомендованные значения энтальпий реакций (5)–(9) и известные литературные данные по стандартным энтальпиям образования ${{\Delta }_{f}}H_{{298}}^{^\circ }$(Nb2О5к) = –1897.0 кДж/моль [37, 38] и ${{\Delta }_{f}}H_{{298}}^{^\circ }$(Znг) = 130.7 кДж/моль [37, 38], по закону Гесса рассчитали стандартные энтальпии образования ниобатов цинка из элементов и простых оксидов (табл. 5). Найденная в работе величина стандартной энтальпии образования кристаллического оксида цинка хорошо согласуется с известными литературными данными, что может служить подтверждением корректности выполненных нами исследований. Здесь необходимо отметить, что относительная точность расчета стандартных энтальпий образования ниобатов цинка из простых оксидов с использованием термодинамического цикла достаточно низкая. Это связано с методикой расчета, в которой определяемая малая величина (энтальпия образования смешанного оксида из простых оксидов) рассчитывается как алгебраическая сумма нескольких больших величин (значения стандартных энтальпий образования из элементов). Поэтому расчет стандартных энтальпий образования ниобатов цинка из простых оксидов был выполнен также исходя из выражения энергии Гиббса образования ниобатов цинка из простых оксидов [43]:
(10)
$n{\text{Zn}}{{{\text{O}}}_{{\text{к}}}} + m{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{О}}}_{{{\text{5к}}}}} = n{\text{ZnO}}m{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{О}}}_{{{\text{5к}}}}},$(11)
${{\Delta }_{f}}G_{T}^{^\circ }(n{\text{ZnO}}m{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{О}}}_{{{\text{5к}}}}}) = RT\ln (a_{{{\text{ZnO}}}}^{n}a_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{m})$(12)
${{({{a}_{{{\text{ZnO}}}}}{{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}})}_{{\text{V}}}} = {{({{a}_{{{\text{ZnO}}}}})}_{{\text{V}}}} = {\text{ }}{{({{a}_{{{\text{ZnO}}}}}{{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}})}_{{{\text{II}}}}},~~$(13)
${{({{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}})}_{{{\text{II}}}}} = {\text{ (}}{{a}_{{{\text{ZnO}}}}}{{{\text{)}}}_{{\text{V}}}}{\text{/(}}{{a}_{{{\text{ZnO}}}}}{{{\text{)}}}_{{{\text{II}}}}},$(14)
${{(a_{{{\text{ZnO}}}}^{3}{{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}})}_{{\text{I}}}} = {{({{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}})}_{{\text{I}}}} = {{(a_{{{\text{ZnO}}}}^{3}{{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}})}_{{{\text{II}}}}},$(15)
${{({{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}})}_{{\text{I}}}} = {{{\text{(}}a_{{{\text{ZnO}}}}^{3}{{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}}{\text{)}}}_{{{\text{II}}}}},$(16)
${{(a_{{{\text{ZnO}}}}^{2}a_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{17}})}_{{{\text{IV}}}}} = {{(a_{{{\text{ZnO}}}}^{2})}_{{{\text{IV}}}}} = {{(a_{{{\text{ZnO}}}}^{2}a_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{17}})}_{{{\text{III}}}}},$(17)
${{(a_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{{\text{17}}}})}_{{{\text{III}}}}} = {{{\text{(}}a_{{{\text{ZnO}}}}^{2}{\text{)}}}_{{{\text{IV}}}}}{\text{/(}}a_{{{\text{ZnO}}}}^{2}{{{\text{)}}}_{{{\text{III}}}}},$(18)
${{({{a}_{{{\text{ZnO}}}}}{{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}})}_{{{\text{III}}}}} = {{({{a}_{{{\text{ZnO}}}}}{{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}})}_{{{\text{II}}}}},$(19)
${{({{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}})}_{{{\text{II}}}}} = {{({{a}_{{{\text{ZnO}}}}}{{a}_{{{\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}})}_{{{\text{III}}}}}{\text{/(}}{{a}_{{{\text{ZnO}}}}}{{{\text{)}}}_{{{\text{II}}}}}.$Таблица 4.
Стандартные энтальпии ${{\Delta }_{r}}H_{{298}}^{^\circ }$ гетерофазных реакций (кДж/моль), рассчитанные по 2-му и 3-му законам термодинамики
| Реакция | 2-ой закон | 3-ий закон | Рекомендованное значение |
|---|---|---|---|
| (5) | 483.7 ± 15.5 | 484.7 ± 7.0 | 484.7 ± 7.0 |
| (6) | 941.3 ± 35.7 | 991.5 ± 16.0 | 966.4 ± 25.9 |
| (7) | 509.4 ± 13.0 | 529.1 ± 7.5 | 516.9 ± 10.0 |
| (8) | 481.6 ± 24.6 | 467.2 ± 7.5 | 474.2 ± 16.1 |
| (9) | 1061.5 ± 5.3 | 1077.1 ± 16.0 | 1068.5 ± 8.5 |
Рассчитанные значения активности оксида ниобия в областях [ZnO + Zn3Nb2O8] (I), [Zn3Nb2O8 + ZnNb2O6] (II) и [ZnNb2O6 + + Zn2Nb34O87] (III) и экспериментально найденные активности оксида цинка (табл. 1, 2) позволили определить стандартные энергии Гиббса ниобатов цинка, а знание абсолютных энтропий простых оксидов цинка [37, 38], ниобия [37, 38] и смешанных, оцененных по Келли и Латимеру [39–42] (см. выше), дало возможность определить энтальпии образования ниобатов цинка из простых оксидов (табл. 6). Ошибка в определении значений энтальпий, рассчитанных таким образом, связана с оценкой энтропии смешанных оксидов и принятым нами условием независимости изменения энтропии реакции образования ниобатов цинка из простых оксидов от температуры. Пересчет значений энтальпий образования к температуре 298.15 K выполняли аналогично пересчету значений энтальпий реакций (5)–(9).
Таблица 5.
Стандартные энтальпии образования ниобатов цинка (кДж/моль)
| Соединение | $ - {{\Delta }_{f}}H_{{298}}^{^\circ }$ | $ - {{\Delta }_{f}}H_{{298}}^{^\circ }$ (из оксидов) |
|---|---|---|
| Zn3Nb2O8(к) | 2992.0 ± 30.2 | 50.1 ± 32.1 |
| ZnNb2O6(к) | 2292.4 ± 19.9 | 48.3 ± 21.3 |
| Zn2Nb34O87(к) | 33056.1 ± 15.0 | 89.7 ± 19.4 |
Таблица 6.
Энергии Гиббса и энтальпии образования ниобатов цинка из простых оксидов (кДж/моль)
| Соединение | $ - {{\Delta }_{f}}G_{{1400}}^{^\circ }$ | $ - {{\Delta }_{f}}H_{{298}}^{^\circ }$ (из оксидов) |
$ - {{\Delta }_{f}}H_{{298}}^{^\circ }$
(из оксидов, рекомендо-ванное значение) |
|---|---|---|---|
| Zn3Nb2O8(к) | 48.2 ± 8.1 | 49.6 ± 9.0 | 50.0 ± 20.0 |
| ZnNb2O6(к) | 32.2 ± 10.5 | 32.6 ± 11.5 | 40.5 ± 15.0 |
| Zn2Nb34O87(к) | 84.5 ± 10.5 | 92.1 ± 11.5 | 90.9 ± 15.0 |
Хорошее согласие значений стандартных энтальпий образования ниобатов цинка, найденных тремя независимыми методами (расчет по 2-ому и 3-ему законам термодинамики и по величине энергии Гиббса образования), свидетельствует о корректности выполненных исследований по определению величин парциальных давлений и активностей компонентов.
ЗАКЛЮЧЕНИЕ
Найденные в данном исследовании термодинамические характеристики системы ZnO–Nb2O5 могут быть весьма полезны при синтезе диэлектрической керамики с высокими физическими характеристиками, которая может быть альтернативой более дорогой на основе оксида тантала. Как отмечалось выше, ниобаты цинка характеризуются высокой сенсорной чувствительностью к водороду [2], причем селективность по этому газу сильно зависит от однофазности, например соединения ZnNb2O6, синтез и эксплуатация которого с сохранением исходных характеристик невозможна без знаний основных термодинамических характеристик используемого сенсора.
Список литературы
Cheng Y., Cao L., He G. et al. // J. Alloys Compd. 2014. V. 85. P. 608. https://doi.org/10.1016/j.jallcom.2014.03.031
Devi G.S., Reddy P.S.P., Ramya K. // Mater. Today Proc. 2016. V. 3. P. 224. https://doi.org/10.1016/j.matpr.2016.01.061
Bafrooei H.B., Nassaj E.T., Ebadzadeh T., Hu C.F. // J. Mater. Sci.: Mater. Electron. 2014. P. 1620. https://doi.org/10.1007/s10854-014-1774-9
Srivastava R., Yadav B.C. // Adv. Mater. Lett. 2012. V. 3. P. 197. https://doi.org/10.5185/amlett.2012.4330
Ueda K., Tabata H., Kawai T. // Appl. Phys. Lett. 2001. V. 79. P. 988. https://doi.org/10.1063/1.1384478
Han S.-J., Song J.W., Yang C.-H. et al. // Appl. Phys. Lett. 2002. V. 81. P. 4212. https://doi.org/10.1063/1.1525885
Cho Y.M., Choo W.K., Kim H. et al. // Appl. Phys. Lett. 2002. V. 80. P. 3358. https://doi.org/10.1063/1.1478146
Rack P.D., Potter M.D., Kurinec S. et al. // J. Appl. Phys. 1998. V. 84. P. 4466. https://doi.org/10.1063/1.368672
Румянцева М.Н., Коваленко В.В., Гаськов А.М., Панье. Т. // Рос. хим. журн. (Журн. Рос. хим. об-ва им. Д.И. Менделеев). 2007. Т. 51. № 6. С. 61.
Xia W., Li L., Zhang P., Ning P. // Mater. Lett. 2011. V. 65. P. 3317. https://doi.org/10.1016/j.matlet.2011.07.044
Bîrdeanu M. et al. // Digest J. Nanomater. Biostruct. 2013. V. 8. № 1. P. 263.
Nono M.C.A., Castro P.J., Rangel E.G.L., Mineiro S.L. // Mater. Sci. Forum. 2016. V. 869. P. 79. https://doi.org/10.4028/www.scientific.net/MSF.869.79
Anjana P.S., Jawahar I.N., Sebastian M.T. // J. Mater. Sci. Mater. Electron. 2009. V. 20. P. 587. https://doi.org/10.1007/s10854-008-9770-6
Bîrdeanu A.V., Fagadar-cosma E. // Digest J. Nanomater. Biostruct. 2015. V. 10. P. 543.
Pitale S.S., Noto L.L., Nagpure I.M., Ntwaeaborwa O.M. // Adv. Mater. Res. 2011. V. 306. P. 251. https://doi.org/10.4028/www.scientific.net/AMR.306-307.251
Bîrdeanu M., Bîrdeanu A., Gruia A.S. et al. // J. Alloys Compd. 2013. V. 573. P. 53. https://doi.org/10.1016/j.jallcom.2013.03.274
Chennakesavulu K., Reddy M.M., Reddy G.R. et al. // J. Mol. Struct. 2015. V. 1091. P. 49. https://doi.org/10.1016/j.molstruc.2015.02.052
Ananda S., Gowda N.M.M., Raksha K.R. // Adv. Nanoparticles. 2014. V. 3. № 4. P. 133. https://doi.org/10.4236/anp.2014.34018
Dayal R.R. // J. Less Common. Met. 1972. V. 26. P. 381. https://doi.org/10.1016/0022-5088(72)90087-2
Anthrop D.F., Searcy A.W. // J. Phys. Chem. 1964. V. 68. P. 2335. https://doi.org/10.1021/j100790a052
Казенас Е.К., Чижиков Д.М., Цветков Ю.В. // Изв. АН СССР. Металлы. 1969. № 1. С. 150.
Hirschwald W., Stolze F., Stranski J.N. // Z. Phys. Chem. 1964. Bd. 42. S. 96. https://doi.org/10.1524/zpch.1964.42.1_2.096
Казенас Е.К., Больших М.А., Петров А.А. и др. Масс-спектрометрическое исследование процессов испарения и диссоциации оксидов меди, серебра, цинка, кадмия. М. 1989. Деп. ВИНИТИ 20.05.89. №3588-В89. 25 с.
Хансен М., Андерко К. Структура двойных сплавов. M.: Изд-во по черной и цветной металлургии. 1962. Т. 2. С. 1488.
Gribchenkova N.A., Steblevsky A.V., Alikhanyan A.S. // J. Chem. Thermodynamics. 2017. V. 1151. P. 6. https://doi.org/10.1016/j.jct.2017.07.009
Gribchenkova N.A., Alikhanyan A.S. // J. Alloys Compd. 2019. V. 778. P. 77. https://doi.org/10.1016/j.jallcom.2018.11.136
Brown J.J., Hummel Jr., Penn F.A. State Univ. Rep., Report No. 10, Contract No. Project ZC-41, College of Mineral Industries, Pennsylvania State University; University Park, Pennsylvania, 1964.
Dayal R.R. // J. Less Common Met. 1972. V. 29. P. 1. https://doi.org/10.1016/0022-5088(72)90142-7
Schäfer H., Gruehn R., Schulte F. // Angew. Chem. Int. Ed. Engl. 1966. V. 5. P. 40. https://doi.org/10.1002/anie.19660040
Reznichenko L.A., Akhnazarova V.V., Shilkina L.A. et al. // Crystallogr. Rep. 2009. V. 54. P. 483. https://doi.org/10.1134/S1063774509030183
Marucco J.F. // J. Solid State Chem. 1974. V. 10. P. 211. https://doi.org/10.1016/0022-4596(74)90028-0
Kimura S. // J. Solid State Chem. 1973. V. 6. P. 438. https://doi.org/10.1016/0022-4596(73)90236-3
Marucco J.F. // J. Chem. Phys. 1979. V. 70. P. 649. https://doi.org/10.1063/1.437545
Ohsawa T., Okubo J., Suzuki T. et al. // J. Phys. Chem. 2011. V. 115. P. 16625. https://doi.org/10.1021/jp203021u
Сидоров Л.Н., Коробов М.В., Журавлева Л.В. Масс-спектральные термодинамические исследования. М.: Изд-во Моск. ун-та, 1985. 308 с.
Grade M., Hirschwald W., Stolze F. // Z. Phys. Chem. 1976. Bd. 100. № 3–6. S. 165. https://doi.org/10.1524/zpch.1976.100.3-6.165
Киреев В.А. Методы практических расчетов в термодинамике химических реакций. М.: Химия, 1970. 520 с.
База данных ТКВ. (http://www.chem.msu.ru/cgibin/tkv.pl).
Latimer W.M. // J. Am. Chem. Soc. 1951. V. 73. P. 1480. https://doi.org/10.1021/ja01148a021
Kelley K.K., Mah A.D. // Bur. Mines Rep. Invest. 1959. № 5490. P. 23.
Mah A.D. // Bur. Mines Rep. Invest. 1966. № 6727.
Mah A.D. // Bur. Mines Rep. Invest. 1960. № 5600.
Searcy A. // Adv. Pap. An. Int. Symp. High Temp. Technol. N.Y., 1959. P. 255.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии