Журнал неорганической химии, 2021, T. 66, № 11, стр. 1547-1560
Координационные полиэдры МСn (M = Ga, In, Tl) в структурах кристаллов
М. О. Карасев a, *, И. Н. Карасева b, Д. В. Пушкин a
a Самарский национальный исследовательский университет им. академика С.П. Королева
443086 Самара, Московское шоссе, 34, Россия
b Самарский государственный технический университет
443100 Самара, ул. Молодогвардейская, 244, Россия
* E-mail: maxkarasev@inbox.ru
Поступила в редакцию 22.03.2021
После доработки 20.05.2021
Принята к публикации 21.05.2021
Аннотация
С помощью метода пересекающихся секторов и полиэдров Вороного–Дирихле проведен кристаллохимический анализ соединений галлия, индия и таллия, в структуре которых содержатся координационные полиэдры MCn (M = Ga, In, Tl). Установлено, что атомы металлов в углеродном окружении проявляют координационные числа 1–7, 9, 10, 12 и 18. Рассмотрено влияние координационного числа, степени окисления и химической природы атомов Ga, In, Tl на основные характеристики полиэдров Вороного–Дирихле (ПВД). Установлено существование единой линейной зависимости телесных углов граней ПВД, отвечающих валентным и невалентным контактам М–C (M = Ga, In, Tl), от соответствующих межъядерных расстояний. Дана количественная оценка стереоэффекта неподеленной пары электронов атомов М(I) (M = Ga, In, Tl), проявляющегося, в частности, в смещении ядер атомов М(I) из центров тяжести их ПВД (0.03–0.52 Å) и асимметрии координационной сферы. Проанализированы агостические взаимодействия М···Н–С (M = Ga, In, Tl).
ВВЕДЕНИЕ
Металлоорганические соединения галлия, индия и таллия находят широкое применение в современном органическом синтезе. Так, галлийорганические соединения используются для создания полимерных галлофлуоренов, применяющихся для изготовления различных оптоэлектронных материаллов [1]. Производные индия используются в качестве допирующих агентов в производстве полупроводников, в то время как таллийорганические соединения представляют исключительный интерес для органической химии, поскольку открывают пути к синтезу различных производных бензола, трудно синтезируемых косвенными путями [2], а также позволяют получать кетимины различного строения [3, 4].
К настоящему времени в базах данных [5, 6] присутствуют сведения о строении более 8000 соединений, в состав которых одновременно входят атомы металлов подгруппы галлия и атомы углерода. Несмотря на это кристаллохимический анализ соединений, включающих координационные полиэдры (КП) MCn (M = Ga, In, Tl) не проводился.
Настоящая работа имеет целью установление особенностей стереохимии галлия, индия и таллия в кристаллах, структура которых включает КП MCn (M = Ga, In, Tl), и продолжает цикл работ, посвященных изучению стереохимии элементов главных подгрупп в углеродном окружении [7–9].
МЕТОДИКА КРИСТАЛЛОХИМИЧЕСКОГО АНАЛИЗА И ОБЪЕКТЫ ИССЛЕДОВАНИЯ
Кристаллохимический анализ проводили с использованием компьютерного пакета TOPOS [10], с помощью которого выполняли расчет основных харкетеристик полиэдров Вороного–Дирихле (ПВД) [11]. К структурам предъявляли требования, аналогичные приведенным в работах [7–9]. Объектами кристаллохимического анализа являлись 109, 39 и 15 соединений, в состав которых входили 161, 48 и 20 кристаллографически разных атомов Ga, In и Tl.
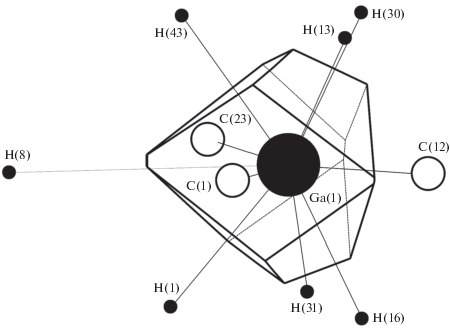
На рис. 1 приведен ПВД атома Ga(1) в структуре Ga(C6Me5)3 {XODLUX} [12] (табл. 1). Запись в фигурных скобках обозначает код, под которым кристаллоструктурные данные для обсуждаемого вещества зарегистрированы в базах данных [5, 6]. В обсуждаемой структуре атом Ga(1) образует три химические связи Ga–C (d(Ga–C) = 1.974–1.986 Å (табл. 1)), а также семь невалентных контактов с атомами водорода (d(Ga···H) = 2.539–3.969 Å). При этом шесть контактов Ga···H являются прямыми и им соответствует диапазон длин d(Ga···H) = = 2.539–2.585 Å, в то время как один невалентный контакт Ga···H, которому отвечает расстояние d(Ga···H) = 3.969 Å, является непрямым. Отметим, что, согласно [13], под непрямыми контактами подразумевают контакты, для которых отрезок Ga···Z не пересекает соответствующую грань ПВД. Таким образом, ПВД атома Ga(1) в структуре Ga(C6Me5)3 {XODLUX} [12] образован 10 гранями (рис. 1).
Таблица 1.
Анализ координации атомов галлия, индия и таллия в некоторых структурах
| Характеристики ПВД атома М* | Величина перекрывания (Å3) двух сфер атомов М и Х с радиусами** | Тип перекрывания M–Х*** | |||||
|---|---|---|---|---|---|---|---|
| атомы окружения Х | r(М–Х), Å | Ω(М–Х), % | rs × rs | rs × RСД | RСД × rs | RСД × RСД | |
| Ga(C6Me5)3 {XODLUX} [15] Центральный атом – Ga(1) с КЧ = 3 |
|||||||
| C(1) | 1.974 | 17.70 | 0.0009 | 0.6311 | 0 | 0.5362 | П3 |
| C(12) | 1.984 | 17.72 | 0.0004 | 0.6231 | 0 | 0.5397 | П3 |
| C(23) | 1.986 | 17.88 | 0.0003 | 0.6313 | 0 | 0.5594 | П3 |
| H(13) | 2.539 | 8.11 | 0 | 0.06 | 0 | 0.1664 | П2 |
| H(16) | 2.565 | 7.75 | 0 | 0.0495 | 0 | 0.1605 | П2 |
| H(31) | 2.575 | 7.84 | 0 | 0.0453 | 0 | 0.1567 | П2 |
| H(30) | 2.578 | 7.46 | 0 | 0.04 | 0 | 0.1395 | П2 |
| H(43) | 2.581 | 7.59 | 0 | 0.0436 | 0 | 0.1568 | П2 |
| H(1) | 2.585 | 7.94 | 0 | 0.047 | 0 | 0.1759 | П2 |
| #H(8) | 3.969 | 0.02 | 0 | 0 | 0 | 0.0011 | П0 |
| InCp* {DURREN} [32] Центральный атом – In(1) с КЧ = 5 + 4 |
|||||||
| C(4) | 2.581 | 7.09 | 0 | 0.5289 | 0 | 0.4457 | П2 |
| C(5) | 2.585 | 7.31 | 0 | 0.5535 | 0 | 0.5005 | П2 |
| C(3) | 2.586 | 7.27 | 0 | 0.5414 | 0 | 0.4785 | П2 |
| C(1) | 2.612 | 6.30 | 0 | 0.4248 | 0 | 0.3179 | П2 |
| C(2) | 2.613 | 6.93 | 0 | 0.5206 | 0 | 0.4957 | П2 |
| H(12) | 3.221 | 10.79 | 0 | 0.0699 | 0 | 0.557 | П2 |
| #H(2) | 3.461 | 2.73 | 0 | 0 | 0 | 0.25 | П0 |
| #H(8) | 3.545 | 3.32 | 0 | 0.0224 | 0 | 1.2158 | П0 |
| #H(12) | 3.551 | 3.53 | 0 | 0 | 0 | 0.5415 | П0 |
| #H(5) | 3.641 | 1.40 | 0 | 0 | 0 | 0.215 | П0 |
| H(12) | 3.662 | 6.00 | 0 | 0 | 0 | 0.2359 | П1 |
| #H(1) | 3.663 | 0.82 | 0 | 0 | 0 | 0.3579 | П0 |
| #H(13) | 3.68 | 1.25 | 0 | 0 | 0 | 0.2781 | П0 |
| #H(10) | 3.733 | 0.73 | 0 | 0 | 0 | 0.0938 | П0 |
| #H(14) | 3.808 | 0.19 | 0 | 0 | 0 | 0.8987 | П0 |
| #H(7) | 3.824 | 0.39 | 0 | 0 | 0 | 0.9692 | П0 |
| H(13) | 3.843 | 2.15 | 0 | 0 | 0 | 0.0843 | П1 |
| H(7) | 3.902 | 3.38 | 0 | 0 | 0 | 0.146 | П1 |
| H(14) | 3.94 | 1.55 | 0 | 0 | 0 | 0.059 | П1 |
| In(1)×2 | 3.943 | 6.23 | 0 | 0 | 0 | 0.367 | П1 |
| In(1)×2 | 3.963 | 6.94 | 0 | 0 | 0 | 0.4872 | П1 |
| #H(8) | 4.47 | 0.52 | 0 | 0 | 0 | 0.2562 | П0 |
| Tl(Cp(SiMe3)2) {GIRBIS} [48] Центральный атом – Tl(1) с КЧ = 10 |
|||||||
| C(22) | 2.938 | 5.49 | 0 | 0.8475 | 0 | 0.1973 | П2 |
| C(1) | 2.971 | 6.43 | 0 | 0.9902 | 0 | 0.3975 | П2 |
| C(17) | 2.972 | 5.46 | 0 | 0.9007 | 0 | 0.297 | П2 |
| C(11) | 2.985 | 5.45 | 0 | 0.9501 | 0 | 0.3743 | П2 |
| C(21) | 2.989 | 5.40 | 0 | 0.9519 | 0 | 0.3829 | П2 |
| C(10) | 3.004 | 4.94 | 0 | 0.7451 | 0 | 0.1831 | П2 |
| C(16) | 3.005 | 4.99 | 0 | 0.8414 | 0 | 0.2821 | П2 |
| C(5) | 3.034 | 5.39 | 0 | 0.8288 | 0 | 0.314 | П2 |
| C(12) | 3.04 | 5.21 | 0 | 0.9268 | 0 | 0.4472 | П2 |
| C(6) | 3.128 | 4.89 | 0 | 0.9557 | 0 | 0.6913 | П2 |
| H(45) | 3.341 | 5.43 | 0 | 0.3348 | 0 | 0.1477 | П2 |
| #H(42) | 3.36 | 1.82 | 0 | 0.6368 | 0 | 0.7252 | П0 |
| #H(20) | 3.369 | 1.96 | 0 | 0.6262 | 0 | 0.7265 | П0 |
| H(33) | 3.419 | 6.16 | 0 | 0.3067 | 0 | 0.2131 | П2 |
| H(5) | 3.443 | 6.65 | 0 | 0.3019 | 0 | 0.2423 | П2 |
| #H(41) | 3.443 | 0.52 | 0 | 0.6352 | 0 | 0.9836 | П0 |
| H(55) | 3.499 | 5.57 | 0 | 0.2536 | 0 | 0.2436 | П2 |
| H(43) | 3.504 | 4.80 | 0 | 0.311 | 0 | 0.3734 | П2 |
| #H(10) | 3.567 | 0.02 | 0 | 0.7095 | 0 | 1.7124 | П0 |
| H(44) | 3.607 | 2.91 | 0 | 0.1416 | 0 | 0.1777 | П2 |
| H(53) | 3.644 | 3.74 | 0 | 0.1183 | 0 | 0.1773 | П2 |
| H(54) | 3.695 | 2.27 | 0 | 0.0526 | 0 | 0.0777 | П2 |
| H(29) | 4.024 | 1.59 | 0 | 0 | 0 | 0.0251 | П1 |
| H(22) | 4.075 | 1.35 | 0 | 0 | 0 | 0.0261 | П1 |
| H(18) | 4.096 | 1.43 | 0 | 0 | 0 | 0.0279 | П1 |
| #H(4) | 4.127 | 0.01 | 0 | 0 | 0 | 0.0822 | П0 |
| #H(38) | 4.364 | 0.03 | 0 | 0 | 0 | 0.0004 | П0 |
| #H(11) | 4.631 | 0.09 | 0 | 0 | 0 | 0.005 | П0 |
* r(M–Х) – расстояния между атомами, Ω(M–Х) – телесный угол, выраженный в процентах от 4π стерадиан, под которым общая грань ПВД атомов M и Х видна из ядра любого из них. Число симметрично равных контактов M–Х указано как (×n). Символом # отмечены атомы Z, для которых отрезок M∙∙∙Z не пересекает соответствующую ему грань ПВД и которые представляют собой неосновные или непрямые соседи [13].
** Во всех случаях первым указан радиус сферы атома M, а вторым – атома Х. Нулевое значение указывает на отсутствие пересечения соответствующих сфер.
*** В соответствии с [10], типы пересечения П0 и П1 следует интерпретировать как невалентные взаимодействия М···Х, в то время как химическим связям М–X соответствуют типы перекрывания П2, П3 и П4.
Координационные числа атомов галлия, индия и таллия устанавливали с помощью метода пересекающихся секторов [14]. В табл. 1 представлены примеры расчета КЧ по методу [14].
ОСОБЕННОСТИ СТРОЕНИЯ КП M(III)Cn
Согласно методу пересекающихся секторов [14], в структурах кристаллов реализуются комплексы, состав которых отвечает общей формуле MCn, где n = 3–6 для атомов Ga(III), 3–5 для атомов In(III) и 2, 3, 5 для атомов Tl(III) (табл. 2).
Таблица 2.
Характеристики ПВД атомов галлия, индия и таллия в окружении атомов углерода*
| Атом М | С.О. | КЧ | Число атомов | Nf | Nnb | VПВД, Å3 | RСД, Å | G3 | DA, Å |
|---|---|---|---|---|---|---|---|---|---|
| Ga | III | 3 | 65 | 22(5) | 6.3 | 12.9(1.2) | 1.454(45) | 0.088(2) | 0.07(4) |
| 4 | 83 | 20(5) | 4 | 11.9(7) | 1.417(28) | 0.088(2) | 0.05(4) | ||
| 5 | 5 | 21(2) | 3.2 | 12.4(8) | 1.435(30) | 0.88(3) | 0.06(4) | ||
| 6 | 1 | 23 | 2.8 | 13.8 | 1.489 | 0.087 | 0.17 | ||
| Все | 148 | 21(5) | – | 12.4(1.1) | 1.434(40) | 0.088(2) | 0.06(4) | ||
| I | 1 | 1 | 18 | 17 | 20.5 | 1.698 | 0.084 | 0.20 | |
| 5 | 1 | 23 | 3.6 | 26.8 | 1.857 | 0.090 | 0.52 | ||
| 12 | 4 | 27(1) | 1.3 | 23.6(5) | 1.780(12) | 0.0815(4) | 0.17(2) | ||
| 18 | 1 | 31 | 0.7 | 20.6 | 1.701 | 0.082 | 0.03 | ||
| Все | 7 | 27(5) | – | 23.2(2.2) | 1.768(55) | 0.083(3) | 0.20(15) | ||
| In | III | 3 | 10 | 22(5) | 6.3 | 15.1(1.3) | 1.531(42) | 0.086(1) | 0.05(3) |
| 4 | 29 | 21(3) | 4.3 | 14.8(5) | 1.524(17) | 0.086(2) | 0.05(4) | ||
| 5 | 1 | 11 | 1.2 | 14.2 | 1.503 | 0.089 | 0.01 | ||
| Все | 40 | 21(4) | – | 14.9(7) | 1.525(25) | 0.086(2) | 0.05(4) | ||
| I | 1 | 1 | 26 | 7.7 | 29.1 | 1.909 | 0.085 | 0.37 | |
| 2 | 1 | 22 | 10 | 21.7 | 1.730 | 0.082 | 0.03 | ||
| 5 | 2 | 27(4) | 4.4 | 26.5(2.9) | 1.848(67) | 0.085(2) | 0.35(8) | ||
| 10 | 4 | 29(3) | 1.9 | 25.5(9) | 1.825(21) | 0.083(1) | 0.26(3) | ||
| Все | 8 | 27(3) | – | 25.7(2.4) | 1.829(57) | 0.084(1) | 0.26(11) | ||
| Tl | III | 2 | 1 | 29 | 13.5 | 20.9 | 1.710 | 0.088 | 0.05 |
| 3 | 2 | 18(5) | 5 | 15.4(3) | 1.545(9) | 0.085(1) | 0.06(1) | ||
| 5 | 1 | 11 | 1.2 | 15.0 | 1.530 | 0.089 | 0.01 | ||
| Все | 4 | 19(8) | – | 16.7(2.8) | 1.582(85) | 0.087(2) | 0.04(2) | ||
| I | 1 | 1 | 25 | 7.3 | 29.0 | 1.906 | 0.084 | 0.32 | |
| 6 | 1 | 21 | 2.5 | 25.6 | 1.828 | 0.082 | 0.22 | ||
| 7 | 1 | 23 | 2.3 | 24.7 | 1.807 | 0.082 | 0.16 | ||
| 9 | 1 | 23 | 1.6 | 21.0 | 1.713 | 0.081 | 0.07 | ||
| 10 | 12 | 30(2) | 2 | 25.3(1.1) | 1.820(27) | 0.082(1) | 0.16(7) | ||
| Все | 16 | 28(4) | – | 25.2(1.8) | 1.818(42) | 0.082(1) | 0.17(8) |
* С.О. – степень окисления; КЧ – координационное число; Nf – среднее число граней ПВД; Nnb – среднее число невалентных контактов, приходящихся на одну химическую связь; VПВД – объем ПВД; RСД – радиус сферы, объем которой равен объему ПВД; G3 – безразмерная величина второго момента инерции ПВД; DA – смещение ядра атома металла из геометрического центра тяжести его ПВД.
КЧ = 2 проявляется исключительно для атомов Tl, содержащихся в структуре [TlC6H3(C6H2Me3)2]TlCl4 · 2CHCl3 {ZELCAW} [15]. Атомы Tl(1) координируют два углеводородных радикала, валентный угол CTlC близок к линейному и равняется 177.4°.
Все три элемента подгруппы галлия образуют трехкоординированные комплексы MC3, на долю которых приходится 42.2 (Ga(III)), 25 (In(III)) и 50% (Tl(III)) от соответствующей выборки. КП комплексов MC3 является треугольник, в центре которого расположен атом металла, способный выходить из плоскости, образованной тремя атомами углерода, на величину δ, лежащую в диапазоне 0.01–0.28 Å. При этом КП в виде плоского треугольника (δ = 0) наблюдается только для двух структур: GaC42H47 {RUPJUH} [16] и GaPh3 {TPHEGA10} [17], в которых атомы Ga расположены на поворотных осях второго порядка (позиционная симметрия С2). Комплекс GaC3 (δ = = 0.054 Å), характеризующийся сайт-симметрией С3, представлен единичным случаем и содержится в структуре GaC27H33 {FAVWAA} [18]. Остальные 73 комплекса MC3 (M = Ga, In, Tl) располагаются в общих позициях в структурах кристаллов.
Тетракоординированное состояние MC4 наблюдается лишь для атомов галлия и индия. На долю комплексов MC4 приходится 53.9 (M = Ga) и 72.5% (M = In) от соответствующей выборки, содержащей трехвалентные металлы. КП металлов в таких комплексах является искаженный тетраэдр. Подавляющее большинство комплексов занимает низкосимметричные позиции в структурах кристаллов – 76 комплексов GaC4 и 26 комплексов InC4 имеют сайт-симметрию С1. Тетракоординированные атомы галлия и индия с позиционной симметрией С2 представлены четырьмя примерами и встречаются в структурах [Sm(Cp*)2][GaEt2(MeC5H3N)] {RIKQEJ} [19], [Ga(bpy)2(CN)2][Ga(CN)4] · pby {MEDBIJ} [20], InMe2(CN) {JUWPOG} [21] и [Sm(Cp*)2][InEt2(MeC5H3N)] {RIKQAF} [19]. Сайт-симметрия Cs встречается у четырех комплексов GaC4 и у одного комплекса InC4 в структурах (GaMe2)2Fe2C20H18 {VIDBUF} [22], GaMe3(t-Bu2Im) {FABYOZ} [23], Ca[GaMe4]2 (Ga(1) и Ga(2)) {BESREZ} [24] и InMe3(t-Bu2Im) {FABYUF} [23]. В изученной выборке встречается единственная структура (PPh4[Ga(CN)4] {MEDBAB} [20]), включающая в свой состав КП GaC4, обладающий позиционной симметрией S4.
Комплексы MC5 известны для всех трех металлов подгруппы галлия, находящихся в степени окисления +3, однако КЧ = 5 является для них крайне нехарактерным. Все пять комплексов GaC5 содержат π-лиганды, связанные с атомами галлия за счет π-электронной плотности ароматической системы. Например, структура GaMe2Cp {DMGACP} [25] содержит атомы галлия, координирующие два метильных радикала и два циклопентадиенид-аниона. Связь с последним осуществляется за счет π-электронной плотности ароматической системы – три из пяти атомов углерода Cp-цикла участвуют в связывании двух атомов галлия, в результате чего структура GaMe2Cp построена на основе бесконечных цепей. КП атомов галия в комплексах GaC5 можно представить в виде сильно искаженных квадратных пирамид. Все пять комплексов GaC5 характеризуются позиционной симметрией С1. Для индия и таллия пентакоординированное состояние представлено единственным примером, представляющим собой изоструктурные (PPh4)2[M(CN)5], где M = In {MEDCEG} [20] и Tl {MEDCAC} [20]. В структурах обсуждаемых соединений атомы индия и таллия образуют КП в виде тригональных бипирамид, характеризующихся неравноценностью длин связей между атомами металла и экваториальными или аксиальными атомами углерода: d(In–Cэкв) = 2.200–2.204 Å, d(In–Cакс) = 2.342 Å, d(Tl–Cэкв) = 2.205–2.212 Å, d(Tl–Cакс) = 2.462 Å. КП MC5 (M = In, Tl) характеризуются сайт-симметрией С2.
Гексакоординированное состояние в рассматриваемой выборке встречается лишь в случае одного комплекса галлия. В структуре тетрахлороалюмината пентаметилциклопентадиенида галлия(III) [Ga(C5Me5)2][AlCl4] {CIZHEZ} [26] атом галлия образует химические связи с двумя ароматическими пентаметилциклопентадиенид-анионами. При этом один из C5Me5-лигандов образует связь за счет сопряженных π-электронов, реализуя η5-тип координации, а другой – за счет σ-связывания. В результате лишь один из пентаметилциклопентадиенид-анионов является ароматическим лигандом. КП галлия в структуре [Ga(C5Me5)2][AlCl4] имеет вид искаженной пентагональной пирамиды. Дополнительным фактором, вызывающим искажение КП, является электростатическое взаимодействие между катионом [Ga(C5Me5)2]+ и анионом [AlCl4]–, в результате которого атом галлия образует слабые невалентные контакты Ga···Cl, характеризующиеся расстояниями 3.00–3.16 Å. Атомы галлия в структуре [Ga(C5Me5)2][AlCl4] обладают позиционной сайт-симметрией С1.
ОСОБЕННОСТИ СТРОЕНИЯ КП M(I)Cn
В соответствии с методом пересекающихся секторов [14], по отношению к атомам углерода атомы одновалентных металлов подгруппы галлия в структурах кристаллов образуют комплексы состава MCn, для которых n = 1, 5, 12 и 18 в случае Ga(I), 1, 2, 5 и 10 для атомов In(I) и 1, 6, 7, 9 и 10 для атомов Tl(I) (табл. 2).
Наибольшее число кристаллических структур, содержащих атомы M(I), наблюдается в случае таллия – 44% от исследованной выборки, содержащей одновалентные металлы.
Все три металла – Ga, In и Tl – способны образовывать соединения, в которых они проявляют КЧ = 1. Такое столь необычное КЧ атомов Ga, In, Tl наблюдается в структурах 3,5-диизопропил-2,6-бис(2,6-диизопропилфенил)фенилгаллия {RUCXIX} [27], 2,6-бис(2,4,6-триизопропилфенил)фенилидах индия {NOBHUH} [28] и таллия {NOSTAQ} [29]. В указанных соединениях атомы М выполняют роль одновалентных заместителей в бензольном ядре. Атомы металлов занимают позиции с симметрией C2 (Ga), С1 (In) и Cs (Tl).
Двухкоординированное состояние для одновалентных производных обсуждаемых металлов наблюдается лишь для индия и представлено всего одной структурой. Атомы In в [In(Im(i-Pr2C6H3)2][Al((CF3)3CO)4] {XIGYOD} [30] координируют две молекулы замещенного по атомам азота имидазола, в результате чего образуется КП состава InC2. Валентный угол CInC равен 120.4°. Позиции, которые занимают атомы индия в [In(Im(i-Pr2C6H3)2][Al((CF3)3CO)4], характеризуются симметрией С1.
Пентакоординированное состояние наблюдается для атомов галлия и индия. В изоструктурных η5-пентаметилциклопентадиенидах MCp* (M = Ga или In), кристаллизующихся в тригональной сингонии, атомы металлов координируют по одному η5-ароматическому лиганду, образуя полусэндвичевые комплексы. Под полусэндвичевыми комплексами понимают металлоорганические соединения, в которых атомы металлов связаны с одним ароматическим лигандом посредством π-электронного облака [2]. Интересной особенностью структур MCp* (M = Ga {RAHBEH} [31] или In {DURREN} [32]) является образование октаэдрических псевдокластеров – шесть молекул MCp* ориентируются атомами металла по отношению друг к другу, образуя сильно искаженный октаэдр. В результате ПВД каждого атома металла в MCp* имеет четыре грани, отвечающие слабым взаимодействиям M···M. Расстояния между атомами металлов в псевдокластере, ПВД которых имеют общие грани, равны 4.073–4.173 Å в случае галлия и 3.943–3.963 Å в случае индия (табл. 1). Заметим, что в базе данных [6] присутствует аналогичное производное таллия TlCp* {FEXDUH} [33], однако вследствие статистической разупорядоченности пентаметилциклопентадиенид-анионов оно не вошло в исследованную выборку.
Для индия, помимо InCp*, известна еще одна структура, в которой он проявляет КЧ = 5. В структуре In(C5Bn5) {VAKMAV} [34] атом металла координирует η5-ароматическую систему полностью замещенного циклопентадиенид-аниона. В структуре In(C5Bn5) наблюдаются специфические взаимодействия между атомами индия (d(In···In) = = 3.632 Å), входящими в состав двух соседних комплексов. Такому взаимодействию, согласно [13], отвечает тип перекрывания П1. Пентакоординированные атомы галлия и индия характеризуются позиционной сайт-симметрией С1.
Координация шести, семи или девяти атомов углерода наблюдается исключительно для атомов Tl(I), причем все они представлены единичными случаями. Структура Tl4[Pt(C≡C–FeCp2)4]2 · ⋅ 2Me2CO · 2CHCl3 {EWUHEK} [35] представляет собой островной шестиядерный комплекс, в котором каждый атом платины координирует четыре ацетиленовых фрагмента посредством σ-связи, а четыре атома Tl взаимодействуют с π-электронной плотностью тройной связи C≡C. При этом структура содержит два кристаллографических сорта атомов Tl, связанных с шестью атомами С ацетиленового фрагмента. Атомы Tl(1) образуют КП TlC6 (рис. 2а), в то время как атомы Tl(2) помимо шести атомов С координируют атом кислорода молекул ацетона, увеличивая тем самым свое КЧ до 7.
Рис. 2.
Фрагменты структур Tl4[Pt(C≡C–FeCp2)4]2 · · 2Me2CO · 2CHCl3 (а) и Tl4[Pt(C≡C–C6H4Me)4]2 · · 4Me2CO (б). Черным большим кружком обозначен атом таллия, черными маленькими кружками – атомы азота, белыми большими кружками – атомы платины, белыми маленькими кружками – атомы углерода, серыми кружками – атомы кислорода. Для упрощения рисунка атомы водорода не показаны.
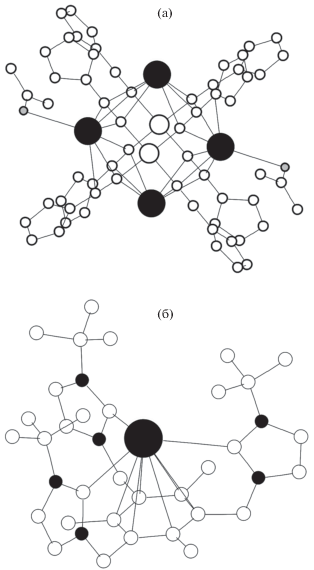
Атомы Tl, входящие в состав КП TlC7, содержатся в структуре Tl4[Pt(C≡C–C6H4Me)4]2 · 4Me2CO {HECGEC} [36], в которой они координируют семь атомов углерода четырех ацетиленовых фрагментов.
Координация девяти атомов углерода атомами таллия наблюдается в структуре [TlC6Me3(CH2Im-t-Bu)3]CF3SO3 · 2ТГФ {LULZUN} [37]. В обсуждаемой структуре атомы Tl образуют связи двух типов за счет одновременного σ- и π-связывания с ароматическим лигандом. Атомы Tl образуют три σ-связи с атомами углерода трех имидазольных систем. Углы СTlC лежат в диапазоне 109.7°–124.0°. Помимо σ-связывания атомы Tl координируют бензольное ядро, проявляющее по отношению к атому металла η6-координацию (рис. 2б). Атомы таллия в структуре [TlC6Me3(CH2Im-t-Bu)3]CF3SO3 · 2ТГФ {LULZUN} [37] характеризуются позиционной симметрией С1.
Координационные полиэдры состава MC10 встречаются только для атомов индия и таллия, причем для Tl(I) КЧ 10 является наиболее характерным. Все 16 комплексов MC10 (4 для In и 12 для Tl) образованы за счет η5-координации ароматических циклопентадиенид-анионов атомом металла. Атомы индия в структуре InCpMe4 {JUDJEX} [38] занимают позиции с сайт-симметрией Cs, в то время как оставшиеся 15 КП MC10 (M = In, Tl) характеризуются позиционной симметрией С1.
В изученной выборке три структуры содержат в своем составе атомы галлия с КЧ = 12. Комплексы GaC12 в структурах [Ga(C6Et6)(PhMe)][GaCl4] · ⋅ 1/2C6Et6 {SARKEB} [39], [Ga(C6H4Cl2][Al2F((CF3)3CO)6] {VUWRAH} [40] и [Ga(PhMe)2] [Al((CF3)3CO)4]{VUWROV} [40] образованы путем координации двух молекул замещенного бензола, проявляющих по отношению к атомам галлия η6-координацию и располагающихся под углом 38.8°–54.6° по отношению друг к другу. Атомы Ga в комплексах GaC12 располагаются в общих позициях в структурах кристаллов.
Координация 18 атомов углерода наблюдается в единственной структуре [GaC24H24][GaBr4] {FIGKOV} [41], в которой атомы Ga(2) координируют три бензольных ядра (2.2.2)парациклофановой системы. Атомы Ga(2) занимают позиции с сайт-симметрией С1.
ХАРАКТЕРИСТИКА ПВД АТОМОВ ГАЛЛИЯ, ИНДИЯ И ТАЛЛИЯ
В структуре 157 исследованных соединений ПВД всех сортов атомов галлия, индия и таллия в сумме образуют 4795 граней. Проведенный анализ показал, что химическим взаимодействиям М–С (М = Ga, In, Tl) отвечает 951 грань. Роль атомов Z, образующих невалентные контакты М··· Z, чаще всего играют H, C и F (2889, 726 и 70 граней соответственно). В табл. 3 приведена краткая характеристика всех валентных и невалентных взаимодействий между атомами M (M = = Ga, In, Tl) и углерода. Наглядно охарактеризовать такие взаимодействия позволяет график зависимости телесных углов (Ω), выраженных в процентах от полного телесного угла 4π стерадиан, под которыми грани ПВД “видны” из ядер атомов обсуждаемых металлов или углерода, от соответствующих межъядерных расстояний М–C и М···C (M = Ga, In, Tl). В качестве примера на рис. 3 представлена зависимость Ω(d) для атомов Ga. В случае In и Tl подобные зависимости имеют практически аналогичный вид. Как видно из рис. 3, невозможно однозначно разделить валентные и невалентные контакты M–C только на основании межатомных расстояний и телесных углов. Длины химических связей М–C лежат в диапазоне 1.93–3.53 Å (для атомов Ga), 2.12–3.17 Å (для атомов In) и 2.13–3.30 Å (для атомов Tl) (табл. 3).
Таблица 3.
Характеристики взаимодействий M–C и M···M (M = Ga, In, Tl) в структурах кристаллов
| Атом М | С.О. | КЧ | Число атомов М | Связи М–C | Невалентные контакты М···C | Невалентные контакты М···М | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| число связей |
d(М–C), Å | диапазон Ω(М–C), % | число контак-тов |
d(М···C), Å | диапазон Ω(М···C), % | число контак-тов |
d(М···М), Å | диапазон Ω(М···М), % | |||||||
| диапазон | среднее | диапазон | среднее | диапазон | среднее | ||||||||||
| Ga | III | 3 | 65 | 195 | 1.93–2.06 | 1.98(2) | 15.2–23.8 | 324 | 2.72–4.68 | 3.14(36) | <6.5 | 34 | 3.04–4.63 | 3.26(32) | <2.8 |
| 4 | 83 | 332 | 1.93–2.78 | 2.07(17) | 6.6–24.3 | 195 | 2.69–4.26 | 3.04(27) | <5.3 | 21 | 2.88–4.41 | 3.26(35) | <3.4 | ||
| 5 | 5 | 25 | 1.96–2.87 | 2.26(35) | 2.5–22.3 | 19 | 2.73–4.24 | 3.24(46) | <4.0 | 5 | 3.04–3.51 | 3.29(23) | <2.5 | ||
| 6 | 1 | 6 | 2.00–2.40 | 2.21(16) | 6.6–18.4 | 5 | 2.77–3.59 | 3.14(42) | <2.7 | – | – | – | – | ||
| Все | 154 | 558 | 1.93–2.87 | 2.05(16) | 2.5–24.3 | 543 | 2.69–4.68 | 3.11(34) | <6.5 | 60 | 2.88–4.63 | 3.26(32) | <3.4 | ||
| I | 1 | 1 | 1 | – | 2.03 | 20.8 | 6 | 3.13–3.75 | 3.45(28) | <4.9 | – | – | – | – | |
| 5 | 1 | 5 | 2.38–2.42 | 2.40(2) | 7.7–7.9 | – | – | – | – | 4 | 4.07–4.17 | 4.12(6) | <5.4 | ||
| 12 | 4 | 48 | 2.86–3.53 | 3.04(17) | 2.4–6.0 | – | – | – | – | – | – | – | – | ||
| 18 | 1 | 18 | 2.91–3.08 | 2.99(5) | 3.8–5.9 | – | – | – | – | – | – | – | – | ||
| Все | 7 | 72 | 2.03–3.53 | 2.97(24) | 2.4–20.8 | 6 | 3.13–3.75 | 3.45(28) | <4.9 | 4 | 4.07–4.17 | 4.12(6) | <5.4 | ||
| In | III | 3 | 10 | 30 | 2.11–2.23 | 2.17(3) | 14.1–20.9 | 31 | 2.95–4.08 | 3.25(29) | <4.9 | 1 | – | 3.67 | <0.3 |
| 4 | 29 | 116 | 2.12–2.85 | 2.26(12) | 8.3–21.3 | 88 | 2.78–4.37 | 3.30(38) | <5.6 | 3 | 3.30–3.58 | 3.39(16) | <0.8 | ||
| 5 | 1 | 5 | 2.20–2.34 | 2.28(8) | 16.9–20.4 | – | – | – | – | – | – | – | – | ||
| Все | 40 | 151 | 2.11–2.85 | 2.24(11) | 8.3–21.3 | 119 | 2.78–4.37 | 3.29(36) | <5.6 | 4 | 3.30–3.67 | 3.46(19) | <0.8 | ||
| I | 1 | 1 | 1 | – | 2.26 | 19.1 | 9 | 3.29–4.51 | 3.89 | <4.6 | – | – | – | – | |
| 2 | 1 | 2 | 2.49–2.51 | 2.50(1) | 16.9–14.3 | 6 | 3.46–4.06 | 3.75(25) | <2.4 | – | – | – | – | ||
| 5 | 2 | 10 | 2.58–2.72 | 2.63(5) | 5.7–7.3 | 12 | 3.48–4.41 | 3.74(24) | <3.9 | 5 | 3.63–3.96 | 3.89(14) | <7.7 | ||
| 10 | 4 | 40 | 2.73–3.17 | 2.94(12) | 3.9–6.6 | 4 | 3.93–4.49 | 4.18(29) | <0.1 | 3 | 3.98–3.99 | 3.99(1) | <5.2 | ||
| Все | 8 | 53 | 2.26–3.17 | 2.85(19) | 3.9–19.1 | 31 | 3.29–4.51 | 3.84(35) | <4.6 | 8 | 3.63–3..99 | 3.93(12) | <7.7 | ||
| Tl | III | 2 | 1 | 2 | 2.12–2.13 | 2.13(1) | 20.0–20.9 | 15 | 2.96–4.45 | 3.66(44) | <6.2 | – | – | – | – |
| 3 | 2 | 6 | 2.17–2.22 | 2.20(2) | 14.9–16.7 | – | – | – | – | – | – | – | – | ||
| 5 | 1 | 5 | 2.20–2.46 | 2.31(14) | 16.0–20.8 | – | – | – | – | – | – | – | – | ||
| Все | 4 | 13 | 2.13–2.46 | 2.23(11) | 14.9–20.9 | 15 | 2.96–4.45 | 3.66(44) | <6.2 | – | – | – | – | ||
| I | 1 | 1 | 1 | 2.34 | – | 18.4 | 8 | 3.35–4.44 | 3.84(42) | <4.3 | – | – | – | – | |
| 6 | 1 | 6 | 2.84–3.19 | 3.00(12) | 5.6–10.6 | 4 | 3.19–3.88 | 3.51(33) | <4.9 | – | – | – | – | ||
| 7 | 1 | 7 | 2.90–3.11 | 3.00(9) | 4.9–9.9 | 4 | 3.19–4.13 | 3.76(40) | <4.7 | – | – | – | – | ||
| 9 | 1 | 9 | 2.89–3.30 | 3.14(15) | 2.5–11.2 | – | – | – | – | – | – | – | – | ||
| 10 | 12 | 120 | 2.71–3.23 | 2.99(10) | 3.5–6.8. | 7 | 3.75–4.39 | 4.03(26) | <1.0 | 1 | 4.60 | – | <0.5 | ||
| Все | 16 | 143 | 2.34–3.30 | 3.00(13) | 2.5–18.4 | 21 | 3.19–4.44 | 3.87(36) | <4.9 | 1 | 4.60 | – | <0.5 | ||
Рис. 3.
Зависимость телесных углов Ω (выраженных в % от 4π стерадиан) граней ПВД атомов Ga от межатомных расстояний Ga–C, соответствующих этим граням.
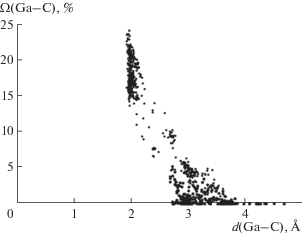
Независимо от КЧ и степени окисления атомов Ga, In и Tl, а также от формы и симметрии их ПВД валентные и невалентные взаимодействия между атомами М (M = Ga, In, Tl) и C описываются едиными линейными зависимостями значений телесных углов граней ПВД от соответствующих межатомных расстояний:
(1)
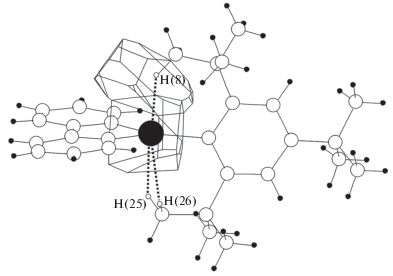
$\Omega ({\text{Ga}}--{\text{C}}) = 42.42\left( {50} \right)--12.890\left( {19} \right)d{\text{(Ga--C)}},$Интересной особенностью координационно-ненасыщенных металлов в структурах кристаллов является возможность существования агостических взаимодействий M···H–C, критерии существования которых представлены в работах [10, 13]. В изученной выборке наблюдается значительное количество “прямых” контактов Ga···H (436 из 2036), In···H (205 из 656) и Tl···H (163 из 326), которые могут отвечать агостическим взаимодействиям М···H–C (М = Ga, In, Tl), обусловленным ненасыщенностью валентных возможностей атомов галия и его аналогов. Среди основных граней типа М···H (М = Ga, In, Tl) встречаются грани, которым соответствуют типы пересечения П2. Следует отметить, что данные грани, в соответствии с [10, 13], следует интерпретировать как агостические взаимодействия М···H–C (М = Ga, In, Tl), соответствующие внутри- и межмолекулярным контактам. В обсуждаемой выборке агостические взаимодействия с атомами водорода присутствуют в 21 структуре, содержащей 32 атома атома галлия, в 7 структурах, в состав которых входят 7 атомов индия, и в 3 структурах, включающих 3 атома таллия. Атомы водорода, участвующие во взаимодействиях М···H–C (М = Ga, In, Tl), входят в состав группировок, содержащих как sp3- (метильные и метиленовые группировки), так и sp2-гибридные атомы углерода (фенильные и винильные фрагменты). Агостические взаимодействия в изученных структурах характеризуются следующими параметрами: d(Ga···H) = 2.00–2.81 Å, Ω(Ga···H) = = 5.2–17.5%; d(In···H) = 2.55–3.03 Å, Ω(In···H) = = 5.4–10.9%; d(Tl···H) = 2.68–3.36 Å, Ω(Tl···H) = = 6.8–8.7%. Из приведенных значений d(М···H) видно, что движение по группе сверху вниз сопровождается закономерным увеличением межатомных растояний, что связано с увеличением радиуса атома М (М = Ga, In, Tl) при переходе от галлия к таллию. Поскольку значения межатомных растояний и телесных углов являются количественной мерой силы взаимодействия двух атомов, ПВД которых имеют общую грань, можно сделать вывод, что наиболее прочная связь типа М···H–C наблюдается в случае М = Ga в структуре C30H37Ga {ZAWGUZ} [43], показанной на рис. 4. В обсуждаемой структуре атомы Ga(1) и атом Н(8) метильной группировки образуют агостическое взаимодействие с характеристиками d(Ga···H) = 2.00 Å, Ω(Ga···H) = 17.5%. Помимо атома Н(8) в агостических взаимодействиях с атомами галлия в структуре C30H37Ga {ZAWGUZ} [43] принимают участие атомы Н(25) и Н(26).
Рис. 4.
Молекула C30H37Ga {ZAWGUZ} [43]. Большой черный кружок – атом галлия, белые большие кружки – атомы углерода, маленькие черные кружки – атомы водорода, маленькие белые кружки – атомы водорода, образующие агостические взаимодействия Ga···H–C (обозначены пунктирными линиями).
Согласно данным табл. 3, в рассмотренных соединениях длина связи M–C в КП MCn (M = Ga, In, Tl) изменяется более чем на 0.7 Å, однако такая вариация межатомного расстояния M–C практически не сказывается на величине объема ПВД атомов М, который в пределах 3σ(VПВД) является постоянной величиной, практически не зависящей от значения КЧ. Напротив, изменение степени окисления атома металла неминуемо сказывается на величине VПВД. Как видно из табл. 2, уменьшение степени окисления атома М сопровождается закономерным увеличением VПВД атомов галлия, индия и таллия. Факт постоянства величин VПВД и RСД в пределах одной и той же степени окисления атомов галлия и его аналогов свидетельствует в пользу модели атома как “мягкой”, обладающей способностью легко деформироваться сферы [44–46], объем которой фиксирован и зависит исключительно от степени окисления атома М и химической природы атомов, непосредственно связанных с ним.
В соответствии с ранее полученными данными о характеристиках ПВД атомов бора и алюминия, находящихся в углеродном окружении [8, 9], VПВД центрального атома в комплексах M(III)Cn (M = = B, Al, Ga, In, Tl) монотонно увеличивается, принимая значения 7.3(7), 11.4(7), 12.4(1.1), 14.8(7) и 16.7(2.8) Å3 для атомов B, Al, Ga, In и Tl соответственно.
Нецентросимметричность окружения атомов элементов подгруппы галлия можно охарактеризовать, используя величину вектора смещения ядра атома из центра тяжести его ПВД (DA) [45]. Из приведенных в табл. 2 данных видно, что величина DA для большинства атомов M(III) равна нулю в пределах 2σ(DA), в то время как для атомов M(I) DA $ \gg $ 0, что вызвано наличием неподеленной электронной пары (Е-пара). В то же время среди трехвалентных производных лишь комплекс Ga(III)C6 имеет довольно высокое значение DA = = 0.17 Å. Гексакоординированное состояние Ga(III) представлено структурой [Ga(C5Me5)2][AlCl4] {CIZHEZ} [26], строение которого подробно обсуждалось выше. Столь высокое значение DA (0.17 Å) обусловлено строением комплекса, а именно сильным искажением ПВД атома галлия, вызванным различным способом координации двух анионов одной химической природы – пентаметилциклопентадиенид-анионов, и наличием двух дополнительных невалентных контактов Ga···Cl. Как отмечалось выше, наличие Е-пары в случае одновалентных соединений элементов подгруппы галлия приводит к асимметрии в распределении электронной плотности в области ядер атомов галлия и его аналогов, что легко можно определить по ненулевым значениям величины DA.
В изученной выборке присутствуют комплексы одновалентных металлов, ПВД которых характеризуются очень низкими значениями DA. Аномально низкое значение DA для атомов M(I) реализуется в комплексах GaC18, InC2 и TlC9 (0.03, 0.03 и 0.07 Å соответственно (табл. 2)). Авторами [30] с помощью квантово-механических расчетов продемонстрировано, что комплексы MC2 (M = Ga(I) и In(I)), образованные путем координации атомами металлов лигандов карбеновой природы, реализуются за счет перекрывания sp2-гибридной орбитали атомов углерода и негибридной p-орбитали атомов галлия или индия. Е-пара атома Ga(I) или In(I), согласно [30], располагается на s-орбитали, участвующей в перекрывании с π-орбиталями имидазольного фрагмента. Данное предположение подтверждается в рамках проведенного нами кристаллохимического анализа. Расположение Е-пары на s-орбитали и ее участие в делокализации по ароматической системе объясняют столь аномально низкое значение вектора DA = 0.03 Å для ПВД атома In(I) в структуре [In(Im(i-Pr2C6H3)2][Al((CF3)3CO)4] {XIGYOD} [30], хотя величина DA для других комплексов In(I)Cn (n = 1, 5 и 10) лежит в диапазоне 0.21–0.40 Å. Отметим, что аналогичный комплекс Ga(I)C2 в изученную выборку не попал, поскольку содержит статистически разупорядоченные трифторметильные группы.
На наш взгляд, низкие значения величины DA в случае GaC18 и TlC9 могут быть связаны с аналогичными комплексам MC2 (M = Ga, In) особенностями электронного строения. Отсутствие стереохимической активности Е-пары у GaC18 и TlC9, по всей видимости, вызвано ее расположением на сферически симметричной s-орбитали атома металла.
Помимо вектора DA искажение ПВД описывается величиной второго момента инерции (G3) – безразмерного параметра, характеризующего степень сферичности полиэдра [47] (табл. 2). Для комплексов GaCn величина G3 изменяется в диапазоне 0.081–0.098, комплексы InCn характеризуются параметром G3 в интервале 0.082–0.092, а для комплексов TlCn значения G3 укладываются в диапазон 0.081–0.089. Согласно [47], на основании величины G3 связи M–C (M = Ga, In, Tl) следует рассматривать преимущественно как ковалентные (G3 > 0.082).
Дополнительный анализ показал, что средняя длина углерод–углеродной связи фрагмента M–C–C не зависит от химической природы атома М и закономерно изменяется в зависимости от гибридизации атома С. Так, в ряду М–C–C, М–C=C и М–C≡C средние величины d(C–C) принимают значения 1.51(6), 1.39(3) и 1.21(1) Å соответственно. Указанные значения d(C–C) в пределах погрешности совпадают с длинами связей C–C в структурах соединений, содержащих КП AlCn [9]. Данный факт, на наш взгляд, можно объяснить исходя из предположения о несущественном перекрывании π-орбиталей этиленового и ацетиленового фрагментов с вакантными орбиталями металлов 13-й группы, поэтому взаимодействия между ионами Tl(I) и кратными C≡C-связями в структурах типа Tl4[Pt(C≡C–FeCp2)4]2 · ⋅ 2Me2CO · 2CHCl3 {EWUHEK} [35] и Tl4[Pt(C≡C–C6H4Me)4]2 · 4Me2CO {HECGEC} [36] следует рассматривать преимущественно как ионные. На это обстоятельство также указывает низкое значение G3 = 0.0816 ПВД атомов Tl в указанных выше комплексах.
С учетом данных о характеристиках ПВД атомов бора и алюминия, входящих в состав комплексов BCn и AlCn [8, 9], максимальное значение параметра G3 для обсуждаемых элементов 13-й группы имеют комплексы BCn, для которых G3 = = 0.094(3). ПВД атомов алюминия и его аналогов, образующих КП M(III)Cn, характеризуются одинаковой в пределах погрешности величиной параметра G3, значения которого равны 0.087(2), 0.088(2), 0.086(2) и 0.087(2) для Al, Ga, In и Tl соответственно.
Наглядно охарактеризовать особенность окружения атомов подгруппы галлия в исследованных структурах позволяет (d, φ)-распределение [45]. В качестве примера на рис. 5 представлен график (d, φ)-распределения для ПВД атомов Ga(III) и In(I). Отметим, что аналогичный вид имеют графики (d, φ)-распределения для ПВД атомов In(III), Tl(III), Ga(I) и Tl(I).
Рис. 5.
Распределение (d, φ) для ПВД атомов Ga, входящих в состав 148 комплексов Ga(III)Cn (а), и атомов In, входящих в состав 8 комплексов In(I)Cn (б).
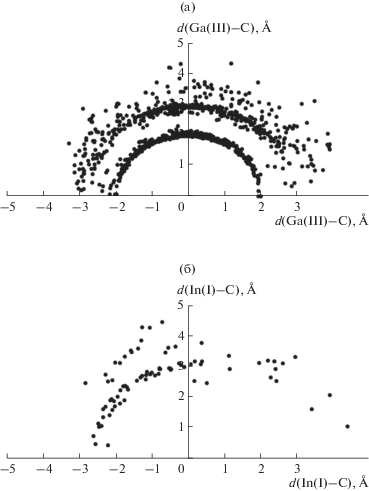
Атомы элементов подгруппы галлия в степени окисления +3 на (d, φ)-распределении имеют две контактные кривые, отвечающие двум координационным сферам атомов металлов. В качестве примера рассмотрим (d, φ)-распределение для контактов Ga–C в комплексах Ga(III)Cn, изображенное на рис. 5а. Первая координационная сфера атомов Ga(III) включает в себя валентные взаимодействия Ga–C, которым соответствует контактная кривая с радиусом ~2.01(5) Å. Вторая координационная сфера представляет собой невалентные взаимодействия Ga/C, которым отвечает контактная кривая с радиусом ~3.09(34) Å.
Несколько иной вид имеет (d, φ)-распределение для комплексов одновалентных металлов подгруппы галлия. В данном случае отчетливо удается различить контактные кривые, отвечающие сильным взаимодействиям М–C (M = Ga, In, Tl). При этом диффузный слой второй координационной сферы практически отсутствует. Следует отметить, что в случае одновалентных Ga, In, Tl первая координационная сфера искажена наличием стереоактивной неподеленной электронной пары, что отчетливо видно на (d, φ)-распределении для ПВД атомов In(I) (рис. 5б). В данном случае контактные кривые для атомов одновалентных металлов подгруппы галлия в первом приближении можно рассматривать как образующие эллипса, а первые координационные сферы одновалентных атомов галлия и его аналогов – как эллипсоиды вращения, длинная ось которых совпадает с направлением вектора DA. Такая асимметрия контактной кривой для атомов M(I) (M = Ga, In, Tl) обусловлена анизотропией валентно-силового поля в области ядер атомов M(I) (M = Ga, In, Tl), вызванной стереохимической активностью Е-пары.
Список литературы
Matsumoto T., Tanaka K., Chujo Y. // Macromolecules. 2015. V. 48. № 5. P. 1343. https://doi.org/10.1021/ma502592c
Эльшенбройх К. Металлоорганическая химия. М.: БИНОМ. Лаборатория знаний, 2011. 746 с.
Fernandez E.J., Laguna A., Lopez-de-Luzuriaga J.M. et al. // Organometallics. 2006. V. 25. № 7. P. 1689. https://doi.org/10.1021/om051030j
Fernandez E.J., Garau A., Laguna A. // Organometallics. 2010. V. 29. № 713. P. 2951. https://doi.org/10.1021/om100188f
Inorganic crystal structure database. Gmelin-institut fur Anorganische Chemie & FIC Karlsruhe. 2019.
Cambridge Structural Database System. Version 5.32 (Crystallographic Data Centre, Cambridge, 2019).
Karasev M.O., Karaseva I.N., Pushkin D.V. // Russ. J. Inorg. Chem. 2018. V. 63. № 3. P. 324. [Карасев М.О., Карасева И.Н., Пушкин Д.В. // Журн. неорган. химии. 2018. Т. 63. № 3. С. 307.]https://doi.org/10.1134/S0036023618030105
Karasev M.O., Karaseva I.N., Pushkin D.V. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. P. 1032. [Карасев М.О., Карасева И.Н., Пушкин Д.В. // Журн. неорган. химии. 2018. Т. 63. № 8. С. 996.]https://doi.org/10.1134/S0036023618080107
Karasev M.O., Karaseva I.N., Pushkin D.V. // Russ. J. Inorg. Chem. 2019. V. 64. № 7. P. 870. [Карасев М.О., Карасева И.Н., Пушкин Д.В. // Журн. неорган. химии. 2019. Т. 64. № 7. С. 714.]https://doi.org/10.1134/S003602361907009X
Blatov V.A., Shevchenko A.P., Serezhkin V.N. // Russ. J. Coord. Chem. 1999. V. 25. № 7. P. 453. [Блатов В.А., Шевченко А.П., Сережкин В.Н. // Коорд. химия. 1999. Т. 25. № 7. С. 483.]
Вайнштейн Б.К., Фридкин В.М., Инденмоб В.Л. Современная кристаллография в четырех томах. Т. 1. М.: Наука, 1979. С. 161.
Vohs J.K., Downs L.E., Barfield M.E. et al. // Polyhedron. 2002. V. 21. № 5–6. P. 531. https://doi.org/10.1016/S0277-5387(01)01034-8
Serezhkin V.N., Mikhailov Yu.N., Byslaev Yu.A. // Russ. J. Inorg. Chem. 1997. V. 42. № 12. P. 1871. [Сережкин В.Н., Михайлов Ю.Н., Буслаев Ю.А. // Журн. неорган. химии. 1997. Т. 42. № 12. С. 2036.]
Blatova O.A., Blatov V.A., Serezhkin V.N. // Russ. J. Coord.Chem. 2000. V. 26. № 12. P. 847. [Блатова О.А., Блатов В.А., Сережкин В.Н. // Коорд. химия. 2000. Т. 26. № 12. С. 903.]
Ahmad S.U., Beckmann J. // Organometallics. 2009. V. 28. № 24. P. 6893. https://doi.org/10.1021/om9007967
Crittendon R.C., Li X.W., Su J., Robinson G.H. // Organometallics. 1997. V. 16. № 11. P. 2443. https://doi.org/10.1021/om970110n
Malone J.F., McDonald W.S. // J. Chem. Soc. A. 1970. V. 1970. P. 3362. https://doi.org/10.1039/J19700003362
Beachley O.T., Churchill M.R., Pazik J.C., Ziller J.W. // Organometallics. 1986. V. 5. № 9. P. 1814. https://doi.org/10.1021/om00140a010
Zeckert K. // Organometallics. 2013. V. 32. № 5. P. 1387. https://doi.org/10.1021/om301032x
Haiges R., Deokar P., Vasiliu M. et al. // Chem. Eur. J. 2017. V. 23. № 38. P. 9054. https://doi.org/10.1002/chem.201700611
Blank J., Hausen H.D., Weidlein J. // J. Organomet. Chem. 1993. V. 444. № 1–2. P. C4. https://doi.org/10.1016/0022-328X(93)83082-7
Lee B., Pennington W.T., Laske J.A., Robinson G.H. // Organometallics. 1990. V. 9. № 11. P. 2864. https://doi.org/10.1021/om00161a007
Schnee G., Faza O.N., Specklin D. et al. // Chem. Eur. J. 2015. V. 21. № 49. P. 17959. https://doi.org/10.1002/chem.201503000
Wolf B.M., Stuhl C., Maichle-Mossmer C., Anwander R. // J. Am. Chem. Soc. 2018. V. 140. № 6. P. 2373. https://doi.org/10.1021/jacs.7b12984
Mertz K., Zettler F., Hausen H.D., Weidlein J. // J. Organomet. Chem. 1976. V. 122. № 2. P. 159. https://doi.org/10.1016/S0022-328X(00)80608-7
Macdonald C.L.B., Gorden J.D., Voigt A. et al. // Dalton Trans. 2008. V. 37. № 9. P. 1161. https://doi.org/10.1039/B716220K
Zhu Z., Fischer R.C., Ellis B.D. et al. // Chem. Eur. J. 2009. V. 15. № 21. P. 5263. https://doi.org/10.1002/chem.200900201
Haubrich S.T., Power P. // J. Am. Chem. Soc. 1998. V. 120. № 9. P. 2202. https://doi.org/10.1021/ja973479c
Niemeyer M., Power P.P. // Angew. Chem. 1998. V. 37. № 9. P. 1277. https://doi.org/10.1002/(SICI)1521-3773(19980518)37: 9<1277::AID-ANIE1277>3.0.CO;2-1
Higelin A., Keller S., Gohringer C. et al. // Angew. Chem. 2013. V. 52. № 18. P. 4941. https://doi.org/10.1002/anie.201209757
Loos D., Baum E., Ecker A. et al. // Angew. Chem. Int. Ed. 1997. V. 36. № 8. P. 860. https://doi.org/10.1002/anie.199708601
Beachley O.T., Churchill M.R., Fettinger J.C. et al. // J. Am. Chem. Soc. 1986. V. 108. № 15. P. 4666. https://doi.org/10.1021/ja00275a077
Werner H., Otto H., Kraus H.J. // J. Organomet. Chem. 1986. V. 315. № 3. P. C57. https://doi.org/10.1016/0022-328X(86)80461-2
Schumann H., Janiac C., Gorlitz F. et al. // J. Organomet. Chem. 1989. V. 363. № 3. P. 243. https://doi.org/10.1016/0022-328X(89)87112-8
Diez A., Fernandez J., Lalinde E. et al. // Inorg. Chem. 2010. V. 49. № 24. P. 11606. https://doi.org/10.1021/ic102000s
Berenguer J.R., Fornies J., Gil B., Lalinde E. // Chem. Eur. J. 2006. V. 12. № 3. P. 785. https://doi.org/10.1002/chem.200500471
Nakai H., Tang Y., Gantzel P., Meyer K. // Chem. Commun. 2003. V. 39. № 1. P. 24. https://doi.org/10.1039/B209071F
Schumann H., Kucht H., Kucht A. et al. // Z. Naturforsch., B: Chem. Sci. 1992. V. 47. № 9. P. 1241.
Schmidbaur H., Nowak R., Huber B., Muller G. // Z. Naturforsch., B: Chem. Sci. 1988. V. 43. № 11. P. 1447.
Slattery J.M., Higelin A., Bayer T., Krossing I. // Angew. Chem., Int. Ed. 2010. V. 49. № 18. P. 3228. https://doi.org/10.1002/anie.201000156
Schmidbaur H., Hager R., Huber B., Muller G. // Angew. Chem., Int. Ed. 1987. V. 26. № 4. P. 338. https://doi.org/10.1002/anie.198703381
Корольков Д.В., Скоробогатов Г.А. Теоретическая химия. СПб.: Изд-во СПбГУ, 2004. 503 с.
Decken A., Gabbai F.P., Cowley A.H. // Inorg. Chem. 1995. V. 34. № 15. P. 3853. https://doi.org/10.1021/ic00119a002
Сережкин В.Н., Блатов В.А., Шевченко А.П. // Коорд. химия. 1995. Т. 21. № 3. С. 163.
Serezhkin V.N., Byslaev Yu.A. // Russ. J. Inorg. Chem. 1997. V. 42. № 7. P. 1064. [Сережкин В.Н., Буслаев Ю.А. // Журн. неорган. химии. 1997. Т.42. № 7. С. 1180.]
Сережкин В.Н., Сережкина Л.Б. // Коорд. химия. 1999. Т. 25. № 3. С. 182.
Блатов В.А., Полькин В.А., Сережкин В.Н. // Кристаллография. 1994. Т. 39. № 3. С. 457.
Harvey S., Raston C.L., Skelton B.W. et al. // J. Organomet. Chem. 1987. V. 328. № 1–2. P. C1. https://doi.org/10.1016/S0022-328X(00)99784-5
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии