Журнал неорганической химии, 2021, T. 66, № 11, стр. 1538-1546
Превращения полимеров 4,4'-дипиридила и цимантренатов кобальта(II) и марганца(II) в присутствии N-доноров различной дентатности
М. А. Уварова a, С. Е. Нефедов a, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: snef@igic.ras.ru
Поступила в редакцию 19.04.2021
После доработки 05.07.2021
Принята к публикации 06.07.2021
Аннотация
Установлено, что реакции суспензии 1D-координационных полимеров (КП) {(µ-dipy)2Mn2[µ-(OOCC5H4)Mn(CO)3]2[η2-(OOCC5H4)Mn(CO)3]2 · 2MeOH}n и {(µ-dipy)Co[(OOCC5H4)Mn(CO)3]2 [O(H)Me]2}n (где dipy = 4,4'-dipy) с монодентатными пиразолом (Hpz) и 3,5-диметилпиразолом (Hdmpz) при кипячении в CH2Cl2 приводят соответственно к образованию 1D-КП {µ-dipy)Mn[(OOCC5H4)Mn(CO)3]2(Hpz)2}n (1) и {(µ-dipy)Co[η2-(OOCC5H4)Mn(CO)3][(OOCC5H4)Mn(CO)3](Hdmpz) · Hdmpz}n (2). В исходном полимере марганца(II) происходит разрушение биядерного фрагмента с координацией в 1 двух молекул Hpz с атомом металла, а в случае кобальта(II) две молекулы спирта замещаются на молекулу Hdmpz и один из анионов становится η2-координированным. В результате реакции исходного КП кобальта(II) с 1,10-фенантролином (Phen), содержащим молекулу воды, образуется биядерный комплекс Co2[(OOCC5H4)Mn(CO)3]4(Phen)2(µ-dipy)(OH2)2 (3). Синтезированные соединения 1–3 изучены методами химического анализа, ИК-спектроскопии и РСА.
ВВЕДЕНИЕ
Для изучения фиксации и превращений различных молекул, их разделения, сорбции, анализа газов, катализа и других процессов используются стабильные координационные полимеры (КП), построенные на функционализированных би-, полиядерных карбоксилатах 3d-металлов, причем их размерность может увеличиваться за счет добавления бидентатного N-донорного 4,4'-дипиридила (dipy) [1–5].
В отличие от них простейшие полимеры металлов, образованные координационными донорно-акцепторными связями с двумя противолежащими атомами азота в дипиридиле, существуют, скорее всего, только в монокристаллическом состоянии. Однако неожиданной особенностью поведения КП 3d-металлов на основе металлоорганической цимантренкарбоновой кислоты и dipy является их умеренная растворимость в хлорорганических растворителях и хорошая растворимость в полярных координирующих растворителях (ТГФ, MeCN, спирты) [6, 7]. Эта особенность позволяет изучать простейшие процессы координации донорных молекул и деградации полимеров и по возможности переносить полученные представления на процессы, происходящие в стабильных классических КП.
Ранее обнаружено, что реакции аддуктов цимантренатов кобальта(II) и марганца(II) M[(OOCC5H4)Mn(CO)3]2[O(H)Me]4 c дипиридилом в MeOH приводят к образованию 1D-КП {(µ-dipy)Co[µ-(OOCC5H4)Mn(CO)3]2[O(H)Me]2}n c геометрией “линия” и {(µ-dipy)2Mn2[µ-(OOCC5H4)Mn(CO)3]2[η2-(OOCC5H4)Mn(CO)3]2 · 2MeOH}n с геометрией “обычная лестница” [6, 7]. В итоге в полимере кобальта присутствуют две лабильные молекулы спирта, способные после удаления в ходе реакции давать две вакантные орбитали, а КП марганца содержит димер, в котором периферийные η2-анионы могут открывать координационные места.
Необходимо отметить, что процессы фиксации и каталитических превращений простейших молекул, таких как N2, CO2 и др., в КП вызывают в последнее время повышенный интерес [8–13].
В настоящей работе сообщается о реакциях полимеров цимантренатов кобальта(II) и марганца(II) c монодентатными пиразолами – пятичленными гетероциклами, имеющими в своем составе двухэлектронодонорный пиридиновый атом азота, и бидентатным 1,10-фенантролином (Phen) в хлористом метилене. В статье обсуждается строение конечных продуктов реакций на основании данных рентгеноструктурного анализа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные полимеры {(µ‑dipy)Co[(OOCC5H4)Mn(CO)3]2[O(H)Me]2}n и {(µ-dipy)2Mn2[µ-(OOCC5H4)Mn(CO)3]2[η2-(OOCC5H4)Mn(CO)3]2 ⋅ 2MeOH}n получали согласно методикам, приведенным в [6, 7].
ИК-спектры соединений регистрировали на ИК-спектрофотометре с Фурье-преобразованием Perkin–Elmer Spectrum 65 методом нарушенного полного внутреннего отражения в интервале частот 400–4000 см–1.
Рентгеноструктурные исследования кристаллов 1–3 проводили по стандартной методике на автоматическом дифрактометре Bruker SMART Apex II, оборудованном CCD-детектором (λMo, графитовый монохроматор, ω-сканирование).
Уточнение структур выполнено с использованием программы комплекса программ SHELXTL PLUS (PC-версия) [14–17].
Кристаллографические данные и детали уточнения приведены в табл. 1, основные геометрические параметры изученных комплексов – в табл. 2–4. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (CCDC 2075904-2075906).
Таблица 1.
Кристаллографические параметры и детали уточнения структур комплексов 1–3
| Параметр | 1 | 2 | 3 |
|---|---|---|---|
| CCDC | 2 072 350 | 2 072 351 | 2 072 352 |
| Брутто-формула | C34H24Mn3N6O10 | C38H32CoMn2N6O10 | C70H44Co2Mn4N6O22 |
| М. м. | 841.41 | 901.55 | 1658.73 |
| Цвет | Розовый | Красно-фиолетовый | Оранжевый |
| T, K | 150(2) | 150(2) | 150(2) |
| Сингония | Триклинная | Триклинная | Триклинная |
| Пр. гр. | Р1 | Р1 | Р1 |
| a, Å | 8.0964(13) | 11.291(11) | 7.5298(9) |
| b, Å | 10.4250(16) | 11.367(11) | 14.6893(18) |
| c, Å | 11.4565(18) | 15.904(13) | 16.628(2) |
| α, град | 85.330(2) | 105.19(2) | 74.580(2) |
| β, град | 71.698(2) | 106.56(2) | 82.276(2) |
| γ, град | 69.800(2) | 93.49(2) | 79.389(2) |
| V, Å3 | 861.2(2) | 1868(3) | 1735.5(4) |
| Z | 1 | 2 | 1 |
| dрасч, мг/м3 | 1.622 | 1.603 | 1.587 |
| µ, мм–1 | 1.151 | 1.172 | 1.254 |
| F(000) | 425 | 918 | 836 |
| Размеры кристалла, мм | 0.26 × 0.24 × 0.22 | 0.18 × 0.16 × 0.14 | 0.24 × 0.22 × 0.20 |
| θ-область сканирования, град | 2.76–30.00 | 1.99–25.00 | 2.55–28.00 |
| Интервалы индексов отражений | –11 ≤ h ≤ 11, –14 ≤ k ≤ 14, –15 ≤ l ≤ 16 |
–11 ≤ h ≤ 13, –13 ≤ k ≤ 13, –18 ≤ l ≤ 18 |
–9 ≤ h ≤ 9, –19 ≤ k ≤ 19, –21 ≤ l ≤ 21 |
| Число отражений | 10106 | 12515 | 17685 |
| Число независимых отражений | 4941 [R(int) = 0.0257] | 6510 [R(int) = 0.1959] | 8286 [R(int) = 0.0234] |
| GOOF | 1.055 | 0.842 | 1.293 |
| R[I > 2σ(I)] | R1 = 0.0454, wR2 = 0.1248 | R1 = 0.1027, wR2 = 0.1738 | R1 = 0.0733, wR2 = 0.2041 |
| R (по всем рефлексам) | R1 = 0.0518, wR2 = 0.1316 | R1 = 0.3236, wR2 = 0.261 | R1 = 0.0831, wR2 = 0.2141 |
| max/min пики электронной плотности, e Å–3 | 0.608 и –1.233 | 0.783 и –0.897 | 2.551 и –1.751 |
Таблица 2.
Основные длины связей и валентные углы в комплексе 1
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Mn(1)–O(1)#1 | 2.1845(15) | Mn(1)–O(1) | 2.1845(15) |
| Mn(1)–N(1)#1 | 2.2416(16) | Mn(1)–N(1) | 2.2416(16) |
| Mn(1)–N(3)#1 | 2.3295(16) | Mn(1)–N(3) | 2.3295(16) |
| Угол | ω, град | Угол | ω, град |
| O(1)#1Mn(1)O(1) | 180.0 | O(1)#1Mn(1)N(1)#1 | 94.57(6) |
| O(1)Mn(1)N(1)#1 | 85.43(6) | O(1)#1Mn(1)N(1) | 85.43(6) |
| O(1)Mn(1)N(1) | 94.57(6) | N(1)#1Mn(1)N(1) | 179.999(1) |
| O(1)#1Mn(1)N(3)#1 | 90.99(6) | O(1)Mn(1)N(3)#1 | 89.01(6) |
| N(1)#1Mn(1)N(3)#1 | 87.71(6) | N(1)Mn(1)N(3)#1 | 92.29(6) |
| O(1)#1Mn(1)N(3) | 89.01(6) | O(1)Mn(1)N(3) | 90.99(6) |
| N(1)#1Mn(1)N(3) | 92.29(6) | N(1)Mn(1)N(3) | 87.71(6) |
Таблица 3.
Основные длины связей и валентные углы в комплексе 2
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Co(1)–O(1) | 2.002(10) | Co(1)–N(1) | 2.040(13) |
| Co(1)–N(3) | 2.138(13) | Co(1)–O(7) | 2.150(10) |
| Co(1)–N(4)#1 | 2.167(14) | Co(1)–O(6) | 2.175(11) |
| Угол | ω, град | Угол | ω, град |
| O(1)Co(1)N(1) | 105.9(5) | O(1)Co(1)N(3) | 85.2(4) |
| N(1)Co(1)N(3) | 94.2(5) | O(1)Co(1)O(7) | 92.7(4) |
| N(1)Co(1)O(7) | 160.4(4) | N(3)Co(1)O(7) | 93.4(4) |
| O(1)Co(1)N(4)#1 | 93.7(4) | N(1)Co(1)N(4)#1 | 87.3(5) |
| N(3)Co(1)N(4)#1 | 178.3(5) | O(7)Co(1)N(4)#1 | 85.3(4) |
| O(1)Co(1)O(6) | 152.7(4) | N(1)Co(1)O(6) | 101.1(5) |
| N(3)Co(1)O(6) | 88.9(4) | O(7)Co(1)O(6) | 61.0(4) |
Таблица 4.
Основные длины связей и валентные углы в комплексе 3
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Co(1)–O(1) | 2.065(3) | Co(1)–O(3) | 2.101(3) |
| Co(1)–N(2) | 2.146(4) | Co(1)–O(11) | 2.151(4) |
| Co(1)–N(3) | 2.154(4) | Co(1)–N(1) | 2.162(4) |
| Угол | ω, град | Угол | ω, град |
| O(1)Co(1)O(3) | 95.91(14) | O(1)Co(1)N(2) | 172.34(15) |
| O(3)Co(1)N(2) | 91.69(15) | O(1)Co(1)O(11) | 90.74(15) |
| O(3)Co(1)O(11) | 92.35(15) | N(2)Co(1)O(11) | 87.99(16) |
| O(1)Co(1)N(3) | 95.34(15) | O(3)Co(1)N(3) | 168.69(15) |
| N(2)Co(1)N(3) | 77.08(16) | O(11)Co(1)N(3) | 88.69(15) |
| O(1)Co(1)N(1) | 87.51(14) | O(3)Co(1)N(1) | 88.09(14) |
| N(2)Co(1)N(1) | 93.71(15) | O(11)Co(1)N(1) | 178.23(16) |
Рентгеноструктурные исследования полимеров выполнены с использованием оборудования ЦКП ФМИ ИОНХ РАН, функционирующего при поддержке государственного задания ИОНХ РАН в области фундаментальных научных исследований.
Синтез комплексов
Синтез {(µ‑dipy)Mn[(OOCC5H4)Mn(CO)3]2(Hpz)2}n (1). К суспензии 0.1 г (0.07 ммоль) поли-мера {(µ‑dipy)2Mn2[µ-(OOCC5H4)Mn(CO)3]2[η2-(OOCC5H4)Mn(CO)3]2 · 2MeOH}n в 10 мл дихлорметана добавляли 0.02 г (0.28 ммоль) пиразола и кипятили в течение 1 ч с обратным холодильником в токе аргона. К полученному прозрачному бесцветному раствору добавляли 2 мл гексана и выдерживали в холодильнике при 5°С в течение 2 сут. Образовавшиеся кристаллы отделяли от маточного раствора декантацией и сушили в токе аргона. Выход 75% (0.09 г).
ИК-спектр (ν, см–1): 3303 сл., 3145 сл., 2613 сл., 2012 с., 1950 с., 1910 с., 1565 с., 1525 ср., 1474 с., 1385 с., 1353 с., 1258 сл., 1276 сл., 1197 сл., 1146 сл., 1123 ср., 1057 с, 1045 с., 929 с., 909 ср., 849 с., 837 ср., 803 ср, 772 с., 664 с, 627 с., 605 с., 542 с.,490 ср., 461 ср.
Синтез {(µ-dipy)Co[η2-(OOCC5H4)Mn(CO)3] [(OOCC5H4)Mn(CO)3](Hdmpz) · Hdmpz}n (2). К суспензии 0.1 г (0.13 ммоль) полимера {(µ-dipy)Co[(µ-(OOCC5H4)Mn(CO)3]2[O(H)Me]2}n в 10 мл дихлорметана добавляли 0.025 г (0.26 ммоль) 3,5-диметилпиразола и кипятили в течение 1 ч с обратным холодильником в токе аргона. К полученному раствору добавляли 2 мл гексана. Образовавшиеся через сутки в холодильнике (5°С) красно-фиолетовые кристаллы отделяли от маточного раствора декантацией и сушили в токе аргона. Выход 80% (0.93 г).
ИК-спектр (ν, см–1): 3223 сл., 3148 сл., 2870 сл., 2021 с., 1933 с., 1920 с., 1848 сл., 1606 сл., 1555 ср., 1486 ср., 1472 ср., 1414 ср., 1391 с., 1360 ср., 1301 ср., 1217 сл., 1195 сл., 1059 сл., 1077 сл., 1039 ср., 1023 ср., 1000 сл., 921 сл., 874 сл., 839 ср., 799 с., 781 с., 815 с., 736 сл., 666 с., 628 с., 558 сл., 541 ср., 522 сл., 455 ср., 422 сл.
Синтез Co2[(OOCC5H4)Mn(CO)3]4(Phen)2(µ-dipy)(OH2)2 (3). К раствору 0.1 г (0.13 ммоль) монокристаллов полимера {(µ-dipy)Co[(µ-(OOCC5H4)Mn(CO)3]2[O(H)Me]2}n в 15 мл метанола добавляли 0.025 г (0.13 ммоль) 1,10-Phen · H2O и перемешивали в течение 1 ч в атмосфере аргона. Полученный оранжевый раствор концентрировали до ~7 мл и выдерживали в течение суток в холодильнике при 5°С. Образовавшиеся кристаллы отделяли от раствора декантацией, промывали гексаном и сушили в токе аргона. Выход 68% (0.073 г).
ИК-спектр (ν, см–1): 3062 сл., 2013 с., 1909 с., 1607 ср., 1590 с., 1537 сл., 1518 сл., 1466 ср., 1426 ср., 1413 ср., 1379 с., 1344 с., 1220 ср., 1190 ср., 1144 ср., 1105 сл., 1091 сл., 1069 сл., 1047 сл., 1028 сл., 952 сл., 846 с., 803 ср., 761 с., 726 с., 664 с., 626 с., 537 с., 488 сл., 423 сл.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Обнаружено, что в результате перемешивания суспензии {(µ-dipy)2Mn2[µ-(OOCC5H4)Mn(CO)3]2 [η2-(OOCC5H4)Mn(CO)3]2 · 2MeOH}n или {(µ-dipy)Co[µ-(OOCC5H4)Mn(CO)3]2[O(H)Me]2)n в хлористом метилене при кипячении с пиразолом (Hpz) или 3,5-диметилпиразолом (Hdmpz) (соотношение реагентов 1 : 2) образуются гомогенные растворы, из которых после добавления гексана и выдерживания в холодильнике кристаллизуются бесцветный {(µ-dipy)Mn[(OOCC5H4)Mn(CO)3]2(Hpz)2}n (1, выход 75%) и красно-фиолетовый {(µ-dipy)Co[η2-(OOCC5H4)Mn(CO)3][(OOCC5H4)Mn(CO)3] (Hdmpz) · Hdmpz}n (2, выход 80%) соответственно.
Отметим, что исходные КП ограниченно растворимы в CH2Cl2, однако он выбран как некоординирующий растворитель, в отличие от полярных координирующих, в которых полимеры растворяются хорошо, но могут составить пиразолам конкуренцию за вакантные орбитали.
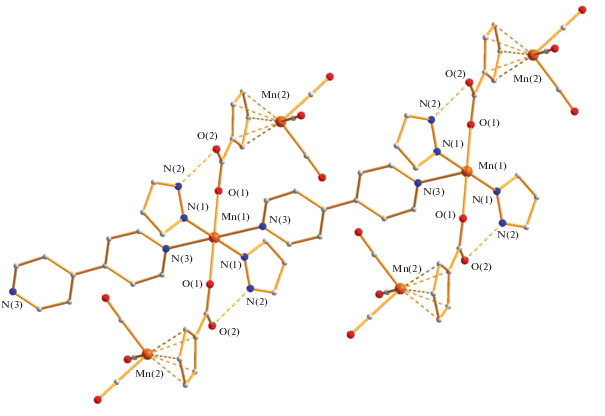
Комплекс 1 формируется в результате деградации биядерного металлофрагмента исходного КП Mn2[µ-(OOCC5H4)Mn(CO)3]2[η2-(OOCC5H4)Mn(CO)3]2 и, по данным РСА (табл. 1, 2, рис. 1), представляет собой 1D-КП, в котором каждый атом марганца(II) находится в центре симметрии и имеет искаженное октаэдрическое окружение из четырех атомов азота, два из которых принадлежат координированным молекулам Hpz (Mn(1)–N(1) 2.2416(16) Å), два – молекулам дипиридила, сшивающим атомы металлов в полимер (Mn(1)–N(3) 2.3295(16) Å), а два оставшихся положения занимают атомы кислорода противолежащих анионов (Mn(1)–O(1) 2.1845(15) Å). Необходимо отметить, что в полимере атомы металлов находятся на одной линии с расстояниями металл–металл 11.711 Å, а молекула мостикового дипиридила оказывается плоской (угол между шестичленными гетероциклами 0о), в отличие от свободной молекулы, в которой угол между этими плоскостями составляет 26.1° [12] из-за стерического отталкивания атомов водорода. В КП 1 присутствует внутримолекулярная водородная связь N–H фрагмента пиразола и второго атома кислорода аниона длиной 2.648 Å (рис. 1).
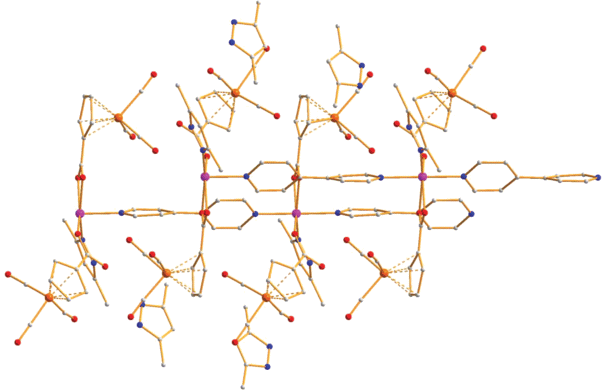
В кристаллической ячейке КП 1 располагаются параллельными слоями с расстояниями до ближайших атомов металла 10.425 Å (рис. 2).
Рис. 2.
Фрагмент упаковки КП 1 в кристалле. Цвета атомов: марганец – оранжевый, кислород – красный, азот – синий, углерод – серый.
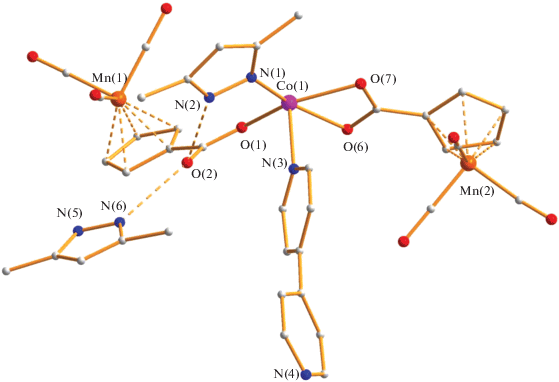
В отличие от синтеза 1, сопровождающегося деградацией биядерного комплекса, при синтезе 1D-КП 2 в исходном полимере атом кобальта(II) имеет две лабильные координированные молекулы метанола, которые могут вытесняться в раствор в ходе реакции с образованием двух вакантных орбиталей. По данным РСА, в соединении 2 (табл. 1, 3) в центросимметричной молекуле атом металла связан с атомами азота координированной молекулы Hdmpz (Co–N 2.040(13) Å) и дипиридила (Co(1)–N(3) 2.138(13) Å, Co(1)–N(4) 2.167(14) Å). Искаженное октаэдрическое окружение атома Co(II) дополнено двумя атомами кислорода η2-связанного аниона (Co(1)–O(7) 2.150(10) Å, Co(1)–O(6) 2.175(11) Å) и атомом кислорода концевого аниона (Co(1)–O(1) 2.002(10) Å) (рис. 3). Если в 1 две молекулы пиразола координированы атомом Mn(II), то в 2 лишь один пиразол связан с атомом Co(II), а второй оказывается сольватным, что, вероятно, определяется стерическими факторами, хотя Hdmpz является более сильным основанием по сравнению с Hpz из-за присутствия в молекуле двух донорных метильных заместителей в 3,5 положениях гетероцикла.
Рис. 4.
Фрагмент упаковки КП 2. Цвета атомов: кобальт – фиолетовый, кислород – красный, азот – синий, углерод – серый.
Атомы водорода N–H-фрагментов как координированной, так и сольватной молекулы Hdmpz связаны с атомом О(2) концевого аниона (N(2)…O(2) 2.757 Å, N(6)…O(2) 2.764 Å).
В отличие от комплекса 1, в 2 угол между гетероциклами молекулы dipy составляет 43.8°, а расстояние между атомами металла равно 11.291 Å.
Геометрия 1D-КП 2 – прямая линия, и в кристаллической ячейке такие линии параллельны, а расстояния между близлежащими атомами металлов двух полимеров составляют 7.523, 7.752 и 8.355 Å.
И, наконец, реакция исходного полимера кобальта(II) с бидентатным 1,10-фенантролином, содержащим молекулу воды (соотношение реагентов 1 : 1) приводит к его деградации с образованием биядерного комплекса Co2[(OOCC5H4)Mn(CO)3]4(Phen)2(µ-dipy)(OH2)2 (3) с выходом 68%.
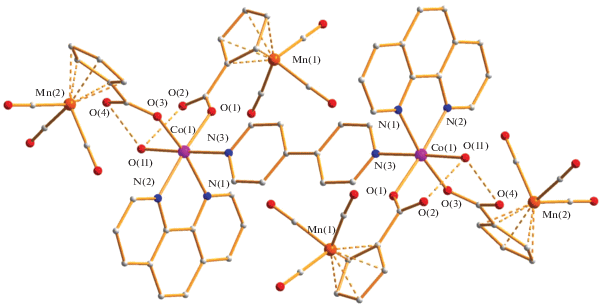
В центросимметричном димере 3, согласно РСА (табл. 1, 4), два атома Co(II) соединены молекулой дипиридила (Co–N 2.154(4) Å), которая, как и в КП 1, является плоской, а расстояние между атомами металла составляет 11.439 Å. Каждый атом кобальта связан c двумя атомами азота молекулы dipy (Co(1)–N(2) 2.146(4) Å, Co(1)–N(1) 2.162(4) Å), двумя атомами кислорода концевых цимантренат-анионов (Co(1)–O(1) 2.065(3) Å, Co(1)–O(3) 2.101(3) Å) и атомом кислорода координированной молекулы воды (Co(1)–O(11) 2.151(4) Å). В итоге атомы металла имеют искаженное октаэдрическое окружение. Молекула воды образует водородные связи с концевыми атомами кислорода анионов (2.643, 2.679 Å) (рис. 5).
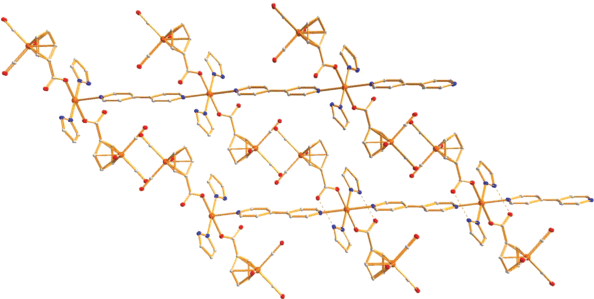
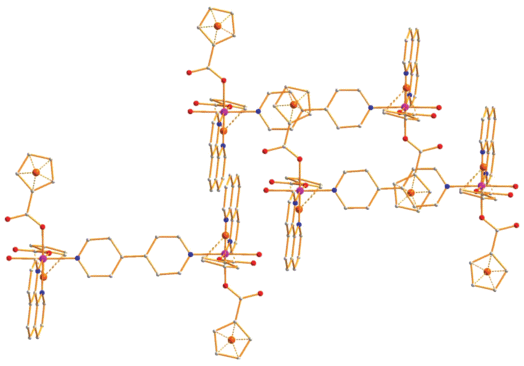
В кристаллической ячейке присутствуют стекинг-взаимодействия молекул координированных фенантролинов длиной 3.398–3.824 Å, а также π–π-контакты мостиковых молекул дипиридила с циклопентадиенильными лигандами анионов соседних молекул димеров (3.342 Å) (рис. 6).
Рис. 6.
Фрагмент упаковки димеров 3 в кристалле. Цвета атомов: кобальт – фиолетовый, кислород – красный, азот – синий, углерод – серый.
Отметим, что если не учитывать в качестве двухэлектронного N-донора дополнительные молекулы dipy, приводящие к образованию 2D-КП [18–25], то полимеры марганца(II) и кобальта(II) с такими молекулами неизвестны [26].
Что же касается четырехэлектронодонорных молекул фенантролина или 2,2'-дипиридила (bpy), то для КП 3d-металлов с dipy были получены комплексы состава [QLnM(µ-dipy)(An2)]n (M = Zn: Q = bpy, L = 4H2O, An = 4-SO3-PhCOO; Q = bpy, L = = H2O, An = µ-4-SO3-PhCOO [27]; Q = Phen, L = 2H2O, An = 2NO3 [28]; M = Cu: Q = bpy, An = η-OClO3; Q = Phen, An = η-OClO3, ClO4 [29]; Q = Phen, An = η-OSO2CF3 [30]; Q = bpy, An = η-ONO2 [31]; Q = bpy, L = 2H2O, An = NO3 [32]; Q = bpy, An = η-OClO3, H2O(solv.); Q = bpy, An = η-FBF3, H2O(solv.) [33]; M = Co: Q = Phen, An = η-PhPO3 [32]). Заметим, что во всех приведенных примерах синтез комплексов осуществлялся в результате реакций Phen/bpyMAn2 с dipy, в отличие от получения 1–3, когда исходными соединениями являлись полимеры.
Список литературы
Cook T.R., Zheng Y.-R., Stang P.J. // Chem. Rev. 2013. V. 113. № 1. P. 734. https://doi.org/10.1021/cr3002824
Leininger S., Olenyuk B., Stang P.J. // Chem. Rev. 2000. V. 100. № 3. P. 53. https://doi.org/10.1021/cr9601324
Eddaoudi M., Moler D.B., Li H.-L. et al. // Acc. Chem. Res. 2001. V. 34. № 4. P. 319. https://doi.org/10.1021/ar000034b
Li J.-R., Ma Y., McCarthy M.C. et al. // Coord. Chem. Rev. 2011. V. 55. № 15-16. P. 1791. https://doi.org/10.1016/j.ccr.2011.02.012
Kuppler R.J., Timmons D.J., Fang Q.-R., et al. // Coord. Chem. Rev. 2009. V. 253. № 23-24. P. 3042. https://doi.org/10.1016/j.ccr.2009.05.019
Uvarova M.A., Grineva A.A., Datchuk R.R., Nefedov S.E. // Russ. J. Inorg. Chem. 2018. V. 63. № 5. P. 618. https://doi.org/10.1134/S0036023618050108
Uvarova M.A., Grineva A.A., Datchuk R.R., Nefedov S.E. // Russ. J. Inorg. Chem. 2020. V. 65. № 1. P. 36. https://doi.org/10.1134/S0036023620010192
Wang Q., Astruc D. // Chem. Rev. 2020. V. 2. № 120. P. 1438. https://doi.org/10.1021/acs.chemrev.9b00223
Cong M.Y., Chen X.Y., Xia K. et al. // J. Mat. Chem. A. 2020. V. 9. № 8. P. 4673. https://doi.org/10.1039/d0ta08741f
Das Prasenjit., Mandal Sanjay K. // Acs Appl. Materials Interfaces. 2020. V. 12. № 33. P. 37137. https://doi.org/10.1021/acsami.0c09024
Zhang L., An PF., Shi YN. et al. // Sci. Adv. 2020. V. 6. № 17. P. 4824. https://doi.org/10.1126/sciadv.aaz4824
Lehnert N., Tuczek F. // Inorg. Chem. 1999. V. 38. № 8. P. 1671. https://doi.org/10.1021/ic9809409
He H., Sun Q., Gao W., et al. // Angew. Chem. 2018. V. 57. № 17. P. 4657.
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
SAINT. Area-Detector Integration Sofware. Madison (WI, USA). Bruker AXS Inc., 2012.
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. № 1. P. 3. https://doi.org/10.1107/S2053229614024218
Hu T., Zhao X., Hu X. et al. // RSC Adv. 2011. V. 1. № 9. P. 1682. https://doi.org/10.1039/c1ra00695a
Pothiraja R., Sathiyendiran M., Butcher R.J., Murugavel R. // Inorg. Chem. 2004. V. 43. № 24. P. 7585. https://doi.org/10.1021/ic048781i
Pothiraja R., Sathiyendiran M., Butcher R.J., Murugavel R. // Inorg. Chem. 2005. V. 44. № 18. P. 6314. https://doi.org/10.1021/ic050742z
Zhang S.-Y., Wojtas L., Zaworotko M.J. // J. Am. Chem. Soc. 2015. V. 137. № 37. P. 12045. https://doi.org/10.1021/jacs.5b06760
Yoshida J., Nishikiori S., Kuroda R. // Chem. Lett. 2007. V. 36. № 5. P. 678. https://doi.org/10.1246/cl.2007.678
Woodward J.D., Backov R., Abboud K.A. et al. // Polyhedron. 2003. V. 22. № 20. P. 2821. https://doi.org/10.1016/S0277-5387(03)00409-1
Li X., Chi X.-L., Xu Y.-C. et al. // Inorg. Chim. Acta. 2016. V. 445. P. 160. https://doi.org/10.1016/j.ica.2016.02.042
Wang Sh.-Q., Yang Q.-Y., Mukherjee S. et al. // Chem. Commun. 2018. V. 54. № 51. P. 7042. https://doi.org/10.1039/C8CC03838D
CSD. Version 5.42 (November 2020)
Zhang J., Zhu L.-G. // J. Mol. Struct. 2009. V. 931. № 1–3. P. 87. https://doi.org/10.1016/j.molstruc.2009.05.032
Xu Sh., Dai Y.-Ch., Qiu Q.-M. et al. // Acta Crystallogr., Sect. E: Struct. Rep. 2012. V. 68. № 9. P. m1222. https://doi.org/10.1107/S1600536812036318
Chawla S.K., Hundal M.S., Kaur J., Obrai S. // Polyhedron. 2001. V. 20. № 17. P. 2105. https://doi.org/10.1016/S0277-5387(01)00703-3
Seidel R.W., Goddard R., Hoch C., Oppel I.M. // Z. Anorg. Allg. Chem. 2011. V. 637. № 11. P. 1545. https://doi.org/P.1545. https://doi.org/10.1002/zaac.201100181
Park H.W., Sung S.M., Min K.S. et al. // Eur. J. Inorg. Chem. 2001. V. 11. P. 2857. https://doi.org/10.1002/1099-0682(200111)2001:11< 2857:AID-EJIC2857>3.0.CO;2-3
Wang M., Ma Ch.-B., Chen Ch.-N., Liu Q.-T. // J. Mol. Struct. 2008. V. 891. № 1–3. P. 292. https://doi.org/10.1016/j.molstruc.2008.03.055
Melnic E., Coropceanu E.B., Forni A. et al. // Cryst. Growth Des. 2016. V. 16. № 11. P. 6275. https://doi.org/10.1021/acs.cgd.6b00807
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии