Журнал неорганической химии, 2021, T. 66, № 10, стр. 1497-1504
Биоактивная керамика на основе ZrO2, легированная Ta2O5: получение и свойства
Д. Н. Грищенко a, *, А. В. Голуб a, В. Г. Курявый a, Д. Х. Шлык a, М. А. Медков a
a Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159д, Россия
* E-mail: grishchenko@ich.dvo.ru
Поступила в редакцию 25.02.2021
После доработки 06.04.2021
Принята к публикации 20.04.2021
Аннотация
Показана возможность улучшить свойства циркониевой керамики за счет комбинации с кальций-фосфатными соединениями для придания биоинертному материалу биоактивных свойств. Изучено влияние Ta2O5 на некоторые свойства керамики. Установлено, что легирование оксидом тантала повышает рентгеноконтрастность кальций-фосфатной циркониевой керамики, но снижает механические и биоактивные свойства. Керамика может быть предложена в качестве материала для замещения дефектов костной ткани. Доказано, что она обладает достаточной прочностью, рентгеноконтрастностью, развитым микрорельефом и наличием биоактивной фазы. Полученные материалы удовлетворяют необходимым для заместительной терапии характеристикам. Метод позволяет получать материал с заданными параметрами для изготовления индивидуальных имплантов.
ВВЕДЕНИЕ
Разработка и исследование новых материалов, используемых в медицине для восстановления утраченной костной ткани, – одно из важных направлений в материаловедении. Керамические материалы, созданные для тканевой инженерии, представляют большой интерес благодаря биоинертности, высоким прочностным характеристикам и коррозионной стойкости [1, 2].
Керамика из диоксида циркония обладает всеми перечисленными характеристиками. Материал способен заменить металлические конструкции: известно его применение в медицине для замещения коленных и бедренных суставов. В ряде случаев в качестве имплантов предпочтительнее использовать именно керамические материалы, поскольку модуль упругости керамических волокон существенно выше, чем у металлов. Для изменения свойств циркониевой керамики используют различные функциональные добавки [3, 4].
Оценка мутагенных и канцерогенных свойств показала возможность использования циркониевых материалов для костной инженерии [5]. Создание композиционной циркониевой керамики, содержащей в качестве резорбируемой фазы кальций-фосфатные соединения, позволит решить проблему биоактивности материала. Известно, что кальций-фосфатные соединения способны инициировать регенерацию собственной костной ткани и постепенно замещаться ею [6–8]. Тесты на цитотоксичность материалов на основе диоксида циркония с различными функциональными добавками (гидроксиапатита, оксида алюминия, силиката натрия) выявили отсутствие токсического воздействия на организм [9–12].
Для усиления рентгеноконтрастности керамических материалов, используемых в медицине, в них добавляют элементы с большой атомной массой. Предпочтение отдают оксидам металлов: вольфрама, тантала, висмута, стронция и др. [13–16]. В ряде работ показано, что допирование некоторых материалов рентгеноконтрастными веществами снижает их биоактивность и механические свойства [17, 18]. Кроме того, некоторые из предлагаемых оксидов обладают высокой цитотоксичносью по отношению к тканям организма [19, 20]. Усилия исследователей направлены на поиск новых композиционных рентгеноконтрастных керамических материалов, поскольку появляется возможность контролировать процесс восстановления кости рентгенологическими методами. Данные рентгенологических исследований в совокупности с другими методами способствуют постановке точного клинического диагноза. Оксид тантала как один из компонентов в составе медицинских материалов используют в качестве рентгеноконтрастного вещества, а также для придания материалам элекретных свойств, влияющих на процессы репаративного остеосинтеза [21].
Цель настоящей работы – получение биоактивной циркониевой керамики, легированной оксидом тантала, и изучение свойств полученных композиционных керамических материалов. Исследования направлены на расширение списка материалов, используемых для замещения поврежденной костной ткани пациента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходная шихта включала следующие компоненты: оксид циркония (ч. д. а.), оксид магния (х. ч.), измельченное стекло (х.с.-2 № 29), оксид тантала (х. ч.), смесь аммония фосфорнокислого двузамещенного (ч.) с карбонатом кальция (х. ч.). Соотношение компонентов в смеси, образующей кальций-фосфатные соединения (КФС), было выбрано таким образом, чтобы отношение Ca/P составляло 1.667. MgO использовали для частичной стабилизации ZrO2. Стекло позволяет формироваться материалу по типу жидкофазного спекания, преимущество которого – снижение температуры. Включенные в состав материала компоненты позволяют улучшить свойства циркониевой керамики: стекло и MgO – механические, КФС – биоактивные, Ta2O5 – рентгеноконтрастные. Состав полученной для изучения керамики представлен в табл. 1.
Таблица 1.
Состав образцов
| Состав | Состав, мас. % | Прочность при сжатии, МПа | ||||
|---|---|---|---|---|---|---|
| КФС | стекло | ZrO2 | MgO | Ta2O5 | ||
| 1 | 10 | 18 | 63.9 | 3.6 | 4.5 | 259 ± 16 |
| 2 | 15 | 17 | 60.95 | 2.55 | 4.5 | 268 ± 25 |
| 3 | 20 | 16 | 57.2 | 2.3 | 4.5 | 283 ± 20 |
| 4 | 10 | 8.5 | 72.25 | 4.25 | 5 | 188 ± 15 |
| 5 | 20 | 17 | 60.5 | 2.5 | 0 | 420 ± 21 |
Составы истирали на вибрационной микромельнице Fritsch Pulverisette-0. Ситовой анализ, проведенный ручным сухим способом (ситом № 005), показал, что 90% измельченных частиц имеют размер не более 50 мкм. Образцы прессовали при 50 МПа с помощью пресс-формы из закаленной стали RC 62 на универсальной испытательной машине Shimadzu Autograp AG-X plus методом одноосного холодного прессования со скоростью 0.5 мм/с и выдержкой 120 с. Формованный образец прокаливали в муфельной печи до 1300°С, скорость нагрева составляла 8 град/мин. Размер полученных образцов: диаметр 1.26 см, толщина 0.4 см.
Открытую пористость определяли экспериментально-расчетным методом. За основу был взят ГОСТ 2409-2014 “Огнеупоры. Метод определения кажущейся плотности, открытой и общей пористости, водопоглощения”. Использовали следующие приборы: OHAUS Corporation Adventurer™ для взвешивания, в том числе гидростатического, и Stage Vacuum Pomp VP 125 для вакуумирования образцов. Насыщающей жидкостью выступала дистиллированная вода. Расчет проводили по формуле: Па = (m3 – m1)/(m3 – m2) × 100 (%), где m1 – масса высушенного образца, г; m2 – масса насыщенного образца, погруженного в жидкость, г; m3 – масса насыщенного образца на воздухе, г.
Дифрактограммы образцов снимали на дифрактометре D8 Advance в CuKα-излучении с графитовым монохроматором. Для получения информации о составе материалов использовали метод рентгенофазового анализа, программу поиска EVA, банк порошковых данных PDF-2. Для исследования качественного и количественного элементарного составов, а также морфологии образцов применяли метод растровой электронной микроскопии (РЭМ). Использовали электронный сканирующий микроскоп Hitachi S5500 с приставкой Thermo Scientific. Подложка – проводящий углеродный скотч. Параметры кристаллической решетки были рассчитаны с помощью программы JANA 2006.
Предел прочности образцов при сжатии определяли на универсальной испытательной машине Shimadzu Autograp AG-X plus. Выполнено по три измерения для каждого состава. Компьютерный томограф General Electric Discovery NM/CT 670 CZT использовали для исследования рентгеноконтрастности образцов.
Влияние легирования на биоактивные свойства материалов исследовали in vitro с помощью модельной биологической среды, известной как SBF-раствор. Процедура приготовления раствора и состав предложены в работе [22]. Величина pH используемого модельного раствора составляла 7.4. Образцы выдерживали в приготовленной среде в течение 20 сут при температуре 37°С. Для поддержания постоянной температуры использовали термостат Binder BD 115. Раствор обновляли каждые 48 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для придания биоинертной циркониевой керамике биоактивных свойств чаще всего используют покрытия из фосфатов кальция. В работе [23] предложен способ получения на керамике из ZrO2 биоактивного покрытия путем нанесения смеси гидроксиапатита и боросиликатного стекла с последующим обжигом.
Биоактивную циркониевую керамику можно получить, минуя дополнительную стадию покрытия образца. При этом биоактивная фаза формируется в процессе керамического обжига и равномерно распределяется по всему объему образца. В зависимости от соотношения компонентов смеси, образующей резорбируемую фазу, можно получать фосфаты кальция различного состава. Наличие в такой керамике одновременно нескольких кальций-фосфатных соединений позволяет регулировать скорость резорбции биоактивной фазы.
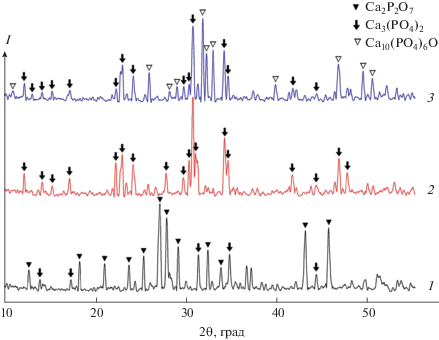
Рентгенофазовый анализ показал, что при выгорании смеси аммония фосфорнокислого двузамещенного с карбонатом кальция образуются кальций-фосфатные соединения следующего состава (рис. 1): Ca2P2O7 и Сa3(PO4)2 при отношении Ca/P = 1, Сa3(PO4)2 при Ca/P = 1.33, Сa3(PO4)2 и Ca10(PO4)6O при Ca/P = 1.667. Оксиапатит Ca10(PO4)6O в среде организма гидролизуется, образуется гидроксиапатит Ca10(PO4)6(OН)2, который является основной минеральной составляющей кости [24] и активно участвует в восстановлении костной ткани пациента. Поэтому отношение Ca/P = 1.667, при котором образуется оксиапатит, выбрано нами для дальнейших исследований.
Рис. 1.
Дифрактограммы смеси аммония фосфорнокислого двузамещенного с карбонатом кальция после обжига при 1300°С: Ca/P = 1 (1), Ca/P = 1.33 (2), Ca/P = 1.667 (3).
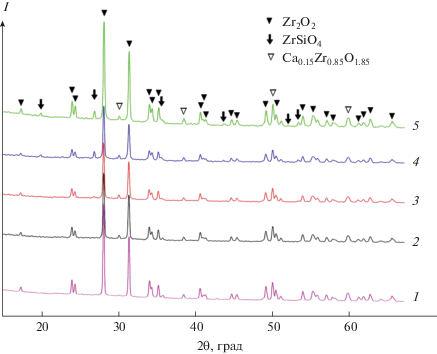
На дифрактограммах образцов керамики после их обжига при 1300°С в зависимости от содержания стекла появляются две или три фазы (рис. 2). При содержании стекла в образце 8.5% на дифрактограмме имеются две фазы: моноклинная бадделита ZrO2 (уточненные параметры элементарной ячейки: a = 5.3164(4), b = 5.1982(4), c = 5.1443(4) Å, β = 99.170° (Р21/а)) и кубическая Ca0.15Zr0.85O1.85. При увеличении содержания стекла появляется третья, тетрагональная, фаза циркона ZrSiO4. Последние две фазы являются продуктами взаимодействия исходной моноклинной модификации оксида циркония со стеклом. На дифрактограммах отсутствуют рефлексы оксида тантала, что может быть следствием перехода Ta2O5 в твердый раствор замещения с оксидом циркония. В частности, ранее в [25] сообщалось о появлении в системе Ta2O5–ZrO2 моноклинной фазы с параметрами решетки a = 5.160(1), b = = 5.208(1), c = 5.3259(3) Å, β = 98.792° (Р21/с), близкими к параметрам бадделита.
Рис. 2.
Дифрактограммы полученных образцов: состав 5 (1), состав 4 (2), состав 1 (3), состав 3 (4), состав 2 (5).
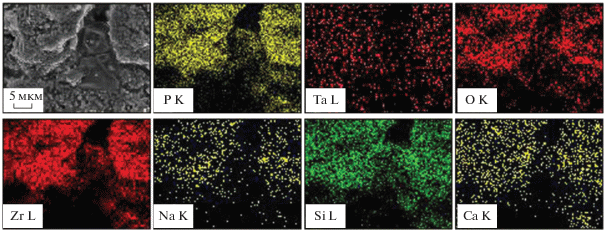
Как следует из карт элементов, представленных на рис. 3, распределение тантала, кальция, фосфора и кремния симбатно распределению циркония, что говорит об однородности микроструктуры полученной керамики. Поскольку моноклинная модификация оксида циркония в образце является доминирующей, это является дополнительным аргументом в пользу заключения о переходе Ta2O5 в твердый раствор замещения с оксидом циркония. Характер распределения кремния, по-видимому, свидетельствует о том, что все частицы керамики равномерно распределены в матрице стекла. В то же время, как будет показано ниже, внутри пор наблюдается повышенное содержание кальция и фосфора.
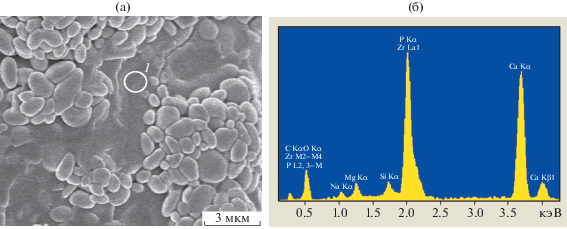
Текстура и свойства поверхности импланта могут обеспечить его стабильную фиксацию в костной ткани пациента на длительный срок. Значения открытой пористости и величина пор имплантируемого материала – важные показатели для прогнозирования биохимических процессов, происходящих на границе имплант–живая ткань. Для успешной имплантации искусственного материала необходимо наличие развитой системы макро- (100–300 мкм) и микропор (5–30 мкм). Макропоры отвечают за прорастание сосудов, микропоры – за фиксацию остеогенных клеток. Согласно исследованиям [26], максимальную степень сцепления между вновь образовавшейся костью и поверхностью импланта обеспечивают материалы с развитым микрорельефом и размером открытых пор 1–10 мкм. Микрогеометрия поверхности излома одного из полученных образцов показана на рис. 4. Наличие пор, средние размеры которых составляют 10–20 мкм, гарантирует хорошую механическую фиксацию импланта из исследуемого материала. Значения открытой пористости исследуемых образцов находятся в диапазоне 10–15%, средняя плотность составляет 3.6–3.9 кг/м3. Следует отметить, что образцы у поверхности более плотные и менее пористые, чем внутри, что объясняется процессом их прессования. Толщина более плотного поверхностного слоя составляет ~1 мм. Рассмотренные ниже снимки, характеризующие рентгеноконтрастность образцов, подтверждают это.
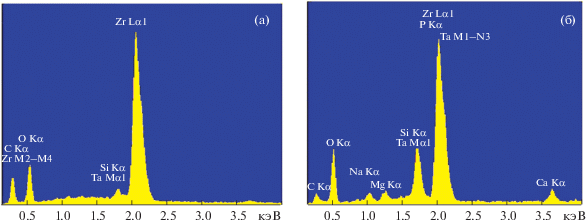
Полученные образцы керамики состоят из частиц ZrO2 округлой, слегка удлиненной формы и стеклофазы в пространстве между ними. Средние размеры частиц ZrO2 составляют 0.5–3 мкм (рис. 5). Энергодисперсионный спектр (ЭДС) образца в отдельных точках (рис. 5б) приведен на рис. 6. Спектр, соответствующий округлым частицам, содержит линии преимущественно циркония и относится к ZrO2 (рис. 6а). Фаза, соединяющая частицы ZrO2, содержит фосфаты кальция, кремний, тантал (рис. 6б). Наличие циркония в спектре этой фазы можно объяснить как процессом формирования последней, так и рассеянием от соседних областей фазы ZrO2. На внутренней поверхности пор микроскопия выявила бесформенные области, образующие слои (рис. 7). Результаты ЭДС показывают, что в составе слоев преобладают фосфор и кальций, а содержание кремния незначительно. В области упакованных частиц диоксида циркония, где отсутствуют подобные образования, содержание кальция и фосфора минимально. Видимых различий между образцами разных составов на микрофотографиях и энергодисперсионных спектрах не обнаружено.
Изучение механических характеристик образцов показало, что прочность материала зависит как от состава, так и от качества предварительного измельчения. Результаты испытаний материалов на прочность представлены в табл. 1. Сравнение механических характеристик составов 1 и 4 позволяет судить об увеличении прочности материала с увеличением содержания стеклофазы в образце. Одинаковое количество порообразователя в указанных образцах исключает его влияние на результат исследования. Сравнение механических характеристик составов 1–3 свидетельствует об увеличении прочности материала с увеличением количества порообразователя. Причина заключается в следующем: во время спекания жидкая стеклофаза частично заполняет образовавшиеся закрытые поры, что упрочняет материал. Изолированные поры импланта не принимают участия в биохимических процессах, происходящих в организме, следовательно, уменьшение закрытых пор не влечет ухудшения биологических характеристик поверхности материала.
Существенная разница механических характеристик импланта и костной ткани пациента является одним из факторов, способствующих резорбции кости вокруг импланта и утрате последнего. Возраст пациента, индивидуальные особенности организма, расположение участка поврежденной ткани, требующей замены, определяют свойства костной ткани. Характеристики ткани пациента должны быть учтены при подборе материала для замены. Согласно исследованиям [27], компактная костная ткань имеет прочность при сжатии 100–230 МПа. Требованиям прочности удовлетворяют все образцы керамики, полученные в данной работе. А возможность подобрать прочность материала конкретному пациенту открывает перспективы для изготовления индивидуальных имплантов с заданными характеристиками.
Способность костных имплантатов поддерживать регенерацию тканей определяется их способностью привлекать остеогенные клетки и стимулировать процесс восстановления кости за счет резорбции биоактивной фазы. В процессе участвует поверхность искусственного материала, на которой формируется биологически активный слой нанокристаллического гидроксиапатита [28, 29]. Известно, что включение Ta2O5 в состав материалов снижает их биоактивность. Например, его содержание в образце стеклокерамики 3 мол. % (или 18 мас. %) лишает материал биоактивных свойств [18]. Исследованы причины их подавления [30]. Содержание Ta2O5 в наших образцах не превышало 5 мас. %.
Исследование влияния легирования на биоактивные свойства материала заключалось в установлении факта осаждения гидроксиапатита на поверхности образцов после их погружения в SBF-раствор на 20 сут и визуальной оценке образовавшегося покрытия. Для изучения был выбран состав 3, образцом сравнения служил состав 5. Одинаковое количество КФС в образцах исключает влияние указанных соединений на результат исследования. Образец керамики с танталом до помещения в SBF-раствор представлен на рис. 5, после – на рис. 8а. Он имеет тонкое неоднородное покрытие в виде полос из нанокристаллического гидроксиапатита. Образец, не содержащий Ta2O5 в своем составе, имеет покрытие из гидроксиапатита в виде плотной растрескавшейся корки (рис. 8б). Из этого следует, что легирование керамики оксидом тантала снижает биологическую активность материала.
Отсутствие токсического действия на организм соединений, используемых в составе керамики, подтверждено многочисленными исследованиями [9–12, 31–33]. Это позволяет считать материал, полученный в ходе работ, нетоксичным.
Идеальный материал для замещения костной ткани должен обладать достаточной рентгеноконтрастностью, чтобы отличить его от окружающих анатомических структур. Компактная костная ткань человека имеет рентгеноконтрастность по шкале Хаунсфилда 1250–1900 HU, губчатая кость – 350–850 HU. Образцы полученной танталсодержащей циркониевой керамики имеют рентгеноконтрастность 3071 HU (рис. 9). Таким образом, рентгеноконтрастность импланта из предложенного материала позволит упростить послеоперационное обследование пациента рентгеновским методом.
ЗАКЛЮЧЕНИЕ
Получена биоактивная, пористая, рентгеноконтрастная керамика на основе диоксида циркония. Биоактивная фаза формируется в процессе керамического обжига из смеси аммония фосфорнокислого двузамещенного с карбонатом кальция, которые одновременно играют роль порообразователя в материале. Величину и количество пор можно регулировать, изменяя процентное отношение кальций-фосфатной смеси к общей массе образца и качество измельчения его компонентов. Скорость резорбции биоактивной фазы в организме можно варьировать за счет соотношения Ca/P в порообразующей смеси. Прочность материала можно регулировать на этапе его прессования. Такой метод получения керамики позволяет изготавливать индивидуальные импланты с заданными характеристиками. Установлено, что легирование оксидом тантала незначительно снижает механические и биоактивные свойства кальций-фосфатной циркониевой керамики, но повышает ее рентгеноконтрастность. Проведенные исследования помогут создать доступный, конкурентоспособный продукт для использования в медицине.
Список литературы
Кирилова И.А., Садовой М.А., Подорожная В.Т. и др. // Хирургия позвоночника. 2013. № 4. С. 52. https://doi.org/10.14531/ss2013.4.52-62
Afzal A. // Materials Express. 2014. V. 4. № 1. P. 1. https://doi.org/10.1166/mex.2014.1148
Smirnov V.V., Krylov A.I., Smirnov S.V. et al. // Inorg. Mater. 2017. V. 53. № 9. P. 980. [Смирнов В.В., Крылов А.И., Смирнов С.В. и др. // Неорган. материалы. 2017. Т. 53. № 9. С. 1001.]https://doi.org/10.1134/S0020168517090151
Obolkina T.O., Goldberg M.A., Smirnov S.V. et al. // Inorg. Mater. 2020. Т. 56. № 2. С. 182. [Оболкина Т.О., Гольдберг М.А., Смирнов В.В. и др. // Неорган. материалы. 2020. Т. 56. № 2. С. 192.]https://doi.org/10.31857/S0002337X20020153
Covacci V., Bruzzese N., Maccauro G. et al. // Biomaterials. 1999. V. 20. P. 371. https://doi.org/10.1016/S0142-9612(98)00182-3
Talashova I.A., Silantieva T.A., Kononovich N.A., Luneva S.N. // Bull. Siberian Mediс. 2012. V. 11. № 3. P. 62. https://doi.org/. [Талашова И.А., Силантьева Т.А., Кононович Н.А., Лунева С.Н. // Бюллетень сибирской медицины. 2012. Т. 11. № 3. С. 62.]https://doi.org/10.20538/1682-0363-2012-3-62-68
Stevens M.M. // Mater. Today. 2008. V. 11. № 5. P. 18. https://doi.org/10.1016/S1369-7021(08)70086-5
Safronova T.V., Putlyaev V.I., Shekhirev M.A., Kuznetsov A.V. // Glass Ceram. 2007. V. 64. № 3. P. 102. [Сафронова Т.В., Путляев В.И., Шехирев М.А., Кузнецов А.В. // Стекло и керамика. 2007. № 3. С. 31.]https://doi.org/10.1007/s10717-007-0027-2
Silva V.V., Lameiras F.S., Lobato Z.I. // J. Biomed. Mater. Res. 2002. V. 63. P. 583. https://doi.org/10.1002/jbm.10308
Goldberg M.A., Obolkina T., Smirnov S. et al. // Materials. 2020. V. 13. № 12. C. 2789. https://doi.org/10.3390/ma13122789
Obolkina T.O., Goldberg M.A., Smirnov S.V. et al. // Dokl. Chem. 2020. V. 493. № 1. С. 99. [Оболкина Т.О., Гольдберг М.А., Смирнов С.В. и др.// Докл. РАН Химия, науки о материалах. 2020. Т. 492. С. 42.]https://doi.org/10.1134/S0012500820070010
Kong Y.M., Bae C.J., Lee S.H. et al. // Biomaterials. 2005. V. 26. № 5. P. 509. https://doi.org/10.1016/j.biomaterials.2004.02.061
Webster T.J., Massa-Schlueter E.A., Smith J.L., Slamovich E.B. // Biomaterials. 2004. V. 25. № 11. P. 2111. https://doi.org/10.1016/j.biomaterials.2003.09.001
Deb S., Abdulghani S., Behiri JC. // Biomaterials. 2002. V. 23. № 16. P. 3387. https://doi.org/10.1016/s0142-9612(02)00039-x
Wang X., Ye J., Wang Y. // Acta Biomateriala. 2007. V. 3. № 5. P. 757. https://doi.org/10.1016/j.actbio.2007.01.004
Aberg J., Henriksson H.B., Engqvist H. et al. // J. Biomed. Mater. Res. A. 2012. V. 100. № 5. P. 1269. https://doi.org/10.1002/jbm.a.34065
Coomaraswamy K.S., Lumley P.J., Hofmann M.P. // J. Endod. 2007. V. 33. P. 295. https://doi.org/10.1016/j.joen.2006.11.018
Riaz M., Zia R., Saleemi F. et al. // Mater. Sci. Poland. 2016. V. 34. № 1. P. 13. https://doi.org/10.1515/msp-2016-0013
Min K.S., Chang H.S., Bae J.M. et al. // J. Endod. 2007. V. 33. P. 1342. https://doi.org/10.1016/j.joen.2007.07.012
Chen C., Hsieh S.C., Teng N.C. et al. // J. Endod. 2014. V. 40. P. 251. https://doi.org/10.1016/j.joen.2013.07.006
Александрова С.А., Александрова О.И., Хомутов В.П. и др. // Цитология. 2018. Т. 60. № 12. С. 987. https://doi.org/10.1134/S0041377118120052
Kokubo T., Takadama H. // Biomaterials. 2006. V. 27. № 15. P. 2907. https://doi.org/10.1016/j.biomaterials.2006.01.017
Miao X., Hu Y., Liu J., Huang X. // Mater. Sci. Eng., C. 2007. V. 27. № 2. P. 257. https://doi.org/10.1016/j.msec.2006.03.009
Sponchia G., Moshtaghioun M., Benedetti A. et al. // Scripta Materialia. 2017. V. 130. № 15. P. 128. https://doi.org/10.1016/j.scriptamat.2016.11.021
Solonenko A.P., Blesman A.I., Polonyankin D.A., Gorbunov V.A. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. С. 993. [Солоненко А.П., Блесман А.И., Полонянкин Д.А., Горбунов В.А. // Журн. неорган. химии. 2018. Т. 63. № 8. С. 953.]https://doi.org/10.1134/S0036023618080211
Hansson S., Norton M. // J. Biomech. 1999. V. 8. № 32. C. 829. https://doi.org/10.1016/s0021-9290(99)00058-5
Баринов С.М. // Успехи химии. 2010. Т. 79. № 1. С. 15. https://doi.org/10.1070/RC2010v079n01ABEH004098
Chen Q.Z., Thompson I.D., Boccaccini A.R. // Biomaterials. 2006. V. 27. № 11. P. 2414. https://doi.org/10.1016/j.biomaterials.2005.11.025
El-Rashidy A.A., Roether J.A., Harhaus L. et al.// Acta Biomater. 2017. V. 62. P. 1. https://doi.org/10.1016/j.actbio.2017.08.030
Grishchenko D.N., Slobodyuk A.B., Kuryavyi V.G., Medkov M.A. // Russ. J. Inorg. Chem. 2020. V. 65. № 10. P. 1606. [Грищенко Д.Н., Слободюк А.Б., Курявый В.Г., Медков М.А. // Журн. неорган. химии. 2020. Т. 65. № 10. С. 1408.]https://doi.org/10.1134/S0036023620100083
Stepanov A.G., Arutyunov S.D., Shekhter A.B., Rudenko T.G. // Modern Probl. Sci. Educat. 2018. № 2. [Степанов А.Г., Арутюнов С.Д., Шехтер А.Б., Руденко Т.Г. // Современные проблемы науки и образования. 2018. № 2.]https://doi.org/10.17513/spno.27506
Fakhardo A.F., Anastasova E.I., Gabdullina S.R. et al. // ACS Appl. Bio Mater. 2019. V. 2. № 10. P. 4427. https://doi.org/10.1021/acsabm.9b00615
Textor M., Sittig C., Frauchiger V. et al. // Titanium in Medicine: Material Science, Surface Science, Engineering, Biological Responses and Medical Applications. 2001. P. 171.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии