Журнал неорганической химии, 2020, T. 65, № 10, стр. 1338-1344
Синтез CaCu3Ti4O12, исследование физико-химических и фотокаталитических свойств
К. В. Иванов a, *, О. В. Алексеева a, А. В. Агафонов a
a Институт химии растворов им. Г.А. Крестова РАН
153045 Иваново, ул. Академическая, 1, Россия
* E-mail: ivk@isc-ras.ru
Поступила в редакцию 07.05.2020
После доработки 25.05.2020
Принята к публикации 27.05.2020
Аннотация
С использованием растворного метода синтеза в среде уксусной кислоты получен предшественник CaCu3Ti4O12 и отожжен при 100, 200, 400, 600, 800 и 1100°С. Прокаленные порошки исследованы физико-химическими методами анализа. По данным рентгенофазового анализа, полностью сформированная кристаллическая структура CaCu3Ti4O12 существует при 1100°С, размер частиц полученного порошка составляет 1–10 мкм. Термический анализ с учетом масс-спектрометрической системы анализа паровой фазы выявил механизм протекающих процессов. Показано влияние высушенного при 100°С порошка предшественника и CaCu3Ti4O12 на фотокаталитическую активность в процессе деколорирования красителя родамина Б. Установлена кинетика модели псевдопервого и псевдовторого порядка адсорбции родамина B на образцах, отожженных при 100 и 1100°C.
ВВЕДЕНИЕ
В последнее время большое внимание уделяется исследованиям фотокаталитической активности материалов со структурой перовскита с целью создания фотокатализаторов [1, 2], применяемых в системах очистки водных и воздушных сред от органических молекул (красителей, фармацевтических соединений) и бактерий [3–5]. Особый интерес представляет разработка фотокатализаторов, активных под воздействием видимого света. Однако широко известный диоксид титана, используемый в качестве фотоактивного материала, имеет ограничения вследствие его низкой фоточувствительности в видимой области спектра из-за большой ширины запрещенной зоны. Одним из методов, позволяющих расширить область поглощения TiO2 в видимую область спектра, является легирование диоксида титана переходными металлами или другими веществами. В ряде таких исследований были изучены металлооксиды [6], гибридные [7], гетероструктурированные [8] и другие системы.
В литературе приводятся сведения об исследовании материалов со структурой перовскита, таких как BaTiO3 [9], SrTiO3 [10], CaTiO3 [11], LaFeO3 [12] и др., обладающих хорошей фотокаталитической активностью. Однако они имеют большие запрещенные зоны (>3 эВ) и могут быть активированы только в ультрафиолетовом свете [13]. Авторами [14] установлено, что CaCu3Ti4O12 (CCTO) имеет две запрещенные зоны: 1.93 и 2.21 эВ. Поэтому изучение фотокаталитических свойств CCTO, представляющего собой двойной кубический перовскит [15], полученный разными способами, является актуальной задачей, так как он сочетает фотокаталитические свойства TiO2 [16], проявляющего высокую активность в ультрафиолете, и CuO, поглощающего видимый свет. Комбинация свойств этих оксидов в CCTO должна способствовать фотокаталитической активности в видимом свете, возникающей в результате переноса заряда в видимом свете из основного в возбужденное состояние.
Известно, что диоксид титана обладает антимикробными и антигрибковыми свойствами преимущественно под действием света [17]. Легирование TiO2 ионами металлов или создание наноразмерных композитов с использованием различных оксидов (CuO, Ag2O и др.) приводит к появлению у них антимикробной активности в темноте [18–20]. Использование таких материалов, как CaCu3Ti4O12, позволяет создавать покрытия на текстильных материалах медицинского назначения и средствах защиты дыхательных путей.
Следует отметить, что в литературе в основном представлены работы по исследованию диэлектрической проницаемости ССТО вследствие его возможного применения в микроэлектронике [21, 22].
Цель настоящей работы – синтез, изучение структуры и фотокаталитических свойств ССТО.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза предшественника керамического порошка ССТО применяли жидкофазный метод в среде уксусной кислоты. В качестве исходных реагентов использовали Ca(OH)2, Cu(CH3COO)2 · H2O, Ti(C4H9O)4 (в стехиометрическом соотношении CaO : CuO : TiO2 = 1 : 3 : 4) и ледяную уксусную кислоту (все реактивы фирмы SIGMA-Aldrich). Методика синтеза заключалась в приготовлении водного раствора Cu(CH3COO)2 · H2O и раствора ацетата кальция в результате взаимодействия Ca(OH)2 с CH3COOH (лед.). Полученные растворы смешивали и перемешивали в течение 1 ч при 85°С. К однородному раствору по каплям добавляли Ti(C4H9O)4 и выдерживали в течение 1 ч при непрерывном нагревании (85°С) и перемешивании. Раствор высушивали в сушильном шкафу при 100°С до постоянной массы и отжигали в воздушной среде при температурах 200, 400, 600, 800 и 1100°С.
Образцы термически обработанных порошков исследовали с помощью физико-химических методов анализа. Морфологию порошков изучали методом электронной сканирующей микроскопии (микроскоп Vega3 SBH Tescan). Термический анализ синтезированного порошка проводили на приборе Netzsch STA 409 C/CD. Рентгеноструктурный анализ синтезированных порошков выполняли на дифрактометре ДРОН-3М (CuKα-излучение, напряжение 40 кВ). ИК-спектры порошков синтезированных соединений в виде таблеток с KBr регистрировали на ИК-Фурье-спектрометре Vertex 80v. Фотокаталитическую активность порошка изучали спектрофотометрически при облучении раствора родамина в суспензии 0.043 г порошка фотокатализатора в кварцевой термостатируемой ячейке объемом 1 л ультрафиолетовым светом. Источником ультрафиолетового излучения служила ртутная лампа высокого давления мощностью 250 Вт с максимумом излучения при 365 нм. Установка подробно описана в работе [23].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Физико-химические характеристики полученных материалов
На рис. 1а, 1б приведены электронные изображения поверхностей полученных порошков и отожженных в течение 1 ч при 100 и 1100°С. Из микрофотографий видно, что материалы имеют полидисперсную структуру. Термически обработанный образец при температуре 100°С и приложенном напряжении 5.0 кВ в процессе измерения представляет собой сочетание агломератов в виде неупорядоченной и пластинчатой структуры. Размер этих зерен составляет 500 нм–8 мкм. Прокаливание при температуре 1100°С и приложенном напряжении 15.0 кВ в ходе съемки приводит появлению более крупных агломератов, имеющих округленную кубическую форму и размеры от 1 до 10 мкм, что обусловлено процессами спекания и формированием кристаллической структуры. Поверхность полученного материала представляет собой развитую структуру с небольшим количеством пор.
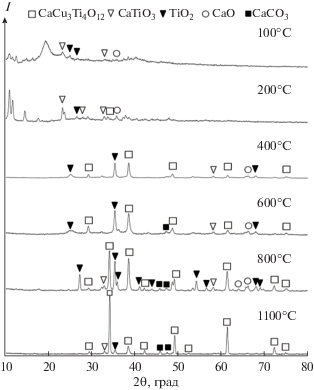
Исследования изменения кристаллической структуры синтезированного порошка в процессе термической обработки, проведенные методом рентгенофазового анализа (рис. 2), позволили установить процесс формирования фазы ССТО в интервале от 100 и 1100°С.
Зародышеобразование кристаллитов CaCu3Ti4O12 наблюдается при температуре 400°С, о чем свидетельствуют соответствующие рефлексы 2θ = = 29.57°, 38.47°, 49.38° и 61.45°. Дальнейшее увеличение температуры обработки сопровождается появлением новых рефлексов на рентгенограмме и ростом кристаллической фазы ССТО, формирование которой завершается при 1100°С (2θ = = 29.57°, 34.45°, 38.47°, 42.36°, 49.38°, 52.53° 61.45°, 72.32°, 74.92°). Как видно из рис. 2, в порошках присутствуют примеси карбоната кальция (2θ = 47.53°, 48.52°), диоксида титана в фазе рутила (2θ = 27.46°, 34.88°, 36.12°, 41,28°, 44,08°, 54.37°, 56.68°, 68.82°, 69.07°), а также оксида кальция (2θ = 64.71°, 67.97°) и титаната кальция (2θ = = 33.4°, 59.68°). Их существенное количество фиксируется у порошка, отожженного при 800°С. Размер кристаллитов, рассчитанный по уравнению Шеррера (D = 0.94λ/(B cosθ)), при 800°С равен 31 нм, при 1100°С – 35 нм.
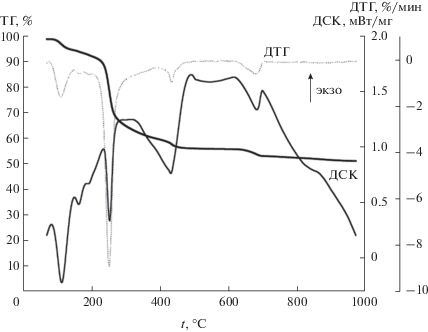
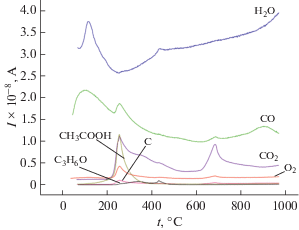
Термический анализ синтезированного порошка (рис. 3), выполненный совместно с идентификацией масс-спектров газовой фазы по ионным токам (рис. 4), позволяет детально рассмотреть тепловые процессы, протекающие в материале при термодеструкции. На термограмме можно выделить три этапа. Первый этап – нагревание образца до температуры ∼320°С, которое сопровождается потерей 36.5% массы, связанной с удалением воды, ацетатных групп и ацетона, о чем свидетельствуют данные масс-спектров ионных токов. Образование ацетона, фиксируемое на рис. 4, обусловлено, по-видимому, разложением избытка уксусной кислоты при нагревании:
CH3COOH → (CH3)2CO + CO2 +H2O,
а также ацетатов, находящихся в синтезированном порошке.
Участок кривой термогравиметрического анализа от 320 до 600°С (второй этап) обусловлен убылью массы (7.4%) вследствие разложения комплексов изобутилата титана с уксусной кислотой до диоксида титана и продуктов деструкции органических соединений. Последующее изменение массы образца при температурах 600–1000°С (третий этап) отвечает разложению карбоната кальция, присутствующего в материале в виде промежуточного продукта, и образованию непосредственно CaCu3Ti4O12. Общая убыль массы образца составляет 48.5%.
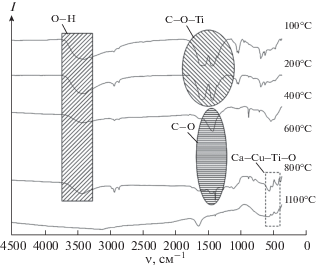
В ИК-спектрах синтезированного порошка (рис. 5) в интервале температур 100–800°С присутствуют полосы поглощения адсорбционной воды в диапазоне 3670–3250 см–1.
При нагревании порошка от 100 до 200°С при 1580 и 1430 см–1 фиксируется наличие бидентатной ацетатной мостиковой группы углерода. При дальнейшем отжиге порошка она разрушается. Далее, вероятно, происходит формирование карбонатных групп, соответствующих колебаниям связи C–O при 1456 и 860 см–1, что подтверждается методами рентгенофазового и термогравиметрического анализа с учетом отходящих газов.
В ИК-спектре порошка, отожженного при 800 и 1100°С, присутствуют полосы при 561, 516 и 441 см–1, свидетельствующие о наличии ССТО. Авторы [24] полагают, что эти колебания относятся к ионам титана (Ti–O 653–550 см–1 и Ti–O–Ti 495–436 см–1).
Фотокаталитические измерения
Фотокаталитическая активность порошка – предшественника ССТО, высушенного при 100°C, и порошка CaCu3Ti4O12, полученного в результате термического отжига при 1100°C, была изучена на примере реакции фотокаталитического деколорирования красителя родамина Б.
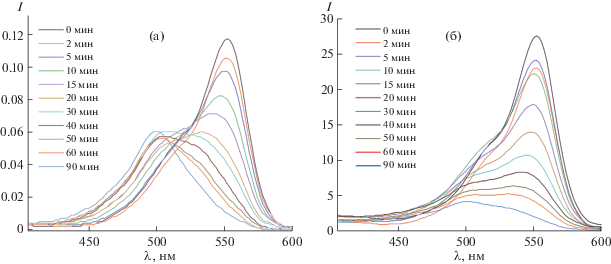
На рис. 6 представлено изменение спектров поглощения водного раствора родамина Б под действием ультрафиолетового излучения лампы высокого давления мощностью 250 Вт с максимумом при 365 нм. Максимум поглощения родамина Б составил 552 нм. Как видно из рис. 6, с увеличением времени облучения водного раствора интенсивность максимума уменьшается, при этом наблюдается изменение цвета раствора от ярко-фиолетового до прозрачного. Из спектров адсорбции видно смещение максимума полосы поглощения (особенно на рис. 6а), связанное, по-видимому, с воздействием порошка, содержащего органические группы, в частности ацетатные, которые оказывают влияние на смещение длины волны в процессе облучения водной суспензии, а также вследствие деколорирования раствора (рис. 6б).
Рис. 6.
Спектры абсорбции родамина Б под действием ультрафиолета в водном растворе порошком, отожженным при 100 (а) и 1100°С (б).
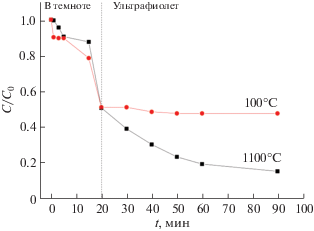
Результаты эффективности фотокаталитического разложения родамина Б на рис. 7 показывают, что наиболее полная деградация красителя в водном растворе происходит при использовании в качестве фотокатализатора порошка ССТО, полученного термической обработкой предшественника при 1100°C. В этом случае деколорирование красителя составило 84.4%, тогда как при использовании порошка, отожженного при 100°C, – 52.1%. Разница в величинах фотокаталитической активности порошков, вероятно, обусловлена различиями в фазовом составе, степени кристалличности и наличии активных центров.
Рис. 7.
Фотокаталитическое разложение радомина Б на катализаторах порошков, отожженных при 100 и 1100°С, в темноте и под действием ультрафиолета.
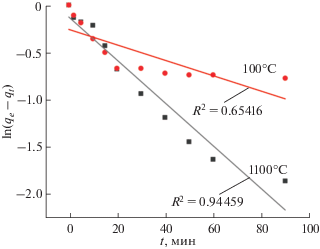
Для анализа процесса адсорбции красителя использовали общую кинетическую модель химических реакций, а именно Лагергрена псевдопервого и псевдовторого порядка. Модель скорости псевдопервого порядка, предложенная Лагергреном [25], выражается уравнением:
ln(qe – qt) = ln qe – k1t,
где qe и qt (мг/г) – количество адсорбированного родамина Б в состоянии равновесия и в определенный момент времени соответственно; t – время контакта (мин); k1 – константа скорости псевдопервого порядка (мин–1), определяемая по наклону участка ln(qe – qt) к t.
Линеаризованная модель псевдовторого порядка выражается следующим уравнением [26]:
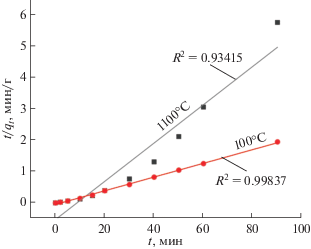
где k2 – константа псевдовторого порядка, г/(мг мин).Согласно приведенному на рис. 8 графику кинетики модели псевдопервого порядка, значения R2 (коэффициент корреляции) адсорбции родамина Б на образцах находятся в диапазоне от 0.65 до 0.94. Экспериментально наблюдаемая кинетика адсорбции для порошка, высушенного при 100°C, недостаточно описывается моделью псевдопервого порядка в силу линейных зависимостей лишь при малых временах контакта фаз. Полученный вид зависимости в указанных координатах свидетельствует, по всей видимости, о смешанной диффузионной кинетике процесса сорбции и не позволяет однозначно выявить лимитирующую стадию. Константы скорости для кинетической модели псевдопервого порядка для порошка – предшественника ССТО, высушенного при 100°C, составили 0.00814 мин–1, а для CaCu3Ti4O12 – 0.02261 мин–1.
Рис. 8.
Кинетика модели псевдопервого порядка адсорбции родамина B на образцах, отожженных при 100 и 1100°C.
По результатам кинетики модели адсорбции родамина B (рис. 9) псевдовторого порядка, значение R2 для образца, отожженного при 100°C, составило 0.99837, а при 1100°C – 0.93415, константа скорости равна соответственно 0.02 и 0.06. В итоге модель псевдопервого порядка достаточно хорошо описывает кинетику ССТО, полученного термической обработкой при 1100°C. Модель псевдовторого порядка согласуется с образцом, высушенным при 100°C, свидетельствуя о том, что адсорбция включает как химическую, так и физическую сорбцию [26].
ЗАКЛЮЧЕНИЕ
Соединение CaCu3Ti4O12 получено при термической обработке при 1100°C предшественника, синтезированного растворным методом. Методом сканирующей электронной микроскопии показано, что размеры частиц синтезированного порошка, высушенного при 100°C, составляют 1–2 мкм, а ССТО – 2–5 мкм. Комплексом методов физико-химического анализа установлено протекание процессов в ходе термической обработки синтезированного материала. Выявлено, что формирование фазы CaCu3Ti4O12 завершается к 1100°С. Кинетика процессов адсорбции для порошка с кристаллической фазой CaCu3Ti4O12 соответствует модели псевдопервого порядка, а предшественника – модели псевдовторого порядка. Обнаружено, что в первые 15 мин более 30% родамина Б удаляется под действием полученных образцов в темноте. Наиболее высокая фотокаталитическая активность проявляется у порошка с кристаллической фазой ССТО, где удаление родамина Б составляет ∼84.4%.
Список литературы
Huerta-Flores A.M., Sánchez-Martínez D., Hernández-Romero M.R. et al. // J. Photochem. Photobiol. A. 2019. V. 368. P. 70. https://doi.org/10.1016/j.jphotochem.2018.09.025
Hu Y., Mao L., Guan X. et al. // Renewable and Sustainable Energy Rev. 2020. V. 119. P. 109527. https://doi.org/10.1016/j.rser.2019.109527
Ahmad J., Majid K. // New J. Chem. 2018. V. 42. P. 3246. https://doi.org/10.1039/C7NJ03617E
Papynov E.K., Shichalin O.O., Buravlev I.Yu. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 263. https://doi.org/10.1134/s0036023620020138
Ellert O.G., Nikolaev S.A., Maslov D.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1403. https://doi.org/10.1134/s0036023618110049
Wan W., Zhang R., Ma M. et al. // J. Mater. Chem. A. 2018. V. 6. P. 754. https://doi.org/10.1039/C7TA09227J
Yang X., Wen Z., Wu Z. et al. // Inorg. Chem. Front. 2018. V. 5. P. 687. https://doi.org/10.1039/C7QI00752C
Su Z., Li H., Chen P. et al. // Catal. Sci. Technol. 2017. V. 7. P. 5105. https://doi.org/10.1039/C7CY01207A
Li J., Zhang G., Han S. et al. // Chem. Commun. 2018. V. 54. P. 723. https://doi.org/10.1039/C7CC07636C
Wu Z., Zhang Y., Wang X. et al. // J. Chem. 2017. V. 41. P. 5678. https://doi.org/10.1039/C7NJ00522A
Иванов К.В., Агафонов А.В., Алексеева О.В. // Изв. вузов. Химия и хим. технология. 2016. Т. 59. № 6. С. 83. https://doi.org/10.6060/tcct.20165906.5384k
Xu K., Feng J. // RSC Adv. 2017. V. 7. P. 45369. https://doi.org/10.1039/C7RA08715B
Zhang G., Liu G., Wang L. // Chem. Soc. Rev. 2016. V. 45. P. 5951. https://doi.org/10.1039/C5CS00769K
Clark J.H., Dyer M.S., Palgrave R.G. et al. // J. Am. Chem. Soc. 2011. V. 133. P. 1016. https://doi.org/10.1021/ja1090832
Kushwaha1 H.S., Madhar N.A., Ilahi B. et al. // Sci. Reports. 2016. V. 6. P. 18557. https://doi.org/10.1038/srep18557
Ribeiro L.N., Fonseca A.C.S., Silva E.F.M. et al. // Chem. Eng. Process: Process Intensification. 2020. V. 147. P. 107 792. https://doi.org/10.1016/j.cep.2019.107792
Li J., Wu Z., Su M. et al. // J. Vacuum. 2020. V. 176. P. 109 346. https://doi.org/10.1016/j.vacuum.2020.109346
He X., Zhang G., Wang X. et al. // Ceram. Int. 2017. V. 43. № 18. P. 16185. https://doi.org/10.1016/j.ceramint.2017.08.196
Jin Y., Dai Z., Liu F. et al. // Water Res. 2013. V. 47. № 5. P. 1837. https://doi.org/10.1016/j.watres.2013.01.003
Chen S., Guo Y., Zhong H. et al. // Chem. Eng. J. 2014. V. 256 P. 238. https://doi.org/10.1016/j.cej.2014.07.006
Liu P., Lai Y., Zeng Y. et al. // J. Alloys Compd. 2015. V. 650. P. 59. https://doi.org/10.1016/j.jallcom.2015.07.247
Homes C.C., Vogt T., Shapiro S.M. et al. // Science. 2001. V. 293. P. 673. https://doi.org/10.1126/science.1061655
Gerasimova T.V., Evdokimova (Galkina) O.L., Kraev A.S. et al. // Microporous Mesoporous Mater. 2016. V. 235. P. 185. https://doi.org/10.1016/j.micromeso.2016.08.015
Kretly L.C., Almeida A.F.L., Fechine P.B.A. et al. // J. Mater. Sci.-Mater. Electron. 2004. V. 15. P. 657.
Lagergren S. // Kung Sven Veten Hand. 1898. V. 24. P. 39. https://doi.org/10.1023/B:JMSE.0000038920.30408.77
Ho Y.S., McKay G. // Process Biochem. 1999. V. 34. P. 451. https://doi.org/10.1016/s0032-9592(98)00112-5
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии