Журнал неорганической химии, 2020, T. 65, № 10, стр. 1426-1433
Синтез наночастиц Pd, Pt и Pd–Pt на углеродных нанотрубках в гидротермальных автоклавных условиях
Р. В. Борисов a, b, *, О. В. Белоусов a, b, А. М. Жижаев a
a Институт химии и химической технологии СО РАН
660036 Красноярск, Академгородок, 50/24, Россия
b Сибирский федеральный университет
660041 Красноярск, пр-т Свободный, 79, Россия
* E-mail: roma_boris@list.ru
Поступила в редакцию 24.04.2020
После доработки 14.05.2020
Принята к публикации 27.05.2020
Аннотация
Методом аммиачного термолиза в автоклавных условиях при температуре 180°С синтезированы и охарактеризованы композиционные материалы Pd/УНТ, Pt/УНТ и Pd–Pt/УНТ с различным содержанием металлов. С помощью сканирующей электронной микроскопии детально исследована морфология полученных объектов: размеры частиц металлического палладия лежат в диапазоне 20−120 нм, платины − 20−150 нм. Методом рентгенофазового анализа установлено, что при совместном восстановлении амминокомплексов палладия(II) и платины(II) в автоклавных условиях на углеродных нанотрубках образуется фаза твердого раствора Pd–Pt. Показано, что при контакте композита Pd/УНТ с солянокислыми растворами H2PtCl6 в гидротермальных условиях при температуре 130°С на углеродных нанотрубках также образуется фаза твердого раствора Pd–Pt.
ВВЕДЕНИЕ
Композиционные функциональные материалы, содержащие наночастицы благородных металлов, находят широкое применение в электронике, водородной энергетике, медицине и других областях [1–3]. При этом частицы палладия и платины на различных подложках используются в каталитических процессах [4–6] и топливных элементах [7]. Среди носителей активных металлов в последнее время наибольшее применение нашли такие химически и температуростойкие пористые углеродные материалы, как сибунит [8], СМК-3 [9], графен [10], углеродные нанотрубки [11, 12].
Для каталитических процессов традиционно применяют монометаллические дисперсные частицы палладия или платины, закрепленные на углеродном носителе [13], однако наибольшей активностью и селективностью обладают катализаторы, содержащие два и более металла [14, 15]. Так, в работе [14] показано, что переход от катализатора палладий-сибунит к биметаллическому золото-палладиевому катализатору приводит к значительному увеличению скорости гидрирования фурфурола за счет синергетического эффекта, связанного с присутствием двух металлов.
Методики синтеза моно- и биметаллических дисперсных частиц, в том числе и на углеродных подложках, очень многообразны [16–22]. Основные подходы к химическому синтезу биметаллических наночастиц сводятся к последовательному или одновременному восстановлению их комплексных солей из растворов, как правило, с использованием восстановителей и стабилизаторов [19]. Наиболее популярен метод пропитки с последующим восстановлением до металла в среде водорода [16–18]. Этим способом авторами [18] получен биметаллический катализатор Pd–Pt/C (0.5 мас. % Pd, 0.9 мас. % Pt), активный в процессах гидродехлорирования. В работе [20] предложен способ синтеза Pd/C- и Pd–Pt/C-катализаторов различного состава сонохимическим методом. В последние годы весьма интенсивно применяются методы послойного нанесения из газовой фазы металлических наночастиц на подложку [14, 21, 22], основанные на разложении металлоорганических соединений. Данным методом можно получать как монометаллические частицы палладия с размерами 6–10 нм на углеродных подложках [14], так и биметаллические частицы Pd–Pt со структурой оболочка–ядро [22]. Весьма интересен способ получения биметаллических твердых растворов палладий–золото при помощи разложения двойных комплексных солей (ДКС) в газовой среде [23]. В работах [24–28] для нанесения металлических частиц рутения, палладия, платины, хрома на оксидные и углеродные носители использован метод термолиза амминокомплексов соответствующих металлов в автоклавных условиях в щелочных средах. Полученные этим методом монометаллические частицы палладия и платины [24, 27] можно модифицировать вторым металлом c помощью реакций контактного восстановления благородных металлов из растворов [29, 30]. Так, в работе [29] в автоклавных условиях были изучены процессы формирования биметаллических частиц Pd–Au и Au–Pt сложного строения, а в [30] синтезированы композитные материалы Au–Pd/C.
Цель настоящей работы – изучить процессы формирования наноразмерных частиц платины и палладия на углеродных нанотрубках (УНТ) методом термолиза их амминокомплексов при 180°С и исследовать поведение композитного материала Pd/УНТ при контакте с растворами H2PtCl6 при 130°C.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали хлорид палладия(II) “ч.”, кислоту H2[PtCl6] “ч.”, соляную кислоту “ос. ч. 20-4”, аммиак водный “ос. ч. 23-5”, гидроксид калия “х. ч.”, аргон газообразный (сорт высший). Рабочие растворы готовили разбавлением рассчитанных аликвот реагентов дистиллированной водой. Хлорид тетраамминпалладия(II) и хлорид тетраамминплатины(II) синтезировали по стандартным методикам [30].
В качестве носителя использовали коммерческий материал на основе углеродных нанотрубок – “Таунит” [31] с удельной поверхностью 151 м2/г. Эксперименты проводили в титановых автоклавах с фторопластовыми вкладышами объемом 30 мл и в кварцевых автоклавах объемом 45 мл по методике, подробно описанной в работах [27, 29, 30].
Формирование высокодисперсных частиц палладия и платины на УНТ проводили в автоклавах при 180°С. Углеродный материал и необходимое количество хлорида тетраамминпалладия(II) или хлорида тетраамминплатины(II) помещали во фторопластовый реактор, заливали 20 мл 0.05 М раствора KОН, удаляли воздух продувкой аргоном с последующей герметизацией системы. В течение 120 мин проводили перемешивание при 25°С, после чего автоклав помещали в нагретый до 180°С термостат на 240 мин с постоянным перемешиванием в вертикальной плоскости. После эксперимента автоклав разбирали, жидкую фазу отбирали на анализ, а твердую многократно промывали дистиллированной водой и сушили при 100°С.
Синтез частиц палладий–платина осуществляли с помощью реакций контактного обмена в гидротермальных условиях. В кварцевый автоклав вливали определенный объем солянокислого (1 M) раствора H2PtCl6 заданной концентрации. Навеску композитного материала Pd/УНТ помещали во фторопластовую чашечку на внутренней поверхности крышки автоклава. Через раствор в течение 1 ч пропускали аргон. Барботирование и герметизацию автоклава осуществляли в камере, заполненной инертным газом. Затем автоклав в вертикальном положении вставляли в отверстие вала воздушного термостата, нагретого до 130°С. После прогрева реактора (40 мин) включали перемешивание, обеспечивая тем самым контакт твердой фазы и раствора только при заданной температуре. После термостатирования в течение 15–240 мин автоклав охлаждали. Аликвоту раствора отбирали для анализа, а осадок промывали дистиллированной водой до отрицательной реакции на хлорид-ионы и сушили при температуре 100°С. Содержание металлов в композите рассчитывали на основании данных атомно-абсорбционного анализа растворов до и после взаимодействия.
Рентгеновские дифрактограммы регистрировали в диапазоне углов 2θ от 5° до 90° с шагом 0.02° на настольном дифрактометре Proto AXRD (Proto Manufacturing, Канада) с использованием CuKα-излучения и накоплением в точке 3 с. Исследования морфологических особенностей осажденных частиц проводили методом сканирующей электронной микроскопии на приборах ТМ3000 (Hitachi, Япония) с системой микроанализа Quantаx 70 (Bruker, Германия) и S5500 (Hitachi, Япония). Методом рентгеноспектрального микроанализа оценивали равномерность распределения частиц по носителю и их морфологию.
Регистрацию изотерм адсорбции азота для исследуемых материалов проводили с помощью анализатора ASAP-2420 (Micromeritics, USA) при 77 K. Расчет текстурных характеристик осуществляли с помощью методов BJH и BET.
Содержание химических элементов в растворах определяли методами атомно-абсорбционной спектроскопии на атомно-абсорбционном спектрометре AAnalyst-400 (Perkin Elmer, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Формирование материалов Pd/УНТ, Pt/УНТ и Pd–Pt/УНТ аммиачным термолизом в щелочных растворах
При температуре от 170°C и выше в щелочной среде водные растворы хлоридов тетраамминпалладия(II) и тетраамминплатины(II) восстанавливаются до высокодисперсных порошков соответствующих металлов [24, 27, 30]. Процесс термолиза комплексных соединений палладия и платины в щелочных водных растворах протекает по следующим уравнениям:
(1)
$\begin{gathered} {\text{3}}\left[ {{\text{Pd}}{{{\left( {{\text{N}}{{{\text{H}}}_{{\text{3}}}}} \right)}}_{{\text{4}}}}} \right]{\text{C}}{{{\text{l}}}_{{\text{2}}}} + 6{\text{KOH}} \to \\ \to \,3{\text{Pd}} + {{{\text{N}}}_{2}} + 10{\text{N}}{{{\text{H}}}_{3}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 6{\text{KCl}}. \\ \end{gathered} $(2)
$\begin{gathered} {\text{3}}\left[ {{\text{Pt}}{{{\left( {{\text{N}}{{{\text{H}}}_{{\text{3}}}}} \right)}}_{{\text{4}}}}} \right]{\text{C}}{{{\text{l}}}_{{\text{2}}}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}} + 6{\text{KOH}} \to \\ \to 3{\text{Pt}} + {{{\text{N}}}_{2}} + 10{\text{N}}{{{\text{H}}}_{3}} + 9{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 6{\text{KCl}}. \\ \end{gathered} $При добавлении в реактор углеродного материала, как было показано в работах [27, 30], процесс восстановления амминокомплексов протекает по его поверхности с образованием частиц нанометровых размеров. Данным способом были получены композитные материалы Pd/УНТ и Pt/УНТ (табл. 1). Вследствие количественного восстановления аммиакатов можно легко варьировать количество металла на носителе. Одновременное восстановление платины(II) и палладия(II) приводит к формированию частиц соответствующих металлов и позволяет получать их на углеродном носителе в заданном мольном соотношении (табл. 1). При нанесении металлов на углеродный материал происходит незначительное уменьшение удельной поверхности (Sисх = 151 г/см3), которое соответствует вкладу металлов с невысокой (относительно УНТ) удельной поверхностью в общую массу образца.
Таблица 1.
Состав продуктов термолиза комплексных соединений
| № образца | Образец | Состав, мас. % | Sуд, м2/г | |
|---|---|---|---|---|
| Pd | Pt | |||
| 1 | Pd/УНТ | 4.8 | – | 147 |
| 2 | Pt/УНТ | – | 6.0 | 145 |
| 3 | Pt/УНТ | – | 3.0 | 146 |
| 4 | Pd–Pt/УНТ | 2.2 | 4.0 | 144 |
| 5 | Pd–Pt/УНТ | 2.9 | 3.6 | 145 |
Электронно-микроскопические исследования композитных материалов Pd/УНТ, Pt/УНТ и Pd–Pt/УНТ показали, что во всех случаях присутствуют металлические частицы, связанные с углеродными нанотрубками. Материал Pd/УНТ (4.8 мас. % Pd) содержит частицы металла размером от 20 до 120 нм, при этом большие частицы состоят из более мелких фрагментов диаметром 8–12 нм (рис. 1а).
Рис. 1.
СЭМ-изображения частиц, осажденных на углеродных нанотрубках: а – Pd/УНТ, 4.8 мас. % Pd, 240 мин, 180°С; б, г – Pt/УНТ, 6.0 мас. % Pt, 240 мин, 180°С; в – Pt/УНТ, 3.0 мас. % Pt, 240 мин, 180°С.

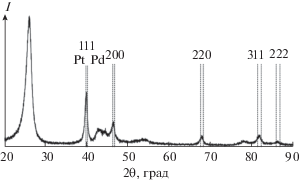
Платина менее равномерно распределена по углеродным нанотрубкам в виде частиц размером 20–200 нм, которые, как и палладий, состоят из более мелких частиц диаметром 5–10 нм (рис. 1б–1г). Помимо сферических глобул прослеживается образование пластинчатых частиц платины (рис. 1г). Методом рентгенофазового анализа подтверждено образование металлических фаз палладия и платины на углеродных носителях. На дифрактограммах (рис. 2) присутствуют пики, соответствующие металлам. Уширение пиков, рассчитанное с помощью полнопрофильного рентгенофазового анализа, коррелирует с дисперсностью полученных частиц. Помимо пиков металла на дифрактограммах присутствуют пики углеродного материала (при 2θ = 26° и 43°), наличие которых согласуется с данными [31, 32].
Рис. 2.
Фрагмент дифрактограмм продуктов осаждения частиц Pd, Pt (6.0 мас. %) и Pd–Pt на углеродные нанотрубки методом щелочного термолиза.
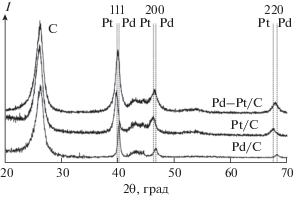
Обнаружено, что при одновременном автоклавном восстановлении комплексных соединений платины и палладия образуются сферические частицы размером 20–120 нм, состоящие из более мелких сфер (рис. 3). Согласно микрорентгеноспектральному анализу, распределение платины и палладия по углеродному носителю равномерное. Атомное соотношение Pd : Pt для образца 4 (табл. 1) варьирует в разных точках от 1 : 0.8 до 1 : 1.1. На дифрактограмме (рис. 2) кроме пиков углерода фиксируются пики, соответствующие фазе твердого раствора палладий–платина Pd0.5Pt0.5 с параметром решетки 3.905 Å. Изменяя соотношение исходных комплексных солей, можно получать функциональные материалы с заданным количеством палладия и платины. Так, в образце 5 (табл. 2) атомное соотношение Pd : Pt составило 1 : 0.7 и распределение частиц тоже равномерное.
Рис. 3.
СЭМ-изображение материала Pd–Pt/УНТ (образец 4, табл. 1) и энергодисперсионный спектр в отображаемой области.
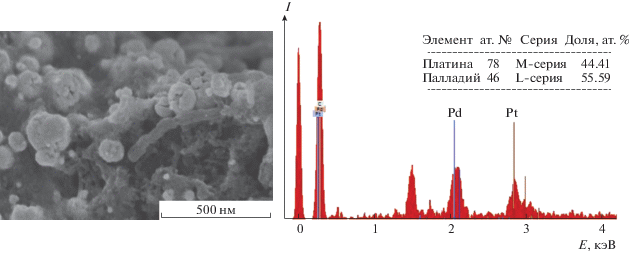
Таблица 2.
Условия формирования и состав композитных материалов Pd–Pt/УМ (130°С, атмосфера Ar)
| № образца | Исходное мольное соотношение Pd : Pt | Продолжительность автоклавирования, мин | Состав композита, мас. % | |
|---|---|---|---|---|
| Pd | Pt | |||
| 1 | 1 : 0 | 30 | 4.1 | – |
| 2 | 1 : 0 | 240 | 4.1 | – |
| 3 | 1 : 0.2 | 30 | 2.9 | 1.1 |
| 4 | 1 : 0.2 | 60 | 2.2 | 1.6 |
| 5 | 1 : 0.2 | 120 | 2.3 | 1.7 |
| 6 | 1 : 0.2 | 240 | 2.3 | 1.7 |
| 7 | 1 : 0.5 | 240 | 2.2 | 1.8 |
Формирование материалов Pd–Pt/УНТ цементацией в солянокислых растворах
Другим подходом для формирования биметаллических частиц могут быть процессы контактного восстановления металла из раствора вторым более электроположительным металлом [29, 30].
Первоначально установлено, что при контакте углеродных нанотрубок в течение 240 мин с солянокислыми растворами H2PtCl6 (СPt = 0.002 моль/л) и H2PdCl4 (СPd = 0.002 моль/л) изменение концентрации металлов в растворе при 180°С составило менее 7%, а при 130°С – менее 5%. Данный факт свидетельствует о низкой сорбционной и восстановительной способности углеродных нанотрубок по отношению к ионам [PtCl6]2– и [PdCl4]2–, в отличие от растворов H[AuCl]4, из которых при повышенных температурах золото(III) способно восстанавливаться на углеродном носителе в виде металлических частиц [33]. К тому же электронно-микроскопическим методом частицы металлов на носителе обнаружить не удалось, поэтому данные процессы в работе детально не рассматривались и не учитывались.
В работе [34] показано, что высокодисперсный палладий реагирует при повышенных температурах (>130°С) с хлорокомплексами Pt(II) и Pt(IV) с образованием твердых растворов Pd–Pt. Восстановление Pt(IV) палладием протекает ступенчато через образование Pt(II). Суммарно данный процесс может быть записан уравнением:
(3)
${{{\text{H}}}_{{\text{2}}}}{\text{PtC}}{{{\text{l}}}_{{\text{6}}}} + 2{\text{Pd}} + 2{\text{HCl}} \to 2{{{\text{H}}}_{{\text{2}}}}{\text{PdC}}{{{\text{l}}}_{4}} + {\text{Pt}}.$В результате взаимодействия образуются биметаллические частицы Pd–Pt, состоящие из ядра палладия, окруженного фазой твердого раствора Pd–Pt, состав которой можно целенаправленно менять, изменяя мольное соотношение Pd/Pt [34]. Наряду с восстановлением платины(IV) (уравнение (3)) происходит растворение металлического палладия (уравнение (4)) вследствие его окисления кислородом [30], который содержится в газовой фазе реактора и в хемосорбированном состоянии на поверхности образца [35]:
(4)
$2{\text{Pd}} + {{{\text{О}}}_{2}} + 8{\text{HCl}} \to 2{{{\text{H}}}_{{\text{2}}}}{\text{PdC}}{{{\text{l}}}_{4}} + 2{{{\text{Н}}}_{{\text{2}}}}{\text{О}}.$Из-за высокой удельной поверхности Pd/УНТ-материала растворимость палладия в солянокислых средах за счет хемосорбированного кислорода может быть выше, чем установленная в работе [35] для чистых дисперсных порошков палладия. Поэтому были проведены эксперименты (табл. 2, образцы 1, 2) при температуре 130°С в атмосфере аргона по определению доли палладия, растворяющегося в ходе эксперимента. Установлено, что за счет протекания процесса (4) в раствор переходит 15% палладия, и данное количество не зависит от продолжительности автоклавного процесса.
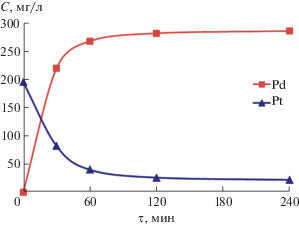
При контакте палладий-углеродного композита с раствором H2PtCl4 при исходном мольном соотношении Pd : Pt = 1 : 0.2 происходит восстановление платины(IV) и растворение металлического палладия по уравнениям (3) и (4). Данный процесс протекает за 120 мин, и дальнейшее увеличение продолжительности почти не влияет на состав композитов (табл. 2). Даже после 240 мин в растворе (рис. 4) остаются ионы платины, и дальнейшая цементация не происходит, что может быть связано как с изоляцией палладия, так и с диспропорционированием образующейся платины(II) [34].
Рис. 4.
Кинетика восстановления Pt(IV) при контакте c композитом Pd/УНТ (4.8 мас. % ) и растворения металлического Pd (автоклав, 130°С, атмосфера аргона).
На дифрактограммах материалов Pd–Pt/УНТ обнаружены уширенные пики твердого раствора Pd–Pt и слабовыраженные пики металлического палладия, которые с увеличением продолжительности синтеза практически незаметны (рис. 5). Согласно рентгеноспектральному микроанализу, равномерное распределение металлов по углеродному носителю и их соотношение не изменяются в различных точках, что косвенно подтверждает образование твердых растворов.
Методом сканирующей электронной микроскопии обнаружено (рис. 6), что вокруг нитевидных образований углеродных нанотрубок происходит частичное разрушение и перекристаллизация металлических частиц. Сферические частицы имеют размеры 40–100 нм и состоят из более мелких частиц. Разрушение сферических частиц связано с процессами растворения палладия, а их рост обусловлен как восстановлением ионов платины на поверхности палладия, так и перекристаллизацией самого палладия. В результате с увеличением продолжительности автоклавного эксперимента от 30 до 240 мин наблюдается исчезновение наиболее мелких частиц и укрупнение крупных (рис. 6).
Рис. 6.
СЭМ-изображения частиц Pd–Pt на углеродном носителе, полученных при 130°С в автоклавных условиях: а – образец 3; б – образец 6 (табл. 2).

Увеличение мольного соотношения Pd : Pt до 1 : 0.5 не привело к появлению отдельно лежащих частиц платины(0). Рентгенографически фаза платины(0) не обнаружена, отмечается лишь некоторое обогащение твердого раствора платиной. При этом значительная часть платины остается в растворе, и состав композита лишь незначительно отличается от мольного соотношения 1 : 0.2. Этот факт может говорить об изоляции палладия твердым раствором палладий-платина и невозможности дальнейшего протекания процесса (3).
ЗАКЛЮЧЕНИЕ
Таким образом, показано, что термолизом аммиакатов в щелочных средах можно получать как монометаллические частицы палладия и платины, так и биметаллические твердые растворы Pt–Pd на углеродных нанотрубках. Установлено, что в результате восстановления в гидротермальных условиях солянокислых растворов H2PtCl6 композитами Pd/УНТ при 130°С образуются биметаллические частицы Pd–Pt на углеродных нанотрубках. Показано влияние мольного соотношения исходных реагентов и продолжительности синтеза на размеры частиц и состав металлических фаз. Методом рентгенофазового анализа доказано формирование твердых растворов Pd–Pt.
Список литературы
Chen A., Ostrom C. // Chem. Rev. 2015. V. 115. P. 11 999. https://doi.org/10.1021/acs.chemrev.5b00324
Lankiang S., Chiwata M., Baranton S. et al. // Electrochim. Acta. 2015. V. 182. P.131. https://doi.org/10.1016/j.electacta.2015.09.061
Nasrabadi H.T., Abbasi E., Davaran S. et al. // Artif. Cell. Nanomed. B. 2014. V. 44. № 1. P. 376. https://doi.org/10.3109/21691401.2014.953632
He L., Weniger F., Neumann H., Beller M. // Angew. Chem. Int. Ed. 2016. V. 55. № 41. P.12 582. https://doi.org/10.1002/anie.201603198
Cai F., Gao D., Si R. et al. // Electrochem. Commun. 2017. V. 76. P. 1. https://doi.org/10.1016/j.elecom.2017.01.009
Xiao X., Jeong H., Song J. et al. // Chem. Commun. 2019. V. 55. № 79. P. 11952. https://doi.org/10.1039/c9cc05915f
Bhowmik T., Kundu M.K., Barman S. // Int. J. Hydrogen Energy. 2017. V. 42. № 1. P. 212. https://doi.org/10.1016/j.ijhydene.2016.11.095
Godina L.I., Tokarev A.V., Simakova I.L. et al. // Catal. Today. 2018. V. 301. P. 78. https://doi.org/10.1016/j.cattod.2017.03.042
Wang Z., Chen W., Han Z. et al. // Nano Res. 2014. V. 7. № 9. P. 1254. https://doi.org/10.1007/s12274-014-0488-x
Ioni Y.V., Voronov V.V., Naumkin A.V. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 6. P. 709. https://doi.org/10.1134/S0036023615060066
Zhang S., Qing M., Zhang H. et al. // Electrochem. Commun. 2009. V. 11. P. 2249. https://doi.org/10.1016/j.elecom.2009.10.001
Kalambate P.K., Li Y., Shen Y. et al. // Anal. Methods. 2019. V. 11. № 4. P. 443. https://doi.org/10.1039/C8AY02381F
Madsen A.T., Rozmysłowicz B., Mäki-Arvela P. et al. // Top. Catal. 2013. V. 56. № 9-10. P. 714. https://doi.org/10.1007/s11244-013-0030-5
Belousov O.V., Tarabanko V.E., Borisov R.V. et al. // React. Kinet. Mech. Cat. 2019. V. 127. № 1. P. 25. https://doi.org/10.1007/s11144-018-1430-0
Musci J.J., Merlo A.B., Casella M.L. // Catal. Today. 2017. V. 296. P. 43. https://doi.org/10.1016/j.cattod.2017.04.063
Ellert O.G., Tsodikov M.V., Nikolaev S.A. et al. // Russ. Chem. Rev. 2014. V. 83. № 8. P. 718. https://doi.org/10.1070/RC2014v083n08ABEH004432
Li H., Sun G., Jiang Q. et al. // Electrochem. Commun. 2007. V. 9. № 6. P. 1410. https://doi.org/10.1016/j.elecom.2007.01.032
Martin-Martinez M., Gómez-Sainero L.M., Palomar J. et al. // Catal. Lett. 2016. V. 146. P. 2614. https://doi.org/10.1007/s10562-016-1895-2
Zaleska-Medynska A., Marchelek M., Diak M. et al. // Adv. Colloid Interface Sci. 2016. V. 229. P. 80. https://doi.org/10.1016/j.cis.2015.12.008
Zheng H., Matseke M.S., Munonde T.S. // Ultrason. Sonochem. 2019. V. 57. P. 166. https://doi.org/10.1016/j.ultsonch.2019.05.023
O’Neill B.J., Jackson D.H.K., Lee J. et al. // ACS Catal. 2015. V. 5. № 3. P. 1804. https://doi.org/10.1021/cs501862h
Cao K., Zhu Q., Shan B. et al. // Sci. Rep. 2015. V. 5. P. 8470. https://doi.org/10.1038/srep08470
Plyusnin P.E., Baidina I.A., Shubin Y.V. et al. // Russ. J. Inorg. Chem. 2007. V. 52. № 3. P. 371. https://doi.org/10.1134/S0036023607030138
Belousov O.V., Sirotina A.V., Belousova N.V. et al. // J. Sib. Fed. Univ. Eng. Technol. 2014. V. 7. № 2. P. 138.
Fesik E.V., Buslaeva T.M., Mel’nikova T.I. et al. // Inorg. Mater. 2018. V. 54. № 12. P. 1299. https://doi.org/10.1134/S0020168518120038
Fesik E.V., Buslaeva T.M., Mel’nikova T.I. et al. // Russ. J. Phys. Chem. A. 2019. V. 93. № 6. P. 1011. https://doi.org/10.1134/S0036024419060098
Borisov R.V., Belousov O.V. // J. Sib. Fed. Univ. Chem. 2014. V. 7. № 3. P. 331.
Tupikova E.N., Platonov I.A., Khabarova D.S. // Kinet. Catal. 2019. V. 60. № 3. P. 366. https://doi.org/10.1134/S0023158419030145
Belousova N.V., Sirotina A.V., Belousov O.V. et al. // Russ. J. Inorg. Chem. 2012. V. 57. № 1. P. 15. https://doi.org/10.1134/S0036023612010044
Borisov R.V., Belousov O.V., Zhizhaev A.M. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 3. P. 308. https://doi.org/10.1134/S0036023618030038
Ткачев A.Г. // Перспективные материалы. 2007. № 3. С. 5.
Яштулов Н.А., Лебедева М.В., Пестов С.М. // Тонкие хим. технологии. 2016. Т. 11. № 5. С. 51. [Yashtulov N.A., Lebedeva M.V., Pestov S.M. // Fine Chem. Technol. 2016. V. 11. № 5. P. 59.]
Borisov R.V., Belousov O.V., Zhizhaev A.M. // J. Sib. Fed. Univ. Chem. 2019. V. 12. № 4. P. 494. https://doi.org/10.17516/1998-2836-0145
Kovalenko N.L., Belousov O.V., Dorokhova L.I. // Russ. J. Inorg. Chem. 2002. V. 47. № 7. P. 967.
Belousov O.V., Dorokhova L.I., Solov’ev L.A. et al. // Russ. J. Phys. Chem. A. 2007. V. 81. № 8. P. 1303. https://doi.org/10.1134/S0036024407080237
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии