Журнал неорганической химии, 2020, T. 65, № 10, стр. 1434-1440
Синтез коллоидных растворов сульфида серебра в тяжелой воде D2O
С. И. Садовников *
Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: sadovnikov@ihim.uran.ru
Поступила в редакцию 24.04.2020
После доработки 15.05.2020
Принята к публикации 27.05.2020
Аннотация
Впервые коллоидные растворы сульфида серебра синтезированы химическим осаждением из растворов нитрата серебра и сульфида натрия в тяжелой воде D2O. При синтезе в качестве стабилизатора использовали цитрат натрия. Размеры наночастиц Ag2S в коллоидных растворах оценены методом динамического рассеяния света и электронной микроскопии. Размер наночастиц сульфида серебра в коллоидных растворах на тяжелой воде, приготовленных из реакционных смесей с разными концентрациями реагентов, составляет от 3 до 19–20 нм. Увеличение концентрации нитрата серебра и уменьшение концентрации цитрата натрия в исходных реакционных смесях приводят к небольшому увеличению размеров наночастиц Ag2S в синтезированных коллоидных растворах. Коллоидные растворы сульфида серебра, синтезированные с использованием тяжелой воды D2O, сохраняют стабильность и неизменный размер наночастиц после хранения в течение более 100 сут.
ВВЕДЕНИЕ
Современные методы исследования наносистем используют разные виды излучений для определения структуры нанообъектов в объеме и на поверхностях. Особые свойства низкоэнергетических нейтронов с длиной волны ∼0.15 нм (1.5 Å), к которым относятся тепловые и холодные нейтроны, позволяют эффективно применять их рассеяние в исследовании твердых тел, жидкостей и коллоидных систем. Методы нейтронографии, в особенности малоугловое рассеяние нейтронов [1–3], чувствительны к особенностям структурной организации на уровне 1–100 нм.
Мaлоугловое paссеяние рентгеновских лучей и нейтронов – один из наиболее эффективных методов изучения структур с размерами от одного до нескольких сотен нанометров. Дифракционная картина образца является результатом интерференции излучения, рассеянного упруго и когерентно, т.е. без изменения длины волны и фазы. Малоугловое рассеяние можно использовать для исследования неупорядоченных объектов без специальной подготовки образцов. Основные формулы, связывающие интенсивность рассеяния со структурой объекта, определяются рассеивающей способностью неоднородностей и контрастом их электронной плотности по отношению к основной матрице [1, 2, 4]. Таким образом, мaлоугловое paссеяние позволяет исследовать объекты различной физической пpиpоды и в разном агрегатном состоянии, включая наночастицы в аморфной матрице (стекле) или коллоидные частицы (квантовые точки) в растворе [5, 6]. При изучении коллоидных растворов методом малоуглового рассеяния нейтронов следует учитывать, что на ядрах атомов водорода облучающие нейтроны поглощаются атомами водорода и практически не рассеиваются. Поэтому при использовании в качестве растворителя обычной воды дифракционную картину получить практически невозможно. По этой причине для изучения строения коллоидных растворов малоугловым рассеянием нейтронов нужно вместо обычной воды H2O использовать как растворитель тяжелую воду D2O. В ядре атома дейтерия кроме протона присутствует нейтрон, поэтому нейтрон из реактора рассеивается на ядре дейтерия упруго. Действительно, когерентные амплитуды рассеяния атомов водорода и дейтерия различаются между собой по величине и знаку. Это приводит к тому, что плотность когерентных амплитуд рассеяния легкой и тяжелой воды также различается по величине и знаку (–0.56 × 1010 и 6.32 × 1010 см–2 соответственно) [7, 8].
При малоугловом рассеянии нейтронов для изучения тонкой структуры нанообъектов важную роль играет вариация контраста. Использование тяжелой воды изменяет рассеивающий контраст между частицами и растворителем и позволяет изучить неоднородность нанообъектов [7, 9]. Очень важно, что измерения в тяжелой воде позволяют существенно понизить концентрацию изучаемых коллоидных растворов по сравнению концентрацией коллоидных растворов, полученных с использованием обычной (легкой) воды. Малоугловое рассеяние нейтронов охватывает интервал длин волн от 0.1 до 2.0 нм (1–20 Å), что соответствует векторам рассеяния от 1 до 10–6 Å–1 [7]. Такой широкий диапазон векторов рассеяния позволяет изучать коллоидные растворы с очень малой концентрацией наночастиц, определяя их реальную форму (сфера, диск, эллипсоид, призма, цилиндр и т.д.). Знание реальной морфологии сульфидных наночастиц, включая Ag2S, заметно влияющей на их люминесцентные и физические свойства, необходимо для применения этих наночастиц в биологии и медицине, энергонезависимых устройствах памяти [10, 11].
Таким образом, для изучения коллоидных растворов методом малоуглового рассеяния нейтронов нужно использовать коллоидные растворы, полученные на тяжелой воде.
Известно, что растворитель оказывает существенное влияние на скорость протекания химических реакций, что связано, в частности, с величиной диэлектрической проницаемости растворителя. Диэлектрическая проницаемость обычной воды H2O и тяжелой воды D2O при комнатной температуре равна ~81.0 и 78.2 соответственно. Реакции с участием D2O обычно протекают с меньшей скоростью, чем с Н2О, а растворимость солей в тяжелой воде несколько меньше (на 5–10%), чем в обычной воде H2O [12]. Недавно установлена разница стандартных восстановительных потенциалов H2O и D2O при гидротермальном синтезе железосодержащих твердых веществ [13]. Однако влияние тяжелой воды на растворение солей очень мало исследовано.
До настоящего времени большинство исследований методом малоуглового рассеяния нейтронов выполнено на биологических объектах, помещенных в тяжелую воду или, для получения высокого контраста, в смесь легкой и тяжелой воды.
Сульфидные коллоидные растворы на тяжелой воде, пригодные для изучения методом малоуглового рассеяния нейтронов, до настоящего времени никто не получал. Существенным свойством этих коллоидных растворов должна быть их стабильность. В литературе отсутствуют какие-либо сведения о таких коллоидных растворах.
В связи с этим в настоящей работе впервые проведен синтез стабильных коллоидных растворов сульфида серебра с использованием тяжелой воды D2O как растворителя. Потенциально они предназначены для изучения реальной структуры наночастиц с помощью малоуглового рассеяния нейтронов, что недоступно для других методов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Во избежание сильного рассеяния нейтронов ядрами водорода при измерении малоуглового рассеяния были синтезированы коллоидные растворы на основе D2O, а не H2O. Для синтеза коллоидных растворов Ag2S на основе D2O была использована та же методика, что и для синтеза коллоидных растворов на основе H2O, описанная в работе [14]. Коллоидные растворы сульфида серебра Ag2S синтезировали химическим осаждением из водных растворов нитрата серебра Ag NO3, сульфида натрия Na2S и цитрата натрия Na3C6H5O7 ≡ Na3Cit в высокочистой деионизированной тяжелой воде D2O. Содержание D2O в использованной тяжелой воде составляло не менее 99.9 мол. %, примесь легкой воды H2O была менее 0.1 мол. %. Удельная электропроводность тяжелой воды не превышала 0.0005 См/м.
Прозрачные стабильные коллоидные растворы с твердой дисперсной фазой Ag2S (нано-Ag2S) получали методом химического осаждения в тяжелой воде D2O. В качестве исходных растворов использовали растворы сульфида натрия Na2S и нитрата серебра AgNO3 в тяжелой воде с одинаковой концентрацией 50 ммоль/л. Ранее [14] было показано, что реакционные смеси с такой концентрацией пересыщены ионами серебра и серы, поэтому синтез Ag2S проводили в течение очень короткого времени.
Синтез проводили при температуре 298 K в темноте. Цитрат натрия при синтезе играет роль стабилизатора, предотвращающего рост наночастиц. Стабилизирующая роль цитрата натрия при гидрохимическом синтезе наноструктурированного сульфида серебра описана ранее в работе [14]. В водном растворе с частицами Ag2S ионы цитрата закрепляются на поверхности частиц и образуют отрицательно заряженный цитратный слой, препятствующий объединению сульфидных частиц [10, 15–18].
В водных растворах с малым содержанием ионов S2– цитрат натрия может восстанавливать ионы Ag+ с образованием наночастиц металлического серебра [10, 18, 19] и образовывать цитратную оболочку на частицах Ag2S [10, 19–21]. Поэтому для получения коллоидных растворов сульфида серебра без примеси Ag и без цитратной оболочки использовали реакционные смеси с небольшим относительным избытком сульфида натрия Na2S. Синтез проводили в темноте в нейтральной среде при pH ≈ 7 по следующей реакционной схеме:
(1)
$\begin{gathered} 2{\text{AgN}}{{{\text{O}}}_{3}} + \left( {1 + \delta } \right){\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}\xrightarrow{{{\text{N}}{{{\text{a}}}_{{\text{3}}}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{O}}}_{{\text{7}}}}{\text{ }}}} \\ \xrightarrow{{\kern 1pt} }\,\,{\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{S}} \downarrow + \,2{\text{NaN}}{{{\text{O}}}_{3}}, \\ \end{gathered} $Для синтеза использовали предварительно приготовленные на тяжелой воде D2O растворы AgNO3, Na2S и Na3Cit. Синтез проводили в следующей последовательности: к 5 мл раствора нитрата серебра приливали 5 мл раствора цитрата натрия (стабилизатора), затем полученный раствор в течение 1–2 с смешивали с 10 мл раствора Na2S.
Стабильные коллоидные растворы с наночастицами сульфида серебра со средним размером менее 20 нм были получены из реакционных смесей 1–8 с концентрациями нитрата серебра ${{C}_{{{\text{AgN}}{{{\text{O}}}_{{\text{3}}}}}}}$ от 0.3125 до 2.5 ммоль/л (табл. 1). Ранее реакционные смеси с такими же концентрациями реагентов были использованы для синтеза коллоидных растворов Ag2S на обычной воде H2O [14]. Одинаковые по составу реакционные смеси были использованы для сравнения размеров наночастиц Ag2S, синтезированных в водных коллоидных растворах на тяжелой D2O и обычной H2O воде.
Таблица 1.
Состав реакционных смесей и средний размер D наночастиц сульфида серебра в коллоидных растворах
| № | Концентрации реагентов в реакционных смесях, моль/л | D, нм (синтез в D2O) |
D, нм [14] (синтез в H2O) |
|||||
|---|---|---|---|---|---|---|---|---|
| AgNO3 | Na2S | Na3Cit | *DДРС ± 0.5 | **DДРС,ср ± 0.5 | ПЭМ | *DДРС ± 0.5 | ПЭМ | |
| 1 | 0.3125 | 0.165 | 5 | 3.1 | 3.5 | 2–3 | 2.3 | 2–3 |
| 2 | 0.3125 | 0.168 | 2.5 | 4.2 | 5.1 | 3–5 | 2.7 | 2–3 |
| 3 | 0.3125 | 0.170 | 1 | 6.5 | 7.9 | 6–7 | 3.1 | 2–4 |
| 4 | 0.625 | 0.313 | 5 | 8.7 | 10.1 | 8–9 | 4.2 | 3–4 |
| 5 | 0.625 | 0.325 | 3.75 | 10.1 | 10.7 | 8–10 | 5.6 | 5–6 |
| 6 | 2.5 | 1.30 | 1 | 11.7 | 14.2 | 10–12 | 8.0 | 8–10 |
| 7 | 0.625 | 0.330 | 2.5 | 15.7 | 17.3 | 15–16 | 9.2 | 8–10 |
| 8 | 0.625 | 0.335 | 1.25 | 18.7 | 20.0 | 18–20 | 10.0 | 9–11 |
Размер (гидродинамический диаметр DДРС) наночастиц Ag2S и дзета-потенциал ζ непосредственно в коллоидных растворах определяли методом динамического рассеяния света (ДРС) на приборе Zetasizer Nano ZS (Malvern Instruments Ltd) при температуре 298 K. Длина волны He–Ne-лазера составляла 633 нм, угол детектирования обратнорассеянного света равен 173°. Для воспроизводимости результатов рассеяние света и размер частиц в каждом растворе измеряли не менее трех раз. На приборе Zetasizer Nano ZS (Malvern Instruments Ltd) определяли также проводимость синтезированных коллоидных растворов.
Для определения размера наночастиц Ag2S использовали также просвечивающий электронный микроскоп JEOL JEM-2010 с решеточным разрешением 0.14 нм. Элементный химический состав наночастиц Ag2S определяли на этом же микроскопе, оснащенном энергодисперсионным спектрометром Phoenix (EDAX) с Si(Li)-детектором, имеющим разрешение по энергии 130 эВ. Для исследования коллоидные растворы наночастиц Ag2S наносили на медную сетку с диаметром отверстий (ячеек) 50 мкм. Дополнительно на медную сетку наносили один-два слоя углеводородного клея.
Синтезированный коллоидный раствор 6 (табл. 1), содержащий частицы сульфида серебра размером 12–14 нм, был подвергнут сублимационной сушке для выделения нанопорошка, пригодного для рентгенодифракционного изучения. Сублимацию проводили в лиофильной сушилке Alpha 1–2 LDplus (Martin Christ) при температуре ледового конденсатора –55°С (218 K). Рентгенодифракционные измерения нанопорошка проводили в интервале углов 2θ = 18°–64° с шагом Δ(2θ) = 0.03° на дифрактометре Shimadzu XRD-7000 в CuKα1,2-излучении. Время сканирования в каждой точке составляло 20 с. Структуру синтезированного сульфида серебра уточняли с помощью программного пакета X’Pert HighScore Plus [22].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Размерные распределения наночастиц Ag2S в синтезированных коллоидных растворах, измеренные методом ДРС, показаны на рис. 1.
Рис. 1.
Размерные распределения частиц сульфида серебра в коллоидных растворах 1–8, измеренные методом ДРС. Нумерация соответствует табл. 1. Размер D представлен в логарифмических координатах.
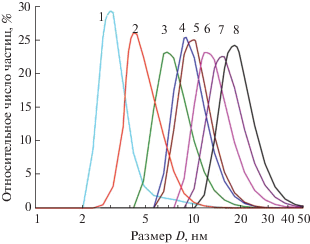
По данным ДРС, размер наночастиц Ag2S в коллоидных растворах 1–8 не превышает 20 нм (рис. 1). Размер частиц, соответствующий максимумам размерных распределений DДРС, составляет от 3 до 19 нм (табл. 1), средний размер DДРС, ср частиц в полученных коллоидных растворах меняется от 3–4 до 20 нм. При увеличении концентрации нитрата серебра в исходных реакционных смесях размер наночастиц Ag2S в синтезированных коллоидных растворах немного растет. Уменьшение концентрации цитрата натрия при прочих равных условиях приводит к уменьшению стабилизирующего эффекта Na3Cit и также сопровождается увеличением размера наночастиц Ag2S.
Размер наночастиц Ag2S в коллоидных растворах, синтезированных на тяжелой воде D2O, немного больше, чем в коллоидных растворах на обычной воде H2O (табл. 1). Это может быть результатом несколько меньшей растворимости цитрата натрия в тяжелой воде по сравнению с обычной водой [9] и, как следствие, небольшим ослаблением стабилизирующего эффекта цитрата натрия. Однако качественное влияние концентрации реагентов на размер наночастиц сульфида серебра в коллоидных растворах, синтезированных с использованием тяжелой воды, такое же, как в коллоидных растворах на обычной воде H2O [14].
ζ-Потенциал квантовых точек или наночастиц в растворе является показателем стабильности системы [23, 24]. Абсолютные значения ±(35 ± ± 15) мВ ζ-потенциала являются признаком электростатической стабильности коллоидных растворов. Частицы с большим отрицательным или положительным поверхностным электрическим зарядом рассматриваются как устойчивые частицы. Измерения методом ДРС показали, что через 100 сут после синтеза ζ-потенциал растворов 1–8 составлял от –28 до –18 мВ, а размер наночастиц был равен 3–19 нм. Большая отрицательная величина ζ-потенциала растворов 1–8 подтверждает их стабильность. Проводимость синтезированных коллоидных растворов составила от 0.067 до 0.108 См/м. Рост проводимости коллоидных растворов по сравнению с использованной тяжелой водой D2O подтверждает наличие в растворах наночастиц с электрическим зарядом. Таким образом, коллоидные растворы сульфида серебра, синтезированные с использованием тяжелой воды D2O, сохранили стабильность и неизменный размер наночастиц после хранения в течение более 100 сут, т.е. имеют такую же высокую стабильность, как и коллоидные растворы, синтезированные в обычной воде.
Просвечивающая электронная микроскопия (ПЭМ) подтвердила малый размер наночастиц Ag2S в синтезированных коллоидных растворах.
ПЭM-изображение наночастиц, содержащихся в коллоидном растворе, полученном из реакционной смеси 3 с минимальной концентрацией цитрата, показано на рис. 2. Размер большинства наночастиц составляет от 6 до 7 нм. Это согласуется с измерениями размерного распределения наночастиц Ag2S в этом растворе методом динамического рассеяния света (рис. 1). Как пример, на вставке к рис. 2 показано HRTEM (ПЭМВР)-изображение наночастицы размером ∼6 нм. На рис. 2 (вставка) хорошо видно межплоскостное расстояние ~0.396 нм, которое совпадает с расстоянием между атомными плоскостями (–102) сульфида серебра с моноклинной (пр. гр. P21/c) структурой типа акантита α-Ag2S [25–27].
Рис. 2.
ПЭМ-изображения коллоидного раствора 3 (табл. 1). На вставке показано HRTEM (ПЭМВР)-изображение наночастицы Ag2S размером ∼6 нм.

Анализ HRTEM-изображения квантовой точки (рис. 2, вставка) подтвердил, что в результате синтеза коллоидного раствора на тяжелой воде действительно образуется моноклинный (пр. гр. P21/c) сульфид серебра со структурой акантита α-Ag2S.
По данным ПЭМ, размер наночастиц сульфида серебра в коллоидном растворе 4 составляет от 8 до 9 нм, а в коллоидном растворе 5 равен 8–10 нм. Более крупные наночастицы сульфида серебра размером до 12, 16 и 20 нм наблюдаются в коллоидных растворах 6, 7 и 8. В целом оценка размеров наночастиц сульфида серебра с помощью просвечивающей электронной микроскопии (табл. 1) подтверждает результаты ДРС измерений размера наночастиц.
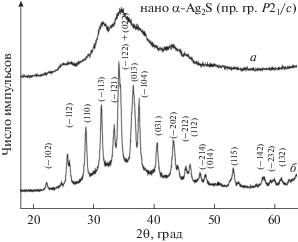
Рентгенограмма нанопорошка сульфида серебра, полученного лиофильной сушкой коллоидного раствора 6 в тяжелой воде D2O (табл. 1), показана на рис. 3. Размер наночастиц Ag2S, по данным ДРС и ПЭМ, составляет ∼12 нм. Дифракционные отражения нанопорошка сильно уширены, и вследствие этого отражения, близкие по положению, перекрываются. Для сравнения на рис. 3 показана рентгенограмма гораздо более крупного нанопорошка моноклинного сульфида серебра с размером частиц ~40–45 нм, осажденного из реакционной смеси AgNO3, Na2S и Na3Cit с концентрациями 50.0, 25.4 и 25.0 ммоль/л соответственно. Количественное уточнение структуры нанопорошка, полученного из коллоидного раствора 6, с помощью программного пакета X’Pert HighScore Plus [22] и сравнение с данными [27] показали, что наблюдаемый набор дифракционных отражений соответствует моноклинному (пр. гр. P21/c) сульфиду серебра со структурой акантита α-Ag2S.
Рис. 3.
Рентгенограмма нанокристаллического сульфида серебра с моноклинной (пр. гр. P21/c) структурой акантита α-Ag2S (а), полученного из коллоидного раствора 6 в тяжелой воде D2O (табл. 1). Для сравнения показана рентгенограмма гораздо более крупного нанопорошка моноклинного сульфида серебра с размером частиц ~40–45 нм (б).
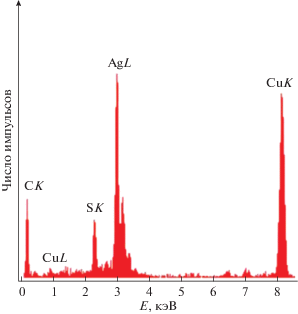
На рис. 4 показан спектр EDX наночастиц Ag2S из коллоидного раствора 6. В спектрах EDX, полученных на просвечивающем электронном микроскопе JEOL JEM-2100, кроме серебра и серы наблюдаются Kα-линии Cu от медной сетки, на которую наносили исследуемые наночастицы, и слабая Kα-линия углерода C от клея (рис. 4). Источником углерода в коллоидных растворах сульфида серебра служит также примесь исходного реактива – цитрата натрия Na3Cit. Раствор цитрата натрия адсорбируется поверхностью наночастиц Ag2S. Согласно данным EDX, в наночастицах сульфида серебра также присутствует примесный кислород, который распределен по поверхности частиц, что выражается в наличии слабой Kα-линии кислорода на 0.525 кэВ. Согласно результатам EDX, за вычетом примесных элементов содержание серебра и серы в синтезированном сульфиде серебра составляет 83.6 ± 0.5 и 12.7 ± 0.2 вес. %, что соответствует сульфиду серебра Ag1.99 ± 0.02S1.00 ± 0.01.
ЗАКЛЮЧЕНИЕ
Впервые коллоидные растворы сульфида серебра синтезированы в тяжелой воде D2O. Синтезированные коллоидные растворы сохраняют стабильность и малый размер наночастиц при хранении в течение более 100 сут. Высокая стабильность коллоидных растворов, синтезированных на тяжелой воде, подтверждается также большой отрицательной величиной их ζ-потенциала.
Изучение коллоидных растворов сульфида серебра, синтезированных на тяжелой воде D2O, методами динамического рассеяния света, просвечивающей электронной микроскопии и рентгеновского энергодисперсионного анализа показало, что при указанных условиях синтеза удалось получить коллоидные растворы с наночастицами сульфида серебра размером от 3 до 19 нм с моноклинной (пр. гр. P21/c) структурой акантита α-Ag2S. Изменение концентрации реагентов в реакционных смесях позволяет регулировать размер наночастиц сульфида серебра в получаемых коллоидных растворах в диапазоне от 2–3 до 20 нм.
Увеличение концентрации нитрата серебра и уменьшение концентрации цитрата натрия в исходных реакционных смесях приводят к небольшому увеличению размеров наночастиц Ag2S в синтезированных коллоидных растворах. Размер наночастиц Ag2S в коллоидных растворах, синтезированных на тяжелой воде D2O, немного (на 1–2 нм) больше, чем в коллоидных растворах на обычной воде H2O. Это служит свидетельством специфики синтеза и стабилизации коллоидных частиц сульфида серебра в тяжелой воде по сравнению с обычной водой. Можно предположить, что различие в размере наночастиц связано с разными свойствами дисперсной среды (тяжелой и обычной воды), в частности, с меньшей растворимостью цитрата натрия в тяжелой воде по сравнению с обычной водой и, вследствие этого, с небольшим ослаблением стабилизирующего эффекта цитрата натрия.
Приготовленные коллоидные растворы пригодны для изучения структуры сульфидных наночастиц методом малоуглового рассеяния нейтронов.
Список литературы
Свергун Д.И., Фейгин Л.А. Рентгеновское и нейтронное малоугловое рассеяние. М.: Физматлит, 1986. 280 с.
Sivia D.S. Elementary scattering theory: for X-ray and neutron users. Oxford: Oxford University Press, 2011. 201 p. https://doi.org/10.1093/acprof:oso/9780199228676.001.0001
Glatter O., Kratky O. Small angle X-ray scattering London: Academic Press, 1982. 515 p.
Ilavsky J., Jemian P.R. // J. Appl. Crystallogr. 2009. V. 42. № 2. P. 347. https://doi.org/10.1107/S0021889809002222
Kuznetsova Yu.V., Rempel A.A., Meyer M. et al. // J. Cryst. Growth. 2016. V. 447. P. 13. https://doi.org/10.1016/j.jcrysgro.2016.04.058
Kuznetsova Yu.V., Rempel A.A. // Russ. J. Phys. Chem. 2017. V. 91. № 6. P. 1105. [Кузнецова Ю.В., Ремпель А.А. // Журн. физ. химии. 2017. Т. 91. № 6. С. 1037.]https://doi.org/10.1134/S0036024417060139
Нозик Ю.З., Озеров З.П., Хенниг К. Структурная нейтронография. М.: Атомиздат, 1979. С. 301.
Балагуров А.М. Дифракция нейтронов для решения структурных и материаловедческих задач. М.: Изд-во Моск. ун-та, 2017. 305 с.
Schmiedel H., Jörchel P., Kiselev M., Klose G. // J. Phys. Chem. B. 2001. V. 105. № 1. P. 111. https://doi.org/10.1021/jp001712e
Sadovnikov S.I., Gusev A.I. // J. Mater. Chem. A. 2017. V. 5. № 34. P. 17676. https://doi.org/10.1039/C7TA04949H
Sadovnikov S.I., Rempel A.A., Gusev A.I. // Russ. Chem. Rev. 2018. V. 87. № 4. P. 303. [Садовников С.И., Ремпель А.А., Гусев А.И. // Успехи химии. 2018. Т. 87. № 4. С. 303.]https://doi.org/10.1070/RCR4803
Sunier A.A., Baumbach J. // J. Chem. Eng. Data. 1976. V. 21. № 3. P. 335. https://doi.org/10.1021/je60070a011
Zhou X., Wang L., Fan X. et al. // Chem. Mater. 2020. V. 32. № 2. P. 769. https://doi.org/10.1021/acs.chemmater.9b04121
Sadovnikov S.I. // Russ. J. Inorg. Chem. 2019. V. 64. № 10. P. 1309. [Садовников С.И. // Журн. неорган. химии. 2019. Т. 64. № 10. С. 1116.]https://doi.org/10.1134/S0036023619100115
Chen R., Nuhfer N.T., Moussa L. et al. // Nanotechnology. 2008. V. 19. № 45. Paper 455604. https://doi.org/10.1088/0957-4484/19/45/455604
Xiong S., Xi B., Zhang K. et al. // Sci. Rep. 2013. V. 3. P. 2177. https://doi.org/10.1038/srep02177
Zhang W., Zhang L., Hui Z. et al. // Solid State Ionics. 2000. V. 130. № 1-2. P. 111. https://doi.org/10.1016/S0167-2738(00)00497-5
Lee P.C., Meisel D. // J. Phys. Chem. 1982. V. 86. № 17. P. 3391. https://doi.org/10.1021/j100214a025
Tang A., Wang Yu., Ye H. et al. // Nanotechnology. 2013. V. 24. № 35. P. 355602. https://doi.org/10.1088/0957-4484/24/35/355602
Sadovnikov S.I., Gusev A.I., Gerasimov E.Yu., Rempel A.A. // Chem. Phys. Lett. 2015. V. 642. P. 17. https://doi.org/10.1016/j.cplett.2015.11.004
Sadovnikov S.I., Gusev A.I., Gerasimov E.Yu., Rempel A.A. // Inorg. Mater. 2016. V. 52. № 5. P. 441. [Садовников С.И., Гусев А.И., Герасимов Е.Ю., Ремпель А.А. // Неорган. материалы. 2016. Т. 52. № 5. С. 487.]https://doi.org/10.1134/S0020168516050149
X’Pert HighScore Plus. Version 2.2e (2.2.5). PANalytical. B.V. Almedo, the Netherlands.
Hunter R.J. Zeta Potential in Colloid Science: Principles and Applications. London: Academic Press, 1988.
Kuznetsova Yu.V., Kazantseva A.A., Rempel A.A. // Russ. J. Phys. Chem. 2016. V. 90. № 4. P.864. [Кузнецова Ю.В., Казанцева А.А., Ремпель А.А. // Журн. физ. химии. 2016. Т. 90. № 4. С. 625.]https://doi.org/10.1134/S0036024416040154
Sadanaga R., Sueno S. // Mineralog. J. (Jap.) 1967. V. 5. № 2. P. 124.
Blanton T., Misture S., Dontula N., Zdzieszynski S. // Powder Diffraction. 2011. V. 26. № 2. P. 114. https://doi.org/ https://doi.org/10.1154/1.3583564
Sadovnikov S.I., Gusev A.I., Rempel A.A. // Phys. Chem. Chem. Phys. 2015. V. 17. № 19. P. 12466. https://doi.org/10.1039/C5CP00650C
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии