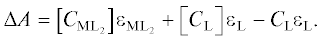Журнал неорганической химии, 2020, T. 65, № 1, стр. 117-123
Устойчивость комплексов Co(III), Ni(II), Cu(II) с 2-фуран- и 2-тиофенкарбогидразонами пиридоксаль-5-фосфата в нейтральном водном растворе
М. Н. Завалишин a, *, Г. А. Гамов a, А. Ю. Хохлова a, А. В. Гашникова a, В. А. Шарнин a
a Ивановский государственный химико-технологический университет
153000 Иваново, пр-т Шереметевский, 7, Россия
* E-mail: zavalishin00@gmail.com
Поступила в редакцию 02.04.2019
После доработки 30.04.2019
Принята к публикации 17.06.2019
Аннотация
Комплексообразование ионов никеля(II), кобальта(III) и меди(II) с 2-фуран- и тиофен-2-карбогидразонами пиридоксаль-5-фосфата в водном растворе исследовано спектрофотометрическим методом. Определен стехиометрический состав и условные константы устойчивости комплексов при pH 7.4, T = 298.2 K и I = 0.25 моль/л. Исследованные координационные соединения в водном растворе включают один ион металла и две молекулы лиганда. Для двухзарядных катионов металлов условные константы устойчивости $\lg \beta _{2}^{'}$ находятся в интервале 10.4–11, для иона Co(III) – 14.7–15.2. Установлено, что влияние природы гидразидного остатка на устойчивость комплексов ионов d-металлов с гидразонами невелико. Дан предварительный анализ возможности использования изученных гидразонов в качестве индикаторов наличия ионов Co(III), Ni(II) и Cu(II) в растворе.
ВВЕДЕНИЕ
Ионы тяжелых металлов являются распространенными загрязнителями почвы и воды [1–4]. Определение ионов тяжелых металлов в почве и воде является важной практической проблемой. Расширение спектра соединений, чувствительных к присутствию тяжелых металлов в растворе, представляет большой интерес. Гидразоны, способные связывать ионы металлов в устойчивые координационные соединения, привлекают внимание исследователей [5–8] и могут быть использованы в качестве индикаторов ионов металлов [9, 10]. Как было недавно установлено, гидразоны – производные пиридоксаль-5'-фосфата (PLP) и пиридинкарбогидразидов – являются эффективными хелатирующими лигандами по отношению к ионам Ni(II), Co(III) [11] и Cu(II), Zn(II) [12]. Изменение гидразидсодержащего фрагмента молекулы может повлиять на ее координационные свойства. Поэтому целью настоящей работы является изучение комплексов, образованных ионами никеля(II), кобальта(III) и меди(II) с 2-фуроил- и тиофен-2-карбогидразонами пиридоксаль-5-фосфата (PLP-2FH и PLP-T2H соответственно), а именно: определение их состава, степени окисления иона металла и констант устойчивости координационных соединений в водном растворе при Т = 298.2 K, рН 7.4 и I = 0.25 моль/л.
Известно несколько работ, посвященных исследованию комплексообразования гидразонов пиридоксаля и его аналогов в водном растворе. Установлено, что основания Шиффа пиридоксаль-5-фосфата и 5-деоксипиридоксаля с фенилглицином образуют координационные соединения состава 1 : 1 и 1 : 2 с ионами Mn2+, Co2+, Ni2+, Cu2+ и Zn2+ [13]. Указано, что лиганд взаимодействует с ионом металла, предположительно, через карбоксильную и иминную группы основания Шиффа. Определен состав равновесных смесей лиганда и его координационных соединений в зависимости от величины pH. Аналогично исследованы координационные соединения оснований Шиффа пиридоксаль-5-фосфата c 2-амино-3-фосфонопропионой кислотой с ионами Al3+ и Ga3+ [14].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гидразоны, образованные пиридоксаль-5-фосфатом и гидразидами 2-фуранкарбоновой и тиофен-2-карбоновой кислот (рис. 1) были синтезированы по методике [15]. Отсутствие примесей контролировали при помощи ЯМР 1H спектроскопии.
Рис. 1.
Гидразоны – производные пиридоксаль-5-фосфата и гидразидов 2-фуранкарбоной (а) и тиофен-2-карбоновой (б) кислот.
Соединения Co(NO3)2 ⋅ 6H2O, Ni(NO3)2 ⋅ 6H2O (Реахим, Россия) и Cu(NO3)2 ⋅ 6H2O (Acros Organics, США) были перекристаллизованы из воды и высушены на воздухе до постоянной массы. Буферные растворы с pH 7.4 были приготовлены из Na2HPO4 ⋅ 12H2O и NaH2PO4 ⋅ 2H2O (ООО “Спектр-Хим”, Россия) марки “х. ч.”. Кислотность буферных растворов контролировали потенциометрически.
Все растворы были приготовлены на бидистиллированной воде (κ = 1.7 мкСм/см, pH 6.6). Значение ионной силы среды (I = 0.25 моль/л), близкое к физиологическому значению в красных кровяных тельцах [16], создавалось за счет компонентов буферной смеси.
Электронные спектры поглощения (ЭСП) растворов гидразонов PLP-2FH и PLP-T2H с концентрацией (1.00 ± 0.05) × 10–4 моль/л, а также смесей гидразонов и катионов металлов (Cгидр = = (1.00 ± 0.05) × 10–4 моль/л, CCo = (5–150) × × 10–6 моль/л, CNi = (7.5–150) × 10–6 моль/л, CCu = (5–150) × 10–6 моль/л) регистрировали на спектрофотометре Shimadzu UV 1800 в диапазоне длин волн 190–500 нм и оптической плотности 0–2.2. Использовали кварцевые кюветы с толщиной поглощающего слоя 1 см. Погрешность определения длины волны не превышала 0.5 нм, точность измерения оптической плотности была равна ±0.003 ед. Температуру поддерживали на уровне 298.2 ± 0.1 K при помощи внешнего термостатирования.
Константы устойчивости гидразонов PLP-2FH и PLP-T2H металлокомплексов определяли из UV-Vis спектров серий из 8–10 растворов с соотношением концентраций металл : гидразон, изменяющимся от 10 : 1 до 1 : 1. Расчет проводили по экспериментальным зависимостям оптической плотности при 3–5 длинах волн от соотношения начальных концентраций реагентов. Для обработки спектральных данных использовали программу FTMT [17]. С целью проверки надежности значений полученных констант осуществляли эксперимент, в котором соотношение концентраций металл : гидразон изменялось от 1 : 10 до 1 : 1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Гидразоны пиридоксаля и его витамеров являются тридентатными лигандами по данным рентгеноструктурного анализа [18–20]. В комплексообразовании с ионом металла принимают участие гидроксильная группа в положении остатка пиридоксаля, атом азота (=N–) и карбонильная группа гидразида или амина [18–20]. Вероятно, основания Шиффа PLP-2FH и PLP-T2H образуют комплексы похожим образом. Таким образом, с одним ионом d-металла могут связываться одна или две молекулы гидразона.
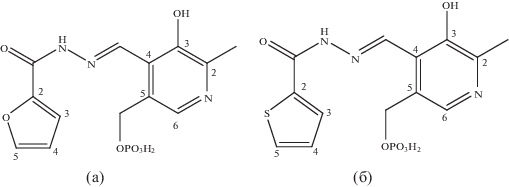
Для определения стехиометрического состава образующихся координационных соединений были использованы зависимости оптической плотности при максимуме поглощения свободного лиганда и комплекса от отношения начальных концентраций металл : лиганд [21] (рис. 2). Из полученных результатов следует, что во всех случаях образуются координационные соединения состава ML2.
Рис. 2.
Зависимости оптической плотности при разных длинах волн от начального соотношения металл : : лиганд: а – Ni : PLP-T2H, б – Co : PLP-2FH, в – Cu : : PLP-2FH.
Ион кобальта(II) имеет электронную конфигурацию 3d7 и в зависимости от лиганда может находиться в низкоспиновом или высокоспиновом состоянии [22]. В низкоспиновом состоянии ион кобальта(II) способен легко отдавать неспаренный электрон в присутствии окислителей.
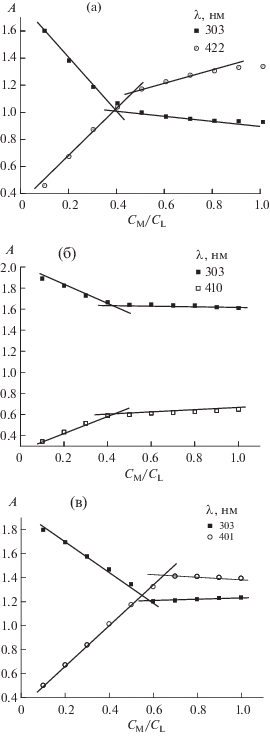
В течение 3–4 ч после приготовления раствора смеси Co2+ и любого гидразона (PLP-2FH или PLP-T2H) в ЭСП происходят изменения (рис. 3). Наблюдаемым изменениям спектра может быть дано следующее объяснение. В начале эксперимента образуется комплекс кобальта Co(II). Ион металла находится в низкоспиновом состоянии и легко может окисляться кислородом, растворенным в воде. Ион кобальта(III) подвержен гидролизу в большей степени, чем Co(II), и координационное соединение частично разрушается, его выход понижается со временем.
Рис. 3.
Изменение спектра смеси Co2+ (7.5 × 10–5 моль/л) и гидразона PLP-T2H (10–4 моль/л). Выдержка между двумя спектрами 10 мин. Пунктиром показан спектр с выдержкой 24 ч.
Кроме того, нами [11] на основании данных ЯМР 1Н и UV-Vis было доказано, что ионы кобальта в комплексах гидразонов пиридоксаль-5-фосфата имеют степень окисления +3.
В присутствии даже небольшого количества окислителя (несколько капель 3%-ного водного раствора H2O2) изменения, показанные на рис. 3, происходят практически мгновенно.
Рис. 4.
Электронный спектр поглощения смеси Co3+ (${{C}_{{{\text{C}}{{{\text{o}}}^{{3 + }}}}}}$ = 5 × 10–6 моль/л) и PLP-T2H (CL = 5 × × 10‒5 моль/л) с ${{C}_{{{{{\text{H}}}^{{\text{ + }}}}}}}$ = 9.2 × 10–2 моль/л (1), ${{C}_{{{\text{PO}}_{4}^{{3 - }}}}}$ = = 7.8 × 10–2 моль/л (2), ${{C}_{{{{{\text{H}}}^{{\text{ + }}}}}}}$ = 4.6 × 10–2 моль/л, ${{C}_{{{\text{PO}}_{4}^{{3 - }}}}}$ = = 3.8 × 10–2 моль/л.
В ЭСП растворов комплексов Ni(II) и Cu(II) не происходит изменений во времени. Это означает, что никель и медь не изменяют свою степень окисления в комплексах с PLP-2FH и PLP-T2H.
Учитывая экспериментальные сложности при исследовании металлокомплексов гидразонов пиридоксаль-5-фосфата, как и в предыдущих работах [11, 12], мы определяли условную константу устойчивости βʹ комплексов Co(III), Ni(II) и Cu(II) с гидразонами PLP-2FH и PLP-T2H:
(1)
${\beta }{\kern 1pt} ' = \frac{{\left[ {{\text{ML}}_{x}^{'}} \right]}}{{\left[ {\text{M}} \right]{{{\left[ {{\text{L}}{\kern 1pt} {\text{'}}} \right]}}^{x}}}},$(2)
$\left[ {{\text{L}}{\kern 1pt} '} \right] = \left[ {\text{L}} \right] + \left[ {{\text{LH}}} \right] + \left[ {{\text{L}}{{{\text{H}}}_{2}}} \right] + \ldots + \left[ {{\text{L}}{{{\text{H}}}_{5}}} \right],$(3)
$\begin{gathered} \left[ {{\text{ML}}_{x}^{'}} \right] = \left[ {{\text{M}}{{{\text{L}}}_{x}}} \right] + \left[ {{\text{M}}{{{\text{L}}}_{x}}{\text{H}}} \right] + \\ + \,\,\left[ {{\text{M}}{{{\text{L}}}_{x}}{{{\text{H}}}_{2}}} \right] + \ldots + \left[ {{\text{M}}{{{\text{L}}}_{x}}{{{\text{H}}}_{{5x}}}} \right]. \\ \end{gathered} $Для удобства чтения заряды частиц опущены.
Величина βʹ зависит от рН среды. Применение буферного раствора гарантирует постоянный состав частиц. С другой стороны, величина βʹ не должна зависеть от концентрации побочных лигандов, взаимодействующих с металлом. Следовательно, нужно учитывать все побочные процессы с участием иона металла при расчете констант равновесия (табл. 1) [11, 12].
Таблица 1.
Побочные процессы, протекающие в системе, содержащей фосфатный буфер, ионы никеля(II), кобальта(III) или меди(II) и гидразоны PLP-2FH и PLP-T2H
| Процесс | lg K | Источник |
|---|---|---|
| H+ + P${\text{O}}_{4}^{{3 - }}$ ↔ HP${\text{O}}_{4}^{{2 - }}$ | 11.48 (I = 0.2) | [23] |
| 2H+ + P${\text{O}}_{4}^{{3 - }}$ ↔ H2P${\text{O}}_{4}^{ - }$ | 18.11 (I = 0.2) | [23] |
| 3H+ + P${\text{O}}_{4}^{{3 - }}$ ↔ H3PO4 | 19.97 (I = 0.2) | [23] |
| Ni2+ + H2O ↔ NiOH+ + H+ | –9.76 (I = 0.2) | [24, с. 645] |
| Co3+ + H2O ↔ CoOH2+ + H+ | –1.92 (I = 1.0) | [24, с. 632] |
| Cu2+ + H2O ↔ CuOH+ + H+ | –7.83 (I = 0.15) | [24, с. 668] |
| Ni2+ + H+ + P${\text{O}}_{4}^{{3 - }}$ ↔ NiHPO4 | 13.59 (I = 0.1) | [25] |
| Ni2+ + 2H+ + P${\text{O}}_{4}^{{3 - }}$ ↔ NiH2P${\text{O}}_{4}^{ + }$ | 18.65 (I = 0.1) | [25] |
| Cu2+ + H+ + P${\text{O}}_{4}^{{3 - }}$ ↔ CuHPO4 | 14.78 (I = 0.1) | [23] |
| Cu2+ + 2H+ + P${\text{O}}_{4}^{{3 - }}$ ↔ CuH2P${\text{O}}_{4}^{ + }$ | 19.25 (I = 0) | [23] |
| Cu2+ + 2H+ + 2P${\text{O}}_{4}^{{3 - }}$ ↔ CuH2P${\text{O}}_{4}^{{2 - }}$ | 27.66 (I = 0.1) | [23] |
| Cu2+ + 4H+ + 2P${\text{O}}_{4}^{{3 - }}$ ↔ CuH2PO4 | 38.12 (I = 0.1) | [23] |
| PLP-2FH + H2O ↔ продукты гидролиза | –4.21 (I = 0.25) | [15] |
| PLP-T2H + H2O ↔ продукты гидролиза | –4.64 (I = 0.25) | [15] |
Отсутствие взаимодействия Co3+ с фосфат-ионами в условиях нашего эксперимента подтверждается отсутствием различий между спектрами поглощения растворов, содержащих равные начальные концентрации Co(III) и гидразона PLP-2FH, но различные начальные концентрации ионов H+ и ${\text{PO}}_{4}^{{3 - }}$ (рис. 4).
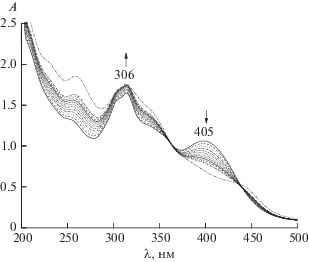
Процессы 1–4, 7–8, 13 или 14 в зависимости от гидразона в случае иона Ni2+, процессы 1–3, 5, 13 или 14 для иона Co3+, процессы 1–3, 6, 9–12, 13 или 14 в случае иона Cu2+ наряду с целевым процессом комплексообразования металла с гидразоном, стехиометрия которого предварительно была определена, закладывали в расчетную схему программы FTMT [12]. Для расчета в программе использовали экспериментальные зависимости оптической плотности от начальной концентрации реагентов при трех длинах волн. Первая длина соответствует электронному переходу в сопряженной π–π–p–π-электронной системе свободного лиганда, вторая и третья – коротко- и длинноволновому максимумам координационного соединения соответственно. Пример экспериментальных данных показан на рис. 5. При изучении комплексообразования кобальта все растворы выдерживали минимум 4 ч. Перед проведением эксперимента проверяли полноту окисления Co2+ → Co3+ по контрольному раствору, содержащему 10–4 моль/л гидразона и 7.5 × 10–5 моль/л нитрата кобальта.
Рис. 5.
Электронные спектры поглощения смесей Ni2+ + PLP-2FH (а) и Cu2+ + PLP-T2H (б), C0(M) + C0(L), моль/л: 10–5 + 10–4 (1); 2 × 10–5 + 10–4 (2); 3 × × 10–5 + 10–4 (3); 4 × 10–5 + 10–4 (4); 5 × 10–5 + 10–4 (5); 6 × 10–5 + 10–4 (6); 7 × 10–5 + 10–4 (7); 8 × 10–5 + + 10–4 (8); 9 × 10–5 + 10–4 (9); 10–4 +10–4 (10).
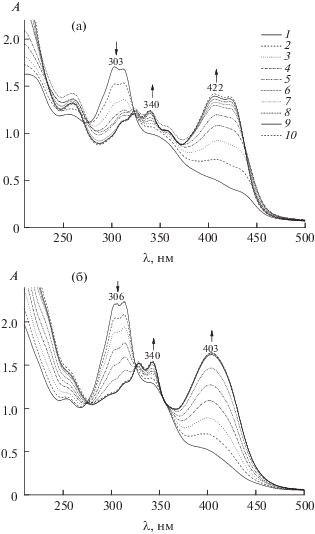
Результаты определения условных констант комплексообразования Ni2+, Co3+, Cu2+ с гидразонами PLP-2FH и PLP-T2H приведены в табл. 2. Погрешности в табл. 2 представляют собой полуширину доверительного интервала с вероятностью 0.95 и размером выборки 3–5 экспериментов (количество параллельных экспериментов указано для каждого случая).
Таблица 2.
Условные константы устойчивости комплексов никеля(II), кобальта(III), меди(II) с гидразонами PLP-2FH и PLP-T2H в водном растворе при T = = 298.2 K, рН 7.4 и I = 0.25 М
| M | L | lg$\beta _{2}^{'}$ | Число параллельных экспериментов |
|---|---|---|---|
| Ni2+ | PLP-2FH | 10.5 ± 0.2 | 4 |
| PLP-T2H | 10.7 ± 0.3 | 3 | |
| Co3+ | PLP-2FH | 14.8 ± 0.1 | 5 |
| PLP-T2H | 15.2 ± 0.3 | 4 | |
| Cu2+ | PLP-2FH | 10.7 ± 0.2 | 4 |
| PLP-T2H | 11.0 ± 0.1 | 5 |
Гидразоны PLP-2FH и PLP-T2H имеют практически одинаковую способность по отношению к ионам Ni2+, Co3+ и Cu2+. Однако гидразон PLP-T2H образует более прочные координационные соединения (в среднем на 0.4 лог. ед.) по сравнению с гидразоном PLP-2FH. Вероятно, это можно объяснить различным влиянием гетероатомов кислорода и серы пятичленных циклов на реакционную способность и конформационные свойства гидразонов. Похожие значения констант устойчивости были получены нами для гидразонов, образованных пиридоксаль-5-фосфатом и пиридинкарбогидразидами [11, 12].
При комплексообразовании оснований Шиффа PLP-2FH и PLP-T2H с ионами никеля(II), кобальта(III) и меди (II) наблюдается значительный батохромный сдвиг. Например, при взаимодействии PLP-T2H с ионом Cu2+ происходит смещение максимума поглощения от 306 до 403 нм. Причиной данного явления является появление в спектре полосы d → π*-перехода. Ион d-металла встраивается в главную систему сопряжения двойных связей лиганда [26]. Таким образом, гидразоны PLP-2FH и PLP-T2H, изменяющие цвет при комплексообразовании со светло-желтого на желто-зеленый, могут рассматриваться в качестве комплексонометрических индикаторов.
Эти изменения могут быть более надежно зарегистрированы спектрофотометрически. Для примера рассмотрим следующие концентрации: CM = 10–5 моль/л, CL = 5 × 10–5 моль/л. Молярные коэффициенты светопоглощения для длинноволновых пиков лиганда и металлокомплекса рассчитаны в программе FTMT (табл. 3). Равновесный состав смеси лиганда с ионами металла определен в программе KEV [27] при pH 7.4. Прирост оптической плотности при фиксированной длине волны при комплексообразовании определяется разницей между оптической плотностью смеси металла с лигандом и свободным лигандом.
Таблица 3.
Коэффициенты экстинкции, равновесные концентрации PLP-2FH, PLP-T2H и их металлокомплексов с ионами Ni2+, Co3+, Cu2+ в водном растворе при pH 7.4
| Комплекс, λ, нм |
εML2 × 10–3 | εL × 10–3 | [CL] × 10–5, моль/л | [CML] × 10–6, моль/л | ΔA* |
|---|---|---|---|---|---|
| Ni2FH, 422 | 31.4 ± 0.2 | 1.3 ± 0.1 | 3.07 | 9.63 | 0.277 |
| NiT2H, 409 | 28.3 ± 0.2 | 1.9 ± 0.2 | 3.04 | 9.79 | 0.239 |
| Co2FH, 410 | 14.6 ± 0.1 | 2.4 ± 0.1 | 3.59 | 7.06 | 0.070 |
| CoT2H, 405 | 14.6 ± 0.1 | 2.5 ± 0.1 | 3.30 | 8.48 | 0.081 |
| Cu2FH, 401 | 60.0 ± 1.0 | 2.5 ± 0.2 | 3.07 | 9.72 | 0.537 |
| CuT2H, 403 | 45.6 ± 1.4 | 0.9 ± 0.7 | 3.03 | 9.85 | 0.430 |
При той же концентрации гидразонов CL = 5 × × 10–5 моль/л возможно обнаружение ионов меди(II) с $C_{{{\text{Cu}}}}^{{2 + }}$ = 10–6 моль/л. В этом случае прирост оптической плотности составит 0.055 для PLP-2FH и 0.043 для PLP-T2H.
ЗАКЛЮЧЕНИЕ
И сследовано комплексообразование ионов никеля(II), кобальта(III) и меди(II) в водном растворе при рН 7.4 и T = 298.2 K. Установлено, что все координационные соединения имеют стехиометрию 1 : 2. При комплексообразовании кобальт в начальный момент времени имеет степень окисления +2, в дальнейшем он окисляется до кобальта(III). Степень окисления меди(II) и никеля(II) не изменяется при комплексообразовании. Определены условные константы устойчивости комплексов Ni2+, Co3+, Cu2+ с гидразонами PLP-2FH, PLP-T2H при рН 7.4, T = 298.2 K и I = 0.25 М. Природа гидразидного остатка в основании Шиффа не оказывает существенного влияния на устойчивость металлокомплекса. Вследствие гидролиза ионы кобальта(III) относительно слабо связываются исследованными гидразонами. Оценена принципиальная возможность использования гидразонов в качестве индикаторов присутствия ионов тяжелых металлов в водном растворе.
Список литературы
Kasimov N., Kosheleva N., Gunin P. et al. // Environ. Earth Sci. 2016. V. 75. P. 1283. https://doi.org/10.1007/s12665-016-6088-1
Vodyanitskii Yu.N., Savichev A.T. // Water Air Soil Pollut. 2014. V. 225. P. 1911. https://doi.org/10.1007/s11270-014-1911-3
Zhulidov A.V., Robarts R.D., Pavlov D.F. et al. // Environ. Monit. Assess. 2011. V. 181. P.539. https://doi.org/10.1007/s10661-010-1848-y
Xu L., Yan W., Jiang F. et al. // J. Coast Conserv. 2018. V. 22. P. 209. https://doi.org/10.1007/s11852-016-0438-8
Pulya A.V., Seifullina I.I., Skorokhod L.S. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 11. P. 1472. [Пуля А.В., Сейфуллина И.И., Скороход Л.С. и др. // Журн. неорган. химии. 2018. Т. 63. № 11. С. 1472.] https://doi.org/10.1134/S003602361811013X
Bulhaca I., Danilescua O., Rijaa A. et al. // Russ. J. Coord. Chem. 2017. V. 43. № 1. P. 21. [Булхака И., Данилескуа О., Риджаа А. и др. // Журн. коорд. химии. 2017. Т. 43. № 1. С. 23.] https://doi.org/10.1134/S1070328417010018
Meshram U.P., Pethe G.B., Yaul A.R. et al. // Russ. J. Phis. Chem. A. 2017. V. 91. № 10. P. 1877. https://doi.org/10.1134/S0036024417100259
Pulya A.V., Seifullina I.I., Skorokhod L.S. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 1. P. 38. [Пуля А.В., Сейфуллина И.И., Скороход Л.С. и др. // Журн. неорган. химии. 2016. Т. 61. № 1. С. 41.] https://doi.org/10.7868/S0044457X16010207
Su X., Aprahamian I. // Chem. Soc. Rev. 2014. V. 43. № 6. P. 963. https://doi.org/10.1039/c3cs60385g
Suvarapu L.N., Seo Y.K., Baek S.-O. et al. // E-J. Chem. 2012. V. 9. № 6. P. 1288. https://doi.org/10.1155/2012/534617
Gamov G.A., Zavalishin M.N., Khokhlova A.Y. et al. // J. Coord. Chem. 2018. V. 20. P. 3304. https://doi.org/10.1080/00958972.2018.1512708
Gamov G.A., Zavalishin M.N., Khokhlova A.Y. et al. // Russ. J. Gen. Chem. 2018. V. 88. № 7. P. 436. [Гамов Г.А., Завалишин М.Н., Хохлова А.Ю. и др. // Журн. общ. химии. Т. 88. № 7. С. 1144.] https://doi.org/10.1134/S1070363218070149
Shanbhag V.M., Martell A.E. // Inorg. Chem. 1990. V. 29. № 5. P. 1023. https://doi.org/10.1021/ic00330a023
Szpoganicz B., Martell A.E. // Inorg. Chem. 1986. V. 25. № 3. P. 327. https://doi.org/10.1021/ic00223a019
Gamov G.A., Khodov I.A., Belov K.V. et al. // J. Mol. Liq. 2019. V. 283. P. 825. https://doi.org/10.1016/j.molliq.2019.03.125
Mouat M.F., Manchester K.L. // Compar. Haematol. Int. 1998. V. 8. № 1. P. 58.
Gridchin S.N., Kochergina L.A., Konovalov P.G. // Russ. J. Coord. Chem. 2003. V. 29. № 12. P. 868. [Гридчин С.Н., Кочергина Л.А., Коновалов П.Г. // Журн. кооорд. химии. 2003. Т. 29. № 12. С. 932.] https://doi.org/10.1023/B:RUCO.0000008399.53700.43
Muraškováa V., Szabóa N., Pižla M. et al. // Inorg. Chim. Acta. 2017. V. 461. P. 111. https://doi.org/10.1016/j.ica.2017.02.014
Back F., Oliveira G., Roman D. et al. // Inorg. Chim. Acta. 2014. V. 412. P. 6. https://doi.org/10.1016/j.ica.2013.12.008
Murphy T.B., Johnson D.K., Rose N.J. et al. // Inorg. Chim. Acta. 1982. V. 66. P. 67. https://doi.org/10.1016/S0020-1693(00)85778-3
Filipsky T., Ríha M., Hrdina R. et al. // Bioorg. Chem. 2013. V. 49. P. 1. https://doi.org/10.1016/j.bioorg.2013.06.002
Goodwin H.A. // Top Curr. Chem. 2004. V. 234. P. 23. https://doi.org/10.1007/b95411
Powell K.J., Brown P.L., Byrne R.H. et al. // Pure Appl. Chem. 2013. V. 85. № 12. P. 2249. https://doi.org/10.1351/PAC-REP-13-06-0
Brown P.L., Ekberg C. Hydrolysis of Metal Ions. Wiley-VCH Verlag GmbH & Co., 2016. 952 p.
Taylor R.S., Diebler H. // Bio. Inorg. Chem. 1976. V. 6. № 3. P. 247. https://doi.org/10.1016/S0006-3061(00)80231-8
Степанов Б.И. Введение в химию и технологию органических красителей. М., 1984. 592 с.
Meshkov A.N., Gamov G.A. // Talanta. 2019. V. 198. P. 200. https://doi.org/10.1016/j.talanta.2019.01.107
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии