Журнал неорганической химии, 2020, T. 65, № 1, стр. 124-130
Синтез и термическое восстановление комплексов [NiLn][B10H10] (L = DMF, H2O, n = 6; L = N2H4, n = 3): образование твердых растворов Ni3C1 – xВx
Е. А. Малинина a, Л. В. Гоева a, Г. А. Бузанов a, В. М. Ретивов b, В. В. Авдеева a, *, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова
119991 Москва, Ленинский пр-т, 31, Россия
b Институт химических реактивов и особо чистых химических веществ НИЦ “Курчатовский институт”
107076 Москва, ул. Богородский вал, 3, Россия
* E-mail: avdeeva.varvara@mail.ru
Поступила в редакцию 19.07.2019
После доработки 05.08.2019
Принята к публикации 27.08.2019
Аннотация
Синтезированы и исследованы комплексы никеля(II) состава [NiLn][B10H10] (L = DMF, H2O, n = 6; L = N2H4, n = 3). Изучено термическое восстановление комплексов на воздухе и в инертной атмосфере в диапазоне температур 20–800°С. Комплексы-прекурсоры и продукты их восстановления идентифицированы методами элементного и рентгенофазового анализа, ИК-спектроскопии. В результате физико-химического исследования продукта термолиза комплекса [Ni(DMF)6][B10H10] установлено образование малоизученных твердых растворов состава Ni3C1 –xВx.
ВВЕДЕНИЕ
Многообразие областей практического применения боридов металлов в промышленности и технике в первую очередь обусловлено природой металла, входящего в их состав. Так, высокая жаропрочность некоторых боридов, например диборида циркония [1–5], делает их перспективными компонентами жаропрочных сплавов, особенно композиционных материалов, армированных боридными волокнами или дисперсно-упрочненных боридами. Бориды лантаноидов широко используются в электронике (особенно гексаборид лантана) благодаря их низкой работе выхода электронов, высокой плотности снимаемых токов и стойкости против ионной бомбардировки. Высокая твердость позволяет применять бориды как абразивные материалы, обеспечивающие при обработке пластичных металлов и сплавов более высокую чистоту поверхности, чем шлифование синтетическим алмазом. Высокие абразивные характеристики боридов TiB2, ZrB2, NiB2 и W2B5 сочетаются с их устойчивостью к взаимодействию с обрабатываемыми материалами.
Одной из областей применения боридов металлов, которая активно развивается в последнее время, является получение высокодисперсных составляющих для создания ультравысокотемпературных керамических композиционных материалов на основе борида гафния [6–10].
Никель является одним из самых активных металлов-катализаторов. Его каталитическая активность зависит от степени дисперсности порошка, его чистоты и метода получения. Бориды никеля успешно используются в качестве катализаторов в процессах гидрирования и иных реакциях органического синтеза, в том числе при парциальном (частичном) гидрировании ацетиленов.
В литературе известны различные способы получения боридов металлов: синтез из элементарных металлов и бора, элемент-термическое восстановление (карботермическое, борокарботермическое или магнийтермическое), осаждение из газовой фазы, электролиз расплавленных сред [11].
Наша научная группа проводит многолетние опыты по изучению координационной способности кластерных анионов бора в присутствии металлов различной природы [12–14]. Помимо традиционных областей применения кластерных анионов бора, которые включают их использование для целей борнейтронозахватной терапии [15, 16], их также используют для создания термически стабильных полимеров [17]. Современные направления использования кластерных анионов бора в экстракции радионуклидов, радионуклидной диагностике и терапии, получении нейтронозащитных покрытий и в качестве модуляторов биологически активных соединений описаны в работах [18–21].
Установлена возможность получения комплексных соединений никеля(II) с лигандами [NiL3][BnHn] (L = Bipy, Phen, BPA, DAB [22, 23]) и производными бензимидазола [24]. Для комплексов кобальта(II) [Co(solv)6][B10H10] (solv = DMF, DMSO) показана возможность термического отжига с образованием борид-оксидной и боридной фаз [25, 26]. В работе [27] описан синтез аналогичных комплексов никеля(II) [Ni(solv)6][B10H10] (solv = DMF, DMSO).
В настоящей работе в продолжение исследований проведено термическое восстановление комплексов-прекурсоров состава [NiLn][B10H10], где L = H2O, DMF, n = 6; L = N2H4, n = 3, с целью получения бинарных боридов никеля(II). Прекурсоры и продукты их восстановления идентифицированы методами элементного анализа, РФА и ИК-спектроскопии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Декагидро-клозо-декаборат триэтиламмония (Et3NH)2[B10H10] синтезировали из декаборана-14 через стадию образования 1,6-бис(триэтиламин)декаборана согласно методике [28]. Клозо-декабораты щелочных металлов получали кипячением (Et3NH)2[B10H10] в водном растворе соответствующего гидроксида металла до полного удаления триэтиламина. Из клозо-боратов щелочных металлов путем катионного обмена на сильнокислотном катионите КУ-2 синтезировали кислоту (H3О)2[B10H10] (20%).
Синтез [Ni(H2O)6][B10H10] ⋅ nH2O (I). К 20%-ному водному раствору (H3О)2[B10H10] (50 мл) приливали раствор гидроксида никеля(II) в воде. Полученную смесь перемешивали до полного растворения гидроксида, при этом контролировали рН реакции. Затем нейтральный прозрачный реакционный раствор упаривали на роторном испарителе при 40°С досуха. Выход конечного продукта близок к количественному.
Синтез [Ni(N2H4)3][B10H10] ⋅ nH2O (II). [Ni(H2O)6][B10H10] (3 ммоль) растворяли в 3 молях 65%-ного водного раствора гидразин гидрата (9 ммоль). В результате изотермического упаривания на воздухе из прозрачного реакционного раствора формировался поликристаллический осадок голубого цвета.
Синтез [Ni(DMF)6][B10H10] (III) проводили по методике, описанной в [27]. Данные физико-химических методов анализа (РФА, ИК-спектр, элементный анализ) совпадают с данными, представленными в [27].
| H | N | B | Ni | |
|---|---|---|---|---|
| Найдено для I, %: | 8.09; | 30.75; | 39.56; | 21.44. |
| Вычислено для H22N6B10Ni, %: | 8.12; | 30.78; | 39.60; | 21.50. |
| H | B | Ni | |
|---|---|---|---|
| Найдено для II, %: | 7.71; | 37.88; | 58.89. |
| Вычислено для H22O6B10Ni, %: | 7.78; | 37.94; | 20.60. |
| C | H | N | B | Ni | |
|---|---|---|---|---|---|
| Найдено для III, %: | 35.09; | 8.43; | 13.59; | 17.51; | 9.49. |
| Вычислено для C18H52N6O6B10Co, %: | 35.13; | 8.52; | 13.66; | 17.57; | 9.54. |
Элементный анализ проводили на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba). Содержание бора и никеля определяли методом ICP MS на атомно-эмиссионном спектрометре с индуктивно-связанной плазмой iCAP 6300 Duo. Для проведения анализа образцы высушивали до постоянной массы.
ИК-спектры исходных соединений и продуктов термолиза записывали на ИК-фурье-спектрофотометре Инфралюм ФТ-02 (НПФ АП “Люмекс”, Россия); суспензия в вазелиновом масле (Aldrich), пластинки NaCl, область 4000–400 см–1, разрешение 1 см–1. Отнесение колебательных частот в ИК-спектрах конечных продуктов приведено в табл. 1.
Таблица 1.
Отнесение колебательных частот (ν, δ, см–1) в ИК-спектрах комплексов [NiLn][B10H10], где L = H2O, DMF, n = 6; L = N2H4, n = 3
| Соединение | $\nu {{\left( {{\text{OH}}} \right)}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | ν(NH) | ν(BH) | ν(С=О) | δ(HOH) | δ(HNH) | δ(BBH) |
|---|---|---|---|---|---|---|---|
| I | 3600–3100 | – | 2480 | – | 1648, 1597 | – | 1038 |
| I110 | 3600–3300, ∼3214 | – | 2525, 2463 | – | 1630, 1607 | – | ν(BО) 1110* |
| II | ∼3550 | 3288, 3232 | 2467 | – | 1650 | 1606, 1569 | 980 |
| III | – | – | 2538, 2533, 2521, 2504, 2431 | 1645 | – | – | 1020 |
Рентгенофазовый анализ образцов выполняли на дифрактометре Bruker D8 Advance (CuKα-излучение) в низкофоновых кюветах с подложкой из ориентированного монокристалла кремния в интервале углов 2θ 5°–80° с шагом 0.01125°.
Термогравиметрический анализ образцов осуществляли методом ДСК–ТГА. Образцы прогревали в алундовых тиглях объемом 40–100 мкл в токе аргона высокой чистоты (расход 100 мл/мин); температурный диапазон 20–400, 20–800°С, скорость нагрева образцов 10 град/мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез [NiLn][B10H10] (L = H2O, DMF, n = 6; L = N2H4, n = 3)
В продолжение исследований по получению бинарных боридов из координационных соединений переходных металлов с легко уходящими лигандами [25–27] нами были синтезированы и изучены комплексы состава [NiLn][B10H10], где L = H2O, DMF, n = 6; L = N2H4, n = 3.
Гексааквакомплекс никеля(II) [Ni(H2O)6][B10H10] ⋅ nH2O (I) получали нейтрализацией 20%-ного водного раствора (H3О)2][B10H10] гидроксидом никеля(II).
Координационное соединение [Ni(N2H4)3][B10H10] (II) образуется при взаимодействии [Ni(H2O)6][B10H10] с 65%-ным раствором гидрата гидразина (схема 1).
Комплекс состава [Ni(DMF)6][B10H10] получали в результате взаимодействия солей клозо-декаборатного аниона с NiCl2 ⋅ 6H2O в DMF [27].
Соединения-прекурсоры I–III идентифицировали методами элементного анализа, ИК-спектроскопии и РФА. Были записаны и изучены термограммы прекурсоров на воздухе и в инертной атмосфере в диапазоне температур 20–800°С.
В ИК-спектре комплекса I (табл. 1) в интервале 3600–3100 см–1 присутствует интенсивная широкая полоса валентных колебаний ν(OH) и полоса деформационных колебаний δ(HOH), расщепленная на два максимума, что указывает на наличие в соединении ассоциированных и координированных молекул H2O. Кроме того, в спектре наблюдаются полосы валентных ν(BH) и деформационных колебаний δ(BBH), что соответствует внешнесферному расположению аниона [B10H10]2–. В свою очередь, уширение полосы ν(BH) свидетельствует о наличии специфических взаимодействий (В)Н…Н(О) между ВН-группами аниона [B10H10]2– и ассоциированными или координированными молекулами воды.
На основании ИК-спектра комплекса II можно полагать, что внутренняя координационная сфера атома металла образована бидентатно-координированными молекулами гидразина. В спектре соединения II полосы валентных колебаний связей N–H аминогрупп лежат ниже 3300 см–1 (табл. 1), что характерно для бидентатно-циклической координации молекул гидразина. Подтверждением NH2–NH2 координации является наличие в спектре полосы валентных колебаний ν(NN) средней интенсивности около 960 см–1, которая отсутствует в спектре некоординированных или мостиковых молекул гидразина. Анион [B10H10]2– находится во внешней сфере, однако заметно влияние координированных молекул гидразина или ассоциированных молекул воды на его состояние, поскольку в спектре наблюдается одна уширенная полоса ν(ВН) при 2450 см–1 (табл. 1).
ИК-спектр и строение комплекса III подробно описаны в работах [23, 26].
Для проведения дальнейших исследований образец I высушивали при t = 110°C в течение 1 ч (образец I110). В ИК-спектре полученного образца обнаружены заметные изменения как валентных колебаний ν(OH) молекул воды, так и валентных колебаний ν(BH) аниона [B10H10]2–. В частности, наблюдается снижение интенсивности полосы ν(OH), и в спектре можно выделить две полосы ν(OH) в интервале 3600–3300 см–1, отвечающие колебаниям ассоциированных и координированных молекул воды (табл. 1). Указанные изменения в спектре соответствуют частичному удалению ассоциированной воды при 110°C с сохранением клозо-декаборатного аниона. Следует отметить, что частичное удаление воды из прогретого образца выводит из участия в межмолекулярных контактах анион [B10H10]2–. В спектре I110 проявляется интенсивная полоса валентных колебаний связей бор–водород с четкими максимумами νап(BH) и νэкв(BH), характерная для некоординированного клозо-декаборатного аниона.
Термические свойства синтезированных соединений
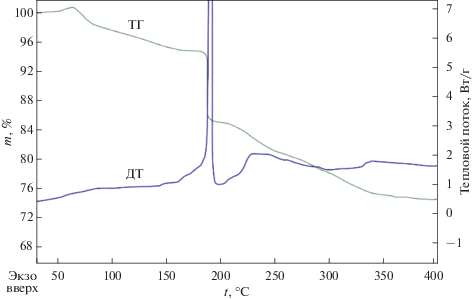
Как видно из рис. 1, на воздухе безводный комплекс II устойчив до 160°С. При нагревании образца до 200°С фиксируется сильный экзотермический эффект, сопровождаемый значительным уменьшением массы образца. Нагревание выше 200°C приводит к термоокислительной деструкции соединения c образованием сложной смеси продуктов окисления. Следует отметить, что термическое разложение Co(II)-содержащего аналога, комплекса [Co(N2H4)3][B10H10], на воздухе происходит иначе [26]. При 120°C на термограмме наблюдается небольшая потеря массы образца, сопровождаемая эндотермическим эффектом и отвечающая удалению ассоциированных молекул воды. Нагревание образца выше 160°C приводит к неконтролируемому выбросу образца в газовую фазу [26]. Сопоставляя полученные данные, можно говорить о том, что формирование борид-нитридной фазы в случае Ni(II)-содержащего прекурсора II будет проходить при более высоких температурах.
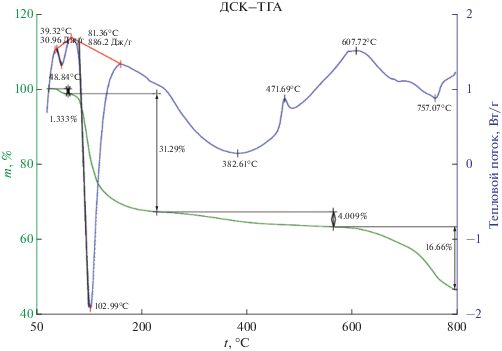
Согласно термограмме комплекса I (рис. 2), основная потеря массы образца с соответствующими эндотермическими эффектами при ∼49 и 102°C соответствует удалению ассоциированных и частично координированных молекул воды. При дальнейшем нагревании образца I в интервале 200–400°C на термограмме наблюдается широкий эндотермический эффект с соответствующей постепенной потерей массы на кривой TГ, что указывает на постепенное удаление оставшихся внутрисферных молекул воды. Дальнейшее повышение температуры в интервале 382–750°C вызывает постепенную деструкцию аниона [B10H10]2–, чему соответствует широкий экзотермический эффект с максимумом при 607°C и потерей массы вплоть до 800°С. На основании полученных результатов можно сделать вывод, что сохранение и постепенное удаление молекул воды при термолизе соединения I вплоть до 400°С при отжиге образца, вероятно, будет препятствовать образованию боридной фазы в чистом виде. В ходе отжига образца в инертной атмосфере следует ожидать формирования бинарных борид-оксидных фаз, близких по составу изученной ранее и образующейся при отжиге в инертной атмосфере комплексов [Со(H2O)6][B10H10] и [Со(DMF)6][B10H10] [25, 26].
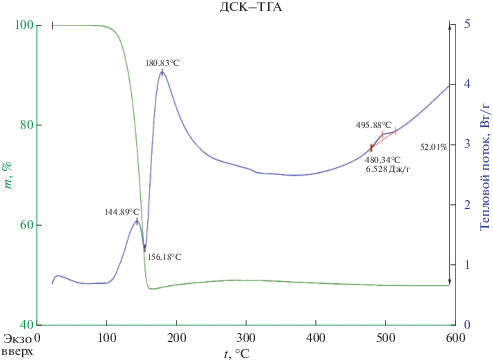
Ввиду низкой термической стабильности комплекса III на воздухе целесообразно привести термограмму комплекса, записанную в аргоне. В аргоне соединение устойчиво до 145°C; при этой температуре на термограмме появляется экзотермический эффект, сопровождаемый приростом массы образца, соответствующий началу горения органической части комплекса. Незначительное повышение температуры до 180°C приводит к дальнейшему разрушению органической части комплекса. Следует отметить, что к этой температуре образец теряет 50% своей массы. Нагревание образца продолжали до 600°C (рис. 3). По окончании эксперимента продукт пиролиза был исследован методами РФА и ИК-спектроскопии.
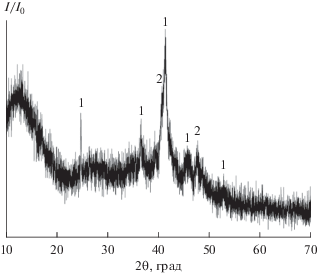
Визуально продукт термолиза ${\text{III}}_{{{\text{аргон}}}}^{{{\text{600}}}}$ представляет собой черный порошок, не претерпевающий превращений на воздухе. По данным РФА, образец представляет собой двухфазную смесь Ni3C и Ni1 – xCx, в которой каждая из фаз слабо окристаллизована. Это может быть вызвано как непродолжительным временем отжига, так и присутствием в твердой фазе аморфного бора, являющегося пространственным препятствием для роста кристаллитов обеих фаз. Рефлексы фаз Ni3C и Ni1 –xCx сдвинуты в сторону меньших значений углов 2θ по сравнению с референсными значениями (рис. 4). Этот факт может служить косвенным доказательством образования твердых растворов Ni3C1 –xВx, которые практически не изучены. Борид-карбидные фазы для ${\text{III}}_{{{\text{аргон}}}}^{{{\text{600}}}}$ не обнаружены. Отметим, что пиролиз аналогичного кобальтсодержащего комплекса [Со(DMF)6][B10H10] практически в тех же условиях (аргон, 650°С) приводит к формированию структурированной борид-оксидной фазы [26].
Рис. 4.
Рентгенограмма продукта пиролиза ${\text{III}}_{{{\text{аргон}}}}^{{{\text{600}}}}$. 1 – фаза Ni3C, 2 – фаза Ni0.98C0.02.
Согласно данным ИК-спектроскопии, продукт термолиза ${\text{III}}_{{{\text{аргон}}}}^{{{\text{600}}}}$ (рис. 5, кривая 3) содержит смешанную металл-оксидную и металл-боридную фазу. В спектре присутствует широкая интенсивная полоса в интервале 1450–1000 см–1 с максимумом около 1400 см–1, относящаяся к валентным колебаниям ν(BО) тетраборатных групп. В пользу этого заключения свидетельствует наличие в спектре полосы валентных колебаний ν(ОН) молекул воды около 3223 см–1, которые легко ассоциируются продуктом термолиза при наличии в нем BO4-групп. Кроме того, в спектре отсутствует полоса ν(BО) при 850 см–1, характерная для оксидов бора B2O3. В области валентных колебаний связей ν(BВ) присутствуют два максимума при 1162 и 1097 см–1, что соответствует наличию боридной фазы в образце. Аналогичные полосы поглощения наблюдаются в спектрах продуктов термолиза соединений кобальта, где установлено наличие борид-оксидной фазы [26] (рис. 5, кривая 2), и в спектре борида гафния (рис. 5, кривая 1).
Рис. 5.
ИК-спектры HfB2 (1) и продуктов термолиза: образца [Со(DMF)6][B10H10], прогретого в аргоне при 650°C (2), и образца ${\text{III}}_{{{\text{аргон}}}}^{{{\text{600}}}}$ (3).
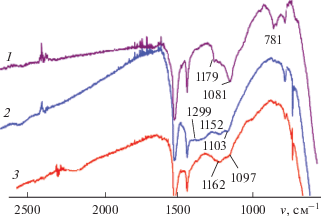
Наличие фаз карбидов никеля в образце ${\text{III}}_{{{\text{аргон}}}}^{{{\text{600}}}}$, которые были обнаружены методом РФА, идентифицировать методом ИК-спектроскопии невозможно, поскольку, как правило, карбиды металлов представляют собой фазы внедрения.
ЗАКЛЮЧЕНИЕ
На основании полученных результатов можно сделать вывод о том, что природа металла существенным образом влияет на процесс термического восстановления и состав продуктов пиролиза. В случае [Ni(DMF)6][B10H10] наряду с оксид-боридной фазой наблюдается образование твердых растворов Ni3C1 –xВx, которые практически не изучены. Для более точного установления возможного состава полученного образца при наличии в нем одновременно структурированной и рентгеноаморфной фаз необходимо дополнительно использовать совокупность физико-химических методов исследования.
Список литературы
Kravchenko S.E., Burlakova A.G., Korobov I.I. et al. // Russ. J. Inorg. Chem. 2016. V. 61. P. 429. https://doi.org/10.1134/S0036023616040112
Simonenko E.P., Simonenko N.P., Sevastyanov V.G. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1772. https://doi.org/10.1134/S003602361814005X
Kravchenko S.E., Torbov V.I., Shilkin S.P. // Russ. J. Inorg. Chem. 2011. V. 56. P. 506. https://doi.org/10.1134/S0036023611040164
Sulyaeva V.S., Shestakov V.A., Rumyantsev Y.M. et al. // Inorg. Mater. 2018. V. 54. P. 133. https://doi.org/10.1134/S0020168518020152
Kravchenko S.E., Burlakova A.G., Domashnev I.A. et al. // Inorg. Mater. 2017. V. 53. P. 804. https://doi.org/10.1134/S002016851708009X
Simonenko E.P., Simonenko N.P., Gordeev A.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 421. https://doi.org/10.1134/S0036023618040186
Simonenko E.P., Simonenko N.P., Papynov E.K. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1. https://doi.org/10.1134/S0036023618010187
Simonenko E.P., Simonenko N.P., Gordeev A.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1484. https://doi.org/10.1134/S0036023618110177
Kosyakov V.I., Shestakov V.A., Kosinova M.L. // Russ. J. Inorg. Chem. 2018. V. 63. P. 822. https://doi.org/10.1134/S0036023618060153
Simonenko E.P., Simonenko N.P., Gordeev A.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1345. https://doi.org/10.1134/S0036023618100170
Matkovich V.I. Boron and Refractory Borides. Berlin: Springer, 1977.
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. P. 1673. https://doi.org/10.1134/S0036023617130022
Malinina E.A., Avdeeva V.V., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2010. V. 55. P. 2148. https://doi.org/10.1134/S0036023610140032
Avdeeva V.V., Malinina E.A., Sivaev I.B. et al. // Crystals. 2016. V. 6. № 60. https://doi.org/10.3390/cryst6050060
Kueffer P.J., Maitz C.A., Khan A.A. et al. // Proceed. Nat. Acad. Sci. 2013. V. 110. P. 6512. https://doi.org/10.1073/pnas.1303437110
Boron Science: New Technologies and Applications / Ed. Hosmane N.S. CRC Press, 2011.
Plesek J. // Chem. Rev. 1992. V. 92. P. 269. https://doi.org/10.1021/cr00010a005
Teixidor F., Viñas C., Demonceau A. et al. // Pure Appl. Chem. 2003. V. 75. P. 1305. https://doi.org/10.1351/pac200375091305
Sivaev I.B., Bregadze V.I. // Organometallic Chem. Res. Perspectives / Ed. Irwin R.P. Nova Publ., 2007. P. 1–59.
Sivaev I.B., Bregadze V.I. // Eur. J. Inorg. Chem. 2009. V. 11. P. 1433. https://doi.org/10.1002/ejic.200900003
Leśnikowski Z.J. // J. Med. Chem. 2016. V. 59. P. 7738. https://doi.org/10.1021/acs.jmedchem.5b01932
Avdeeva V.V., Polyakova I.N., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2016. V. 61. P. 302. https://doi.org/10.1134/S0036023616030037
Goeva L.V., Avdeeva V.V., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1050. https://doi.org/10.1134/S0036023618080089
Avdeeva V.V., Polyakova I.N., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2015. V. 60. P. 817. https://doi.org/10.1134/S0036023615070037
Avdeeva V.V., Polyakova I.N., Vologzhanina A.V. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 9. P. 1125. https://doi.org/10.1134/S0036023616090023
Malinina E.A., Goeva L.V., Buzanov G.A. et al. // Russ. J. Inorg. Chem. 2019. V. 64 (11). P. 1325.
Avdeeva V.V., Polyakova I.N., Goeva L.V. et al. // Inorg. Chim. Acta. 2016. V. 451. P. 129. https://doi.org/10.1016/j.ica.2016.07.016
Knoth W.H., Miller H.C., Sauer J.C. et al. // Inorg. Chem. 1964. V. 3. P. 159.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии