Журнал неорганической химии, 2019, T. 64, № 8, стр. 829-836
Гидротермальный синтез NH4V3O8 в растворах четырех- и пятивалентного ванадия
Н. В. Подвальная 1, *, Г. С. Захарова 1, П. А. Слепухин 2
1 Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
2 Институт органического синтеза УрО РАН
620137 Екатеринбург, ул. Софьи Ковалевской, 22, Россия
* E-mail: podnat@inbox.ru
Поступила в редакцию 06.12.2018
После доработки 18.01.2019
Принята к публикации 15.02.2019
Аннотация
Изучены условия образования и морфология триванадата аммония NH4V3O8, образующегося в смешанных растворах четырех- и пятивалентного ванадия в присутствии различных аммонийсодержащих добавок (NH4Cl, (NH4)2SO4, NH4NO3, CH3COONH4). Установлено, что формирование NH4V3O8 в гидротермальных условиях наблюдается при 180°С, кислотности 2.5 ≤ рН ≤ 8.0 и мольном соотношении V2O5 : VOSO4 ⋅ 3H2O = 2 : 1. Присутствие сульфата ванадила VOSO4 ⋅ 3H2O способствует формированию триванадата аммония, расширяя интервал его образования до слабощелочной среды. Варьирование параметров синтеза, в частности величины рН, приводит к получению частиц NH4V3O8 различной морфологии. Добавки аммонийсодержащих солей способствуют образованию микрокристаллов NH4V3O8 преимущественно в форме пластин различного размера. Впервые получены наночастицы триванадата аммония в виде нанопроволоки с экстремальным отношением l/d ∼ 100.
ВВЕДЕНИЕ
Оксидные соединения ванадия с контролируемыми размером, морфологией и химическим составом вызывают большой интерес благодаря возможности применения в качестве элементов электронных устройств, каталитически активных материалов, химических сенсоров, катодных материалов химических источников тока. Потенциальные возможности использования ванадий-оксидных соединений обусловлены их ионно-электронным типом проводимости, а также широким интервалом варьирования степени окисления ванадия (от +2 до +5).
Известен ряд ванадатов аммония различной структуры и морфологии: NH4V4O10, NH4V3O7, NH4V3O8, (NH4)2V3O8. Ванадат аммония NH4V4O10, или (NH4)0.5V2O5 в зависимости от условий гидротермального метода синтеза может иметь различную морфологию. Ванадат NH4V4O10 с морфологией нанопроволоки, агломерированной в “цветы”, получен из раствора NH4VO3 и H2C2O4 ⋅ 2H2O в присутствии гексаметилентетраамина C6H12N4. Использование титановой фольги в качестве подложки позволяет избежать агломерации нанопроволоки NH4V4O10 [1]. Ванадат NH4V4O10 c морфологией наноремней диаметром 50–200 нм и длиной несколько мкм синтезирован при 180°С из раствора NH4VO3 при рН 1 с использованием додецилбензолсульфоната натрия C12H25C6H4SO3Nа в качестве темплата [2]. Увеличение рН до 2.5 позволяет получать наноремни NH4V4O10 диаметром 80–200 нм и длиной десятки мкм [3]. Ванадат NH4V4O10 образуется также в гидротермальных условиях при взаимодействии пентаоксида ванадия с гидроксидом аммония. В зависимости от рН реакционной массы частицы NH4V4O10 формируются в виде наноремней (рН 3) или наностержней (рН 5). Установлено, что площадь удельной поверхности NH4V4O10 зависит от рН реакционной массы и увеличивается с уменьшением кислотности [4]. (NH4)2V3O8 с морфологией пластин синтезирован автоклавной обработкой NH4VO3 в растворе этанол : вода = 1 : 1 в присутствии полимера Pluronic P 123 [5]. (NH4)2V3O8 с морфологией пластин также может быть получен гидролизом из водного раствора NH4VO3 и VOSO4 ⋅ 3H2O при соотношении компонентов 1 : 2, кислотности реакционной массы 7 ≤ рН ≤ 10 и температуре 80°C [6]. Гидротермальным (4.0 ≤ рН ≤ 5.5, t = 180–200°С, 24 ч) и гидротермально-микроволновым методами (3.5 ≤ рН ≤ 5.0, t = 180–200°С, 20 мин) при взаимодействии NH4VO3 и лимонной кислоты C6Н8О7 синтезирован ванадат NH4V3O7. Установлено, что частицы NH4V3O7 в зависимости от условий синтеза могут иметь морфологию микросфер и нанопластин [7].
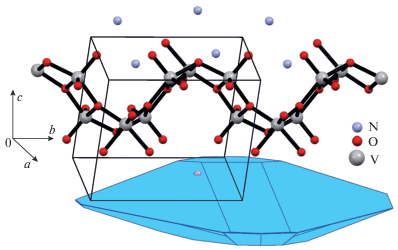
Интерес к триванадату аммония NH4V3O8 возник относительно недавно и обусловлен возможностью использования данного соединения в качестве катодного материала литиевых источников тока [8–10], матрицы энзимных биосенсоров [11], газового сенсора для определения паров аммиака [12]. Соединение NH4V3O8 имеет слоистую структуру, образованную искаженными квадратными VO5-пирамидами и VO6-октаэдрами. Ионы ${\text{NH}}_{{\text{4}}}^{{\text{ + }}}$ расположены между ванадий-кислородными слоями [13]. Атомы водорода группировок ${\text{NH}}_{{\text{4}}}^{{\text{ + }}}$ образуют слабые водородные связи с концевым V=О кислородом [14].
В литературе описано несколько методов синтеза триванадата аммония различной морфологии [15–20]. Традиционно метод гидролитического осаждения используется для получения соединений ванадия из кислых и слабокислых растворов. Так, гидролитическим осаждением из раствора NH4VO3 в присутствии HCl при pH 4.0 и температуре 65°C синтезирован NH4V3O8 с морфологией пластин толщиной 50 нм. При увеличении температуры до 80°C толщина пластин составляет 200−400 нм [15]. Уменьшение рН реакционной массы до 2.0 приводит к формированию наностержней диаметром 30−50 нм и длиной 300−500 нм [10]. Наностержни NH4V3O8 диаметром 60 нм и длиной несколько мкм получены методом гидролитического осаждения из ванадиевого золя при pH 2.0 в присутствии мочевины (V : (NH2)2CO = 2 : 1) [16]. Соединение NH4V3O8 ⋅ ⋅ 0.75H2O с морфологией частиц, подобной ремням, образуется в гидротермальных условиях из раствора метаванадата аммония при pH 1.5 [17]. Cоединение NH4V3O8 ⋅ 0.2H2O с морфологией частиц в виде хлопьев толщиной 150 нм синтезировано автоклавной обработкой раствора метаванадата аммония и додецилсульфата натрия C12H25SO4Nа при 130°С и 2.0 ≤ рН ≤ 3.0 [9]. В присутствии C12H25C6H4SO3Nа в гидротермальных условиях при температуре 180°C и времени процесса 48 ч из раствора метаванадата аммония с pH 4.0 выделены наностержни NH4V3O8 ⋅ 0.37H2O диаметром 30 нм и длиной до 2 мкм [18]. Гидротермальной обработкой метаванадата аммония NH4VO3 (t = = 140°C, 48 ч) в присутствии уксусной кислоты (pH 4) синтезированы микрокристаллы NH4V3O8 с морфологией частиц, подобной ремням длиной 21.3 ± 7.4 мкм, шириной 2−15 мкм, толщиной 600−900 нм [14]. Ли с соавт. с помощью комбинации золь-гель и гидротермального методов синтеза получены наноремни (NH4)2V6O16 ⋅ 1.5H2O в присутствии (NH4)2SO4 [19].
Современный гидротермально-микроволновой метод, позволяющий значительно сократить время синтеза, использован также в ряде работ для синтеза триванадата аммония. Гидротермально-микроволновым методом из раствора NH4VO3 в интервале температур 150−180°C при рН 2.0−5.0 получены микрокристаллы NH4V3O8 с морфологией цветов (pH 2.0, t = 180°С), ремней (pH 3.0, t = = 150°С), хлопьев (pH 4.0, t = 180°С) и пластин (pH 5.0, t = 180°С) [8]. Гидротермально-микроволновой обработкой раствора метаванадата аммония в присутствии уксусной кислоты СН3COOH при температуре 140°C в интервале рН 2.5−3.0 получены микрокристаллы с морфологией цветов размером 20−30 мкм. Увеличение рН до 5.5 позволяет синтезировать NH4V3O8 с морфологией пластин размером 20−30 мкм [20].
Анализ литературных данных показал, что морфология триванадата аммония в основном определяется величиной рН реакционной массы. В большинстве публикаций исследования проводили в кислой и слабокислой области рН. Влияние добавок соединений четырехвалентного ванадия на особенности формирования триванадата аммония не изучено.
Цель настоящей работы – изучение условий образования NH4V3O8 в присутствии ионов четырехвалентного ванадия, позволяющих расширить область его существования. Дополнительно рассмотрено влияние добавок аммонийсодержащих солей на морфологию NH4V3O8.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных веществ использовали пентаоксид ванадия V2O5, гидрат сульфата ванадила VOSO4 ⋅ 3H2O, 10%-ный раствор аммиака NH4OH, 30%-ный раствор пероксида водорода H2O2, 1 М раствор серной кислоты Н2SO4. В качестве аммонийсодержащей добавки использовали хлорид аммония NH4Cl, сульфат аммония (NH4)2SO4, нитрат аммония NH4NO3, ацетат аммония CH3COONH4 марки не ниже “х. ч.”. Синтез NH4V3O8 осуществляли следующим образом: навеску V2O5 растворяли в H2O2, в полученный раствор добавляли расчетное количество VOSO4 ⋅ ⋅ 3H2O и аммонийсодержащую добавку. Мольное соотношение V2O5 : VOSO4 ⋅ 3H2O : соль аммония в зависимости от опыта варьировали как 2 : (0–1) : : (0–1). Кислотность среды изменяли в интервале 2.0 < рН < 8.5. Раствор подвергали гидротермальной обработке в автоклаве при 180°С в течение 24 ч, а затем охлаждали до комнатной температуры. В результате образовывался оранжевый осадок, который отфильтровывали, промывали водой и сушили на воздухе при комнатной температуре.
Исследование морфологии образцов было проведено с помощью сканирующего электронного микроскопа JEOL JSM 6390 LA, совмещенного с энергодисперсионным рентгеновским анализатором EX-23010BU при ускоряющем напряжении 10–15 кВ. Фазовый состав соединений устанавливали по рентгенограммам, снятым на дифрактометре Shimadzu XRD-7000 в CuKα-излучении (λ = 1.5418 Å). Структура полученного соединения подтверждена данными рентгеновского структурного анализа, который проведен на монокристальном рентгеновском дифрактометре Xcalibur 3 (CuKα-излучение, графитовый монохроматор, ω-сканирование с шагом 1° при 295(2) K). Комплектность на углах рассеяния θ < 65.15° равна 99.5%. ИК-спектры образцов, таблетированных с СsJ, регистрировали на ИК-Фурье-спектрометре Vertex 80 в интервале частот 4000−400 см–1. Термический анализ выполнен на термоанализаторе STA 449 F3 Jupite, совмещенном с масс-спектрометром QMS 403 (Netzsch).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
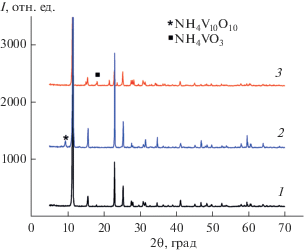
На рис. 1 приведены дифрактограммы порошков NH4V3O8, полученных в гидротермальных условиях при мольном соотношении V2O5 : VOSO4 ⋅ ⋅ 3H2O = 2 : 1 и различных значениях рН. Установлено, что образование однофазного NH4V3O8 происходит в интервале 2.5 ≤ рН ≤ 8.0. Все дифракционные пики индексируются как моноклинная фаза NH4V3O8 (пр. гр. 2P1/m) с параметрами элементарной ячейки: a = 5.006(5), b = 8.419(4), c = = 7.878(8) Å, β = 96.06(9)°, V = 332.022 Å3 и хорошо согласуются с литературными данными (ICSD № 67282). Установлено, что при рН < 2.5 в продуктах реакции в качестве примеси присутствует NH4V4O10. Гидротермальная обработка реакционного раствора при рН > 8.0 приводит к появлению в продуктах реакции NH4VO3 в качестве примеси. Таким образом, впервые триванадат аммония получен при pH 6.0−8.0. Необходимым условием для этого является наличие в реакционном растворе четырехвалентного ванадия в виде VOSO4 ⋅ 3H2O. В отсутствие VOSO4 ⋅ 3H2O в указанном интервале рН NH4V3O8 не образуется. Для подтверждения влияния ионов VO2+ на фазообразование NH4V3O8 проведен опыт, в котором вместо VOSO4 ⋅ 3H2O использовали Н2SO4 (V2O5 : Н2SO4 = = 2 : 1). Согласно результатам рентгенофазового анализа, в выбранных условиях синтеза (pH 7.0) в качестве основной фазы образуется NH4VO3. Очевидно, что использование сульфата ванадила в качестве прекурсора способствует формированию триванадата аммония в нейтральной и слабощелочной области, расширяя интервал его образования. Вероятно, наличие ионов четырехвалентного ванадия VO2+ благоприятно сказывается на протекании поликонденсации ванадий-оксидных звеньев за счет реакций оляции и оксоляции [5].
Формирование NH4V3O8 в присутствии ванадил-ионов можно описать следующими химическими реакциями. На первой стадии при растворении V2O5 в пероксиде водорода образуется красно-коричневая монопероксованадиевая кислота [21]:
(1)
${{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}} + {\text{ 2}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} \to {\text{ 2HV}}{{{\text{O}}}_{{\text{2}}}}\left( {{{{\text{O}}}_{{\text{2}}}}} \right) + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Согласно диаграмме ионного состояния ванадия(V), в растворе при pH 7 в рабочем диапазоне концентраций ванадия последний существует в виде иона ${{{\text{V}}}_{{\text{4}}}}{\text{O}}_{{12}}^{{4 - }}$ [22]. Образование аниона ${{{\text{V}}}_{{\text{4}}}}{\text{O}}_{{12}}^{{4 - }}$ в процессе синтеза можно представить реакцией:
(2)
$\begin{gathered} {\text{HV}}{{{\text{O}}}_{2}}({{{\text{O}}}_{2}}) + {\text{O}}{{{\text{H}}}^{ - }} \to {1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}{{{\text{V}}}_{4}}{\text{O}}_{{12}}^{{4 - }} + \\ + \,\,{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{O}}}_{2}}. \\ \end{gathered} $На второй стадии при добавлении сульфата ванадила и водного раствора аммиака кристаллизация триванадата аммония описывается следующей реакцией:
(3)
$\begin{gathered} {{{\text{V}}}_{{\text{4}}}}{\text{O}}_{{12}}^{{4 - }} + 2{\text{V}}{{{\text{O}}}^{{2 + }}} + 2{\text{N}}{{{\text{H}}}_{4}}{\text{OH}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{O}}}_{2}} \to \\ \to 2{\text{N}}{{{\text{H}}}_{4}}{{{\text{V}}}_{{\text{3}}}}{{{\text{O}}}_{8}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $На рис. 2 представлен ИК-спектр триванадата аммония, полученного при pH 7.0. В области колебаний связей V−O присутствуют четыре основные полосы поглощения. Интенсивные узкие полосы поглощения при 1005 и 968 см–1 обусловлены валентными колебаниями концевых кислородных связей V5+=O в искаженных октаэдрах VO6 и квадратных пирамидах VO5 соответственно. Полоса при 736 см–1 характеризует асимметричные валентные колебания мостиковых связей V−O−V, полоса при 595 см–1 – симметричные и асимметричные валентные колебания двойного мостика [23]:
Рис. 2.
ИК-спектр NH4V3O8, полученного при pH 7.0. Звездочкой обозначены ${\text{NO}}_{3}^{ - }$-ионы в матрице CsJ.
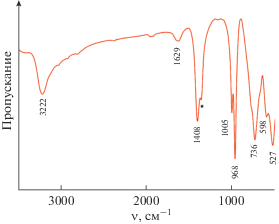
Полоса при 527 см–1 описывает валентные колебания связей V−О кристаллической решетки. Симметричные деформационные колебания ${\text{NH}}_{4}^{ + }$-групп проявляются при 1408 см–1. Широкая интенсивная полоса с максимумом при 3222 см–1 описывает асимметричные валентные колебания ${\text{NH}}_{4}^{ + }$-групп. Кристаллогидратная вода идентифицируется характеристическим пиком при 1629 см–1. Сдвиг этой полосы в высокочастотную область обусловлен образованием водородных связей между молекулами воды и ${\text{NH}}_{4}^{ + }$-группами.
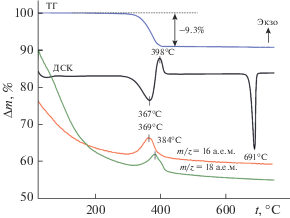
Термический анализ, совмещенный с масс-спектроскопией, позволил оценить термическую стабильность NH4V3O8 (рис. 3). Термолиз NH4V3O8 проходит в одну стадию. Согласно ТГ-кривой, потеря массы (~9.28 мас. %) наблюдается в температурном интервале 297−400°C, сопровождается сильным экзотермическим эффектом с максимумом при 398°C и описывает термическое разложение NH4V3O8 с образованием V2O5. По данным масс-спектроскопии, при этом происходит последовательное выделение аммиака (m/z = 16 a. e. м.) и воды (m/z = 18 a. e. м.). Температуры максимума выделения аммиака и воды равны 369 и 384°C соответственно. Количество кристаллогидратной воды, рассчитанное по ТГ-кривой, равно 1.76 Н2O на одну формульную единицу NH4V3O8, что хорошо согласуется с данными [19]. Незначительное увеличение количества воды можно объяснить влиянием относительной влажности воздуха на состав соединения, приводящей к адсорбции молекул воды. Процесс термолиза триванадата аммония может быть представлен реакцией:
(4)
$\begin{gathered} {\text{2N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{V}}}_{{\text{3}}}}{{{\text{O}}}_{{{\text{8 }}}}} \cdot {\text{1}}.{\text{76}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to \\ \to {\text{3}}{{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{5 }}}}} + {\text{2N}}{{{\text{H}}}_{{\text{3}}}} + {\text{4}}.{\text{52}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}.\quad \\ \end{gathered} $Рис. 3.
Кривые ТГ, ДСК, ионного тока воды (m/z = = 18 a. e. м.) и аммиака (m/z = 16 a. e. м.) порошка NH4V3O8 в атмосфере воздуха.
Электронно-микроскопические исследования показали, что морфология NH4V3O8 зависит от рН реакционного раствора (рис. 4). Частицы NH4V3O8, синтезированные в интервале 2.5 ≤ рН ≤ ≤ 4.0, образуют ансамбли в форме цветов. Размер агломератов NH4V3O8, полученных из растворов с 2.5 ≤ рН < 3.0 и 3.0 < рН ≤ 4.0, составляет 50−75 и 100−150 мкм соответственно (рис. 4а, 4б). Cростки пластинчатых кристаллов в форме цветов образованы пластинами толщиной 2−5 мкм. В интервале 4.0 < рН ≤ 5.0 наблюдается образование NH4V3O8 смешанной морфологии. Наряду с пластинчатыми кристаллами в форме цветов присутствуют протяженные наночастицы шириной 100−400 нм и длиной, достигающей несколько мкм (рис. 4в). В интервале 5.0 < рН ≤ 8.0 порошок NH4V3O8 состоит из кристаллов правильной формы в виде шестиугольников шириной до 100 мкм и длиной до 200 мкм (рис. 4г). При понижении общей концентрации раствора до 1.5 М и pH 4.0 синтезирован NH4V3O8 с морфологией нанопроволоки, характеризующейся экстремальным отношением длины к ширине: l/d ∼ 100 (рис. 4д). Выход продукта с указанной морфологией составил ∼85%. Чистота NH4V3O8 подтверждена рентгеновским энергодисперсионным микроанализом (рис. 4е). В энергетическом спектре присутствуют только линии азота, кислорода, ванадия и углерода, что свидетельствует об отсутствии каких-либо посторонних примесей. Наличие дополнительного пика от углерода обусловлено подложкой, применяемой для фиксации образца.
Рис. 4.
СЭМ-изображения порошков NH4V3O8, полученных при соотношении V2O5 : VOSO4 ⋅ 3H2O = 2 : 1 (а, б, в, г), 1.125 : 0.75 (д) и pH 2.5 (а), 4.0 (б), 5.0 (в), 8.0 (г), pH 4.0 (д), и спектр рентгеновского энергодисперсионного микроанализа NH4V3O8 (е).

Влияние добавок аммонийсодержащих солей на морфологию NH4V3O8 изучено при соотношении компонентов реакционного раствора V2O5 : : VOSO4 ⋅ 3H2O : соль аммония = 2 : 1 : 1 и pH 4.0. Выбор указанной величины рН обусловлен отсутствием примеси метаванадата аммония в продуктах реакции. При увеличении рН реакционного раствора до 5.0−6.0 в присутствии солей аммония в конечном продукте помимо NH4V3O8 в качестве примеси фиксируется NH4VO3. Согласно диаграмме ионного состояния ванадия(V), в растворе при pH 4.0 в рабочем диапазоне концентраций последний существует в виде иона V10O27(OH)5– [22]. Образование аниона V10O27(OH)5– в реакционном растворе описывается реакцией:
(5)
$\begin{gathered} {\text{2HV}}{{{\text{O}}}_{{\text{2}}}}({{{\text{O}}}_{{\text{2}}}}) + {\text{O}}{{{\text{H}}}^{--}} \to \\ \to \,\,{\text{1/5}}{{{\text{V}}}_{{{\text{1}}0}}}{{{\text{O}}}_{{{\text{27}}}}}{{({\text{OH}})}^{{{\text{5}}--}}} + {\text{1}}.{\text{4}}{{{\text{Н }}}_{{\text{2}}}}{\text{O}} + {{{\text{O}}}_{{\text{2}}}}. \\ \end{gathered} $Тогда формирование NH4V3O8 в растворах при pH 4.0 может быть представлено реакцией:
(6)
$\begin{gathered} {{{\text{V}}}_{{{\text{10}}}}}{{{\text{O}}}_{{{\text{27}}}}}{{\left( {{\text{OH}}} \right)}^{{5--}}} + \,\,4{\text{NH}}_{4}^{ + } + \,\,2{\text{V}}{{{\text{O}}}^{{2 + }}} + 3{\text{O}}{{{\text{H}}}^{--}} + \, \\ + \,\,\,1.5{{{\text{O}}}_{2}} \to 4{\text{N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{V}}}_{{\text{3}}}}{{{\text{O}}}_{8}} + \,\,4{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Установлено, что введение (NH4)2SO4 приводит к образованию удлиненно призматических кристаллов NH4V3O8 (преимущественно правильных шестиугольников) длиной 250−300 мкм, шириной 50−150 мкм и толщиной 5−15 мкм. При уменьшении концентрации VOSO4 ⋅ 3H2O в исходном растворе до 0.5 моль/л наблюдается формирование чешуйчатых дендритов (рис. 5а). Добавление к реакционному раствору CH3COONH4 приводит к образованию NH4V3O8 в виде слоистых дендритов длиной 150−200 мкм, шириной 70−100 мкм, толщиной 5−15 мкм (рис. 5б). В присутствии NH4Сl частицы NH4V3O8 имеют смешанную морфологию, состоящую из гексагональных пластин и нанопроволоки (рис. 5в). Использование NH4NO3 в качестве добавки позволяет получать микрокристаллы NH4V3O8 правильной формы в виде шестиугольников длиной до 300 мкм, шириной 70−120 мкм и толщиной 15−25 мкм (рис. 5г). Таким образом, введение в реакционный раствор добавок аммонийсодержащих солей приводит к формированию частиц NH4V3O8 преимущественно пластинчатой морфологии, различающихся размерными характеристиками.
Рис. 5.
СЭМ-изображения порошков NH4V3O8, полученных в присутствии (NH4)2SO4 (а), CH3COONH4 (б), NH4CL (в), NH4NO3 (г).

С целью определения влияния аммонийсодержащих добавок на процесс формирования триванадата аммония проведен сравнительный рентгеноструктурный анализ монокристаллов. Для исследования были использованы монокристаллы NН4V3O8, полученные без добавки и в присутствии NH4NO3, следующих размеров: 0.528 × × 0.326 × 0.042 мм и 0.463 × 0.202 × 0.07 мм. Для указанных монокристаллов определены параметры элементарной ячейки: a = 5.0015(4), b = = 8.4296(9), c = 7.8683(7) Å, β = 96.330(9)°, V = = 329.63(5) Å3 и a = 4.9950(4), b = 8.4456(9), c = = 7.8610(6) Å, β = 96.376(7)°, V = 328.40(5) Å3. Полученные значения хорошо согласуются с литературными данными (ICSD № 67282). Согласно сканирующей электронной микроскопии (СЭМ), частицы NН4V3O8 при добавлении в реакционную массу NH4NO3 имеют форму правильных шестиугольников с ярко выраженным увеличением размерных характеристик. Установлено, что наибольший размер имеют грани, лежащие в плоскости {001} (рис. 6). Такое направление совпадает с направлением роста оксованадиевых слоев. По-видимому, увеличение концентрации ионов аммония в условиях кристаллизации NH4V3O8 в присутствии NH4NO3 приводит к увеличению заселенности позиций ионов ${\text{NH}}_{4}^{ + }$ на поверхности растущего кристалла и наращиванию новых оксованадиевых слоев вдоль оси с. При этом формируются более толстые пластины по сравнению с образцом в отсутствие NH4NO3. Очевидно, что добавка NH4NO3 промотирует рост кристалла NH4V3O8 вдоль оси с и выступает в роли “capping agent” (покрывающего агента), селективно адсорбируясь на гранях кристалла вдоль оси с. Имеются сведения, что функцию “capping agent” может выполнять и гидроксид лития LiOН, который обеспечивает преимущественный рост микрокристаллов NH4V3O8 в направлении b [24]. Примечательно, что явление “capping agent” получает все большую популярность в химической технологии и нанохимии материалов [25, 26]. Добавление в реакционные растворы различных органических и неорганических добавок, выполняющих роль промоторов или ингибиторов нуклеации и роста кристалла в определенном направлении, активно применяется для кристаллографической ориентации формы и размера синтезируемого материала. Управление размерами и морфологией частиц гексаванадата аммония следует учитывать при использовании NH4V3O8 в качестве материала.
ЗАКЛЮЧЕНИЕ
Разработан новый подход к получению триванадата аммония в гидротермальных условиях, который заключается в использовании VOSO4 ⋅ ⋅ 3H2O, способствующего процессу поликонденсации ванадий-кислородных групп. В присутствии ионов четырехвалентного ванадия значительно расширяется область существования NH4V3O8. Формирование триванадата аммония происходит в интервале 2.5 ≤ рН ≤ 8.0. В зависимости от рН реакционного раствора морфология частиц претерпевает существенные изменения – от частиц, подобных цветам, до кристаллов правильной формы в виде шестиугольников. Установлено, что использование различных аммонийсодержащих добавок позволяет варьировать размер частиц NH4V3O8. Впервые синтезированы наночастицы триванадата аммония в виде нанопроволоки с экстремальным отношением l/d ∼ 100 (отношение V2O5 : VOSO4 ⋅ 3H2O = 1.125 : 0.75, pH 4.0).
Список литературы
Fang D., Cao Y., Liu R. et al. // Appl. Surf. Sci. 2016. V. 360. P. 658. https://doi.org/10.1010/j.apsusc.2015.11.038
Wang H.Y., Huang K.L., Huang C.H. et al. // J. Power Sources. 2011. V. 196. № 2. P. 5645. https://doi.org/10.1016/j.jpowsour.2011.02.046
Wang N., Chen W., Mai L. et al. // J. Solid State Chem. 2008. V. 181. № 3. P. 652. https://doi.org/10.1016/j.jssc.2007.12.036
Sarkar S., Veluri P.S., Mitra S. et al. // Electrochim. Acta. 2014. V. 132. P. 448. https://doi.org/10.1016/j.electacta.2014.03.144
Ren T.-Z., Yuan Z.-Y., Zou X. // Cryst. Res. Technol. 2007. V. 42. № 4. P. 317. https://doi.org/10.1002/crat.200610821
Zakharova G., Enyashin A.N., Podvalnaya N.V. et al. // J. Phys. Chem. Solids. 2017. V. 101. P. 58. https://doi.org/10.1016/j.jpcs.2016.10.011
Zakharova G.S., Baklanova I.V., Suntsov A.Yu. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 12. P. 1584. [Захарова Г.С., Бакланова И.В., Сунцов А.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 12. С. 1646.]https://doi.org/10.1134/S0036023616120214
Cheng Y., Huang J., Li J. et al. // Electrochim. Acta. 2016. V. 212. P. 217. https://doi.org/10.1016/j.electacta.2016.07.008
Wang H., Huang K., Liu S. et al. // J. Power Sources. 2011. V. 196. № 2. P. 788. https://doi.org/10.1016/j.jpowsour.2010.07.022
Cao S., Huang J., Ouyang H. et al. // Mater. Lett. 2014. V. 126. P. 20. https://doi.org/10.1016/j.matlet.2014.03.156
Sreunou N., Mousty Ch., Durupthy O. et al. // J. Mater. Chem. 2012. № 22. P. 15291.
Leonardi S.C., Premerano P., Donato N. et al. // J. Solid State Chem. 2013. V. 201. P. 105. https://doi.org/10.1016/j.jssc.2013.03.028
Huang S.D., Shan Y. // Chem. Commun. 1998. № 10. P. 1069.
Zakharova G.S., Kurilenko A.S., Zhu Q. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 3. P. 270. [Захарова Г.С., Куриленко А.С., Zhu Q. и др. // Журн. неорган. химии. 2015. Т. 60. № 3. С. 318]. https://doi.org/10.1134/S0036023615030237]
Cao S., Huang J., Li J. et al. // Mater. Lett. 2015. V. 148. P. 192. https://doi.org/10.1016/j.matlet.2015.02.012
Park H.K., Kim.G. // Solid State Ionics. 2010. V. 181. № 5–7. P. 311. https://doi.org/10.1016/j.jssc.2010.01.011
Mai L.Q., Lao C.S., Hu B. et al. // J. Phys. Chem. B. 2006. V. 110. № 37. P. 18138.
Wang H.Y., Ren Y., Wang W.J. et al. // J. Power Sources. 2012. V. 199. № 2. P. 315. https://doi.org/10.1016/j.jpowsour.2011.10.069
Li H.-Y., Wang L., Wei C. et al. // Mater. Technology. 2015. V. 30. P. A109. https://doi.org/10.1179/17535557A15Y.000000006
Zakharova G.S., Ottmann A., Ehrstein B. et al. // Mater. Res. Bull. 2016. V. 83. P. 225. https://doi.org/10.1016/j.materresbull.2016.06.010
Butler A., Clague M.J., Meister G.E. // Chem. Rev. 1994. V. 94. № 3. P. 625.
Livage J. // Coord. Chem. Rev. 1998. V. 178–180. № 2. P. 999.
Kristallov L.V., Koryakova O.V., Perelyaeva L.A. et al. // Russ. J. Inorg. Chem. 1987. V. 32. № 8. P. 1073. [Кристаллов Л.В., Корякова О.В., Переляева Л.А. и др. // Журн. неорган. химии. 1987. Т. 32. № 8. С. 1811.]
Dell’Agli G., Grippo S.M. // Termochim. Acta. 1993. V. 227. № 10. P. 197.
Wang J., Ren Y., Khoo E. et al. // J. Phys. Chem. C. 2008. V. 112. № 37. P. 14306. https://doi.org/10.1021/j.p804035r
Chandrasekaran P., Viruthagiri G., Srinivasan N. // J. Alloys Compd. 2012. V. 540. P. 89. https://doi.org/10.1016/j.jallcom.2012.06.032
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии