Журнал неорганической химии, 2019, T. 64, № 12, стр. 1278-1287
Синтез и исследование производных аниона [B10H10]2– с аминокислотами
Е. Ю. Матвеев 1, 2, *, С. С. Акимов 3, А. С. Кубасов 1, В. М. Ретивов 4, К. Ю. Жижин 1, 2, Н. Т. Кузнецов 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 МИРЭА – Российский технологический университет (Институт тонких химических технологий
им. М.В. Ломоносова)
119571 Москва, пр-т Вернадского, 86, Россия
3 ООО “Химмед”
115230 Москва, Каширское шоссе, 9, Россия
4 НИЦ “Курчатовский институт” – ИРЕА”
107076 Москва, Богородский Вал, 3, Россия
* E-mail: cat1983@yandex.ru
Поступила в редакцию 14.05.2019
После доработки 03.06.2019
Принята к публикации 17.07.2019
Аннотация
Изучено взаимодействие тетрагидрофуранового, тетрагидропиранового и 1,4-диоксанового производных аниона [B10H10]2– и ряда аминокислот (глицина, цистеина, серина, п-аминобензойной кислоты). Показано, что в ходе реакций происходит раскрытие экзо-полиэдрического циклического заместителя с образованием клозо-декаборатов, содержащих пендантную аминокислотную группу, при этом нуклеофильный реагент присоединяется через атом кислорода. В качестве нуклеофильных реагентов могут выступать как сами аминокислоты (в водной среде), так и их натриевые соли (в среде диметилформамида). Все полученные соединения фактически являются эффективными полидентатными лигандами, способными координироваться металлом как за счет донорных атомов присоединенного фрагмента аминокислоты, так и посредством образования трехцентровых двухэлектронных связей. Синтезированные вещества исследованы методами элементного анализа, ИК-спектроскопии, полиядерной (11B, 13C и 1H) ЯМР-спектроскопии, ESI масс-спектрометрии. Клозо-декабораты с пендантными фрагментами аминокислот представляют интерес в 10B-нейтронозахватной терапии злокачественных опухолей из-за высокого содержания атомов бора и удобного способа их транспорта к пораженным клеткам.
ВВЕДЕНИЕ
Производные кластерных анионов бора [BnHn]2– (n = 10, 12) в настоящее время представляют интерес в синтезе соединений, перспективных для применения в 10B-нейтронозахватной терапии (10В-НЗТ) злокачественных опухолей из-за высокого содержания атомов бора в молекуле [1–4]. Одной из наиболее актуальных задач является поиск методов направленной функционализации борных кластеров для удобного способа их транспорта к пораженным клеткам. Анионы [BnHn]2– (n = 10, 12) могут быть модифицированы как за счет радикальных реакций, так и посредством реакций, протекающих по механизму электрофильно-индуцируемого нуклеофильного замещения (EINS) [5–14]. Полученные замещенные клозо-бораты могут быть функционализированы за счет введенных экзо-полиэдрических функциональных групп [15–18]. На основе кластерных анионов бора и их производных могут быть также получены различные комплексные соединения, в которых анионы [BnHn]2– могут находиться как во внешней сфере, так и быть связаны с комплексообразователем М трехцентровыми взаимодействиями М–Н–В [19–21]. Координационные соединения с лигандами на основе борных кластеров могут выступать в качестве препаратов сочетанного действия для 10В-НЗТ [1–4]. Однако один из наиболее эффективных методов функционализации анионов [BnHn]2– (n = 10, 12) заключается в раскрытии циклических заместителей оксониевого и тиониевого типов в соответствующих производных с получением соединений с пендантными функциональными группами. Эти реакции протекают при действии нуклеофилов различного типа (N-, O-, S-, Hal-нуклеофилы и т.д.) и могут быть использованы для введения фрагментов больших молекул, в том числе биологически активных (аминокислот, нуклеотидов, углеводов, краун-эфиров и т.д.) [9, 22–37].
Соединения с пендантными биологически активными функциональными группами представляют особый интерес из-за их обособленности от борного кластера.
Такие производные непосредственно можно использовать в 10B-нейтронозахватной терапии злокачественных опухолей либо в качестве полидентатных лигандов для синтеза комплексных соединений, которые могут применяться как в классической 10B-НЗТ, так и в терапии сочетанного действия.
Аминокислоты являются одними из наиболее распространенных биогенных соединений. Помимо своей роли остатков в белках, они участвуют во множестве важных биологических процессов, таких как транспорт нейротрансмиттеров и биосинтез. Поэтому очень актуальной является разработка методов синтеза производных клозо-боратных анионов с аминокислотными группами, которые могут стать перспективными соединениями для применения в 10B-НЗТ.
Цель настоящей работы – исследование реакций тетрагидрофуранового, тетрагидропиранового и 1,4-диоксанового производных аниона [B10H10]2– и ряда аминокислот (глицина, серина, цистеина, п-аминобензойной кислоты).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
[2-(1-(1,4-Диоксаний))]нонагидро-клозо-декаборат тетрабутиламмония (n-Bu4N)[B10H9O2C4H8], [2-(1-(тетрагидрофураний))]нонагидро-клозо-декаборат тетрабутиламмония (n-Bu4N)[B10H9OC4H8] и [2-(1-(тетрагидропираний))]нонагидро-клозо-декаборат тетрабутиламмония (n-Bu4N)[B10H9OC5H8] синтезировали по разработанной ранее методике [38]. 1,4-Диоксан, тетрагидропиран, тетрагидрофуран очищали согласно [39]. Натриевые соли глицина, серина и аланина получали согласно [40]. Метанол (99.9%, Merck), этанол (99.9%, Merck), диметилформамид (99.9%, Aldrich), глицин (99%), L-серин (97%), L-цистеин (99%), п-аминобензойную кислоту (х. ч.), хлорид тетрафенилфосфония (99.9%, Aldrich) использовали без дополнительной очистки.
Методы физико-химического анализа
Элементный анализ на углерод, водород, азот и серу осуществляли на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba). Определение бора методом ICP MS выполнено на атомно-эмиссионном спектрометре с индуктивно-связанной плазмой iCAP 6300 Duo в ЦКП “Исследовательский научно-аналитический центр НИЦ "Курчатовский институт” – ИРЕА”.
ИК-спектры синтезированных соединений записывали на ИК-фурье-спектрометре ИНФРАЛЮМ ФТ-02 (НПФ АП “Люмекс”) в области 7000–300 см–1 с разрешением 1 см–1. Образцы готовили в виде суспензий в вазелиновом масле (Aldrich) или во фторированном масле “Fluorolube” (Merck).
Спектры ЯМР (1Н, 11B и 13С) растворов записывали на спектрометре Bruker Avance II-300 на частотах 300.3, 96.32 и 75.49 МГц соответственно с внутренней стабилизацией по дейтерию. В качестве внешних стандартов использовали тетраметилсилан и эфират трехфтористого бора (11B).
Масс-спектры с электроспрей-ионизацией пробы для растворов исследуемых веществ в воде и ацетонитриле записывали на спектрометре Bruker MicrOTOF-Q (Bruker Daltonik, Germany). Условия ионизации: Apollo II, источник ионизации – электроспрей, напряжение +(–)4500 V, температура 200°C , поток 3 мкл/мин.
Взаимодействие с глицинатом натрия
К раствору (Bu4N)[B10H9O2C4H8] (0.90 г, 2 ммоль), (Bu4N)[B10H9OC5H10] (0.90 г, 2 ммоль) или (Bu4N)[B10H9OC4H8] (0.90 г, 2 ммоль) в диметилформамиде (15 мл) добавляли глицинат натрия (0.20 г, 2 ммоль) и реакционную смесь перемешивали в течение 4 ч. Полученный раствор выливали в 50 мл 0.04 М водного раствора (Ph4P)Cl. Полученный светло-желтый осадок отфильтровывали, перекристаллизовывали из этанола и высушивали в глубоком вакууме.
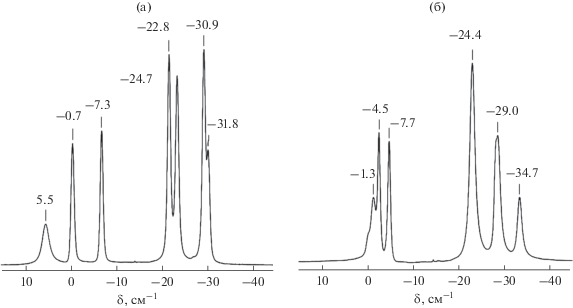
2-[2-(2-(Аминоацетилокси)этокси)этокси]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2[B10H9(O(CH2)2)2OOCCH2NH2)]. Выход 1.49 г (78%). ЯМР 1H (сигналы от катиона не указаны) (CD3CN, δ, м. д.): 4.45 (т, 2H, CН2 (α)), 3.87 (т, 2H, CН2 (β)), 3.56 (т, 2H, CН2 (δ)), 3.42 (т, 2H, CН2 (γ)), 3.30 (c, 2H, –OC(O)CН2), 2.42 (с, 2H, NH2); ЯМР 11B (CD3CN, δ, м. д.): –1.3 (c, BO (2)), –4.5, –7.7 (оба д, по 1B, BH (10,1)), –24.4 (м, BH (3,5,6,9)), –29.0 (д, 2В, ВН (7,8)), –34.7 (д, 1В, BH (4)); ЯМР 13C (CD3CN, δ, м. д.): 163.5 (C=O), 72.4 (СН2 (β)), 68.7 (СН2 (α)), 63.6 (СН2 (γ)), 61.7 (CH2 (δ)), 40.6 (–OC(O)CН2).
ИК-спектр (см–1): 3415 (ν(N–H)), 2450 (ν(B–H)), 1677 (ν(C=O)), 1615 (δ(H–N–H)), 1067–1151 (ν(C–O)).
| C | H | N | B | |
| Найдено, %: | 67.02; | 6.38; | 1.50; | 11.19. |
| Для C54H61P2B10O4N | ||||
| вычислено, %: | 67.69; | 6.42; | 1.46; | 11.28. |
ESI MS. Найдено, а. е. м.: 280.33 {H+ + + [B10H9(O(CH2)2)2OOCCH2NH2)]2–}– (B10H22O4C6N). Вычислено: М = 280.36. Найдено, а. е. м.: 618.71 {(C6H5)4P+ + [B10H9(O(CH2)2)2OOCCH2NH2)]2–}– (C30H41PB10O4N). Вычислено: М = 618.74.
2-[5-(Аминоацетилокси)пентилокси]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2 [B10H9O(CH2)5OOCCH2NH2]. Выход 1.57 г (82%). ЯМР 1H (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 4.15 (т, 2H, CН2 (ε)), 3.61 (т, 2H, CН2 (α)), 3.12 (c, 2H, –OC(O)CН2), 2.35 (с, 2H, NH2), 2.19 (м, 2H, CН2 (β)), 1.92 (м, 2H, CН2 (γ)), 1.65 (м, 2H, CН2 (δ)); ЯМР 11B (CD3CN, δ, м. д.): ‒1.1 (c, BO (2)), –4.6, –7.9 (оба д, по 1B, BH (10,1)), –24.5 (м, BH (3,5,6,9)), –29.1 (д, 2В, ВН (7, 8)), –34.5 (д, 1В, BH (4)); ЯМР 13C (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 163.2 (C=O), 69.8 (СН2 (α)), 67.2 (CH2 (ε)), 40.2 (–OC(O)CН2), 30.0 (СН2 (β)), 28.3 (СН2 (δ)), 20.5 (СН2 (γ)). ИК-спектр (см–1): 3419 (ν(N–H)), 2452 (ν(B–H)), 1682 (ν(C=O)), 1615 (δ(H–N–H)), 1054–1149 (ν(C–O)).
| C | H | B | N | |
| Найдено, %: | 69.43; | 6.60; | 11.22; | 1.51. |
| Для C55H63P2B10O3N | ||||
| вычислено, %: | 69.09; | 6.64; | 11.31; | 1.46. |
ESI MS. Найдено, а. е. м.: 278.36 {H+ + + [B10H9(O(CH2)5OOCCH2NH2)]2–}– (B10H24O3C7N). Вычислено: М = 278.38. Найдено, а. е. м.: 616.74 {(C6H5)4P+ + [B10H9(O(CH2)5OOCCH2NH2)]2–}– (C31H43PB10O3N). Вычислено: М = 616.77.
2-[4-(Аминоацетилокси)бутокси]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2[B10H9O(CH2)4OOCCH2NH2]. Выход 1.41 г (75%).
ЯМР 1H (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 4.21 (т, 2H, CН2 (δ)), 3.69 (т, 2H, CН2 (α)), 3.21 (c, 2H, –OC(O)CН2), 2.38 (м, 2H, CН2 (β)), 2.41 (с, 2H, NH2), 1.71 (м, 2H, CН2 (γ)); ЯМР 11B (CD3CN, δ, м. д.): –1.1 (c, BO (2)), –4.8, –7.9 (оба д, по 1B, BH (10,1)), –24.6 (м, BH (3, 5, 6, 9)), –29.1 (д, 2В, ВН (7,8)), –34.9 (д, 1В, BH (4)); ЯМР 13C (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 162.5 (C=O), 70.1 (СН2 (α)), 68.4 (CH2 (δ)), 40.4 (–OC(O)CН2), 29.6 (СН2 (β)), 25.2 (СН2 (γ)).
ИК-спектр (см–1): 3411 (ν(N–H)), 2448 (ν(B–H)), 1680 (ν(C=O)), 1614 (δ(H–N–H)), 1045–1156 (ν(C–O)).
| C | H | B | N | |
| Найдено, %: | 69.21; | 6.48; | 11.39; | 1.54. |
| Для C54H61P2B10O3N | ||||
| вычислено, %: | 68.84; | 6.53; | 11.47; | 1.49. |
ESI MS. Найдено, а. е. м.: 264.32 {H+ + + [B10H9(O(CH2)4OOCCH2NH2)]2–}– (B10H22O3C6N). Вычислено: М = 264.36. Найдено, а. е. м.: 602.72 {(C6H5)4P+ + [B10H9(O(CH2)4OOCCH2NH2)]2–}– (C22H57N2B10O3). Вычислено: М = 602.75.
Взаимодействие с 2-амино-3-гидроксипропаноатом натрия. К раствору (Bu4N)[B10H9O2C4H8] (0.90 г, 2 ммоль), (Bu4N)[B10H9OC5H10] (0.90 г, 2 ммоль) или (Bu4N)[B10H9OC4H8] (0.90 г, 2 ммоль) в диметилформамиде (15 мл) добавляли 2-амино-3-гидроксипропаноат натрия (0.26 г, 2 ммоль) и реакционную смесь перемешивали в течение 4 ч. Полученный раствор выливали в 50 мл 0.04 М водного раствора (Ph4P)Cl. Полученный светло-желтый осадок отфильтровывали, перекристаллизовывали из этанола и высушивали в глубоком вакууме.
2-[2-(2-(2-Амино-3-гидроксипропаноилокси)эток-си)этокси]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2[B10H9(O(CH2)2)2OOCCH2OHCH2NH2)]. Выход: 1.42 г (72%.)
ЯМР 1H (сигналы от катиона не указаны) (CD3CN, δ, м. д.): 4.42 (т, 2H, CН2 (α)), 3.85 (т, 2H, CН2 (δ)), 3.59 (т, 2H, CН2 (β)), 3.50 (c, 1H, ‒OC(O)CН(NH2)CH2OH), 3.42 (т, 2H, CН2 (γ)), 3.38 (м, 1H, –OC(O)CН(NH2)CH2OH), 2.51 (с, 2H, NH2); ЯМР 11B (CD3CN, δ, м. д.): –1.0 (c, BO (2)), –4.7, –7.9 (оба д, по 1B, BH (10,1)), –24.6 (м, BH (3, 5, 6, 9)), –29.4 (д, 2В, ВН (7,8)), –34.8 (д, 1В, BH (4)); ЯМР 13C (CD3CN, δ, м. д.): 164.7 (C=O), 72.1 (СН2 (β)), 67.9 (СН2 (γ)), 64.5 (СН2 (α)), 63.8 (–OC(O)CН(NH2)CH2OH), 62.7 (CH2 (δ)), 59.2 (–OC(O)CН(NH2)CH2OH).
ИК-спектр (см–1): 3476–3498 (ν(O–H)), 3415 (ν(N–H)), 2447 (ν(B–H)), 1676 (ν(C=O)), 1621 (δ(H–N–H)), 1062–1149 (ν(C–O)).
| C | H | N | B | |
| Найдено, %: | 67.13; | 6.48; | 1.48; | 10.85. |
| Для C55H64P2B10O5N | ||||
| вычислено, %: | 66.78; | 6.52; | 1.42; | 10.93. |
ESI MS. Найдено, а. е. м.: 311.38 {H+ + + [B10H9O2C4H8OCOCH2OHCH2NH2]2–}– (B10H25O5C7N). Вычислено: М = 311.39. Найдено, а. е. м.: 649.74 {(C6H5)4P+ + [B10H9O2C4H8OCOCH2OHCH2NH2]2–}– (C31H44PB10O5N). Вычислено: М = 649.78.
2-[5-(2-Амино-3-гидроксипропаноилокси)пентилокси]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2[B10H9O(CH2)5OOCCH2OHCH2NH2]. Выход 1.34 г (68%).
ЯМР 1H (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 4.26 (м, 1H, ‒OC(O)CН(NH2)CH2OH), 4.15 (т, 2H, CН2 (ε)), 3.85 (т, 2H, CН2 (α)), 3.41 (м, 1H, ‒OC(O)CН(NH2)CH2OH), 2.24 (т, 2H, CН2 (β)), 1.98 (т, 2H, CН2 (γ)), 1.72 (т, 2H, CН2 (δ)), 2.65 (с, 2H, NH2); ЯМР 11B (CD3CN, δ, м. д.): –1.3 (c, BO (2)), –4.8, –8.0 (оба д, по 1B, BH (10,1)), –24.6 (м, BH (3,5,6,9)), –29.4 (д, 2В, ВН (7,8)), –34.5 (д, 1В, BH (4)); ЯМР 13C (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 164.1 (C=O), 72.3 (СН2 (α)), 63.8 (–OC(O)CН(NH2)CH2OH), 67.2 (CH2 (ε)), 59.8 (–OC(O)CН(NH2)CH2OH), 29.5 (СН2 (β)), 28.1 (СН2 (δ)), 20.5 (СН2 (γ)).
ИК-спектр (см–1): 3476–3498 (ν(O–H)), 3415 (ν(N–H)), 2451 (ν(B–H)), 1680 (ν(C=O)), 1625 (δ(H–N–H)), 1069–1150 (ν(C–O)).
| C | H | B | N | |
| Найдено, %: | 68.49; | 6.79; | 10.87; | 1.47. |
| Для C56H66P2B10O4N | ||||
| вычислено, %: | 68.13; | 6.74; | 10.95; | 1.42. |
ESI MS. Найдено, а. е. м.: 309.41 {H+ + + [B10H9OC5H10OCOCH2OHCH2NH2]2–}– (B10H27O4C8N). Вычислено: М = 309.42. Найдено, а. е. м.: 647.78 {(C6H5)4P+ + [B10H9OC5H10OCOCH2OHCH2NH2]2–}– (C32H46PB10O4N). Вычислено: М = 647.81.
2-[4-(2-Амино-3-гидроксипропаноилокси)буток-си]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2[B10H9O(CH2)4OOCCH2OHCH2NH2]. Выход 1.38 г (71%).
ЯМР 1H (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 4.22 (м, 1H, ‒OC(O)CН(NH2)CH2OH), 4.12 (т, 2H, CН2 (δ)), 3.76 (т, 2H, CН2 (α)), 3.38 (м, 1H, ‒OC(O)CН(NH2)CH2OH), 2.24 (т, 2H, CН2 (β)), 1.87 (т, 2H, CН2 (γ)), 2.65 (с, 2H, NH2); ЯМР 11B (CD3CN, δ, м. д.): –1.2 (c, BO (2)), –4.7, –7.6 (оба д, по 1B, BH (10,1)), –24.7 (м, BH (3,5,6,9)), ‒29.6 (д, 2В, ВН (7,8)), –34.7 (д, 1В, BH (4)); ЯМР 13C (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 164.6 (C=O), 72.4 (СН2 (α)), 63.8 (–OC(O)CН(NH2)CH2OH), 67.6 (CH2 (δ)), 59.8 (–OC(O)CН(NH2)CH2OH), 29.57 (СН2 (β)), 28.2 (СН2 (γ)).
ИК-спектр (см–1): 3479–3486 (ν(O–H)), 3414 (ν(N–H)), 2449 (ν(B–H)), 1678 (ν(C=O)), 1629 (δ(H–N–H)), 1071–1150 (ν(C–O)).
| C | H | B | N | |
| Найдено, %: | 68.22; | 6.58; | 11.03; | 1.38. |
| Для C5H64P2B10O4N | ||||
| вычислено, %: | 67.88; | 6.63; | 11.11; | 1.44. |
ESI MS. Найдено, а. е. м.: 295.38 {H+ + + [B10H9OC4H8OCOCH2OHCH2NH2]2–}– (B10H25O4C7N). Вычислено: М = 295.39. Найдено, а. е. м.: 633.75 {(C6H5)4P+ + [B10H9OC4H8OCOCH2OHCH2NH2]2–}– (C31H44PB10O4N). Вычислено: М = 633.78.
Взаимодействие с 2-амино-3-меркаптопропаноатом натрия
К раствору (Bu4N)[B10H9O2C4H8] (0.90 г, 2 ммоль), (Bu4N)[B10H9OC5H10] (0.90 г, 2 ммоль) или (Bu4N)[B10H9OC4H8] (0.90 г, 2 ммоль) в диметилформамиде (15 мл) добавляли 2-амино-3-гидроксипропаноат натрия (0.26 г, 2 ммоль) и реакционную смесь перемешивали в течение 4 ч. Полученный раствор выливали в 50 мл 0.04 М водного раствора (Ph4P)Cl. Полученный светло-желтый осадок отфильтровывали, перекристаллизовывали из этанола и высушивали в глубоком вакууме.
2-[2-(2-(2-Амино-3-меркаптопропаноилокси)эток-си)этокси]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2[B10H9(O(CH2)2)2OOCCH2SHCH2NH2)]. Выход: 1.41 г (70%.)
ЯМР 1H (сигналы от катиона не указаны) (CD3CN, δ, м. д.): 4.48 (т, 2H, CН2 (α)), 3.82 (т, 2H, CН2 (δ)), 3.52 (т, 2H, CН2 (β)), 3.40 (c, 1H, ‒OC(O)CН(NH2)CH2SH), 3.35 (т, 2H, CН2 (γ)), 2.78 (м, 1H, –OC(O)CН(NH2)CH2SH), 2.44 (с, 2H, NH2); ЯМР 11B (CD3CN, δ, м. д.): –1.0 (c, BO (2)), –4.9, –8.1 (оба д, по 1B, BH (10,1)), –24.7 (м, BH (3,5,6,9)), –29.7 (д, 2В, ВН (7,8)), –34.8 (д, 1В, BH (4)); ЯМР 13C (CD3CN, δ, м. д.): 165.1 (C=O), 71.9 (СН2 (β)), 67.7 (СН2 (γ)), 64.2 (СН2 (α)), 62.2 (CH2 (δ)), 57.9 (–OC(O)CН(NH2)CH2SH), 28.4 (‒OC(O)CН(NH2)CH2SH).
ИК-спектр (ν, см–1): 3417 (ν(N–H)), 2450 (ν(B–H)), 1671 (ν(C=O)), 1620 (δ(H–N–H)), 1062–1151 (ν(C–O)).
| C | H | B | N | S | |
| Найдено, %: | 66.07; | 6.35; | 10.66; | 1.44; | 3.15. |
| Для C55H64P2B10O4SN | |||||
| вычислено, %: | 65.72; | 6.42; | 10.75; | 1.39; | 3.19. |
ESI MS. Найдено, а. е. м.: 327.45 {H+ + + [B10H9O2C4H8OCOCH2SHCH2NH2]2–}– (B10H25O4C7SN). Вычислено: М = 327.46. Найдено, а. е. м.: 665.81 {(C6H5)4P+ + [B10H9O2C4H8OCOCH2SHCH2NH2]2–}– (C31H44PB10O4SN). Вычислено: М = 665.85.
2-[5-(2-Амино-3-меркаптопропаноилокси)пентилокси]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2[B10H9O(CH2)5OOCCH2SHCH2NH2]. Выход 1.44 г (72%).
ЯМР 1H (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 4.05 (т, 2H, CН2 (ε)), 3.94 (м, 1H, –OC(O)CН(NH2)CH2SH), 3.81 (т, 2H, CН2 (α)), 2.91 (м, 1H, –OC(O)CН(NH2)CH2SH), 2.17 (т, 2H, CН2 (β)), 1.96 (т, 2H, CН2 (γ)), 1.65 (т, 2H, CН2 (δ)), 2.51 (с, 2H, NH2); ЯМР 11B (CD3CN, δ, м. д.): –1.2 (c, BO (2)), –4.6, –8.0 (оба д, по 1B, BH (10,1)), ‒24.5 (м, BH (3,5,6,9)), –29.6 (д, 2В, ВН (7,8)), ‒34.9 (д, 1В, BH (4)); ЯМР 13C (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 164.4 (C=O), 72.4 (СН2 (α)), 67.2 (CH2 (ε)), 60.1 (‒OC(O)CН(NH2)CH2SH), 29.5 (СН2 (β)), 28.3 (‒OC(O)CН(NH2)CH2SH), 25.7 (СН2 (δ)), 20.1 (СН2 (γ)).
ИК-спектр (см–1): 3414 (ν(N–H)), 2451 (ν(B–H)), 1678 (ν(C=O)), 1628 (δ(H–N–H)), 1074–1154 (ν(C–O)).
| C | H | B | N | S | |
| Найдено, %: | 67.39; | 6.58; | 10.69; | 1.42; | 3.16. |
| Для C56H66P2B10O3SN | |||||
| вычислено, %: | 67.04; | 6.63; | 10.78; | 1.37; | 3.20. |
ESI MS. Найдено, а. е. м.: 325.47 {H+ + + [B10H9OC5H10OCOCH2SHCH2NH2]2–}– (B10H27O3C8SN). Вычислено: М = 325.48. Найдено, а. е. м.: 663.84 {(C6H5)4P+ + + [B10H9OC5H10OCOCH2SHCH2NH2]2–}– (C32H46PB10O3SN). Вычислено: М = 663.87.
2-[4-(2-Амино-3-меркаптопропаноилокси)бутокси]нонагидро-клозо-декаборат тетрафенилфосфония (Ph4P)2[B10H9O(CH2)4OOCCH2SHCH2NH2]. Выход 1.35 г (68%).
ЯМР 1H (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 4.09 (т, 2H, CН2 (δ)), 3.87 (м, 1H, –OC(O)CН(NH2)CH2SH), 3.71 (т, 2H, CН2 (α)), 2.79 (м, 1H, –OC(O)CН(NH2)CH2SH), 2.27 (т, 2H, CН2 (β)), 1.81 (т, 2H, CН2 (γ)), 2.59 (с, 2H, NH2); ЯМР 11B (CD3CN, δ, м. д.): –1.2 (c, BO (2)), –4.8, –7.8 (оба д, по 1B, BH (10,1)), –24.6 (м, BH (3,5,6,9)), –29.5 (д, 2В, ВН (7,8)), –34.8 (д, 1В, BH (4)); ЯМР 13C (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 164.9 (C=O), 71.8 (СН2 (α)), 59.2 (CH2 (δ)), 56.8 (–OC(O)CН(NH2)CH2SH), 29.57 (СН2 (β)), 29.4 (–OC(O)CН(NH2)CH2SH), 25.2 (СН2 (γ)).
ИК-спектр (см–1): 3411 (ν(N–H)), 2448 (ν(B–H)), 1684 (ν(C=O)), 1621 (δ(H–N–H)), 1073–1151 (ν(C–O)).
| C | H | B | N | S | |
| Найдено, %: | 67.23; | 6.57; | 10.85; | 1.46; | 3.19. |
| Для C55H64P2B10O3SN | |||||
| вычислено, %: | 66.78; | 6.52; | 10.93; | 1.42; | 3.24. |
ESI MS. Найдено, а. е. м.: 311.45 {H+ + + [B10H9OC4H8OCOCH2SHCH2NH2]2–}– (B10H25O3C7SN). Вычислено: М = 311.46. Найдено, а. е. м.: 649.80 {(C6H5)4P+ + [B10H9OC4H8OCOCH2SHCH2NH2]2–}– (C31H44PB10O3SN). Вычислено: М = 649.85.
Взаимодействие с п-аминобензойной кислотой
В круглодонную колбу помещали 0.15 г (1.1 ммоль) п-аминобензойной кислоты, 40 мл воды и 0.50 г (1.1 ммоль) (Bu4N)[B10H9O2C4H8], (Bu4N)[B10H9OC5H10] или (Bu4N)[B10H9OC4H8]. Реакционную смесь кипятили в течение 8 ч и затем охлаждали до комнатной температуры. Осадок отфильтровывали, а фильтрат упаривали на роторном испарителе. Остаток сушили в вакууме масляного насоса при температуре 60°С и остаточном давлении 10–1 мм рт. ст. в течение 3 ч.
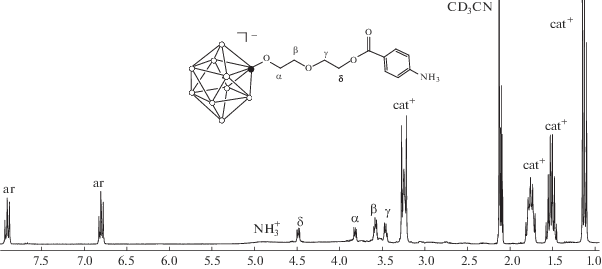
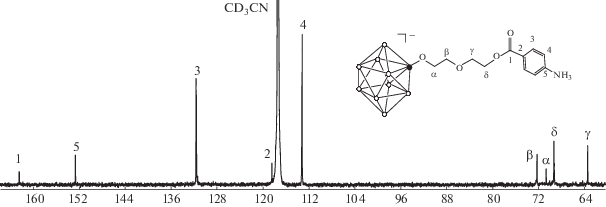
2-[2-(2-(4-Аммониобензоилокси)этокси)этокси]нонагидро-клозо-декаборат тетрабутиламмония (Bu4N)[B10H9(O(CH2)2)2OOCC6H4(4-NH3)]. Выход 0.54 г (84%). ЯМР 1H (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 7.91 (м, 2Н, CH (ar)), 6.80 (м, 2H, CH (ar)), 4.91 (с, 3H, NH3), 4.48 (т, 2H, CН2 (δ)), 3.83 (т, 2H, CН2 (α)), 3.58 (т, 2H, CН2 (β)), 3.48 (т, 2H, CН2 (γ)); ЯМР 11B (CD3CN, δ, м. д.): –0.5 (с, 1B, BO (2)), –1.6, –5.2 (оба д, по 1B, BH (10,1)), –22.6 (д, 4B, BH (3,5,6,9)), –28.5 (д, 2B, BH (7,8)), –32.9 (д, 1B, BH (4)); ЯМР 13C (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 162.5 (C=O), 152.7 (Car–N), 131.7, 113.2 (HCar), 118.5 (Car–C), 72.3 (СН2 (β)), 70.7 (СН2 (α)), 69.3 (CH2 (δ)), 63.4 (СН2 (γ)).
ИК-спектр (см–1): 3367 (ν(N–H)), 3194 (ν(N+–H)) 2453 (ν(B–H)), 1712 (ν(C=O)), 1615 (δ(H–N–H)), 1525 (δ(H–N+–H)), 1065–1157 (ν(C–O)alkox).
| C | H | B | N | |
| Найдено, %: | 55.81; | 10.29; | 18.39; | 4.84. |
| Для B10C27O4H59N2 | ||||
| вычислено, %: | 55.44; | 10.34; | 18.48; | 4.79. |
ESI MS. Найдено, а. е. м.: 342.25 {H+ + + [B10H9OCH2CH2OCH2CH2OOCC6H4NH2]2–}– (B10C11O4H24N). Вычислено: М = 342.27. Найдено, а. е. м.: 584.53 {(C4H9)4N+ + + [B10H9OCH2CH2OCH2CH2OOCC6H4NH2]2–}– (B10C27O4H59N2). Вычислено: М = 584.55.
2-[5-(4-Аммониобензоилокси)пентилокси]нонагидро-клозо-декаборат тетрабутиламмония (Bu4N)[B10H9O(CH2)5OOCC6H4(4-NH3)]. Выход 0.52 г (81%).
ЯМР 1H (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 7.79 (м, 2Н, CH (ar)), 6.87 (м, 2H, CH (ar)), 5.12 (с, 3H, NH3), 4.32 (т, 2H, CН2 (ε)), 3.69 (т, 2H, CН2 (α)), 2.16 (м, 2H, CН2 (β)), 1.97 (м, 2H, CН2 (δ)), 1.69 (м, 2H, CН2 (γ)); ЯМР 11B (CD3CN, δ, м. д.): –1.0 (с, 1B, BO (2)), –2.7, ‒4.8 (оба д, по 1B, BH (10,1)), –23.2 (д, 4B, BH (3,5,6,9)), –28.4 (д, 2B, BH (7,8)), –34.1 (д, 1B, BH (4)); ЯМР 13C (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 164.8 (C=O), 151.2 (Car–N), 131.5, 114.0 (HCar), 115.9 (Car–C), 70.2 (СН2 (α)), 67.6 (CH2 (ε)), 30.3 (СН2 (β)), 28.3 (СН2 (δ)), 20.4 (СН2 (γ)).
ИК-спектр (см–1): 3359 (ν(N–H)), 3223 (ν(N+–H)) 2447 (ν(B–H)), 1715 (ν(C=O)), 1606 (δ(H–N–H)), 1518 (δ(H–N+–H)), 1051–1146 (ν(C–O)alkox).
| C | H | B | N | |
| Найдено, %: | 58.02; | 10.68; | 18.47; | 4.73. |
| Для B10C28O3H62N2 | ||||
| вычислено, %: | 57.69; | 10.72; | 18.55; | 4.81. |
ESI MS. Найдено, а. е. м.: 340.30 [B10H9OCH2CH2CH2CH2CH2OOCC6H4NH3]– (B10C12O3H26N). Вычислено: М = 340.29. Найдено, а. е. м.: 582.56 {(C4H9)4N+ + + [B10H9OCH2CH2CH2CH2CH2OOCC6H4NH2]2–}– (B10C28O3H61N2). Вычислено: М = 582.57.
2-[4-(4-Аммониобензоилокси)бутокси]нонагидро-клозо-декаборат тетрабутиламмония (Bu4N)[B10H9O(CH2)4OOCC6H4(4-NH3)]. Выход 0.42 г (67%).
ЯМР 1H (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 7.85 (м, 2Н, CH (ar)), 6.96 (м, 2H, CH (ar)), 5.07 (с, 3H, NH3), 4.40 (т, 2H, CН2 (δ)), 3.74 (т, 2H, CН2 (α)), 2.41 (м, 2H, CН2 (β)), 1.80 (м, 2H, CН2 (γ)); ЯМР 11B (CD3CN, δ, м. д.): –0.8 (с, 1B, BO (2)), –2.0, –4.2 (оба д, по 1B, BH (10,1)), –22.9 (д, 4B, BH (3,5,6,9)), –27.9 (д, 2B, BH (7,8)), –33.8 (д, 1B, BH (4)); ЯМР 13C (сигналы от катиона не указаны) (СD3CN, δ, м. д.): 162.3 (C=O), 151.8 (Car–N), 133.7, 114.0 (HCar), 116.6 (Car–C), 70.0 (СН2 (α)), 68.2 (CH2 (δ)), 34.2 (СН2 (β)), 25.2 (СН2 (γ)).
ИК-спектр (см–1): 3369 (ν(N–H)), 3214 (ν(N+–H)), 2459 (ν(B–H)), 1710 (ν(C=O)), 1624 (δ(H–N–H)), 1523 (δ(H–N+–H)), 1043–1151 (ν(C–O)alkox).
| C | H | B | N | |
| Найдено, %: | 57.29; | 10.57; | 19.84; | 4.97. |
| Для B10C27O3H60N2 | ||||
| вычислено, %: | 57.00; | 10.63; | 19.00; | 4.92. |
ESI MS. Найдено, а. е. м.: 326.28 [B10H9OCH2CH2CH2CH2OOCC6H4NH3]– (B10C11O3H24N). Вычислено: М = 326.28. Найдено, а. е. м.: 568.56 {(C4H9)4N+ + + [B10H9OCH2CH2CH2CH2OOCC6H4NH2]2–}– (B10C27O3H59N2). Вычислено: М = 568.55.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
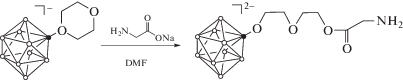
Нами изучено взаимодействие тетрагидрофуранового, тетрагидропиранового и 1,4-диоксанового производных декагидро-клозо-декаборатного аниона с натриевыми солями аминокислот (глицина, цистеина, серина). На примере реакции с глицинатом натрия показано, что в результате подобных взаимодействий происходит раскрытие циклического заместителя атомом кислорода карбоксильной группы (схема 1 ):
Схема 1 . Раскрытие циклического заместителя в 1,4-диоксановом производном клозо-декаборатного аниона с помощью глицината натрия.
Первоначально нами были предприняты попытки провести взаимодействие аминокислот с (n-Bu4N)[B10H9O2C4H8], (n-Bu4N)[B10H9OC4H8] и (n-Bu4N)[B10H9OC5H10] в присутствии амида натрия. Однако в этом случае образуются смеси продуктов раскрытия как самой аминокислотой, так и амидом натрия. Поэтому в качестве нуклеофильных агентов мы использовали натриевые соли аминокислот.
Идентификацию строения полученных соединений проводили на основании данных ЯМР- и ИК-спектроскопии. В спектрах ЯМР 11В всех полученных производных наблюдается классическая для клозо-боратов картина с раскрытым циклическим заместителем оксониевого типа (рис. 1). Например, в спектре 11B {1H} продукта взаимодействия 1,4-диоксанового производного с глицинатом натрия происходит смещение сигнала от ипсо-атома бора в сторону сильного поля относительно этого же сигнала в спектре исходного соединения, сближение сигналов от неэквивалентных апикальных вершин и перераспределение сигналов от остальных экваториальных атомов бора. Однако данный метод не является информативным относительно строения введенной функциональной группы, так как спектры ЯМР 11В всех полученных соединений чрезвычайного схожи между собой из-за малого влияния последней на борный кластер. Поэтому для анализа строения пендатной группы были использованы данные 1Н и 13С ЯМР- и ИК-спектроскопии.
В спектре ЯМР 1Н присутствуют триплеты при 4.45–3.42 м. д. от атомов водорода раскрытого 1,4-диоксанового цикла, синглет при 3.30 м. д. от CH2-группы аминокислоты и уширенный синглет при 2.42 м. д. от аминогруппы. Интегральные интенсивности всех сигналов равны. В спектре ЯМР 13С помимо сигналов от атомов углерода спейсерной цепи и тетрафенилфосфониевого катиона присутствует сигнал в слабом поле при 163.5 м. д., который можно отнести к карбоксильному атому углерода аминокислотного фрагмента.
В ИК-спектре полученного соединения по сравнению со спектром 1,4-диоксанового производного наблюдается исчезновение полосы деформационных колебаний связи С–О–С оксониевого циклического заместителя при 940–970 см–1 и появление интенсивной расщепленной полосы при 1030–1160 см–1, которая относится к валентным колебаниям связи С–О–С в алкоксильной цепочке. Кроме того, по сравнению со спектром глицината натрия в спектре продукта происходит смещение полосы валентных колебаний связи С=О в сторону больших волновых чисел (от 1660 до 1677 см–1), что говорит об участии именно карбоксильной группы в процессе раскрытия 1,4-диоксанового цикла. Частоты поглощения валентных колебаний связи азот–водород не изменяются и находятся в области 3410–3420 см–1.
Изучение взаимодействия анионов [B10H9O2C4H8]–, [B10H9OC5H10]– и [B10H9OC4H8]– с п-аминобензойной кислотой в среде N,N-диметилформамида показало, что образуются два продукта раскрытия карбоксильной и аминогруппой. Проведение же реакции в H2O позволяет получить преимущественно производное с присоединенной молекулой кислоты через атом кислорода.
Основная информация о типе пендантной группы была получена из ИК-спектров поглощения полученных соединений. В спектре продуктов раскрытия в чистом диметилформамиде присутствуют полосы поглощения валентных колебаний связей N–H при 3358 см–1 и связей O–H при 3485 см–1, которые практически совпадают с полосами аналогичных колебаний в чистой п-аминобензойной кислоте (3358 и 3478 см–1 соответственно). Это указывает на образование смеси двух продуктов с концевыми гидроксильными и аминогруппами. В спектре производного, полученного в водной среде, полоса поглощения при 3478 см–1 исчезает и остаются лишь полосы колебаний NH3+- и NH2-групп. Это однозначно свидетельствует в пользу образования клозо-декабората с пендантной группой, присоединенной через карбоксильный атом кислорода. Полоса, отвечающая ν(С=O), смещается по сравнению с полосой в п-HOOCC6H4NH2 (1665 см–1) в сторону бóльших волновых чисел на ~30 см–1, что вызвано изменением карбоксильного типа связи на сложноэфирный.
Строение заместителя было установлено на основании данных ЯМР-спектроскопии. Так, в спектре ЯМР 1H соединения (Bu4N)[B10H9(O(CH2)2)2OOCC6H4(4-NH3)] присутствуют два мультиплета при 7.91 и 6.80 м. д. от протонов бензольного кольца присоединенной пендантной группы и сильно уширенный синглет при 4.91 м. д. от протонов аммонийной группы. В спектре также наблюдаются четыре триплета при 4.48 (δ), 3.83 (α), 3.58 (β) и 3.48 м. д. (γ) от протонов алкоксильного спейсера (рис. 2).
Интегральные интенсивности сигналов от протонов полученного аниона равны. Остальные сигналы отвечают тетрабутиламмониевому катиону. Следует отметить, что сигнал от протонов δ-CH2-группы при 4.48 м. д. смещен в слабое поле относительно сигнала от тех же протонов в аналогичном производном с пендантной гидроксильной группой (3.69 м. д.). Это связано с сильным акцепторным влиянием соседней сложноэфирной группы и доказывает, что молекула п-аминобензойной кислоты присоединяется через карбоксильную группу. В случае присоединения нуклеофильного реагента через аминогруппу химические сдвиги от протонов алкоксильного спейсера лежали бы в области 3.0–4.0 м. д.
В спектре ЯМР 13С того же соединения присутствуют сигналы при 152.7, 131.7, 118.5 и 113.2 м. д. от бензольного кольца присоединенной кислоты, сигнал от карбоксильного атома углерода при 162.5 м. д., а также четыре сигнала от атомов углерода алкоксильной цепочки (рис. 3).
В ESI масс-спектре полученного продукта присутствуют два пика от иона [B10H9OCH2CH2OCH2CH2OOCC6H4NH3]– при 342.25 а. е. м. и однозарядного ансамбля {(C4H9)4N+ + + [B10H9OCH2CH2OCH2CH2OOCC6H4NH2]}2– при 584.55 а. е. м. Данные результаты определения масс анионов хорошо согласуются с вычисленными значениями.
Список литературы
Bregadze V.I., Sivaev I.B., Lobanova I.A. // Appl. Radiat. Isot. 2009. V. 67. P. S101. https://doi.org/10.1016/j.apradiso.2009.03.024
Barth R.F. // Appl. Radiat. Isot. 2009. V. 67. P. S3. https://doi.org/10.1016/j.apradiso.2009.03.102
Moss R.L. // Appl. Radiat. Isot. 2014. V. 88. P. 2. https://doi.org/10.1016/j.apradiso.2013.11.109
Barth R.F., Vicente MGraca H., Harling O.K. et al. // Radiation Oncology. 2012. V. 7. P. 146. https://doi.org/10.1186/1748-717X-7-146
Zhizhin K.Yu., Mustyatsa V.N., Matveev E.Yu. et al. // Russ. J. Inorg. Chem. 2003. V. 48. № 5. P. 671. [Жижин К.Ю., Мустяца В.Н., Матвеев Е.Ю. и др. // Журн. неорган. химии. 2003. Т. 48. № 5. С. 760.]
Akimov S.S., Matveev E.Yu., Razgonyaeva G.A. et al. // Russ. Chem. Bull. 2010. V. 59. № 2. P. 371. [Акимов С.С., Матвеев Е.Ю., Разгоняева Г.А. и др. // Изв. АН. Сер. хим. 2010. № 2. С. 364.] https://doi.org/10.1007/s11172-010-0088-1
Klyukin I.N., Zhdanov A.P., Matveev E.Yu. et al. // Inorg. Chem. Commun. 2014. V. 50. P. 28. https://doi.org/10.1016/j.inoche.2014.10.008
Retivov V.M., Matveev E.Yu., Lisovskiy M.V. et al. // Russ. Chem. Bull. 2010. V. 59. № 3. P. 550. [Ретивов В.М., Матвеев Е.Ю., Лисовский М.В. и др. // Изв. АН. Сер. хим. 2010. № 3. С. 538.] https://doi.org/10.1007/s11172-010-0123-2
Sivaev I.B., Semioshkin A. A., Brellochs B. et al. // Polyhedron. 2000. V. 19. P. 627. https://doi.org/10.1016/S0277-5387(00)00293-X
Bernard R., Cornu D., Perrin M. et al. // J. Organomet. Chem. 2004. V. 689. P. 977.
Matveev E.Yu., Kubasov A.S., Razgonyaeva G.A. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 7. P. 776. [Матвеев Е.Ю., Кубасов А.С., Разгоняева Г.А. и др. // Журн. неорган. химии. 2015. Т. 60. № 7. С. 858.] https://doi.org/10.1134/S0036023615070104
Klyukin I.N., Kubasov A.S., Limarev I.P. et al. // Polyhedron. 2015. V. 101. P. 215. https://doi.org/10.1016/j.poly.2015.09.025
Zhizhin K.Yu., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2089. https://doi.org/10.1134/S0036023610140019
Kubasov A.S., Matveev E.Yu., Turishev E.S. et al. // Doklady Chemistry. 2017. V. 477. Part 1. P. 257. [Кубасов А.С., Матвеев Е.Ю., Турышев Е.С. и др. // Докл. АН. 2017. Т. 477. № 3. С. 307.] https://doi.org/10.1134/S0012500817110088
Klyukin I.N., Voinova V.V., Selivanov N.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 12. P. 1546. [Клюкин И.Н., Воинова В.В., Селиванов Н.А. и др. // Журн. неорган. химии. 2018. Т. 63. № 12. С. 1536.] https://doi.org/10.1134/S0036023618120112
Kubasov A.S., Turishev E.S., Polyakova I.N. et al. // J. Organomet. Chem. 2017. V. 828. P. 106. https://doi.org/10.1016/j.jorganchem.2016.11.035
Klyukin I.N., Zhdanov A.P., Bykov A.Yu. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 2. P. 213. [Клюкин И.Н., Жданов А.П., Быков А.Ю. и др. // Журн. неорган. химии. 2018. Т. 63. № 2. С. 200.] https://doi.org/10.1134/S0036023618020110
Zhdanov A.P., Polyakova I.N., Razgonyaeva G.A. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 6. P. 847. [Жданов А.П., Полякова И.Н., Разгоняева Г.А. и др. // Журн. неорган. химии. 2011. Т. 56. № 6. С. 905.] https://doi.org/10.1134/S003602361106026X
Malinina E.A., Zhizhin K.Yu., Goeva L.V. et al. // Dokl. Chemistry. 2001. V. 378. № 1–3. P. 139. [Малинина Е.А., Жижин К.Ю., Гоева Л.В. и др. // Докл. АН. 2001. Т. 378. № 3. С. 351.] https://doi.org/10.1023/A:1019254503484
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1673. https://doi.org/10.1134/S0036023617130022
Avdeeva V.V., Polyakova I.N., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 7. P. 817. [Авдеева В.В., Полякова И.Н., Гоева Л.В. и др. // Журн. неорган. химии. 2015. Т. 60. № 7. С. 901.] https://doi.org/10.1134/S0036023615070037
Matveev E.Yu., Retivov V.M., Razgonyaeva G.A. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 10. P. 1549. [Матвеев Е.Ю., Ретивов В.М., Разгоняева Г.А. и др. // Журн. неорган. химии. 2011. Т. 56. № 10. С. 1628.] https://doi.org/10.1134/S0036023611100160
Prikaznov A.V., Shmal’ko A.V., Sivaev I.B. et al. // Polyhedron. 2011. V. 30. P. 1494. https://doi.org/10.1016/j.poly.2011.02.055
Matveev E.Yu., Razgonyaeva G.A., Mustyatsa V.N. et al. // Russ. Chem. Bull. 2010. V. 59. № 3. P. 556. [Матвеев Е.Ю., Разгоняева Г.А., Мустяца В.Н. и др. // Изв. АН. Сер. хим. 2010. № 3. С. 544.] https://doi.org/10.1007/s11172-010-0125-0
Semioshkin A.S., Sivaev I.B., Bregadze V.I. // Dalton Trans. 2008. P. 977. https://doi.org/10.1039/B715363E
Orlova A.V., Kondakov N.N., Kimel B.G. et al. // Appl. Organomet. Chem. 2007. V. 21. P. 98. https://doi.org/10.1002/aoc.1151
Matveev E.Yu., Akimov S.S., Kubasov A.S. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 6. P. 808. [Матвеев Е.Ю., Акимов С.С., Кубасов А.С. и др. // Журн. неорган. химии. 2017. Т. 62. № 6. С. 827.] https://doi.org/10.1134/S0036023617060146
Zhizhin K.Yu., Mustyatsa V.N., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2005. V. 50. № 2. P. 245. [Жижин К.Ю., Мустяца В.Н., Малинина Е.А. и др. // Журн. неорган. химии. 2005. Т. 50. № 2. С. 243.]
Peymann T., Kuck K., Gabel D. // Inorg. Chem. 1997. V. 36. P. 5138. https://doi.org/10.1021/ic970647t
Grin M.A., Semioshkin A.A., Titeev R.A. et al. // Mendeleev Commun. 2007. V. 17. P. 14. https://doi.org/10.1016/j.mencom.2007.01.005
Prikaznov A.V., Laskova Yu.N., Semioshkin A.A. et al. // Russ. Chem. Bull. 2011. V. 60. № 12. P. 2550. [Приказнов А.В., Ласкова Ю.Н., Семиошкин А.А. и др. // Изв. АН. Сер. хим. 2011. № 12. С. 2501.] https://doi.org/10.1007/s11172-011-0392-4
Laskova J., Kozlova A., Białek-Pietras M. et al. // J. Organomet. Chem. 2016. V. 807. P. 29. https://doi.org/10.1016/j.jorganchem.2016.02.009
Kikuchi S., Kanoh D., Sato S. et al. // J. Controlled Release. 2016. V. 237. P. 160. https://doi.org/10.1016/j.jconrel.2016.07.017
Laskova J., Kozlova A., Ananyev I. et al. // J. Organomet. Chem. 2017. V. 834. P. 64. https://doi.org/10.1016/j.jorganchem.2017.02.009
Kubasov A.S., Matveev E.Yu., Retivov V.M. et al. // Russ. Chem. Bull. 2014. V. 63. № 1. P. 187. [Кубасов А.С., Матвеев Е.Ю., Ретивов В.М. и др. // Изв. АН. Сер. хим. 2014. № 1. С. 187.] https://doi.org/10.1007/s11172-014-0412-2
Semioshkin A., Nizhnik E., Godovikov I. et al. // J. Organomet. Chem. 2007. V. 692. P. 4020. https://doi.org/10.1016/j.jorganchem.2007.06.00
Matveev E.Yu., Akimov S.S., Kubasov A.S. et al. // Fine Chemical Technologies. 2019. V.14. № 1. P. 59. [Матвеев Е.Ю., Акимов С.С., Кубасов А.С. и др. // Тонкие химические технологии. 2019. Т.14. № 1. С. 59.] https://doi.org/10.32362/2410-6593-2019-14-1-59-65
Zhizhin K.Yu., Mustyatsa V.N., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2004. V. 49. № 2. P. 180. [Жижин К.Ю., Мустяца В.Н., Малинина Е.А. и др. // Журн. неорган. химии. 2004. Т. 49. № 2. С. 221.]
Органикум. В 2-х т. Пер. с нем. Т. 1. М.: Мир, 1992.
Knizhnikov V.A., Azizbekyan O.P., Prishchepenko V.M. // Russ. J. Gen. Chem. 2003. V. 73. № 9. P. 1445. [Книжников В.А., Азизбекян О.П., Прищепенко В.М. // Журн. общ. химии. 2003. Т. 73. № 9. С. 1529.]
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии