Журнал неорганической химии, 2019, T. 64, № 12, стр. 1271-1277
Адсорбция метана на металлорганической каркасной структуре Cu-BTC110
М. К. Князева 1, *, О. В. Соловцова 1, А. Ю. Цивадзе 1, А. А. Фомкин 1, А. В. Школин 1, И. Е. Меньщиков 1, А. Л. Пулин 1, А. А. Ширяев 1, В. В. Высоцкий 1, М. Р. Киселев 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский пр-т, 31, стр. 4, Россия
* E-mail: batrakovamk@mail.ru
Поступила в редакцию 26.04.2019
После доработки 06.05.2019
Принята к публикации 17.07.2019
Аннотация
Проведен синтез металлорганической каркасной структуры Cu-BTC110 сольвотермальным методом с использованием органического растворителя N,N'-диметилформамида при температуре 110°С. Образец Cu-BTC110 обладает следующими адсорбционными характеристиками: объем микропор W0 = 0.38 см3/г, удельная поверхность SБЭТ = 850 м2/г, радиус микропор х0 = 0.36 нм, стандартная характеристическая энергия адсорбции бензола Е0 = 33.6 кДж/моль. Исследована адсорбция метана на образце Cu-BTC110 при температурах от 210 до 293 K и давлениях до 140 кПа. По изостерам адсорбции рассчитана дифференциальная мольная теплота адсорбции метана.
ВВЕДЕНИЕ
В современной энергетике такие газы, как метан или водород, являются перспективными видами топлива, применяемого в автомобильном транспорте, а также в летательных аппаратах. Однако безопасное хранение и транспортировку этих газов сложно осуществить из-за их взрывоопасных свойств, что делает невозможным применение такого вида топлива в широких масштабах. Металлорганические каркасные структуры (МОКС или MOF) обладают всеми необходимыми для решения этой проблемы свойствами: высокой характеристической энергией, наличием регулярной нанопористой структуры с развитым объемом микропор и удельной площадью поверхности, что является важным аспектом для хранения, транспортировки и разделения энергетических газов, в том числе метана и водорода [1].
Металлорганические каркасные структуры представляют собой координационные соединения, состоящие из ионов или кластеров различных металлов, связанных органическими лигандами [2]. В качестве неорганических составляющих, как правило, используют двух-, трех-, реже четырехзарядные катионы металлов, которые очень хорошо изучены. Наиболее часто встречаются соединения на основе ионов металлов: Cu2+, Zn2+, Со2+, Cr3+, Al3+, Fe3+, Ti4+, а также катионов многих редкоземельных металлов [3]. 1,3,5-Бензолтрикарбоновая или тримезиновая кислота (C6H3(COOH)3) является перспективным источником органического лиганда BTC – 1,3,5-бензолтрикарбоксилата ([C6H3(COO)3]3–), который применяется для создания многих MOF, обеспечивая высокую прочность каркаса за счет трех равноотстоящих карбоксилатных групп.
Наибольшую известность из металлорганических каркасных структур имеет семейство HKUST-1, представителем которого является MOF-199 (Cu-BTC или [Cu3(BTC)2(H2O)3]n). Металлорганическая каркасная структура типа MOF-199 содержит полости с размерами пор примерно 6 Å. Молекулы воды очень легко удаляются из каркаса и оставляют открытыми катионы меди (Cu2+) [4].
В работе [5] проводили синтез Cu-BTC с различными растворителями для выявления его влияния на структурно-энергетические характеристики. В ходе эксперимента было отмечено, что наиболее высокую удельную поверхность имеют образцы с растворителем N,N'-диметилформамидом (DMF) SBET = 1421 м2/г, смесь H2O : DMF (V% 70 : 30) SBET = 1430 м2/г и смесь H2O : EtOH : DMF (V% 40 : 20 : 40) SBET =1400 м2/г, но среди представленных вариантов наибольшим объемом пор обладает вариант DMF Wp = 0.74 см3/г. В работе [5] использовали дополнительный метод очистки ультразвуком. Выход кристаллов Cu-BTC находился в широком диапазоне 24–86%.
В работе [6] рассмотрена возможность оптимизации гидрофобных свойств металлорганического каркаса HKUST-1 с использованием хлороформа в качестве компонента реакционной среды в процессе синтеза, что увеличивает текстурные и структурные характеристики MOF-199. Наибольшая удельная поверхность SBET =1670 м2/г наблюдалась в образце, приготовленном в реакционной среде CHCl3–DMF–H2O и окончательно промытом хлороформом.
Улучшение структурных характеристик, а именно повышение значений удельной поверхности и увеличение объема микропор структуры Cu-BTC, позволяет проявлять высокую адсорбционную способность [7]. При сорбции газов с их небольшой концентрацией в различных газовых смесях MOF-199 обладает большой селективностью, а также хорошо регенерируется не теряя своей эффективности [8], имеет сравнительно низкую стоимость по сравнению с другими MOF-структурами за счет себестоимости исходных веществ, необходимых для синтеза MOF.
Высокие значения удельной поверхности, объема микропор делают структуру Cu-BTC привлекательным материалом для применения в различных областях физической химии. Однако получение таких структур достигается путем усложнения методики синтеза (дополнительной промывки или очистки) и применения дорогостоящих реагентов, что делает невозможным применение MOF-199 в широких масштабах. Более того, получение Cu‑BTC с высокими значениями удельной поверхности ведет к получению нестабильных структур, что также мешает их применению для хранения и транспортировки газов.
В связи с этим разработка методики синтеза стабильных структур Cu-BTC с высокими значениями удельной поверхности и высокой адсорбционной активностью по энергетическим газам является необходимой и актуальной задачей.
В данной работе синтез металлорганической каркасной структуры Cu-BTC проводили по упрощенной методике, наиболее пригодной для производства в крупных масштабах и позволяющей обеспечивать стабильность структурно-энергетических характеристик. Структуру Cu-BTC110 синтезировали с использованием иона переходного металла Cu2+ и органического лиганда BTC. Для координирования связи металл–лиганд наиболее подходящим является органический растворитель N,N'-диметилформамид. В результате образуется высокоактивная металлорганическая каркасная структура Cu-MOF с оптимальной величиной удельной площади поверхности и стабильными показателями структурно-энергетических характеристик, необходимых для адсорбции энергетических газов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза MOF использовали:
а) 1,3,5-бензолтрикарбоновую кислоту (тримезиновую, Н3BTC, 1,3,5-benzenetricarboxylic acid) с содержанием основного компонента 98% фирмы Acros Organics;
б) гемипентагидрат нитрата меди(II) (Cu(NO3)2 · 2.5H2O, copper(II) nitrate, hemipentahydrate) с содержанием основного компонента 99% фирмы Acros Organics.
в) N,N'-диметилформамид (DMF, N,N'-dimethylformamide) с содержанием основного компонента 99.9% фирмы Scharlau.
Методы исследования физико-химических свойств Cu-BTC110
Пористую структуру полученных образцов исследовали на специализированном анализаторе Quantochrome iQ. Структурно-энергетические характеристики полученных образцов определяли по изотермам стандартного пара азота при 77 K. Для определения удельной поверхности SБЭТ использовали подход, описанный в [9], для анализа микропористой структуры – теорию объемного заполнения микропор [10].
Для исследования фазового состава МОКС, а также морфологии прибегали к аналитическим методам исследования – порошковой рентгеновской дифракции и сканирующей электронной микроскопии.
Исследование дифракции рентгеновских лучей на образце проводили на порошковом дифрактометре Empyrean фирмы Panalytical в диапазоне углов 2θ от 0° до 50°, при этом использовали геометрию фокусировки Брэгга–Брентано и CuKα-фильтрацию рентгеновского излучения. Перед исследованием образец растирали в мелкодисперсный порошок-пудру, смешивали со спиртом до образования однородной пасты, затем укладывали на специальную пластинку и высушивали, после чего устанавливали пластинку с образцом на столик прибора и производили измерения.
Исследования элементного состава поверхности адсорбентов, а также их морфологии проводили на сканирующем электронном микроскопе Quanta 650 FEG фирмы FEI (США). Увеличение 51 000 раз, ускоряющее напряжение 30 кВ. Исследуемый образец перед измерениями измельчали путем раздавливания исходных гранул, имевших характерные размеры 1–5 мм.
Адсорбцию метана исследовали весовым методом на оригинальном стенде, описанном в [11], в интервале абсолютных давлений до 1.5 бар и широком интервале температур.
Методика синтеза металлорганической каркасной структуры Cu-1,3,5-benzenetricarboxylate (Cu-BTC110)
В работе использовали сольвотермальный метод синтеза [12, 13]. Тримезиновую кислоту (1,3,5-бензолтрикарбоновую кислоту (Н3ВTС)) массой 4 г растворяли в N,N'-диметилформамиде объемом 24 мл, получая раствор 1. Затем кристаллогидрат нитрата меди(II) Cu(NO3)2 · 2.5H2O массой 2 г растворяли в N,N'-диметилформамиде объемом 24 мл, получая раствор 2. Затем раствор 1 приливали к раствору 2, перемешивая его на магнитной мешалке (частота вращения 300–400 об./мин) c нагревом от 100 до 110°С до образования золя голубого цвета. Образующийся золь помещали в аналитический автоклав с фторопластовым стаканчиком, синтез вели при температуре 110°С в течение 24 ч до образования твердого осадка. Образующийся осадок многократно промывали N,N'-диметилформамидом и отделяли от маточного раствора методом вакуумного фильтрования. Образец сушили при комнатной температуре в течение 24 ч, а затем в сушильном шкафу при температуре 110°С в течение 3–4 ч.
Характеристики синтезированного образца и исходных веществ для его получения представлены в табл. 1.
Таблица 1.
Характеристики полученного образца MOF Cu-BTC110 и исходных веществ, использованных в синтезе
| Вещество | Химическая формула | Молярная масса, г/моль | Внешний вид |
|---|---|---|---|
| Металлорганическая каркасная структура Cu-BTC110 | [Cu3(C9H3O6)2 ⋅ (H2O)2.5] | 741 | Порошок голубого цвета |
| Источник катионов металла: гемипентагидрат нитрата меди(II) | Cu(NO3)2 · 2.5H2O | 219 | Синее кристаллическое вещество |
| Органический лиганд: 1,3,5-бензолтрикарбоновая (тримезиновая кислота) | C9H6O6 | 210 | Бесцветное кристаллическое вещество |
| Органический растворитель: N,N'-диметилформамид | НСON(CH3)2 | 73 | Бесцветная жидкость |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование пористой структуры синтезированного образца
Структурно-энергетические характеристики полученного образца определяли по изотерме стандартного пара азота при 77 K, представленной на рис. 1. Изотерма адсорбции азота имеет Г-образный вид. Петля адсорбционного гистерезиса практически отсутствует, что указывает на практически малый объем мезопор в пористой структуре адсорбента.
Рис. 1.
Изотерма адсорбции–десорбции азота на образце Cu-BTC110 при 77 К: 1 – адсорбция, 2 – десорбция.
Образец Cu-BTC110 преимущественно является микропористым адсорбентом (табл. 2). Полученный образец Cu-BTC110 имеет развитую микропористую структуру (W0 = 0.38 см3/г).
Таблица 2.
Структурно-энергетические характеристики синтезированного образца Cu-BTC110
| Параметр | Cu-BTC |
|---|---|
| Удельная площадь поверхности, SБЭТ, м2/г | 850 |
| Удельный объем микропор, W0, см3/г | 0.38 |
| Эффективный радиус микропор, х0, нм | 0.36 |
| Предельная величина адсорбции в микропорах, а0, ммоль/г | 10.9 |
| Характеристическая энергия адсорбции азота, Е, кДж/моль | 11.1 |
| Характеристическая энергия адсорбции стандартного пара бензола, Е0, кДж/моль | 33.6 |
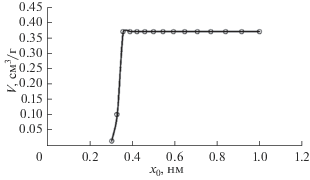
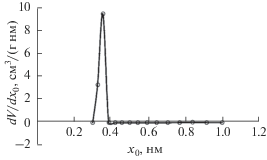
Результаты анализа пористой структуры для исследуемого адсорбента Сu-BTC110 методом DFT на установке Quantachrom iQ представлены на рис. 2 и 3. Из рис. 2 следует, что объем микропор составляет 0.37 см3/г, а из рис. 3 видно, что распределение пор по размерам имеет один ярко выраженный максимум при х0 ~ 0.36 нм. Это означает, что структура материала мономодальная, и ее характеристики качественно совпадают с результатами определения пористой структуры по ТОЗМ.
Рентгенофазовый анализ
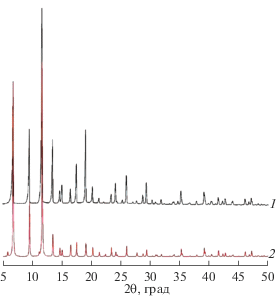
Фазовый состав и структуру образцов изучали методом порошковой рентгеновской дифракции. На рис. 4 представлены дифрактограммы синтезированного в работе образца Cu-BTC110 и образца HKUST-1 [14]. Основные рефлексы на рентгеновской дифрактограмме синтезированного образца согласуются с литературными данными. Структура Cu-BTC характеризуются кубической кристаллической решеткой с параметром a = 26.3 Å и объемом V = 18198.5 Å3.
ИК-Фурье-спектроскопия
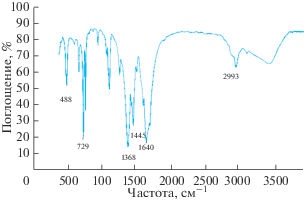
ИК-спектр Cu-BTC110 регистрировали с использованием дисков KBr. Как следует из рис. 5, полосы, полученные при 488 и 729 см–1, могут быть обусловлены валентными колебаниями связей Cu−O [15]. Пики, наблюдаемые между 663–766 см–1, соответствуют колебаниям связей в бензольном кольце и вне плоскости ароматического кольца. Полосы между 827–1153 см–1 относятся к симметричным и асимметричным деформационным колебаниям O−C=O [16]. Сильные пики поглощения при 1368, 1445 и 1640 см–1 связаны с деформационными колебаниями связей C−O, асимметричным и симметричным типами С=О соответственно в группе −СООН (в 1,3,5-бензолтрикарбоновой кислоте). Небольшой пик при 2933 см–1 обусловлен присутствием растворителя N,N'-диметилформамида, так как этот пик не наблюдается, когда образцы синтезируют с метанолом, например, в работе [17]. Широкая полоса, появляющаяся при 3346−3710 см–1, связана с наличием поверхностно-сорбированной водой и гидроксильными группами −ОН в структуре образца Cu-BTC110 [18, 19].
Сканирующая электронная микроскопия (СЭМ)
Для образца MOF Cu-BTC110 исследованы морфологические характеристики поверхности и элементный химический состав с помощью электронной микроскопии (EDAX). Снимки синтезированного образца Cu-BTC110 представлены на рис. 6. Морфология образцов характеризуется ограненными частицами с линейными размерами от ∼10 до ∼120 нм, которые представляют собой кристаллы или сростки кристаллов с характерными проявлениями кристалличности кубической сингонии.
Химический состав поверхности образца Cu-BTC110, определенный по результатам сканирующей электронной микроскопии, представлен в табл. 3. Наибольшее содержание в образце углерода достигает ∼60 ат. %. Кроме того, в полученном материале содержится значительное количество кислорода ∼28 ат. %, меди ∼6 ат. % и незначительное количество азота ∼6 ат. %. Большое содержание атомов углерода в структуре Cu-BTC110 может благоприятно влиять на адсорбцию углеводородов, в частности метана.
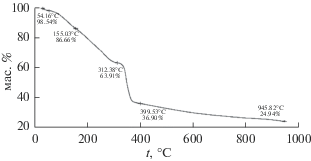
Термогравиметрический анализ
Термогравиметрическая кривая синтезированного образца Cu-BTC110 представлена на рис. 7 при нагревании до 900°C в потоке аргона. Скорость увеличения температуры 10 град/мин. Потеря веса на первой стадии (~5%) при температуре до 100°C до уровня 95% обусловлена десорбцией молекул воды из образца. Потеря массы на втором этапе ~36% до уровня 63.91% при температуре около 312°C соответствует десорбции молекул растворителя (температура кипения растворителя 153°С) и структурной воды (табл. 1). Потеря веса на третьей стадии ~65% при 400°C до уровня 36.90% соответствует практически полному разложению образца Cu-BTC, в результате чего образуется остаток в виде оксида меди. На последней стадии потеря веса ~75% при 945.82°С соответствует полному разложению MOF структуры Cu-BTC110. Этот анализ показывает, что образец Cu-BTC110 термически не стабилен и его структура деградирует уже при ∼200°C. Отсюда следует важный вывод – регенерацию образца Cu-BTC110 следует проводить при температурах, позволяющих десорбировать физически адсорбированную воду. Этому условию соответствуют температуры, близкие к температуре кипения воды. Наиболее щадящий и энергоэффективный режим регенерации может быть реализован при 110°С.
Адсорбция метана на образце Сu-BTC110
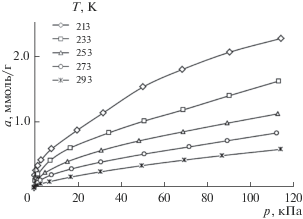
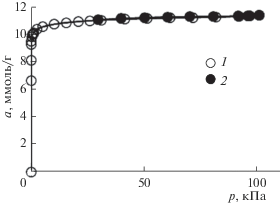
Наличие значительного объема микропор W0 = 0.38 см3/г при величине удельной поверхности SБЭТ = 850 м2/г и высокой стандартной характеристической энергии адсорбции Е0 = 33.6 кДж/моль создает хорошие перспективы использования образца Cu-BTC110 для адсорбционного аккумулирования газов, в частности метана [20, 21]. Для оценки эффективности применения полученного образца для хранения энергетически важных газов исследовали изотермы адсорбции метана при низких температурах (рис. 8).
Как следует из рис. 8, адсорбция метана резко возрастает в начальной части изотермы, а затем постепенно замедляет свой рост. Возможной причиной такого поведения является преимущественная адсорбция молекул метана на катионах Cu2+ в начальной области заполнений и последующее заполнение порового пространства по механизму объемного заполнения микропор.
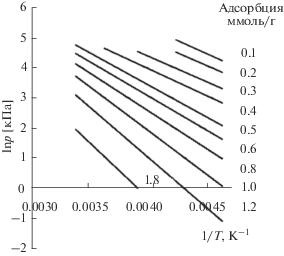
С использованием полученных данных построили изостеры адсорбции в координатах ln p–1000/T при a = const, которые хорошо аппроксимировались линейными кривыми (рис. 9).
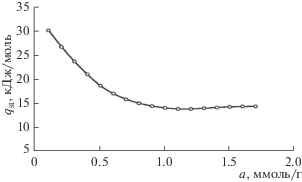
По изостерам рассчитали зависимость дифференциальной мольной теплоты адсорбции от величины адсорбции по уравнению:
Как следует из рис. 10, начальная изостерическая теплота адсорбции метана на MOF-структуре Cu-BTC110 достигает 30 кДж/моль, что, вероятно, обусловлено дисперсионным взаимодействием молекул метана с катионами Cu2+, а затем резко уменьшается в связи с заполнением собственно объема микропор.
Применение Cu-BTC110 в качестве адсорбента в широких масштабах возможно в виде функциональных композитных материалов. Исследования по аккумулированию метана на функциональных композитных адсорбентах, разработанных на основе структуры Cu-BTC110, представлены в работе [19].
ЗАКЛЮЧЕНИЕ
Проведен синтез металлорганической каркасной структуры Cu-BTC110 с помощью неорганической соли нитрата меди, тримезиновой кислоты и растворителя N,N’-диметилформамида. На основе адсорбционных данных по азоту при 77 K определены структурно-энергетические характеристики микропористой структуры с помощью уравнения Дубинина–Радушкевича. Образец Cu-BTC110 обладает следующими адсорбционными характеристиками: объемом микропор W0 = = 0.38 см3/г, SБЭТ = 850 м2/г, х0 = 0.36 нм, стандартная характеристическая энергия адсорбции бензола Е0 = 33.6 кДж/моль. Синтезированная структура MOF Cu-BTC110 термически нестабильна свыше 200°С. Применение Cu-BTC110 в качестве адсорбента в широких масштабах возможно в виде функциональных композитных материалов.
Список литературы
Zhao D., Yuan D., Zhou H.-C. et al. // Energy Environ. Sci. 2008. V. 1. P. 222.
Hoskins B.F., Robson R. et al. // J. Am. Chem. Soc. 1989. V. 111. № 15. P. 5962.
Batten S.R., Champness N.R. et al. // Cryst. Eng. Comm. 2012. V. 14. P. 3001.
Yu S., Jiang Z., Ding H. et al. // J. Membr. Sci. 2015. V. 481. P. 73.
Israr F., Kim D. K., Kim Y. et al. // Ultrason. Sonochem. 2016. V. 29. P. 186.
Isaeva V.I., Chernyshev V.V., Sokolova N.A. et al. // Russ. J. Phys. Chem. 2018. V. 92. № 12. P. 2391.
Yanga Y., Donga H., Wanga Y. et al. // J. Solid State Chem. 2018. V. 258. P. 582.
Xie J., Yan N., Qu Z. et al. // J. Environ. Sci. 2012. V. 24. № 4. P. 640.
Кельцев Н.В. // Основы адсорбционной техники. М.: Химия, 1976. 512 с.
Дубинин М.М. // Адсорбция и пористость. М.: Изд-во ВАХЗ, 1972. 127 с.
Shkolin A.V., Fomkin A.A. et al. // Measurement Techniques. 2018. V. 61. № 4. P. 395.
Батракова М.К., Соловцова О.В., Фомкин А.А. и др. // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 6. С. 563.
Князева М.К., Школин А.В., Фомкин А.А. и др. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 6. С. 537.
Yakovenko A.A., Reibenspies J.H., Bhuvanesh N. et al. // J. Appl. Cryst. 2013. V. 46. P. 346.
Li Y., Yang R.T. et al. // AIChE J. 2008. V. 54. P. 269.
Dikio E.D., Farah A.M. et al. // Chem. Sci. Trans. 2013.V. 2. № 4. P.1386.
Rowsell J.L.C., Yaghi O.M. et al. // J. Am. Chem. Soc. 2006. V. 128. P. 1304.
Lin J., Wang D., Chen D. et al. // Environ. Prog. Sustainable Energy. 2015. V. 34. P. 74.
Wang C., Chen F., Chen Z. et al. // Sci. Adv. Mater. 2016. V. 8. № 9. P.1760.
Князева М.К., Цивадзе А.Ю., Соловцов О.В. и др. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 1. С. 11.
Цивадзе А.Ю., Аксютин О.Е., Ишков А.Г. и др. // Физикохимия поверхности и защита материалов. 2016. Т. 52. № 1. С. 19.
Соловцова О.В., Школин А.В., Меньщиков И.Е. и др. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 5. C. 471.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии