Журнал неорганической химии, 2019, T. 64, № 11, стр. 1146-1153
Твердофазный синтез и обратимая кислородная емкость Li/Mg-сверхстехиометрических твердых растворов на основе шпинели MgMnO3–δ
Г. А. Бузанов 1, *, Н. П. Симоненко 1, К. Ю. Жижин 1, Н. Т. Кузнецов 1
1 Институт общей и неорганической химии РАН
119071 Москва, Ленинский пр-т, 31, Россия
* E-mail: gbuzanov@yandex.ru
Поступила в редакцию 25.04.2019
После доработки 08.05.2019
Принята к публикации 13.05.2019
Аннотация
Методом твердофазного синтеза из механокомпозитов, полученных при помоле смесей высокочистых прекурсоров (MgO, Mn2O3, MnO2 и Li2CO3), синтезированы ряды твердых растворов-шпинелей с заданным составом по катионам Mg1 +xMnO3 – δ и впервые MgLixMnO3 – δ – потенциальных материалов каталитических систем окислительных процессов, например, окислительной конверсии метана и сжигания с химическим циклом. Определена область их гомогенности до 1573 K при p(O2) = 0.21 атм. Для обоих рядов твердых растворов методом ТГ-ДСК изучен процесс синтеза из Mn2O3 и MnO2 на воздухе, определено содержание кислорода в полученных веществах (ТГ-ДСК, титриметрия). Исследованы продукты глубокого восстановления шпинелей Mg1 + xMnO3 – δ и MgLixMnO3 – δ смесью Ar + 4.8% H2, для которых изучены параметры регенерации воздухом в исходные однофазные шпинели. Для полученных материалов в 20 циклах окисления–восстановления показана хорошая воспроизводимость значений обратимой емкости по кислороду.
ВВЕДЕНИЕ
Кристаллиты системы Mg–Mn–O представляют многоплановый интерес в качестве компонентов материалов для катализаторов окислительных процессов [1, 2], в том числе экологически безопасного процесса сжигания разного рода топлива с химическим циклом (англ.: chemical looping combustion, CLC) [3–6], а также катодов магний-ионных батарей [7]. Изучение фазовых равновесий в системе Mg–Mn–O стало предметом ряда исследований [8–10]. Для развития систематического материаловедения этой технологически важной системы и родственных ей систем необходимо получить непротиворечивые данные о фазовых равновесиях. Одной из основных задач является синтез химически чистых соединений с заданным составом, а также изучение областей гомогенности образуемых ими твердых растворов.
Состояние многокомпонентной системы, летучесть компонентов которой значительно различается, зависит от температуры, соотношения компонентов, а также от парциального давления летучих компонентов. В случае систем Mg–Mn–О и Li–Mg–Mn–O фазовый состав кристаллитов будет определяться соотношением элементов-металлов, температурой и парциальным давлением кислорода p(O2). Ввиду высокой обратимой кислородной емкости – способности обратимо отдавать кислород в определенных условиях или в ходе реакций [3] и образовывать протяженные твердые растворы [7] – одним из наиболее интересных соединений системы Mg–Mn–O с практической точки зрения является кубическая шпинель MgxMnO3 – δ (Fd3m) со структурой, аналогичной β-Mn3O4, стабильная при обычных условиях. Основные преимущества этого материала – низкая стоимость, возможность синтеза из широкого круга прекурсоров (оксиды, нитраты и др.), их доступность и отсутствие специальных условий получения, экологическая безопасность и возможность переработки. Тройные фазы системы Li–Mn–O, в частности со структурой шпинели, могут выступать в роли активных компонентов каталитических систем окислительных процессов [11–16], например окислительной конверсии метана в этилен. Принимая это во внимание наряду с высокой обратимой емкостью по кислороду шпинели MgMnO3 – δ, допирование MgMnO3 – δ ионами Li+ с образованием твердых растворов MgLixMnO3 – δ представляет особый интерес для создания новых материалов каталитических систем окислительных процессов. В настоящее время для синтеза шпинели MgMnO3 – δ и твердых растворов Mg1 +xMnO3 – δ используется несколько подходов, которые отличаются значительными временными затратами или необходимостью применения вспомогательных реагентов (растворители, гелеобразователи и др.). В работе [3], где впервые было предложено использование MgMnO3 – δ в качестве материала-носителя кислорода для процесса CLC, шпинель MgMnO3 – δ была получена методом твердофазного синтеза (прекурсоры – Mn2O3 и MgO, помол 24 ч, отжиг при 1473 K в течение 2 ч на воздухе). Для этих образцов методом иодометрического титрования был определен состав шпинельной фазы (MgMnO2.68), а также изучены превращения этого материала в среде CH4, H2, CO, CO2 и N2 и показана устойчивость материала к циклам восстановления-окисления и отложению углерода при взаимодействии с CO и CH4. Исследование промоторов (MgO, Ce0.9Gd0.1O2 – δ) для улучшения кинетических характеристик окислительно-восстановительных превращений в композитах с MgMnO3 – δ (помол в этаноле смесей MgMnO3 – δ с промоторами, 24 ч) [4] показало, что при отжиге композитов MgMnO3 – δ c MgO даже при 1373 K не происходит растворения последнего в шпинели; положительная роль MgO в таких композиционных материалах заключается в препятствовании агломерации частиц MgMnO3 – δ. Для синтеза шпинели MgMnO3 – δ и твердых растворов Mg1 +xMnO3 – δ также было предложено использовать золь-гель метод. В работах [17, 18] гель, основным компонентом которого был тетрагидрат смешанного ацетата магния-марганца(II) MgMn(C2O4)2 · 4H2O, полученный при постепенном добавлении спиртового раствора H2C2O4 к раствору эквимолярной смеси Mg(CH3COO)2 · 4H2O и Mn(CH3COO)2 · 4H2O в этаноле, высушивали и отжигали при 923 K на воздухе или в кислороде, при этом образовывались нанокристаллиты (~20 нм) фазы MgMnO3. Состав полученного таким образом продукта, вычисленный по данным ТГ-ДСК, был MgMnO2.71 [19].
В [20] для образцов MgMnO3 (прекурсоры – нитраты Mg и Mn(II), восстановитель – лимонная кислота, отжиг продуктов сжигания геля при 623–1023 K на воздухе) была показана высокая фотокаталитическая активность в отношении процесса окисления антибиотиков в водных растворах методом озонирования. Сверхстехиометрические твердые растворы Mg1 +xMnO3 – δ в настоящее время изучены только на примере одного состава – Mg1.5MnO3 – δ, рассматриваемого в качестве перспективного катодного материала магний-ионных батарей. Для получения этого состава твердого раствора был использован гликоль-цитратный метод синтеза из нитратов Mg и Mn(II) с последующим отжигом продуктов сжигания геля при 923 K (2 ч) на воздухе. Для полученного таким способом гомогенного твердого раствора были определены структура и электрохимические характеристики [7].
Помимо кубической фазы шпинели методом ионного обмена в гидротермальных условиях (1073 K, 3000 атм, 6 ч) были получены образцы MgMnO3 со структурой ильменита FeTiO3 [21]. В качестве прекурсоров были использованы Li2MnO3, MgCl2 · 6H2O и KClO3. Роль последнего, по-видимому, заключалась в предотвращении восстановления ионов Mn водой. Однако данных о воспроизведении этих результатов в литературе нет. Одновременно с этим для синтеза MgMnO3 использовали непосредственно реакцию MgO и MnO2 при высоком давлении (1173–1273 K, 65 кбар) [21]. Оба подхода, по данным авторов, позволили получить образцы стехиометрического состава MgMnO3 со структурой ильменита, претерпевающие разложение с потерей кислорода при 853 K и образованием дефицитной по кислороду кубической фазы состава MgMnO2.9. Синтез при атмосферном давлении (прекурсоры – MgO и MnO2, 873–1273 K, 1 атм О2) приводил к получению аналогичной фазы – MgMnO2.9 [21].
Таким образом, для твердых растворов Mg1 +xMnO3 – δ не были разработаны оптимальные методики твердофазного синтеза из высокочистых прекурсоров, что особенно актуально ввиду развития высокопроизводительной техники непрерывной механохимической обработки [22], а также не была установлена область гомогенности и не исследованы продукты их восстановления. Литийсодержащие сверхстехиометрические шпинели MgLixMnO3 – δ – потенциальные материалы каталитических систем окислительных процессов – не были получены и исследованы до настоящего времени.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза в работе использовали прекурсоры особой чистоты: Mn2O3, MnO2 и Li2CO3 с содержанием основного компонента не менее 99.97%. Для получения веществ с точно известным заданным составом прекурсоры подвергали сушке в сушильном шкафу при 483–523 K. В качестве весовой формы магния применяли MgO. Ввиду возможных ошибок в приготовлении веществ с заданным составом из-за заметной гигроскопичности MgO особое внимание было уделено этому прекурсору. MgO получали термолизом особо чистого гидрата основного карбоната магния nMgCO3 · Mg(OH)2 · mH2O при 923 K в кварцевых ампулах со шлифом. По окончании выдержки при 923 K (2 ч) ампулу с MgO извлекали из печи при ~673 K, закрывали пришлифованной крышкой и помещали до использования в эксикаторе над CaH2. Для синтеза использовали только свежеприготовленный MgO.
Смеси прекурсоров с необходимым мольным соотношением компонентов-металлов подвергали механохимической активации (МХА), в результате образовывались механокомпозиты, состоящие из активированных доменов прекурсоров. Далее их отжигали в среде с необходимым содержанием кислорода. Для МХА использовали шаровую вибромельницу Retsch MM400 с размольными стаканами (25 мл) и размольными шарами (2–5 мм) из нержавеющей стали с покрытием из диоксида циркония. Время активации составляло 25–30 мин при частоте колебаний размольных стаканов 30 Гц, отношение массы шаров к массе обрабатываемых реагентов поддерживали на уровне 20–25 : 1. В настоящей работе использовали следующие газовые среды: кислород высокой чистоты (p(O2) ~1 атм), воздух (p(O2) ~ 0.21 атм), аргон высокой чистоты (p(O2) ≤ ≤ 1 × 10–4 атм) и смесь аргон + 4.8% водорода (p(H2) ~ 0.048 атм). Для синтеза на воздухе использовали муфельную печь Nabertherm L 5/11 и алундовые тигли, для синтеза в среде или токе кислорода, аргона или смеси H2 + Ar – кварцевую трубку-реактор (l = 800 мм, d = 35 мм) с системой подачи и отведения газов, герметизированную шлифовыми соединениями по обоим концам. В этом случае образец помещали в кварцевую лодочку. Ток газа контролировали ротаметром и поддерживали на уровне 70–80 мл мин–1, выхлоп газа из системы осуществляли через склянку Тищенко с концентрированной серной кислотой. Снаружи трубку-реактор обогревали трубчатой печью НАКАЛ ПТ 0.25.2/12.5 (Pt/PtRh-термопара). Для глубокого восстановления навеску образца твердого раствора (~400 мг) загружали в кварцевую лодочку известной массы, нагревали в токе смеси Ar + + 4.8% H2 (70–80 мл/мин) до 1123 K со скоростью 34 град/мин и выдерживали при этой температуре в течение 5 мин. Затем ток газа прекращали и оставляли установку остывать. Лодочку с образцом взвешивали для определения убыли кислорода и отбирали пробу образца для исследования методами ТГ-ДСК и РФА. Оставшуюся часть образца подвергали окислению – отжигу на воздухе при 1123 K в кварцевой трубке-реакторе в течение 15 мин. После охлаждения производили взвешивание лодочки с образцом. Количество циклов окисления-восстановления повторяли необходимое количество раз. Значение обратимой кислородной емкости рассчитывали как отношение (mox – mred)/mox, где mox – масса полностью окисленного материала-шпинели (исходного или после регенерации), взятого для восстановления Ar + 4.8% H2, mred – масса продукта/продуктов после операции восстановления.
Элементный анализ исследуемых образцов проводили методом масс-спектрометрии с индуктивно-связанной плазмой (ICP MS) на оптическом эмиссионном спектрометре iCAP 6300 Duo. Для перевода проб в раствор использовали 10%-ный раствор HCl особой чистоты с добавлением 30%-ного раствора H2O2 особой чистоты. Рентгенофазовый анализ (РФА) образцов выполняли в диапазоне углов 2θ = 10°–80° с шагом 0.01023° на рентгеновском дифрактометре Bruker D8 Advance (CuKα-излучение, Ni-фильтр, детектор LYNXEYE, геометрия на отражение) Центра коллективного пользования ИОНХ РАН. Термические исследования выполняли на синхронном термоанализаторе SDT Q600. Смеси прекурсоров, подвергшиеся МХА, во избежание абсорбции влаги исследовали методом ТГ-ДСК сразу после процедуры активации. Помимо ТГ-ДСК определение состава твердых растворов проводили методом обратного перманганатометрического титрования. По окончании растворения твердой фазы в избытке 0.098 н раствора H2C2O4, подкисленной избытком 2 М H2SO4, остаток щавелевой кислоты титровали раствором 0.0482 н KMnO4. Расчеты производили по уравнениям, например:
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение гомогенных твердых растворов-шпинелей Mg1 +xMnO3 – δ c х ≤ 0.2 возможно при 1073 K, в то время как для растворения большего количества MgO требуется отжиг при 1173–1223 K (рис. 1a). Продукты, получаемые при отжиге механически активированных смесей MgO как с Mn2O3, так и c MnO2, идентичны. Использование механокомпозитов, получаемых посредством МХА смеси прекурсоров при указанных параметрах, позволило сократить время последующего термического синтеза твердых растворов до 2 ч. Более продолжительные активация (≥45 мин) или отжиг (6, 12, 24 ч) не приводили к инструментально детектируемым изменениям фазового состава или содержания кислорода. При увеличении соотношения Mg : Mn > 1.45 : 1 в исходной смеси прекурсоров происходит образование второй фазы – Mg6MnO8 (рис. 1a, кривая 3). Близость положения рефлексов фазы шпинели и кубической фазы Mg6MnO8 создает определенные трудности их идентификации. Наиболее информативной областью дифракционной картины в данном случае является диапазон 2θ = 42°–44° (рис. 1б), в котором проявляется основной пик фазы Mg6MnO8 (4 0 0). С ростом содержания магния решетка сужается – с a = 0.8435(4) нм для MgMnO3 – δ до 0.8410(3) нм для предельного состава твердого раствора Mg1.45MnO3 – δ. Как видно из рис. 1б (кривые 3, 4), для образцов с соотношениями Mg : Mn = 1.7 : 1 и 5.5 : 1 наблюдается равновесие краевого состава твердого раствора Mg1.45MnO3 – δ и фазы Mg6 –xMnO8 – δ. В случае с рядом литийсодержащих твердых растворов MgLixMnO3 – δ образование второй фазы – твердого раствора Mg(Li)6MnO8 – наступает при меньшей концентрации введенного сверхстехиометрического металла: при содержании лития >25 мол. % (MgLi0.25MnO3 – δ) материал становится двухфазным (рис. 2). Увеличение температуры отжига не приводит к растворению второй фазы в случае обоих серий твердых растворов. Получение однофазных образцов шпинелей MgLixMnO3 – δ (0.1 ≤ x ≤ ≤ 0.25) возможно уже при 1023–1073 K. При введении лития в шпинель также наблюдается сжатие ячейки с a = 0.8435(4) нм для MgMnO3 – δ до 0.8434(1) и 0.8356(8) нм для MgLi0.02MnO3 – δ и MgLi0.25MnO3 – δ соответственно.
Рис. 1.
Дифрактограммы: а – шпинели MgMnO3 – δ (1), твердого раствора Mg1.45MnO3 – δ (2), двухфазной смеси Mg1.45MnO3 – δ + Mg6 –xMnO8 – δ (Mg : Mn = = 1.7 : 1) (3), двухфазной смеси Mg1.45MnO3 – δ + + Mg6 –xMnO8 – δ (Mg : Mn = 4.5 : 1) (4); б – фрагмент дифрактограммы (2θ = 42°–44°), Sp – фаза шпинели MgMnO3 – δ или Mg1 +xMnO3 – δ, Mg6 – фаза Mg6MnO8 – δ.
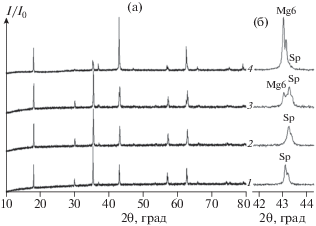
Рис. 2.
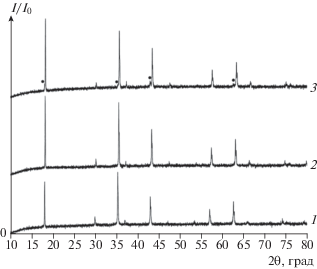
Дифрактограммы образцов твердых растворов шпинелей MgLixMnO3 – δ: 1 – MgLi0.02MnO3 – δ, 2 – MgLi0.25MnO3 – δ, 3 – двухфазная смесь брутто-состава “MgLi0.3 2MnO3 – δ”, ⚫ – ssMg(Li)6MnO8 – δ, ss – твердый раствор. Для фазы ssMg(Li)6MnO8 – δ маркером ⚫ отмечены только визуально различимые рефлексы.
Кроме прямого синтеза из смесей прекурсоров MgO, Mn2O3 или MnO2 (ряд Mg1 +xMnO3 – δ), а также Li2CO3 (ряд MgLixMnO3 – δ) получение обоих рядов аналогичных твердых растворов возможно при отжиге механокомпозитов смесей стехиометрической шпинели MgMnO3 – δ с MgO или Li2CO3 в условиях, аналогичных синтезу (1123–1273 K, 2 ч).
Возможность получения гомогенных твердых растворов Mg1 +xMnO3 – δ путем реакции стехиометрической шпинели MgMnO3 – δ с MgO противоречит данным [4]. Это было продемонстрировано на примере отжига смеси MgMnO3 – δ + 25 мол. % MgO (~7.8 мас. % MgO), когда уже при 1123 K (2 ч) из активированной смеси образовывался твердый раствор Mg1.25MnO3 + δ.
Изучение термического поведения активированных смесей прекурсоров на воздухе показало, что синтез MgMnO3 – δ из Mn2O3 и MnO2 протекает неодинаково. Все вещества, получаемые в ТГ-ДСК экспериментах, были однофазными шпинелями. Для проведения ТГ-ДСК эксперимента отбирали пробы от свежеприготовленных активированных смесей прекурсоров с необходимым мольным соотношением Mg : Mn или Mg : Li : Mn, оставшуюся же часть смеси отжигали в муфельной печи (1273 K, 2 ч) на воздухе и после остывания исследовали титриметрически.
Результаты определения содержания кислорода в образующихся соединениях по данным ТГ-ДСК и титриметрии приведены в табл. 1. Значения достаточно хорошо согласуются между собой, расхождение при этом может быть обусловлено различием в условиях синтеза, а именно ограниченностью времени для установления равновесия твердое вещество–кислород воздуха в термографических экспериментах. Для ТГ-ДСК экспериментов со смесями Mn2O3 состав образующихся соединений рассчитывали для точки окончания поглощения кислорода на стадии, ассоциированной с экзоэффектом, в случае со смесями MnO2 – окончанием выделения кислорода. Следует отметить, что отжиг смесей прекурсоров в кислороде не приводит к увеличению содержания последнего в получаемых твердых растворах – определяемые значения находятся в пределах погрешности титриметрического определения.
Таблица 1.
Состав шпинели MgMnO3 – δ и гомогенных твердых растворов Mg1 +xMnO3 – δ и MgLixMnO3 – δ на ее основе
| Соотношение компонентов-металлов в однофазных продуктах | Прекурсор марганца | Состав, рассчитанный по данным | |
|---|---|---|---|
| ТГ-ДСК | титриметрии* | ||
| Mg : Mn = 1 : 1 | Mn2O3 | MgMnO2.58 | MgMnO2.65 Mg1.252MnO2.85 |
| Mg : Mn = 1.252 : 1 | Mn2O3 | Mg1.252MnO2.80 | |
| Mg : Mn = 1 : 1 | MnO2 | MgMnO2.65 | MgMnO2.67 |
| Mg : Li : Mn = 1 : 0.107 : 1 | Mn2O3 | MgLi0.107MnO2.65 | MgLi0.107MnO2.70 |
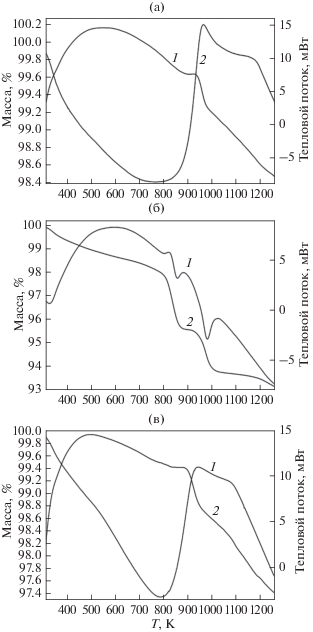
Изучение термического поведения активированных смесей прекурсоров показало, что в случае смеси 2MgO + Mn2O3 (продукт – шпинель MgMnO3 – δ) синтез начинается в области 873 K и заканчивается при 961 K (рис. 3a), что сопоставимо с условиями синтеза с использованием сжигания геля (823–928 K) [17, 18]. Синтезу предшествует (>773 K) значительный прирост массы за счет присоединения кислорода. Потеря массы, наблюдаемая с начала нагревания (303–763 K), обусловлена выделением кислорода из активированного Mn2O3, что не противоречит его содержанию в смеси. Вид дифференциальной кривой и кривой потери массы при нагревании смеси 2.504MgO + Mn2O3 (продукт – твердый раствор Mg1.252MnO3 – δ) сходен с таковым для смеси с эквимолярным соотношением Mg : Mn. В этом случае температура начала синтеза равна ~873 K, однако завершается он при несколько более высокой температуре (993 K). При дальнейшем нагревании как шпинели MgMnO3 – δ (выше ~1144 K), так и твердого раствора Mg1.252MnO3 – δ (выше ~1058 K) происходит их разложение, по-видимому, с образованием твердого раствора на основе тетрагональной модификации Mn3O4, а также MgO [3]. Термическое поведение эквимолярной смеси MgO + MnO2 имеет значительные отличия (рис. 3б). Синтез происходит в интервале 799–855 K, при этом образуется шпинель состава MgMnO2.65, что сопровождается выделением кислорода (рис. 3б). Синтез твердых растворов MgLi1 +xMnO3 – δ протекает в сходных условиях и наблюдается при 793–941 K. Это показано на примере нагревания смеси MgO, Mn2O3 и Li2CO3 с соотношением компонентов-металлов Mg : Li : Mn = 1 : 0.107 : 1. Перед синтезом происходит потеря CO2 из Li2CO3 и кислорода из Mn2O3. Для расчета состава методом ТГ-ДСК необходимо было убедиться, что в условиях механоактивации не происходило разложение Li2CO3. Это было показано при измерении объема выделившегося CO2 при обработке смесей, прошедших МХА c использованием 5% HCl: содержание ${\text{CO}}_{3}^{{2 - }}$ в смеси Li2CO3, Mn2O3 и MgO, подвергшейся МХА, не отличается от рассчитанного для исходной смеси без обработки. Вследствие изоляции исследуемых препаратов от действия воздуха влиянием адсорбированной воды на данные ТГ-ДСК можно пренебречь.
Рис. 3.
Данные ТГ-ДСК нагревания смесей прекурсоров на воздухе (p(O2) = 0.21 атм), подвергшихся механохимической обработке: 2MgO + Mn2O3. (a), MgO + + MnO2 (б), 2MgO + 0.107 Li2CO3 + Mn2O3 (в); 1 – дифференциальная кривая, 2 – кривая массы.
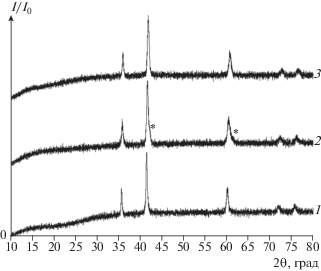
Наибольший интерес для циклических окислительно-восстановительных процессов, связанных с переносом кислорода, представляет стадия, на которой материал-носитель кислорода теряет максимальное количество кислорода. Поэтому в настоящей работе были изучены обратимые превращения продуктов глубокого восстановления твердых растворов Mg1 +xMnO3 – δ и MgLixMnO3 – δ. О глубине восстановления твердых растворов, полученных при восстановлении в идентичных условиях, можно судить по значению привеса в термогравиметрическом эксперименте на воздухе. Все продукты глубокого восстановления шпинели MgMnO3 – δ, а также твердых растворов Mg1 +xMnO3 – δ и MgLixMnO3 – δ смесью Ar + + 4.8% H2 представляют собой твердые растворы (Mg,Mn)O и (Mg,Mn,Li)O (рис. 4). Следует отметить, что при восстановлении шпинели Mg1.252MnO3 – δ обнаруживается образование двух твердых растворов (Mg,Mn)O (рис. 4, кривая 2), близких по составу.
Рис. 4.
Дифрактограммы продуктов глубокого восстановления смесью Ar + 4.8% H2 шпинелей MgMnO3 – δ (1), Mg1.252MnO3 – δ (2) и MgLi0.107MnO3 – δ (3). Знаком * отмечены двойники рефлексов, относящиеся к фазам (Mg,Mn)O, близким по составу.
Как было показано методом РФА, во всем диапазоне составов гомогенных твердых растворов – шпинелей Mg1 +xMnO3 – δ и MgLixMnO3 – δ – продукты различной глубины их восстановления могут быть регенерированы в исходную шпинель. Дифракционные картины получаемых при этом веществ идентичны исходным шпинелям Mg1 +xMnO3 – δ и MgLixMnO3 – δ, взятым для восстановления смесью аргон–водород. Результаты исследования термического поведения продуктов восстановления MgMnO3 – δ, а также твердых растворов Mg1 +xMnO3 – δ и MgLixMnO3 – δ приведены на рис. 5. Из диаграмм видно, что окисление твердых растворов (Mg,Mn)O и (Mg,Mn,Li)O начинается уже при 520–550 K; на дифференциальной кривой можно наблюдать два экзоэффекта: первый в области 673–723 K, второй в интервале 769–808 K. По-видимому, первый экзоэффект связан с окислением твердых растворов (Mg,Mn)O и (Mg,Mn,Li)O и образованием твердого раствора на основе тетрагональной модификации Mn3O4 [3], второй – с синтезом шпинели MgMnO3 – δ, непосредственно наблюдаемой на дифрактограммах остатков после ТГ-ДСК. Такое отнесение первого экзоэффекта согласуется с тем, что на термограмме окисления продукта восстановления шпинели Mg1.252MnO3 – δ (рис. 5б), состоящего из двух близких по составу твердых растворов (MgxMny)O1 – α (рис. 3, кривая 2), этот эффект выражен слабее по сравнению с окислением однофазного твердого раствора MgMnO1 – ε (рис. 5a). Наименее выражен первый экзотермический эффект при окислении MgLi0.107MnO1 – γ, это связано с более низкой температурой, необходимой для синтеза шпинелей ряда MgLixMnO3 – δ по сравнению с MgMnO3 – δ и Mg1 +xMnO3 – δ.
Рис. 5.
Данные ТГ-ДСК нагревания продуктов глубокого восстановления твердых растворов шпинелей на воздухе (p(O2) = 0.21 атм): MgMnO3 – δ (а), Mg1.252MnO3 – δ (б), MgLi0.107MnO3 – δ (в); 1 – дифференциальная кривая, 2 – кривая массы.
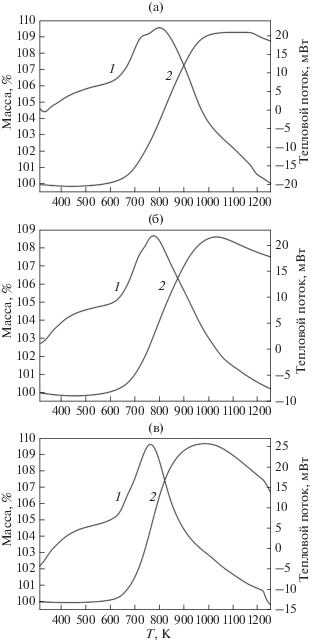
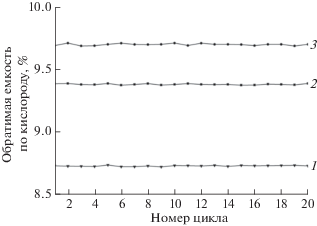
Из кривых массы видно (рис. 5), что реакция с кислородом воздуха продуктов восстановления шпинели Mg1.252MnO3 – δ сопровождается привесом в 8.73% (рис. 5), это значение на 7% меньше, чем для продукта восстановления MgMnO3–δ (9.39%). Однако при окислении MgLi0.107MnO1 – γ (продукт восстановления шпинели MgLi0.107MnO3 – δ) наблюдается привес в 9.72% за счет присоединения кислорода. При двадцатикратном последовательном повторении восстановления твердых растворов Mg1 +xMnO3 – δ и MgLixMnO3 – δ смесью Ar + 4.8% H2 и окислении образующихся продуктов сохраняется исходная структура шпинели, что было продемонстрировано методом РФА. Значения обратимой емкости по кислороду для шпинелей MgMnO3 – δ, Mg1.252MnO3 – δ и MgLi0.107MnO3 – δ характеризуются хорошей стабильностью и воспроизводимостью (рис. 6). Эти данные находятся в отличном согласии с результатами по изучению окисления методом ТГ-ДСК. Введение сверхстехиометрического лития на примере состава MgLi0.107MnO3 – δ увеличивает обратимую емкость по кислороду на ~3.5% по сравнению со шпинелью MgMnO3 – δ, а магния, наоборот, снижает на ~7% для исследованных составов. Следует отметить, что найденные значения для шпинели MgMnO3 – δ выше таковых, полученных в работе [3] для смеси с более высоким содержанием H2 (15%). Это расхождение может быть вызвано спеканием кристаллитов шпинели, поскольку изучаемые авторами образцы были получены отжигом при 1473 K, в то время как в данной работе температура синтеза исследованных образцов не превышала 1123 K.
ЗАКЛЮЧЕНИЕ
Проведен синтез и обратимое глубокое восстановление шпинелей Mg1 +xMnO3 – δ и MgLixMnO3 – δ, определен предельный состав по литию и магнию, а также содержание кислорода. Показано, что введение лития в шпинель повышает обратимую емкость по кислороду, а магния, наоборот, понижает ее относительно стехиометрической MgMnO3 – δ. Простота получения твердых растворов-шпинелей MgLixMnO3 – δ со значительным содержанием лития, обладающих более высокой обратимой емкостью по кислороду по сравнению со шпинелью MgMnO3 – δ, и простота их регенерации позволяют использовать эти материалы для каталитических систем окислительных процессов, таких как окислительная конверсия метана или сжигание с химическим циклом.
Список литературы
Yusuf S., Neal L., Bao Z. et al. // ACS Catal. 2019. V. 9. № 4. P. 3174. https://doi.org/10.1021/acscatal.9b00164
Yusuf S., Neal L.M., Li F. // ACS Catalysis. 2017. V. 7. № 8. https://doi.org/10.1021/acscatal.7b02004
Hwang J.H., Baek J.I., Ryu H.J. et al. // Fuel. 2018. V. 231. P. 290. https://doi.org/10.1016/j.fuel.2018.05.111
Hwang J.H., Lee K.-T. // J. Ceram. Process. Res. 2018. V. 19. № 5. P. 372.
Adanez J., Abad A., Garcia-Labiano F. et al. // Prog. Energy Combust. Sci. 2012. V. 38. № 2. P. 215. https://doi.org/10.1016/j.pecs.2011.09.001
Bayham S.C., Tong A., Kathe M. et al. // WIREs Energy Environ. 2015. V. 5. № 2. P. 216. https://doi.org/10.1002/wene.173
Saha P., Jampani P.H., Hong D.-H. et al. // Mater. Sci. Eng. B. 2015. V. 202. P. 8. https://doi.org/10.1016/j.mseb.2015.08.008
Dilner D., Pavlyuchkov D., Zienert T. et al. // J. Am. Ceram. Soc. 2017. V. 100. № 4. P. 1661. https://doi.org/10.1111/jace.14686
Oliveira V., Brett N. // J. Phys. Colloq. 1986. V. 47 (C1). P. C1-453. https://doi.org/10.1051/jphyscol:1986168
Panda S.K., Jung I.-H. // J. Am. Ceram. Soc. 2014. V. 97. № 10. P. 3328. https://doi.org/10.1111/jace.13106
Lunsford J.H. // Catal. Today. 2000. V. 63. P. 165. https://doi.org/10.1016/S0920-5861(00)00456-9
Fox J.M. // Catal. Rev.-Sci. Eng. 1993. V. 35. № 2. P. 169. https://doi.org/10.1080/01614949308014605
Ito T., Lunsford J.H. // Nature. 1985. V. 314. P. 7212. https://doi.org/10.1038/314721b0
Галанов С.И., Галанов А.И., Смирнов М.Ю. и др. // Изв. Томского политехн. ун-та. 2005. Т. 308. № 1. С. 126.
Nipan G.D., Buzanov G.A., Zhizhin K.Yu. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 14. P. 1689. https://doi.org/10.1134/S0036023616140035
Buzanov G.A., Nipan G.D., Zhizhin K.Yu. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 5. P. 551. [Бузанов Г.А., Нипан Г.Д., Жижин К.Ю и др. // Журн. неорган. химии. 2017. Т. 62. № 5. С. 551. https://doi.org/10.7868/S0044457X17050051]https://doi.org/10.1134/S0036023617050059
Seehra M.S., Singh V., Thota S. et al. // Appl. Phys. Lett. 2010. V. 97. № 11. P. 112507. https://doi.org/10.1063/1.3489094
Seehra M.S., Singh V., Thota S. // J. Appl. Phys. 2011. V. 110. № 11. P. 113907. https://doi.org/10.1063/1.3664910
Thota S., Singh A., Prasad B. et al. // AIP Advances. 2012. V. 2. P. 032140. https://doi.org/10.1063/1.4747457
Lua J., Suna J., Chen X. et al. // Chem. Eng. J. 2019. V. 358. P. 48. https://doi.org/10.1016/j.cej.2018.08.198
Chamberland B.L., Sleight A.W., Weiher J.W. // J. Solid State Chem. 1970. V. 1. P. 512. https://doi.org/10.1016/0022-4596(70)90133-7
Аввакумов Е.Г., Гусев А.А. Механические методы активации в переработке природного и техногенного сырья. Новосибирск: Гео, 2009. 155 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии