Микроэлектроника, 2020, T. 49, № 6, стр. 413-428
Термическое атомно-слоевoе осаждение TiNx с использованием TiCl4 и N2H4
А. И. Абдулагатов a, *, М. Х. Рабаданов a, И. М. Абдулагатов a
a Дагестанский государственный университет (ДГУ)
367000 Махачкала, ул. Гаджиева, 43-а, Россия
* E-mail: ilmitdina@gmail.com
Поступила в редакцию 13.12.2019
После доработки 20.01.2020
Принята к публикации 11.02.2020
Аннотация
Aтомно-слоевое осаждение (АСО) нитрида титана (TiN) проводилось попеременными поверхностными реакциями тетрахлорида титана (TiCl4) и гидразина (N2H4). Осаждение проводилось в интервале температур от 150 до 350°C. Процесс нанесения пленки исследовали in situ методами кварцевого пьезоэлектрического микровзвешивания (КПМ) и Фурье-ИК-спектроскопии (ФИКС). При 200 и 225°С КПМ данные показали самоограничивающийся характер поверхностных реакций TiCl4 и N2H4, а также линейность роста пленки с количеством циклов. При оптимальной температуре роста в 275°C постоянная роста TiNx пленки составляла 0.36 Å/цикл. Шероховатость и плотность полученной при данной температуре пленки толщиной 116.3 Å соответственно составляли 7.2 Å и 87.5% (от объемной плотности TiN). Анализ данных пленок рентгеновской фотоэлектронной спектроскопией (РФС) показал, что содержание примесей хлора в них ниже предела чувствительности инструмента (<0.2 ат. %), а кислорода примерно 14 ат. %. Рентгеноструктурные измерения показали, что пленки имеют кубическую поликристаллическую структуру. ФИКС метод использовали для исследования химии поверхности осаждения при 200 и 275°С. Была также продемонстрирована возможность осаждения АСО титан-алюминиевого нитрида (TiAlxNy), где в качестве прекурсора алюминия использовали триметилалюминий (ТМА). В пленках, полученных при 275°С, содержание примесей кислорода и хлора было примерно 3 и 4 ат. % соответственно.
ВВЕДЕНИЕ
Атомно-слоевое осаждение (АСО) привлекло значительное внимание вследствие его уникальной способности наносить высоко конформные, бездефектные функциональные тонкие пленки на структурах с высоким аспектным отношением [1]. Данная технология позволяет контролировать толщину наносимых покрытий на уровне Ангстрема. Под названием “молекулярное наслаивание”, этот метод был разработан в начале шестидесятых годов прошлого столетия научной школой член-корреспондента Академии наук СССР Валентина Борисовича Алесковского [2]. В АСО рост пленок осуществляется “снизу-вверх” посредством повторяющихся, самоограничивающихся поверхностных реакций. В отличие от плазмастимулированного АСО (ПС-АСТ) в термическом АСО пленки осаждаются за счет термически стимулированных поверхностных реакций.
В западных странах одним из движущих факторов развития АСО технологий в основном являются проблемы электронной промышленности [1]. В 2007 г. международный план по развитию полупроводниковой технологии (ITRS) включил АСО как метод осаждение пленок оксидов с высокими диэлектрическими постоянными для затворов в МДП-структуре и диффузионных барьеров для меди [1, 3]. Потребность в сверхтонких барьерных пленках для медных контактов привела к росту исследований в области АСО проводящих нитридов металлов, таких как TaN, TiN и WN [4].
В связи с этим, нитрид титана (TiN) стал одним из наиболее изученных среди АСО нитридов металлов, который осаждался различными прекурсорами и методами [4, 5]. Первые описанные в литературе термические АСО процессы осаждения TiN использовали галогениды титана TiCl4 [6–13] или TiI4 [14] в качестве прекурсора титана, и аммиак (NH3) как прекурсор азота. Применяя TiCl4 и NH3, ранее было продемонстрированно осаждение поликристаллического кубического АСО TiN с постоянной роста 0.2–0.3 Å/цикл при температурах от 350 до 500°C [13, 15]. Использование TiI4 вместо TiCl4 вело к незначительным изменениям в параметре роста, количестве примесей и температуре осаждения [14].
Вскоре было установлено, что высокие температуры осаждения и присутствие примесей галогенов являются недостатками систем TiCl4/NH3 и TiI/NH3 ограничивающими их применение в промышленности [4]. Для снижения примесей, TiCl4 напускали с такими cореагентами, как цинк [15, 16], триметилалюминий (TMA) [17] и плазма смеси газов H2/N2 [18]. В то же время, тестировались альтернативные металлоорганические (МО) прекурсоры титана, такие как тетракис(диэтиламидо)титан (ТДЕАТ) [19] и тетракис (диметиламидо) титан (ТДМАТ) [20–22]. Эти алкиламиды в паре с NH3 позволили снизить температуру осаждения TiN до 200°C и ниже. Однако использование МО ведет к росту пленок низкой плотности с высоким содержанием примесей [21]. Кроме этого, ранее сообщалось о проблемах с адгезией к меди данных пленок [5]. Относительно хорошего качества пленки TiN получали при низких температурах с помощью плазменно-стимулированного MO АСО [23–25].
В поисках более реакционноспособного прекурсора азота ранее был опробован 1,1-диметилгидразин (C2H8N2, ДМГ) в сочетании с TiCl4 [26]. Используя TiCl4 и ДМГ, осаждение пленок TiN было продемонстрировано при относительно низкой температуре 250°C с постоянной роста 0.2 Å/цикл. Однако пленки, полученные при 300°C, содержали ~16 ат. % хлора и ~6 ат. % углерода [26]. Примеси хлора могут диффундировать в оксидные затворы МДП [27, 28], что ухудшает их диэлектрические свойства и увеличивает вероятность коррозии.
Поскольку осаждение пленок TiN термическим АСО хорошего качества при температурах ниже 300°C остается проблемой, в данной работе мы исследовали в качестве альтернативной химии осаждения применение комбинации TiCl4 и гидразин (N2H4). Первые исследования по АСО TiN с использованием TiCl4 и гидразина (N2H4) были ранее представлены в работах [29, 30]. С некоторых пор интерес к данной системе возрос и было опубликовано несколько работ [31, 32]. Гидразин – более предпочтительный восстановитель титана Ti+4 в хлориде до Ti+3 в нитриде титана по сравнению с другими реагентами азота [33, 34]. Эффективность гидразина как реагента в сравнении с аммиаком, который чаще всего используется в качестве прекурсора азота, можно оценить из термохимических расчетов для газофазных реакций TiCl4 c NH3 или N2H4 [35].
Из данных расчетов видно, что при 275°C осаждение TiN с использованием N2H4 возможно, так как стандартное изменение свободной энергии отрицательно. Газофазная реакция хлорида титана и аммиака становится термохимически возможной при 320°С [15], где ΔG320°C = –0.6 ккал/моль [35]. Неполная поверхностная реакция TiCl4 c NH3 даже при высоких температурах ведет к низким темпам роста и присутствию примесей в пленках [36]. Отсутствие алкильных составляющих в молекуле гидразина гарантирует отсутствие углеродных примесей в пленках, что является недостатком АСО системы TiCl4/ДМГ [26]. Ранее гидразин успешно применялся при осаждении AlN [37] и GaN [38] методом химического осаждения из газовой фазы (ХОГФ), АСО Si3N4 [39], TaN [40], AlN [41, 42] и в процессах азотирования некоторых металлов переходной группы [43].
Помимо АСО TiNx в данной работе была изучена возможность использования N2H4 для осаждения АСО TiAlxNy, где триметилалюминий (TMA) использовался как реагент алюминия. Пленки TiAlxNy рассматриваются как возможная альтернатива TiN вследствие его высокой стойкости к окислению и надлежащих электрических характеристик [4]. Ранее было показано, что пленки TiAlxNy с низким содержанием алюминия являются эффективным барьерным слоем в устройствах микроэлектроники [44]. Помимо применения в электронике, пленки TiAlxNy могут применяьтся как твердые покрытия [45, 46], а также как селективный абсорбер в преобразователях солнечной энергии [47, 48] и т.д. Осаждение пленок TiAlxNy термическим АСО было ранее продемонстрировано с использованием системы TiCl4/NH3/TMA [17], TiCl4/диметилалюминий гидрид этилпипердина (ДМАГ-ЭПП) [49], или ТДМАТ/NH3/ДМАГ-ЭПП [50]. Для осаждения АСО TiAlxNy гидразин применялся впервые.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследование АСО TiNx и TiAlxNy проводилось на оборудовании компании АСО НаноТех (г. Махачкала, Россия). АСО установка состоит из вакуумной камеры с горячими стенками. В качестве газа носителя использовался азот ультравысокой чистоты (УВЧ, 99.999%). В процессе осаждения давление в реакторе, при помощи натекателя УВЧ N2,поддерживалось на уровне ~0.8 Торр. Тетрахлорид титана с чистотой 99.8% был получен от Sigma-Aldrich, inc. (CAS: 7550-45-0). Используемый гидразин имел уровень чистоты 98% (Sigma-Aldrich, inc., CAS: 302-01-2). Оба химических вещества были перенесены в стеклянные контейнеры в перчаточном пластиковом мешке в среде инертного газа (УВЧ N2). Контейнеры с TiCl4 и N2H4 перед использованием были дегазированы с использованием 2–3 циклов процедуры замораживание-откачка-оттаивание. При обращении с гидразином необходимо соблюдать особую осторожность из-за его взрывоопасности [51]. Гидразин держали в стеклянной посуде из-за его возможного разложения в стальных контейнерах [37]. Триметилалюминий (Al(CH3)3, ТМА) с чистотой 97%, использованный для осаждения ALD Al2O3 и TiAlxNy, был поставлен компанией Sigma-Aldrich, inc. (CAS: 75-24-1). В процессе АСО прекурсоры держались при комнатной температуре. Гидразин при комнатной температуре – жидкость с давлением паров 10 Торр при 30.7°C (данные Sigma-Aldrich, inc.).
Предварительно нарезанные кремниевые пластины (Si〈100 〉) размером 2.5 × 2.5 см использовали в качестве подложки для ex-situ анализа полученных TiNx и TiAlxNy пленок. Кремниевая пластина с траншеями, с соотношением сторон 1/4, компании Sematech Inc. (США), использовалась для исследования конформности нанесения пленки нитрида титана. Изображения слома подложки с пленкой были получены с помощью сканирующего электронного микроскопа (СЭМ) при напряжении и токе пучка 5.0 кэВ и 10 мкА соответственно.
До начала осаждения пленок все кремниевые пластины были промыты ацетоном, изопропанолом, высушены в потоке УВЧ N2 и оставлены для дегазации в реакционной камере под вакуумом в течение примерно 30 мин. Все использованные в данной работе кремниевые пластины имели слой естественного оксида кремния толщиной примерно 25 Å.
КПМ исследования проводились in situ с использованием позолоченных полированных кристаллов кварца с резонансными частотами 6 МГц, поставленных компанией Colorado crystal corp. (США). Разрешение КПМ по массе составляет примерно 0.3 нг/см2. Подробную информацию о КПМ инструментарии, использованном в данной работе, можно получить из предыдущей публикации [52]. До начала нанесения нитрида титана, поверхность кварцевого кристалла покрывали, в том же реакторе, пленкой АСО Al2O3 толщиной примерно 60 Å, для чего использовали ТМА и H2O. Погрешности КПМ данных для каждой из точек кривых насыщения прекурсоров рассчитывались по стандартным отклонениям 10–15 измерений.
Время подачи и продувки реагентов (в секундах) для одного АСО цикла в статье обозначены как t1/t2/t3/t4, где t1 – время напуска TiCl4, t3 – время напуска N2H4, а t2, t4 – время продувки после напусков первого и второго реагентов соответственно. Время одного АСО цикла TiAlxNy обозначали как t1/t2/t3/t4/t6/t7/t8/t9, где t6 и t8 – время напуска TMA и N2H4, а t7 и t9 – времена их продувки.
Данные отражения и дифракции рентгеновских лучей (ОРЛ и ДРЛ) были получены с помощью дифрактометра высокого разрешения с рентгеновской медной трубкой, работающей при λ = 1.54 Å и током нити 40 мА и напряжением 40 кВ. ОРЛ анализ использовался для определения плотности, поверхностной среднеквадратичной (RMS) шероховатости и толщины полученных TiNx пленок. Для ДРЛ анализа образцы держали при ω = 1°, а сканирование детектором проводили от 20° до 80° (2θ). ДРЛ измерения проводились для определения кристаллической структуры и размера зерен пленок TiNx. Представленные на некоторых рисунках значения погрешности толщины АСО пленок рассчитывались из значений толщин трех образцов напыляемых одновременно и расположенных один за другим по направлению потока газа на расстоянии примерно 1.5 см друг от друга.
Данные рентгеновской фотоэлектронной спектроскопии (РФС) были получены с использованием монохроматического Al Kα рентгеновского источника (1486.6 эВ) с возможностью распыления Ar+. Энергия ионов аргона при травлении составляла примерно 1.5 кэВ. Фотоэлектроны собирали с помощью полусферического анализатора. Данные РФС позволили определить химический состав и уровень примесей в полученных пленках.
Трансмиссионные Фурье-ИК-спектроскопические (ФИКС) исследования осаждения TiNx проводили в режиме in situ при 200 и 275°С. ФИКС эксперименты проводили в специально оборудованном АСО аппарате с теплыми стенками, где осаждение проводили на спрессованных наночастицах оксида циркония (ZrO2). Сканирование было выполнено с помощью спектрометра Nicolet Magna 560, оборудованного инфракрасным детектором MCT-B с азотным охлаждением. Более детальную информацию об использованной АСО установке, интегрированной с ФИКС, можно получить из одной из ранних публикации [53].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
А) КПМ исследование АСО TiNx
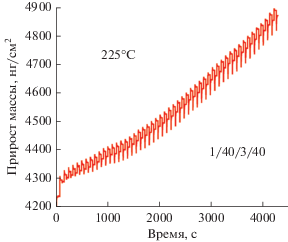
На рис. 1 показаны данные КПМ, полученные в процессе нуклеации АСО TiNx на аморфном АСО Al2O3, предварительно нанесенном на кристалл КПМ. Осаждение проводилось при 225°С с временем напуска и продувки реагентов в цикле 1/40/3/40. Процесс осаждения начинается значительным приростом массы на 32.5 нг/см2 на первом АСО циклe. Это происходит за счет существенного прироста массы во время первого напуска TiCl4, что связано с высокой концентрация поверхностных (–OH) групп аморфного Al2O3. На втором и последующих циклах общий прирост массы за цикл резко снизился до 10 нг/см2, а затем в течение около 20 циклов стабилизировался на уровне ~14 нг/см2. Отметить относительно быструю нуклеацию пленки нитрида на поверхности оксида алюминия. Ранее указывалось, что АСО пленки, осаждаемые при 350 и 450°С с использованием TiCl4 и NH3, имеют нуклеационный период на SiO2 от 100 до 150 циклов [7, 54]. Такая разница может быть связана как с низкой популяцией гидроксильных групп на поверхности оксида кремния при высоких температурах, так и низкой реакционностью используемых прекурсоров. В продвинутых интегральных схемах барьерные слои для меди должны быть очень тонкими, непрерывными и без дефектов, чтобы эффективно противостоять диффузии и быть электрически надежными [55, 56]. В связи с этим короткий нуклеационный период осаждаемой барьерной пленки нитрида более предпочтителен.
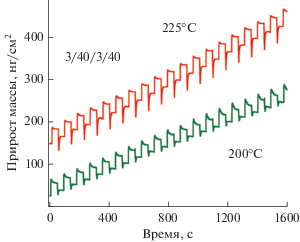
Рис. 2 иллюстрирует наблюдаемый КПМ прирост массы в течение восемнадцати АСО TiNx циклов при температурах 200 и 225°С. Видно, что попеременное дозирование TiCl4 и N2H4 в реакционную камеру ведет к линейному приросту массы, а также обеспечивает высокую воспроизводимость процесса от цикла к циклу. Кроме этого, с повышением температуры наблюдается увеличение прироста массы приходящегося на один АСО цикл.
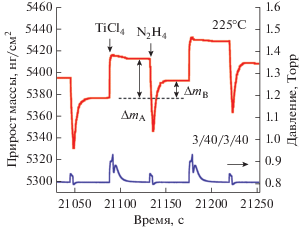
На рис. 3 показан детальный вид сигнала КПМ, наблюдаемый при 225°C после нуклеации на Al2O3. Данный рисунок показывает изменение массы во время напуска TiCl4 и N2H4, а также данные датчика давления в камере. Для осаждения использовали время напуска и продувки за один цикл 3/40/3/40. Парциальное давление TiCl4 при напуске в течение 3 с составляло 125 мТорр (37.5 × × 104 L), а N2H4 – примерно 40 мТорр (12 × 104 L), где 1L = 1 × 10–6 Торр ⋅ с. Напуск TiCl4 приводит к увеличению массы на 36 нг/см2 (ΔmА), после чего масса стабилизируется и остается постоянной на время продувки, за которым следует снижение массы после напуска N2H4 и ее стабилизация. В результате общий прирост массы за один цикл составил 16.5 нг/см2 (ΔmВ). При 200°С значения ΔmА и ΔmВ составляли 28.4 и 12.5 нг/см2 соответственно. Увеличение и снижение массы во время напуска реагентов происходит в соответствии с предполагаемым механизмом поверхностных реакций, где напуск TiCl4 приводит к росту массы, а замена (–Cl) лигандов на титане на аминогруппы (–NHx) – к ее снижению. Резкое снижение массы во время напуска N2H4 связано с температурно-индуцированными скачками частоты осцилляции кварцевого кристалла. Схожие скачки ранее наблюдались в АСО процессах, которые проводились с использованием озона (О3) [57] или газов с высокой теплоемкостью [58].
Самоограничиваемость поверхностных реакций TiCl4 и N2H4 исследовали с помощью КПМ при температурах осаждения 200 и 225°C. На рис. 4а представлены КПМ данные зависимости прироста массы, приходящейся на один АСО цикл, от продолжительности напуска TiCl4. Эксперимент проводился при времени напуска и продувки реагентов в цикле х/40/3/40, где х – изменяемое время напуска TiCl4, а 3 – фиксированное время напуска N2H4 в секундах. Аналогично, на рис. 4б показаны результаты насыщения для N2H4, которые были получены с использованием времени для одного цикла 3/40/x/40, где х – изменяемое время напуска N2H4, и где время напуска TiCl4 составляло 3 с. Из данных графиков видно, что при данных температурах осаждения прирост массы за цикл достигает плато при 2.5-секундных напусках TiCl4 и N2H4. Это говорит о том, что поверхностные реакция TiCl4 и N2H4 являются самоограничивающимися и тем самым выполняется одно из необходимых условий проведения процесса АСО. На рис. 4 максимальный прирост массы TiNx на один цикл при 200 и 225°C составлял 12.6 и 16.5 нг/см2 соответственно.
Рис. 4.
КПМ данные зависимости прироста массы за один АСО цикл от времени напуска: а) TiCl4 и б) N2H4 при 200 и 225°С.
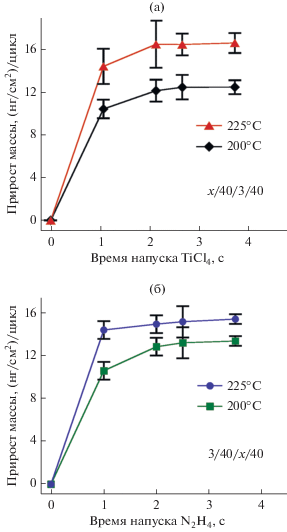
В представленных ниже экспериментальных данных использовали параметры АСО цикла 3/40/3/40, где количество напускаемых TiCl4 и N2H4 оптимально для гарантированного достижения насыщения в поверхностных реакциях. Время продувки в 40с в данной работе не оптимизировалось и было выбрано произвольно.
Б) Осаждение и анализ АСО пленок TiNx и TiAlxNy на кремниевых подложках
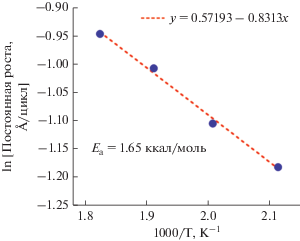
Температурную зависимость роста АСО TiNx исследовали осаждением на подложках Si〈100 〉 в интервале температур от 150 до 350°С. При каждой температуре на подложки со слоем естественного оксида кремния наносили по 300 АСО циклов TiNx. На рис. 5 представлены зависимость постоянной роста и плотности пленки нитрид титана от температуры осаждения. Данные были получены измерением толщины и плотности полученных пленок методом отражения рентгеновских лучей (ОРЛ). При 150°C постоянная роста TiNx составляла 0.46 Å/цикл, при 200°C она снизилась до 0.3 Å/цикл, после чего скорость роста линейно увеличилась до 0.38 Å/цикл при 275°C. Эта тенденция согласуется с термически активированным процессом. График Аррениуса зависимости натурального логарифма постоянной роста TiNx от температуры осаждения в интервале от 200 до 275°C показан на рис. 6. Из наклона средней линии рассчитали энергию активации (Ea), равную 1.65 ккал/моль. Увеличение темпа роста пленки с повышением температуры согласуется с КПМ данными. При осаждении выше 275°C наблюдается снижение постоянной роста и плотности пленки. Значительный градиент по толщине (~38%) осаждаемых пленок наблюдался при 300°С, что предположительно связано с термическим разложением N2H4. По некоторым литературным данным, жидкий [59] и газофазный [60] гидразин разлагаются при ~300°C. Возможно, при 350°С гидразин разлагается в газовой фазе до реакции с поверхностью, что ведет к значительному снижению количества поверхностных реакционных групп и соответственно к падению темпа роста.
Рис. 5.
ОРЛ данные зависимости постоянной роста и плотности АСО пленок TiNx от температуры осаждения. Пленки осаждались на Si〈100 〉 с естественным оксидом, используя 300 АСО циклов при каждой температуре.
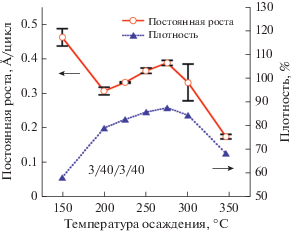
Рис. 6.
График Аррениуса температурной зависимости ln постоянной осаждения TiNx в интервале от 200 до 275°C. Наклон графика Аррениуса дает энергию активации Ea = 1.65 ккал/моль.
На рис. 5 также показано, что плотность пленки достигает своего пикового значения 4.6 г/см3 при 275°C. Значительное снижение плотности пленки наблюдается при 350°С. Расчетные значения прироста массы (~15 нг/см2) из ОРЛ данных для плотности (82.7%) и постоянной роста (0.33 Å/цикл) хорошо согласуются с данными, полученными КПМ при 225°С (~16 нг/см2). Данные среднеквадратичной (RMS) шероховатости пленок TiNx полученные с помощью ОРЛ, показали, что с ростом температуры осаждения шероховатость увеличивается. Так, шероховатость пленок толщиной примерно 100 Å увеличилась от 5 Å при 200°C до 7.2 Å при 275°C. Высокая скорость роста и плотность пленки TiNx полученной при 275°C, говорит о том, что это оптимальная температура осаждения АСО TiNx с использованием TiCl4 и N2H4.
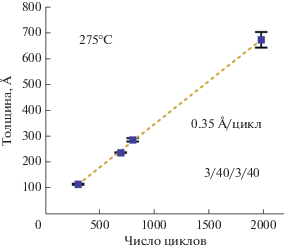
На рис. 7 показана зависимость толщины TiNx от количества АСО циклов. Эксперимент проводили при оптимальной температуре осаждения в 275°C. Из наклона средней линии была получена постоянная роста TiNx равная 0.35 Å/цикл. Максимальная разница в толщине ~9% между образцами, расположенными на расстоянии около 5 см друг от друга, наблюдалась только при осаждении с использованием 2000 циклов. Подобное поведение свойственно для осаждаемых АСО материалов с кристаллической структурой [57]. Шероховатость пленок, полученных при 275°C, менялась в зависимости от их толщины. Так, пленки толщиной 116.3 и 670.6 Å, имели среднеквадратичную шероховатость 7.2 и 12 Å соответственно.
Рис. 7.
Зависимость толщины пленки TiNx от числа АСО циклов. Пленки получены осаждением при 275°C на Si〈100 〉 с естественным оксидом.
Из литературных данных, постоянная роста АСО TiNx, полученная с использованием TiCl4 и N2H4, варьировалась от 0.23 до 0.34 Å для температур осаждения между 250 и 350°С [31]. Используя TiCl4 и NH3, получали пленки с постоянной роста в одном случае 0.17 Å/цикл [6], а в другом 0.4 Å/цикл [61] при 350°C. Замена аммиака на трет-бутиламин [62], аллиламин [62] и диметилгидразин [26] приводила к снижению постоянной роста до 0.03 Å/цикл (400°C), 0.15 Å/цикл (400°C) и 0.11 Å/цикл (200°C) соответственно. В сравнении с представленными выше АСО системами, TiCl4/N2H4 АСО демонстрирует улучшение в темпе роста при низких температурах осаждения. MO-АСО процессы с использованием ТДМАТ, ТДЕАТ или тетракис(этилметиламидо)титан (ТЭМАТ) в комбинации с NH3, в интервале температур 200 до 240°C, демонстрировали темп роста TiNx в диапазоне от 0.95 до 5.0 Å/цикл [19, 22, 63, 64]. Однако, эти системы имеют существенные недостатки в отношении чистоты осаждаемых пленок и в плане самоограничиваемости процесса.
Плотность пленок TiNx, полученная в данной работе при 275°С (4.6 г/см3), выше плотности пленок, полученных с применением TiCl4 и NH4 при 350°С (4.2 г/см3) и близка к значениям, полученным при 400 (4.7 г/см3) и 450°С (4.85 г/см3) [61]. Низкая плотность полученных АСО пленок относительно справочных данных 5.4 г/см3 [65], возможно, связана с присутствием водородных примесей. Плотность пленок, полученных с использованием ТДМАТ и NH3, при 240°С составляет 3.0 г/см3 [21].
Цвет пленок TiNx, нанесенных при 275°C, варьировался от золотистого, для пленок толщиной 287.0 Å, до темно-красного для пленок толщиной 670.6 Å. Эта цветовая гамма аналогична наблюдаемой для термического АСО TiNx с использованием TiCl4 и NH3 [13, 15], где золотистый и темно-фиолетовый цвета наблюдали при толщине пленок 1600 и 2300 Å соответственно, при температуре осаждения 500°C [13].
Используя последовательность напуска прекурсоров TiCl4/N2H4/TMA/N2H4, пленки АСО TiAlxNy осаждали при 275°C, при этом время напуска и продувки составляли 3/50/4.5/50/4/50/4.5/50. В одной из ранних публикаций, где в качестве прекурсоров использовали TiCl4, TMA и NH3, было показано, что данный порядок дозирования реагентов способствовал получению TiAlxNy пленок с наименьшими количеством примесей [17]. В данной работе пленки TiAlxNy были получены дозированием ТМА в течение 4 с, при этом парциальное давление прекурсора составляло 100 мТорр или 4 × × 105 L. Дозы гидразина 4.5 с приводили к парциальному давлению 50 мТорр, что эквивалентно воздействию 2.25 × 105 Л. Для этих экспериментов время дозирования и продувки были выбраны произвольно. Пленки TiAlxNy толщиной ~450 Å, нанесенные на кремниевые подложки, имели золотистый цвет, а пленки толщиной ~1080 Å демонстрировали темно-синий цвет.
Из ОРЛ измерений постоянная роста АСО TiAlxNy составила примерно 1.8 Å, а ее плотность – около 3.4 г/см3. Был отмечен градиент по толщине TiAlxNy пленок, который составлял около 20%, между образцами, расположенными по направлению потока газа на расстоянии примерно 5 см друг от друга после 600 АСО циклов. Также визуально можно было заметить градиент толщины на самих подложках размером 2.5 × 2.5 см. Возможно, это связано с недостаточным насыщением прекурсоров, образованием побочных продуктов, требующих более длительного времени продувки и т.д. Полученные пленки TiAlxNy показали среднеквадратичные значения шероховатости порядка 6.5 Å для пленок толщиной примерно 1080 Å, что значительно ниже шероховатости пленок TiNx, полученных при схожих условиях.
Ранние публикации по АСО TiAlxNy, где использовались TiCl4, TMA и NH3 с той же самой последовательностью дозирования, показали максимальную скорость роста 0.3 Å/цикл при 400°C [17]. АСО TiAlxNy пленки, полученные с помощью TiCl4, ДМАГ-ЭПП и NH3, показали постоянную роста 1.67 Å/цикл при 350°C [49], а с использованием ТДМАТ, ДМАГ-ЭПП и NH3 при 200°C постоянная роста была 1.2 Å/цикл [64].
Кристаллическую структуру АСО пленок TiNx и TiAlxNy, полученных при 275°С, определяли методом дифракции рентгеновских лучей (ДРЛ). Дифрактограмма АСО пленки TiNx толщиной 287.0 Å приведена на рис. 8. Расположение индексов Миллера и относительная интенсивность дифракционных линий близки к справочным данным для кубического поликристаллического TiN (номер PDF 87-0633, JCPDS-ICDD 2002). Аналогичная дифракционная картина наблюдалась для пленок TiNx толщиной 670.6 Å (не показано). Пики углов дифракции на рис. 8 смещены в сторону больших значений относительно справочных данных для TiN. Аналогичное наблюдали для АСО пленок нитрида титана, полученных с использованием NH3 в комбинации с TiCl4 или TiI4, что связывали с включением кислорода в кристаллическую решетку нитрида, вызывающим сдвиги пиков [14, 15]. Из рисунка видно, что дифракционные линии кристаллографических плоскостей (200) и (111) имеют наибольшую интенсивность. Используя формулу Шеррер и данные ширины на уровне половинной амплитуды (FWHM) наиболее интенсивной дифракционной линии (200) рассчитан размер зерна, равный примерно 9 нм.
Рис. 8.
Рентгеновские дифрактограммы АСО пленок TiNx и TiAlxNy толщиной 287 и 450 Å соответственно, полученные при 275°C.
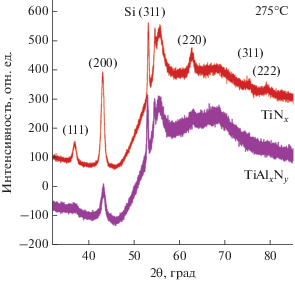
В других работах по термическому АСО TiNx также получали поликристаллические кубические или аморфные пленки в зависимости от температуры осаждения и уровня содержания в них примесей. АСО системы TiCl4/NH3 или TiI4/NH3 при температуре ниже 400°C демонстрировали (200) как преференциальную плоскость роста, а при температурах выше 400°C пик (111) был наиболее интенсивный [14, 15, 61]. Интересно отметить, что кристаллическая структура пленок TiNx, полученная в данной работе при 275°С и других работах при температурах <400°С, преференциально ориентирована в плоскости (200), а не в более энергетически выгодной (111) [15]. Как сообщалось ранее, используя 1,1-диметилгидразин и TiCl4 при 300°C, получали слабо кристаллизованные пленки с единственным пиком в плоскости (200), возможно, это связано с наличием 6 ат. % углеродных примесей [26]. Пленки, полученные с использованием ТДМАТ и NH3, при 200°C имели аморфную структуру [64] и слабо кристаллизованную при 240°C [21].
Дифрактограмма пленки TiAlxNy толщиной 450 Å, полученная при 275°С, представлена на рис. 8. Как видно из рисунка, она имеет дифракционные пики, схожие с TiNx. Как и для TiNx, в пленке TiAlxNy дифракционная линия кристаллографической плоскости (200) показала наибольшую интенсивность. Положение данного пика смещено в сторону большего угла дифракции. Данный эффект, скорее всего, связан с замещением алюминия в решетке TiN [17]. Несмотря на то что толщина пленки TiAlxNy была выше чем TiNх, интенсивность ее дифракционных пиков значительно ниже. Это говорит о том, что пленка TiAlxNy содержит значительный процент аморфной фазы в сравнении с TiNx. Aморфная структура предпочтительна для барьерных свойств.
Из литературных данных АСО пленки TiAlxNy, полученные при 400°C с использованием химии TiCl4/TMA/NH3, имели слабую кристалличность, при этом дифракционные линии плоскостей (200) и (111) имели наибольшую интенсивность [17]. В другом случае, АСО пленки TiAlxNy, полученные при 200°C с использованием ТДМАТ и ДМАГ-ЕПП в качестве источников алюминия, были аморфными [50, 64], но при этом пленки содержали до 25 ат. % примесей углерода.
Из изложенного видно, что пленки TiNx и TiAlxNy, полученные с использованием N2H4, проявляют кристалличность при более низких температурах осаждения в сравнении с другими термическими АСО системами.
На рис. 9 представлен полученный с помощью РФС профиль распределения химических элементов по глубине в образце АСО TiNx толщиной 287 Å, полученном при 275°C. Пленка имела в толще следующий элементный состав: Ti (45 ат. %), N (41 ат. %), O (14 ат. %) и концентрациюя хлора ниже предела обнаружения РФС (~0.2 ат. %). Из этого вытекает, что химия поверхности между TiCl4 и N2H4 способствуют полному удалению лигандов хлора в процессе осаждения. Как видно из рисунка, кислород относительно равномерно распределен по глубине пленки. Равномерноe распределение кислорода по всей толще АСО TiNx пленок ранее наблюдалось также для систем TiCl4/NH3 или TiI4/NH3. Ряд исследований механизма окисления TiN пленок объясняют данный феномен преференциальным окислением границ зерен [66, 67]. Ранее отмечалось, что столбчатая зернистая структура бинарных нитридов переходных металлов также является причиной ускоренной диффузии по ним меди через границы зерен [49]. Предположительно активное окисление образцов происходит при их охлаждении на воздухе, так как образцы вынимались из вакуумной камеры при температуре осаждения. Также не исключается, что кислород в пленку мог попасть с гидразином из-за присутствия в нем примесей.
Рис. 9.
РФС профиль распределения химических элементов по глубине в образце АСО TiNx толщиной 287 Å, полученном с использованием времени цикла 3/40/3/40 при 275°C.
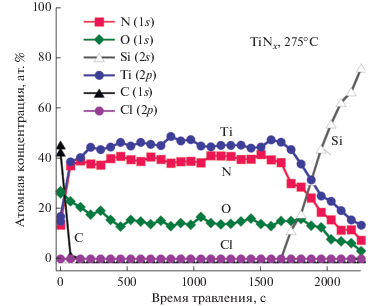
РФС анализ пленки TiNx толщиной 138.4 Å, полученной при 150°C, показал наличие в ней ~9 ат. % примесей хлора и ~38 ат. % кислорода. Предположительно, при данной температуре на подложке образуется соль дихлорид гидразина (N2H6Cl2) [68], которая имеет температуру плавления 198°C. Известно также, что хлорид титана образует стабильные комплексы с диметилгидразином типа Ti2Cl4(NNMe2)2(NH2NMe2)2 и TiCl2(Me2NNMe)2 [33]. Схожие комплексы, возможно, образуются на поверхности при попеременном дозировании TiCl4 и N2H4 при низких температурах осаждения. ОРЛ измерения показали необычно высокую скорость роста 0.46 Å за цикл при 150°C и относительно большой градиент по толщине пленок, что характерно для реакций конденсационного типа.
Пленки TiNx схожей толщины, полученные при 200°C, имели концентрацию хлора ниже предела обнаружения прибором,aкислорода ~28 ат. %. С учетом РФС данных для пленок, полученных при 275°С, можно предположить, что химия процесса осаждения TiCl4/N2H4 работает и при 200°С, однако относительно низкая плотность ведет к снижению их устойчивости к окислению на воздухе.
Литературные данные по содержанию примесей в АСО TiNx пленках, полученных термическим путем с использованием TiCl4 и NH3, разнятся. Так, в одном случае содержание кислорода составляло 32 ат. % для пленок толщиной 340 Å, полученных при 500°С, однако это число было 9 ат. % для более утолщенных пленок [15]. В другом случае было показано, что содержание Cl в пленке TiNх обратно пропорционально температуре осаждения: ~2.5 ат. % при 350°С, 0.5 ат. % при 400°С и 0.3 ат. % при 450°С [61]. Гораздо более низкое качество пленки наблюдали для MO-АСО TiNх процессов. К примеру, пленки полученные с использованием ТДМАТ и NH3 при 180 и 200°C, имеют уровень примесей кислорода до 45 ат. % и углерода до 10 ат. % [21, 64, 69]. Примесей углерода и хлора в АСО пленках TiNx полученных при 300°С с помощью TiCl4 и ДМГ, было ~16 и ~6 ат. % соответственно [26]. Присутствие примесей углерода в этих пленках, возможно, связано с большей прочностью связи C–N (749 кДж/моль) в сравнении с Ti–N (515 кДж/моль) [70, 71].
На рис. 10 представлен РФС профиль распределения химических элементов по глубине в образце АСО TiAlxNy толщиной 600 Å, полученном с использованием времени цикла 3/60/3/60/2/60/3/60 при 275°C. Полученные пленки имели в толще следующий состав: Al (40 ат. %), Ti (15 ат. %), N (32 ат. %), O (3 ат. %), Cl (4 ат. %), где концентрация углерода была ниже предела чувствительности прибора. Отсутствие углеродных примесей свидетельствует о том, что поверхностная реакция между ТМА и N2H4 протекает до конца. Присутствие примесей хлора указывает на не идеальности протекающих на поверхности химических реакций. Содержание кислорода в пленке TiAlxNy (3 ат. %) значительно ниже его концентрации в пленке TiNx (14 ат. %). Схожее снижение примесей кислорода наблюдалось в предыдущих публикациях по термическому АСО TiAlxNy [17]. Данный эффект от присутствия Al также наблюдали для пленок, полученных другими методами, в частности, методом физического осаждения из газовой фазы (ФОГФ) [72]. Стабильность сплава к окислению можно объяснить меньшей кристалличностью пленки, что эффективно снижает количество диффузионных каналов для O2 и воды воздуха. Кроме этого, при окислении на воздухе формируется аморфная пленка, которая является эффективным диффузионный барьером. Из рис. 9 также видно, что полученная пленка TiAlxNy имеет высокую концентрацию Al по сравнению с Ti. Плотность полученной пленки TiAlxNy (3.4 г/см3) близка к справочным данным для AlN (3.26 г/см3) [65]. Расчеты показывают, что реакция гидразина с триметилалюминием по схеме AlC3H9(g) + 3/4N2H4(g) = AlN + 3CH4(g) + + 1/4N2(g) (ΔG275°C = –180.9 ккал/моль) более термохимически предпочтительна, чем с хлоридом титана (ΔG275°C = –46.45 ккал/моль) [35]. Ранее низкотемпературное ХОФГ пленок AlN было показано с использованием ТМА и N2H4 [37, 73] а также АСО AlN с ТДЕАА и N2H4 [42]. АСО пленка TiAlxNy толщиной ~1280 Å, полученная при 250°С после Ar+ распыления, имела следующий состав: Al (40 ат. %), Ti (11 ат. %), N (32 ат. %), O (12.5 ат. %), Cl (4.5 ат. %), где концентрация углерода была ниже предела чувствительности РФС. Из этого видно, что с повышением температуры осаждения от 250 до 275°С наблюдается увеличение содержание титана, незначительно снижается концентрации хлора и существенно снижается концентрация кислорода.
Рис. 10.
РФС профиль распределения химических элементов по глубине в пленке TiAlхNy толщиной 600 Å, полученной с использованием времени цикла 3/60/3/60/2/60/3/60 при 275°C.
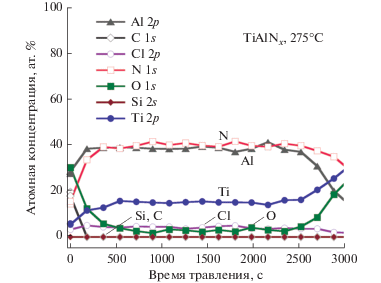
Для сравнения, попеременным напуском TiCl4/NH3/TMA/NH3 при 300°C получали АСО пленки TiAlxNy с композицией Cl (~6 ат. %), O (~0.6 ат. %), C (>6 ат. %) и Al (~8 ат. %) [17]. Присутствие примесей хлора и углерода говорит о том, что поверхностные реакции ТМА, TiCl4 и NH3 протекают не полностью. Также надо отметить низкую концентрацию алюминия (~8 ат. %) по сравнению с пленками, полученными в данной работе (40 ат. %). Juppo и др. [17] ранее показали, что концентрацию алюминия в TiAlxNy пленках можно регулировать, изменяя последовательность напуска реагентов. Соотношением компонентов в сплавах можно также управлять количеством субциклов в суперцикле [74].
В) ИК спектроскопия поверхностных реакций TiCl4 и N2H4 и механизм осаждения АСО TiNx
Фурье-ИК-спектроскопия (ФИКС) использовалась для исследования химии поверхности после напуска TiCl4 и N2H4 в процессе TiNx ALD. На рис. 11 показаны разностные спектры FTIR, полученные для температур осаждения 200 и 275°C путем вычитания спектров из предшествующей реакций. Эти спектры были получены после напуска TiCl4 и N2H4 после каждой полуреакции на третьем АСО цикле на частицах ZrO2, заранее покрытых тонким слоем АСО Al2O3. В представленных разностных ФИКС спектрах снижение пика поглощения указывают на потерю поверхностных реакционных групп, а увеличение поглощения показывают увеличение популяции реакционных групп.
Рис. 11.
Разностные ФИКС спектры после третьего напуска TiCl4 и N2H4, наблюдаемые в процессе АСО TiNx при 200 и 275°C.
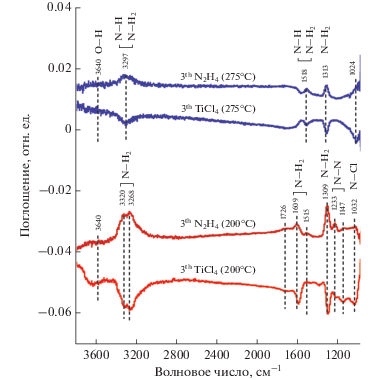
После напуска TiCl4 наблюдалась потеря поверхностных групп при температурах осаждения 200 и 275°C. Характерные моды Ti–Cl и TiN, которые располагаются около 500 и 670 см–1 волновых чисел соответственно [36], не могут быть обнаружены, поскольку расположены за пределами диапазона измерения инструмента. Предполагается, что реакция TiCl4 с поверхностью приводит к образованию монодентатных и бидентатных групп Ti–Clx, что наблюдалось ранее при ИК исследованиях АСО системы TiCl4 и NH3 [36].
На второй полуреакции напуск N2H4 при 200°C привел к появлению полос при 3320, 3268, 1609, 1515 и 1309 см–1, которые относятся соответственно к антисимметричному, симметричному, ножничному и веерному режимам колебания ‒NH2 [75]. Небольшие пики на длинах волн 1233 и 1147 см–1 находятся в непосредственной близости от известных из литературы N–N растягивающих и маятниковые колебаний –NH2 молекулярного гидразина [76]. Это может быть связано с наличием физизорбированных молекул гидразина. При этом невозможно провести четкое различие между –NH2, связанным с атомом Ti, и –NH2 в молекулярном гидразине. ФИКС не показал наличия пиков, ассоциированных с присутствием характерных вибрационных полос хлорида гидразиния (N2H5Cl), дихлорида гидразиния (N2H6Cl2) или соли NH4Cl при 200 и 275°С [36, 77, 78]. На основе литературных данных для ИК спектров NH2Cl слабый пик при 1032 см–1 может быть приписан к изгибам N–Cl [79].
Несколько другой механизм реакции наблюдается во время напуска TiCl4 и N2H4 при 275°C. На рис. 11 можно наблюдать более четкое переворачивание ИК спектров после дозирования прекурсоров. Здесь, пики при 3297, 1518 и 1313 см–1 относятся к растяжению, ножничным и веерным колебаниям первичного амина (–NH2). Схожие пики ранее наблюдались в инфракрасных сигнатурах гидразина на TiO2 при температурах от 25 до 350°C [76, 80]. ИК сигнатура –NH2 и =NH (вторичный амин) трудно различима из-за перекрытия областей растяжения N–H и областей деформации N–H, поэтому на поверхности могут присутствовать как первичные, так и вторичные амины. Наличие режима ножниц при 1518 см–1 является единственным различием между первичными и вторичными аминами. Спектр после напуска гидразина указывает на присутствие поверхностно-связанного первичного амина, этот вывод можно сделать из отсутствия пиков растяжения N–N молекулярного гидразина. Ранние ИК исследования процесса АСО TiNx при 400°С с применением TiCl4 и NH3 показали, что в результате реакции NH3с−TiClx на поверхности образуется NH4Cl [36].
Полоса поглощения при 3640 см–1, относящаяся к –О–Н колебаниям, при 200 и 275°С, не наблюдалась. Это свидетельствует о том, что появление кислорода в пленках нитрида титана прежде всего связано с окислением на воздухе и в меньшей степени от присутствия кислородсодержавших примесей в гидразине. Небольшие пики при 1726 и 1024 см–1, обнаруженные при 200 и 275°С соответственно, не были идентифицированы. Широкий пик с центром около 1300 см–1 в спектре для 275°С также не был идентифицирован.
Полная диссоциативная адсорбция гидразина на поверхности, предположительно, происходит в соответствии с N2H4 → 2NH2ад → 2NHад + 2H, где соотношение между числом первичных и вторичных аминов на поверхности зависит от температуры. Подобное можно наблюдать при непосредственном сравнении ФИКС спектров, полученных в процессе АСО TiNx с использованием химии TiCl4/NH3 и TiCl4/N2H4. На рис. 12 представлены ИК спектры после дозирования NH3 при 350, 425°C и N2H4 при температуре 275°C. Как видно из рисунка, наблюдаемые виды поверхностных групп при напуске аммиака при 350°С и гидразина при 275°С схожи. При температуре реакции 425°C в спектрах TiCl4/NH3 отсутствует полоса при 1313 см–1 (веерные колебания –NH2), что свидетельствует о том, что на поверхности присутствуют группы типа –NH с колебаниями при 3297 и 1518 см–1. Полосы вторичного амина при волновых числах 3436 и 1558 см–1 ранее наблюдал Snyder и др. [36] при 400°C на частицах оксида кремния во время ИК исследований TiNx АСО для системы TiCl4 и NH3. Постепенное снижение интенсивности ножничных деформаций –NH2 при напуске при 127°C с их полным удалением при 400°C ранее наблюдали Dillon и др. [81]. Из выше изложенного видно, что при оптимальной температуре осаждения TiNx в 275°С на поверхности присутствуют как первичные, так и вторичные амины.
Рис. 12.
Разностные ФИКС спектры после второго напуска N2H4 при 275°C и NH3 при 350 и 425°С в процессе АСО TiNx.
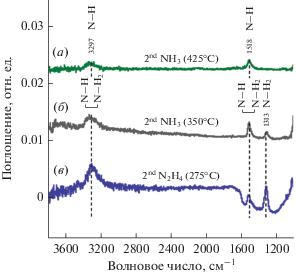
По некоторым литературным данным, сдвиг в механизме роста TiNx ведет к изменению кристалличности пленки TiN, где дифракционная плоскость (200) более предпочтительна при температурах ниже 400°C, а (111) при более высоких температурах, где преимущественно присутствуют =NH поверхностные группы.
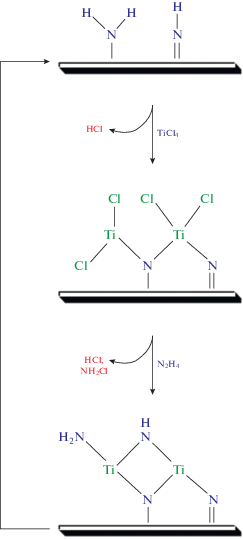
Данные КПМ, ФИКС и ОРЛ могут быть использованы для предложения механизма роста пленки нитрида титана. На рис. 13 представлен один из возможных вариантов протекания поверхностных реакций между TiCl4 и N2H4 в процессе АСО. Из ФИКС данных следует, что при 275°С после напуска гидразина на поверхности образуются как первичные, так и вторичные амины. Поэтому на рис. 13 начальная поверхность представлена в виде комбинации –NH2 и =NH. Продуктом реакции паров TiCl4 с такой поверхностью является –TiCl4 –x, где х может принимать значения 1, 2, и 3. После напуска N2H4 происходит замещение –Cl лигандов атомов титана на ‒NH2 и =NH, тем самым происходит регенерация исходных поверхностных групп. Из КПМ данных, полученных при 225°С, отношение ΔmВ (величина увеличения массы после напуска TiCl4, рис. 3) к ΔmА (остаточная масса после напуска N2H4) равно 0.44. Для случая, представленного на рис. 13, где х = 2, рассчитанная из мольных значений генерируемых и удаляемых поверхностных групп величина отношения ΔmВ/ΔmА составляет 0.42, что наиболее близко к экспериментальным данным. При этом надо учитывать, что КПМ данные были получены при температуре ниже оптимальной температуры осаждения – 275°С. Как видно из рисунка, на стадии напуска TiCl4 происходит частичная редукция Ti+4 хлорида титана до Ti+3 объемного TiN, а полная редукция титана протекает при напуске N2H4. В качестве газофазных продуктов поверхностных реакций указаны HCl и, возможно, NH2Cl [31]. Для определения реальных продуктов реакции требуется более детальное исследование с помощью газовой масс-спектрометрии.
Г) Конформность покрытия АСО TiNx
Способность равномерно наносить тонкие пленки на подложки со сложной микро/нано топографией является одной из особенностей технологии АСО. Для оценки возможности АСО TiNx с использованием TiCl4 и N2H4 конформно наносить пленки, было проведено осаждение на наноструктурированной подложке. На рис. 14 представлены СЭМ изображения поперечного сечения кремниевой пластины в верхней (рис. 14а) и нижней (рис. 14б) частях канавки после 2000 АСО циклов при 275°C. При осаждении использовали 3/60/3/60 время дозировки и продувки. Аспектное соотношение сторон траншеи 4 : 1. СЭМ изображение показывает, что пленка равномерно покрывает вход в траншею, а также отлично воспроизводит острые углы на дне канавки. Толщина пленки на дне траншеи и на поверхности одинакова и примерно равна 700 Å, что согласуется с постоянной роста в 0.35 Å/цикл. Превосходная комфортность нанесенного АСО TiNx объясняется самоограничением поверхностных реакций и эффективностью N2H4 в качестве реагента.
ЗАКЛЮЧЕНИЕ
В данной работе было продемонстрировано АСО TiNx в интервале температур от 200 до 275°C с использованием TiCl4 и N2H4. Применяя данную химию осаждения, можно наносить однородные, не содержащие примесей хлора пленки TiNx. Осаждение при 275°C является более оптимальным с точки зрения высокой плотности получаемых пленок и темпа роста в сравнении с АСО TiNx с использованием TiCl4 и NH3. Несмотря на относительно низкие температуры осаждения, полученные TiNx пленки имели кристаллическую структуру и короткий нуклеационный период на Al2O3. Было установлено, что кислород является основной примесью в полученных TiNx пленках. Примеси в самом гидразине, а также окисление на воздухе являются главными причинами присутствия кислорода в пленках. Первая проблема может быть решена применением гидразина более высокого класса чистоты. Одним из вариантов улучшения стабильности к окислению на воздухе является осаждение тернарных нитридов. Пленки АСО TiAlxNy, полученные с использованием TiCl4, N2H4 и TMA, были менее кристалличны и соответственно были менее подвержены окислению, чем пленки TiNx. Кроме этого, процесс АСО TiAlxNy демонстрирует более высокий темп роста пленки, что делает его привлекательными для замены TiN. Гидразин показал себя эффективным реагентом для замещения поверхностных метильных групп на аминогруппы, что способствовало получению пленок TiAlxNy без примесей углерода. Несмотря на это, процесс осаждения АСО TiAlxNy с гидразином требует дальнейшей оптимизации для снижения примесей хлора и кислорода.
Список литературы
George S.M. Atomic Layer Deposition: An Overview // Chemical Reviews. 2010. V. 110. P. 111–131.
Malygin A.A. et al. From V.B. Aleskovskii’s “Framework” Hypothesis to the Method of Molecular Layering/Atomic Layer Deposition // Chemical Vapor Deposition. 2015. V. 21(10–12). P. 216–240.
Technology Roadmap for Semiconductors. http:// www.itrs.net/.International, 2007.
Kim H. Atomic layer deposition of metal and nitride thin films: Current research efforts and applications for semiconductor device processing // J. Vacuum Science & Technology B. 2003. V. 21(6). P. 2231–2261.
Zaera F. The surface chemistry of thin film atomic layer deposition (ALD) processes for electronic device manufacturing // J. Materials Chemistry. 2008. V. 18(30). P. 3521–3526.
Ahn C.H. et al. Characteristics of TiN thin films grown by ALD using TiCl(4) and NH3 // Metals and Materials International. 2001. V. 7(6). P. 621–625.
Satta A. et al. Growth mechanism and continuity of atomic layer deposited TiN films on thermal SiO2 // J. Applied Physics. 2002. V. 92(12). P. 7641–7646.
Juppo M., Rahtu A., Ritala M. In situ mass spectrometry study on surface reactions in atomic layer deposition of TiN and Ti(Al)N thin films // Chemistry of Materials. 2002. V. 14(1). P. 281–287.
Kim J. et al. Physical properties of highly Conformal TiN thin films grown by atomic layer deposition. Japanese // J. Applied Physics Part 1-Regular Papers Short Notes & Review Papers. 2003. V. 42(3). P. 1375–1379.
Kim J. et al. Properties including step coverage of TiN thin films prepared by atomic layer deposition // Applied Surface Science. 2003. V. 210(3–4). P. 231–239.
Tiznado H., Zaera F. Surface chemistry in the atomic layer deposition of TiN films from TiCl4 and ammonia // J. Physical Chemistry B. 2006. V. 110(27). P. 13491–13498.
Elers K.E. et al. TiCl4 as a precursor in the TiN deposition by ALD and PEALD // J. Electrochemical Society. 2005. V. 152(8). P. G589–G593.
Hiltunen L. et al. Nitrides of Titanium, Niobium, Tantalum and Molybdenum Grown as Thin-Films by the Atomic Layer Epitaxy Method // Thin Solid Films. 1988. V. 166(1–2). P. 149–154.
Ritala M. et al. Atomic layer epitaxy growth of TiN thin films from TiI4 and NH3 // J. Electrochemical Society. 1998. V. 145(8). P. 2914–2920.
Ritala M. et al. Atomic Layer Epitaxy Growth of Tin Thin-Films // J. Electrochemical Society. 1995. V. 142(8). P. 2731–2737.
Ritala M. et al. Effects of intermediate zinc pulses on properties of TiN and NbN films deposited by atomic layer epitaxy // Applied Surface Science. 1997. V. 120(3–4). P. 199–212.
Juppo M. et al. Trimethylaluminum as a reducing agent in the atomic layer deposition of Ti(Al)N thin films // Chemical Vapor Deposition. 2001. V. 7(5). P. 211–217.
Heil S.B.S. et al. Low-temperature deposition of TiN by plasma-assisted atomic layer deposition // J. Electrochemical Society. 2006. V. 153(11). P. G956–G965.
Min J.S. et al. Atomic layer deposition of TiN films by alternate supply of tetrakis(ethylmethylamino)-titanium and ammonia // Japanese J. Applied Physics Part 1-Regular Papers Short Notes & Review Papers. 1998. V. 37(9A). P. 4999–5004.
Kim H.K. et al. Metalorganic atomic layer deposition of TiN thin films using TDMAT and NH3 // J. Korean Physical Society. 2002. V. 41(5). P. 739–744.
Elam J.W. et al. Surface chemistry and film growth during TiN atomic layer deposition using TDMAT and NH3 // Thin Solid Films. 2003. V. 436(2). P. 145–156.
Assaud L. et al. Highly-Conformal TiN Thin Films Grown by Thermal and Plasma-Enhanced Atomic Layer Deposition // Ecs J. Solid State Science and Technology. 2014. V. 3(7). P. P253–P258.
Kim J.Y. et al. Remote plasma enhanced atomic layer deposition of TiN thin films using metalorganic precursor // J. Vacuum Science & Technology A. 2004. V. 22(1). P. 8–12.
Kim J.Y. et al. Remote plasma-enhanced atomic-layer deposition of TiN by using TDMAT with a NH3 plasma // J. Korean Physical Society. 2004. V. 45(6). P. 1639–1643.
Heil S.B.S. et al. Plasma-assisted atomic layer deposition of TiN monitored by in situ spectroscopic ellipsometry // J. Vacuum Science & Technology A. 2005. V. 23(4). P. L5–L8.
Juppo M., Ritala M., Leskela M. Use of 1,1-dimethylhydrazine in the atomic layer deposition of transition metal nitride thin films // J. Electrochemical Society. 2000. V. 147(9). P. 3377–3381.
Park D.G., Kim T.K. Effects of fluorine and chlorine on the gate oxide integrity of W/TiN/SiO2/Si metal-oxide-semiconductor structure // Thin Solid Films. 2005. V. 483(1–2). P. 232–238.
Luoh T. et al. TiCl4 Barrier Process Engineering in Semiconductor Manufacturing // Coatings. 2016. V. 6. № 1.
Abdulagatov A.I., Anderson V.R., Cavanagh A.S., Wang W., George S.M. Atomic Layer Deposition of Titanium Nitride Using Titanium Tetrachloride and Hydrazine. in AVS 57th International Symposium & Exhibition. 2010. Albuquerque, New Mexico, USA: AVS.
Abdulagatov A.I. Growth, characterization and post-processing of inorganic and hybrid organic-inorganic thin films deposited using atomic and molecular layer deposition techniques, in Chemistry Department. 2012. University of Colorado at Boulder ProQuest Dissertations and Theses. P. 335.
Hinckley A., Muscat A. Atomic Layer Deposition of TiN below 600 K Using N2H4 // Solid State Phenomena. 2018. V. 282. P. 232–237.
Wolf S. et al. Low temperature thermal ALD TaNx and TiNx films from anhydrous N2H4 // Applied Surface Science. 2018. V. 462. P. 1029–1035.
Scheper J.T. et al. Low-temperature deposition of titanium nitride films from dialkylhydrazine-based precursors // Materials Science in Semiconductor Processing. 1999. V. 2(2). P. 149–157.
Winter C.H., McKarns P.J., Scheper J.T. Precursors for the chemical vapor deposition of titanium nitride and titanium aluminum nitride films. Chemical Aspects of Electronic Ceramics Processing. 1998. V. 495. P. 95–106.
HSC Chemistry version 5.1.
Snyder M.Q. et al. An infrared study of the surface chemistry of titanium nitride atomic layer deposition on silica from TiCl4 and NH3 // Thin Solid Films. 2006. V. 514(1–2). P. 97–102.
Fujieda S., Mizuta M., Matsumoto Y. Low-temperature metalorganic chemical vapour deposition of AIN for surface passivation of GaAs // Advanced Materials for Optics and Electronics. 1996. V. 6(3). P. 127–134.
Fujieda S., Mizuta M., Matsumoto Y. Growth-Characterization of Low-Temperature Mocvd Gan – Comparison between N2H4 and NH3 // Japanese J. Applied Physics Part 1-Regular Papers Short Notes & Review Papers. 1987. V. 26(12). P. 2067–2071.
Morishita S., Sugahara S., Matsumura M. Atomic-layer chemical-vapor-deposition of silicon-nitride // Applied Surface Science. 1997. V. 112. P. 198–204.
Burton B.B., Lavoie A.R., George S.M. Tantalum nitride atomic layer deposition using (tert-butylimido) tris(diethylamido) tantalum and hydrazine // J. Electrochemical Society. 2008. V. 155(7). P. D508–D516.
Abdulagatov A.I. et al. Atomic Layer Deposition of Aluminum Nitride and Oxynitride on Silicon Using Tris(dimethylamido)aluminum, Ammonia, and Water // Russian J. General Chemistry. 2018. V. 88(8). P. 1699–1706.
Abdulagatov A.I. et al. Atomic Layer Deposition of Aluminum Nitride Using Tris(diethylamido)aluminum and Hydrazine or Ammonia // Russian Microelectronics. 2018. V. 47(2). P. 118–130.
Vogt K.W., Naugher L.A., Kohl P.A. Low-Temperature Nitridation of Transition-Metals with Hydrazine // Thin Solid Films. 1995. V. 256(1–2). P. 106–115.
Petrov I. et al. Interfacial Reactions in Epitaxial Al/Ti1-Xalxn (0-Less-Than-or-Equal-to-X-Less-Than-or-Equal-to-0.2) Model Diffusion-Barrier Structures // J. Vacuum Science & Technology a-Vacuum Surfaces and Films. 1993. V. 11(1). P. 11–17.
Stuber M., Hultman L., Matthews A. Special Issue of Surface and Coatings Technology on 25 Years of TiAlN Hard Coatings in Research and Industry Preface // Surface & Coatings Technology. 2014. V. 257. P. 1–2.
Abrikosov I.A. et al. Phase Stability and Elasticity of TiAlN // Materials. 2011. V. 4(9). P. 1599–1618.
Barshilia H.C. et al. Optical properties and thermal stability of TiAlN/AlON tandem absorber prepared by re active DC/RF magnetron sputtering // Solar Energy Materials and Solar Cells. 2008. V. 92(11). P. 1425–1433.
Biswas A. et al. Spectroscopic ellipsometric characterization of TiAlN/TiAlON/Si3N4 tandem absorber for solar selective applications // Applied Surface Science. 2008. V. 254(6). P. 1694–1699.
Koo J. et al. Study on the characteristics of TiAlN thin film deposited by atomic layer deposition method // J. Vacuum Science & Technology a-Vacuum Surfaces and Films. 2001. V. 19(6). P. 2831–2834.
Kim J.Y. et al. Compositional variations of TiAlN films deposited by metalorganic atomic layer deposition method // Japanese J. Applied Physics Part 1-Regular Papers Short Notes & Review Papers. 2002. V. 41(2A). P. 562–565.
Schmidt E.W. Hydrazine and its Derivatives: Preparation, Properties, Applications. Wiley-Interscience, 2nd ed., 2001.
Elam J.W., Groner M.D., George S.M. Viscous flow reactor with quartz crystal microbalance for thin film growth by atomic layer deposition // Review of Scientific Instruments. 2002. V. 73(8). P. 2981–2987.
Goldstein D.N., McCormick J.A., George S.M. Al2O3 Atomic Layer Deposition with Trimethylaluminum and Ozone Studied by in Situ Transmission FTIR Spectroscopy and Quadrupole Mass Spectrometry // Journal of Physical Chemistry C. 2008. V. 112(49). P. 19530–19539.
Satta A. et al. Initial growth mechanism of atomic layer deposited TiN // Applied Physics Letters. 2004. V. 84(22). P. 4571–4573.
Murarka S.P. Multilevel interconnections for ULSI and GSI era // Materials Science & Engineering R-Reports. 1997. V. 19(3–4). P. 87–151.
Sun J.N. et al. Probing diffusion barrier integrity on porous silica low-k thin films using positron annihilation lifetime spectroscopy // J. Applied Physics. 2001. V. 89(9). P. 5138–5144.
Elam J.W. et al. Atomic layer deposition of In2O3 using cyclopentadienyl indium: A new synthetic route to transparent conducting oxide films // Chemistry of Materials. 2006. V. 18(15). P. 3571–3578.
Rocklein M.N., George S.M. Temperature-induced apparent mass changes observed during quartz crystal microbalance measurements of atomic layer deposition // Analytical Chemistry. 2003. V. 75(19). P. 4975–4982.
Heubusch H.P., Pugmire T.K. The Compatibility of Stainless Steels with Nitrogen Tetroxide and Hydrazine AIAA Paper 90-2063. 1990. V. A90-43356. P. 36.
Hanratty T.J. et al. Thermal Decomposition of Hydrazine Vapor in Silica Vessel // Industrial and Engineering Chemistry. 1951. V. 43(5). P. 1113–1116.
Jeon H. et al. Study on the characteristics of TiN thin film deposited by the atomic layer chemical vapor deposition method // J. Vacuum Science & Technology a-Vacuum Surfaces and Films. 2000. V. 18(4). P. 1595–1598.
Juppo M. et al. Atomic layer deposition of titanium nitride thin films using tert-butylamine and allylamine as reductive nitrogen sources // Electrochemical and Solid State Letters. 2002. V. 5(1). P. C4–C6.
Kim J.Y. et al. Comparison of TiN films deposited using tetrakisdimethylaminotitanium and tetrakisdiethylaminotitanium by the atomic layer deposition method // Japanese J. Applied Physics Part 1-Regular Papers Short Notes & Review Papers. 2003. V. 42(7A). P. 4245–4248.
Kim J.Y. et al. Comparison of TiN and TiAlN as a diffusion barrier deposited by atomic layer deposition // J. Korean Physical Society. 2002. V. 40(1). P. 176–179.
CRC Handbook of Chemistry and Physics, ed. D.R. Lide, Boca Raton, FL, 2004. CRC Press.
Logothetidis S. et al. Room temperature oxidation behavior of TiN thin films // Thin Solid Films. 1999. V. 338(1–2). P. 304–313.
Van Bui H. et al. Growth Kinetics and Oxidation Mechanism of ALD TiN Thin Films Monitored by In Situ Spectroscopic Ellipsometry // J. Electrochemical Society. 2011. V. 158(3). P. H214–H220.
Troyan J.E. Properties, Production, and Uses of Hydrazine // Industrial and Engineering Chemistry. 1953. V. 45(12). P. 2608–2612.
Musschoot J. et al. Atomic layer deposition of titanium nitride from TDMAT precursor // Microelectronic Engineering. 2009. V. 86(1). P. 72–77.
Devore T.C., Gallaher T.N. Vibrational Infrared-Spectrum of the Group-Iv Transition-Metal Nitride Gaseous Molecules // J. Chemical Physics. 1979. V. 70(7). P. 3497–3501.
Yun J.Y., Park M.Y., Rhee S.W. Effect of the gas-phase reaction in metallorganic chemical vapor deposition of TiN from tetrakis(dimethylamido)titanium // J. Electrochemical Society. 1998. V. 145(7). P. 2453–2456.
Chim Y.C. et al. Oxidation resistance of TiN, CrN, TiAlN and CrAlN coatings deposited by lateral rotating cathode arc // Thin Solid Films. 2009. V. 517(17). P. 4845–4849.
Mizuta M. et al. Low-Temperature Growth of Gan and Aln on Gaas Utilizing Metalorganics and Hydrazine Japanese // J. Applied Physics Part 2-Letters. 1986. V. 25(12). P. L945–L948.
Abdulagatov A.I. et al. Molecular Layer Deposition and Thermal Transformations of Titanium(Aluminum)-Vanadium Hybrid Organic-Inorganic Films // Russian J. Applied Chemistry. 2018. V. 91(3). P. 347–359.
Giguere P.A., Liu I.D. On the Infrared Spectrum of Hydrazine // J. Chemical Physics. 1952. V. 20(1). P. 136–140.
Amores J.M.G. et al. An FT-IR study of ammonia adsorption and oxidation over anatase-supported metal oxides // Applied Catalysis B-Environmental. 1997. V. 13(1). P. 45–58.
Devillepin J., Novak A. Infrared and Raman-Spectra of Crystals of Hydrazinium Chloride and Bromide at Low-Temperature. 1. Intramolecular Vibrations // Molecular Crystals and Liquid Crystals. 1974. V. 27(3–4). P. 391–415.
Snyder R.G., Decius J.C. The Infrared Spectra of N2H6Cl2 and N2H6F2 // Spectrochimica Acta. 1959. V. 13(4). P. 280–290.
Moore G.E., Badger R.M. The Infrared Spectra and Structure of the Chloramines and Nitrogen Trichloride // J. American Chemical Society. 1952. V. 74(23). P. 6076–6080.
Chuang C.C., Shiu J.S., Lin J.L. Interaction of hydrazine and ammonia with TiO2 // Physical Chemistry Chemical Physics. 2000. V. 2(11). P. 2629–2633.
Dillon A.C. et al. Ammonia Decomposition on Silicon Surfaces Studied Using Transmission Fourier-Transform Infrared-Spectroscopy // J. Vacuum Science & Technology a-Vacuum Surfaces and Films. 1991. V. 9(4). P. 2222–2230.
Дополнительные материалы отсутствуют.
Инструменты
Микроэлектроника