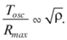Химическая физика, 2023, T. 42, № 2, стр. 66-77
Фемтосекундная лазерная микрохирургия ооцитов мыши: образование и динамика кавитационных пузырей при воздействии остро сфокусированного лазерного излучения на различные зоны ооцита
А. А. Астафьев 1, А. М. Шахов 1, А. А. Осыченко 1, Д. Ю. Мартиросян 1, *, У. А. Точило 1, А. Д. Залесский 1, М. С. Сырчина 1, А. В. Карменян 2, Chia-Liang Cheng 2, В. А. Надточенко 1, 3
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Department of Physics, National Dong Hwa University
Hualien, Taiwan
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: petrosyan359@gmail.com
Поступила в редакцию 18.02.2022
После доработки 17.05.2022
Принята к публикации 20.05.2022
- EDN: IWNUPS
- DOI: 10.31857/S0207401X23020048
Аннотация
В настоящей работе изучены образование и динамика кавитационных пузырей, возникающих в различных зонах предовуляторных ооцитов мыши в результате оптического пробоя под действием фемтосекундных лазерных импульсов с длиной волны 790 нм. Динамика роста и схлопывания кавитационного пузыря определена по временнóй зависимости интенсивности рассеянного света на пузыре. Было численно охарактеризовано различие в порогах оптического пробоя и динамике кавитационного пузыря между различными регионами ооцита и водного буферного раствора.
1. ВВЕДЕНИЕ
Остро сфокусированное излучение фемтосекундного лазера позволяет проводить малоинвазивные хирургические операции биологических клеток или тканей. Взаимодействие сфокусированного объективом микроскопа излучения лазера с биологическим материалом происходит в предельно малом вокселе в окрестности фокального пятна. Высокая плотность энергии, достижимая при низкой энергии фемтосекундного импульса, обеспечивает минимальный нагрев и пренебрежимо малое разрушение биологического материала за пределами зоны воздействия, что определяет малоинвазивность хирургического вмешательства, например возможность проводить операции с внутренними органеллами клетки без разрушения внешней мембраны.
Со времени первой демонстрации Кенигом [1] фемтосекундная клеточная хирургия показала себя отличным инструментом для минимально инвазивной и чрезвычайно точной манипуляции отдельными клетками как in vitro [2–5] так и in vivo [6–8]. При фокусировке фемтосекундных лазерных импульсов объективом с большой числовой апертурой (NA > 0.8) в биологическом материале создаются интенсивности излучения, достаточные для индуцирования многофотонной ионизации в субфемтолитровом объеме. Комбинированный эффект многофотонной и ударной ионизации создает очень большие плотности свободных электронов, что приводит к абляции биологических тканей с размерами надрезов менее 100 нм [2, 9].
Существует два режима фемтосекундной лазерной хирургии, различающихся параметрами лазерного излучения. В одном подходе используется небольшое число усиленных импульсов (от одного до сотен) с частотой повторения около 1 кГц и энергией импульса от ∼100–101 нДж [4, 10, 11]. Плотности свободных электронов, генерирующиеся в этом режиме, способны вызывать кавитационные пузыри и ударные волны в жидкости. Быстрое расширение кавитационного пузыря вызывает разрывы в биологическом материале [12, 13]. Второй подход основан на использовании длинных цугов импульсов (от тысяч до миллионов импульсов) лазерного осциллятора с частотой повторения около 80 МГц и энергиями импульсов, меньшими порога оптического пробоя [2, 14, 15]. В этом режиме создается так называемая плазма низкой плотности, которая через свободные электроны вызывает химическую декомпозицию (разрыв связей) биомолекул [9, 16, 17]. Помимо этого, лазерная ионизация и диссоциация молекул воды ведут к генерации активных форм кислорода (АФК), таких как гидроксил радикал (OH•) и супероксид $\left( {{\text{O}}_{2}^{ - }} \right)$ [18]. Известно, что АФК эффективно реагируют с биомолекулами, такими как азотистые основания нуклеиновых кислот, и таким образом могут вызывать гибель клеток в высокой концентрации [19–21]. Аккумуляция описанных выше химических эффектов при поглощении многих импульсов приводит к абляции биологического материала.
В ряде работ были теоретически рассмотрены фундаментальные механизмы оптического пробоя и кавитации в водной среде и исследован вопрос о пороге пробоя [9, 12, 22]. Однако хорошо проработанная теория оптического пробоя была создана только для модельной среды – чистой воды. Реальный биологический материал содержит органические молекулы, обладающие меньшим, чем вода, потенциалом ионизации, и поэтому может более эффективно генерировать электронную плазму при нелинейном поглощении излучения. В экспериментальных работах показано влияние загрязнений и растворенных веществ на пороги кавитации в водной среде [12]. Помимо этого, биологический материал отличается от воды по своим гидродинамическим свойствам, дополнительные вязкие и упругие силы могут влиять на динамику развития кавитационного пузыря. Известны работы по изучению кавитации под действием наносекундных лазерных импульсов в ооцитах мыши [23, 24], в которых было показано, что пороги кавитации в материале ооцита значительно меньше, чем в воде, в силу наличия эндогенных хромофоров, поглощающих лазерное излучение. Кроме того, рост кавитационных пузырей в ооцитах был ограничен упругими силами, возникающими при деформации биологического материала. Однако эти результаты не являются в полной мере применимыми для описания кавитации под действием фемтосекундных лазерных импульсов ввиду различия режимов взаимодействия излучения с веществом.
В настоящей работе, мы исследовали процесс кавитации, вызванной влиянием фемтосекундных лазерных импульсов в различных зонах предовуляторных (GV) ооцитов мыши при регистрации динамики роста и схлопывания отдельного кавитаиционного пузыря по интенсивности рассеянного света. Были численно охарактеризованы различия в порогах оптического пробоя и динамике кавитационного пузыря между различными зонами ооцита и дистиллированной водой.
2. МАТЕРИАЛЫ И МЕТОДЫ
Для получения ооцитов использовали самок мышей гибридной линии F1 (CBA/C57Bl) в возрасте от 1.5 до 2.5 месяцев. Протокол выделения ооцитов описан в работе [8]. При лазерном воздействии ооциты находились на покровном стекле микроскопа в капле фосфатного буферного раствора PBS (Sigma-Aldrich (USA)) объемом 50 мкл [9].
Схема установки. Фемтосекундные лазерные импульса на длине волны 790 нм c частотой повторения 80 МГЦ и энергией до 30 нДж генерировались титан-сапфировым осциллятором “Tsunami” компании Spectra-Physics (USA)). Импульсы проходили через ячейку Поккельса производства компании Avesta Project Ltd. (Россия), которая использовалась для выделения одиночных импульсов. Одиночные импульсы усиливались в самодельном четырехпроходном усилителе на базе титан-сапфирового осциллятора модели TiF-20 (Avesta Project Ltd., Россия), характерная энергия составляла 100–200 нДж. Энергия лазерного импульса варьировалась с помощью лазерного аттенюатора, состоящего из полуволновой пластины и поляризационного куба. Лазерные импульсы заводились в инвертированный оптический микроскоп Olympus IX71 с помощью коротковолнового фильтра FESH0750 производства компании Thorlabs (USA), установленного под углом 45°, на предметном столике которого помещался образец – капля раствора с ооцитами на покровном стекле. Импульсы фокусировались на образце объективом UPlanFLN 40×/0.75NA (Olympus). Размеры фокального пятна имели следующие параметры: радиус перетяжки лазерного пучка w0 = = 0.64 мкм и длина перетяжки (параметр Релея) ${{Z}_{0}}$ = 1.63 мкм (k – волновое число). Длительность импульса в фокальной плоскости измерялась автокоррелятором модели AA-M (Avesta Project Ltd., Россия). Призменный компрессор использовался для компенсации дисперсии групповых скоростей в объективе и прочих оптических элементах.
Для регистрации кавитации использовалось непрерывное излучение синего лазерного диода на длине волны 445 нм с мощностью 80 мВт, которое заводилось в объектив микроскопа соосно с фемтосекундными лазерными импульсами. Рассеянное на пузыре в обратном направлении синее излучение собиралось тем же объективом и направлялось через боковой выход микроскопа на систему регистрации, состоящую из фотоэлектрического умножителя, электрический сигнал с которого выводился на цифровой осциллограф модели WaveSurfer 62Xs производства компании LeCroy (USA). Запись сигнала осциллографом была синхронизована с приходом фемтосекундного импульса через электрический сигнал с электронного блока ячейки Поккельса. Временнóе разрешение составляло около 5 нс. Для того чтобы исключить постоянную засветку ооцитов синим излучением, луч диода перекрывался электромеханическим затвором (Sh05 компании Thorlabs (USA)), который открывался по электрическому сигналу, синхронизованным с работой ячейки Поккельса, на время 40 мс. Для компенсации инерционности затвора его открывание начиналось за 10 мс до срабатывания ячейки Поккелься и прихода лазерного импульса.
На предметном столике микроскопа была установлена двухкоординатная сканирующая пъезоплатформа модели NT-MDT (Россия), которая позволяла перемещать образец относительно фокуса объектива в поле 120 × 120 мкм с шагом до нескольких нанометров. Перемещение платформы осуществлялось через персональный компьютер с помощью джойстика. Открывание затвора и срабатывание ячейки Поккельса происходило по электрическому сигналу, генерировавшемуся при нажатии гашетки джойстика. Наблюдение за образцом в реальном времени проводилось с помощью установленной на микроскопе CMOS-камеры DCC1545M компании Thorlabs (USA). Видео эксперимента записывалось в виде файла на компьютере.
3. РЕЗУЛЬТАТЫ
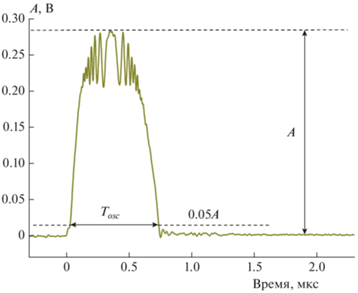
На рис. 1 показана кинетическая кривая рассеяния излучения при кавитации, вызванной поглощением излучения одиночного фемтосекундного импульса в растворе PBS. Данная кинетическая зависимость позволяет проследить процесс образования, расширения и схлопывания кавитационного пузыря. При нелинейном поглощении излучения импульса происходит формирование электронной плазмы большой плотности в области фокуса объектива. При термализация и рекомбинация электронов плазмы в фокальной области образуется перегретая жидкость. Существенным является то, что нагрев происходит за время, существенно меньшее времен тепловой и акустической релаксации, что приводит к появлению значительных локальных напряжений в жидкости. Акустическая релаксация напряжения приводит к появлению волны разгрузки (отрицательному давлению) в жидкости. При соответствующей температуре и отрицательном давлении может быть перейдена граница метастабильного состояния и в этом случае образуется пузырь, заполненный водяным паром. Давление пара вызывает расширение пузыря, которое проявляется как рост сигнала рассеяния. По мере расширения давление пара в пузыре падает и становится меньше давления окружающей жидкости. Под действием внешнего давления пузырь схлопывается (падение сигнала рассеяния на рис. 1). Для долгоживущих пузырей могло наблюдаться несколько циклов расширения–схлопывания с затухающей амплитудой. Высокочастотные осцилляции сигнала рассеяния вблизи вершины пика, по-видимому, связаны с зависимостью интенсивности рассеяния в обратном направлении от радиуса пузыря в соответствии с теорией Ми [25].
Рис. 1.
Осциллограмма рассеяния при кавитации под действием одиночного лазерного импульса в буферном растворе PBS. Нулевое время соответствует приходу лазерного импульса. Энергия импульса составляла 28 нДж. Показаны амплитуда пика рассеяния и время осцилляции пузыря.
В однородной жидкости максимальный радиус пузыря связан с длительностью цикла расширения–схлопывания пузыря (временем осцилляции Tosc) и может быть в предположении вязкой несжимаемой жидкости оценен из теории Релея:
(1)
${{R}_{{max}}} = 0.546{{\left( {\frac{{{{p}_{\infty }} - {{p}_{v}}}}{\rho }} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{T}_{{osc}}},$Для воды, считая давление в жидкости атмосферным и пренебрегая давлением газа внутри пузыря, получаем
Для относительно небольших пузырей необходимо также учитывать влияние поверхностного натяжения. Используя теорию Гилмора [26], можно получить следующие приблизительные формулы для максимального размера пузыря [27]: где(4)
$\begin{gathered} f({{T}_{{osc}}}) = 0.43238\exp \left( {\frac{{ - {{T}_{{osc}}}}}{{248.2074}}} \right) + 0.47292 \times \\ \times \,\,\exp \left( {\frac{{ - {{T}_{{osc}}}}}{{49.01347}}} \right) + 0.15773\exp \left( {\frac{{ - {{T}_{{osc}}}}}{{1589.40295}}} \right) + 1. \\ \end{gathered} $Практически мы измеряли время жизни пузыря как ширину пика рассеяния на уровне 5% от максимальной амплитуды; наряду с этим при каждом измерении записывалась также величина амплитуды.
Хотя формулы (3), (4) и можно использовать для оценки размера кавитационного пузыря в воде или водном растворе, их применимость при кавитации в среде с вязкоэластичными свойствами, такой как материал клетки, не является очевидной. Поэтому Rmax внутри ооцита оценивалась по величине амплитуды A сигнала рассеяния. Измеренная в ходе эксперимента величина интенсивности рассеяния пробного излучения являлась монотонно возрастающей функцией Tosc. В водном растворе мы могли рассчитать Rmax по формулам (3), (4) и таким образом получить калибровочную зависимость А(Rmax). Мы предположили, что эта калибровочная зависимость может быть использована для оценки размера пузыря внутри клетки. Это предположение в дальнейшем было подтверждено оценками Rmax по модели Релея–Гилмора.
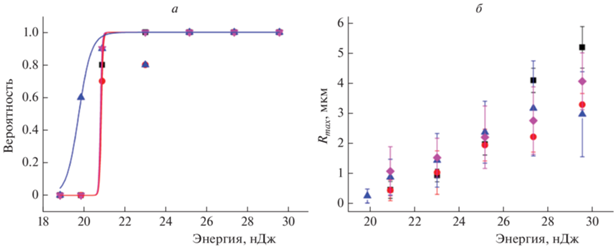
Период осцилляций, а следовательно, и размер кавитационного пузыря зависели от энергии импульса. На рис. 2 показана зависимость Rmax от энергии, измеренная для дистиллированной воды и раствора PBS при прочих равных условиях. Обращает на себя внимание практически совпадающий ход обеих зависимостей. Кроме того, мы могли найти величину порога кавитации, определяемую как наименьшее значение энергии, при котором на осциллограмме рассеяния наблюдался различимый сигнал рассеяния. Эта величина была одинаковой для воды и PBS и составляла примерно 20.6 нДж. Отсюда можно сделать вывод, что нелинейное поглощение фемтосекундного излучения и плотность образующейся при нелинейном поглощении излучения электронной плазмы для этих двух сред практически не различались. Это является достаточно нетривиальным результатом, поскольку фосфатный буферный раствор в отличие от воды имеет заметное линейное поглощение в спектральной области 190–250 нм. Таким образом, в этом растворе возможно возбуждение при четырехфотонном поглощении, которому соответствует длина волны 790/4 = 198 нм.
Рис. 2.
Зависимость максимального размера кавитационного пузыря от энергии импульса в дистиллированной воде (◼) и растворе PBS (⚫). В каждой точке значение скорости рассеяния усреднялось осциллографом по 50 измерениям. Значение Rmax пузыря вычислялось из усредненного времени осцилляции по формуле (2).
Далее мы провели измерения кавитации внутри GV-ооцита. Результаты опыта показали существенно различные реакции на фемтосекундные импульсы различных областей клетки. Чтобы показать это наглядно, в ходе эксперимента и при обработке результатов ооцит был разделен на три области, хорошо различаемые на оптическом изображении: цитоплазму, ядро и ядрышко. Для каждого значения энергии проводилось 10 измерений в произвольной точке в каждой из областей. Одновременно проводилось 10 измерений в буферном растворе возле ооцита. Положение фокуса объектива оставалось неизменным в течение всей серии. Для каждого из 10 измерений находились значения периода осцилляций Tosc, амплитуды сигнала рассеяния А и с помощью описанной выше процедуры калибровки находился средний радиус пузыря. В то же время мы могли рассчитать вероятность кавитации, которая определялась как отношение числа зарегистрированных актов рождения пузыря к числу испытаний. На рис. 3 показаны измеренные зависимости размера кавитационного пузыря и вероятности кавитации от энергии импульса при кавитации в буферном растворе, ядрышке, ядре и цитоплазме ооцита.
Вероятность образований пузыря могла быть приближена логистической функцией, как показано на рис. 3. Из этого приближения находился порог кавитации, который определялся как значение энергии, при котором вероятность была равна 0.5. Обращают на себя внимание близкие значения порогов кавитации для всех четырех сред. Для буферного раствора, цитоплазмы и ядра пороги практически совпадали и составляли 20.8–20.9 нДж, в ядрышке порог был несколько ниже – 19.8 нДж. Как было показано выше, эти пороги практически совпадают с порогом пробоя дистиллированной воды. Нами были проведены аналогичные измерения в нескольких ооцитах, и во всех случаях порог пробоя внутри клетки оказывался примерно совпадающим с порогом пробоя водного раствора.
Как и в водном растворе, внутри клетки увеличение энергии импульса сопровождалось ростом размера пузыря. Важно отметить, что при относительно небольших энергиях и радиусе пузырей менее 2–3 мкм различия в значениях радиуса пузырей находились в пределах ошибки измерений. Однако при увеличении энергии пузыри внутри ооцита были уже заметно меньше, чем в водном растворе. Этот эффект, по всей видимости, вызван влиянием эластичных сил внутри материала клетки, которые препятствуют расширению пузыря.
Помимо среднего значения важной характеристикой был также разброс между значениями периода осцилляций и размерами пузыря для разных измерений. Эксперименты вывили следующую качественную картину: в среде измеренные значения Tosc и Rmax были ближе к среднему значению, чем внутри ооцита, где встречались точки с очень большим отклонением от среднего. Для более строгой формализации этого наблюдения нами были проведены по 20 измерений в растворе PBS, цитоплазме, ядре и ядрышке ооцита при одинаковых экспериментальных условиях. Кроме того, с помощью процедуры калибровки, описанной выше, оценивался максимальный размер пузыря. Результаты измерений средних значений Rmax и среднеквадратичного отклонения (σ) от среднего для этих четырех сред представлены в табл. 1.
Таблица 1.
Сравнение значений максимального радиуса и времени жизни (τ) пузыря в среде и различных частях ооцита (энергия импульса – 23.9 нДж)
| Среда и части ооцита | τ, мкс | σ, мкс | Rmax, мкм | ΔRmax, мкм |
|---|---|---|---|---|
| PBS | 0.261 | 0.029 | 1.650 | 0.107 |
| Цитоплазма | 0.305 | 0.288 | 1.273 | 0.551 |
| Ядро | 0.234 | 0.112 | 1.167 | 0.517 |
| Ядрышко | 0.429 | 0.108 | 1.504 | 0.356 |
Как можно видеть, для буферного раствора все измеренные значения лежали вблизи среднего значения, в то время как внутри ооцита разброс значений был гораздо выше, а в цитоплазме он был даже сравним с самим средним значением. Как уже говорилось выше, соотношение между средним периодом осцилляции в различных областях ооцита и в среде не было постоянным и изменялось от опыта к опыту. Тем не менее общей была качественная картина: наименьший разброс по времени жизни был в буферном растворе, наибольший – в цитоплазме. Аналогичная картина наблюдалась и для максимальных значений радиуса пузыря. Средние значения радиуса пузырей для буферного раствора и ядрышка PBS были довольно близки, а в ядре и цитоплазме они были меньше на 20–25%. Необходимо отметить, что различия средних значений радиуса пузырей находились в пределах ошибки измерений; таким образом, деформации материала клетки не оказывали критического влияния на расширение пузырей относительно небольшого размера.
Различия во времени осцилляции могли возникать по двум причинам. Во-первых, в основе их могло лежать различие в динамике процессов роста и схлопывания кавитационного пузыря в клетке из-за наличия дополнительных вязкоупругих сил в среде (раствор PBS). В этом случае модель Релея–Гилмора уже не в полной мере описывала бы динамику пузыря, что привело бы к другому соотношению между Tosc и Rmax. Во-вторых, различия значений Tosc могут указывать на различия в максимальном размере пузыря в соответствии с формулами (2)–(4). Описать эту проблему можно с помощью диаграммы, на которой представлены результаты измерений параметров кавитационного пузыря в координатах радиус – период осцилляции. На рис. 4 приведен пример таких диаграмм для четырех сред; для сравнения также приведена кривая, соответствующая формулам (3), (4). Энергия импульса составляла 23.9 нДж.
Рис. 4.
Диаграммы, построенные в координатах максимальный радиус пузыря – время осцилляции, при кавитации в растворе PBS (a), цитоплазме (б), ядре (в) и ядрышке (г) ооцита. Энергия импульса – 23.9 нДж. Каждая точка соответствует одному акту кавитации, в каждой из сред сделано 20 измерений. Штриховая линия соответствует зависимости Rmax(Tosc), согласно модели Релея–Гилмора (формулы (3), (4)).
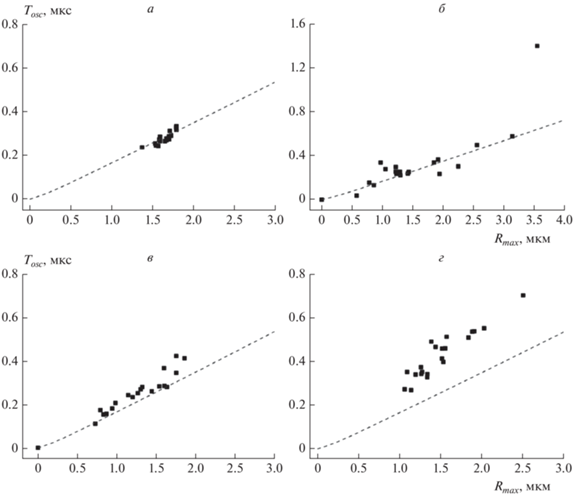
Анализ диаграмм позволяет сделать следующие выводы. Для раствора PBS, как и следовало ожидать, положение экспериментальных точек хорошо описывалось теоретической моделью Релея–Гилмора. В цитоплазме, несмотря на больший разброс результатов, большинство точек лежало вблизи кривой, соответствующей той же модели, хотя имелся и их разброс. Для ядра результаты измерений приближались к теоретической кривой, однако наблюдалось некоторое затягивание периода осцилляций. В среднем Tosc было на 9% выше значений, предсказываемых теоретической моделью. Наиболее интересными были результаты, полученные для ядрышка ооцита. Здесь все экспериментальные точки лежали значительно выше “теоретической” кривой. Продолжительность цикла расширение-схлопывания пузыря была в среднем на 60% дольше, чем следовало из модели Релея–Гилмора. Следует также отметить, что динамика и роста, и схлопывания пузыря в ядрышке существенно отличалась от динамики в случае водного раствора (рис. 5).
Рис. 5.
Сравнение кинетических кривых светорассеяния на кавитационных пузырях с близкими амплитудами в растворе PBS (1) и ядрышке ооцита (2). Энергия импульса – 23.9 нДж.
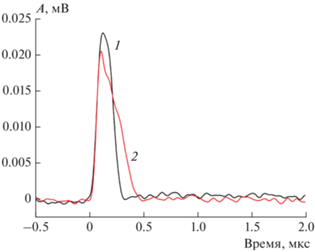
Форма пика светорассеяния на кавитационном пузыре в ядрышке была несимметричной – задний фонт был существенно длиннее переднего. Это указывает на то, что схлопывание пузыря по времени продолжалась дольше, чем расширение. Оценка времени жизни пузыря по формулам (2)–(4) предполагает, что длительность роста пузыря (время от рождения до достижения максимального размера) равна длительности схлопывания. Измерения светорассеяния в водном растворе указывают на качественную правильность этого предположения – длительности переднего и заднего фронта пика рассеяния примерно равны (рис. 5).
Таким образом, можно сделать вывод, что материал ядрышка ооцита обладает особенностями, связанными с его механическими свойствами, которые влияют на динамику образования кавитационных пузырей. В материале ооцита вне ядрышка динамика образования пузырей хорошо согласуется с моделью Релея–Гилмора.
Возвращаясь к диаграммам, приведенным на рис. 4, следует также отметить различия в распределении пузырей по размеру в различных областях ооцита. В цитоплазме и ядре было зарегистрировано значительное число небольших пузырей радиусом 1 мкм и меньше, в то время как в ядрышке, несмотря на значительную ширину распределения пузырей по размерам, все они были больше 1 мкм.
Получить дополнительную информацию о неоднородности цитоплазмы ооцита можно, сопоставляя размер и время жизни кавитационого пузыря с положением точки прицеливания. Для этого нами проводилась серия измерений из 20–40 выстрелов по произвольно выбранным точкам в цитоплазме ооцитам. Параллельно велась видеосъемка. Наблюдалось соответствие между положением точки в цитоплазме клетки и величиной и временем жизни пузыря. На рис. 6 представлены точки, в которых проводилась серия измерения из 32 выстрелов на одном из ооцитов.
Рис. 6.
Серия из 32 измерений периода осцилляции кавитационного пузыря в цитоплазме ооцита. Синие (более мелкие) кружки – Tosc < 0.9 мкс, красные (более крупные) – Tosc > 0.9 мкс. Энергия импульса была постоянной и составляла 28.2 нДж.

Для удобства представлений результатов все измерения были поделены на две группы – с периодом осцилляции пузыря, большим и меньшим 0.9 мкс, которые помечены на рис. 6 красными (крупные) и синими (мелкие) кружками соответственно. Как можно видеть, все измерения при больших значениях Tosc оказались локализованными в одном и том же секторе цитоплазмы. Усредненные значения Tosc в этих двух группах измерений оказались равными 1.32 и 0.47 мкс, т.е. различались примерно в три раза. Можно сделать вывод, что существовала область в цитоплазме с более сильным откликом на лазерные импульсы. Следует отметить, что для серий измерений с разной энергией импульса на одном и том же ооците области с “сильным” и “слабым” откликом примерно совпадали. Нами было обследовано два ооцита. В обоих ядро располагалось не в центре, а было сдвинуто к краю клетки. Для обоих ооцитов и во всех измерениях область “сильного” сигнала кавитации располагалась между ядром и ближайшим к ядру краем ооцита (см. рис. 5).
Еще одним интересным явлением было образование долгоживущих возмущений в материале ооцита при лазерном пробое. В то время как время жизни кавитационного пузыря не превышало единиц микросекунд, длительность возмущений составляла доли секунд и более, так что их можно было зарегистрировать на видеоизображении. Согласно данным светорассеяния существует заметная корреляция между периодом осцилляции кавитационного пузыря Tosc и величиной и длительностью возмущений. Небольшие возмущения на видеоизображении, проявлявшиеся как локальные движения в цитоплазме, начинали наблюдаться при Tosc > 0.4 мкс. При длительности периода осцилляции $ \gtrsim {\kern 1pt} 0.8$ мкс в материале ооцита образовывались хорошо заметные на изображении долгоживущие пузыри. В цитоплазме они схлопывались за времена порядка долей секунд. В ядрышке могло оставаться остаточное повреждение, которое не исчезало за времена вплоть до десятков минут. Пример долгоживущего пузыря в цитоплазме ооцита, зарегистрированного на видеоизображении, показан на рис. 6. Характерный размер остаточных пузырей составлял микрометры (например, около 4 мкм на рис. 7). При этом максимальный диаметр соответствующего кавитационного пузыря, оцененный по амплитуде сигнала светорассеяния, составлял ≈16 мкм, т.е. был в разы большим.
Рис. 7.
Серия кадров из видеоизображения ооцита при пробое. Энергия импульса – 28.2 нДж; а – до выстрела, б – спустя 50 мс после выстрела, в – спустя 500 мс после выстрела. Время жизни пузыря согласно видеоизображению составляло 200–250 мс. Максимальный диаметр – ≈3.9 мкм. Время жизни соответствующего кавитационного пузыря, измеренное по сигналу светорассеяния, составляло 1.47 мкс.

Образование пузыря происходило за время, меньшее периода следования кадров; в результате на видеоизображении оно выглядело “мгновенным”. Получить информацию о динамике формирования пузыря можно по данным светорассеяния (пример приведен на рис. 8).
Рис. 8.
Сравнение сигналов светорассеяния при оптическом пробое в буферном растворе (1) и в цитоплазме ооцита (2). Энергия импульса – 68 нДж.
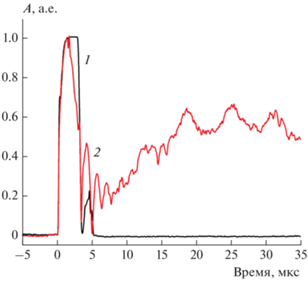
Как в среде, так и в цитоплазме при пробое наблюдался короткий (до нескольких мкс) пик, связанный с образованием кавитационного пузыря. При этом было заметно несколько циклов расширения и схлопывания (в среде – два, в цитоплазме – четыре). После этого в буферном растворе сигнал рассеяния выходил на нуль. В цитоплазме вместо этого происходил рост сигнала рассеяния, который выходил на максимум за время около 20–25 мкс после выстрела. Этот рост мы связываем с образованием долгоживущего остаточного пузыря. Сигнал рассеяния оставался на ненулевом уровне в течение всего временнóго диапазона (4 мс) измерения скорости рассеяния.
4. ОБСУЖДЕНИЕ
Одним из основных результатов этой работы является близкое совпадение порогов пробоя биологического материала и чистой воды фемтосекундными лазерными импульсами. Таким образом, содержащиеся в биоматериале органические вещества и эндогенные хромофоры оказывают малое влияние на пробой, несмотря на то, что они имеют поглощение в более длинноволновой области и, следовательно, меньший порядок многофотонного поглощения в сравнении с водой. В этом отношении фемтосекундные лазерные импульсы радикально отличаются от более длинных наносекундных. Как было показано в работах [23, 24], для наносекундных импульсов порог пробоя материала клетки был в несколько раз меньше порога пробоя воды. Добавление в воду содержащихся в клетке хромофоров, таких как NADH оказывало схожее действие на величину порога. Таким образом, уменьшение длительности импульса изменяет характер поглощения в биоматериале.
Схожие явления наблюдались и при исследовании лазерного пробоя в водных растворах: для наносекундных импульсов порог пробоя сильно зависел от содержащихся в воде загрязнений и растворенных веществ, в то время как для субнаносекундных импульсов он практически не зависел от степени очистки воды. Значения порога пробоя для физиологического раствора и дистиллированной воды также практически совпадали [12]. К подобному же выводу приводит модельный расчет порога лазерного пробоя на основе кинетических уравнений электронной плотности в воде при нелинейном поглощении лазерных импульсов [28].
Для наносекундных импульсов ИК-диапазона наличие загрязнений, которое учитывалось как фоновая плотность свободных электронов в жидкости, на порядок снижало порог пробоя, в то время как для импульсов длительностью от ≤10 пс загрязнения практически не влияли на порог пробоя.
На качественном уровне подобные явления можно объяснить более эффективным возбуждением многофотонного поглощения сверхкороткими лазерными импульсами. Для наносекундых импульсов генерация электронной плазмы происходит по механизму лавинной ионизации, при этом содержащиеся в водной среде загрязнения и добавки “поставляют” начальную электронную плотность для развития лавины. Развитие лавины и достигнутая к концу импульса электронная плотность сильным образом зависят от степени чистоты воды. Ультракороткие импульсы за счет больших пиковых интенсивностей позволяют проводить эффективную многофотонную ионизацию молекул воды, создавая плотность электронов, достаточную для дальнейшей ударной ионизации даже в чистой воде [12, 28]. Таким образом, при фемтосекундном пробое загрязнения и растворенные в воде вещества больше не являются лимитирующим фактором при генерации плазмы.
Еще одной особенностью фемтосекундных импульсов является способность производить пробой в ограниченной области и создавать кавитационные пузыри размером в микрометры и доли микрометров, добиваясь тем самым практически “точечного воздействия” на биоматериал. Нами было показано, что внутри материала клетки вблизи порога пробоя кавитационные пузыри могут иметь радиус до сотен нанометров (рис. 3). Динамика подобных пузырей внутри клетки имеет свои особенности с сравнении с большими по размеру кавитационными пузырями, создаваемыми при лазерном пробое наносекундными лазерными импульсами. Для последних наблюдался эффект ограничения роста пузыря силами, возникающими при деформации биоматериала. В результате при прочих равных условиях пузыри внутри клеток имели существенно меньший радиус, чем в воде [23]. В нашем случае размеры пузырей в воде и ооците были близкими в пределах экспериментальной погрешности (рис. 3) Только при увеличении радиуса пузыря свыше ≈2 мкм наблюдался ограничивающий эффект биологической матрицы. Таким образом, мы можем сделать вывод, что для динамики кавитационных пузырей в клетке характерны два режима. Для небольших размеров пузырей можно пренебрегать деформациями биоматериала и силами, возникающими при деформации. В этом случае расширение пузыря происходит примерно так же, как и в воде. При радиусе больше нескольких микрометров силы деформации начинают играть существенную роль и ограничивают рост пузыря.
Наконец, еще одна величина, с помощью которой можно характеризовать кавитацию в материале клетки, – это однородность характеристик кавитационного пузыря (максимальный радиус и период осцилляций). Как было показано выше, в материале ооцита эта однородность существенно ниже, чем в водном растворе. Большая величина разброса размеров кавитационного пузыря должна быть связана с оптической неоднородностью ооцита. Можно предположить, что в биоматериале присутствовали небольшие, сильно поглощающие частицы. Когда эти частицы оказываются вблизи фокуса объектива, мы наблюдаем сильный кавитационный отклик за счет повышенного поглощения. В то же время потери на поглощение и рассеяние, а также искажения, вызванные аберрациями лазерного пучка, способны уменьшить эффективную интенсивность излучения в области фокуса. В этом случае поглощенная в фокальной области энергия, а следовательно, и размер пузыря будут существенно меньше средних значений. Данные рассуждения позволяют объяснить причины разброса в значениях характеристик пузыря в цитоплазме и ядре ооцита. Ядрышко отличается гораздо большей оптической однородностью: на изображении в оптическом микроскопе у него отсутствует сколько-нибудь заметная структура. Следовательно, для ядрышка явления, связанные с потерями излучения и аберрациями на оптическом пути через материал ооцита, должны быть менее выраженными, чем для цитоплазмы или ядра.
Действительно, на диаграмме, представленной на рис. 4г, в ядрышке не было зарегистрировано кавитационных пузырей размером <1 мкм. Тем не менее существуют механизмы, приводящие к уширению распределения кавитационных пузырей в ядрышке по размеру. В частности имеются заметные выбросы в область радиуса около 2 мкм и выше. По современным представлениям ядрышко GV-ооцитов животных имеет неоднородное строение, и представляет собой губчатую структуру со сгущениями материала (так называемыми фибриллярными центрами), имеющими характерный размер ≈1 мкм [29, 30]. Можно предположить, что при попадании сфокусированного фемтосекундного импульса в более плотные области фибриллярных центров поглощается большая доля энергии импульса, что и приводит к появлению пузырей большего размера. В этом случае неоднородность поглощения является основным механизмом, приводящим к разбросу размеров кавитационных пузырей. Дополнительным механизмом могут быть искажения, вносимые преломлением лазерного пучка на границе раздела ядро–ядрышко. Простые оценки, основанные на численных расчетах согласно обобщенной теории Лоренца–Ми для известных показателей преломления нуклеоплазмы и материала ядрышка (1.3544 и 1.3744 соответственно [29]) показывают, что в зависимости от положения фокуса пучка внутри ядрышка интенсивность излучения в фокальном пятне может варьироваться вплоть до 6–7% как в сторону уменьшения, так и увеличения в сравнении со случаем фокусировки в однородной среде.
Еще один вопрос, который был исследован нами, – это соответствие динамики кавитационных пузырей в ооците упрощенной теоретической модели Релея. Экспериментальные измерения показали, что в целом соотношение между максимальным радиусом пузыря и периодом осцилляций хорошо согласуется с этой моделью: наблюдалась пропорциональность между Rmax и Tosc. Отметим, что схожие результаты были получены ранее для наносекундного лазерного пробоя в ооцитах [23]. Коэффициент пропорциональности при пробое в ядре и особенно в ядрышке был, однако, заметно больше модельного. Наиболее очевидная причина этого различия – неточность калибровки, проведенной в водном растворе при измерениях внутри клетки. Дело в том, что потери на рассеяние и аберрации пробного излучения диода в оптически неоднородном биоматериале приводят к уменьшению амплитуды сигнала рассеяния, зарегистрированного фотоэлектронным умножителем. Как следствие, значение радиуса пузыря, полученное из калибровки, будет заниженным, а, значит, отношение Tosc/Rmax – завышенным. Численно измерить потери на рассеяние сложно ввиду оптической неоднородности ооцита; представляется разумной оценка неточности метода в несколько процентов. Далее, как следует из формулы (1), коэффициент пропорциональности между Rmax и Tosc зависит от плотности среды:
В более плотной среде этот коэффициент должен быть выше. Используя аппросимацию экспериментальных данных формулой (1), мы получаем для плотности материала ядра оценку в 1.18 г/см3. Из сказанного выше, следует, что это оценка сверху, которая не учитывает потери пробного излучения в ооците.
Для ядрышка ооцита приближение экспериментальных данных формулой (1) дает для плотности материала явно завышенную величину – 2.4 г/см3. Кроме того, в ядрышке динамика схлопывания пузырей заметно отклонялась от модели Релея. Это отклонение можно объяснить особенностью свойств материала ядрышка, в частности наличием у него конечной вязкости и упругопластичных свойств. Теоретический анализ проблемы схлопывания пузыря в вязкой жидкости показывает, что при учете параметров конечной среды время схлопывания отклоняется от теоретических данных расчета по модели Релея и растет с увеличением вязкости [31].
Численное моделирование осцилляций пузыря, возникающих при лазерном пробое в вязко-упругой и пластичной среде, имитирующей реальную биоткань, было проведено в работе [32]. Результаты расчетов показывают, что отношение Tosc/Rmax растет с ростом коэффициента вязкости, модуля упругости и напряжения пластического течения. Кроме того, учет упругих и пластических свойств приводит к несимметричному характеру цикла расширения–схлопывания пузыря: фаза схлопывания становится длиннее фазы расширения. Таким образом, мы можем качественно объяснить наблюдавшиеся в эксперименте отклонения осцилляций кавитационного пузыря в ядрышке от релеевской модели.
С практической точки зрения то, что в материале ооцита, исключая ядрышко, соотношение между Rmax и Tosc с хорошей численной точностью соответствует модели Релея–Гилмора, означает, что период осцилляций, измеренный оптическими методами или с помощью гидрофона, можно использовать для вычисления размера кавитационных пузырей в клетке по формулам (2)–(4). Стоит отметить, что измерение соотношения между максимальным радиусом и периодом осцилляций пузыря может быть использовано для качественной или даже количественной оценки плотности, вязкости и других свойств материала.
Наконец, остановимся на процессе формирования долгоживущих пузырей внутри ооцита. Следует подчеркнуть его отличие от лазерной кавитации, при которой паровые пузыри не являются стационарными, а живут ограниченный период времени – до микросекунд в наших экспериментах, схлопываясь под действием внешнего давления. Остаточные пузыри наблюдались на существенно больших временны́х масштабах – до сотен миллисекунд. Это означает, что они являлись квазистационарными, и давление в жидкости было уравновешено давлением содержащегося в пузыре газа. Можно предположить, что остаточные пузыри были заполнены в основном парами воды, образующимися при нагреве жидкости после поглощения лазерного импульса. В этом случае парообразование можно рассматривать как сложный двухстадийный процесс.
На первой стадии сразу после лазерного пробоя происходят быстрый нагрев жидкости в перегретое состояние и взрывное кипение по достижении спинодальной кривой на фазовой диаграмме [33]. Взрывное кипение происходит за субмикросекундные времена, меньшие характерного временнóго масштаба теплопереноса. Оно охватывает только относительно небольшой объем, где произошла генерация плазмы при лазерном пробое.
На второй стадии происходит переход в паровую фазу части нагретой жидкости, окружающей кавитационный пузырь. Этот процесс происходит при меньших температурах, чем взрывное кипение и является более медленным. По данным светорассеяния по времени он занимает до десятков микросекунд и на первых этапах происходит параллельно осцилляциям кавитационного пузыря (рис. 8). Последний выступает как зародыш, постепенно расширяющийся по мере заполнения парами воды. Однако остаточный паровой пузырь даже при максимальном расширении не достигает размеров предшествовавшего ему кавитационного пузыря. Это видно как по амплитуде сигнала на осциллограмме рассеяния, так и по размерам остаточного пузыря, оценивавшихся по видеоизображению. По достижении паровым пузырем максимальных размеров наступает достаточно длительный стационарный период, в течение которого идет постепенная конденсация содержащихся в нем водяных паров. По мере конденсации и уменьшения содержания водяного пара в пузыре он постепенно сжимается внешним давлением, так что давление пара в нем остается равным атмосферному, что поддерживает равновесие стенок пузыря.
Возникает вопрос, почему остаточные пузыри при тех же экспериментальных условиях не наблюдались при пробое в водном растворе, а только внутри ооцита, ведь процессы парообразования и роста парового пузыря не являются специфичными для биоматериала. Мы полагаем, что причиной этого являются значительные потоки жидкости в том числе и конвективного характера и действие архимедовой силы, которые приводят к тому, что зародившийся в фокальной области пузырь затем смещается из фокуса. Как следствие, он плохо регистрируется как на видеоизображении, так и на осциллограмме светорассеяния. Внутри клетки пузырь оказывается “вмороженным” внутрь биологической матрицы, которая препятствует его перемещению. Таким образом, мы можем регистрировать его в течение всех стадий его жизни. Специфический случай составляет ядрышко ооцита, где видимое остаточное повреждение сохранялось в течение десятков минут. По-видимому, этот факт связан с особенностями строение ядрышка, представляющего собой более плотную в сравнении с остальными областями клетки губчатообразную структуру, состоящую преимущественно из белковых молекул.
ЗАКЛЮЧЕНИЕ
В работе предложен экспериментальный метод образования кавитационных пузырей с помощью фемтосекундного лазера, позволяющий детектировать динамику развития кавитационного пузыря, используя комбинацию флеш-изображения и кинетику рассеяния зондирующего излучения на поверхности пузыря. Данный метод позволяет регистрировать динамику для каждого индивидуального случая. Также была показаны возможность индуцирования пузырей, имеющих размер порядка сотен нанометров, и отличие динамики образования пузыря в зависимости от среды, в которой наблюдалось явление. Методика апробирована в растворе PBS и в различных зонах GV-ооцита мыши и показано, что полученная с помощью нее динамика хорошо соответствует теоретической модели Релея. Получено подтверждение особенного строения ядрышка, значительно отличающегося по своей структуре от других частей ооцита.
Работа выполнена при поддержке грантом Российского фонда фундаментальных исследований 19-53-52007, MOST 108-2923-M-259-002-MY3.
Список литературы
König K., Riemann I., Fischer P. et al. // Cell Mol. Biol. 1999. V. 45. P. 195.
König K., Riemann I., Fritzsche W. et al. // Opt. Lett. 2001. V. 26. № 11. P. 819.
Tirlapur U.K., König K. // Nature. 2002. V. 418. № 6895. P. 290.
Watanabe W., Arakawa N., Matsunaga S. et al. // Opt. Express. 2004. V. 12. № 18. P. 4203.
Maxwell I., Chung S., Mazur E. et al. // Med. Laser Appl. 2005. V. 20. № 3. P. 193.
Yanik M.F., Cinar H., Cinar H.N. et al. // Nature. 2004. V. 432. № 7019. P. 822.
Supatto W., Débarre D., Moulia B. et al. // Proc. Natl. Acad. Sci. USA. 2005. V. 102 №. 4. P. 1047.
Sacconi L., O’Connor R.P., Jasaitis A. et al. // J. Biomed. Opt. 2007. V. 12. № 5. P. 050502.
Vogel A., Noack J., Hüttman G. et al. // Appl. Phys. B Lasers Opt. 2005. V. 81. № 8. P. 1015.
Heisterkamp A., Maxwell I.Z., Mazur E. et al. // Opt. Express. 2005. V. 13. № 10. P. 3690.
Bourgeois F., Ben-Yakar A. // Ibid. 2008. V. 16. № 8. P. 5963.
Kennedy P.K. // IEEE J. Quantum Electron. 1995. V. 31. № 12. P. 2241.
Vogel A., Linz N., Freidank S. et al. // Phys. Rev. Lett. 2008. V. 100. № 3. P. 038102.
Sacconi L., Tolić-Nørrelykke I.M., Antolini R. et al. // J. Biomed. Opt. 2005. V. 10. № 1. P. 014002.
Shimada T., Watanabe W., Matsunaga S. et al. // Opt. Express. 2005. V. 13. № 24. P. 9869.
Boudaïffa B., Cloutier P., Hunting D. et al. // Science. 2000. V. 287. № 5458. P. 1658.
Sanche L. // Eur. Phys. J. D 2005. V. 35. № 2. P. 367.
Nikogosyan D.N., Oraevsky A.A., Rupasov V.I. et al. // Chem. Phys. 1983. V. 77. № 1 P. 131.
Hutchinson F. // Prog. Nucleic Acid Res. Mol. Biol. 1985. V. 32. P. 115.
Oraevsky A.A., Nikogosyan D.N. // Chem. Phys. 1985. V. 100. № 3. P. 429.
Tirlapur U.K., König K., Peuckert C. et al. // Exp. Cell Res. 2001. V. 263. № 1. P. 88.
Feng Q., Moloney J.V., Newell A.C. et al. // IEEE J. Quantum Electron. 1997. V. 33. № 2. P. 127.
Hutson M.S., Ma X. // Phys. Rev. Lett. 2007. V. 99. 158104-1.
Jayasinghe A.K., Rohner J., Hutson M.S. et al. // Biomed. Opt. Express. 2011. V. 2. № 9. P. 2590.
Rayleigh L. // Mag. J. Sci. 1917. V. 34. P. 94.
Gilmore F.R. Lab. Report. № 26-4. Pasadena, California: Calif. Inst. Tech., 1952.
Vogel A. // Proj. Rep. 2009. V. 44. № 0704.
Noack J., Vogel A. // IEEE J. Quantum. 1999. V. 35. № 8. P. 1156.
Handwerger K.E., Cordero J.A., Gall J.G. et al. // Mol. Biol. Cell 2005. V. 16. № 1. P. 202.
Lo S.J., Lee C.C., Lai H.J. et al. // Cell Res. 2006. V. 16. № 6. P. 530.
Bogoyavlenskiy V.A. // Phys. Rev. E: Stat. Phys., Plasmas, Fluids, Relat. Interdiscip. Top. 1999. V. 60. № 1. P. 504.
Brujan E.A., Vogel A. // J. Fluid Mech. 2006. V. 558. P. 281.
Vogel A., Venugopalan V. // Chem. Rev. 2003. V. 103. № 2. P. 577.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика