Химическая физика, 2023, T. 42, № 1, стр. 73-83
Моделирование времязависимого захвата O3 на покрытии из метановой сажи в условиях конкурентной адсорбции O3/NO2 и O3/N2O5
В. В. Зеленов 1, *, Е. В. Апарина 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: v.zelenov48@gmail.com
Поступила в редакцию 15.02.2022
После доработки 14.03.2022
Принята к публикации 21.03.2022
- EDN: HREHOS
- DOI: 10.31857/S0207401X23010144
Аннотация
Исследован захват О3 (1 · 1012–5 · 1013 см−3) на покрытии из метановой сажи, предварительно обработанном N2O5, с использованием проточного реактора с подвижной вставкой. Исходя из зависимости коэффициента захвата озона от времени экспозиции и от концентрации [O3], установлен механизм захвата и получен ряд элементарных параметров, описывающих процесс захвата при произвольных концентрациях О3. На базе ленгмюровского представления адсорбции предложено модельное описание захвата на покрытии из сажи в условиях конкурентной адсорбции O3/NOx, где NOx = NO2 и N2O5, с учетом многостадийности процесса захвата. На основании разработанной модели и элементарных параметров, описывающих захват О3, NO2 и N2O5 на свежем сажевом покрытии, а также захват озона на поверхности, предварительно обработанной NO2 и N2O5, проведены численные оценки дополнительных каналов захвата озона для двух реальных сценариев соотношения концентраций O3/NO2 и O3/N2O5. Для промышленно развитого региона в зимнее время, когда концентрация озона минимальна (10 ppb O3, 17 ppb NO2 и 4 ppb N2O5), дополнительный интегральный вклад в захват O3 на продуктах реакции NO2 с сажей составляет 68%, а в случае N2O5 – 3.6%. Для того же региона летом при максимальной концентрации озона (36 ppb O3, 17 ppb NO2 и 4 ppb N2O5) аналогичные вклады будут составлять 20% и 1% соответственно. Причины такого различия обсуждаются.
ВВЕДЕНИЕ
Окислы азота NO, NO2, N2O5 наряду с озоном O3 играют важную роль в окислительной способности земной атмосферы. Один из таких компонентов – N2O5 как активный ночной реагент образуется по реакциям NO2 + O3 → NO3 + O2, NO3 + NO2 + M ↔ N2O5 [1] и участвует в разветвленной схеме разрушения озона в верхних слоях атмосферы [2]. В то же время гетерогенный захват N2O5 на частицах атмосферного аэрозоля за счет такой убыли N2O5 ведет к увеличению концентрации озона [3]. В целом расход N2O5 определяется как убылью реагентов NO2 и O3, так и гетерогенными реакциями на капельках облаков и частицах аэрозолей различной природы [1, 4, 5]. Исходя из натурных измерений в тропосфере, относительные концентрации N2O5 составляют 50–100 ppt над Арктикой в зимний период и до 3.8 ppb над загрязненными регионами [4]. Измеряемые концентрации O3 в тропосфере дают значения порядка 35–40 ppb [5, 6]. В приземной тропосфере озон образуется в циклах фотохимических реакций с участием OH, NOx и различных органических компаундов [6, 7]; дополнительный вклад вносят грозы и частично интрузия из стратосферы. При натурных измерениях относительных концентраций O3, NO2 и отдельно NOx в течение года в приземной тропосфере промышленно развитого региона установлено, что содержание озона максимально летом (40 ppb) и минимально зимой (10 ppb) с локальным минимумом в 0.3 ppb. При этом максимуму [О3] соответствует минимум [NOx] (17 ppb), а минимуму [О3] – максимум [NOx] (30 ppb). Содержание NO2 на протяжении года слабо изменяется и остается на уровне 15–20 ppb [8].
Средняя масса аэрозоля в тропосфере составляет 4.6 мкг · м–3. При этом на долю органической фракции приходится около 27%, большей частью которой является углерод [9–11]. Углеродсодержащий аэрозоль образуются в результате горения топлив и биомасс, а также лесных пожаров. Глобальная эмиссия основного компонента сажи – углерода оценивается в 6.6–11.6 Тг в год, а концентрация субмикронных частиц углерода в воздухе составляет ∼0.6 мкг · м–3 [12–14].
Захват O3 на покрытии из сажи горения углеводородов исследован в большом числе работ с применением различных методик и способов регистрации как газофазных реагентов и продуктов, так и продуктов конденсированной фазы [15]. Наблюдалась зависимость коэффициента захвата γ от времени экспозиции к газу-реагенту и от его концентрации. Коэффициенты захвата озона на покрытиях из сажи различных углеводородов, измеренные и рассчитанные на истинную ВЕТ-поверхность (Brunnauer–Emmett–Teller), составляют γini ∼ 10–3 – начальная величина и γss ∼ 10–4–10–5 – усредненное значение за большой промежуток времени. Во многих работах отмечается сложный многостадийный характер захвата. Исходя из температурной зависимости коэффициента захвата, в ряде работ оценены коэффициент Ленгмюра KL, теплота адсорбции Qad и энергия активации Ea элементарных реакций захвата O3 на сажевом покрытии [16–18].
Данные по временнóму поведению коэффициента захвата γ(t) озона, его зависимости от концентрации О3, по содержанию образующихся продуктов и кинетическим параметрам элементарных реакций необходимы для корректного описания процесса такого взаимодействия и в конечном итоге для моделирования глобальных химических процессов, протекающих в атмосфере. Захват озона на частицах аэрозоля в тропосфере происходит в условиях конкурентной адсорбции. С одной стороны, вследствие малости концентраций конкурирующих газов-реагентов захваты каждого из них должны происходить независимо и практически не должны влиять друг на друга. С другой стороны, в результате захвата конкурирующего агента может образовываться новый химически активный твердый продукт, на котором возможен дополнительно захват озона. В частности, установлено, что в результате захвата NO2 на свежем сажевом покрытии образуются поверхностные центры, способные к такому захвату [19].
Газ-реагент N2O5 является важным промежуточным звеном в атмосферной химии окислов азота, а его концентрация термодинамически связана с концентрациями NO2 и NO3. Лабораторные исследования взаимодействия N2O5 с сажей некоторых углеводородов немногочисленны и содержат большой разброс значений коэффициентов захвата γ: от 0.33 до 4 ∙ 10–5 в зависимости от концентрации газа-реагента, учета геометрической или удельной поверхности сажи и временнóго фактора процесса, когда γini начального захвата на порядок больше γss квазистационарного захвата [15, 20]. Установлено, что захват N2O5 на таких субстратах происходит в результате совместного действия физсорбции и окислительно-восстановительной реакции с образованием газофазного продукта NO либо NO2 и следового количества НNO3. Наблюдается начальный быстрый захват с коэффициентом захвата γini ≈ 0.1 (в расчете на геометрическую поверхность сажи) и последующее уменьшение коэффициента захвата до значений γss ≈ 5 ⋅ 10–3. С учетом реальной (BET) поверхности сажи γss оценивается как 3 ⋅ 10–8 [21]. Исходя из зависимости γ от концентрации реагента, авторы предполагают сложный механизм взаимодействия N2O5 с сажей: N2O5 + {C} → → N2O3(ads) + Продукт, N2O3(ads) → NO + NO2. Такой процесс является некаталитическим, т.е. углеродные центры расходуются в этих процессах захвата, что приводит к модификации поверхности субстрата и образованию новых функциональных групп.
Цель данной работы – установление дополнительных каналов стока озона на поверхностных центрах, образующихся в результате захвата конкурирующего газа-реагента. В качестве такого конкурирующего агента рассматриваются N2O5 и исследованный нами ранее NO2. На базе лэнгмюровского представления конкурентной адсорбции предложено модельное описание процесса захвата озона на свежем сажевом покрытии в присутствии этих газов-реагентов. Получены количественные оценки дополнительного канала захвата озона для ряда его характерных тропосферных концентраций.
ЭКСПЕРИМЕНТ
Химический реактор. Захват О3 и N2O5 исследовали в проточном реакторе с подвижной вставкой и нанесенным на нее пленочным сажевым покрытием [18]. Реактор сопряжен с масс-спектрометром высокого разрешения с электронной ионизацией. Диапазон энергии ионизирующих электронов можно варьировать от 50 до нескольких эВ при разбросе в 0.1 эВ.
При исследовании захвата N2O5 основной поток гелия (особой чистоты) протекает через термостатированную ампулу, заполненную кусочками тефлоновых капилляров и намороженной на них N2O5, а затем через цилиндрический стеклянный реактор с внутренним диаметром dR = 1.3 см с линейной скоростью u = 100–250 см · с–1 при суммарном давлении в реакторе p = 1–3 Торр. Тонкий центральный стержень из нержавеющей стали с сажевым покрытием диаметром dr = 0.2 см и максимальной длиной L = 50 см можно перемещать с помощью внешнего магнита вдоль оси трубки реактора из компенсирующего объема в зону контакта с газом-реагентом. Через компенсирующий объем подается дополнительный поток гелия во избежание неконтролируемого диффузного потока газа-реагента из зоны реакции в этот объем. Отбор пробы в масс-спектрометр проводится в виде молекулярного пучка через отверстие диаметром 0.35 мм в вершине напускного конуса, расположенного соосно с внешней трубкой реактора.
При исследовании захвата озона к основному потоку гелия через боковой ввод подавался дополнительный поток смеси O3/He с заданной концентрацией озона. Эта смесь приготавливалась заранее в бачке из нержавеющей стали. Бачок и все трубки подачи смеси в реактор были пропассивированы заранее молекулярным фтором.
Реагент N2O5 приготавливали заранее в статических условиях по реакции O3 + NO2 → NO3 + O2, NO3 + NO2 → N2O5, затем перемораживали в ампулу криостата при медленной прокачке потоком гелия и хранили при температуре ампулы, равной 178 К. Основным побочным реагентом была двуокись азота, вклад потока которой в поток N2O5 составлял около 5%.
В качестве источника сажи использовали лабораторную горелку, присоединенную к газовой магистрали. Металлический стержень располагали на расстоянии 15–17 см от основания пламени при постоянном вращении стержня вручную. Удельную поверхность сажи определяли экспериментально по методу BET. При диффузионном горении метана и при наших условиях нанесения удельная поверхность сажи составляет Sspec = = (40 ± 10) м2 · г−1.
Процедура измерения. Экспериментальные зависимости коэффициента захвата O3 на сажевом покрытии от времени его экспозиции определяли по относительному изменению концентрации озона на масс-спектральной линии I48 (m/z = 48) при введении стержня с покрытием в зону его контакта с озоном и последующем выведении из этой зоны. Измерение интенсивности ионного тока проводили в режиме механической модуляции молекулярного пучка и синхронного счета ионов. В отсутствие стержня с покрытием измеряли исходную концентрацию озона. Вводили в зону контакта участок стержня (обычно на 5–10 см), одновременно включая режим многократного измерения в течение нескольких сот секунд. Убирали стержень и повторно измеряли уровень концентрации озона. Вновь вводили стержень и повторяли многократный режим измерения до полного прекращения захвата озона. Изменяли исходную концентрацию озона и повторяли всю процедуру измерения при введении следующего участка стержня с покрытием.
При наших скоростях потока и давления в реакторе кинетика расхода озона при его захвате на сажевом покрытии описывается уравнением первого порядка:
(1)
$--d\left[ {{{{\text{O}}}_{3}}\left( {{{t}_{c}},t} \right)} \right]/d{{t}_{c}} = {{k}_{w}}\left( t \right)\left[ {{{{\text{O}}}_{3}}\left( {{{t}_{c}},t} \right)} \right],$При (dr/dR) $ \ll $ 1 для сажевого покрытия, поверхность которого определяется эффективной площадью Sef, выраженной через массу навески ρm на единичную поверхность и удельную поверхность сажи Sspec, величина $k_{w}^{k}\left( t \right)$ определяется уравнением
(2)
$k_{w}^{k}\left( t \right) \approx (\gamma \left( t \right){{c}_{{{{{\text{О}}}_{{\text{3}}}}}}}{{S}_{{spec}}}{{\rho }_{m}}/{{d}_{R}})\left( {{{d}_{r}}/{{d}_{R}}} \right).$Характерное время контакта tc составляет не более 0.1 с, что существенно меньше минимального времени (t = 5 с) интегрирования интенсивности сигнала масс-спектрального пика. На этом основании возможно интегрирование уравнения (1) по tc, и с учетом (2) зависимость коэффициента захвата γ в уравнении (1) от времени экспозиции t при захвате на сажевом покрытии с учетом ВЕТ-поверхности есть
(3)
$\gamma {\text{(}}t{\text{)}} = \frac{{{\text{ln}}\left( {{{I_{{{\text{48}}}}^{{\text{0}}}} \mathord{\left/ {\vphantom {{I_{{{\text{48}}}}^{{\text{0}}}} {{{I}_{{48}}}}}} \right. \kern-0em} {{{I}_{{48}}}}}{\text{(}}t{\text{)}}} \right)}}{{{{t}_{c}}}}\frac{{d_{R}^{{\text{2}}}}}{{{{c}_{{{{{\text{O}}}_{{\text{3}}}}}}}{{S}_{{spec}}}{{\rho }_{m}}{{d}_{r}}}},$Времязависимый захват N2O5 и O3 на сажевом покрытии, предварительно экспонированном к конкурентному газу-реагенту. На рис. 1 приведен временнóй профиль концентрации N2O5 при введении в реакционную зону стержня с сажевым покрытием, которое было предварительно экспонировано к озону. При периодическом введении стержня наблюдается воспроизводимый захват молекул N2O5 и воспроизводимая десорбция этих молекул после вывода стержня из зоны реакции. Воспроизводимость захвата при повторном введении стержня свидетельствует о механизме захвата через распад молекул на поверхностных центрах без изменения химической активности этих центров. В противном случае повторный захват на химически инертном покрытии был бы менее эффективен. Кроме того, временнóй профиль [N2O5] не может быть объяснен только адсорбцией, поскольку последняя происходит за характерное время достижения динамического равновесия в реакции
(R1)
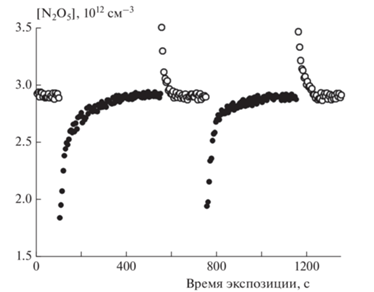
$\begin{gathered} {{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}\left( {\text{г}} \right) + {\text{z}}\left( {{\text{тв}}} \right)\underset{{{{k}_{d}}}}{\overset{{{{k}_{a}}}}{\longleftrightarrow}}{{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}} \ldots {\text{z}}\xrightarrow{{{{k}_{r}}}} \\ \xrightarrow{{\kern 1pt} }{\text{z}}\left( {{\text{тв}}} \right) + {\text{M}}\left( {\text{г}} \right). \\ \end{gathered} $Рис. 1.
Изменение концентрации реагента N2O5 в реакторе при введении в него подвижного стержня с покрытием из метановой сажи, предварительно экспонированном к озону. Условия захвата N2O5: [N2O5] = 2.9 · 1012 см–3, Т = 295 К, давление p = 2.3 Торр, ΔL = 10 см, средняя скорость потока гелия u = 147 см · с–1, масса навески сажи на единичную поверхность стержня ρm = 130 мкг · см–2. Полые символы – измеряемая концентрация N2O5 при периодическом удалении стержня с покрытием из зоны контакта; сплошные символы – концентрация N2O5 при введении стержня в зону реакции.
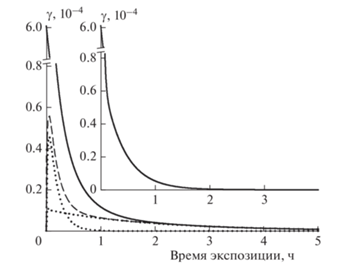
На сажевом покрытии, предварительно экспонированном к N2O5, наблюдается захват озона. В отличие от предыдущего случая захват происходит необратимо. На рис. 2 приведен пример временнóго профиля концентрации озона при периодическом введении в его поток экспонированного сажевого покрытия. Соответствующая временнáя зависимость коэффициента захвата γ(t) приведена на рис. 3. Для сравнения на этом же рисунке на вставке приведена аналогичная зависимость коэффициента захвата озона в этих же условиях на свежем сажевом покрытии. Формы временны́х профилей коэффициентов захвата подобны. На основании подобия профилей мы сделали вывод о подобии механизмов захвата и возможности аппроксимации временны́х зависимостей аналитической формулой:
(4)
$\gamma \left( t \right) = {{\gamma }_{r}}\exp \left( { - {{a}_{r}}t} \right) + {{\gamma }_{s}}\exp \left( { - {{a}_{s}}t} \right)\left[ {1 - \exp \left( {--{{a}_{r}}t} \right)} \right].$Рис. 2.
Изменение концентрации озона в реакторе при ведении в него подвижного стержня с покрытием из метановой сажи, предварительно экспонированном к реагенту N2O5. Условия захвата O3: [O3] = 2.6 · · 1012 см–3, Т = 295 К, давление p = 1.4 Торр, ΔL = 10 см, средняя скорость потока гелия u = 200 см · с–1, масса навески сажи на единичную поверхность стержня ρm = 130 мкг · см–2. Полые символы – измеряемая концентрация O3 в отсутствие стержня с покрытием; сплошные символы – концентрация O3 при введенном стержне в поток O3.
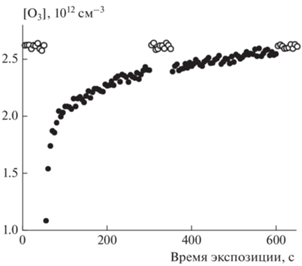
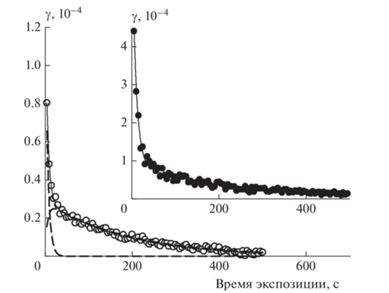
Рис. 3.
Временнáя зависимость коэффициента захвата О3 (полые символы), рассчитанная из данных рис. 2 по формуле (3); сплошная кривая – аппроксимация по формуле (4) с параметрами из табл. 1; штриховые кривые – вклады первой быстрой и последующей медленной стадий захвата. На вставке для сравнения – временнáя зависимость коэффициентa захвата О3 на свежем покрытии из метановой сажи в аналогичных условиях [18].
Эта формула следует из описания захвата газа-реагента по двухстадийному механизму реакции с адсорбированной молекулой на поверхности [18]. Здесь слагаемые в правой части формулы (4) представляют собой вклады в коэффициент захвата его быстрой (“rapid”) и медленной (“slow”) стадий. Параметры γr и γs определяют зависимость коэффициента захвата от концентрации газа-реагента, а параметры ar и as характеризуют их временнýю зависимость.
Зависимости коэффициента захвата озона на сажевом покрытии от времени экспозиции, подобные приведенным на рис. 3, были получены в диапазоне концентраций 1 · 1012−5 · 1013 см–3. Результаты аппроксимации этих зависимостей по формуле (4) приведены в табл. 1, а зависимости соответствующих параметров от концентрации озона – на рис. 4 и 5.
Таблица 1.
Параметры аппроксимации по формуле (4) коэффициента захвата γ(t) озона при Т = 295 К на покрытии из метановой сажи, предварительно экспонированной к реагенту N2O5
| [O3], 1012 см–3 | γr, 10−4 | ar, с−1 | γs, 10−5 | as, 10−2 с−1 |
|---|---|---|---|---|
| 1.1 | 1.32 ± 0.5 | 0.1 ± 0.05 | 3 ± 1.1 | 0.9 ± 0.5 |
| 2.6 | 1.4 ± 0.15 | 0.15 ± 0.02 | 2.9 ± 0.2 | 0.5 ± 0.1 |
| 3.4 | 1.2 ± 0.14 | 0.12 ± 0.02 | 2.3 ± 0.4 | 1.2 ± 0.3 |
| 5.7 | 0.94 ± 0.1 | 0.12 ± 0.02 | 1.7 ± 0.2 | 1 ± 0.2 |
| 6.9 | 1.05 ± 0.1 | 0.13 ± 0.02 | 2.6 ± 0.2 | 0.6 ± 0.2 |
| 9.2 | 0.63 ± 0.3 | 0.15 ± 0.05 | 2 ± 0.6 | 0.4 ± 0.2 |
| 11 | 0.81 ± 0.1 | 0.09 ±0.02 | 1.5 ± 0.3 | 0.7 ±0.3 |
| 11 | 0.71 ±0.07 | 0.13 ± 0.02 | 1.4 ± 0.1 | 0.5 ± 0.1 |
| 12 | 0.84 ± 0.1 | 0.16 ± 0.03 | 1.6 ± 0.3 | 1.8 ± 0.3 |
| 12 | 0.9 ± 0.15 | 0.18 ± 0.04 | 2 ± 0.3 | 1.4 ± 0.2 |
| 14 | 0.65 ± 0.08 | 0.15 ± 0.03 | 2.2 ± 0.4 | 0.2 ± 0.1 |
| 20 | 0.64 ± 0.09 | 0.17 ± 0.02 | 1.3 ± 0.2 | 0.8 ± 0.2 |
| 22 | 0.52 ± 0.06 | 0.12 ± 0.02 | 1 ± 0.1 | 0.8 ± 0.2 |
| 24 | 0.5 ± 0.08 | 0.14 ± 0.03 | 1.5 ± 0.6 | 1 ± 0.3 |
| 27 | 0.56 ± 0.17 | 0.23 ± 0.07 | 1.1 ± 0.1 | 1.3 ± 0.4 |
| 40 | 0.35 ± 0.07 | 0.23 ± 0.1 | 0.9 ± 0.2 | – |
| 49 | 0.33 ± 0.08 | 0.24 ±0.04 | 0.87 ± 0.2 | – |
Рис. 4.
Зависимость параметров γr и γs коэффициента времязависимого захвата O3 на покрытии из метановой сажи, предварительно экспонированном к N2O5, от [O3]: сплошные символы – γr, быстрая стадия захвата (масштаб 1 : 1); полые символы – γs, последующая медленная стадия (масштаб по вертикали 1 : 10). Сплошные прямые – аппроксимация по формуле (5) с параметрами γr,max, KL,r, γs,max, KL,s из табл. 2.

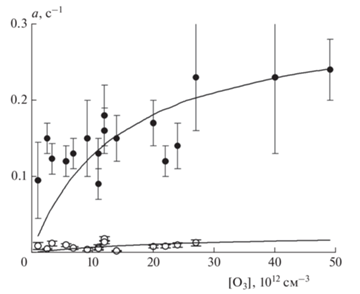
Рис. 5.
Зависимость параметров ar и as коэффициента времязависимого захвата O3 на покрытии из метановой сажи, предварительно экспонированном к N2O5, от [O3]: сплошные символы – ar, быстрая стадия захвата; полые символы – as, последующая медленная стадия. Сплошные кривые – аппроксимация по формуле (6) с параметрами kr, ks, KL,r и KL,s из табл. 2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Зависимости параметров γr и γs, а также ar и as от концентрации озона, приведенных на рис. 4 и 5, аналогичны по форме подобным зависимостям для захвата озона на свежем сажевом покрытии [18]. Такая форма зависимости соответствует механизму захвата посредством реакции на поверхности с адсорбированной частицей [23, 24]. Параметры, определяющие эту зависимость, представляют собой комбинацию элементарных констант, описывающих процесс захвата:
(5)
$\begin{gathered} {{\gamma }_{r}} = {{\gamma }_{r}}_{{,max}}/\left( {1 + {{K}_{L}}_{{,r}}\left[ {{{{\text{O}}}_{3}}} \right]} \right), \\ {{\gamma }_{s}} = {{\gamma }_{s}}_{{,max}}/\left( {1 + {{K}_{L}}_{{,s}}\left[ {{{{\text{O}}}_{3}}} \right]} \right), \\ \end{gathered} $(7)
$\theta = {{K}_{L}}\left[ {{{{\text{O}}}_{3}}} \right]/\left( {1 + {{K}_{L}}\left[ {{{{\text{O}}}_{3}}} \right]} \right),$Результаты аппроксимации зависимостей на рис. 4 и 5 по формулам (5)–(7) приведены в табл. 2. Здесь же приведены результаты аппроксимации данных, полученных ранее по захвату O3, N2O5 и NO2 на свежей сажевой поверхности, а также по захвату О3 на поверхности, предварительно экспонированной к NO2. На основании совокупности этих параметров возможно промоделировать процесс захвата озона в условиях конкурентной адсорбции O3/N2O5 и O3/NO2 с учетом дополнительного канала стока озона на продуктах захвата N2O5 и NO2.
Таблица 2.
Элементарные параметры, определяющие по формулам (5), (6) времязависимый коэффициент захвата O3, N2O5 и NO2 на покрытии из метановой сажи
| Адсорбат/адсорбент | Первая, быстрая стадия | Вторая, медленная стадия | ||||
|---|---|---|---|---|---|---|
| KL,r, 10−14 см3 | kr, c−1 | γr,max, 10−4 | KL,s, 10−14 см3 | ks, 10−2 c−1 | γs,max, 10−5 | |
| О3/свежая сажа [18] | 7 ± 1 | 0.39 ± 0.05 | 6.6 ± 0.4 | 11 ± 2 | 2.8 ± 0.1 | 13 ± 2 |
| N2O5/свежая сажа [20] | 0.66 ± 0.15 | 0.84 ± 0.05 | 0.55 ± 0.1 | 0.7 ± 0.4 | 10 ± 0.6 | 1.4 ± 0.1 |
| NO2/свежая сажа [19] | 5.7 ± 0.7 | 0.22 ± 0.02 | 1.6 ± 0.2 | 6.3 ± 1.7 | 2.6 ± 0.3 | 2.1 ± 0.3 |
| O3/сажа после обработки N2O5 | 6.9 ± 1 | 0.3 ± 0.02 | 1.4 ± 0.2 | 4.7 ± 1 | 2.5 ± 0.4 | 2.7 ± 0.3 |
| O3/сажа после обработки NO2 [19] | 3.5 ± 1 | 0.2 ± 0.06 | 1.5 ± 0.2 | 3.0 ± 0.8 | 2.0 ± 0.5 | 2.2 ± 0.5 |
Расход озона в условиях конкурентной адсорбции О3/NOx с учетом двухстадийности процесса захвата будет определяться совокупностью реакций:
(R2)
$\begin{gathered} {{{\text{O}}}_{3}}\left( {\text{г}} \right) + {{{\text{z}}}_{r}}\left( {{\text{тв}}} \right) \rightleftarrows {{{\text{O}}}_{3}} \ldots {{{\text{z}}}_{r}}\left( {{\text{тв}}} \right)\xrightarrow{{k_{{r{\text{,}}{{{\text{O}}}_{{\text{3}}}}}}^{{}}}} \\ \xrightarrow{{\kern 1pt} }{{{\text{z}}}_{s}}_{{,{{{\text{O}}}_{3}}}}\left( {{\text{тв}}} \right) + {{{\text{О}}}_{{\text{2}}}}\left( {\text{г}} \right), \\ \end{gathered} $(R3)
$\begin{gathered} {\text{N}}{{{\text{O}}}_{x}}\left( {\text{г}} \right) + {{{\text{z}}}_{r}}\left( {{\text{тв}}} \right) \rightleftarrows {\text{N}}{{{\text{O}}}_{x}} \ldots {{{\text{z}}}_{r}}\left( {{\text{тв}}} \right)\xrightarrow{{k_{{r{\text{,N}}{{{\text{O}}}_{x}}}}^{{}}}} \\ \xrightarrow{{\kern 1pt} }z_{{s,{\text{N}}{{{\text{O}}}_{x}}}}^{{m{\kern 1pt} od}}\left( {{\text{тв}}} \right) + {\text{Продукт}}\,1\left( {\text{г}} \right), \\ \end{gathered} $(R4)
$\begin{gathered} {{{\text{O}}}_{{\text{3}}}}\left( {\text{г}} \right) + {{{\text{z}}}_{s}}_{{,{{{\text{O}}}_{3}}}}\left( {{\text{тв}}} \right) \rightleftarrows {{{\text{O}}}_{3}} \ldots {{{\text{z}}}_{s}}_{{{\text{,}}{{{\text{O}}}_{{\text{3}}}}}}\left( {{\text{тв}}} \right)\xrightarrow{{k_{{s{\text{,}}{{{\text{O}}}_{{\text{3}}}}}}^{{}}}} \\ \xrightarrow{{\kern 1pt} }{{{\text{z}}}_{{fin}}}_{{,{{{\text{O}}}_{{\text{3}}}}}}\left( {{\text{тв}}} \right) + {{{\text{О}}}_{{\text{2}}}}\left( {\text{г}} \right), \\ \end{gathered} $(R5)
$\begin{gathered} {{{\text{O}}}_{{\text{3}}}}\left( {\text{г}} \right) + {\text{z}}_{{s,{{{\text{O}}}_{3}}}}^{{mod}}\left( {{\text{тв}}} \right) \rightleftarrows {{{\text{O}}}_{3}} \ldots {\text{z}}_{{s,{\text{N}}{{{\text{O}}}_{x}}}}^{{mod}}\left( {{\text{тв}}} \right)\xrightarrow{{k_{{r,{{{\text{O}}}_{{\text{3}}}}}}^{{mod}}}} \\ \xrightarrow{{\kern 1pt} }{\text{z}}_{{s,{{{\text{O}}}_{3}}}}^{{mod}}\left( {{\text{тв}}} \right) + {{{\text{О}}}_{2}}\left( {\text{г}} \right), \\ \end{gathered} $(R6)
$\begin{gathered} {{{\text{O}}}_{{\text{3}}}}\left( {\text{г}} \right) + {\text{z}}_{{s,{{{\text{O}}}_{3}}}}^{{mod}}\left( {{\text{тв}}} \right) \rightleftarrows {{{\text{O}}}_{3}} \ldots {\text{z}}_{{s,{{{\text{O}}}_{3}}}}^{{mod}}\left( {{\text{тв}}} \right)\xrightarrow{{k_{{s,{{{\text{O}}}_{{\text{3}}}}}}^{{mod}}}} \\ \xrightarrow{{\kern 1pt} }{\text{z}}_{{fin,{{{\text{O}}}_{3}}}}^{{mod}}\left( {{\text{тв}}} \right) + {{{\text{О}}}_{2}}\left( {\text{г}} \right), \\ \end{gathered} $(R7)
$\begin{gathered} {\text{N}}{{{\text{O}}}_{x}}\left( {\text{г}} \right) + {\text{z}}_{{s,{\text{N}}{{{\text{O}}}_{x}}}}^{{m{\kern 1pt} od}}\left( {{\text{тв}}} \right) \rightleftarrows \\ \rightleftarrows {\text{N}}{{{\text{O}}}_{x}} \ldots {\text{z}}_{{s,{\text{N}}{{{\text{O}}}_{x}}}}^{{m{\kern 1pt} od}}\left( {{\text{тв}}} \right)\xrightarrow{{k_{{s{\text{,N}}{{{\text{O}}}_{x}}}}^{{}}}} \\ \xrightarrow{{\kern 1pt} }z_{{fin,{\text{N}}{{{\text{O}}}_{x}}}}^{{m{\kern 1pt} od}} + {\text{Продукт}}\,2\left( {\text{г}} \right), \\ \end{gathered} $(R8)
$\begin{gathered} {{{\text{O}}}_{3}}\left( {\text{г}} \right) + {\text{z}}_{{fin,{\text{N}}{{{\text{O}}}_{x}}}}^{{m{\kern 1pt} od}}\left( {{\text{тв}}} \right) \rightleftarrows \\ \rightleftarrows {{{\text{O}}}_{3}} \ldots {\text{z}}_{{fin,{\text{N}}{{{\text{O}}}_{x}}}}^{{m{\kern 1pt} od}}\left( {{\text{тв}}} \right)\xrightarrow{{k_{{r,{{{\text{O}}}_{3}}}}^{{m{\kern 1pt} od}}}} \\ \xrightarrow{{\kern 1pt} }{\text{z}}_{{s,{{{\text{O}}}_{3}}{\text{,N}}{{{\text{O}}}_{x}}}}^{{m{\kern 1pt} od}}\left( {{\text{тв}}} \right) + {{{\text{O}}}_{2}}\left( {\text{г}} \right), \\ \end{gathered} $(R9)
$\begin{gathered} {{{\text{O}}}_{3}}\left( {\text{г}} \right) + {\text{z}}_{{s,{{{\text{O}}}_{3}},{\text{N}}{{{\text{O}}}_{x}}}}^{{m{\kern 1pt} od}}\left( {{\text{тв}}} \right) \rightleftarrows \\ \rightleftarrows {{{\text{O}}}_{3}} \ldots {\text{z}}_{{s,{{{\text{O}}}_{3}},{\text{N}}{{{\text{O}}}_{x}}}}^{{m{\kern 1pt} od}}\left( {{\text{тв}}} \right)\xrightarrow{{k_{{s,{{{\text{O}}}_{3}}}}^{{m{\kern 1pt} od}}}} \\ \xrightarrow{{\kern 1pt} }{\text{z}}_{{fin,{{{\text{O}}}_{3}}{\text{,N}}{{{\text{O}}}_{x}}}}^{{m{\kern 1pt} od}}\left( {{\text{тв}}} \right) + {{{\text{O}}}_{2}}\left( {\text{г}} \right). \\ \end{gathered} $Расход озона из газовой фазы определяется его захватом на поверхности:
(8)
$\begin{gathered} {{\gamma }_{{{{{\text{O}}}_{3}}}}}(t) = 4[{{J}_{{{\text{R2}}}}}(t) + {{J}_{{{\text{R4}}}}}(t) + {{J}_{{{\text{R5}}}}}(t) + \\ + \,\,{{J}_{{{\text{R}}6}}}(t) + {{J}_{{{\text{R}}8}}}(t) + {{J}_{{{\text{R}}9}}}(t)]/{{c}_{{{{{\text{O}}}_{{\text{3}}}}}}}[{{{\text{O}}}_{3}}].~~~~~ \\ \end{gathered} $Реакционные потоки JR2(t) и JR4(t) представляют собой сток озона в реакциях (R2) и (R4) по механизму мономолекулярного распада соответствующего поверхностного комплекса:
(9)
$\begin{gathered} {{J}_{{{\text{R2}}}}}\left( t \right) = {{k}_{{r,{{{\text{O}}}_{3}}}}}{{\theta }_{{r,{{{\text{O}}}_{3}}}}}\left[ {{{{\text{z}}}_{r}}\left( t \right)} \right], \\ {{J}_{{{\text{R}}4}}}\left( t \right) = {{k}_{{s,{{{\text{O}}}_{3}}}}}{{\theta }_{{s,{{{\text{O}}}_{3}}}}}\left[ {{{{\text{z}}}_{{s,{{{\text{O}}}_{3}}}}}\left( t \right)} \right], \\ \end{gathered} $Реакционные потоки JR5(t), JR6(t), JR8(t), JR9(t) ответственны за дополнительный сток озона в соответствующих реакциях на гетерогенных продуктах захвата конкурирующего газа-реагента. При этом канал стока по реакциям (R5) и (R8) представляет собой быструю стадию захвата, а канал стока по реакциям (R6) и (R9) – повторную медленную стадию захвата озона на тех же центрах адсорбции:
(10)
$\begin{gathered} {{J}_{{{\text{R5}}}}}\left( t \right) = k_{{r,{{{\text{O}}}_{{\text{3}}}}}}^{{mod}}\theta _{{r,{{{\text{O}}}_{{\text{3}}}}}}^{{mod}}\left[ {{\text{z}}_{{s,{\text{N}}{{{\text{O}}}_{x}}}}^{{mod}}\left( t \right)} \right], \\ {{J}_{{{\text{R6}}}}}\left( t \right) = k_{{s,{{{\text{O}}}_{{\text{3}}}}}}^{{mod}}\theta _{{s,{{{\text{O}}}_{{\text{3}}}}}}^{{mod}}\left[ {{\text{z}}_{{s,{{{\text{O}}}_{{\text{3}}}}}}^{{mod}}\left( t \right)} \right], \\ {{J}_{{{\text{R8}}}}}\left( t \right) = k_{{r,{{{\text{O}}}_{{\text{3}}}}}}^{{mod}}\theta _{{r,{{{\text{O}}}_{{\text{3}}}}}}^{{mod}}\left[ {{\text{z}}_{{fin,{\text{NO}}x}}^{{mod}}\left( t \right)} \right], \\ {{J}_{{{\text{R9}}}}}\left( t \right) = k_{{s,{{{\text{O}}}_{{\text{3}}}}}}^{{mod}}\theta _{{s,{{{\text{O}}}_{{\text{3}}}}}}^{{mod}}\left[ {{\text{z}}_{{s,{{{\text{O}}}_{{\text{3}}}},{\text{N}}{{{\text{O}}}_{x}}}}^{{mod}}\left( t \right)} \right]. \\ \end{gathered} $Реакционные потоки зависят от поверхностной плотности [zi(t)] этих центров. Поверхностная плотность последних определяется из решения системы дифференциальных уравнений, описывающих их временнýю эволюцию:
[zr(t = 0)] = [z0], [${{{\text{z}}}_{{s,{{{\text{O}}}_{3}}}}}$(t = 0)] = [${\text{z}}_{{s,{\text{N}}{{{\text{O}}}_{x}}}}^{{mod}}$(t = 0)] = = [${\text{z}}_{{s,{{{\text{O}}}_{3}}}}^{{mod}}$(t = 0)] = [${\text{z}}_{{fin,{\text{N}}{{{\text{O}}}_{x}}}}^{{mod}}$(t = 0)] = [${\text{z}}_{{s,{{{\text{O}}}_{3}},{\text{N}}{{{\text{O}}}_{x}}}}^{{mod}}$(t = 0)] = 0.
Здесь [z0] – максимальная поверхностная плотность активных центров для данного типа поверхности.
После решения этой системы уравнений и подстановки полученных значений [zi(t)] в выражение (8) мы получаем явный вид коэффициента захвата озона для всей совокупности центров адсорбции. Коэффициент захвата γ(t) озона без учета его захвата на гетерогенных продуктах реакции конкурирующего реагента выражается формулой (4) с параметрами
Пример моделирования величины времязависимого коэффициента захвата озона в условиях конкурентной адсорбции O3/NO2 приведен на рис. 6. Зависимость соответствует соотношению среднемесячных концентраций этих газов-реагентов, измеренных в нижней тропосфере промышленно развитого региона в зимнее время, когда концентрация озона минимальна [8]. Как видно из рис. 6, учет дополнительного канала стока озона увеличивает время переработки сажевого субстрата. Интегральный вклад этого канала для условий, указанных в подписи к рис. 6, составляет 68% от основного канала стока по реакциям (R2) и (R4). При типичных летних среднемесячных концентрациях, 36 ppb O3 и 17 ppb NO2, измеренных в том же регионе, вклад дополнительных каналов стока озона будет составлять около 20%.
Рис. 6.
Временнáя зависимость коэффициента захват О3 на покрытии из метановой сажи, смоделированная для условий конкурентной адсорбции O3 и NO2 при их типичных концентрациях в тропосфере: [O3] = 10 ppb, [NO2] = 17 ppb. Сплошная кривая – суммарный коэффициент захвата γ(t) с учетом конкурентной адсорбции; штриховая кривая – вклад, обусловленный захватом О3 только на центрах ${{{\text{z}}}_{{s,{\text{N}}{{{\text{O}}}_{2}}}}},$ образующихся в ходе захвата конкурирующего агента NO2; точечные кривые – вклады в последний из первичной и вторичной стадий захвата О3 на этих центрах. На вставке – временная зависимость коэффициента захвата О3 без учета его захвата на центрах ${{{\text{z}}}_{{s,{\text{N}}{{{\text{O}}}_{2}}}}}.$
При среднемесячной концентрации NO2 17 ppb равновесие NO3 + NO2 ↔ N2O5 смещается вправо. При этом [N2O5]/[NO3] ≈ 20, т.е. концентрация N2O5 по сравнению с NO3 максимальна и составляет ∼4 ppb [4]. Даже при этой максимальной концентрации N2O5 и минимальном среднемесячном значении в 10 ppb [O3] дополнительный канал стока озона в условиях конкурентной адсорбции [O3]/[N2O5] оказывается равным всего 3.6%. Основной причиной такого малого влияния реагента N2O5 является малая доля поверхности, занятая его адсорбированными молекулами. При малых концентрациях N2O5 эта доля, ${{\theta }_{{{{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}},$ просто равна ${{K}_{{L,{{{\text{N}}}_{2}}{{{\text{O}}}_{5}}}}}$[N2O5], исходя из ее определения по формуле (П.1). Из табл. 2 видно, что ${{K}_{{L,{{{\text{N}}}_{2}}{{{\text{O}}}_{5}}}}}$ на порядок меньше аналогичных параметров для других газов-реагентов.
ЗАКЛЮЧЕНИЕ
Захват химически активного газа на поверхности обусловлен химической реакцией с участием его адсорбированных молекул. Доля поверхности, занятая адсорбированными молекулами, в условиях конкурентной адсорбции в ленгмюровском представлении определяется ниже формулами (П.1). В условиях тропосферы при малых концентрациях O3 и NOx, т.е. при ${{K}_{{L,{{{\text{O}}}_{3}}}}}$[O3] $ \ll $ 1 и ${{K}_{{L,{\text{N}}{{{\text{O}}}_{x}}}}}$[NOx] $ \ll $ 1, эта доля равна ${{K}_{{L,{{{\text{O}}}_{3}}}}}$[O3] и не зависит от присутствия конкурирующего газа-реагента.
В действительности оказывается, что в результате захвата конкурирующего газа-реагента образуется химически активная поверхность, на которой также возможен захват озона. Таким образом, существует дополнительный канал его стока, который ранее не учитывался. С целью количественной оценки вклада этого канала был исследован захват озона на поверхности сажи, предварительно обработанной реагентом N2O5 до полного прекращения захвата последнего. Установлен механизм захвата и получен ряд элементарных параметров, позволяющих моделировать величину коэффициент захвата при произвольных концентрациях озона.
На базе ленгмюровского представления адсорбции предложено модельное описание захвата на сажевом покрытии в условиях конкурентной адсорбции O3/NOx, NOx = NO2 и N2O5, с учетом многостадийности процесса захвата. На основании разработанной модели и элементарных параметров, описывающих захват О3, NO2 и N2O5 на свежем сажевом покрытии, а также захват озона на поверхности, предварительно обработанной NO2 или N2O5, проведены численные оценки дополнительных каналов захвата озона для двух реальных тропосферных сценариев соотношения концентраций O3/NO2 и O3/N2O5. В нижней тропосфере промышленно развитого региона в зимнее время, когда концентрация озона минимальна (10 ppb O3, 17 ppb NO2 и 4 ppb N2O5), дополнительный интегральный вклад в захват O3 на продуктах реакции NO2 составляет 68%, а в случае N2O5 – 3.6%. Для того же региона летом при максимальной концентрации озона (36 ppb O3, 17 ppb NO2 и 4 ppb N2O5) аналогичные вклады будут составлять 20% и 1% соответственно. Полученные оценки показывают, что для ряда сценариев дополнительный канал стока, который ранее не учитывался, может быть существенным.
ПРИЛОЖЕНИЕ 1
Доли поверхности, занятые адсорбированными молекулами озона и NOx, в условиях их конкурентной адсорбции выражаются формулами
(П.1)
$\begin{gathered} {{\theta }_{r}}{{_{,}}_{{\text{O}}}}_{{_{3}}} = \\ = {{K}_{L}}{{_{,}}_{r}}{{_{,}}_{{\text{O}}}}_{{_{3}}}[{{{\text{O}}}_{3}}]{\text{ }}/(1 + {{K}_{L}}{{_{,}}_{r}}{{_{,}}_{{\text{O}}}}_{{_{3}}}[{{{\text{O}}}_{3}}] + {{K}_{L}}{{_{,}}_{r}}{{_{,}}_{{{\text{N}}{{{\text{O}}}_{x}}}}}[{\text{N}}{{{\text{O}}}_{x}}]), \\ {{\theta }_{{s,{{{\text{O}}}_{3}}}}} = \\ = {{K}_{{L,s,{{{\text{O}}}_{3}}}}}\left[ {{{{\text{O}}}_{3}}} \right]/\left( {1 + {{K}_{{L,s,{{{\text{O}}}_{3}}}}}\left[ {{{{\text{O}}}_{3}}} \right] + {{K}_{{L,s,{\text{N}}{{{\text{O}}}_{x}}}}}\left[ {{\text{N}}{{{\text{O}}}_{x}}} \right]~} \right), \\ \theta _{{r,{{{\text{O}}}_{3}}}}^{{mod}} = \\ = {{K_{{L,r,{{{\text{O}}}_{3}}}}^{{mod}}\left[ {{{{\text{O}}}_{3}}} \right]} \mathord{\left/ {\vphantom {{K_{{L,r,{{{\text{O}}}_{3}}}}^{{mod}}\left[ {{{{\text{O}}}_{3}}} \right]} {\left( {1 + K_{{L,r,{{{\text{O}}}_{3}}}}^{{mod}}\left[ {{{{\text{O}}}_{3}}} \right] + {{K}_{{L,s,{\text{N}}{{{\text{O}}}_{x}}}}}\left[ {{\text{N}}{{{\text{O}}}_{x}}} \right]} \right)}}} \right. \kern-0em} {\left( {1 + K_{{L,r,{{{\text{O}}}_{3}}}}^{{mod}}\left[ {{{{\text{O}}}_{3}}} \right] + {{K}_{{L,s,{\text{N}}{{{\text{O}}}_{x}}}}}\left[ {{\text{N}}{{{\text{O}}}_{x}}} \right]} \right)}}, \\ \theta _{{s,{{{\text{O}}}_{3}}}}^{{mod}} = \\ = {{K_{{L,s,{{{\text{O}}}_{3}}}}^{{mod}}\left[ {{{{\text{O}}}_{3}}} \right]} \mathord{\left/ {\vphantom {{K_{{L,s,{{{\text{O}}}_{3}}}}^{{mod}}\left[ {{{{\text{O}}}_{3}}} \right]} {\left( {1 + K_{{L,s,{{{\text{O}}}_{3}}}}^{{mod}}\left[ {{{{\text{O}}}_{3}}} \right] + {{K}_{{L,s,{\text{N}}{{{\text{O}}}_{x}}}}}\left[ {{\text{N}}{{{\text{O}}}_{x}}} \right]} \right)}}} \right. \kern-0em} {\left( {1 + K_{{L,s,{{{\text{O}}}_{3}}}}^{{mod}}\left[ {{{{\text{O}}}_{3}}} \right] + {{K}_{{L,s,{\text{N}}{{{\text{O}}}_{x}}}}}\left[ {{\text{N}}{{{\text{O}}}_{x}}} \right]} \right)}}, \\ {{\theta }_{{r,{\text{N}}{{{\text{O}}}_{x}}}}} = {{K}_{{L,r,{\text{N}}{{{\text{O}}}_{x}}}}}\left[ {{\text{N}}{{{\text{O}}}_{x}}} \right]/(1\, + \,{{K}_{{L,r,{{{\text{O}}}_{3}}}}}\left[ {{{{\text{O}}}_{3}}} \right] + \\ + \,\,{{K}_{{L,r,{\text{N}}{{{\text{O}}}_{x}}}}}\left[ {{\text{N}}{{{\text{O}}}_{x}}} \right]~), \\ \theta _{{s,{\text{N}}{{{\text{O}}}_{x}}}}^{{mod}} = {{{{K}_{{L,s,{\text{N}}{{{\text{O}}}_{x}}}}}\left[ {{\text{N}}{{{\text{O}}}_{x}}} \right]} \mathord{\left/ {\vphantom {{{{K}_{{L,s,{\text{N}}{{{\text{O}}}_{x}}}}}\left[ {{\text{N}}{{{\text{O}}}_{x}}} \right]} {(1\, + \,K_{{L,s,{{{\text{O}}}_{3}}}}^{{mod}}\left[ {{{{\text{O}}}_{3}}} \right] + }}} \right. \kern-0em} {(1\, + \,K_{{L,s,{{{\text{O}}}_{3}}}}^{{mod}}\left[ {{{{\text{O}}}_{3}}} \right] + }} \\ + \,\,{{K}_{{L,s,{\text{N}}{{{\text{O}}}_{x}}}}}\left[ {{\text{N}}{{{\text{O}}}_{x}}} \right]). \\ \end{gathered} $ПРИЛОЖЕНИЕ 2
Явный вид вкладов в коэффициент захвата озона на сажевом покрытии в условиях конкурентной адсорбции O3/NOx на продуктах реакции конкурирующего газа-реагента определяется выражениями
Работа выполнена в рамках госзадания FFZE-2022-0008 (регистрационный номер 1021051302551-2-1.3.1;1.4.7;1.6.19).
Список литературы
McDuffie E.E., Fibiger D.L., Dubé W.P. et al. // J. Geophys. Res. Atmos. 2018. V. 123. P. 4345; https://doi.org/10.1002/2018JD028336
Ларин И.К. // Хим. физика. 2019. Т. 38. № 5. С. 81; https://doi.org/10.1134/S0207401X1905008X
Ларин И.К., Алоян А.Е., Ермаков А.Н. // Хим. физика. 2021. Т. 40. № 5. С. 86; https://doi.org/10.31857/S0207401X21050095
Chang W.L., Bhave P.V., Brown S.S. et al. // Aerosol Sci. Technol. 2011. V. 45. P. 665; https://doi.org/10.1080/02786826.2010.551672
Jaeglé L., Shah V., Thornton J.A. et al. // J. Geophys. Res. Atmos. 2018. V. 123. P. 12368; https://doi.org/10.1029/2018JD029133
Washenfelder R.A., Wagner N.L., Dubé W.P, Brown S.S. // Environ. Sci. Technol. 2011. V. 45. P. 2938; https://doi.org/10.1021/es10334u
Liu Z., Doherty R.M., Wild O. et al. // Atmos. Chem. Phys. 2022. V. 22. P. 1209; https://doi.org/10.5194/acp-22-1209-2022
Roberts-Semple D., Song F., Gao Yu. // Atmos. Pollut. Res. 2012. V. 3. P. 247; www.atmospolres.com
Wagner N.L., Riedel T.P., Young C.J. et al. // J. Geophys. Res. 2013. V. 118D. P. 9331; https://doi.org/10.1002/jgrd.50653
Berner A., Sidla S., Galambos Z. et al. // J. Geophys. Res. Atmosph. 1996. V. 101. P. 19559; https://doi.org/10.1029/95JD03425
Pohl K., Cantwell M., Herckes P., Lohmann R. // Atmos. Chem. Phys. 2014. V. 14. P. 7431; https://doi.org/10.5194/acp-14-7431-2014,2014
Bond T.C., Streets D.G., Yarber K.F. et al. // J. Geophys. Res. 2004. V. 109. D14203; https://doi.org/10.1029/2003JD003697
Wang R., Tao S., Shen H. et al. // Environ. Sci. Technol. 2014. V. 48. P. 6780; https://doi.org/10.1021/es5021422
Klimont Z., Kupiainen K., Heyes C. et al. // Atmos. Chem. Phys. 2017. V. 17. P. 8681; https://doi.org/10.5194/acp-8681-2017
Burkholder J.B., Sander S.P., Abbatt J.P.D. et al. “Chemical Kinetics and Photochemical Data for Use in Atmospheric Studies, Evaluation No 19”. NASA JPL Publication 19-5. Pasadena, 2019; http://jpldataeval.jpl.nasa.gov
Kamm S., Möhler O., Naumann K-H. et al. // Atmos. Environ. 1999. V. 33 P. 4651.
Chughtai A.R., Kim J.M., Smith D.M. // J. Atmos. Chem. 2003. V. 45. P. 231; https://doi.org/10.1023/A:1024250505886
Зеленов В.В., Апарина Е.В. // Хим. физика 2021. Т. 40. № 5. С. 55; https://doi.org/10.31857/S0207401X21050149
Зеленов В.В., Апарина Е.В. // Хим. физика 2021. Т. 40. № 10. С. 76; https://doi.org/10.31857/S0207401X21100137
Зеленов В.В., Апарина Е.В. // Хим. физика 2022. Т. 41. № 12. С. 81; https://doi.org/10.31857/S0207401X22120111
Karagulian F., Rossi M.J. // J. Phys. Chem. A. 2007. V. 111. P. 1914; https://doi.org/10.1021/jp0670891
Moise T., Rudich Y. // J. Geophys. Res. 2000. V. 105D. P. 14667; doi: 0148-0227/00/2000JD900071
Ammann M., Pöschl U., Rudich Y. // Phys. Chem. Chem. Phys. 2003. V. 5. P. 351; https://doi.org/10.1039/b208708a
Pöschl U., Rudich Y., Ammann M. // Atmos. Chem. Phys. 2007. V. 7. P. 5989; www.atmos-chem-phys.net/7/5989/2007/
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


