Химическая физика, 2023, T. 42, № 1, стр. 64-72
Взаимодействие наночастиц золота с цианиновыми красителями в холестерических субмикрочастицах ДНК. Влияние способа их введения в систему
М. А. Колыванова 1, 2, М. А. Климович 1, 2, О. В. Дементьева 3, В. М. Рудой 3, В. А. Кузьмин 1, А. В. Трофимов 1, В. Н. Морозов 1, *
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Федеральный медицинский биофизический центр им. А.И. Бурназяна
Федерального медико-биологического агентства России
Москва, Россия
3 Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
Москва, Россия
* E-mail: morozov.v.n@mail.ru
Поступила в редакцию 12.11.2021
После доработки 17.05.2022
Принята к публикации 20.05.2022
- EDN: MOYPZC
- DOI: 10.31857/S0207401X23010065
Аннотация
Сопоставлены результаты, полученные при двух разных способах введения цианиновых красителей SYBR Green I (SG) и PicoGreen (PG), а также ультрамалых наночастиц золота (НЧЗ) в холестерическую жидкокристаллическую дисперсию (ХЖКД) ДНК: путем предварительной инкубации с ДНК и введения в готовую дисперсную систему. В отсутствие красителей и в присутствии SG предварительная инкубация НЧЗ в растворе ДНК приводила к усилению разрушения ее холестерической фазы. В то же время более эффективное тушение флуоресценции SG наблюдалось при введении НЧЗ в готовую дисперсную систему. Для случая PG порядок введения компонентов не влиял ни на свойства ХЖКД ДНК, ни на флуоресценцию красителя.
ВВЕДЕНИЕ
Дезоксирибонуклеиновая кислота (ДНК) не только играет важную биологическую роль, но также может выступать в качестве “строительного материала” для создания наноразмерных объектов [1, 2]. Одним из примеров такого молекулярного конструирования является Ψ(psi)-конденсация (psi – polymer- and salt-induced [3]): в присутствии нейтрального полимера и сильного электролита молекулы ДНК способны к самоорганизации и образованию частиц с упорядоченной внутренней структурой. В литературе такие системы получили название жидкокристаллических дисперсий (ЖКД) ДНК [4]. Наиболее интересны среди них дисперсии с холестерической организацией частиц (в дальнейшем будем называть их ХЖКД ДНК): они выделяются высокой оптической активностью и способны инкорпорировать самые разные функциональные агенты (ионы металлов, наночастицы (НЧ), молекулы красителей и т.д.). Эти свойства делают ХЖКД ДНК перспективными для практического применения, например в качестве оптических датчиков для обнаружения биологически активных соединений [5] или платформы для нейтрон-захватной терапии [6].
Весьма многообещающим представляется создание на основе ХЖКД ДНК сенсорных систем с использованием флуорофоров и НЧ: первые интересны в качестве маркеров [7–9], а вторые способны как усиливать, так и тушить их сигнал [10]. Однако взаимодействие НЧ с красителями в ЖКД ДНК, а также влияние их комплексов на свойства субстрата практически не исследованы. Некоторые аспекты влияния НЧ золота (НЧЗ) на флуоресцентные свойства красителей в системах с различной упаковкой ДНК были рассмотрены нами ранее [11, 12]. В частности, показано, что НЧЗ могут нарушать пространственную организацию молекул ДНК в частицах ХЖКД, а красители способны усиливать их деструктивное действие [13]. Воздействие НЧЗ также может быть значительно усилено в результате их инкубации с ДНК перед формированием дисперсии [14]. Поскольку о действии красителей в этом случае ничего не известно, целью настоящей работы было исследование свойств ХЖКД ДНК, полученных при двух различных способах инкорпорирования НЧЗ и красителей: путем предварительной инкубации с ДНК в ее молекулярном растворе и введения этих компонентов в готовую дисперсную систему.
МАТЕРИАЛЫ И МЕТОДЫ
Для приготовления ХЖКД ДНК использовали коммерческие препараты выделенной из молок осетровых рыб и деполимеризованной ультразвуком ДНК марки Деринат® с молекулярной массой (0.25÷0.5) · 106 Да (Техномедсервис, Россия) и полиэтиленгликоля (ПЭГ) с молекулярной массой 4000 Да (Biochem Chemopharma, Франция). Их растворы готовили на основе водно-солевого буфера, содержащего 10–2 М NaH2PO4 и 0.3 M NaCl (pH ≈ 7.4), и смешивали друг с другом с таким расчетом, чтобы концентрация этих веществ в конечной системе составляла 1.2 · 10–4 М (ДНК) и 170 мг/мл (ПЭГ). Концентрацию ДНК определяли спектрофотометрически, пользуясь значением коэффициента экстинкции ε260 ≈ 6600 М–1 см–1. Полученную смесь интенсивно перемешивали и в соответствии с известными данными о кинетике “созревания” ХЖКД ДНК [15] выдерживали не менее 90 мин при комнатной температуре. Об образовании ХЖКД ДНК свидетельствовало появление интенсивной отрицательной полосы в спектре кругового дихроизма (КД) в области длин волн λ = 270–280 нм.
Обработку ХЖКД ДНК проводили исследованными ранее [12, 13] цианиновыми красителями SYBR Green I (SG) и PicoGreen (PG) (10000- и 200-кратные растворы препаратов в ДМСО) производства компании Lumiprobe (США). Их концентрацию определяли спектрофотометрически, пользуясь известными значениями коэффициентов экстинкции: ε494 ≈ 73 000 М–1 · см–1 (SG) и ε500 ≈ 70 000 М–1 · см–1 (PG) [16]. Процедура синтеза сферических НЧЗ, средний размер которых непосредственно после получения составлял ≈2.5 нм, а также анализ их характеристик детально описаны в наших предыдущих работах [11, 12]. В настоящем исследовании были использованы свежеприготовленные НЧЗ, для которых не характерно явление плазмонного резонанса [17].
Использовали два различных способа введения исследуемых агентов в ХЖКД ДНК: 1) раствор ДНК в течение 10–15 мин инкубировали с красителем, затем вносили НЧЗ и выдерживали систему при комнатной температуре в течение 30–40 мин, после чего добавляли раствор ПЭГ; 2) краситель и НЧЗ вносили по очереди в предварительно приготовленную ХЖКД с соблюдением тех же времен инкубации, что и в первом способе. Оба способа введения компонентов схематично представлены на рис. 1.
Рис. 1.
Схематичное представление исследуемых способов внесения красителей и НЧЗ в ХЖКД ДНК: а – предварительная инкубация с ДНК, б – внесение компонентов в готовую дисперсную систему.

Измерения концентрации ДНК и красителей проводили с помощью спектрофотометра UV-3101 PC компании Shimadzu (Japan). Флуоресценцию регистрировали на спектрофлуориметре Флюорат-02-Панорама производства компании Люмэкс (Россия) при следующих параметрах настройки прибора: длина волны возбуждения – 498 нм, область регистрации – 510–620 нм, шаг – 2 нм. Абсорбционные и флуоресцентные измерения проводили в кварцевых кюветах размером 1.0 × 0.4 см. Спектры КД регистрировали с помощью дихрометра СКД-2, изготовленного в лаборатории лазерно-спектрального приборостроения Института спектроскопии РАН [18] с использованием кварцевых кювет размером 1.0 × 1.0 см. Спектры КД представляли в виде зависимости разницы поглощения лево- и правополяризованного света ${{\Delta }}A = {{A}_{L}}--{{A}_{R}}$ от длины волны λ. Нагрев и охлаждение образцов проводили в термостатируемом кюветном отделении дихрометра. Температуру регулировали в диапазоне 20–80 °C. Перед каждым измерением образцы выдерживали в кюветном отделении в течение 5–10 мин с целью их равномерного нагрева/охлаждения.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
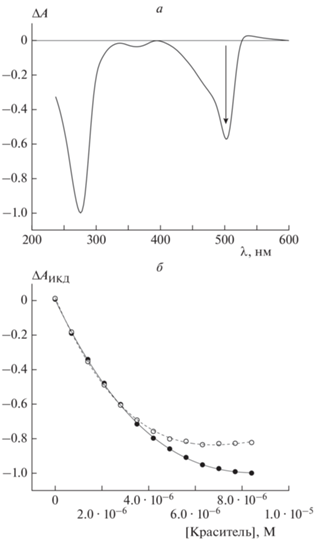
Цианиновые красители SG и PG имеют сходную структуру и спектральные свойства, но разный заряд: +2 (SG) против +3 (PG). В свободном состоянии они не проявляют оптической активности, однако связывание с ДНК в частицах ее ХЖКД приводит к возникновению индуцированного КД (ИКД) – появлению на КД-спектре отрицательных полос, повторяющих по форме их спектры поглощения [13]. В качестве примера КД-спектр ХЖКД ДНК, содержащей 4.90 · 10–6 М PG, показан на рис. 2а. На рис. 2б представлены зависимости амплитуды сигналов ИКД от концентрации красителей. Видно, что на начальном этапе ход кривых практически идентичен, однако зависимость для PG раньше выходит на плато, что может быть обусловлено бóльшим размером его сайта связывания в молекуле ДНК по сравнению с сайтом связывания SG: 4 пары оснований (13.6 Å) против 3.4 пар оснований (11.5 Å) [19]. Кроме того, в исследованном диапазоне концентраций сигнал ИКД PG был до ≈1.2 раз менее интенсивным.
Рис. 2.
а – КД-спектр ХЖКД ДНК в присутствии 4.90 · 10–6 М красителя PG, нормированный на величину сигнала на длине волны λ = 275 нм; б – зависимость интенсивности сигнала ИКД, нормированной на минимальное значение амплитуды индуцированной полосы, от концентрации красителей SG (⚫) и PG (⚪). Стандартные отклонения, рассчитанные по трем независимым измерениям, не превышали 5%.
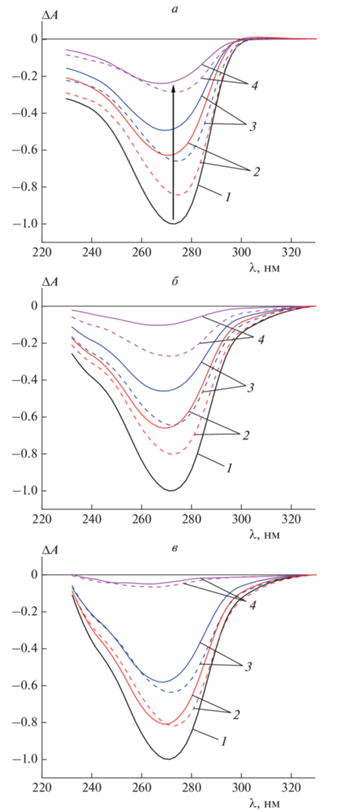
На рис. 3 представлены нормированные спектры КД трех систем, обработанных НЧЗ: ХЖКД ДНК в отсутствие красителей (рис. 3а) и в присутствии SG или PG в концентрации 7.00 · 10–6 М (рис. 3б и 3в). Компоненты вносили двумя указанными выше способами: до или после формирования дисперсии (сплошные и штриховые кривые соответственно). Сигнал КД неизменно убывал по мере увеличения концентрации НЧЗ, однако существенно более сильное его падение наблюдалось в присутствии красителей. В случае предварительной инкубации НЧЗ с ДНК уменьшение амплитуды КД-сигнала относительно необработанной красителями системы было до ≈2.1 раз больше в присутствии SG (ср. сплошные кривые 4 на рис. 3а и б) и до ≈4.6 раз больше в присутствии PG (ср. сплошные кривые 4 на рис. 3а и в). При внесении НЧЗ в готовую ХЖКД ДНК соответствующие различия составляли до ≈1.1 (SG) и до ≈4.3 (PG) раз.
Рис. 3.
Нормированные спектры КД трех систем, обработанных НЧЗ: ХЖКД ДНК в отсутствие красителей (а) и в присутствии 7.00 · 10–6 М SG (б) или PG (в). Красители и НЧЗ вносили в систему до или после формирования ХЖКД (сплошные и штриховые кривые соответственно). Концентрация НЧЗ составляла 0 (1), 2.27 · 10–8 (2), 4.46 · 10–8 (3) и 10.55 · 10–8 М (4).
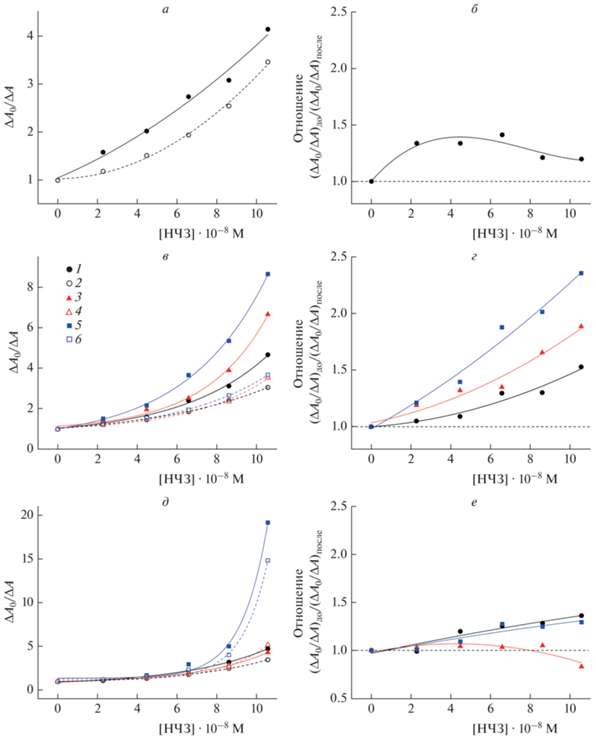
На рис. 4 приведены данные, позволяющие сравнить степень разрушения холестерической фазы ДНК при двух разных способах введения (0÷10.55) · 10–8 М НЧЗ в ХЖКД: в отсутствие и в присутствии красителей SG и PG. Результаты выражены в виде отношения ΔA0/ΔA (ΔA0 и ΔA – значения амплитуды сигнала КД на длине волны λ = 275 нм в отсутствие и в присутствии НЧЗ; рис. 4а, в, д), а также в виде отношения (ΔA0/ΔA)до/(ΔA0/ΔA)после, где индексы “до” и “после” обозначают порядок введения исследуемых соединений в ХЖКД ДНК (рис. 4б, г, е). Предварительная инкубация НЧЗ с ДНК способствовала их более выраженному деструктивному действию как в отсутствие красителей, так и в присутствии SG. В первом случае эффективность НЧЗ была до ≈1.4 раз выше по сравнению с их введением в готовую дисперсию (рис. 4б). При введении НЧЗ в готовую ХЖКД ДНК, содержащую SG, степень разрушения холестерической фазы ДНК слабо зависела от концентрации этого красителя (ср. кривые 2, 4, 6 на рис. 4в), однако в случае предварительной инкубации НЧЗ с ДНК она возрастала с ростом его концентрации (ср. кривые 1, 3, 5 на рис. 4в). Отношение КД-сигналов при этом составляло до ≈1.5, ≈1.9 и ≈2.4 при концентрации SG, равной 1.40 · 10–6, 3.50 · 10–6 и 7.00 · 10–6 М соответственно (рис. 4г). В присутствии красителя PG различия в интенсивности КД-сигналов для случаев предварительной инкубации НЧЗ с ДНК и их внесения в готовую дисперсию не превышали 30% (рис. 4д и е). Степень разрушения ХЖКД ДНК, содержащих PG, при добавлении НЧЗ была значительно выше, чем в присутствии SG: до ≈1.2, ≈1.5 и ≈4.1 раз при концентрации красителя 1.40 · 10–6, 3.50 · 10–6 и 7.00 · 10–6 М соответственно. В случае предварительной инкубации НЧЗ с ДНК различия были менее существенными.
Рис. 4.
Разрушение холестерической фазы ДНК под действием НЧЗ в отсутствие (а) и в присутствии красителей SG (в) или PG (д) в концентрации 1.40 · 10–6 (⚫, ⚪), 3.50 · 10–6 (▲, △) и 7.00 · 10–6 М (◼, ◻). Сплошные кривые соответствуют предварительной инкубации частиц с ДНК, а штриховые – их введению в готовую дисперсную систему. Отношение степени разрушения холестерической фазы ДНК при разной последовательности введения НЗЧ в систему, не содержащую (б) и содержащую красители SG (г) или PG (е) в концентрации 1.40 · 10–6 (⚫), 3.50 · 10–6 (▲) и 7.00 · 10–6 М (◼). Стандартные отклонения, рассчитанные по трем независимым измерениям, не превышали 8% (а, в, д) и 11% (б, г, е) соответственно.
Путем добавления красителей в ХЖКД ДНК можно не только усиливать разрушение холестерической организации молекул, но и способствовать ее восстановлению при температурной обработке в присутствии НЧЗ [13]. Температурная обработка является своеобразным способом “закалки” этой системы: нагрев ХЖКД ДНК до 80 °C и последующее охлаждение до 20 °C приводят к увеличению ее оптической активности. Однако НЧЗ мешают формированию “возвратной” холестерической фазы ДНК. Сравнение интенсивности КД-сигналов ХЖКД ДНК до и после цикла нагрев–охлаждение в присутствии (0÷10.55) · 10–8 М НЧЗ приведено на рис. 5а. Предварительная инкубация НЧЗ с ДНК не только усиливала разрушение сформированной затем ХЖКД (ср. кривые 1 и 3 на рис. 5а), но и ухудшала оптические свойства системы после охлаждения (ср. кривые 2 и 4 на том же рисунке). Наиболее ярко этот эффект был выражен в области малых концентраций НЧЗ. Так, например, если при введении 2.27 · 10–8 М НЧЗ в готовую ХЖКД амплитуда КД-сигнала после цикла температурной обработки восстанавливалась примерно на 83%, то в случае предварительной инкубации НЧЗ с ДНК – только примерно на 65%. Аналогичный эффект наблюдался и в присутствии 7.00 · 10–6 М SG (рис. 5б). В то же время в присутствии PG во всех рассмотренных случаях независимо от порядка введения реагентов восстановленный КД-сигнал превышал величину сигнала до температурной обработки в 1.32–7.53 раз.
Рис. 5.
Зависимости нормированной на начальное значение амплитуды КД-сигнала ХЖКД ДНК от концентрации НЧЗ до тепловой обработки (⚫ и ⚪) и после цикла нагрев–охлаждение 20 °C → 80 °C → 20 °C (▲ и △) в отсутствие красителей (а) и в присутствии 7.00 · 10–6 М SG (б) или PG (в). Кривые с маркерами ⚫ и ▲ соответствуют предварительной инкубации красителей и НЧЗ с ДНК, а с маркерами ⚪ и △ – их внесению в готовую дисперсную систему. Стандартные отклонения, рассчитанные по трем независимым измерениям, не превышали 5%.

Связывание SG и PG с ДНК в частицах ее ХЖКД приводит к росту флуоресценции обоих красителей по сравнению с регистрируемой в их молекулярных растворах. Однако интенсивность их флуоресценции в этой системе значительно ниже, чем в изотропном растворе ДНК, поскольку плотная упаковка молекул способствует усилению эффекта самотушения. Она также может приводить и к более сильному тушению флуоресценции красителей при добавлении НЧЗ [11, 12].
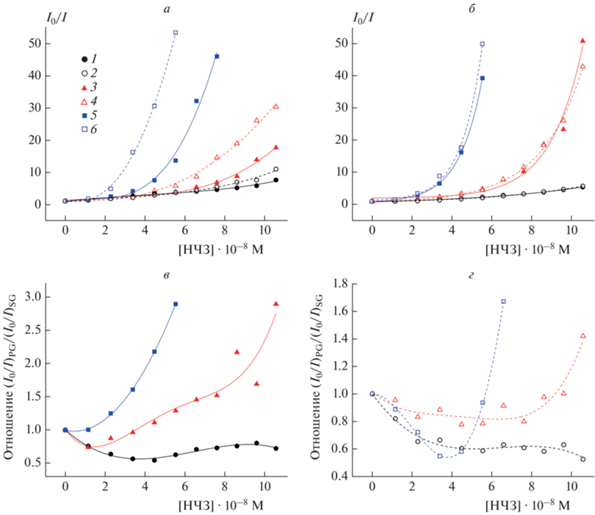
Сравнение тушения флуоресценции красителей SG и PG в различной концентрации в присутствии НЧЗ при разной последовательности введения компонентов в ХЖКД ДНК приведено на рис. 6. Данные представлены в виде отношения I0/I (I0 и I – значения интенсивности флуоресценции красителей в отсутствие и в присутствии НЧЗ), а также в виде отношения (I0/I)PG/(I0/I)SG. Для всех рассмотренных случаев, за исключением кривой 1 на рис. 6а, соответствующей наибольшему содержанию SG, с ростом концентрации НЧЗ наблюдалось отклонение экспериментальных зависимостей от линейных графиков в координатах Штерна–Фольмера. Для SG наиболее сильное тушение было отмечено при введении красителя и НЧЗ в готовую ХЖКД ДНК. Различия в степени тушения по сравнению с наблюдаемой при предварительной инкубации НЧЗ с ДНК усиливались по мере уменьшения концентрации красителя: они составляли примерно до 1.5, 2.2 и 4.1 раз при концентрации SG, равной 1.05 · 10–6, 3.50 · 10–7 и 7.00 · 10–8 М соответственно. Для PG различия в степени тушения при двух разных способах введения НЧЗ в ХЖКД не превышали 30% (рис. 6б). В целом, при обоих вариантах введения имела место картина, показанная нами ранее [12]: при низкой концентрации красителей более эффективное тушение флуоресценции (до ≈2.9 раз) наблюдалось для PG, в то время как при высокой их концентрации до ≈2 раз более сильное тушение наблюдалось для SG (рис. 6г и д).
Рис. 6.
Зависимости отношения I0/I для красителей SG (а) и PG (б) в концентрации 1.05 · 10–6 (⚫, ⚪), 3.50 · 10–7 (▲, △), 7.00 · 10–8 М (◼, ◻) от концентрации НЧЗ при различных способах их инкорпорирования в ХЖКД ДНК: предварительная инкубация с ДНК (закрашенные маркеры), введение в готовую дисперсную систему (полые маркеры). Отношение зависимостей (I0/I)PG и (I0/I)SG от концентрации НЧЗ для случая их предварительной инкубации с ДНК (в) или введения в готовую дисперсную систему (г) для следующих концентраций красителей: 1.05 · 10–6 (⚫, ⚪), 3.50 · 10–7 (▲, △), 7.00 · 10–8 М (◼, ◻). Стандартные отклонения, рассчитанные по трем независимым измерениям, не превышали 8% (а, б) и 11% (в, г) соответственно.
Поскольку амплитуда КД-сигнала зависит от шага пространственной спиральной закрутки холестерика [20], считается, что в случае добавления НЧЗ в готовую ХЖКД ДНК нарушение упаковки молекул состоит в раздвижении и изменении угла закрутки слоев [21]. В работе [22] для обозначения этого механизма был предложен термин “нематизация”. В случае же предварительной инкубации в результате связывания НЧЗ с ДНК может происходить исключение отдельных молекул или их групп из процесса формирования ХЖКД при добавлении ПЭГ. В работе [14] этот механизм был описан как предотвращение взаимного “узнавания” молекул ДНК. Таким образом, могут иметь место два механизма разрушения упаковки ДНК в частицах ее ХЖКД при добавлении НЧЗ: I – “нематизация”, II – исключение молекул. Если “нематизация” предполагает сохранение упорядоченной структуры частиц ХЖКД ДНК, то разрушение по механизму II, по-видимому, связано с непосредственным разрушением частиц дисперсии, т.е. с формированием фракции “изотропной ДНК”. Вместе с тем нельзя исключить, что, даже будучи связанными с НЧЗ, молекулы ДНК способны к самоорганизации. Поэтому усиление деструктивного действия НЧЗ в ряде ситуаций, в том числе при снятии стерических ограничений (в случае предварительной инкубации), можно объяснить бóльшим числом НЧЗ, инкорпорированных в частицы дисперсии, и/или увеличением размеров их агрегатов.
Мы полагаем, что наблюдаемые в настоящей работе эффекты обусловлены различием вкладов механизмов I и II. В отсутствие красителей изменение способа введения НЧЗ в рассматриваемом случае не приводит к значительному усилению их деструктивного действия, поскольку из-за относительного слабого взаимодействия НЧЗ с ДНК в растворе количество ее исключенных молекул невелико. В этом случае нарушение упаковки молекул ДНК в частицах ХЖКД реализуется преимущественно по механизму I. Можно предположить, что в присутствии специфичных к ДНК положительно заряженных красителей SG и PG взаимодействие с НЧЗ будет усиливаться за счет дополнительного электростатического притяжения. Однако для всех исследованных концентраций SG, а также для наименьшей концентрации PG степень разрушения холестерической фазы ДНК при введении НЧЗ в готовую дисперсную систему, содержащую красители, практически не отличалась от наблюдавшейся для необработанной ими системы. Это свидетельствует о доминировании механизма I.
Частицы ХЖКД ДНК “сопротивляются” разрушению по механизму II только до достижения некоторой концентрации PG, а при ее превышении наблюдается резкое усиление деструктивного действия НЧЗ, которое мы связываем с исключением части молекул ДНК из формирования субмикрочастиц ХЖКД. Можно предположить, что увеличение концентрации SG будет приводить к аналогичному результату и степень разрушения холестерической фазы ДНК при внесении НЧЗ до и после формирования дисперсии будет примерно такой же, как и в случае PG. В случае предварительной инкубации НЧЗ с обработанной красителями ДНК, по-видимому, возрастает вклад исключения ее молекул (разрушения по механизму II). Усиление этого эффекта с ростом концентрации красителей связано с увеличением числа возможных центров электростатического связывания НЧЗ. То есть, чем больше “меченных” красителем молекул ДНК, тем более эффективно их взаимодействие с НЧЗ (здесь мы предполагаем, что одна НЧЗ может взаимодействовать с несколькими центрами связывания соседних молекул ДНК) и, соответственно, исключение из процесса формирования ХЖКД.
В пользу исключения отдельных молекул ДНК и/или целых групп ее молекул свидетельствует более слабое тушение флуоресценции SG, наблюдаемое в случае предварительной инкубации НЧЗ с ДНК. Как было показано нами ранее [11, 12], тушение флуоресценции SG такими НЧЗ в изотропном растворе значительно слабее, чем в молекулярно-организованных системах. Увеличением количества молекул ДНК, высвобождающихся из частиц дисперсии с ростом концентрации PG, также объясняется полученный нами в работе [12] вид зависимости отношения степени тушения флуоресценции этого красителя в ХЖКД ДНК и в ее изотропном растворе: при высокой концентрации красителя упорядоченная надмолекулярная структура ДНК практически полностью разрушена и тушение соответствует регистрируемому в случае изотропного раствора.
ЗАКЛЮЧЕНИЕ
В работе проведено сравнение двух способов инкорпорирования в состав ХЖКД ДНК близких по структуре, но различающихся по величине заряда (+2 и +3 соответственно) флуоресцентных цианиновых красителей SG и PG, а также отрицательно заряженных НЧЗ. Впервые исследовано влияние образования тройных комплексов ДНК–краситель–НЧЗ на структуру жидкокристаллической матрицы и флуоресцентные свойства красителей для случаев предварительной инкубации этих компонентов с ДНК или их введения в готовую дисперсную систему.
На основе полученных данных можно сделать следующие выводы.
1. Предварительная инкубация НЧЗ с ДНК усиливает их деструктивное действие на ХЖКД как в отсутствие красителей (до ≈1.4 раз), так и в присутствии SG в исследованном диапазоне концентраций (до ≈2.4 раз). В случае PG порядок введения компонентов не играет существенной роли (различия в степени разрушения холестерической фазы ДНК под действием НЧЗ не превышали ≈30%).
2. Порядок введения красителей и НЧЗ может влиять на формирование так называемой “возвратной” холестерической фазы ДНК, получаемой при нагреве системы до 80 °C и ее последующем охлаждении до 20 °C. В отсутствие красителей и в присутствии SG наблюдалось ухудшение оптических свойств “возвратной” ХЖКД ДНК, в то время как в присутствии PG они заметно не изменялись.
3. В отсутствие красителей как в случае предварительной инкубации НЧЗ с ДНК, так и при их введении в готовую дисперсную систему преобладает “нематизация” частиц ХЖКД ДНК (их разрушение по механизму I). В то же время увеличение числа положительно заряженных центров связывания НЧЗ с ростом концентрации красителей может приводить к усилению вклада исключения отдельных молекул ДНК из структуры жидкокристаллических частиц (разрушение по механизму II).
Список литературы
Евдокимов Ю.М., Сычев В.В. // Успехи химии. 2008. Т. 77. № 2. С. 194.
Seeman N.C., Sleiman H.F. // Nat. Rev. Mater. 2018. V. 3. P. 17068.
Jordan C.F., Lerman L.S., Venable J.H. // Nat. New Biol. 1972. V. 236. № 64. P. 67.
Yevdokimov Y.M., Skuridin S.G., Lortkipanidze G.B. // Liq. Cryst. 1992. V. 12. № 1. P. 1.
Скуридин С.Г., Верещагин Ф.В., Гусев В.М. и др. // Жидкие кристаллы и их практич. использ. 2020. Т. 20. № 3. С. 80.
Yevdokimov Y.M., Salyanov V.I., Kondrashina O.V. et al. // Intern. J. Biol. Macromol. 2005. V. 37. № 4. P. 165.
Пронкин П.Г., Татиколов А.С. // Хим. физика. 2021. Т. 40. № 2. С. 3.
Пронкин П.Г., Татиколов А.С. // Хим. физика. 2022. Т. 41. № 2. С. 3.
Бурцев И.Д., Егоров А.Е., Костюков А.А. и др. // Хим. физика. 2022. Т. 41. № 2. С. 41.
Ribeiro T., Baleizão C., Farinha J.P.S. // Sci. Rep. 2017. V. 7. № 1. P. 2440.
Morozov V.N., Kolyvanova M.A., Dement’eva O.V. et al. // J. Lumin. 2020. V. 219. P. 116898.
Morozov V.N., Kolyvanova M.A., Dement’eva O.V. et al. // J. Mol. Liq. 2021. V. 321. P. 114751.
Морозов В.Н., Климович М.А., Колыванова М.А. и др. // Химия высоких энергий. 2021. Т. 55. № 5. С. 339.
Евдокимов Ю.М., Салянов В.И., Скуридин С.Г. и др. // Успехи химии. 2015. Т. 84. № 1. С. 27.
Скуридин С.Г., Лорткипанидзе Г.Б., Мусаев О.Р. и др. // Высокомолекуляр. соединения. 1985. Т. 27. № 11. С. 2266.
Zipper H., Brunner H., Bernhagen J. et al. // Nucleic Acids Res. 2004. V. 32. P. e103.
Дементьева О.В., Карцева М.Е., Сухов В.М. и др. // Коллоид. журн. 2017. Т. 79. С. 562.
Евдокимов Ю.М., Компанец О.Н. // Науч. приборостр. 2018. Т. 28. № 3. С. 44.
Dragan A.I., Pavlovic R., McGivney J.B. et al. // J. Fluoresc. 2012. V. 22. № 4. P.1189.
Belyakov V.A., Orlov V.P., Semenov S.V. et al. // Liq. Cryst. 1996. V. 20. № 6. P. 777.
Скуридин С.Г., Дубинская В.А., Штыкова Э.В. и др. // Биол. мембраны. 2011. Т. 28. № 3. С. 191.
Евдокимов Ю.М. // Вестн. Моск. ун-та. Сер. 2. Химия. 2015. Т. 56. № 3. С. 147.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


