Химическая физика, 2023, T. 42, № 1, стр. 10-14
Термическое разложение 1,1-бис(метокси-NNO-азокси)-3-нитро-3-азабутана
В. В. Захаров 1, *, И. Н. Зюзин 1, Б. Л. Корсунский 1, 2, Т. С. Ларикова 1, Н. В. Чуканов 1, **
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
2 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: vzakh@icp.ac.ru
** E-mail: chukanov@icp.ac.ru
Поступила в редакцию 21.01.2022
После доработки 05.03.2022
Принята к публикации 21.03.2022
- EDN: HRBOUD
- DOI: 10.31857/S0207401X23010132
Аннотация
Термическое разложение 1,1-бис(метокси-NNO-азокси)-3-нитро-3-азабутана изучено в изотермических и неизотермических условиях. Теплоты его плавления и термического разложения равны соответственно –29.1 кДж/моль (7.0 ккал/моль) и 387 кДж/моль (92.5 ккал/моль). Проанализирован состав газообразных продуктов термического разложения. Реакция протекает автокаталитически. Реакционным центром в молекуле изученного вещества является диазеноксидная группа. Предложен механизм процесса. Лимитирующая стадия реакции включает пятичленное циклическое переходное состояние.
ВВЕДЕНИЕ
Алкокси-NNO-азоксисоединения (N-алкил-N'-алкоксидиазен-N-оксиды) представляют собой относительно новый и интересный класс энергоемких соединений [1–3]. Известны также вещества, в молекулах которых вместе с алкокси-NNO-азокси-группами содержатся другие энергоемкие функциональные группы [4–9].
В ряде работ исследовалось термическое разложение алкокси-NNO-азоксисоединений, что позволило сделать выводы об их термической устойчивости [10–16]. Оказалось, что в зависимости от структуры этих веществ реакция может протекать по-разному: как по радикальному механизму, так и по молекулярному – через образование циклического переходного состояния.
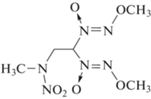
Настоящая работа посвящена изучению термического разложения 1,1-бис(метокси-NNO-азокси)-3-нитро-3-азабутана (или 4,4-бис(2-метокси-1-оксидодиазенил)-2-нитро-2-азабутана) (I), вещества, в молекуле которого совмещены два типа энергоемких групп – две геминальные диазеноксидные группы и одна нитраминная:
I
Интересно отметить, что эти два типа группы изомерны. Как показали термохимические измерения [17], диазеноксидная группа более энергоемка, чем нитраминная, хотя связь N–NO2 менее прочная, чем любая связь в диазеноксидной группе. Соединение I перспективно при использовании его в качестве возможного компонента твердых ракетных топлив [18].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Соединение I синтезировали по известной методике [19] и очищали путем двукратной перекристаллизации из этанола с горячим фильтрованием. Образец сушили на воздухе на горячей платформе (100 °С) в течение суток. Температура плавления (Tпл) соединения I равна 103.6–104.0 °С [18] (литературные данные по Tпл: 98 °С [20] и 103.1–104.0 °С [19]).
Термическое разложение соединения I в неизотермическом режиме изучалось методами дифференциальной сканирующей калориметрии (ДСК) и термогравиметрии с использованием синхронного термического анализатора NETZSCH STA 449F5 компании Netzsch (Germany), сопряженного с квадрупольным масс-спектрометром QMS 403C Aёolos Netzsch (Germany), в диапазоне температур 30–350 °С при продувке аргоном со скоростью 40 мл/мин, скорости нагрева 2 °С/мин и массе навески 2.8 мг. Масс-спектрометрический анализ газообразных продуктов термического разложения соединения I проводили на встроенном в прибор STA 449F5 масс-спектрометре в режиме регистрации предварительно выделенных ионов при энергии ионизирующих электронов 70 эВ.
Кинетику термического разложения в изотермическом режиме исследовали по потере массы с помощью автоматических термовесов АТВ-14М [21]. Исследуемое вещество помещали в стеклянный стаканчик (навеска образца была близка к 10 мг).
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
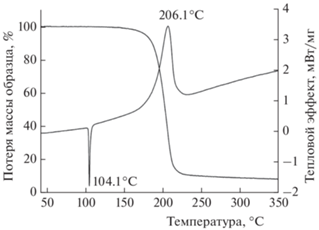
На рис. 1 приведены результаты, полученные методом термического анализа. Кривая ДСК содержит два пика – эндотермический и экзотермический. Первый из них соответствует плавлению, теплота этого процесса равна –29.1 кДж/моль (–7.0 ккал/моль). Экзотермический пик на кривой ДСК и соответствующая потеря массы отвечают процессу термического разложения. При нагревании до 350 °С потеря массы составила ~90%, а соответствующий тепловой эффект найден равным 387 кДж/моль (92.5 ккал/моль).
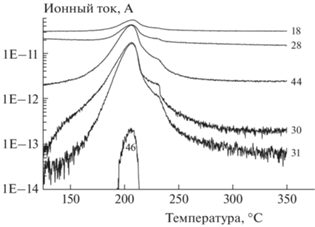
На рис. 2 приведены результаты масс-спектрометрических измерений, проводившихся синхронно с ТГ и ДСК. Было установлено, что в качестве газообразных продуктов реакции образуются N2O, H2O, NO2, NO, N2 и СН3ОН. Стоит отметить, что из-за низкого разрешения масс-спектра заключение о соотношении N2O, NO и N2 не стопроцентное, поскольку образование сигналов с m/z = 28, 30 и 44 можно отнести также к CO, CH2O и СО2 соответственно. Более того, какая-то доля этих газов должна неизбежно образовываться при окислении метанола двуокисью азота.
Рис. 2.
Кинетические кривые образования газообразных продуктов при термическом разложении соединения I, полученные по масс-спектрометрическим измерениям при скорости нагрева 2 град/мин; числа при кривых – значения m/z.
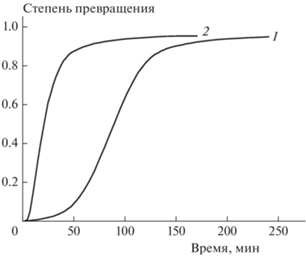
Опыты, проведенные в изотермическом режиме, показали, что реакция протекает с ярко выраженным самоускорением (кривая 1 на рис. 3). Подобные зависимости характерны для автокаталитических реакций. Для проверки этого предположения был проведен опыт по термическому разложению соединения I в присутствии конденсированного остатка, образующегося в результате реакции разложения; для этого после завершения процесса в реакционный сосуд вводили свежее вещество в таком же количестве, как и в предыдущем опыте, и вновь проводили разложение. Как видно (кривая 2 на рис. 3), реакция действительно сильно ускоряется под действием продукта разложения. Тем самым можно считать надежно доказанным, что изученная реакция протекает автокаталитически, причем автокатализ обусловлен действием конденсированных продуктов.
Рис. 3.
Кинетические кривые термического разложения соединения I при температуре 179.5 °С: 1 – в отсутствие добавок, 2 – в присутствии добавки конденсированного продукта термического разложения.
Если предположить, что как первичная некаталитическая стадия реакции, так и следующая за ней автокаталитическая стадия имеют первые кинетические порядки по исходному веществу и по автокатализатору, то кинетика разложения может быть описана следующим уравнением:
Здесь η – степень превращения, k1 и k2 – соответственно константы скорости некаталитической и каталитической реакций. Уравнение (1) можно записать в виде выражения для wуд – удельной скорости реакции:(2)
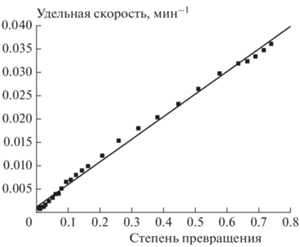
${{w}_{{{\text{уд}}}}} \equiv \frac{{{{d{{\eta }}} \mathord{\left/ {\vphantom {{d{{\eta }}} {dt}}} \right. \kern-0em} {dt}}}}{{1 - {{\eta }}}} = {{k}_{1}} + {{k}_{2}}{{\eta }}{\text{.}}$На рис. 4 в качестве примера приведена одна из зависимостей в координатах wуд – η. Из нее видно, что изученная реакция вплоть до высоких степеней превращения описывается уравнениями автокаталитической реакции (1) и (2).
Рис. 4.
Зависимость удельной скорости термического разложения соединения I при температуре 179.5 °С от степени превращения.
Расчеты показали, что константы скорости k1 значительно меньше (как правило, на ~2 порядка) констант скорости k2. Поэтому их не удается определить с приемлемой точностью.
В табл. 1 приведены величины k2 при различных температурах. Соответствующие значения энергии активации и предэкспоненциального множителя найдены равными соответственно (41.7 ± 2.7) ккал/моль (174.5 кДж/моль) и 1017.0 ± 1.4 c–1.
Таблица 1.
Значения констант скорости k2 при различных температурах
| Температура, °С | k2, c–1 |
|---|---|
| 150 | 2.7 · 10–5 |
| 160 | 8.7 · 10–5 |
| 170 | 3.2 · 10–4 |
| 179.5 | 5.5 · 10–4 |
| 190 | 2.3 · 10–3 |
Трактовка механизма термического разложения соединения I осложнена тем, что молекула этого вещества содержит два типа реакционноспособных функциональных групп – два диазеноксидные и нитраминную. Для выяснения того, какая из этих групп лимитирует процесс термического разложения, целесообразно сопоставить приведенные выше данные с результатами исследования термического разложения диазеноксидов, молекулы которых не содержат нитраминной группы и для которых ранее был предложен механизм распада [13–16]. Такое сопоставление показало, что на ранних стадиях соединение I распадается ничуть не быстрее диазеноксидов, не содержащих нитраминной группы (да и вообще нитрогрупп).
В качестве примера на рис. 5 приведены кинетические кривые термического разложения соединения I и 1-(2,2-бис(метокси-NNO-азокси)этил)пиразола, молекула которого вообще не содержит нитрогрупп.
Рис. 5.
Кинетические кривые термического разложения соединения I (1) и 1-(2,2-бис(метокси-NNO-азокси)этил)пиразола (2) при температуре 170 °С.
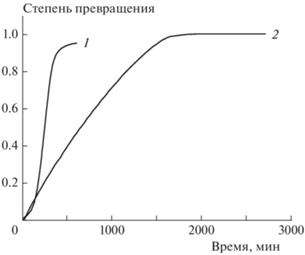
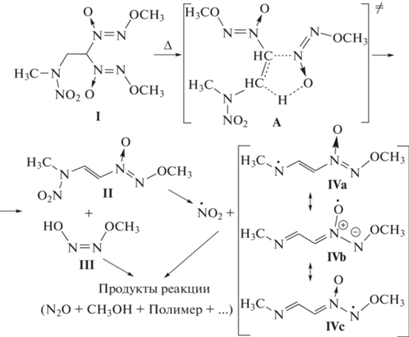
Из рисунка видно, что на начальных этапах соединение I разлагается даже несколько медленнее 1-(2,2-бис(метокси-NNO-азокси)этил)пиразола. Это позволяет заключить, что реакционным центром в молекуле соединения I при термическом разложении является 2,2-бис(метокси-NNO-азокси)этильная группа. Сказанное, а также состав образующихся продуктов и высказанные ранее соображения [13–16] о механизме термического разложения диазеноксидов позволяют предложить, что реакция протекает по следующей схеме:
Согласно этой схеме, реакция протекает через пятичленное циклическое переходное состояние А и сопровождается образованием двух промежуточных продуктов – непредельного нитрамина II и цис-монометилгипонитрита III. Промежуточный продукт III может далее распадаться на N2O и метанол (опять-таки через пятичленное переходное состояние). Диоксид азота, также являющийся одним из газообразных продуктов разложения, по-видимому, образуется в результате гомолитического разрыва связи N–NO2 в промежуточном продукте II. Такое направление реакции облегчается стабилизацией радикала IV за счет распределения неспаренного электрона по всей π-системе. Это распределение частично представлено набором валентных схем IVa–IVc, из которого наибольший вклад, по-видимому, вносит валентная схема IVb, включающая типичный N-оксидный радикал.
Данные, приведенные на рис. 3, однозначно свидетельствуют о том, что в изученной реакции имеет место автокатализ конденсированными продуктами разложения. Именно этим объясняется то, что соединение I на начальных этапах разлагается медленнее 1-(2,2-бис(метокси-NNO-азокси)этил)пиразола, но в дальнейшем по скорости значительно обгоняет его. Полученный результат представляется удивительным, поскольку известно, что для термического разложения как диазеноксидов, так и нитраминов автокатализ не характерен. Действительно, имеющиеся данные свидетельствуют о том, что термическое разложение диазеноксидов, не содержащих других реакционноспособных групп, протекает без самоускорения [22]. Нитрамины, как правило, распадаются со слабым самоускорением, обусловленным протеканием параллельно-последовательных реакций [23]. Единственным надежно установленным исключением является тетрил, при разложении которого реализуется автокатализ, имеющий кислотную природу [24].
Ввиду сложной (по-видимому, полимерной) структуры конденсированного продукта трактовать природу автокатализа при термическом разложении соединения I затруднительно. В то же время целесообразно отметить, что сходное, хотя и менее интенсивное поведение наблюдалось при синтезе метокси-NNO-азоксиэтена препаративным пиролизом 1,1-бис(метокси-NNO-азокси)этана [25, 26].
Работа выполнена по теме госзадания ИПХФ РАН (регистрационный номер AAAA-A19-119101690058-9) и по теме госзадания ФИЦ ХФ РАН им. Н.Н. Семёнова 0082-2019-0006 (регистрационный номер АААА-А21-121011990037-8).
Список литературы
Зюзин И.Н., Лемперт Д.Б. // Изв. АН СССР. Сер. хим. 1985. № 4. С. 831.
Зюзин И.Н., Нечипоренко Г.Н., Головина Н.И., Трофимова Р.Ф., Логинова М.В. // Изв. АН. Сер. хим. 1997. № 8. С. 1486.
Зюзин И.Н., Головина Н.И., Лемперт Д.Б., Нечипоренко Г.Н., Шилов Г.В. // Изв. АН. Сер. хим. 2008. № 3. С. 619.
Зюзин И.Н., Головина Н.И., Федоров Б.С., Шилов Г.В., Нечипоренко Г.Н. // Изв. АН. Сер. хим. 2003. № 3. С. 726.
Зюзин И.Н., Лемперт Д.Б. // Изв. АН. Сер. хим. 2009. № 10. С. 2108.
Zyuzin I.N., Suponitsky K.Yu., Sheremetev A.B. // J. Heterocyclic Chem. 2012. T. 7. № 3. C. 561; https://doi.org/10.1002/jhet.811
Зюзин И.Н. // Журн. орган. химии. 2015. Т. 49. № 4. С. 536.
Зюзин И.Н., Супоницкий К.Ю., Далингер И.Л. // Химия гетероцикл. соединений. 2017. Т. 53. № 6/7. С. 702.
Зюзин И.Н. // Изв. АН. Сер. хим. 2020. № 10. С. 1949.
Зюзин И.Н., Лемперт Д.Б. // Журн. общ. химии. 2010. Т. 80. № 9. С. 1473.
Зюзин И.Н., Лемперт Д.Б. // Кинетика и катализ. 2011. Т. 52. № 1. С. 19.
Зюзин И.Н., Лемперт Д.Б. // Журн. общ. химии. 2012. Т. 82. № 6. С. 947.
Захаров В.В., Чуканов Н.В., Зюзин И.Н., Неделько В.В., Корсунский Б.Л. // Хим. физика. 2019. Т. 38. № 2. С. 3.
Корсунский Б.Л., Захаров В.В., Ларикова Т.С. и др. // Хим. физика. 2022. Т. 41. № 7. С. 32; https://doi.org/10.31857/S0207401X22070081
Захаров В.В., Корсунский Б.Л., Ларикова Т.С., Зюзин И.Н., Чуканов Н.В. // Хим. физика. 2022. Т. 41. № 9. С. 3; https://doi.org/10.31857/S0207401X22090126
Захаров В.В., Зюзин И.Н., Корсунский Б.Л., Ларикова Т.С., Чуканов Н.В. // Хим. физика. 2022. Т. 41. № 12. С. 7; https://doi.org/10.31857/S0207401X2212010X
Кирпичев Е.П., Зюзин И.Н., Авдонин В.В., Рубцов Ю.И., Лемперт Д.Б. // ЖФХ. 2006. Т. 80. № 9. С. 1543.
Зюзин И.Н., Лемперт Д.Б., Набатова А.В., Казаков А.И. // Физика горения и взрыва. 2020. Т. 56. № 4. С. 104; https://doi.org/10.15372/FGV20200410
Зюзин И.Н. // Изв. АН. Сер. хим. 2019. № 10. С. 1949.
Марченко Г.А., Мухаметзянов А.С., Целинский И.В., Ермошкин А.С. // Журн. орган. химии. 1985. Т. 21. № 7. С. 1429
Гальперин Л.Н., Колесов Ю.Р., Зеленов Н.А. // Измерит. техника. 1981. № 4. С. 23.
Зюзин И.Н., Лемперт Д.Б., Нечипоренко Г.Н. // Изв. АН СССР. Сер. хим. 1988. № 7. С. 1506.
Дубовицкий Ф.И., Корсунский Б.Л. // Успехи химии. 1981. Т. 50. № 10. С. 1828.
Дубовицкий Ф.И., Манелис Г.Б., Смирнов Л.П. // ЖФХ. 1961. Т. 35. № 3. С. 521.
Зюзин И.Н. // ЖПХ. 2009. Т. 82. № 10. С. 1677.
Грачев В.П., Зюзин И.Н., Курмаз С.В. и др. // Изв. РАН. Сер. хим. 2020. № 12. С. 2312.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика