Химическая физика, 2023, T. 42, № 1, стр. 3-9
Электрическое стимулирование каталитической активности покрытий из наночастиц золота при окислении СО
М. В. Гришин 1, *, А. К. Гатин 1, В. Г. Слуцкий 1, А. С. Федотов 2, В. А. Харитонов 1, Б. Р. Шуб 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
Москва, Россия
* E-mail: grishin@.chph.ras.ru
Поступила в редакцию 17.11.2021
После доработки 03.12.2021
Принята к публикации 20.12.2021
- EDN: MOXHLV
- DOI: 10.31857/S0207401X23010053
Аннотация
Экспериментально определено увеличение скорости каталитического окисления СО на покрытиях из наночастиц золота при подаче на них электрического напряжения различной полярности и величины от внешнего источника. В условиях эксперимента при 430 °С, атмосферном давлении, начальном составе смеси 1.8% СО + 10.2% О2 + Ar и начальном размере частиц покрытия 0.2–3 нм последовательное увеличение подаваемого положительного напряжения U вначале приводит к росту скорости окисления СО на 28% при U = +10 В, плавно снижающемуся до 20% при U = +30 В. Подача отрицательного напряжения менее эффективна: вначале скорость окисления растет на 12% при U = –10 В, а затем снижается до 7% при U = –30 В. Выполнены квантовохимические расчеты теплот ассоциации СО и О2 с простейшим электронейтральным или электрически заряженным кластером золота Au3, а также теплот реакций Au3CO + O → Au3CO2 и Au3CO2 → Au3 + CO2 для различных зарядов Au3-содержащих комплексов. По результатам расчетов предложено объяснение увеличения скорости каталитического окисления СО на покрытиях из наночастиц золота, электрически заряженных с помощью внешнего источника напряжения.
ВВЕДЕНИЕ
Наночастицы платины и палладия (в виде покрытий) используются как катализаторы окисления СО в конверторах, которыми оснащаются современные автомобили для снижения вредных выбросов в выхлопных газах [1–4]. В последние годы проводятся исследования по возможной замене платиновых и палладиевых катализаторов в конверторах на обладающие большей сырьевой базой катализаторы на основе золота [5–8]. Увеличение активности указанных катализаторов является актуальной задачей, решение которой будет способствовать как увеличению экологической чистоты двигателей внутреннего сгорания, так и снижению стоимости конверторов за счет уменьшения требуемой для окисления СО массы дорогостоящих катализаторов из благородных металлов.
В настоящее время основным приемом, позволяющим влиять на активность каталитических покрытий, является варьирование материала подложки, на которую оно наносится (см. обзоры [9, 10]). В общем случае подложка может оказывать следующее воздействие на состояние нанесенных на нее наночастиц (НЧ): предотвращать их слипание либо способствовать противоположному процессу – изменять их форму, состав и заряд, а также стабилизировать промежуточные продукты реакции. В результате описанных выше эффектов взаимодействия в системе наночастица–подложка химические свойства НЧ могут изменяться в широких пределах. Взаимосвязь каталитических свойств и структуры, электронных свойств, природы подложки и других параметров структурированных на наноуровне покрытий рассмотрено в ряде работ [11–17].
Возможность увеличения каталитической активности покрытий из наночастиц Pt и Pd при окислении СО методом подачи на них напряжения впервые продемонстрирована в наших опытах, представленных в работах [18–21]. Показано, что подача на платиновое покрытие положительного напряжения U = +10 В или +30 В приводила к увеличению скорости окисления СО на 18% или 54%, соответственно [18, 19], а при подаче таких же напряжений на палладиевое покрытие скорость окисления СО увеличивалась на 14% или 42% [20, 21]. В то же время эффект от подачи на покрытия отрицательного напряжения был существенно ниже. Предложено объяснение полученных результатов, связывающее увеличение каталитической активности указанных покрытий с электрическим зарядом, возникающим на платине или палладии при подаче на них напряжения.
Возможность увеличения каталитической активности покрытий из наночастиц золота при окислении СО разрабатываемым методом подачи напряжения на покрытия впервые установлена в наших опытах, представленных в работе [22]. В условиях эксперимента из работы [22] подача на покрытие из наночастиц Pt напряжения U = +10 В приводила к увеличению скорости окисления СО на 28%.
Данная работа продолжает начатые в [22] экспериментальные исследования, расширяя как диапазон, так и полярность подаваемого на покрытия из НЧ золота электрического напряжения. Кроме того, выполнены квантовохимические расчеты теплот ассоциации электронейтрального и электрически заряженного простейшего кластера золота Au3 с СО и О2, а также теплот реакций Au3CO + O → Au3CO2 и Au3CO2 → Au3 + CO2 для различных зарядов Au3-содержащих комплексов, поясняющие влияние подаваемого на золотое покрытие из НЧ золота напряжения на его каталитическую активность при окислении СО.
ЭКСПЕРИМЕНТАЛЬНЫЕ УСЛОВИЯ
Эксперименты по окислению СО в смеси с начальным составом 1.8% СО + 10.2% О2 + Ar проводили при температуре 430 °С и атмосферном давлении в прогреваемой статической установке. Реактор установки состоял из стеклянной трубки длиной 250 мм с внутренним диаметром 5 мм, снабженной вентилями входа, выхода и отбора проб продуктов реакции. Внутри реактора размещался образец – алюминиевая пластина размером 100 × 3 мм с нанесенным на нее с двух сторон покрытием из НЧ золота. Пластину подсоединяли к незаземленной клемме источника напряжения, а заземленную клемму источника соединяли с металлической фольгой, охватывающей стеклянную трубку реактора. Подробное описание установки приведено в работе [22].
Нанесение покрытия осуществлялось методом пропитки следующим образом. Вначале на каждую из сторон пластины наносили и высушивали на воздухе 150 мкл водного раствора тетрахлораурата водорода HAuCl4 ∙ 4H2O с содержанием золота 0.7 ∙ 10–2 мг/мл. Затем пластину размещали в реакторе, где в потоке аргона с расходом 30 мл/мин прогревали до 400 °С в течение 4 ч. При этом происходило разложение HAuCl4 и на пластине образовывалось золотое покрытие. По данным сканирующей туннельной микроскопии созданное таким методом покрытие состояло из НЧ золота размером 0.2–3 нм [22].
Эксперименты по окислению СО начинали с прогрева реактора с образцом до 430 °С в потоке исходной смеси с расходом 30 мл/мин. После этого проводили несколько серий экспериментов. В первой серии электрическое напряжение U на образец с нанопокрытием из НЧ золота не подавали: U = 0. Первый опыт этой серии начинали сразу по достижении реактором температуры 430 °С. После этого реактор дополнительно продували исходной смесью с указанным расходом в течение 5 мин. Затем вентили входа и выхода из реактора закрывали и заполнившую реактор смесь выдерживали в нем в течение 10 мин. По истечении этого времени с помощью подсоединенного к реактору шприца проводили отбор пробы из реактора для хроматографического анализа состава продуктов реакции. Затем реактор опять продували исходной смесью (время продувки – 5 мин, расход смеси – 30 мл/мин) и аналогично первому проводили второй опыт с целью подтверждения полученного в первом опыте результата.
После этого на образец подавали положительное напряжение U = +5 В и начинали вторую серию экспериментов. Реактор снова продували исходной смесью в течение 5 мин с расходом смеси 30 мл/мин, закрывали и выдерживали в нем смесь в течение 10 мин. Затем осуществляли отбор пробы из реактора и хроматографически определяли содержание СО и СО2 в отобранной пробе. Подобная процедура проводилась дважды. Далее напряжение отключали (U = 0), и по той же методике, что и в экспериментах с подачей напряжения на образец, определяли состав продуктов реакции при отсутствии напряжения на золотом покрытии. Повторное проведение экспериментов при U = 0 связано с тем, что подача на образец напряжения приводит к частичному уносу с образца заряженных НЧ золота под действием электрического поля и последующему их уносу из реактора во время его продувки свежей смесью [22]. Вследствие этого для корректного определения влияния напряжения на конверсию СО в СО2 данные по конверсии с подачей напряжения должны сравниваться с данными по конверсии при U = 0, полученными после подачи напряжения. Затем аналогичным образом последовательно проводилось еще несколько серий экспериментов: при U = –5 В и U = 0; U = +10 В и U = 0; U = –10 В и U = 0; U = +20 В и U = 0; U = –20 В и U = 0; U = = +30 В и U = 0; U = –30 В и U = 0.
Для оценки влияния материала подложки на окисление СО проводили контрольные опыты, в которых использовали алюминиевую пластину без покрытия. Опыты проводили по той же методике, что и опыты с золотым покрытием.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
На рис. 1 приведены экспериментальные данные по степени превращения (конверсии) СО в СО2:
(1)
$\left[ {{\text{C}}{{{\text{O}}}_{{\text{2}}}}} \right]{\text{/}}{{\left[ {{\text{CO}}} \right]}_{{\text{0}}}}{\text{ = }}\left[ {{\text{C}}{{{\text{O}}}_{{\text{2}}}}} \right]{\text{/}}\left( {\left[ {{\text{CO}}} \right] + \left[ {{\text{C}}{{{\text{O}}}_{{\text{2}}}}} \right]} \right){\text{,}}$Рис. 1.
Конверсия СО на покрытии из наночастиц золота при различных напряжениях, подаваемых на покрытие. Черные точки – конверсия при последовательной подаче положительных и отрицательных напряжений, светлые – конверсия при U = 0 как до, так и после подачи напряжения.

Аналогичный эффект уменьшения каталитической активности нанесенных методом пропитки покрытий из наночастиц Pt или Pd после подачи на них напряжения наблюдался ранее в наших опытах по окислению СО на указанных покрытиях [18–21]. Однако падение активности было более существенным, достигая 48% после подачи на покрытия U = +30 В или –30 В.
Отметим, что при последовательном увеличении подаваемого на образец напряжения с его поверхности также последовательно уносятся вначале мелкие, а затем более крупные заряженные частицы золота в силу лучшего сцепления крупных частиц с разномасштабными неоднородностями на поверхности подложки. При этом предложенная методика проведения опытов позволяет определять влияние (или отсутствие влияния) размера частиц золота на эффект увеличения их каталитической активности при подаче на них напряжения.
Установленный эффект уноса означает, что для корректного определения влияния напряжения на каталитическую активность образца с покрытием из НЧ золота необходимо сравнивать конверсию СО при подаче напряжения с конверсией СО при U = 0 после подачи напряжения. Такое сравнение приведено на рис. 2. Из этого рисунка следует, что при последовательном увеличении подаваемого на покрытие из наночастиц золота положительного или отрицательного напряжения степень конверсии СО вначале растет с увеличением напряжения, а затем плавно снижается. Подобная волнообразная зависимость степени конверсии от напряжения может быть объяснена следующим образом. Известно, что каталитическое окисление СО на наночастицах золота, нанесенных на окисленную поверхность металлов, происходит при взаимодействии молекул СО, адсорбированных на частицах, с поверхностными оксидами или с молекулами О2, адсорбированными на оксидах [8, 23, 24]. При этом оптимальными для катализа являются достаточно мелкие двуслойные НЧ золота с числом атомов n ∼ 10 и характерным размером d ∼ 0.3 нм [25]. В создаваемых нами методом пропитки покрытиях подобные частицы присутствуют на подложке до подачи на нее напряжения [22], и их наличие обеспечивает увеличение конверсии СО при малых подаваемых напряжениях U < 10 В. Однако при больших значениях U мелкие двуслойные частицы уносятся с подложки и на остающихся более крупных частицах с тремя и более слоями золота заряд при подаче напряжения смещается на внешнюю границу частиц, постепенно удаляющуюся от оптимального для реакции второго слоя золота по мере роста напряжения и увеличения размера остающихся на подложке частиц. Именно с этим и связано снижение конверсии СО при U > 10 В.
Рис. 2.
Увеличение конверсии СО на покрытии из наночастиц золота при последовательном увеличении подаваемого на покрытие положительного или отрицательного напряжения.
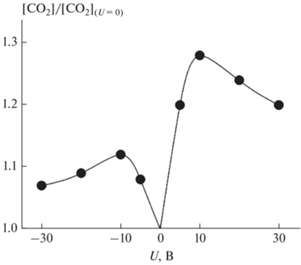
Из рис. 2 следует также, что увеличение степени конверсии при подаче на покрытие положительного напряжения заметно превышает ее увеличение при подаче аналогичного отрицательного напряжения. Так, при подаче U = +10 В увеличение степени конверсии оставляет 28%, в то время как при подаче U = –10 В приводит к ее увеличению лишь на 12%, что в 2.3 раза меньше. Подобная большая эффективность применения положительных напряжений для увеличения скорости каталитического окисления СО характерна также для платиновых и палладиевых покрытий [19, 21].
Кроме того, из рис. 2 следует, что в диапазоне U от 0 до +10 В, когда степень конверсии растет с ростом U, коэффициент увеличения скорости составляет 2.8% на 1 В при 430 °С. Такой коэффициент превышает аналогичные значения коэффициентов для платины (1.8%/В при 250 °С) [19] или палладия (1.4% на 1 В при 330 °С) [21]. Это означает, что оптимальные для конверсии мелкие наночастицы золота размером d ~ 0.3 нм, остающиеся в покрытии при 0 ≤ U ≤ 10 В, более чувствительны к промотирующему действию напряжения, чем наночастицы Pt или Pd.
Отметим, что в контрольных опытах с образцом без золотого покрытия конверсия CO не наблюдалась как при U = 0, так и при подаче напряжения на образец.
КВАНТОВОХИМИЧЕСКИЕ РАСЧЕТЫ
Каталитическое окисление СО на наночастицах Aun, находящихся на окисленной металлической поверхности, происходит при взаимодействии молекул СО, адсорбированных на этих НЧ золота, с поверхностными оксидами металлов MeOx или с молекулами О2, адсорбированными на оксидах [8, 23, 24]. При взаимодействии происходит отрыв атома О от MeOx или адсорбированного О2 и ассоциация его с СО в СО-комплексах Aun(CO)m, что приводит к образованию СО2-комплексов Aun(CO)m – 1CO2:
(2)
${\text{A}}{{{\text{u}}}_{n}}{{\left( {{\text{CO}}} \right)}_{m}} + {\text{O}} \to {\text{A}}{{{\text{u}}}_{n}}{{\left( {{\text{CO}}} \right)}_{m}}_{{--{\text{ }}1}}{\text{C}}{{{\text{O}}}_{2}}.$Последующий распад СО2-комплексов приводит к выделению СО2:
(3)
${\text{A}}{{{\text{u}}}_{n}}{{\left( {{\text{CO}}} \right)}_{m}}_{{--{\text{ }}1}}{\text{C}}{{{\text{O}}}_{2}} \to {\text{A}}{{{\text{u}}}_{n}}{{\left( {{\text{CO}}} \right)}_{m}}_{{--{\text{ }}1}} + {\text{C}}{{{\text{O}}}_{2}}.$Для объяснения обнаруженного в наших экспериментах влияния напряжения на каталитическую активность покрытий из НЧ золота при окислении СO мы провели квантовохимические расчеты теплот ассоциации атома О с простейшим электронейтральным или электрически заряженным СО-комплексом Au3CO. Заряженные СО-комплексы образуются при взаимодействии СО с заряженными золотыми частицами в покрытии под напряжением. Расчеты проводились в рамках теории функционала плотности с использованием программного пакета OpenMX-3.7 [26, 27] (приближение PBE13, базис s2p2d1 для Au и s2p2 для С и О). Результаты расчетов представлены в табл. 1. Там же приведены рассчитанные нами теплоты и некоторых других реакций. Структуры рассчитанных соединений приведены на рис. 3.
Таблица 1.
Теплоты (в ккал/моль) ассоциации Au3 c СО и О2, Au3CO с О, а также теплоты распада Au3CO2 в зависимости от заряда (0, “+” или “–”) Au3-содержащих реагентов
| Реакция | Теплоты ассоциации | ||
|---|---|---|---|
| 0 | + | – | |
| Au3 + CO → Au3CO | 40.2 | 34.5 | 39.4 |
| Au3CO + O → Au3CO2 | 86.2 | 94.9 | 106.0 |
| Au3CO2 → Au3 + CO2 | –5.9 | –8.4 | –24.9 |
| Au3 + O2 → Au3O2 | 27.8 | 7.5 | 39.9 |
Рис. 3.
Структуры электронейтральных, а также положительно и отрицательно заряженных Au3-содержащих соединений: серые кружки – Au, черные – C, белые – O. Числа – расстояния в Å.

Как следует из данных табл. 1, создание на частице Au3CO как положительного, так и отрицательного заряда приводит к увеличению теплоты ассоциации Au3CO с атомом О. Из таблицы также следует, что для нейтрального и положительно заряженного тримера Au3 теплота адсорбции с СО превышает теплоту адсорбции с О2, а для отрицательно заряженного тримера Au3, наоборот, теплота адсорбции с О2 превышает теплоту адсорбции с СО. Кроме того, расчеты указывают на умеренную эндотермику распада как электронейтрального, так и заряженного СО2-комплекса Au3CO2.
По результатам расчетов предложен механизм, объясняющий увеличение каталитической активности покрытий из НЧ золота при подаче на них электрического напряжения. Подача напряжения приводит к возникновению заряда как на наночастицах золота в покрытии, так и на адсорбированных СО-комплексах. Появление на СО-комплексах заряда увеличивает скорость их окисления до СО2-комплексов за счет увеличения теплоты ассоциации СО-комплексов с атомом кислорода из О2-комплексов или оксидов на поверхности подложки, что продемонстрировано на расчетных примерах ассоциации О с электронейтральным или заряженными СО-комплексами. Увеличение скорости образования СО2-комплексов на заряженных НЧ и последующий их распад приводят в итоге к увеличению скорости образования СО2 на покрытиях из НЧ золота под напряжением.
Больший эффект от подачи положительного напряжения связан с тем, что на положительно заряженных частицах золота теплота адсорбции СО превышает теплоту адсорбции О2, а на отрицательно заряженных НЧ теплота адсорбции О2 превышает теплоту адсорбции СО, что продемонстрировано на расчетных примерах образования положительно или отрицательно заряженных комплексов Au3СО и Au3O2. При этом на положительно заряженных частицах образуются в основном СО-комплексы, а на отрицательно заряженных – О2-комплексы. Это приводит к большему числу СО-комплексов на поверхности положительно заряженных частиц Au, что обеспечивает большую скорость образования СО2-комплексов и последующего выделения СО2 из них при подаче положительного напряжения на покрытия из НЧ золота.
ЗАКЛЮЧЕНИЕ
Экспериментально определено, что подача на покрытие из НЧ золота как положительного, до U = +30 В, так и отрицательного, до U = –30 В, напряжения приводит к увеличению скорости каталитического окисления СО при 430 °С, атмосферном давлении, начальном составе смеси 1.8% СО + 10.2О2 + Ar и начальном размере частиц в покрытии 0.2–3 нм, однако эффект от подачи положительного напряжения превышает эффект от подачи аналогичного отрицательного напряжения.
Установлено, что при последовательном увеличении подаваемого на покрытие положительного или отрицательного напряжения скорость окисления СО вначале растет с ростом напряжения, увеличиваясь на 28% при U = +10 В и на 12% при U = –10 В, а затем плавно снижается до 20% при U = +30 В и 7% при U = –30 В. Предложено объяснение такой волнообразной зависимости конверсии СО от напряжения, связывающее уменьшение промотирующего эффекта напряжения при U > 10 В c уносом из покрытия при U > 10 В малых заряженных НЧ золота размером ~0.3 нм, оптимальным для окисления СО.
Выполнены квантовохимические расчеты теплот адсорбции СО и О2 на простейшем электронейтральном или электрически заряженном кластере золота Au3, а также теплот реакций Au3CO + O → → Au3CO2 и Au3CO2 → Au3 + CO2 при различных зарядах Au3-содержащих комплексов. Расчетами установлено, что, во-первых для электронейтрального и положительно заряженного тримера Au3 теплота адсорбции СО превышает теплоту адсорбции О2, а для отрицательно заряженного тримера Au3 теплота адсорбции О2 превышает теплоту адсорбции СО; во-вторых, создание на частице Au3CO как положительного, так и отрицательного заряда приводит к увеличению теплоты его ассоциации с атомом О; и, в-третьих, распад как электронейтрального, так и заряженного комплекса Au3CO2 происходит с умеренной эндотермикой.
По результатам расчетов предложен механизм, объясняющий увеличение каталитической активности покрытий из НЧ золота при подаче на них электрического напряжения. Подача напряжения приводит к возникновению заряда как на наночастицах золота в покрытии, так и на адсорбированных СО-комплексах. Появление на СО-комплексах заряда увеличивает скорость их окисления до СО2-комплексов за счет увеличения теплоты ассоциации с атомом О из О2-комплексов или оксидов на поверхности подложки. Увеличение скорости образования СО2-комплексов на заряженных частицах приводит и к увеличению скорости образования СО2 вследствие распада комплексов.
Больший эффект от подачи положительного напряжения связан с тем, что на положительно заряженных частицах Au теплота адсорбции СО превышает теплоту адсорбции О2, а на отрицательно заряженных теплота адсорбции О2 превышает теплоту адсорбции СО. Это приводит к появлению большего числа СО-комплексов на поверхности положительно заряженных золотых частиц и, соответственно, большей скорости образования СО2 при подаче положительного напряжения на покрытия из НЧ золота.
Квантовохимические расчеты выполнялись с использованием суперкомпьютерных ресурсов МСЦ РАН.
Работа выполнена в рамках госзадания ФИЦ ХФ РАН по теме 1.1 (регистрационный номер 122040500058-1).
Список литературы
Csere Csaba // Car and Driver. 1988. V. 33. № 7. P. 63.
Kaspar J., Fornasiero P., Graziani M. // Catal. Today. 1999. V. 50. № 2. P. 285.
Brandt E., Wang Y., Grizzle J. // IEEE Trans. Control Syst. Technol. 2000. V. 8. № 5. P. 767.
Алексахин А.В., Кириченко А.С. // Экономика в промышленности. 2013. № 4. С. 3.
Guzman J., Gates B.C. // J. Amer. Chem. Soc. 2004. V. 126. № 2. P. 2672.
Ануфриенко В.Ф., Мороз Б.Л., Ларина Т.В. и др. // ДАН. 2007. Т. 413. № 4. С. 493.
Nikolaev S.A., Golubina E.V., Krotova L.N. et al. // Appl. Catal., B. 2015. V. 168. P. 303.
Takei T., Akira T., Nakamura J. et al. // Adv. Catal. 2012. V. 55. P. 1.
Бухтияров В.И., Слинько М.Г. // Успехи химии. 2001. Т. 70. № 2. С. 167.
Roldan Cuenya B. // Thin Solid Films. 2010. V. 518. № 12. P. 3127.
Гришин М.В., Гатин А.К., Дохликова Н.В. и др. // Кинетика и катализ. 2015. Т. 56. № 4. С. 539.
Эллерт О.Г., Цодиков М.В., Николаев С.А., Новоторцев В.М. // Успехи химии. 2014. Т. 83. № 8. С. 718.
Николаев С.А., Смирнов В.В., Васильков А.Ю., Подшибихин В.Л. // Кинетика и катализ. 2010. Т. 51. № 3. С. 396.
Simakova I.L., Solkina Yu.S., Moroz B.L. et al. // Appl. Catal., A. 2010. V. 385. № 1–2. P. 136.
Roldan Cuenya B., Behafarid F. // Surf. Sci. Rep. 2015. V. 70. № 2. P. 135.
Ланин С.Н., Пичугина Д.А., Шестаков А.Ф. и др. // ЖФХ. 2010. Т. 84. № 12. С. 2330.
Гришин М.В., Гатин А.К., Слуцкий В.Г., Харитонов В.А., Шуб Б.Р. // Хим. физика. 2015. Т. 34. № 7. С. 3.
Гришин М.В., Гатин А.К., Слуцкий В.Г. и др. // Хим. физика. 2020. Т. 39. № 3. С. 29.
Гришин М.В., Гатин А.К., Слуцкий В.Г. и др. // Хим. физика. 2020. Т. 39. № 5. С. 84.
Гришин М.В., Гатин А.К., Слуцкий В.Г. и др. // Хим. физика. 2021. Т. 40. № 6. С. 10.
Гришин М.В., Гатин А.К., Слуцкий В.Г. и др. // Хим. физика. 2021. Т. 40. № 9. С. 3.
Гришин М.В., Гатин А.К., Слуцкий В.Г. и др. // Хим. физика. 2022. Т. 41. № 6. С. 3.
Schubert M., Hakenberg S., Veen A. et al. // J. Catal. 2001. V. 122. P. 9523.
Sankar M., He Q., Engel K. et al. // Chem. Rev. 2020. V. 120. № 8. P. 3890.
Herzing A., Kiely C., Carley A., Landon P., Hutchings G. // Science. 2008. V. 321. P. 1331.
Ozaki T. // Phys. Rev. B. 2003. V. 67. P. 155 108.
Ozaki T., Kino H. // Ibid. 2004. V. 69. P. 195 113.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


