Химическая физика, 2023, T. 42, № 1, стр. 28-34
Структурные группы природных фосфолипидов, участвующие в образовании комплексов с флавоноидами
Л. Н. Шишкина 1, *, М. В. Козлов 1, Т. В. Константинова 1, А. Н. Смирнова 1, В. О. Швыдкий 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: shishkina@sky.chph.ras.ru
Поступила в редакцию 16.02.2022
После доработки 04.04.2022
Принята к публикации 20.04.2022
- EDN: HNJTEF
- DOI: 10.31857/S0207401X23010107
Аннотация
Определены параметры УФ-спектров кверцетина, дигидрокверцетина, генистеина, препаратов природных фосфолипидов и смесей флавоноидов с фосфолипидами в хлороформе путем математической обработки этих спектров по методу Гаусса. Показано, что положение максимума полосы II в УФ-спектрах исследованных флавоноидов не зависит от природы растворителя, а зависимость оптической плотности полос II и I растворов этих флавоноидов от их концентрации подчиняется закону Бугера–Ламберта–Бера. Обнаружено, что параметры УФ-спектров природных липидов существенно зависят от полярности растворителя и состава фосфолипидов. На примере генистеина показано, что флавоноид взаимодействует с сопряженными двойными связями жирных кислот фосфолипидов, а в образовании комплексов участвуют также азот- и фосфорсодержащие группировки фосфолипидов.
Флавоноиды, являющиеся природными полифенолами, широко распространены в растительном мире и пищевых продуктах и характеризуются огромным спектром биологической активности, которую связывают с наличием у них антиоксидантных свойств [1–3]. Показано, что антиоксидантная активность (АОА) любых биологически активных веществ (БАВ) в сложных системах, в том числе и антиоксидантов, зависит от их гидрофобности и способности влиять на структурное состояние биологических мембран [4–6]. Так, флавоноиды могут адсорбироваться в мембранных порах, взаимодействовать с липидами, вызывать перестройку структуры мембран и образовывать комплексы с фосфолипидами (ФЛ) [7–12]. При этом образование комплексов существенно снижает эффективность ингибирования флавоноидов в процессах окисления независимо от скорости зарождения радикалов в системе [8, 13].
Для оценки содержания флавоноидов в растительных объектах, как правило, используют УФ-спектрометрию, осуществляя экстракцию сырья водно-спиртовыми смесями в различных соотношениях и проводя регистрацию УФ-спектров в метаноле или этаноле. Поскольку полярность элюента существенно изменяет как набор БАВ, так и количественное соотношение экстрагируемых фракций ФЛ и АОА выделенных липидов [14, 15], возникает необходимость детального анализа УФ-спектров самих флавоноидов в хлороформе и выявления структурных компонентов ФЛ, принимающих участие в образовании комплексов с флавоноидами.
Цель работы – изучение параметров УФ-спектров кверцетина, дигидрокверцетина, генистеина, препаратов природных липидов с разным количественным соотношением фракций фосфолипидов и их смесей в хлороформе путем математической обработки спектров по методу Гаусса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
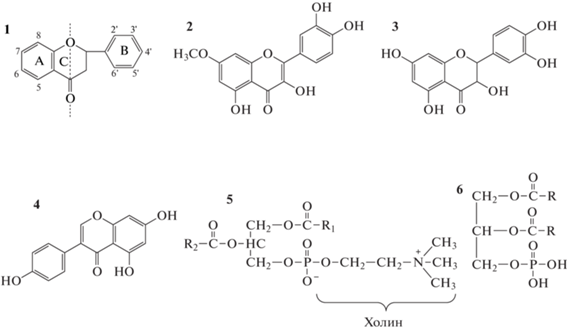
Объектами исследования являлись кверцетин производства компании Sigma-Aldrich (USA), дигидрокверцетин (ДГК), генистеин производства НИЦ “Фармзащита” ФМБА (Россия). В качестве природных ФЛ были взяты два образца соевого лецитина-стандарта в 10%-ном водно-этанольном растворе фирмы “БИОЛЕК” (Харьков) и смесь липидов, выделенных из сердца быка в этаноле, среди ФЛ которых преобладает фосфатидная кислота (ФК). В образцах лецитина среди ФЛ преимущественно содержится фосфатидилхолин (ФХ). Рабочие растворы в хлороформе готовили непосредственно перед экспериментом. Общая формула флавоноидов и структурные формулы использованных в работе препаратов, ФХ и ФК, представлены на рис. 1.
Рис. 1.
Структурные формулы соединений: 1 – общая формула флавоноидов, 2 – кверцетин, 3 – дигидрокверцетин, 4 – генистеин, 5 – фосфатидилхолин, 6 – фосфатидная кислота.
После отгонки исходных растворителей и приготовления растворов природных липидов в хлороформе качественный и количественный состав их ФЛ определяли методом тонкослойной хроматографии, используя силикагель типа H компании Sigma-Aldrich (USA), стеклянные пластинки размером 90 × 120 мм и смесь “хлороформ – метанол – ледяная уксусная кислота – дистиллированная вода” в объемном соотношении 12.5 : 7.5 : 2 : 1 в качестве мобильной фазы [16]. Количественный анализ состава ФЛ после удаления пятен с пластинки и их сжигания до неорганического фосфата (P) хлорной кислотой проводили спектрофотометрически при длине волны λ = 815 нм по образованию фосфорномолибденового комплекса в присутствии аскорбиновой кислоты на спектрофотометре ПЭ-5400ВИ группы компаний “ЭКРОС” (Россия). Для каждой пробы анализировали не менее 4–5 хроматографических дорожек. Подробности методики анализа состава ФЛ представлены в работе [15].
Ультрафиолетовые спектры растворов флавоноидов, липидов и их смесей в хлороформе регистрировали на спектрофотометре UV-1700 PharmaSpec производства компании Shimadzu (Japan) в диапазоне длин волн от 240 до 500 нм в кварцевой кювете толщиной 10 мм. Полученные УФ-спектры подвергали математической обработке по методу Гаусса с разложением их на гауссианы, соблюдая следующие условия: совпадение контура исходного спектра с расчетным после аппроксимации на уровне 1 · 10–4–1 · 10–5.
Экспериментальные данные обрабатывали стандартными статистическими методами, используя программный продукт MS Excel и пакет компьютерных программ KINS [17]. В приведенных ниже таблицах данные представлены в виде средних арифметических значений с указанием их средних квадратичных ошибок (M ± m).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кверцетин и ДГК широко представлены в самых разных растительных объектах, а генистеин является одним из основных флавоноидов сои. Это обусловило выбор данных флавоноидов в качестве объектов исследования. В УФ-спектрах флавоноидов в спиртовых растворах обычно присутствуют две полосы поглощения с максимумами в диапазоне длин волн 240–285 нм (полоса II) и 300–400 нм (полоса I). Поглощение полосы II связывают с наличием в молекуле бензоильной группировки, включающей кольцо A и прилегающую к нему часть кольца C, а поглощение полосы I – с присутствующей в структуре молекул цианомоильной группировкой, включающей кольцо B и прилегающую к нему часть кольца C (рис. 1) [18]. Ультрафиолетовые спектры изученных в работе флавоноидов и их гауссианы приведены на рис. 2–4.
Рис. 2.
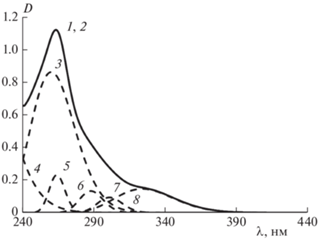
УФ-спектр кверцетина и его гауссианы: 1 и 2 – исходный и расчетный спектры, 3 – 255.9 нм, 4 – 332.6 нм, 5 – 361.4 нм, 6 – 375.6 нм, 7 – 387.3 нм; [Q] = 7.6 · 10–4 моль/л.
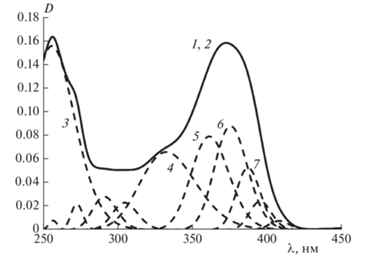
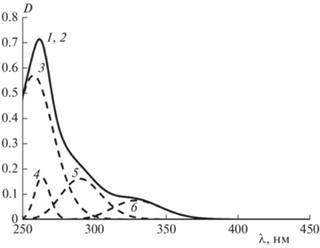
Рис. 3.
УФ-спектр дигидрокверцетина и его гауссианы: 1 и 2 – исходный и расчетный спектры, 3 – 289.6 нм, 4 – 274.0 нм, 5 – 299.6 нм, 6 – 333.3 нм; [QH2] = 1.8 · · 10–4 моль/л.
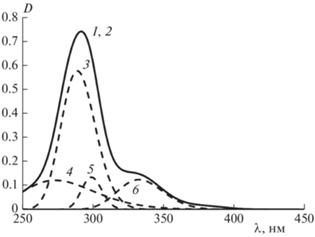
Рис. 4.
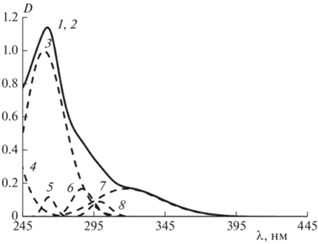
УФ-спектр генистеина и его гауссианы: 1 и 2 – исходный и расчетный спектры, 3 – 258.5 нм, 4 – 264.5 нм, 5 – 291.0 нм, 6 – 329.9 нм; [G] = 1.2 · 10–5 моль/л.
Кверцетин, являющийся самым известным и наиболее изученным флавоноидом, относится к классу флавонолов. В его УФ-спектре в растворе метанола имеются полосы поглощения с максимумами при 255 и 269 нм и два плеча при 301 и 370 нм [18]. В этанольных растворах кверцетина обнаружены три полосы поглощения с максимума при 256, 303 и 328 нм [19]. Общий УФ-спектр раствора кверцетина в хлороформе характеризуется двумя полосами поглощения с максимумами при 256 и (374 ± 0.7) нм (рис. 2).
Можно было ожидать, что близкие по структуре кверцетин и ДГК (флаванонол), различающиеся наличием или отсутствием только одной двойной связи C2–C3 (рис. 1), будут иметь и близкие характеристики УФ-спектров. Однако отсутствие двойной связи C2–C3 в кольце C в молекуле ДГК вызывает существенный батохромный сдвиг максимума полосы II (289.6 нм) и проявление полосы I в виде плеча при (322.0 ± 0.7) нм (рис. 3). Необходимо отметить, что и АОА кверцетина в реакции автоокисления метилолеата в тонком слое в 1.6 раза выше, чем у ДГК [3].
Генистеин является одним из представителей изофлавонов. В УФ-спектрах его раствора в метаноле максимум полосы поглощения II проявляется при 261 нм и имеется плечо при 328 нм [18]. В УФ-спектрах генистеина в хлороформе максимум полосы поглощения II наблюдается при 263 нм, а плечо немного сдвигается в область меньших длин волн – к (321.5 ± 1.5) нм (рис. 4). Таким образом, на положение максимума полосы II в УФ-спектрах флавоноидов более сильное влияние оказывает структура молекулы, а не полярность растворителя.
Для изучения механизма взаимодействия флавоноидов с ФЛ необходимо проанализировать зависимость оптической плотности максимумов полос поглощения от их концентрации. Данные, представленные на рис. 5 и 6, свидетельствуют о том, что зависимость оптической плотности D в максимумах обеих полос поглощения всех изученных в работе флавоноидов от концентрации последних четко следует закону Бугера–Ламберта–Бера с коэффициентами корреляции R = 0.996–1.0. Рассчитанные величины коэффициентов молярной экстинкции (ε) приведены в табл. 1. Из этих данных следует, что самое большое значение ε растворов флавоноидов в хлороформе для полосы II наблюдается у ДГК, а для полосы I – у кверцетина.
Рис. 5.
Зависимость оптической плотности D максимума полосы поглощения II от концентрации флавоноидов: 1 – кверцетин, 2 – дигидрокверцетин, 3 – генистеин.
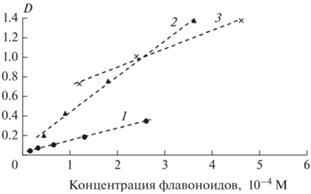
Рис. 6.
Зависимость оптической плотности максимума полосы поглощения I от концентрации флавоноидов. Обозначения те же, что и на рис. 5.
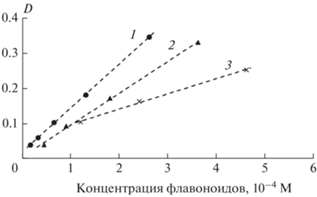
Таблица 1.
Величины коэффициентов молярной экстинкции (ε) максимумов полос поглощения флавоноидов в растворе хлороформа
| Флавоноид | ε полосы II, л · моль–1 · см–1 | ε полосы I, л · моль–1 · см–1 |
|---|---|---|
| Кверцетин | 1235 ± 15 | 1255 ± 10 |
| Дигидрокверцетин | 3630 ± 35 | 910 ± 10 |
| Генистеин | 1870 ± 20 | 555 ± 5 |
Математическая обработка УФ-спектров с использованием метода Гаусса позволила выявить как общность, так и существенные различия в тонкой структуре спектров. Наиболее интенсивной у всех флавоноидов является полоса поглощения II, но относительно исходного спектра величина ее максимума несколько смещается в сторону меньших длин волн у генистеина и ДГК и практически не изменяется у кверцетина. Максимум полосы поглощения I проявляется при большей длине волны у кверцетина и ДГК, но его значение сдвигается в сторону существенно меньших длин волн у генистеина. Самое большое число полос поглощения при разложении вывялено в УФ-спектре кверцетина (рис. 2), в то время как в УФ-спектрах ДГК (рис. 3) и генистеина (рис. 4) их значительно меньше.
Следующим этапом работы стало изучение УФ-спектров растворов природных липидов в хлороформе, данные о которых в литературе практически отсутствуют, что обусловлено сложностью состава липидов и большим набором молекулярных видов фракций ФЛ в природных объектах. В работе были использованы два образца лецитина, различающиеся как долей ФЛ в составе общих липидов: (42.7 ± 1.6)%, n = 8 и (64.8 ± 5.0), n = 6 для образцов № 1 и № 2, соответственно, так и количественным соотношением фракций ФЛ (табл. 2).
Таблица 2.
Количественное соотношение (P) фракций фосфолипидов в природных препаратах
| Фракция фосфолипидов | P, % | ||
|---|---|---|---|
| образец лецитина № 1 | образец лецитина №2 | липиды из сердца быка | |
| Лизоформы ФЛ | 3.71 ± 0.21 | 2.79 ± 0.21 | − |
| СЛ | 4.19 ± 0.19 | 4.34 ± 0.06 | − |
| ФХ | 88.7 ± 0.8 | 84.55 ± 0.60 | 5.75 ± 1.30 |
| ФИ + ФС | 1.18 ± 0.12 | 2.29 ± 0.23 | − |
| ФЭ | 0.93 ± 0.41 | 1.84 ± 0.25 | 2.90 ± 0.29 |
| КЛ | 0.04 ± 0.005 | 2.93 ± 0.48 | 10.90 ± 0.50 |
| ФК | 1.23 ± 0.06 | 1.25 ± 0.16 | 80.45 ± 1.10 |
В УФ-спектрах растворов лецитина в гексане и дистиллированной воде ранее было выявлено три полосы поглощения с максимумами в областях 195–200, 225–230 и 280–285 нм, обусловленных наличием в составе ФЛ лецитина сложных эфиров и несопряженных двойных связей, сопряженных двойных связей и кетодиенов соответственно [20, 21]. Анализ результатов обработки УФ-спектров раствора лецитина в хлороформе (табл. 3) свидетельствует о существенном влиянии природы растворителя и состава ФЛ лецитина на их характеристики.
Таблица 3.
Длины волн λ (в нм) и оптическая плотность (D) максимумов полос поглощения УФ-спектров растворов природных липидов в хлороформе
| Природные липиды | λ/D |
|---|---|
| Лецитин, образец № 1 Лецитин, образец № 2 Липиды из сердца быка |
249/0.167 253/0.335 269/0.167 284/0.122 218/0.195 241/0.143 244/0.219 284/0.052 231//0.623 259/0.075 283/0.099 307/0.073 |
Во-первых, независимо от состава ФЛ и полярности растворителя только для кетодиенов выявлено совпадение максимумов полос поглощения для всех изученных образцов природных липидов.
Во-вторых, наличие в составе ФЛ более высокой доли фракций, содержащих преимущественно насыщенные жирные кислоты (лизоформы ФЛ, СЛ и ФХ), вызывает батохромный сдвиг максимумов полос поглощения в их УФ-спектрах.
В-третьих, в УФ-спектрах смеси липидов из сердца быка, в составе ФЛ которой преимущественно присутствуют наиболее легкоокисляемые фракции КЛ и ФК (табл. 2), выявлен интенсивный максимум полосы поглощения в области длин волн сопряженных двойных связей (230 нм). Необходимо также отметить следующее: при наличии в составе ФЛ лецитина высокой доли азотсодержащих фракций (СЛ, ФХ, ФС и ФЭ) в их УФ-спектрах выявлены полосы поглощения с максимумами в диапазоне длин волн 240–255 нм, а присутствие в смеси природных ФЛ более 90% только фосфорсодержащих фракций обуславливает появление полосы поглощения с максимумом при 307 нм. Кроме того, при двукратном уменьшении концентрации лецитина (образец № 1) в его УФ-спектрах наблюдается падение интенсивности максимумов полос поглощения при 249 и 284 нм в 2.2–2.25 раза. Это позволяет предполагать, что и для растворов природных липидов в хлороформе соблюдается линейная зависимость их оптической плотности от концентрации.
Для выявления структурных группировок ФЛ, участвующих в образовании комплексов с флавоноидами, были исследованы УФ-спектры смесей генестеина с лецитином (образец № 2) и смесью природных липидов из сердца быка (рис. 7 и 8). Как видно из этих данных, наблюдаются сдвиг максимумов и/или исчезновение ряда полос поглощения в спектрах ФЛ, существенный рост интенсивности полосы II генистеина и появление новых максимумов в области длин волн 315–325 нм. Это соответствует литературным данным о способности флавоноидов образовывать комплексы с ФЛ и встраиваться в фосфолипидный бислой мембран [8–12].
ЗАКЛЮЧЕНИЕ
Таким образом, положение максимума полосы поглощения II в УФ-спектрах флавоноидов практически не зависит от полярности растворителя и определяется строением их молекулы. Зависимость оптической плотности максимумов полос поглощения I и II от концентрации флавоноидов четко следует закону Бугера–Ламберта–Бера, что важно для выявления их способности образовывать комплексы с ФЛ. Параметры УФ-спектров растворов природных липидов в хлороформе существенно отличаются от ранее полученных в растворе гексана и дистиллированной воды [20, 21] и обусловлены набором ФЛ в их составе. Экспериментальные данные, полученные на примере лецитина, позволяют предположить, что оптическая плотность их растворов в хлороформе тоже линейно зависит от концентрации.
Выявление способности структурных компонентов ФЛ образовывать комплексы с фланоноидами, проведенное на примере смесей генистеина с лецитином или смесью природных липидов из сердца быка, путем математической обработки спектров по методу Гаусса, позволило сделать следующие заключения. Образование комплекса подтверждается как сдвигами максимумов полос поглощения или существенными изменениями их оптической плотности, так и исчезновением или появлением дополнительных полос поглощения. Значительный рост интенсивности полосы II генистеина и изменение параметров УФ-спектров лецитина и смеси природных липидов в области длин волн сопряженных двойных связей и кетодиенов (280–285 нм) свидетельствует о проникновении генистеина в гидрофобный бислой ФЛ и образовании рафтов, что было показано ранее для других флавоноидов и с использованием других модельных систем [9, 10, 12]. Анализ характеристик УФ-спектров природных липидов в зависимости от их состава позволяет предположить, что исчезновение максимумов полос поглощения в УФ-спектрах смесей генистеина с лецитином и появление дополнительной полосы поглощения в УФ-спектре его смеси с природными липидами из сердца быка при 318.5 нм обусловлено участием азот- и фосфорсодержащих фрагментов ФЛ в образовании комплекса с генистеином.
Работа выполнена в рамках госзадания Института биохимической физики им. Н.М. Эмануэля РАН по теме 44.4 (регистрационный номер 0084-2019-0014).
Список литературы
Тараховский Ю.С., Ким Ю.А., Абдрасилов Б.С., Музафаров Е.Н. Флавоноиды: биохимия, биофизика, медицина. Пущино: Synchrobook, 2013.
Семенов А.А., Карцев В.Г. Биологическая активность природных соединений. М.: Международный благотворительный фонд “Научное Партнерство”, 2012.
Mazaletskaya L.I., Sheludchenko N.I., Shishkina L.N. // Chemical Reactions in Gas, Liquid and Soil Phases: Synthesis Properties and Application / Eds. Zaikov G.E., Kozlowski R.M. N.Y.: NSP, 2012. P. 11–20.
Кривандин А.В., Фаткуллина Л.Д., Шаталова О.В. и др. // Хим. физика. 2013. Т. 32. № 5. С. 91; https://doi.org/10.7868/S0207401X13050075
Жигачева И.В., Бинюков В.И., Русина И.Ф. и др. // Хим. физика. 2020. Т. 39. № 7. С. 41; https://doi.org/10.31857/S0207401X20070122
Русина И.Ф., Вепринцев Т.Д., Васильев Р.Ф. // Хим. физика. 2022. Т. 41 № 2. С. 12; https://doi.org/10.31857/S0207401X22020108
Xu K., Liu B., Ma Yu. et al. // Molecules. 2009. V. 14. P. 3486.
Мазалецкая Л.И., Шелудченко Н.И., Шишкина Л.Н. // Прикл. биохимия и микробиол. 2010. Т. 46. № 2. С. 148.
Tarahovsky Yu.S., Muzafarov E.N., Kim Yu.A. // Mol. Cell. Biochem. 2008. V. 314. P. 65; https://doi.org/10.1007/s11010-008-9766-9
Остроумова О.С., Ефимова С.С., Щагина Л.В. // Биофизика. 2013. Т. 58. № 3. С. 474.
Rich G.T., Buchweitz M., Winterbone M.S. et al. // Nutrients. 2017. V. 9 https:// doi.org/https://doi.org/10.3390/nu9020111
Leite N.B., Martin D.B., Alvares D.S. et al. // Chem. Phys. Lipids. 2022. V. 242. 105160; https://doi.org/10/1016/j.chemphyslip.2021.105160
Mazaletskaya L., Sheludchenko N., Shishkina L. // Chem. and Chem. Technol. 2012. V. 6. № 1. P. 35.
Шишкина Л.Н., Мазалецкая Л.И., Смирнова А.Н., Швыдкий В.О. // Биофизика. 2021. Т. 66. № 3. С. 482.
Смирнова А.Н., Швыдкий В.О., Шишкина Л.Н. // Хим. физика. 2021. Т. 40. № 7. С. 43.
Биологические мембраны: методы / Под ред. Финдлея Дж. Б.С., Эванза В.Х. М.: Мир, 1990.
Брин Э.Ф., Травин С.О. // Хим. физика. 1991. Т.10. № 6. С. 830.
Markham K.N., Merby T.J. // The Flavonoids. Boston: Springler, 1975. P. 45.
Георгиевский В.Г., Рыбаченко А.И., Казаков А.Л. Физико-химические и аналитические характеристики флавоноидных соединений. Ростов н/Д.: Ростовский гос. ун-т, 1988.
Маракулина К.М., Крамор Р.В., Луканина Ю.К. и др. // ЖФХ. 2016. Т. 90. № 2. С. 182.
Шишкина Л.Н., Козлов М.В., Повх А.Ю., Швыдкий В.О. // Хим. физика. 2021. Т. 40. № 9. С. 57.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика