Химическая физика, 2022, T. 41, № 5, стр. 101-16
Масс-спектрометрическое исследование реакции атома фтора и монохлоруксусной кислоты
Е. С. Васильев 1, *, Г. В. Карпов 1, Д. К. Шартава 2, И. И. Морозов 1, С. В. Савилов 3, О. С. Морозова 1, П. С. Хомякова 1, 4
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Миланский технический университет
Милан, Италия
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
4 Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
* E-mail: vasiliev@chph.ras.ru
Поступила в редакцию 10.01.2022
После доработки 18.01.2022
Принята к публикации 20.01.2022
- EDN: HSYNUP
- DOI: 10.31857/S0207401X22050119
Аннотация
С использованием проточного реактора низкого давления изучены кинетические закономерности реакции атомарного фтора с монохлоруксусной кислотой при температуре T = 293 K. Контроль концентраций реагентов осуществляли методом молекулярно-пучковой масс-спектрометрии, детектируя молекулярные пики веществ. С привличением литературных данных рассчитано значение константы скорости реакции $k = (9.6 \pm 3.8) \cdot {{10}^{{ - 11}}}$ см3 · молекул–1 · с–1, которое представляет собой среднее значение, определенное при сравнении с константами скорости конкурирующих реакций (kref). Для двух конкурирующих реакций: атома фтора с 2-фторэтанолом и атома фтора с циклогексаном определены отношения констант скорости k/kref, равные 0.99 ± 0.12 и 0.75 ± 0.04 соответственно. Проведено сравнение константы скорости реакции атомарного фтора с монохлоруксусной кислотой с константами скорости реакций атомарного фтора с хлорзамещенными уксусными кислотами: дихлоруксусной и трихлоруксусной.
ВВЕДЕНИЕ
Галогенированные уксусные кислоты широко распространены в окружающей среде и обнаружены в атмосферном воздухе, дождевой воде, почве, поверхностных и грунтовых водах, природных водоемах. Монохлоруксусная кислота (МХУК) представляет собой сильную кислоту с константой кислотности pKa (298.15 K) = 2.851 [1].
В работе [2] были измерены константы Генри (KH) для ряда галогенуксусных кислот (haloaceticacid). Для МХУК при комнатной температуре было установлено значение ln(KH[298.15 K], моль · кг–1 · · атм–1) = 11.59 ± 0.14. Проведенный расчет показал, что при высоком значении константы для атмосферных условий распределение между газовой и жидкой фазами таково, что кислота находится в основном в жидкой фазе с характерной для облаков концентрацией, равной 0.05–1 г/м–3 и удаляется из атмосферы с дождем. В образцах дождевой влаги среди галогенированных органических кислот наиболее распространены хлорированные уксусные кислоты [3]. В дождевой воде обнаружены и монохлоруксусная (МХУК) и дихлоруксусная и трихлоруксусная (ТХК) кислоты с максимальными концентрациями МХУК в летние месяцы масштаба 1–2 мкг/л [4]. Дальнейшая судьба кислоты, выпадающей в осадках на поверхность земли и растительный покров, связана с распределением ее между почвой, водами (почвенными, грунтовыми, речными, озерными и т.д.) и растительностью.
Настоящая работа связана с измерением константы скорости реакции атома фтора с монохлоруксусной кислотой (МХУК) при комнатной температуре (293 K). При лабораторном изучении атмосферной химии реакция с атомом фтора представляет собой удобный искусственный источник для формирования радикалов, образующихся в атмосфере в процессе окисления МХУК. Знание точных кинетических параметров реакций позволяет планировать эксперимент. Для измерения константы скорости был применен метод конкурирующих реакций, для контроля концентрации реагентов использовали масс-спектральную методику.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспериментальная аппаратура и методика кинетических измерений подробно описаны в ранней публикации авторов [5]. Там же приведены данные кинетической реакции атомарного фтора и трихлоруксусной кислоты. Эксперименты выполняли, используя проточный реактор низкого давления 1–4 (рис. 1), соединенный с масс-спектрометром 7–9. Вдоль оси реактора располагалась трубка-инжектор 1, по которой в реактор подавали газовую смесь, состоящую из МХУК и реагента конкурирующей реакции – 2-фторэтанола или циклогексана. МХУК вводили в реактор, пропуская поток гелия через U-образную трубку, имевшую фритту из спекшегося измельченного стекла, на которую насыпали кристаллы МХУК. 2-Фторэтанол или циклогексан подавали из колб, содержащих смеси 1.5 и 3.2% вещества с гелием, соответственно, при давлении 0.5–0.9 бар. Поток смеси реагента конкурирующей реакции с гелием смешивали с потоком гелия, содержавшим МХУК, при низком давлении в области входа в реактор трубки-инжектора. По трубке реактора 4 протекал регулируемый поток инертного газа-носителя гелия в смеси с атомами фтора. Атомы фтора получали при пропускании через высокочастотный разряд 2 газовой смеси F2 и He (избыток He более 99%). Типичная скорость газового потока в реакторе составляла ~3 м/с, общее давление в реакторе – 1.0 мбар.
Рис. 1.
Схема экспериментальной установки. Проточный реактор с масс-спектрометром: 1 – подвижный инжектор, 2 – электроды ВЧ-разряда на линии подачи молекулярного фтора в смеси с гелием, 3 – термостатируемая “рубашка”, 4 – зона реакции, 5 – система молекулярного напуска, 6 – модулятор пучка, 7 – ионный источник, 8 – электроды квадрупольного масс-спектрометра, 9 – ВЭУ, 10 – синхронный детектор, 11 – компьютер.
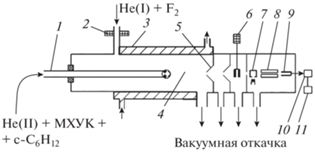
Концентрации веществ в реакторе рассчитывали по результатам измерений потоков газовых смесей 2-фторэтанола, циклогексана и молекулярного фтора и сравнения этих потоков с потоком газа-носителя. Массовый расход газа в потоках смесей определяли по скорости падения давления при истечении газов из калиброванного объема. В опыте концентрации фторэтанола и циклогексана в реакторе меняли в диапазоне от 10 до 30 и молекулярного фтора – от 10 до 15 ед. (1 ед. = 1012 молекул · см–3). Степень диссоциации фтора составляла 97%, что для концентрации атомов дает верхнюю границу – 3 · 1013 атом · см–3. Регулировку и стабилизацию потока газа-носителя осуществляли с помощью расходомера Mass Flow Controller, тип 1160 B (MKS Instruments, США). Давление в реакторе измеряли мембранным манометром Baratron, тип 122A (MKS Instruments, США). Отбор пробы из реакционной зоны в масс-спектрометр осуществляли в форме модулированного молекулярного пучка. Система формирования молекулярного пучка состояла из сопла и сепаратора 5. Пучок модулировали в камере между сепаратором и входной диафрагмой ионного источника масс-спектрометра 6. Для достижения вакуума между соплом и входной диафрагмой использовали паромасляные диффузионные насосы. Для ионизации применили метод электронного удара с энергией ионизирующих электронов 70 эВ.
В качестве фильтра масс использовался квадрупольный масс-спектрометр (7, 8) МС7303 (Россия). После разделения по массам ионы регистрировали с помощью вторичного электронного умножителя 9. Система регистрации включала в себя синхронный детектор 10 модели 124A (Princeton Applied Research, США) и компьютер 11. Предел детектирования фторэтанола и циклогексана составлял ~1010 молекул · см–3 при накоплении сигнала в течение 300 с. В опытах использовали: гелий высокой чистоты марки “Б” (99.99%), монохлоруксусную кислоту (99%; Sigma-Aldrich), циклогексан (99%; Sigma-Aldrich), 2-фторэтанол (95%; Sigma-Aldrich); F2 (98%; 5% в He).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследование реакции CH2ClC(O)OH с атомарным фтором
при комнатной температуре состояло из двух этапов, в которых было проведено сравнение скорости исследуемой реакции со скоростями двух конкурирующих реакций, у которых известны данные кинетики. Для сравнения реакционной способности хлоруксусных кислот были выбраны те же конкурирующие реакции, что и при исследовании реакций атома фтора с дихлоруксусной и трихлоруксусной кислотами [5, 6], а именно: F + + CH2FCH2OH, F + c-C6H12.1. Измерение масс-спектра МХУК
В предварительных опытах перед началом кинетического эксперимента проведено измерение масс-спектра МХУК, полученного с помощью метода электронного удара (M = 94 а.е.м.), а также выполнено сравнение полученного спектра со спектром, известным по базе данных NIST [7]. Спектр получен при энергии ионизации электронов 70 эВ. Напуск вещества в смеси с гелием в ионный источник масс-спектрометра осуществляли из реактора в форме молекулярного пучка, что обеспечивало минимальное влияние гетерогенных процессов на стенках электродов ионного источника на характер спектра. Вещество при комнатной температуре представляло собой некрупные кристаллы (размером 1–2 мм) с достаточно низким давлением паровой фазы (~0.1 Торр). Вещество подавали в проточный реактор, пропуская гелий через U-образную трубку, имевшую стеклянную фритту, на которую насыпали кристаллы МХУК, предварительно измельчив их в фарфоровой ступке. Масс-спектр представлен в графическом виде на рис. 2 для диапазона m/z = = 30–100, в котором расположена основная часть интенсивных пиков. Представлены спектры наиболее интенсивных пиков (с интенсивностью более 1% от высоты основного пика при m/z = 50).
Рис. 2.
Масс-спектры интенсивных пиков МХУК (с интенсивностью более 1% от высоты пика при m/z = = 50) в диапазоне m/z = 30–100: эксперимент – спектр, полученный в настоящей работе; NIST – спектр из базы данных NIST.
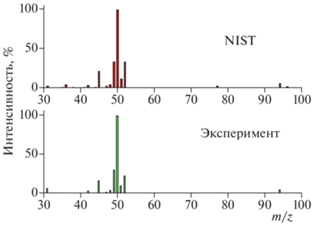
Отметим, что в спектре имеется молекулярный пик при m/z = 94 c существенной интенсивностью, которая по данным нашего эксперимента составляет 5.9% от высоты основного пика. Это позволило в ходе эксперимента осуществлять контроль концентрации МХУК по молекулярному пику. Спектры в области m/z = 45–52, в которой располагаются пики с интенсивностью более 10%, имеют небольшие отличия: спектр, измеренный нами, отличается от спектра по данным NIST не более чем на 30%. Также заметим, что слабые по интенсивности пики спектра при m/z = 36 (HCl+) и m/z = 38 (H37Cl+) существенно отличаются. Как и в случаях с трихлоруксусной и дихлоруксусной кислотами, масс-спектр МХУК по данным NIST имеет заметно более интенсивный пик при m/z = 36, рост которого можно объяснить пиролизом МХУК на поверхности электродов ионного источника масс-спектрометра. Последующая ионизация вероятного продукта пиролиза HCl приводит к росту интенсивности пика при m/z = 36.
2. Измерение константы скорости реакции атома фтора с МХУК. Конкурирующая реакция – реакция атомов фтора с 2-фторэтанолом
Константу скорости k1 определяли в экспериментах, где конкурирующей реакцией выступала реакция
(2)
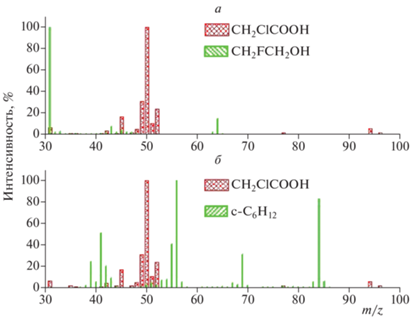
${\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{FC}}{{{\text{H}}}_{{\text{2}}}}{\text{OH}} + {\text{F}} \to Продукты.$Для определения масс-спектральных пиков, пригодных для мониторинга концентраций реагентов, были проанализированы спектры МХУК и CH2FCH2OH. На рис. 3а представлены масс-спектры в диапазоне масс 30–100 а.е.м., каждый из которых нормирован на 100% по наиболее интенсивному пику спектра – при m/z = 50 и 31 для МХУК и CH2FCH2OH соответственно. Видно, что молекулярный пик каждого реагента (кислоты при m/z = 94 и спирта при m/z = 64) имеет достаточную интенсивность (высота пика при m/z = 94 составляет 5.9%, а пика при m/z = 64 – 14.2%) и не имеет пересечения с осколочными пиками спектра другого реагента. Это позволило проводить контроль концентрации реагентов по их молекулярным пикам.
Рис. 3.
Масс-спектры в диапазоне масс 30–100 а.е.м., нормированные на 100% по наиболее интенсивным пикам спектров: а – МХУК и CH2FCH2OH нормированы по m/z = 50 и m/z = 31 соответственно; б – для МХУК и циклогексана нормированы по m/z = 50 и m/z = 56 соответственно. Масс-спектры кислоты и циклогексана – согласно нашим данным, спектр спирта CH2FCH2OH – согласно данным NIST.
Результат измерений глубины превращения реагента МХУК по отношению к глубине превращения 2-фторэтанола представлен на рис. 4. Результаты получены при изменении концентрации 2-фторэтанола в реакционной смеси. Отношение констант k1/k2= (k1/kref)exp определено из наклона прямой линии, полученного в результате линейного регрессионного анализа:
(3)
${{\ln ({{{{{[{\text{МХУК]}}}}_{0}}} \mathord{\left/ {\vphantom {{{{{[{\text{МХУК]}}}}_{0}}} {[{\text{МХУК}}]}}} \right. \kern-0em} {[{\text{МХУК}}]}})} \mathord{\left/ {\vphantom {{\ln ({{{{{[{\text{МХУК]}}}}_{0}}} \mathord{\left/ {\vphantom {{{{{[{\text{МХУК]}}}}_{0}}} {[{\text{МХУК}}]}}} \right. \kern-0em} {[{\text{МХУК}}]}})} {\ln ({{{{{[{\text{REF}}]}}_{0}}} \mathord{\left/ {\vphantom {{{{{[{\text{REF}}]}}_{0}}} {[{\text{REF}}]}}} \right. \kern-0em} {[{\text{REF}}]}})}}} \right. \kern-0em} {\ln ({{{{{[{\text{REF}}]}}_{0}}} \mathord{\left/ {\vphantom {{{{{[{\text{REF}}]}}_{0}}} {[{\text{REF}}]}}} \right. \kern-0em} {[{\text{REF}}]}})}} = {{({{{{k}_{1}}} \mathord{\left/ {\vphantom {{{{k}_{1}}} {{{k}_{{ref}}}}}} \right. \kern-0em} {{{k}_{{ref}}}}})}_{{exp}}},$(4)
${{k}_{1}} = {{({{{{k}_{1}}} \mathord{\left/ {\vphantom {{{{k}_{1}}} {{{k}_{{ref}}}}}} \right. \kern-0em} {{{k}_{{ref}}}}})}_{{exp}}}{{k}_{{ref}}}.$Рис. 4.
Зависимость глубины превращения МХУК по отношению к глубине превращения 2-фторэтанола в реакциях с атомом фтора, полученная в эксперименте при комнатной температуре; k1/k4 = 0.99 ± 0.12.
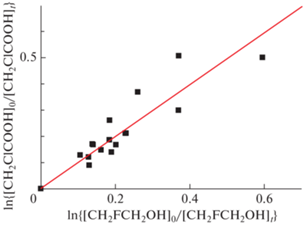
В нашем случае [REF]0 = [CH2FCH2OH]0 и [REF] = [CH2FCH2OH], kref = k2. Показано, что глубины превращения реагентов и, следовательно, константы скорости реакций (1) и (2) практически равны. Отношение k1/k2 = 0.99 ± 0.12.
Значение константы скорости конкурирующей реакции (2) представлено нами ранее в работе [8], где методом конкурирующих реакций были установлены отношения констант скорости реакции (2) и реакций
(5)
${\text{C}}{{{\text{H}}}_{4}} + {\text{F}}\xrightarrow{{{{k}_{5}}}}{\text{C}}{{{\text{H}}}_{3}} + {\text{HF}}$(6)
${\text{c - }}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{12}}} + {\text{F}}\xrightarrow{{{{k}_{6}}}}{\text{c - }}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{11}}} + {\text{HF}}.$Так, эти отношения составили k2/k5 = 2.37 и k2/k6 = = 0.69 соответственно. Величина k2 = (1.38 ± 0.48) · · 10–10 см3 · молекула–1 · с–1. Других данных о значении k2 в доступной авторам литературе не найдено. Нами была проведена “ревизия” величины k2, основанная на современных данных констант скорости реакций (5) и (6). В настоящее время рекомендуемое значение k5 = 6.3 · 10–11 см3 · молекул–1 · с–1 [9], а оценка погрешности, нами в работе [5], составила 18%. На основании этих данных и установленного отношения k2/k5 можно рассчитать значение k2 = (1.49 ± 0.27) · 10–10 см3 молекул–1 · с–1.
Значение константы скорости k6 рассчитывали как среднюю величину по доступным литературным данным, которые не имеют существенных расхождений. Как будет показано ниже, k6 = (1.16 ± ± 0.21) · 10–10 см3 · молекул–1 · с–1. Соответственно комбинирование значений k2/k6 = 0.69 и k6 дает в результате k2 = (8.02 ± 1.44) · 10–11 см3 · молекул–1 · с–1. Скорректированное значение k2 представляет собой среднее значение, которое составляет k2 = = (1.15 ± 0.49) · 10–10 см3 · молекул–1 · с–1.
Комбинируя полученное в опытах отношение k1/k2 = 0.99 ± 0.12 с величиной константы скорости конкурирующей реакции k2, получаем k1 (293 K) = = (1.14 ± 0.5) · 10–10 см3 · молекул–1 · с–1. Значение k1 получено со значительной погрешностью, что связано с существенной ошибкой константы скорости конкурирующей реакции. Это послужило одной из причин дальнейшей работы, в которой использовалась другая конкурирующая реакция.
3. Измерение константы скорости реакции атома фтора с МХУК. Конкурирующая реакция – реакция атомов фтора с циклогексаном
Константу скорости k1 определяли также в эксперименте, где конкурирующей реакцией выступала реакция (6). Были проанализированы масс-спектры. На рис. 3б представлены спектры МХУК и циклогексана в диапазоне масс 30–100 а.е.м., каждый из которых нормирован на 100% по наиболее интенсивному пику соответствующего спектра. В этом случае молекулярный пик каждого реагента также имеет достаточную интенсивность (интенсивность пика кислоты при m/z 94 – 5.9%, а циклогексана при m/z 84 – 82.1%) и не имеет пересечения с осколочными пиками спектра другого реагента, что позволило контролировать концентрации реагентов по их молекулярным пикам.
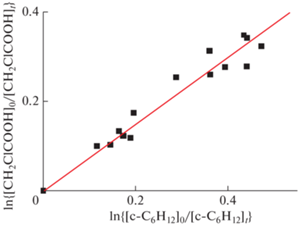
Результат измерений глубины превращения МХУК по отношению к глубине превращения циклогексана представлен на рис. 5. Результаты получены при изменении в реакционной смеси концентрации циклогексана. Отношение констант k1/k6 определено из наклона прямой линии, полученной в результате линейной регрессии, при подгонке согласно уравнению (3). В этом случае [REF]0 = [c-C6H12]0 и [REF] = [c-C6H12], kref = k6. В опытах было установлено, что глубина превращения МХУК меньше глубины превращения циклогексана. Отношение k1/k6 = 0.75 ± 0.04.
Рис. 5.
Зависимость глубины превращения МХУК по отношению к глубине превращения циклогексана в реакциях с атомом фтора, полученная в эксперименте при комнатной температуре; k1/k4 = 0.75 ± 0.04.
Для кинетики реакции (6) в литературе имеется сравнительно небольшое количество экспериментальных данных, и все они получены при комнатной температуре. В работе [10] были получены данные прямых измерений k6 = (1.31 ± 0.39) · · 10–10 см3 · молекул–1 · с–1. Позднее в работах [11, 12] были определены величины k6 в экспериментах с непрямым измерением константы скорости, где исследовалась реакция
(7)
${\text{F}} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{6}}\xrightarrow{{{{k}_{7}}}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{5}} + {\text{HF}}.$В результате были получены отношения: k6/k5 = = 4.3 ± 0.6 и k6/k7 = 0.71 ± 0.07.
В работе [5] проведен анализ известных данных для реакций (5) и (7) и предложены следующие значения констант: k5 = (6.3 ± 1.1) · 10–11 см3 · · молекул–1 · с–1 и k7 = (1.43 ± 0.72) · 10–10 см3 · молекул–1 · с–1. На основании этих данных можно рассчитать значения k6: (2.7 ± 0.6) · 10–10 см3 · молекул–1 · с–1 и (1.02 ± 0.52) · 10–10 см3 · молекул–1 · с–1 соответственно. Видно, что имеющиеся данные существенно различаются, поэтому для расчета k1 были использованы лишь два значения k6, различие между которыми не превышает величину суммарной погрешности. Первое значение получено по данным прямых измерений: (1.31 ± 0.39) · 10–10 см3 · · молекул–1 · с–1 [10], а второе, (1.02 ± 0.52) · 10–10 см3 · · молекул–1 · с–1, рассчитано на основании данных измерения отношения констант скорости k6/k7 [12].
Комбинируя значение k1/k6 из опыта с двумя известными величинами k6, полученными при анализе имеющихся литературных данных, получаем для k1 два рассчитанных значения: (9.8 ± 3.0) · · 10–11 см3 · молекул–1 · с–1 и (7.6 ± 3.9) · 10–11 см3 · · молекул–1 · с–1. Значение k1 определено со значительной погрешностью, которая связана с низкой точностью известных констант скорости основных референсных реакций (6) и (7).
В экспериментах с 2-фторэтанолом и циклогексаном определены три независимых значения k1(293 K): (11.4 ± 5.0) · 10–11, (9.8 ± 3.0) · 10–11 и (7.6 ± ± 3.9) · 10–11 см3 · молекул–1 · с–1. Минимальное значение от максимального отличается на 33%. В результате была рассчитана средняя величина, которая составила (9.6 ± 3.8) · 10–11 см3 · молекул–1 · с–1. Константы скорости, полученные в опытах с 2‑фторэтанолом и циклогексаном, можно представить в виде отношения 1 : 0.86 (k1 (REF = = CH2FCH2OH): k1(REF = c-C6H12)). Значительная погрешность средней величины связана как с различием значений константы скорости конкурирующей реакции (6), так и с систематическими ошибками при определении констант скорости конкурирующих реакций (2) и (6). Последнее подтверждается тем, что ранее при исследовании реакций атомарного фтора с другими хлоруксусными кислотами в реакционных схемах с 2-фторэтанолом и циклогексаном (см. табл. 1) для констант скорости были получены отношения 1 : 0.95 и 1 : 0.73 для дихлоруксусной и трихлоруксусной кислоты соответственно. Таким образом, полученные при сравнении константы скорости в реакции с участием c-C6H12 систематически меньше тех, которые получены в реакции с участием CH2FCH2OH.
Таблица 1.
Константы скорости реакций атомов фтора с хлоруксусными кислотами (CCl3COOH, CHCl2COOH, CH2ClCOOH), полученные в экспериментах с рядом конкурирующих реакций; указаны пики масс-спектров, на которых регистрировались изменения концентраций веществ в ходе реакций
| Реакция | Реагент конкурирующей реакции | k/kref | k, 10–11 см3 · молекул–1 · с–1 | Пики масс-спектров* |
|---|---|---|---|---|
| F + CCl3COOH | CH3CCl3 | 7.4 ± 1.2 | 5.0 ± 1.4 | m/z = 45 (COOH+); m/z = 97 (CH3C${\text{Cl}}_{2}^{ + }$) |
| C2H5OH | 0.24 ± 0.02 | 3.7 ± 1.9 | m/z = 83 (CH${\text{Cl}}_{2}^{ + }$); m/z = 46 (M+) | |
| CH2FCH2OH | 0.34 ± 0.04 | 5.1 ± 1.9 | m/z = 45 (COOH+); m/z = 64 (M+) | |
| c-C6H12 | 0.28 ± 0.02 | 3.7 ± 1.1 4.6 ± 2.6 |
m/z = 45 (COOH+); m/z = 84 (M+) | |
| 4.3 ± 0.8 | ||||
| F + CHCl2COOH | CH2FCH2OH | 0.72 ± 0.11 | 8.3 ± 3.7 | m/z = 84 (CH2${\text{Cl}}_{2}^{ + }$); m/z = 64 (M+) |
| c-C6H12 | 0.60 ± 0.12 | 7.9 ± 2.8 6.1 ± 3.3 |
m/z = 49 (CH2Cl+); m/z = 84 (M+) | |
| CH3CCl3 | 11.9 ± 1.8 | 8.2 ± 2.1 | m/z = 51 (CH237Cl+); m/z = 97 (CH3C${\text{Cl}}_{2}^{ + }$) |
|
| 8.3 ± 3.9 | ||||
| F + CH2ClCOOH | CH2FCH2OH | 0.99 ± 0.12 | 11.4 ± 5.0 | m/z = 94 (M+); m/z = 64 (M+) |
| c-C6H12 | 0.75 ± 0.04 | 9.8 ± 3.0 7.6 ± 3.9 |
m/z = 94 (M+); m/z = 84 (M+) |
|
| 9.6 ± 3.8 | ||||
По данным наших экспериментов можно несколькими способами провести сравнение реакционной способности атомов фтора с рядом хлоруксусных кислот: трихлоруксусной, дихлоруксусной и монохлоруксусной. В случае, когда для каждой из трех реакций в качестве конкурирующей выступала реакция (2), сравнение констант скорости реакций приводит к следующему результату: k(F + + CCl3COOH) : k(F + CHCl2COOH) : k(F + + CH2ClCOOH) = 0.34 : 0.72 : 0.99 в единицах k2. Или 1 : 2.1 : 2.9, если нормировать на k(F + + CCl3COOH). Аналогичное сравнение возможно для случая, когда конкурирующей реакцией выступала реакция (6). Тогда соотношения представляются как 1 : 2.1 : 2.7 (или 0.28 : 0.60 : 0.75 в единицах k6). Кроме того, можно провести сравнение констант скорости этих реакций, полученных при усреднении по всем полученным данным для различных конкурирующих реакций. В этом случае k(F + CCl3COOH) : k(F + CHCl2COOH) : k(F + + CH2ClCOOH) = 1 : 1.9 : 2.2 в единицах k(F + + CCl3COOH).
Таким образом, однозначно следует, что реакционная способность кислот в ряду растет. Ранее было отмечено, что рассчитанные значения k1 имеют значительную погрешность. Это также справедливо и для констант скорости реакций F + CCl3COOH и F + CHCl2COOH. Игнорируя погрешность, с которой получены экспериментальные данные, можно утверждать, что константы линейно связаны с количеством атомов водорода, содержащихся в молекулах, при переходе от трихлоруксусной кислоты к дихлоруксусной кислоте. При переходе к МХУК также происходит существенный рост константы скорости реакции, однако линейная зависимость от числа атомов водорода в молекулах искажается.
ЗАКЛЮЧЕНИЕ
В настоящей работе впервые установлены кинетические закономерности реакции атомарного фтора с монохлоруксусной кислотой при комнатной температуре T = 293 K. На основе имеющихся литературных данных [8, 10, 12] определена константа скорости реакции k1 = (9.6 ± 3.8) · 10–11 см3 · · молекул–1 · с–1, которая представляет собой среднее значение, полученное из сопоставления с константами скорости конкурирующих реакций (kref): атома фтора с 2-фторэтанолом и атома фтора с циклогексаном. Определены отношения констант скорости k/kref = 0.99 ± 0.12 и 0.75 ± 0.04 соответственно. Проведено сравнение константы скорости реакции атомарного фтора с монохлоруксусной кислотой и с хлорзамещенными уксусными кислотами: дихлоруксусной и трихлоруксусной. Показано, что для комнатных температур они относятся как k (F + CCl3COOH) : k (F + CHCl2COOH) : k (F + CH2ClCOOH) = 1 : 1.9 : 2.2. Таким образом, настоящая работа является продолжением систематических исследований ФИЦ ХФ РАН, посвященных влиянию органических загрязнителей на окружающую среду в водной [13–15] и газовой [16] средах.
Работа выполнена в рамках госзадания Министерства науки и высшего образования Российской Федерации (регистрационный номер 122040500060-4) и поддержана грантом Российского фонда фундаментальных исследований № 19-05-50076 (Микромир).
Список литературы
McDougall A.O., Long F.A. // J. Phys. Chem. 1962. V. 66. № 3. P. 429.
Bowden D.J., Clegg S.L., Brimblecombe P. // J. Atmos. Chem. 1998. V. 29. № 1. P. 85.
Laniewski K., Borén H., Grimvall A. // Chemosphere. 1999. V. 38. № 2. P. 393.
Reimann S., Grob K., Frank H. // Environ. Sci. Technol. 1996. V. 30. № 7. P. 2340.
Vasiliev E.S., Morozov I.I., Karpov G.V. // Intern. J. Chem. Kinet. 2019. V. 51. № 12. P. 909.
Васильев Е.С., Сыромятников А.Г., Шартава Д.К. и др. // Хим. безопасность. 2018. Т. 2. № 1. С. 206.
NIST Standard Reference Database. Number 69 / Eds. Linstrom P.J., Mallard W.G. Gaithersburg, USA: Natl. Inst. Stand. Technol., 2018.
Васильев Е.С., Морозов И.И., Хак В. и др. // Кинетика и катализ. 2006. Т. 47. № 6. С. 859.
Atkinson R., Baulch D.L., Cox R.A. et al. // Atmos. Chem. Phys. 2006. V. 6. № 11. P. 3625.
Pearson R.K., Cowles J.O., Hermann G.L. et al. // IEEE J. Quantum Electron. 1973. V. 9. № 9. P. 879.
Smith D.J., Setser D.W., Kim K.C. et al. // J. Phys. Chem. 1977. V. 81. № 9. P. 898.
Heinemann-Fiedler P., Hoyermann K., Rohde G. // Ber. Bunsenges. Phys. Chem. 1990. V. 94. № 11. P. 1400.
Штамм Е.В., Скурлатов Ю.И., Рощин А.В. и др. // Хим. физика. 2019. Т. 38. № 11. С. 16.
Скурлатов Ю.И., Штамм Е.В., Рощин А.В. и др. // Хим. физика. 2019. Т. 38. № 11. С. 65.
Васильев Е.С., Карпов Г.В., Волков Н.Д. и др. // Хим. физика. 2021. Т. 40. № 3. С. 17.
Васильев Е.С., Волков Н.Д., Карпов Г.В. и др. // Хим. физика. 2021. Т. 40. № 10. С. 30.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


