Химическая физика, 2022, T. 41, № 12, стр. 66-69
Транспорт олигонуклеотидов в клетки HL-60 с помощью наночастиц целлюлозы
С. В. Стовбун 1, А. С. Веденкин 1, М. Г. Михалева 1, *, Д. В. Зленко 1, 2, Л. И. Воронина 1, А. А. Бухвостов 3, Д. А. Кузнецов 1, 3
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова Минздрава России
Москва, Россия
* E-mail: wawe@bk.ru
Поступила в редакцию 16.02.2022
После доработки 04.04.2022
Принята к публикации 20.04.2022
- EDN: GPHXEG
- DOI: 10.31857/S0207401X22120093
Аннотация
В настоящее время востребованы биоразлагаемые, нетоксичные, биосовместимые переносчики лекарств. Наночастицы целлюлоза, получаемые путем механического истирания, способны к образованию множественных водородных связей, что позволяет им образовывать комплексы с потенциальными лекарственными средствами. Мы показали, что комплекс олигонуклеотидов с целлюлозой в качестве переносчика проникает в раковые клетки HL-60, в результате чего повышается их цитотоксичность. Данные спектроскопического анализа также показывают, что комплекс целлюлоза – флуоресцентный краситель проникает в цитоплазму клеток HL-60. Наши результаты показывают, что наночастицы целлюлозы могут использоваться в качестве носителей противораковых лекарств, а также как оптическая метка для тканевых и внутриклеточных процессов.
ВВЕДЕНИЕ
Доставка многих лекарств оказывается много более эффективной, если в качестве переносчиков используются наночастицы, например, липосом, дендримеров, магнитных жидкостей [1, 2]. Особенно актуально применение специфических переносчиков при лечении онкологических заболеваний, так как концентрация лекарства в опухоли увеличивается, а его накопление в здоровых тканях снижается, что позволяет значительно уменьшить побочные эффекты. Помимо этого, включение лекарств в состав переносчиков, например наночастиц, обеспечивает пролонгированное действие, а также упрощает проникновение через естественные барьеры, такие как клеточные мембраны [3–7].
Благодаря заключению в капсулу лекарство, например олигонуклеотиды – одноцепочечные ДНК (оцДНК) с противораковой активностью длиной 50–100 пар оснований (п.о.) [8, 9], защищено от разрушающего действия нуклеаз и других ферментов. Такие оцДНК способны ингибировать каталичитескую активность ДНК-полимераз, что определяет их потенциал в качестве противоопухолевого препарата. Кроме того, использование переносчика может улучшить проникновение амфифильных олигонуклеотидов через клеточные мембраны и тем самым существенно усилить их фармакологический потенциал [5–8].
К переносчикам лекарств предъявляют множество требований, таких как биосовместимость, нетоксичность, легкость наполнения лекарственным веществом, но вместе с тем и достаточная эффективность удерживания препарата в процессе доставки. Наночастицы (НЧ) целлюлозы удовлетворяет вышеперечисленным требованиям. Более того, существуют многочисленные сообщения об эффективном ее использовании для переноса лекарств [10, 11]. Стоит отметить также, что НЧ целлюлозы способны к образованию множества водородных связей [12, 13]. Сильное связывание с их помощью олигонуклеотидов с частицами НЧ целлюлозы экранирует олигонуклеотиды от разрушающего действия межклеточных нуклеаз.
Стоит отметить, что для достижения большей эффективности немаловажно правильно осуществить подбор механизма переноса, соответствующего выбранному способу доставки. В данном случае мы рассматриваем вариант пассивного (диффузионного) переноса олигонуклеотидов с помощью наноцеллюлозы. Однако в перспективе существует возможность добиться варианта направленного движения исследуемого комплекса. Такой механизм переноса наночастиц возможен в случае действия неравновесных флуктуаций различного характера – так называемого рэтчет-эффекта [14].
Учитывая это, мы в настоящей работе исследовали возможность доставки олигонуклеотидов (оцДНК) [15] в клетки HL-60 с помощью НЧ целлюлозы, полученных путем механического истирания в виде водного геля [9, 16].
МАТЕРИАЛЫ И МЕТОДЫ
Культуры клеток
Клетки HL-60 (Институт Пастера, Санкт-Петербург) культивировали по стандартной методике [17, 18] в пластиковых флаконах объемом 25 мл при +37 °С и влажность 78–86% в атмосфере CO2 в среде DMEM/F12 (Gibco) с добавлением бычьей сыворотки и антибиотиков (пенициллин – 100 ед/мл, стрептомицин – 100 мкг/мл).
Наноцеллюлоза
Крафтовая беленая целлюлоза лиственных пород получена на Архангельском целлюлозно-бумажном комбинате (Россия). Суспензии целлюлозы готовили в три этапа [16]. На первом этапе проводили гидролиз целлюлозы в течение 2 ч, при 95–97 °С в смешанном водном растворе серной кислоты (10%) и перекиси водорода (3%). Затем суспензию целлюлозы (2.5–2.8%) измельчали на коллоидной мельнице МК 2000 производства компании IKA (Germany) при комнатной температуре. Затем полученную целлюлозную массу (2.5–2.8%) разбавляли дистиллированной водой в 10 раз и диспергировали с помощью гомогенизатора высокого давления HPH 2000/4-DH5 (IKA, Germany). Полученные суспензии целлюлозы (∼2.5 мг/мл) представляли собой белые вязкие жидкости, которые использовали в экспериментах.
Выделение оцДНК
В течение суток клетки HL-60 культивировали в присутствии 25MgCl2 с концентрацией 20 мМ, где доля изотопа 25Mg2+ составляла 96.47%, или же в присутствии 24MgCl2 с концентрацией 20 мМ, где доля изотопа 24Mg2+ составляла 88.76% (Gamma Labs, Spain) [19]. Затем клетки обрабатывали 0.3%-ным раствором Трипсин-ЭДТА в соотношении 1 : 10 по объему (Worthington, USA) в течение часа и отмывали от изотопно-меченой среды. Для этого культуру осаждали центрифугированием при 10 000 об/мин в течение 15 мин при температуре 4 °С и ресуспеспендировали в 20 объемах чистой культуральной среды. Процедуру отмывки повторяли трижды.
Для получения образцов клеточных лизатов отмытые от изотопной метки и осажденные центрифугированием клетки культуры HL-60 ресуспендировали в 10 объемах раствора c pH = 7.80, содержащего трис-НСl с концентрацией 15 мМ, MgCl2 с концентрацией 15 мМ, EDTA с концентрацией 1.5 мМ и Triton X-100 с концентрацией 2.0% и инкубировали при комнатной температуре в течение 10 мин. К полученным образцам добавляли сульфат аммония (70% от насыщенного раствора) и инкубировали в течение 12 ч при 4 °С. Затем образцы центрифугировали при 7000 об/мин при температуре 22 °С и отбирали супернатанты. Последние обрабатывали тремя типами экзонуклеаз: фага лямбда, III E. coli и экзонуклеазой S1 [20], а затем проводили каскадную ультрафильтрацию через селективно-проницаемые мембраны типа K75/K25 (TechSep, France) с пределами молекулярной эксклюзии 75–25 кДа [19]. Затем фракцию оцДНК с длиной цепи 40–60 п.о. очищали при помощи высокоэффективной жидкостной хроматографии на колонке полиметил-амидопропил-метакриламидом PRP-X600 AE (Waters, USA), как было описано ранее [19]. Длину цепей оцДНК в полученных образцах контролировали электрофоретическим методом в 4.5%-ном агарозном геле. Выделенную оцДНК осаждали путем добавления 10 объемов ледяного этанола и хранили полученные осадки при 4 °С не более 3 мес.
Обработка клеток HL-60
В культуру клеток вносили раствор оцДНК итоговой концентрации 25 мкг/мл (2.5 · 10–5), а также раствор целлюлозы до итоговой концентрации 100 мкг/мл (1.0 · 10–4). В контрольные образцы вносили равный объем деминерализованной воды. Образцы инкубировали в течение 6 ч при температуре 37 °С. После окончания инкубации клетки трижды переосаждали центрифугированием при 12 000 об/мин в течение 15 мин при температуре 4 °С и отмывали, ресуспендируя в чистой культуральной среде.
Затем осадки клеток тщательно ресуспендировали при комнатной температуре в 10 объемах раствора с pH = 7.80, содержащем трис-НСl с концентрацией 15 мМ, Triton X-100 с концентрацией 2.0%, EDTA с концентрацией 1.5 мМ и MgCl2 с концентрацией 20 мМ. Цитозольную фракцию из лизатов клеток выделяли ультрацентрифугированием при 150 000 об/мин в течение 3 ч при температуре 4 °С на центрифуге Spinco модели L5-75B (Beckman, USA) с ротором SW 27.1. В супернатантах определяли содержание белка по Бредфорду и содержание ДНК по Бартону и снимали спектры поглощения в интервале длин волн 190–1100 нм на сканирующем спектрофотометре Lambda 1050 UV-VIS (Perkin Elmer, USA). Цитозольную фракцию обрабатывали рибонуклеазой А (Worthington, USA) с концентрацией 5.0 мкг/мл в течение 1 ч при 37 °С. Реакцию останавливали путем добавления 10 объемов “ледяного” ацетона и инкубировали полученный раствор при 4 °С в течение 12 ч. Затем растворы осветляли центрифугированием при 20 000 об/мин в течение 30 мин.
Полученные образцы супернатантов подвергали ультрафильтрации на мембранах Dia-flo с отсечкой по молекулярной массе 1.0 кДа (Amicon SA, France) в аппарате ММС16 CrossFlow (Amicon BV, Nitherlands) при давлении 5.5 МПа и комнатной температуре. Фильтраты элюировали буфером с pH = 8.20, содержащим трис-НСl с концентрацией 20 мМ и ЭДТА с концентрацией 1.5 мМ и анализировали.
Оценка числа погибших клеток
Для оценки числа погибших клеток лизосомы живых клеток окрашивали витальным флуоресцентным маркером активных лизосом Lyso-GFP BacMam (ThermoFisher, USA) с длиной волны возбуждения 488 нм в соответствии с протоколом производителя. Далее живые клетки промывали бессывороточной средой и сканировали с помощью автоматизированного конфокального микроскопа A1R MP Plus компании Nicon (Japan). Контуры клеток автоматически регистрировались и количественно учитывались с помощью дифференциально-интерференционного контраста с использованием анализатора данных NIS-Elements AR (Nicon, Japan) и анализировались с помощью пакета программ GX004 Combie в составе модуля NIS-Elements AR (Nikon, Japan).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Данные о цитотоксичности наноцеллюлозы и оцДНК приведены в табл. 1. Раствор оцДНК обладает выраженной цитотоксичностью, так как обработка им культуры клеток HL-60 в течение 6 ч приводит к достоверному увеличению доли мертвых клеток [9]. Обработка культуры HL-60 раствором оцДНК с высокой концентрацией (30 мг/мл) приводит к гибели 60% клеток. Обработка культуры HL-60 растворами целлюлозы (0.01%) не приводила к гибели клеток. Более того, в присутствии наноцеллюлозы (0.01%) количество погибших клеток снижалось достоверно и весьма существенно (в два раза).
Таблица 1.
Гибель клеток HL-60 (шт/млн) при обработке растворами оцДНК в различных концентрациях в присутствии 0.01% целлюлозы и без нее
| Концентрация оцДНК, мкг/мл | Концентрация целлюлозы, % | |
|---|---|---|
| 0.00 | 0.01 | |
| 0.0 | 21 082 ± 226 | 10 088 ± 211 |
| 0.3 | 45 287 ± 2018 | 339 214 ± 1086 |
| 30.0 | 604 004 ± 6390 | 683 411 ± 1807 |
Обработка культуры клеток HL-60 растворами, содержащими одновременно и НЧ целлюлозы, и оцДНК приводила к усилению цитотоксичности последних. Отметим, что цитотоксичность растворов с низкой (0.3 мг/мл) концентрацией оцДНК в присутствии целлюлозы с концентрацией 0.01% возрастала в 7.5 раз и достигала 30%. В случае растворов с высокой концентрацией оцДНК (30 мг/мл) эффект увеличения цитотоксичности в присутствии НЧ целлюлозы также наблюдался, но был значительно менее выражен (≈15%), хотя по абсолютной величине смертность в этом случае составила почти 70%.
Увеличение цитотоксичности оцДНК в присутствии раствора целлюлозы может быть следствием трансмембранного переноса НЧ целлюлозы внутрь клеток, в процессе которого облегчается и перенос внутрь клеток молекул оцДНК, например в связанном с НЧ целлюлозы состоянии [10, 11]. Для того чтобы подтвердить проникновение НЧ целлюлозы в цитоплазму, из клеток HL-60 была выделена фракция цитозоля, в которой были гидролизованы белки и нуклеиновые кислоты. В результате единственным высокомолекулярным агентом, который мог сохраниться в цитозольной фракции клеточного лизата могла быть целлюлоза [21]. Остаточная высокомолекулярная фракция была отфильтрована и проанализирована спектрофотометрически.
Спектр поглощения выделенной из цитозоля высокомолекулярной фракции характеризуется явно выраженным максимумом поглощения в видимой области спектра (450–480 нм), а также второстепенным максимумом в дальнем красном диапазоне (790–800 нм, рис. 1). Спектр поглощения культуральной среды DMEM/F12, использованной для культивирования клеток, в общих чертах совпал со спектром поглощения высокомолекулярной фракции цитозоля.
Рис. 1.
Спектры поглощения растворов: 1 – раствор целлюлозы в культуральной среде DMEM/F12, 2 – раствор высокомолекулярной фракции цитозоля клеток HL-60, обработанных раствором целлюлозы.
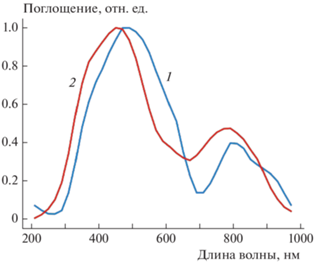
Поскольку ни низкомолекулярные компоненты клеток HL-60, ни раствор наноцеллюлозы не содержат хромофоров, поглощающих в видимом и ближнем ИК-диапазоне длин волн, обнаруженный спектр поглощения может принадлежать только рН-индикатору (феноловому красному), содержащемуся в культуральной среде DMEM/F12. При высоких значениях рН максимум в спектре поглощения фенолового красного расположен в области около 560 нм, а при низких – около 430 нм. Таким образом, главный пик в спектре поглощения высокомолекулярной фракции, выделенной из цитозоля клеток HL-60, можно принять за очень сильно уширенный спектр поглощения фенолового красного. Вполне вероятно, что в культуральной среде происходит адсорбция фенолового красного на НЧ целлюлозы, что и влечет за собой катастрофическое уширение спектра поглощения и появление в нем дополнительной полосы в области ближнего ИК-диапазона (800–900 нм). Появление полосы поглощения в ИК-области и общее уширение спектра свидетельствуют о формировании конденсированной фазы на поверхности наночастиц, а не об изменениях в спектре молекулярной адсорбции красителя. При этом десорбции красителя даже после проникновения НЧ целлюлозы в клетку, по-видимому, достаточно эффективно препятствуют множественные водородные связи между молекулами красителя и НЧ целлюлозы.
ЗАКЛЮЧЕНИЕ
Таким образом, проведенный спектроскопический анализ позволяет утверждать, что НЧ целлюлозы проникают в цитоплазму клеток HL-60. Учитывая значительное увеличение цитотоксичности растворов оцДНК в присутствии НЧ целлюлозы, можно предположить, что они выполняют функцию переносчиков цитотоксического агента внутрь клетки [10, 11]. Сделанное предположение позволяет объяснить механизм действия НЧ целлюлозы. Кроме того, прочная адсорбция красителя на НЧ целлюлозы указывает, что раствор целлюлозы, содержащий адсорбированные красители, может быть использован в качестве оптической метки для тканевых и внутриклеточных процессов.
Работа выполнена в рамках госзадания ФИЦ ХФ РАН № 122040500058-1.
Список литературы
De Jong W.H., Borm P.J.A. // Intern. J. Nanomed. 2008. V. 3. № 2. P. 133.
Cho K., Wang X.U., Nie S., Chen Z., Shin D.M. // Clin. Cancer Res. 2008. V. 14. № 5. P. 1310.
Gopalakrishnan S., Chenthilnathan A. // J. Pharmac. Sci. Technol. 2011. V. 3. № 2. P. 548.
Tiwari G. Tiwari R., Sriwastawa B. et al. // Intern. J. Pharmac. Invest. 2012. V. 2. № 1. P. 2.
Jung J.H., Chae J.J., Prausnitz M.R. // Drug Discovery Today. 2019. V. 24. № 8. P. 1654.
Климович М.А., Сажина Н.Н., Радченко А.Ш. и др. // Хим. физика. 2021. Т. 40. № 2. С. 33.
Семёнова М.Г., Антипова А.С., Пальмина Н.П. и др. // Хим. физика. 2019. Т. 38. № 12. С. 38.
Stovbun S., Ermakov K., Bukhvostov A., Vedenkin A., Kuznetsov D. // Scientia Pharmac. 2019. V. 87. № 4. P. 25.
Stovbun S.V., Vedenkin A.S., Bukhvostov A.A. et al. // BB Rep. 2020. V. 24. P. 100835.
Salimi S., Sotudeh-Gharebagh R., Zarghami R., Chan S.Y., Yuen K.H. // ACS Sustain. Chem. Eng. 2019. V. 7. № 19. P. 15800.
Xie J., Li J. // J. Bioresour. Bioprod. 2017. V. 2. № 1. P. 1.
Wang Y., Wei X., Li J. et al. // Fibers Polym. 2015. V. 16. № 3. P. 572.
Анпилова А.Ю., Масталыгина Е.Е., Храмеева Н.П., Попов А.А. // Хим. физика. 2020. Т. 39. № 1. С. 66.
Гуляев Ю.В., Бугаев А.С., Розенбаум В.М., Трахтенберг Л.И. // УФН. 2020. Т. 190. № 4. С. 337.
Ermakov K.V., Bukhvostov A.A., Vedenkin A.S. et al. // ACTA MEDICA. 2020. V. 62. № 4. P. 170.
Zlenko D.V., Nikolsky S.N., Vedenkin A.S. et al. // Polymers. 2019. V. 11. № 11. P. 873.
Olins A.L., Herrmann H., Lichter P., Olins D.E. // Experim. Cell Res. 2000. V. 254. № 1. P. 130.
Roy M.K., Thalang V.N., Trakoontivakorn G., Nakahara K. // Biochem. Pharmacol. 2004. V. 67. № 1. P. 41.
Buchachenko A.L., Kuznetsov D.A. // Rus. J. Phys. Chem. B. 2021. V. 15. № 1. P. 1.
Dewar J.M., Lydall D. DNA Repair Protocols. Totowa, N.J.: Humana Press, 2012. P. 341.
Stovbun S.V., Kalinina T.S., Zlenko D.V. et al. // Intern. J. Biolog. Macromol. 2021. V. 182. P. 743.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


