Химическая физика, 2022, T. 41, № 12, стр. 60-65
Структурно-функциональное состояние растения перца при биокультивировании на питательной среде с наночастицами железа в асептических условиях
О. А. Богословская 1, *, И. П. Ольховская 1, Г. С. Нечитайло 2, Н. Н. Глущенко 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: obogo@mail.ru
Поступила в редакцию 30.11.2021
После доработки 22.03.2022
Принята к публикации 20.04.2022
- EDN: UGOZRI
- DOI: 10.31857/S0207401X22120032
Аннотация
В работе предложен метод модификации питательной среды для выращивания высших растений в асептических условиях, путем замены традиционных добавок солей микроэлементов на наночастицы (НЧ). Представлены данные по влиянию НЧ железа в составе питательной среды Мурасиге–Скуга на морфометрические и физиологические показатели растений перца: изменение структуры листьев, содержание хлорофилла и урожайность. Показано, что посадочный материал, культивированный на средах с НЧ железа вместо сульфата железа в асептических условиях, обладает улучшенными морфометрическими и физиологическими показателями, что является фактором увеличения урожая плодов перца на 6–125% по сравнению с контролем.
ВВЕДЕНИЕ
Использование биотехнологий в сельском хозяйстве ориентировано на стабильное развитие сельскохозяйственного производства. Методы культивирования растительных тканей наиболее часто используются в качестве биотехнологических инструментов для базовых и прикладных целей: как для исследований процессов развития растений, так и для их коммерческого получения с конкретными промышленными и агрономическими признаками, а также для селекции растений, удаления вирусов из инфицированных особей с целью выращивания высококачественного здорового растительного материала и улучшения урожая [1].
Центральной проблемой биотехнологии является интенсификация биопроцессов как за счет повышения потенциала биологических агентов и их систем, так и за счет усовершенствования методов применения биокатализаторов [2–6]. В этом отношении использование наноразмерных структур в различных приемах оздоровления и культивирования посадочного материала, а возможно, и клонального размножения растений, представляет собой перспективное направление. Подбор питательных сред, обеспечивающих потребности культуры ткани продуцента в химических компонентах, необходимых для оптимального роста и развития растений и/или биосинтеза целевого продукта, является важным фактором создания эффективной биотехнологической системы. Смеси минеральных солей (макро- и микроэлементов) – обязательные компоненты питательных сред, помимо витаминов и сахарозы как источника углерода.
Наши многолетние исследования позволили установить следующие особенности действия НЧ на биосистемы. Наночастицы металлов имеют низкую токсичность, в 7–50 раз меньшую токсичности металлов в ионной форме; обладают пролонгированным и полифункциональным действием; в биотических дозах, т.е. в дозах, в 10–50 раз меньших максимально переносимых доз, стимулируют обменные процессы; легко проникают во все органы и ткани, проявляют синергидный эффект с природными полисахаридами, а их биологическая активность зависит от особенностей строения частиц и их физико-химических характеристик [7–10]. Учитывая эти уникальные свойства НЧ металлов, мы включили их в состав питательной среды вместо солей.
Большая часть новейшей литературы по применению нанотехнологий посвящена удобрениям и пестицидам в виде наночастиц, а также сенсорам при выращивании и защите растений [11]. Удобрения с наночастицами – это экологически чистые удобрения или “интеллектуальные” удобрения, способные уменьшить нормы внесения удобрений и снизить потери питательных веществ из них, в основном фосфора и азота [12]. Наночастицы обеспечивают постепенное и контролируемое высвобождение питательных веществ и эффективное использование их растениями, что помогает предотвратить загрязнение водных объектов и окружающей среды [13]. Удобрения с наночастицами способны как сами обеспечивать растения питательными веществами, так и усиливать действие удобрений даже при применении их в меньших количествах [14]. Внекорневое применение таких удобрений снижает стресс у растений [15].
Удобрения с наночастицами можно разделить на следующие категории в зависимости от потребности растений в питательных веществах: 1) удобрения с макроэлементами, 2) удобрения с микроэлементами. Удобрения с макроэлементами состоят из комбинации элементов, таких как калий (K), магний (Mg), азот (N), кальций (Ca) и фосфор (P). По прогнозам, общее потребление макроэлементных удобрений увеличится до 263 млн т в 2050 г., что свидетельствует о существенной потребности в этих удобрениях в сельскохозяйственном секторе.
Группа ученых [16] проверила эффективность действия наночастиц Mg и Fe на рост черноглазого гороха (Vigna unguiculata) путем внекорневой подкормки и отметила увеличение фотосинтетической способности листьев и массы семян, что, в свою очередь, привело к повышению урожайности культуры. Наночастицы Ca вместе с гуминовыми кислотами улучшали рост проростков арахиса на 30% [17]. Наши исследования показали, что предпосевная обработка семян ярового ячменя наночастицами железа, цинка и меди в составе полимерной пленки повышает урожайность на 4.1% по сравнению с необработанными семенами. При этом влажность бункерного зерна была ниже, чем влажность зерна контрольной группы на 2.2%, что способствовало экономии энергии при его сушке [18].
На основании вышеизложенного становится очевидным, что при культивировании растений в асептических условиях замена солей жизненно необходимых металлов железа, цинка, меди в составе питательной среды Мурасиге–Скуга на НЧ этих металлов может оказаться эффективной [19]. В представленной работе наночастицы этих элементов с заданными физико-химическими характеристиками в разных концентрациях индивидуально или в комбинации друг с другом в разных соотношениях вводились в состав питательной среды.
Целью наших исследований было изучение морфометрических, физиологических, анатомических показателей растений перца, выращенного на модифицированной наночастицами железа среде Мурасиге–Скуга, и его урожайности при культивировании в грунте.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Наночастицы железа были получены методом высокотемпературной конденсации на установке Миген-3 в ФИЦ химической физики им. Н.Н. Семёнова РАН [20]. Исследование физико-химических характеристик НЧ железа было проведено сотрудниками Лаборатории нано- и микроструктурного материаловедения. Определены: средний диаметр наночастиц Fe (27.0 ± 0.51 нм), содержание кристаллической металлической фазы (53.6%), содержание фазы оксида железа Fe3O4 (46.4%), толщина оксидной пленки (3.5 нм) [21].
Объект исследования – культура растения перца Capsicum annuum L. сорта LJ-king. Для культивирования растений в работе использовали питательную среду Мурасиге–Скуга [19].
В подготовленные стерильные банки с питательной средой раскладывали по 3 шт. семян перца в каждую банку. Для каждого варианта среды использовали по 10 банок с тремя семенами в каждой. Банки с семенами помещали на стеллажи в стерильной комнате с контролируемым постоянным режимом: температура – 22–25 °С, влажность – 36%, освещенность – 3500–3000 лк в режиме 12 ч свет/12 ч темнота в сутки.
Через 15 сут роста проверяли всхожесть семян. Через 40 сут роста и развития растений оценивали следующие морфометрические показатели: длину корня, длину ростка, массу зеленой части растений; физиологические показатели: активность корня и содержание хлорофилла. Активность корня определяли по восстановлению трифенилтетразолия хлорида (ТТХ). Корни инкубировали с раствором ТТХ при 37 °C в течение 1.5 ч. Добавляли H2SO4, этилацетат, корень растирали в ступке пестиком, и суспензию фильтровали. На спектрофотометре измеряли поглощение фильтрата при длине волны 485 нм [22]. Выделение хлорофилла из листьев перца проводили путем экстракции 100%-ным ацетоном. Экстракты центрифугировали и измеряли их спектры поглощения при 662 и 645 нм [23].
Для оценки урожайности растения перца через 60 дней от начала культивирования растений в асептических условиях посадочный материал из стерильных банок высаживали в почву теплицы. В теплице поддерживали следующие условия: температура почвы составляла 10–25 °C, температура воздуха днем – 13–28 °C, ночью – 15–20 °C в зависимости от фазы роста и развития растений.
Почву в теплице для посадки перцев готовили следующим образом: сначала вспахивали, затем добавляли органическое удобрение и снова вспахивали, добиваясь равномерного перемешивания. Органическое удобрение содержало N, P2O5 и K2O. Доза вносимого органического удобрения составляла 150 кг/м2. Для полива растений применяли капельный метод. Капельная оросительная труба проходила в почве. Почву мульчировали пластиком, благодаря чему сохраняли влажность почвы.
Статистическую обработку данных осуществляли в программах Microsoft Excel 2010 и Statistica 20 (“StatSoft, Inc.”, USA). Определяли средние значения изучаемых показателей (М) и стандартные ошибки среднего (±SEМ). Достоверность различий между вариантами (р) оценивали методами параметрической (t-критерий Стьюдента) статистики. Различия между вариантами считали статистически значимыми при p ≤ 0.05
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Культивирование растений на питательных средах в асептических условиях отвечает современным требованиям качества посадочного материала [11]. Одним из факторов культивирования растений являются условия их выращивания. Помимо температуры и освещенности, большое значение имеет состав питательных сред, как правило, сбалансированный по содержанию не только витаминов, аминокислот, гидролизатов, хелатов и других веществ, но и по содержанию макро- и микроэлементов. Учитывая уникальные биологические свойства НЧ металлов, мы разработали способ введения в питательную среду наночастиц жизненно необходимых элементов, заменяя сульфаты металлов на НЧ. Высокая реакционная способность наночастиц накладывает определенные требования на способ приготовления питательных сред, поскольку наночастицы, обладающие высокой удельной поверхностью, в водной среде активно агрегируют друг с другом. При этом необходимо сохранять стерильность питательной среды. Подробно процедура создания стерильной питательной среды с наночастицами металлов на основе среды Мурасиге–Скуга описана в нашем патенте [19].
Одним из жизненно важных элементов для роста растений является железо, дефицит которого приводит к развитию хлороза растений, задержке роста и снижению урожайности [24]. В последнее время НЧ железа стали использовать в виде удобрений с целью повышения как урожайности, так и качества продукции растениеводства. Показано, что эти НЧ повышают абсорбцию питательных веществ, увеличивают фотосинтетическую активность листьев, усиливают обменные процессы [25]. Однако морфометрические, физиологические, анатомические изменения растений, культивированных на питательных средах с добавлением наночастиц Fe, не изучены. Ранее нами установлено, что наночастицы металлов обладают биотическим действием, т.е. стимулируют обменные процессы в концентрациях, в 10–100 раз меньших значений максимально переносимой дозы. С учетом этого факта в питательные среды наночастицы Fe были введены в концентрациях, в 2–100 раз меньших, чем стандартная концентрация железа сульфата в среде Мурасиге–Скуга. Содержания остальных компонент, входящих в состав питательной среды, оставляли без изменений [19].
При выращивании растения перца на питательной среде, содержащей вместо железа в ионной форме НЧ железа в концентрациях 0.06, 0.3 и 3.0 мг/л, наблюдается изменение морфометрических параметров растений (рис. 1, 2). Так, длина корня растения при концентрациях НЧ железа 0.06, 0.3 и 3.0 мг/л увеличивается на 54%, 118% и 102%, соответственно, по сравнению с растениями, выращенными на стандартной среде Мурасиге–Скуга. Стимуляцию роста корней при действии наночастиц Fe наблюдали многие авторы на примере различных растений, в том числе арахиса, сои, шпината и др. [25–30]. Введение в состав питательной среды НЧ железа слабо отражается на длине ростка и зеленой массе растения (рис. 1).
Рис. 1.
Изменение длины корня (I), длины ростка (II) и массы зеленой части растения перца (III), культивированного в асептических условиях на питательной среде Мурасиге–Скуга (1) и на модифицированной среде с наночастицами Fe в концентрациях 0.06 (2), 0.3 (3), 3.0 мг/л (4); данные представлены в виде опыт/контроль (О/К), %; * – р ≤ 0.05.
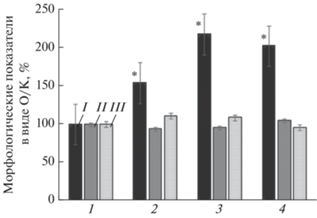
Рис. 2.
Фотография проростков растения перца, культивированного в асептических условиях на питательной среде Мурасиге–Скуга (1) и на модифицированной среде с НЧ железа в концентрациях 0.06 (2), 0.3 (3) и 3.0 мг/л (4).

На рис. 3 представлены результаты влияния НЧ железа в составе питательной среды Мурасиге–Скуга на физиологические показатели растения перца. Видно, что при выращивании перца на питательной среде, содержащей вместо железа в ионной форме наночастицы железа в концентрации 0.06 и 0.3 мг/л, активность корня перца сорта LJ-king увеличивается соответственно на 59% и 58% по сравнению с контролем. Следовательно, полученные нами результаты, а также данные других исследователей демонстрируют, что НЧ железа в оптимальной концентрации являются фактором стимуляции роста и активности корня при формировании корневой системы растений.
Рис. 3.
Изменение активности корня (I), содержания хлорофилла (II) и прорастания семян растения перца (III), культивированного в асептических условиях на питательной среде Мурасиге–Скуга (1) и на модифицированной среде с НЧ железа в концентрациях 0.06 (2), 0.3 (3) и 3.0 мг/л (4); данные представлены в виде опыт/контроль (О/К), %; * – р ≤ 0.05.
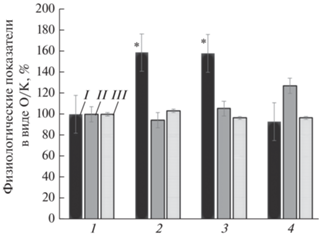
Введение в питательную среду НЧ железа вместо железа в ионной форме оказывает влияние на прорастание семян и содержание хлорофилла. Как видно из рис. 3, введение в питательную среду НЧ железа в концентрации 0.06 мг/л повышает показатель прорастания семян перца на 3.5%, а в концентрациях 0.3 и 3.0 мг/л – способствует увеличению содержания хлорофилла в листьях соответственно на 5% и 27% по сравнению с контролем.
После 60 дней от начала культивирования растений в асептических условиях посадочный материал из стерильных банок высаживали в почву теплицы. Через 80 дней после высаживания растений был собран урожай перцев. Результаты исследования приведены на рис. 4.
Рис. 4.
Изменение показателей растения перца (I – урожайность, II – количество плодов, III – прорастание семян), посадочный материал которого выращен в асептических условиях на питательной среде Мурасиге–Скуга (1) и на модифицированной среде с НЧ железа в концентрациях 0.12 (2), 0.6 (3) и 3.0 мг/л (4); данные представлены в виде опыт/контроль (О/К), %; * – р ≤ 0.05.
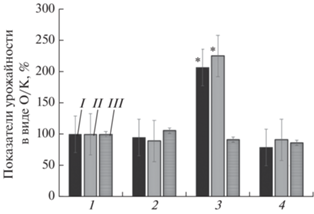
Видно, что урожайность растения перца в экспериментальных группах разная. Так, наибольшую урожайность показал посадочный материал, выращенный на питательной среде с НЧ железа в концентрации 0.6 мг/л. По количеству плодов и общей массе значения показателей превышают контроль соответственно в 2.06 и 2.25 раза по сравнению с контролем.
При использовании НЧ железа в растениеводстве были изучены изменения физиологических функций растений. Так, установлено действие наночастиц Fe2O3 на рост арахиса. Показано, что НЧ оксида железа стимулируют рост, увеличивают длину корней, высоту и биомассу растений, регулируя содержание фитогормонов и активность антиоксидантных ферментов [31]. Влияние наночастиц Fe3O4 выражается в снижении общего содержания хлорофилла и каротиноидов и повышении уровня малонового диальдегида и основных показателей перекисного окисления липидов растений лаванды и тимьяна [32]. Однако наблюдаемые физиологические эффекты наших исследований и других авторов далеки от объяснения механизмов воздействия НЧ железа на растения. Мы предположили, что возможный механизм стимулирующего действия НЧ железа на растения может быть связан с изменением структуры и функции биологических компонентов.
В нашем исследовании проведен систематический анализ влияния наночастиц Fe на изменения структуры клеток листьев растения перца сорта C. annuum [31]. Установлено, что НЧ железа регулируют рост растений, причем низкие их концентрации играют положительную роль в образовании большего количества хлоропластов и способствуют более плотной упаковке гран в листьях по сравнению с контролем (действием Fe2+). Известно, что биогенез хлоропластов и организация гран являются двумя жизненно важными процессами развития хлоропластов, обеспечивающими захват света во время фотосинтеза [33]. Кроме того, было высказано предположение, что укладка гран играет важную роль в защите фотосистемы II, расположенной в сложенном гране, как это было представлено Андерсоном и Aрo в 1994 году [34]. Повышенное содержание хлорофилла также свидетельствует об усилении эффективности фотосинтеза в растительных клетках.
Анатомические исследования свидетельствуют, что при действии НЧ железа изменения затрагивают толщину клеточных стенок (табл. 1). Известно, что растительные клеточные стенки проявляют крайнюю прочность на растяжение, а изменения механических свойств клеточных стенок могут не только существенно влиять на распределение устьиц и проницаемость клеточной стенки, но и на размер растительных клеток [30]. Не следует забывать также, что наночастицы Fe в биологических системах активно участвуют в реакции Хабера–Вайса с образованием OH•-радикалов, которые могут вызвать ослабление клеточной стенки, облегчить растяжение клеток и тем самым способствуют увеличению параметров растений [35]. При действии НЧ железа происходит увеличение сосудистых пучков листьев, что приводит к усилению переноса питательных веществ. Наблюдаемые нами особенности изменения анатомии листа, мезофилла, плотности упаковки гран, величины клеточной стенки являются одним из важных ответов на воздействие наночастиц Fe, которые при действии в биотических концентрациях обеспечивают получение хорошо развитого посадочного материала, способствующего повышению урожайности перца.
Таблица 1.
Показатели анатомического строения листа растения перца сорта LJ-king при воздействии железа сульфата и наночастиц железа (3 мкг/мл)**
| Показатели | Толщина клеточной стенки, мкм | Число хлоропластов на клетку | Содержание хлорофилла, мг/г |
|---|---|---|---|
| Fe2+ | 0.17 ± 0.02 | 8.0 ± 1.1 | 1.3 ± 0.3 |
| НЧ Fe | 0.10 ± 0.04* | 12.0 ± 1.3* | 1.5 ± 0.4 |
Дальнейшие исследования с применением методов геномики, транскриптомики и протеомики позволят раскрыть сложные механизмы стимуляции процессов роста и развития растений при использовании нанотехнологий.
ЗАКЛЮЧЕНИЕ
Растения, выращенные в асептических условиях, отвечают современным требованиям к качеству посадочного материала. Наши исследования показывают, что посадочный материал, выращенный на питательной среде Мурасиге–Скуга, в которую вместо сульфата железа введены наночастицы железа, имеет улучшенные морфометрические и физиологические показатели за счет структурной перестройки. Благодаря совместному использованию био- и нанотехнологии получен посадочный материал с хорошо развитой и активной корневой системой и улучшенными морфометрическими и физиологическими показателями, что позволяет повысить урожайность плодов перца.
Авторы благодарят Министерство образования и науки РФ и сотрудников лаборатории ФИЦ ХФ РАН под руководством А.Н. Жигача за поддержку в проведении экспериментов.
Список литературы
Loyola-Vargas V.M., Ochoa-Alejo N. // Methods Mol. Biol. 2018. V. 1815. P. 3; https://doi.org/10.1007/978-1-4939-8594-4_1
Биотехнологии в сельском хозяйстве; https:// ekovse.ru/stati/biotehnologiya-i-selskoe-hozyaystvo/
Александрова В.А., Футорянская А.М. // Хим. физика. 2021. Т. 40. № 12. С. 65; https://doi.org/10.31857/S0207401X21120025
Герасимов Г.Н., Громов В.Ф., Иким М.И. и др. // Хим. физика. 2021. Т. 40. № 11. С. 65; https://doi.org/10.31857/S0207401X21110030
Писаренко Л.М., Касаикина О.Т., Иванов В.Б. // Хим. физика. 2020. Т. 39. № 9. С. 31; https://doi.org/10.31857/S0207401X20090095
Григоренко Б.Л., Хренова М.Г., Кулакова А.М. и др. // Хим. физика. 2020. Т. 39. № 9. С. 13; https://doi.org/10.31857/S0207401X20060023
Глущенко Н.Н., Богословская О.А., Ольховская И.П. // Хим. физика. 2002. Т. 21. № 4. С. 79.
Рахметова А.А., Алексеева Т.П., Богословская О.А. и др. // Рос. нанотехол. 2010. Т. 5. № 3–4. С. 102.
Богословская О.А., Рахметова А.А., Овсян-никова М.Н. и др. // Рос. нанотехнол. 2015. Т. 10. № 1–2. С. 93.
Рахметова А.А., Богословская О.А., Ольховская И.П. и др. // Рос. нанотехнол. 2015. Т. 10. № 1–2. С. 123.
Mittal D., Kaur G., Singh P. et al. // Front. Nanotechnol. 2020. V. 2. P. 579954; https://doi.org/10.3389/fnano.2020.579954
Dimkpa C.O., Prem S., Bindraban P.S. // J. Agric. Food. Chem. 2018. V. 66. Issue 26. P. 6462; https://doi.org/10.1021/acs.jafc.7b02150
Dwivedi S., Saquib Q., Al-Khedhairy A.A. et al. // Understanding the Role of Nanomaterials in Agriculture / Eds. Singh, D., Singh, H., Prabha, R. Springer, New Delhi, 2016. P. 271; https://doi.org/10.1007/978-81-322-2644-4_17
Rameshaiah G.N., Pallavi J., Shabnam S. // Intern. J. Engineer. Res. Gen. Sci. 2015. V. 3. P. 314.
Tarafdar J.C., Xiong Y., Wang W.N. et al. // Appl. Biol. Res. 2012. V. 14. P. 138.
Delfani M., Baradarn F.M., Farrokhi N. et al. // Commun. Soil Sci. Plant Anal. 2014. V. 45. P. 530; https://doi.org/10.1080/00103624.2013.863911
Liu X., Zhang F., Zhang S. et al. // Plant Nutri. Ferti. Sci. 2005. V. 11. P. 385.
Yablokov A.G., Bogoslovskaya O.A., Olkhovskaya I.P. et al. // Amer. J. Chem. Soc. 2020. V. 14. № 07. P. 1140; https://doi.org/10.21475/ajcs.20.14.07.p.2366
Чжао Х., Лю М., Чень Ю. и др. Способ выращивания растений с использованием наночастиц металлов и питательная среда для его осуществления: Патент RU 2 612 319 C1 // Б.И. 2017. № 7. С. 30.
Leipunsky I.O., Zhigach A.N., Kuskov M.L. et al. // J. Alloys Compd. 2019. V. 778. P. 271; https://doi.org/10.1016/j.jallcom.2018.11.088
Zhao H., Liu., Chen Y. et al. // PCT Patent CN 108471713 B. 2020. Registration date 10.20.2020
Onanuga A.O., Jiang P., Adl S. // J. Agric. Sci. 2012. V. 4. № 3. P. 93; https://doi.org/10.5539/jas.v4n3p93
Lichtenthaler H., Buschmann C. // Handbook of Food Analytical Chemistry: Pigments, Colorants, Flavors, Texture and Bioactive Food Components / Eds. Wrolstad R.E., Acree T.E., Decker E.A. et al. Canada: John Wiley & Sons, 2005. P. 171.
Briat J.F., Dubos C., Gaymard F. // Trends Plant Sci. 2015. V. 20. P. 33; https://doi.org/10.1016/j.tplants.2014.07.005
Li X., Yang Y., Gao B. et al. // PLoS One. 2015. V. 10. № 4. P. e0122884; https://doi.org/10.1371/journal.pone.0122884
Alidoust D., Isoda A. // Acta Physiol. Plant. 2013. V. 35. P. 3365; https://doi.org/10.1007/s11738-013-1369-8
Ghafariyan M.H., Malakouti M.J., Dadpour M.R. et al. // Environ. Sci. Technol. 2013. V. 47. P. 10645; https://doi.org/10.1021/es402249b
Jeyasubramanian K., Thoppey U.U.G., Hikku G.S. et al. // RSC Adv. 2016. V. 6. P. 15451; https://doi.org/10.1039/C5RA23425E
Raju D., Mehta U.J., Beedu S.R. // IET Nanobiotechnol. 2016. V. 10. P. 141.
Rui M., Ma C., Hao Y. et al. // Front. Plant. Sci. 2016. V. 7. P. 815; https://doi.org/10.3389/fpls.2016.00815
Gonçalves S., Mansinhos I., Solana R.R. et al. // Molecules. 2021. V.26. № 21. P. 6427; https://doi.org/10.3390/molecules26216427
Yuan J., Chen Y., Li H. et al. // Sci. Rep. 2018. V. 8. № 1. P. 3228; https://doi.org/10.1038/s41598-017-18055-w
Sheykhbaglou R., Sedghi M., Shishevan M.T. et al. // Notulae Scientia Biologicae. 2010. V. 2. № 2. P. 112; https://doi.org/10.15835/nsb224667
Trujillo-Reyes J., Majumdar S., Botez C.E. et al. // J. Hazard. Mater. 2014. V. 267. P. 255; https://doi.org/0.1016/j.jhazmat.2013.11.067.20
Kim J.H., Lee Y., Kim E.J. et al. // Environ. Sci. Technol. 2014. V. 48. № 6. P. 3477; https://doi.org/10.1021/es4043462
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


