Журнал высшей нервной деятельности им. И.П. Павлова, 2023, T. 73, № 6, стр. 845-856
Эффекты различных режимов интервальных гипоксических тренировок в экспериментальных моделях тревожно-депрессивных состояний на грызунах
М. Ю. Зенько 1, К. А. Баранова 1, М. В. Кукина 1, Е. А. Рыбникова 1, *
1 Федеральное государственное бюджетное учреждение науки Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: rybnikovaea@infran.ru
Поступила в редакцию 15.08.2023
После доработки 28.08.2023
Принята к публикации 31.08.2023
- EDN: XLISSQ
- DOI: 10.31857/S004446772306014X
Аннотация
Разработка немедикаментозных способов коррекции стресс-индуцированных расстройств и улучшения адаптации к стрессорным воздействиям остается актуальной задачей физиологии, имеющей большой трансляционный потенциал. Ранее нами были предложены эффективные в данном отношении способы гипоксического гипобарического прекондиционирования и дистантного ишемического кондиционирования. Цель настоящей работы состояла в переносе принципов прекондиционирования на подходы нормобарической интервальной гипоксической тренировки (ИГТ). Исследованы эффекты пяти новых режимов ИГТ (3 пятиминутных сеанса гипоксии по 16% О2 в день, 3 сеанса по 12% О2, 7 сеансов по 12% О2, 15 сеансов по 12% О2, 3 сеанса по 9% О2) в экспериментальных моделях депрессии и посттравматического стрессового расстройства у крыс. Прекондиционирующий режим высокой интенсивности 3 × 9%О2 оказал наиболее выраженный антидепрессивный и анксиолитический эффект в моделях обеих патологий. При снижении уровня гипоксии до 12% О2 частично сохраняли эффективность режимы ИГТ с увеличением количества сеансов. Тренировочный режим наибольшей длительности – 15 × 12%О2, обладал эффективностью в отношении коррекции формирования экспериментальной депрессии. Переходный режим – 7 × 12%О2 – оказывал анксиолитический эффект, тогда как прекондиционирующий режим средней интенсивности – 3 × 12%О2 – продемонстрировал и антидепрессивный, и анксиолитический эффект. Результаты свидетельствуют, что наибольшее влияние на эффективность оказывала интенсивность гипоксического воздействия. При этом снижение интенсивности до 16% О2 приводило к ослаблению или потере стресс-протективных свойств. В отношении режима 3 × 9%О2 как наиболее перспективного целесообразно провести дальнейшие исследования по выявлению молекулярных механизмов, реализующих его стресс-протективное и анксиолитическое действие.
За последние несколько лет пандемия COVID-19, психотравматизация вследствие вооруженных конфликтов, вынужденного переселения или несчастных случаев коснулись миллионов людей по всему миру (Carpiniello, 2023). Возрастающий уровень стрессогенности, по различным экспертным оценкам, приводит к увеличению количества индуцированных ею психических расстройств. Так, у пациентов, уже успешно вылечившихся от COVID-19, в 31% случаев наблюдаются симптомы депрессии, в 28% – ПТСР и в 42% – тревожного расстройства (Mazza et al., 2022). У участников военных конфликтов впоследствии частота возникновения ПТСР может достигать 37.8%, у спасателей и пожарников – рекордные 57% (Iversen et al., 2008; Jakupcak et al., 2008; Obuobi-Donkor et al., 2022). По данным последних метаанализов, распространенность депрессии среди общей популяции в настоящее время может достигать 25–33.7% (Cooke et al., 2020; Wang et al., 2020; Mahmud et al., 2023).
С учетом недостаточной эффективности имеющихся средств профилактики и терапии, разработка новых способов и подходов к повышению устойчивости организма к стрессорным воздействиям по-прежнему остается крайне актуальной проблемой. Одним из наиболее перспективных направлений может быть возрождение интереса к методу интервальной гипоксической тренировки как средству индукции перекрестной адаптации между гипоксией и психоэмоциональным стрессом, когда адаптация к одному из влияний сопровождается формированием толерантности к стрессорам другой модальности или природы (Zenko, Rybnikova, 2023).
Интервальная гипоксическая тренировка (ИГТ) представляет собой чередование эпизодов гипоксии с нормоксией, гипоксией меньшей интенсивности, гиперкапнией или даже гипероксией. Разработано большое количество вариаций сочетаний и циклов ИГТ, различающихся по модальности, интенсивности и количеству эпизодов, длительности каждого отдельного цикла и т.д. Описаны сочетания как коротких эпизодов гипоксии/нормоксии (от 1 до 20 мин) (Cao et al., 1992) в течение одного дня, так и намного более длительных эпизодов гипоксии/нормоксии до 12 часов и продолжительностью до 90 дней (Rodriguez et al., 1999). Наибольшее распространение получили режимы ИГТ с небольшим количеством эпизодов в день (3–15) в условиях умеренной гипоксии (10–16% O2), которые считаются оптимальными по соотношению безопасности и эффективности, по сравнению с воздействием более интенсивной гипоксии (8–9% O2) или большим количеством эпизодов (Navarrete-Opazo, Mitchell, 2014).
Изучение физиологических механизмов, лежащих в основе эффектов ИГТ, является актуальной задачей в связи с высоким терапевтическим потенциалом данного метода. Показано, что ИГТ повышает адаптивные возможности кардиореспираторной системы, улучшает гемореологические свойства, повышает активность метаболических процессов, в т.ч. в миокарде, уровень белков антиоксидантной защиты, шаперонов, эритропоэтина, индуцибельной NO-синтазы, подавляет окислительный стресс, модулирует стрессорный ответ и функцию гипоталамо-гипофизарно-адреналовой оси (Зенько, Рыбникова 2020; Balestra et al., 2021; Cai et al., 2010; Knaupp et al., 1992; Park et al., 2022; Rybnikova et al., 2023; Zembron-Lacny et al., 2020).
Наши предыдущие исследования по разработке нейропротективных способов с применением гипобарической гипоксии показали, что не тренировочные, а кондиционирующие режимы гипоксии, вызывающие срочную мобилизацию адаптационных ресурсов на молекулярно-клеточном и системном уровнях, могут быть наиболее эффективными (Зенько, Рыбникова, 2020; Rybnikova et al., 2022; Rybnikova et al., 2023). С использованием модели гипобарической гипоксии на крысах нами было показано, что гипобарическое пре- и посткондиционирование оказывает мощное стресс-протективное, антидепрессивное и анксиолитическое действие в моделях постгипоксических и постстрессорных патологий на крысах (Зенько, Рыбникова, 2020; Rybnikova et al., 2022; Rybnikova et al., 2023). Кроме того, принципы кондиционирования были успешно реализованы нами при разработке способов дистантного ишемического пре- и посткондиционирования, также оказывающего выраженное стресс-протективное действие в моделях на крысах (Баранова, Зенько, 2018).
Сравнение гипобарической и нормобарической гипоксии выявляет сходство молекулярных сенсоров и, соответственно, адаптивного ответа, однако при этом нормобарическая гипоксия оказывает меньше побочных эффектов, является более управляемым воздействием, и, как следствие, более безопасным (Millet et al., 2012). Нормобарическую гипоксию с использованием дыхательной смеси можно мгновенно остановить в случае возникновения неблагоприятных эффектов, сняв маску или подав кислород в камеру, в отличие от использования гипобарической барокамеры, где необходимо постепенное изменение давления во избежание баротравмы. В отличие от нормобарической, гипобарическая гипоксия может приводить к возникновению симптомов острой высотной болезни, легочной вазоконстрикции, изменениям вентиляционной реакции и жидкостного баланса (Conkin, Wessel, 2008; Loeppky et al., 2005; Millet et al., 2012). Учитывая вышеизложенное, в настоящей работе была поставлена задача разработать эффективные способы нейропротекции и стресс-протекции с применением нормобарической гипоксии и подходов ИГТ. При этом на основании собственного многолетнего опыта было сделано предположение, что принципы кондиционирования (снижение числа сеансов, дней воздействия, с увеличением интенсивности гипоксического фактора) могут быть также применимы и к парадигме нормобарической гипоксии (Rybnikova et al., 2022). С целью проверки данного предположения нами проведен сравнительный экспериментальный анализ эффективности прекондиционирующих режимов (3 × 9%О2, 3 × 12%О2, 3 × 16%О2), тренировочных режимов (15 × × 12%О2), и переходных вариантов (7 × 12%О2) в отношении коррекции патогенеза постстрессорных тревожно-депрессивных расстройств в моделях на крысах.
МЕТОДИКА
Исследования проведены на 96 взрослых самцах крыс линии Вистар из ресурсов ЦКП “Биоколлекция” ИФ РАН, содержащихся в стандартных условиях при свободном доступе к воде и пище. При проведении экспериментов были соблюдены принципы, изложенные в директивах Европейского Совета (2010/63/ЕU) и положениях ИФ РАН о работе с животными, используемыми в научных экспериментах.
Для моделирования гипоксических нормобарических условий использована автоматическая установка, создающая гипоксию требуемой интенсивности за счет кислорода воздуха и поступающего в камеру азота, поток которого находится под программным управлением компьютера через регулирующий блок и систему клапанов. Установка состоит из прозрачной камеры, разделенной съемной сеткой на 6 отсеков, плотно прилегающей к ней крышки с размещенными на ней редуктором и клапаном ввода азота, клапанами и патрубками с вентиляторами для продувки камеры атмосферным воздухом, цифровым датчиком уровня кислорода и электронным управляющим блоком (изготовитель АО “Технопарк Санкт-Петербурга”).
С использованием камеры одновременно для всей группы крыс создавали 5-минутную нормобарическую гипоксию с последующей 15-минутной реоксигенацией, 3 и более эпизодов гипоксии/реоксигенации (5/15 мин) в день подряд ежедневно в течение 3 дней. Это соотношение длительности эпизодов отражает оригинальный подход, который базируется на предыдущем опыте авторов, полученном при исследованиях действия гипобарического пре-/посткондиционирования и дистантной ишемии (Зенько, Рыбникова, 2020; Rybnikova et al., 2022; Rybnikova et al., 2023).
Экспериментально исследованы эффекты пяти режимов интервальных тренировок: 3 пятиминутных сеанса гипоксии по 16% О2 в день, 3 сеанса по 12% О2, 7 сеансов по 12% О2, 15 сеансов по 12% О2, 3 сеанса по 9% О2. Дизайн режимов базировался на гипотезе авторов о том, что трехкратное воздействие более интенсивной гипоксией может оказывать более выраженное влияние (соответственно, режимы сравнения – 9% О2, 3 сеанса, и 16% О2, 3 сеанса), а эффективность среднего по интенсивности режима гипоксии может увеличиваться с увеличением числа сеансов, что характерно для классических подходов ИГТ.
Эффекты данных тестовых гипоксических воздействий были исследованы в экспериментальных моделях психоэмоционального стресса и постстрессорных тревожно-депрессивных состояний у крыс.
“Выученная беспомощность” (ВБ)
В качестве экспериментальной модели депрессии была использована классическая модель “выученной беспомощности” (ВБ) (Henkel et al., 2002; Seligman, Maier, 1967; Seligman, Beagley, 1975; Willner, 1986). Крысы подвергались воздействию аверсивного неизбегаемого стрессора, электрокожного раздражения (1 мА, 60 Гц, 15 с), 60 раз с непредсказуемыми интервалами между ними от 15 до 45 с.
Модель ПТСР “стресс–рестресс”
Для индукции аналога посттравматического стрессового расстройства (ПТСР) использовали модель “травматический стресс – рестресс”. Эта модель, предложенная И. Либерзоном и коллегами в 1997 году (Liberzon et al., 1997), выгодно отличается от других моделей своей этиологической обоснованностью. Ее основу составляет парадигма “травматический стресс – рестресс”, в которой воспроизводится патогенетическая роль предшествующей психотравматизации в ситуации, воспринимаемой как угроза для жизни. Процедура стрессирования включала условно “тяжелый” патогенный стресс (2 ч иммобилизации, 20 мин вынужденного плавания и, после 15-минутного перерыва, воздействие эфиром до обездвиживания). Через 7 сут производился напоминающий, условно более “мягкий”, рестресс (30 мин иммобилизации), выполняющий роль триггера, запускающего развитие модельного аналога ПТСР с симптоматикой тревожного патологического состояния.
Поведенческое тестирование
Для оценки поведения, двигательной активности и уровня тревожности животных использовали тестирование в “открытом поле” (ОП) и “приподнятом крестообразном лабиринте” (ПКЛ).
Тест ОП, являющийся классическим методом исследования поведения грызунов в новых (стрессогенных) условиях (Hall, 1936), позволяет оценить уровни локомоторной активности и ориентировочно-исследовательского поведения крыс. Тестирование проводилось на 4-й день после стресса моделей ВБ и ПТСР в установке площадью 1 м2 квадратной формы, разбитой на 36 секторов, с источником света сверху в центре установки. Испытуемое животное помещали в центр открытого поля и в течение 5 минут фиксировали его активность, в ходе эксперимента отмечали время латентного периода, количество пересеченных квадратов различных зон установки, время груминга, вертикальных стоек, иммобилизации.
Для изучения уровня тревожности животных и возможного анксиолитического эффекта ИГТ соответственно, был применен поведенческий тест “Приподнятый крестообразный лабиринт” (Pellow et al., 1985). Тестирование в ПКЛ проводилось на 5-й день после стресса моделей ВБ и ПТСР. ПКЛ представляет из себя приподнятый на 1 м над полом лабиринт с двумя открытыми освещенными (стрессогенными) и двумя закрытыми (темными, условно защищенными) рукавами. Крысу помещали в центр установки и в течение 5 минут регистрировали выбор рукавов и центра, время, проведенное во всех этих зонах (Pellow et al., 1985; Walf, Frye, 2007).
Функция гипоталамо-гипофизарно-адренокортикальной системы
Методом твердофазного иммуноферментного анализа проведено определение уровней кортикостерона в плазме туловищной крови, полученной при декапитации животных на 6-й день после модельного стрессирования. Использованы коммерческие ИФА-киты (K210R, Кортикостерон крыса/мышь ИФА, ООО Хема, Россия).
Статистическая обработка результатов
Был использован программный пакет STATISTICA 12.0. Распределение параметров, проанализированных в статье, было проверено на нормальность по критерию Колмогорова–Смирнова, после чего был использован непараметрический U-критерий Манна–Уитни. Различия между выборками считали статистически значимыми при р ≤ 0.05. Данные на рисунках представлены в виде среднего ± стандартная ошибка среднего (M ± SEM).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Формирование экспериментальной депрессии у животных в модели “выученной беспомощности” сопровождалось проявлением локомоторного дефицита, характерного для данного заболевания: крысы этой группы совершали достоверно меньше пересечений крайних квадратов ОП, то есть демонстрировали снижение горизонтальной двигательной активности (р = 0.027, рис. 1 (а), *), при сохранении вертикальной двигательной активности.
Рис. 1.
Результаты поведенческого тестирования в тесте “открытое поле”. (а) – горизонтальная двигательная активность крыс модели ВБ, ВБ+ИГТ и контроля, количество пройденных крайних квадратов открытого поля. (б) – горизонтальная двигательная активность крыс модели ПТСР, ПТСР + ИГТ и контроля, количество пройденных крайних квадратов. (в) – время иммобилизации крыс модели ВБ, ВБ + ИГТ и контроля, секунды. (г) – время иммобилизации крыс модели ПТСР, ПТСР+ИГТ и контроля, секунды. Контроль (n = 12), ВБ – группа ВБ (n = 12), 3 × 9 + ВБ, 15 × 12 + ВБ, 7 × 12 + ВБ, 3 × 16 + ВБ – группы ВБ в сочетании с указанным режимом ИГТ, соответственно (n = 6), ПТСР – группа модели ПТСР (n = 6), 3 × × 9 + ПТСР, 15 × 12 + ПТСР, 7 × 12+ ПТСР, 3 × 16 + ПТСР – группы модели ПТСР в сочетании с заданным режимом ИГТ, соответственно (n = 6 в каждой). * – достоверное отличие от контрольной группы, # – достоверное отличие от группы соответствующей патологии, p < 0.05, критерий Манна–Уитни. Fig. 1. The results of behavioral testing in the “open field” test. (a) – horizontal locomotor activity of rats of the LH model, LH + IHT and control, the number of lateral squares of the open field passed. (б) – horizontal locomotor activity of rats of the PTSD model, PTSD + IHT and control, the number of lateral squares passed. (в) – the time of freezing of rats of the LH model, LH + IHT and control, seconds. (г) – the time of freezing of rats of the PTSD model, PTSD+IHT and control, seconds. Control – control animals (n = 12), LH – group of LH (n = 12), 3 × 9 + LH, 15 × 12 + LH, 7 × 12 + LH, 3 × 16 + LH – groups of LH combined with the specified IHT regime, respectively (n = 6), PTSD – group of model PTSD (n = 6), 3 × 9 + PTSD, 15 × 12 + PTSD, 7 × 12 + PTSD, 3 × 16 + PTSD are groups of the PTSD model combined with the specified IHT mode, respectively (n = 6 in each). * – significant difference from the control group, # – significant difference from the group of the corresponding pathology, p < 0.05, Mann–Whitney test.
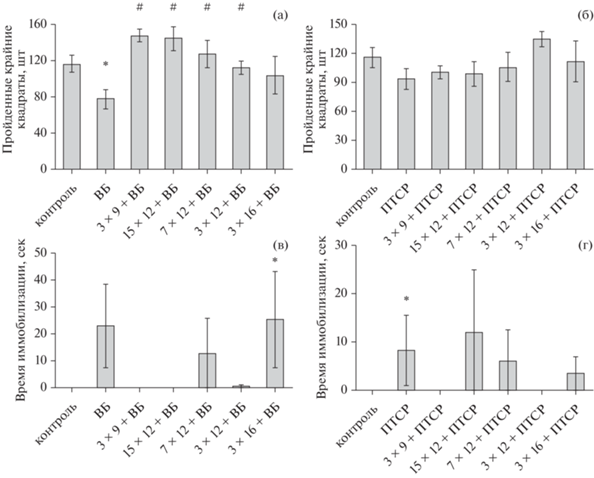
В группах 3 × 9%О2 + ВБ, 15 × 12%О2 + ВБ, 7 × 12%О2 + ВБ, 3 × 12%О2 + ВБ (все тестовые группы, кроме 3 × 16%О2 + ВБ) показатель горизонтальной активности крыс был достоверно выше, чем у животных с модельной депрессией (р = 0.001, р < 0.01, р = 0.023 и р = = 0.044 соответственно; рис. 1 (а), #) и соответствовал значениям контроля, что свидетельствует об отсутствии депрессивно-подобной симптоматики. Наибольшие абсолютные показатели двигательной активности были отмечены в группах 3 × 9%О2 + ВБ и 15 × 12%О2 + ВБ (рис. 1 (а)).
Иммобилизация, также характерная для развития модельной депрессии у крыс, была отмечена у части крыс в группах ВБ, 3 × × 16%О2 + ВБ (р < 0.05, рис. 1 (в), *), 7 × × 12%О2 + ВБ и у одной крысы в группе 3 × × 12%О2 + ВБ; в контроле и группах 3 × 9%О2 + + ВБ, 15 × 12%О2 + ВБ иммобилизация полностью отсутствовала (рис. 1 (в)).
По сравнению с депрессивными состояниями, при развитии модельного ПТСР нарушений горизонтальной двигательной активности в тесте ОП обычно не отмечается, что также было продемонстрировано в нашем эксперименте (рис. 1, б). В группе ПТСР проявлений иммобилизации животных было достоверно больше, чем у контроля (р < 0.05, рис. 1 (г), *), в группах 15 × 12%О2 + ПТСР, 7 × 12%О2 + ПТСР, 3 × 16%О2 + ПТСР иммобилизации наблюдались у отдельных животных (рис. 1 (г)), а в контроле и группах 3 × × 9%О2 + ПТСР, 3 × 12%О2 + ПТСР иммобилизация отсутствовала (рис. 1 (г)).
Тестирование в ПКЛ показало, что по проявлениям исследовательской активности и тревожности крысы модели депрессии не отличаются от контрольных (рис. 2 (а, в)), как и поведенческие показатели животных большинства режимов ИГТ + ВБ, однако для групп 3 × 9%О2 + ВБ (в большей степени) и 3 × 12%О2 + ВБ (по меньшему количеству показателей) выявлен достоверный анксиолитичеcкий эффект даже относительно группы контроля. Животные группы 3 × 9%О2 + ВБ проводили больше времени в центре установки от начала посадки в ПКЛ (р = 0.016, рис. 2 (a), *), чаще выходили в открытые рукава (р = 0.028, рис. 2 (д), *) и проводили там больше времени, чем контрольные (р = 0.022, рис. 2 (в), *).
Рис. 2.
Результаты теста “приподнятый крестообразный лабиринт”. (а) – начальное время нахождения в центре в группах ВБ, ВБ + ИГТ и контроля, секунды. (б) – начальное время нахождения в центре групп ПТСР, ПТСР + ИГТ и контроля, секунды. (в) – время нахождения в открытых рукавах групп ВБ, ВБ + + ИГТ и контроля, секунды. (г) – время, проведенное в открытых рукавах в группах ПТСР, ПТСР + ИГТ и контроля, секунды. (д) – количество выходов в открытые рукава в группах ВБ, ВБ + ИГТ и контроля, шт. (е) – количество выходов в открытые рукава в группах ПТСР, ПТСР+ИГТ и контроля, шт. Контроль – контрольные животные (n = 12), ВБ – группа ВБ (n = 12), 3 × 9 + ВБ, 15 × 12 + ВБ, 7 × 12 + ВБ, 3 × 16 + ВБ – группы ВБ и указанного режима ИГТ соответственно (n = 6), ПТСР – модельная группа ПТСР (n = 6), 3 × 9 + ПТСР, 15 × 12 + ПТСР, 7 × 12 + ПТСР, 3 × 16 + ПТСР – модельная группа ПТСР и указанная группа режима ИГТ соответственно (n = 6 в каждой). * – достоверное отличие от контрольной группы, # – достоверное отличие от соответствующей группы патологии, p < 0.05, критерий Манна–Уитни. Fig. 2. Results of “elevated plus-maze” test. (a) – initial time in the center of the LH, LH + IHT and control groups, seconds. (б) – initial time in the center of the PTSD, PTSD + IHT and control groups, seconds. (в) – time spent in the open arms by the LH, LH + IHT and control groups, seconds. (г) – time spent in the open arms by the PTSD, PTSD + IHT and control groups, seconds. (д) – number of entries to open arms by the LH, LH + IHT and control groups, pcs. (е) – Number of entries to open arms by the PTSD, PTSD + IHT and control groups, pcs. Контроль – control animals (n = 12), ВБ – LH group (n = 12), 3 × 9 + ВБ, 15 × 12 + ВБ, 7 × 12 + ВБ, 3 × 16 + ВБ – LH and indicated IHT mode groups, respectively (n = 6), ПТСР – PTSD model group (n = 6), 3 × 9 + ПТСР, 15 × 12 + ПТСР, 7 × 12 + ПТСР, 3 × 16 + ПТСР – PTSD model and indicated IHT mode groups, respectively (n = 6 in each). * – significant difference from the control group, # – significant difference from the corresponding pathology group, p < 0.05, Mann–Whitney test.
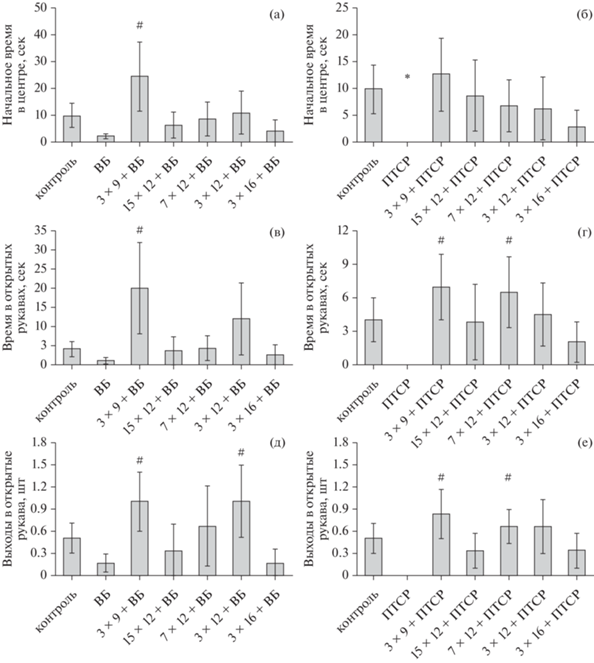
Крысы группы 3 × 12%О2 + ВБ достоверно чаще контроля выходили в открытые рукава ПКЛ (р = 0.036, рис. 2 (д), #) и проводили там по абсолютным показателям второе время после группы 3 × 9%О2 + ВБ (р = 0.05, рис. 2 (в)).
В отличие от модели экспериментальной депрессии, был выявлен значимый анксиогенный эффект стрессирования в модели ПТСР (рис. 2 (б, г, е)). При первоначальном высаживании в установку ПКЛ крысы с экспериментальным ПТСР стремились максимально быстро уйти со света в закрытые темные рукава, проводя минимальное латентное время в центре от начала опыта (p = 0.028, рис. 2 (б)). Позже в ходе теста у этих животных полностью отсутствовали выходы в открытые освещенные рукава ПКЛ (рис. 2 (г, е)), которые являются для крыс выраженным стрессогенным фактором, в то время как контрольные животные выходили в них и проводили время, исследуя окружающую обстановку, что говорит о низком уровне их тревожности (рис. 2 (г, е)).
Тестирование в ПКЛ позволило выявить значимый анксиолитический эффект гипоксических режимов в модели экспериментального ПТСР: по латентному времени, проведенному после высаживания в центр, животные режимов ИГТ не отличались от контрольных, крысы групп 3 × 9%О2 + ПТСР и 7 × 12%О2 + ПТСР проводили достоверно больше времени в открытых рукавах, чем крысы группы ПТСР (р = 0.028, р = 0.028, рис. 2 (г), #), и чаще в них выходили (р = = 0.026, р = 0.024, рис. 2 (е), #).
Результаты определения содержания кортикостерона в плазме крови показали, что развитие экспериментальной депрессии сопровождалось стойким повышением базального уровня данного глюкокортикоидного гормона выше контрольных значений, что подтверждает формирование у экспериментальных животных депрессивно-подобного состояния (р < 0.01, рис. 3 (а), *). В группах 3 × 9%О2 + ВБ, 7 × 12%О2 + ВБ, 3 × 12%О2 + ВБ и 3 × 16%О2 + ВБ (то есть все, кроме 15 × × 12%О2 + ВБ) применение ИГТ достоверно относительно группы ВБ снижало этот показатель до контрольных значений (р < 0.01, р < < 0.01, р < 0.05, р < 0.01, рис. 3 (а), #).
Рис. 3.
Базальная концентрация кортикостерона в плазме крови. (а) – уровень кортикостерона в плазме крови в группах ВБ, ВБ + ИГТ и контроля, нмоль/л. (б) – уровень кортикостерона в плазме крови у крыс в группах ПТСР, ПТСР + ИГТ и контроля, нмоль/л. Контроль – контрольные животные (n = 12), ВБ – группа ВБ (n = 12), 3 × 9 + ВБ, 15 × 12 + ВБ, 7 × 12 + ВБ, 3 × 16 + ВБ – ВБ в сочетании с указанными группами режима ИГТ, соответственно (n = 6), ПТСР – модельная группа ПТСР (n = 6), 3 × 9 + ПТСР, 15 × 12 + + ПТСР, 7 × 12 + ПТСР, 3 × 16 + ПТСР – модель ПТСР в сочетании с указанными группами режима ИГТ, соответственно (n = 6 в каждой). * – достоверное отличие от контрольной группы, # – достоверное отличие от соответствующей группы патологии, p < 0.05, критерий Манна–Уитни. Fig. 3. Basal corticosterone concentration in blood plasma. (a) – plasma corticosterone levels in the LH, LH + IHT and control groups, nmol/L. (б) – plasma corticosterone levels in the PTSD, PTSD + IHT and control rats, nmol/L. Control –control animals (n = 12), ВБ – LH group (n = 12), 3 × 9 + ВБ, 15 × 12 + ВБ, 7 × 12 + ВБ, 3 × × 16 + ВБ – LH combined with indicated IHT regime groups, respectively (n = 6), ПТСР – PTSD model group (n = 6), 3 × 9 + ПТСР, 15 × 12 + ПТСР, 7 × 12 + ПТСР, 3 × 16 + ПТСР – PTSD model combined with indicated IHT mode groups, respectively (n = 6 in each). * – significant difference from the control group, # – significant difference from the corresponding pathology group, p < 0.05, Mann–Whitney test.
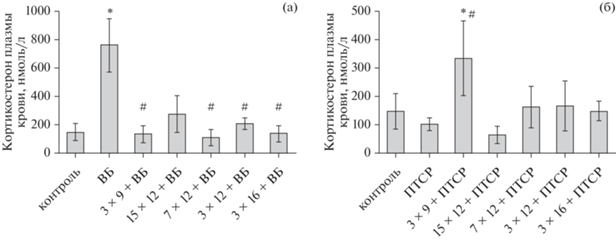
В модели экспериментального ПТСР группа 3 × 9%О2 + ПТСР была единственной, в которой уровень кортикостерона плазмы крови был достоверно выше, чем у контроля и животных модели ПТСР (р < 0.05, р < 0.05, рис. 3 (б), *, #)).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как уже отмечалось выше, локомоторная заторможенность, выявляемая в тесте ОП, является характерным проявлением экспериментальной депрессии у крыс (Hall, 1936; Henkel et al., 2002; Willner, 1986). В соответствии с этим в ходе наших экспериментов животные с ВБ пересекали достоверно меньше квадратов, что подтверждало формирование у них депрессивно-подобного состояния. При этом применение ИГТ перед стрессированием в модели ВБ в большинстве групп позволило частично или полностью предотвратить развитие экспериментальной депрессии, отслеживаемое на поведенческом уровне, однако при этом эффективность коррекции депрессивно-подобной поведенческой симптоматики для разных тестовых режимов ИГТ оказалась неодинаковой. Исключением являлась группа 3 × 16%О2 + ВБ, сохранившая полноценную депрессивно-подобную симптоматику, поскольку у крыс этой группы наблюдалась низкая двигательная активность и высокий уровень иммобилизаций, соответственно, данный тренировочный режим проявил себя в парадигме ВБ как неэффективный. В группах 3 × 9%О2 + ВБ, 15 × × 12%О2 + ВБ, 7 × 12%О2 + ВБ, 3 × 12%О2 + ВБ патологическая моторная ретардация отсутствовала, причем первые две группы лидировали по абсолютным значениям горизонтальной двигательной активности. Однако в группах режимов 3 × 16%О2 + ВБ, 7 × 12%О2 + ВБ, 3 × × 12%О2 + ВБ были отмечены эпизоды неподвижности, что может свидетельствовать о недостаточной их эффективности в данной модели (Henkel et al., 2002).
В качестве патогенетической основы развитие экспериментальной депрессии в группе ВБ сопровождалось стойким достоверным повышением уровня базального кортикостерона плазмы крови. При всех режимах, кроме 15 × 12%О2, ИГТ нормализовала этот показатель.
В режимах 3 × 9%О2 + ВБ, 15 × 12%О2 + ВБ иммобилизация полностью отсутствовала, а двигательная активность находилась на уровне контроля. На этом основании можно назвать данные режимы (кондиционирующий высокой интенсивности и тренировочный средней интенсивности, но максимальной продолжительности) наиболее эффективными в модели ВБ по выраженности антидепрессивного действия из рассмотренных в данном эксперименте. Таким образом, разработанный прекондиционирующий режим не уступил по выраженности эффекта тренировочному, однако его процедура укорочена в 5 раз, поскольку для его реализации требуется 3 дня (а не 15), что в трансляционном отношении является существенным преимуществом.
Хорошо известно, что тревожное поведение животного характеризуется предпочтением закрытых рукавов приподнятого лабиринта открытым и центру, тогда как анксиолитический эффект, напротив, может приводить к большему времени, проведенному в открытых рукавах и центре установки (Pellow et al., 1985; Walf, Frye, 2007). Тестирование в ПКЛ в наших экспериментах показало выраженную анксиолитическую активность отдельных режимов ИГТ в обеих моделях постстрессорных расстройств. Так, по показателям в ПКЛ животные группы экспериментальной депрессии и большинства режимов ИГТ + ВБ не отличались от контроля, однако в режимах 3 × 9%О2 и 3 × 12%О2 был показан достоверный анксиолитический эффект. Крысы группы 3 × 9%О2 + ВБ чаще и более длительно выходили в открытые рукава установки ПКЛ, больше исследовали центр установки в начале тестирования, чем животные с пост-стрессорной патологией. Наряду с этим в модели ПТСР в группе 3 × 9%О2 базальный уровень кортикостерона в плазме крови был выше, чем в контроле и у группы ПТСР. Учитывая известный факт, что при ПТСР нередко развивается гипофункция периферического звена ГГАС (De Kloet et al., 2006; Lehrner et al., 2016; Yehuda, 2005), можно предполагать, что данный стимулирующий эффект кондиционирующего режима ИГТ, нацеленный на предотвращение гормональной дисфункции ГГАС, может рассматриваться как один из механизмов стресс-протективного действия данного режима ИГТ в модели ПТСР (Bower, Yehuda, 2017; Daskalakis et al., 2016). Кроме того, как нами было показано ранее, умеренное повышение уровня кортикостерона в крови наблюдается при применении наиболее эффективных режимов гипоксического гипобарического прекондиционирования и сопровождает повышение устойчивости мозга к гипоксии и стрессам (Зенько, Рыбникова, 2020; Рыбникова и др., 2008). В группах с ИГТ 3 × 12%О2 и 7 × × 12%О2 стимулирующего эффекта на ГГАС не выявлено, однако отмечается низкий уровень тревожности в ПКЛ. Таким образом, эти три кондиционирующих режима высокой и средней интенсивности обладали наиболее выраженным анксиолитическим эффектом. В режимах ИГТ другой интенсивности и длительности показатели тревожности в основном находились на уровне контрольных животных, что может свидетельствовать об их эффективности в коррекции экспериментального ПТСР, однако меньшей, чем у режимов 3 × 9%О2, 3 × 12%О2 и 7 × 12%О2.
Для модели ПТСР “стресс–рестресс” не характерны нарушения двигательной активности, что было показано в тесте ОП – по этому показателю группы модельной патологии и всех режимов ИГТ не отличались от контроля, однако в группе ПТСР-подобной патологии наблюдались эпизоды иммобилизации, которые можно связать с повышенной тревожностью животных в этой модели. В режимах 15 × 12%О2 + ПТСР, 7 × 12%О2 + ПТСР, 3 × 16%О2 + ПТСР у отдельных животных также была отмечена иммобилизация, а в режимах 3 × 9%О2 + ПТСР, 3 × 12%О2 + ПТСР и контроле иммобилизация полностью отсутствовала. Эти данные, также как и результаты по показателю уровня тревожности, обсужденные выше, могут свидетельствовать об ограниченной эффективности тренировочных режимов и режима низкой интенсивности (15 × 12%О2, 7 × 12%, 3 × 16%О2) в модели ПТСР, и наибольшей эффективности кондиционирующих режимов высокой и средней интенсивности 3 × 9%О2 и 3 × 12%О2.
Режим ИГТ низкой интенсивности 3 × × 16%О2 показал отсутствие стресс-протективного эффекта в изученных моделях депрессии и ПТСР, поскольку патологическая симптоматика у этих животных проявлялась на уровне групп с экспериментальными патологиями.
Обобщая вышеизложенное, можно заключить, что кондиционирующий режим высокой интенсивности 3 × 9%О2 имел наиболее выраженный антидепрессивный, противотревожный и стресс-протективный эффект в обеих моделях. Близкими к нему по эффективности, но не по всем показателям, были режимы 15 × 12%О2, 3 × 12%О2 и 7 × 12%О2.
15 × 12%О2 – тренировочный режим наибольшей длительности, оказывал превентивное действие в модели ВБ. 7 × 12%О2, тренировочный режим средней интенсивности, обладал анксиолитическим эффектом, а 3 × 12%О2, кондиционирующий режим средней интенсивности, – и антидепрессивным, и анксиолитическим эффектом.
ЗАКЛЮЧЕНИЕ
В результате проведенных работ установлено, что ИГТ значимо повышает стрессоустойчивость в моделях тревожно-депрессивных патологий. Наиболее заметное влияние на выраженность эффекта оказывает интенсивность гипоксического воздействия. Показано, что принципы кондиционирования успешно могут применяться и при разработке подходов ИГТ, поскольку кондиционирующий режим 3 × 9%О2 оказался наиболее эффективным режимом из всех протестированных. При снижении уровня гипоксии до 12% О2 эффективность антидепрессивного или анксиолитического эффекта частично или полностью сохраняют режимы с увеличением количества сеансов (3, 7 и 15). При этом увеличение количества сеансов с 3 до 7 (в режимах 3 × 12%О2 и 7 × 12%О2) не приводит к усилению анксиолитического эффекта, поэтому такое увеличение нецелесообразно. Снижение интенсивности до 16% О2 приводит к выраженному снижению основных стресс-протективных свойств ИГТ в данных моделях патологий. Полученные результаты свидетельствуют о том, что кондиционирующие режимы ИГТ имеют значительный трансляционный потенциал для здравоохранения, поэтому с целью формирования доказательной базы необходимо дальнейшее изучение протективных эффектов и механизмов данных режимов.
Список литературы
Баранова К.А., Зенько М.Ю. Анксиолитический эффект дистантного ишемического пре- и посткондиционирования в модели посттравматического стрессового расстройства. Журн. высш. нерв. деят. им. И.П. Павлова. 2018. 68 (5): 663–672.
Зенько М.Ю., Рыбникова Е.А. Роль глюкокортикоидных гормонов в стресс-протективных эффектах гипоксического посткондиционирования в моделях депрессии и посттравматического стрессового расстройства у крыс. Журн. высш. нервн. деят. им. И.П. Павлова. 2020. 70 (6): 825–836.
Рыбникова Е.А., Миронова В.И., Пивина С.Г., Ордян Н.Э., Тюлькова Е.И., Самойлов М.О. Гормональные механизмы гипоксического прекондиционирования у крыс. Докл. РАН. 2008. 421 (5): 713–715.
Balestra C., Lambrechts K., Mrakic-Sposta S., Vezzoli A., Levenez M., Germonpré P., Virgili F., Bosco G., Lafère P. Hypoxic and hyperoxic breathing as a complement to low-intensity physical exercise programs: a proof-of-principle study. Int. J. Mol. Sci. 2021. 22: 9600.
Bowers M.E., Yehuda R. Neuroendocrinology of posttraumatic stress disorder: Focus on the HPA Axis. Stress: Neuroendocrinology and neurobiology, handbook of stress. 2017. 2: 165–172.
Cai M.C., Huang Q.Y., Liao W.G., Wu Z., Liu F.Y., Gao Y.Q. Hypoxic training increases metabolic enzyme activity and composition of α-myosin heavy chain isoform in rat ventricular myocardium. Eur. J. Appl. Physiol. 2010. 108: 105–111.
Cao K.Y., Zwillich C.W., Berthon-Jones M., Sallivan C.E. Increased normoxic ventilation induced by repetitive hypoxia in conscious dogs. J. Appl. Physiol. 1992. 73: 2083–2088.
Carpiniello B. The mental health costs of armed conflicts — a review of systematic reviews conducted on refugees, asylum-seekers and people living in war zones. Int. J. Environ. Res. Public Health. 2023. 20: 2840.
Conkin J., Wessel J.H. Critique of the equivalent air altitude model. Aviation, space, and environmental medicine. 2008. 79 (10): 975–982.
Cooke J.E., Eirich R., Racine N., Madigan S. Prevalence of posttraumatic and general psychological stress during COVID-19: A rapid review and meta-analysis. Psychiatry Research. 2020. 292: 113 347.
Daskalakis N.P., McGill M.A., Lehrner A., Yehuda R. Endocrine aspects of PTSD: Hypothalamic-pituitary-adrenal (HPA) axis and beyond. Comprehensive Guide to Post-Traumatic Stress Disorders. 2016. 245–260.
De Kloet C., Vermetten E., Geuze E., Kavelaars A., Heijnen C., Westenberg H. Assessment of HPA-axis function in posttraumatic stress disorder: pharmacological and non-pharmacological challenge tests, a review. J. Psychiatr. Res. 2006. 40 (6): 550–567.
Hall C.S. Emotional behavior in the rat. III. The relationship between emotionality and ambulatory activity. J. Comp. Psychol. 1936. 22 (3): 345.
Henkel V., Bussfeld P., Möller H.J., Hegerl U. Cognitive-behavioural theories of helplessness/hopelessness: valid models of depression? European archives of psychiatry and clinical neuroscience. 2002. 252: 240–249.
Iversen A.C., Fear N.T., Ehlers A., Hughes J.H., Hull L., Earnshaw M., Greenberg N., Rona R., Wessely S., Hotopf M. Risk factors for post-traumatic stress disorder among UK Armed Forces personnel. Psychol. Med. 2008. 38: 511–522.
Jakupcak M., Luterek J., Hunt S., Conybeare D., McFall M. Posttraumatic stress and its relationship to physical health functioning in a sample of Iraq and Afghanistan war veterans seeking postdeployment VA Health Care. J. Nerv. Ment. Dis. 2008. 196: 425–428.
Knaupp W., Khilnani S., Sherwood J., Scharf S., Steinberg H. Erythropoietin response to acute normobaric hypoxia in humans. J. Appl. Physiol. 1992. 73: 837–840.
Lehrner A., Daskalakis N., Yehuda R. Cortisol and the hypothalamic-pituitary-adrenal axis in PTSD. Posttraumatic Stress Disorder. 2016. 265–290.
Liberzon I., Krstov M., Young E.A. Stress-restress: effects on ACTH and fast feedback. Psychoneuroendocrinology. 1997. 22 (6): 443–453.
Loeppky J.A., Roach R.C., Maes D., Hinghofer-Szalkay H., Roessler A., Gates L., Fletcher E.R., Icenogle M.V. Role of hypobaria in fluid balance response to hypoxia. High Alt. Med. Biol. 2005. 6: 60–71.
Mahmud S., Mohsin M., Dewan M.N., Muyeed A. The global prevalence of depression, anxiety, stress, and insomnia among general population during COVID-19 pandemic: a systematic review and meta-analysis. Trends in Psychol. 2023. 31: 143–170.
Mazza M.G., De Lorenzo R., Conte C., Poletti S., Vai B., Bollettini I., Melloni E.M.T., Furlan R., Ciceri F., Rovere-Querini P., Benedetti F. Anxiety and depression in COVID-19 survivors: role of inflammatory and clinical predictors. Brain, Behavior, and Immunity. 2020. 89: 594–600.
Millet G.P., Faiss R., Pialoux V. Point: Counterpoint: Hypobaric hypoxia induces/does not induce different responses from normobaric hypoxia. Journal of applied physiology. 2012. 112 (10): 1783–1784.
Navarrete-Opazo A., Mitchell G.S. Therapeutic potential of intermittent hypoxia: a matter of dose. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2014. 307: R1181–R1197.
Obuobi-Donkor G., Oluwasina F., Nkire N., Agyapong V.I.O. A scoping review on the prevalence and determinants of post-traumatic stress disorder among military personnel and firefighters: Implications for public policy and practice. International Journal of Environmental Research and Public Health. 2022. 19 (3): 1565.
Park H.Y., Jung W.S., Kim S.W., Lim K. Effects of interval training under hypoxia on the autonomic nervous system and arterial and hemorheological function in healthy women. Int. J. Womens Health. 2022. 14: 79–90.
Pellow S., Chopin P., File S.E., Briley M. Validation of open: closed arm entries in an elevated plus-maze as a measure of anxiety in the rat. J. Neurosci. Methods. 1985. 14 (3): 149–167.
Rodriguez F.A., Casas H., Casas M., Pagés T., Rama R., Ricart A., Ventura J.L., Ibáñez J., Viscor G. Intermittent hypobaric hypoxia stimulates erythropoiesis and improves aerobic capacity. Med. Sci. Sports Exerc. 1999. 31: 264–268.
Rybnikova E.A., Baranova K.A., Zenko M.Yu., Churilova A.V., Stupin K.N. Comparative analysis of various modes of preconditioning to increase high altitude tolerance. Integrative Physiology. 2022. 3 (3): 348–358.
Rybnikova E.A., Nalivaeva N.N., Zenko M.Y., Baranova K.A. Intermittent hypoxic training as an effective tool for increasing the adaptive potential, endurance and working capacity of the brain. Front. Neurosci. 2022. 16: 941740.
Seligman M.E., Beagley G. Learned helplessness in the rat. J. Comp. Physiol. Psychol. 1975. 88 (2): 534.
Seligman M.E., Maier S.F. Failure to escape traumatic shock. Journal of experimental psychology. 1967. 74 (1): 1.
Walf A.A., Frye C.A. The use of the elevated plus maze as an assay of anxiety-related behavior in rodents. Nat. Protoc. 2007. 2 (2): 322–328.
Wang S., Zhang Y., Ding W., Meng Y., Hu H., Liu Z., Zeng X., Wang M. Psychological distress and sleep problems when people are under interpersonal isolation during an epidemic: A nationwide multicenter cross-sectional study. European Psychiatry. 2020. 63 (1): e77.
Willner P. Validation criteria for animal models of human mental disorders: learned helplessness as a paradigm case. Prog. Neuro-Psychopharmacol. Biol. Psychiatry. 1986. 10 (6): 677–690.
Yehuda R. Neuroendocrine aspects of PTSD. Anxiety Anxiolytic Drugs. 2005. 371–403.
Zembron-Lacny A., Tylutka A., Wacka E., Wawrzyniak-Gramacka E., Hiczkiewicz D., Kasperska A., Czuba M. Intermittent hypoxic exposure reduces endothelial dysfunction. Biomed Res. Int. 2020. 2020: 6479630.
Zenko M.Y., Rybnikova E.A. Cross-Adaptation: from F.Z. Meerson to the Present. Part 2. Mechanisms of Cross-Adaptation. Neurosci Behav Physi. 2023. 53: 409–415.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


