Журнал высшей нервной деятельности им. И.П. Павлова, 2023, T. 73, № 4, стр. 510-523
Анализ мозговой и мышечной активности при управлении кортико-спинальным нейроинтерфейсом
Е. В. Боброва 1, *, В. В. Решетникова 1, А. А. Гришин 1, Е. А. Вершинина 1, М. Р. Исаев 2, 3, Д. Р. Пляченко 4, П. Д. Бобров 2, 3, Ю. П. Герасименко 1
1 ФГБУН Институт физиологии РАН им. И.П. Павлова
Санкт-Петербург, Россия
2 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
3 Институт трансляционной медицины ГБОУ ВПО
Российского национального исследовательского медицинского университета им. Н.И. Пирогова
Москва, Россия
4 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: eabobrovy@gmail.com
Поступила в редакцию 01.04.2023
После доработки 27.04.2023
Принята к публикации 05.05.2023
- EDN: VYPHUG
- DOI: 10.31857/S0044467723040032
Аннотация
Разработан кортико-спинальный нейроинтерфейс, основанный на кинестетическом воображении тыльного сгибания стопы, дополненный робототехническим устройством перемещения конечностей “Биокин” и чрескожной электростимуляцией спинного мозга (ЧЭССМ). Показано, что доля правильных ответов при классификации ЭЭГ-сигналов мозга (ДПО) в условиях работы с нейроинтерфейсом в среднем составляет 68% и значимо увеличивается при добавлении механотерапии и ЧЭССМ на 9%. ЭМГ-активность передней большеберцовой мышцы (ПБМ), осуществляющей тыльное сгибание стопы, во время инструкции воображать движение увеличена по сравнению с таковой во время инструкции находиться в покое. Добавление механотерапии и ЧЭССМ при работе с нейроинтерфейсом в большей степени влияет не на увеличение активности ПБМ при воображении движения ипсилатеральной стопы, но на уменьшение активности ПБМ при инструкции находиться в покое. Выявленные эффекты, по-видимому, важны для формирования адекватных координационных паттернов управляющих сигналов от ЦНС и мышечной активности при реализации движений и могут использоваться в клинической реабилитации двигательной активности с использованием кортико-спинального нейроинтерфейса.
ВВЕДЕНИЕ
Кинестетическое воображение движений – это ментальное представление ощущений, которые возникают при соответствующих реальных движениях. Хотя воображение движений является известным методом восстановления двигательных функций конечностей, а его влияние на нейропластичность в областях мозга, обеспечивающих регуляцию движений, хорошо известно (Page, 2012; Burianová, 2020), общее влияние воображения движений на периферическую двигательную систему еще не полностью изучено. Электромиографические (ЭМГ) исследования мышечной активности во время воображения движений показали разные результаты (Ranganathan et al., 2004; Personnier et al., 2008; Hashimoto, Rothwell, 1999; Gandevia et al., 1997). В некоторых исследованиях сообщается о сублиминальной (т.е. не вызывающей сокращение мышцы) ЭМГ активности во время воображения движений (Hashimoto, Rothwell, 1999; Gandevia et al., 1997, Dickstein et al., 2005, Guillot et al., 2007). В некоторых исследованиях не выявлена активация мышц во время выполнения задач, связанных с воображением движений, например, приседания на корточках (Mulder et al., 2005) или поднятия по лестнице (Geiger et al., 2019).
Регистрация и машинная классификация специфических изменений активности мозга во время воображения различных движений является одной из основных парадигм для создания неинвазивных нейроинтерфейсов (Бобров, Фролов, 2017; Hramov et al., 2021; Saha et al., 2021). Предложено множество классификаторов активности мозга, а также метрик для численной оценки их работы, таких как доля правильных ответов (ДПО), площадь под ROC-кривой, точность (precision), полнота (recall) и др. (Hramov et al., 2021). Эффективность подобных систем для восстановления двигательных функций верхних конечностей подтверждается многочисленными клиническими исследованиями (см. обзоры (Bai et al., 2020; Kruse et al., 2020)).
Восстановление функций нижних конечностей с помощью воображения движений – сравнительно недавно появившееся и развивающееся направление исследований (см. обзор (Боброва и др., 2019; Camargo-Vargas, Callejas-Cuervo, Mazzoleni, 2021). Большинство исследований направлено на восстановление функции ходьбы (King et al., 2013, 2014, 2015; Do et al., 2013; García-Cossio et al., 2015; Donati et al., 2016; Villiger et al., 2013), ряд работ – на восстановление движений в голеностопном суставе (Do et al., 2011, 2012; McCrimmon et al., 2014, 2015). Совместно с нейроинтерфейсами используются роботизированные устройства (Do et al., 2013; Xu et al., 2014; García-Cossio et al., 2015; Donati et al., 2016; Li et al., 2021; Pino et al., 2022; Cui et al., 2022; Gao et al., 2022), функциональная электрическая стимуляция (Do et al., 2011; Takahashi et al., 2012; King et al., 2014, 2015; McCrimmon et al., 2014, 2015; Mrachacz-Kersting et al., 2016; Bouton, 2020; Ren et al., 2020), виртуальная реальность (Donati et al., 2016; King et al., 2013; Luu et al., 2016; Ren et al., 2020), тактильная стимуляция опорной поверхности (Cheron et al., 2012). В последние годы стали появляться разработки систем педалирования, напоминающих велосипед, запускаемых при успешном воображении движений нижних конечностей, что детектируется нейроинтерфейсом, с использованием в качестве обратной связи виртуальной реальности (Perez et al., 2021; Cardoso et al., 2019).
Одной из недавно появившихся перспективных систем для нейрореабилитации нижних конечностей является кортико-спинальный интерфейс. Кортико-спинальный нейроинтерфейс использует активность головного мозга для управления стимуляцией спинного мозга с целью искусственного соединения нейронных сетей головного и спинного мозга для восстановления двигательной функции (Nishimura et al., 2013; Zimmermann, Jackson, 2014). Нейронную активность мозга, отражающую двигательные намерения, преобразуют в команды для стимуляции спинного мозга (Alam et al., 2016; Capogrosso et al., 2016; Yadav et al., 2020). Было показано, что контролируемая мозгом стимуляция спинного мозга более эффективна для восстановления движений, чем стимуляция без обратной связи (McPherson et al., 2015; Capogrosso et al., 2016; Bonizzato et al., 2018). Первая работа, посвященная неинвазивному кортико-спинальному нейроинтерфейсу, появилась в 2022 г. (Insausti-Delgado et al., 2022). В ней описывается тестирование кортико-спинального нейроинтерфейса, основанного на запуске магнитной стимуляции спинного мозга от ЭЭГ-сигналов, на 10 здоровых испытуемых.
Для создания кортико-спинального нейроинтерфейса может быть использована чрескожная электрическая стимуляция спинного мозга (ЧЭССМ). ЧЭССМ – это неинвазивный метод, который может активировать нейронные сети спинного мозга, управляющие движением. Показано, что ЧЭССМ может инициировать непроизвольные шагательные движения у здорового человека (Городничев и др., 2012; Gerasimenko et al., 2015) и у пациентов с нарушениями движений (Harkema et al., 2011). ЧЭССМ может воздействовать не только на мышцы через структуры спинного мозга, но и на нейронную активность головного мозга. ЧЭССМ вызывает изменения активности головного мозга (Telkes et al., 2020; Ridder et al., 2013; Bentley et al., 2016; McGeady et al., 2021; Steele et al., 2022; Moens et al., 2012; Manson et al., 2022), при этом электрическая стимуляция мышц подобного эффекта не вызывает (Steele et al., 2022). У здоровых испытуемых при ЧЭССМ выявлено увеличение активности в сенсомоторных областях коры, таламусе, хвостатом ядре, бледном шаре и скорлупе, а уменьшение – в прилежащем ядре и задней теменной коре (Manson et al., 2022); изменения активности 4, 6 и 9-го полей Бродмана (Steele et al., 2022). Сочетание воображения движения со стимуляцией нервов верхних и нижних конечностей повышает возбудимость кортикоспинального тракта у здоровых людей (Kaneko et al., 2014; Takahashi et al., 2019; Yasui et al., 2019). При изучении влияния ЧЭССМ шейного отдела спинного мозга на долю правильных ответов при управлении нейроинтерфейсом, основанным на классифицировании ЭЭГ при реальных движениях руки, значимых изменений не было выявлено (McGeady et al., 2021).
Механотерапия широко применяется в двигательной реабилитации (Даминов, 2013; Бодрова, 2012). В сочетании с ЧЭССМ механотерапия становится более эффективной (Harkema et al., 2011, Grishin et al., 2019; Богачева и др., 2015).
Анализ работ, посвященных методам классификации ЭЭГ, показывает, что наиболее популярные и эффективные алгоритмы основаны на поиске оптимальных пространственных фильтров при помощи метода Common Spatial Patterns (CSP, Lotte et al., 2018; Hramov et al., 2021). В работе (Jayaram, Barachant, 2018) на нескольких наборах данных от разных исследовательских групп было показано, что метод CSP с линейным дискриминантным анализом обеспечивает сопоставимую и нередко более высокую точность классификации (оценивалась площадь под ROС-кривой), чем более продвинутые методы выделения признаков и классификации. Поэтому в данной работе для выделения признаков использовался именно метод CSP, как будет описано далее.
В данной статье представлен инновационный метод нейрореабилитации, основанный на кортико-спинальном нейроинтерфейсе, запускающем ЧЭССМ и механотерапию от сигналов мозга при воображении тыльного сгибания правой (ПС) или левой стопы (ЛС). Анализируется активность мозга, оцениваемая по ДПО сигналов ЭЭГ при воображении этих движений и при инструкции находиться в покое, а также активность мышц, обеспечивающих тыльное сгибание стоп, при управлении нейроинтерфейсом, основанным на кинестетическом воображении этих движений, в зависимости от дополнительных воздействий в виде механотерапии с помощью робототехнического устройства перемещения конечностей и/или ЧЭССМ.
МЕТОДИКА
Для проведения экспериментов использовался разработанный авторами статьи кортикоспинальный нейроинтерфейс (рис. 1) – комплекс на базе нейроинтерфейса со зрительной обратной связью, дополненный механотренажером “Биокин” и электростимулятором “БиоСтим-5”, который обеспечивал чрескожную электростимуляцию спинного мозга (ЧЭССМ). Интерфейс программы нейроинтерфейса и принцип работы классификатора были аналогичны подробно описанным в статье (Боброва и др., 2023). При работе нейроинтерфейса на экране монитора в случайном порядке предъявлялись три инструкции испытуемому: воображать тыльное сгибание ПС – треугольник, направленный вправо (П), ЛС – треугольник влево (Л), находиться в покое – треугольник, направленный вверх (R).
Рис. 1.
Блок-схема кортико-спинального нейроинтерфейса. Пояснения в тексте. Fig. 1. Block diagram of brain-spine neurointerface. Explanations in the text.
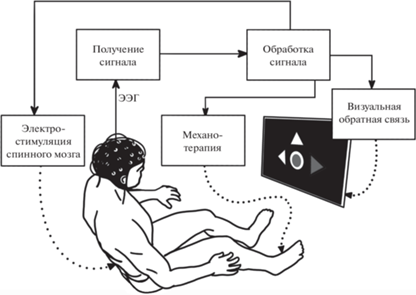
Механотренажер обеспечивал пассивное перемещение конечности в случае успешного воображения движения, задаваемого инструкцией. Успешность оценивалась по ДПО, вычисляемой классификатором нейроинтерфейса. Чем выше ДПО при воображении движения стопы, тем больше угол сгибания в голеностопном суставе.
При ЧЭССМ стимулировали дорсальные корешки спинного мозга на уровне L1–L2 на расстоянии 1.5 см от срединной линии позвоночника во время инструкции воображать движение. При инструкции воображать движения ПС стимулировали корешки справа от средней линии, ЛС – слева; ЧЭССМ запускалась независимо от ДПО. Ритмическая стимуляция осуществлялась через накожные электроды заполненными (5 кГц) бифазными импульсами, длительностью 1 мс, с частотой 15 Гц.
ЭЭГ регистрировали с помощью беспроводного электроэнцефалографа SmartBCI (производства компании “Мицар”, Санкт-Петербург), обеспечивающего возможность записи ЭЭГ с 32 отведений с частотой дикретизации 250 Гц. Электроэнцефалограф (вес 50 г) закреплялся в непосредственной близости от места контакта электродов с поверхностью головы, отсутствие длинного шлейфа позволяло минимизировать влияние сетевых помех и артефактов движения на регистрируемую ЭЭГ.
ЭМГ-активость передних большеберцовых мышц (ПБМ, tibialis anterior), икроножных (ИМ), четырехглавых мышц бедра (ЧМБ) и двуглавых мышц бедра (ДМБ) правой и левой ног регистрировали с помощью беспроводного миографа DELSYS Trigno.
Классификация ЭЭГ
Электроэнцефалограмма фильтровалась в диапазоне 5–30 Гц при помощи фильтра Баттерворта 5-го порядка. Для поиска пространственных фильтров использовался метод CSP: отбирались те CSP-компоненты, для которых отношение большей и меньшей дисперсий для двух сравниваемых классов (покой и воображение движений ЛС либо покой и воображение движений ПС) превышало 0.7, при условии, что сумма этих дисперсий равна 1. Если таких компонент не было, то отбирались компоненты с максимальным отношением дисперсий. Минимальное число отобранных компонент равнялось 6. Логарифмы дисперсий отобранных компонент образовывали векторы признаков, которые классифицировались при помощи квадратичного дискриминантного анализа.
Процедура эксперимента
В эксперименте приняли участие 10 испытуемых (6 женщин и 4 мужчин в возрасте 21–35 лет), до этого не имевших опыта управления нейроинтерфейсом. Протокол исследования соответствовал требованиям Хельсинкской декларации и был одобрен Этической комиссией Института физиологии им. И.П. Павлова РАН. Исследования проводили с соблюдением основных биоэтических правил, все испытуемые дали письменное согласие на участие в экспериментах.
Каждый испытуемый принял участие в 1 сессии, включающей в себя 4 сеанса управления нейроинтерфейсом, основанным на воображении тыльного сгибания ПС или ЛС, с разными условиями: 1) управление нейроинтерфейсом без дополнительных воздействий, 2) управление нейроинтерфейсом с добавлением механотерапии, т.е. с пассивным приведением в движение стоп с помощью робототехнического устройства перемещения конечностей (механотренажера “БиоКин”) в случае высокого значения ДПО, 3) управление нейроинтерфейсом с включением ЧЭССМ при инструкции испытуемому воображать движение, 4) управление нейроинтерфейсом с обоими видами дополнительных воздействий. Кроме того, в начале эксперимента проводили регистрацию ЭМГ-активности в трех условиях: 1) при пассивном перемещении стоп в механотренажере с максимальной, но комфортной амплитудой движения, 2) при активном повторении испытуемым этих же движений в том же темпе и 3) при воображении этих же движений той же амплитуды и в том же темпе.
Анализ данных
Анализировали интегральные характеристики ЭМГ-активности мышц нижних конечностей при реальных и воображаемых движениях стоп при разных условиях проведения эксперимента. Рассчитывалось среднее значение модуля сигнала ЭМГ в интервалы времени при инструкции участнику эксперимента воображать движения ПС, ЛС и в покое (R).
Для оценки влияния условий эксперимента и инструкций испытуемому на ЭМГ-активность мышц и ДПО использовали дисперсионный анализ. Перед проведением дисперсионного анализа проводили разведывательный анализ Explore, который позволяет выявить выбросы и визуализировать распределения. Оценку отклонений распределения от нормального проводили с использованием критерия Колмогорова–Смирнова. В случае отклонения от нормальности, которое было выявлено для ЭМГ-активности, но не для ДПО, логарифмировали данные с целью симметризации распределения и приближения его к нормальному.
Затем при анализе ЭМГ-активности проводили двухфакторный дисперсионный анализ ANOVA RM (Analysis of Variance, Repeated Measures) для зависимых переменных – факторы Условие (1/2/3/4) и Инструкция (Л/П/R). Затем, с целью уточнения результатов для выявления влияния условия (т.е. значимости стимуляционных воздействий) проводили однофакторный дисперсионный анализ ANOVA RM – фактор Условие (1/2/3/4) – по отдельности для правой и левой ПБМ для каждой из инструкций Л, П, и R.
Различия в зависимости от экспериментальных условий ДПО сигналов мозга при воображении движений ПС по сравнению с состоянием покоя и ЛС по сравнению с состоянием покоя оценивали методом двухфакторного дисперсионного анализа ANOVA RM – факторы Условие (1/2/3/4) и Стопа (ПС/ЛС).
В случае выявления значимых эффектов анализировали множественные сравнения. Статистические решения принимались на 5%-м уровне.
Расчеты проводились с использованием программного комплекса SPSS Inc.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Показатели работы ИМК приводятся в табл. 1. Приводятся средние числа правильных положительных и отрицательных ответов, средние числа ложных положительных и отрицательных ответов, F-мера, точность, полнота и доля правильных ответов, а также стандартные отклонения для этих величин, ДПО.
Таблица 1.
Показатели работы ИМК. TP — число правильных положительных ответов (воображение движения), TN — число правильных отрицательных ответов (покой), FP и FN — число ложных положительных и отрицательных ответов Table 1. The BCI performance measures. TP stands for True Positives (motor imagery detection), TN stands for True Negatives (resting state detection), FP stands for False Positives, and FN stands for False Negatives
| Доп. условие | Конечность | TP | TN | FP | FN | F-мера | Точность | Полнота | Доля правильных ответов (ДПО), % |
|---|---|---|---|---|---|---|---|---|---|
| Нет | Левая | 289 ± 50 | 262 ± 41 | 144 ± 41 | 117 ± 50 | 0.69 ± 0.07 | 0.67 ± 0.06 | 0.71 ± 0.12 | 68 ± 6 |
| Правая | 288 ± 52 | 261 ± 44 | 145 ± 44 | 118 ± 52 | 0.68 ± 0.07 | 0.67 ± 0.06 | 0.71 ± 0.13 | 68 ± 7 | |
| Механотерапия | Левая | 303 ± 36 | 282 ± 31 | 124 ± 31 | 103 ± 36 | 0.73 ± 0.05 | 0.71 ± 0.05 | 0.75 ± 0.09 | 72 ± 4 |
| Правая | 306 ± 36 | 280 ± 41 | 126 ± 41 | 100 ± 36 | 0.73 ± 0.04 | 0.71 ± 0.06 | 0.75 ± 0.09 | 72 ± 4 | |
| ЧЭССМ | Левая | 320 ± 36 | 287 ± 34 | 119 ± 34 | 86 ± 36 | 0.76 ± 0.05 | 0.73 ± 0.05 | 0.79 ± 0.09 | 75 ± 5 |
| Правая | 320 ± 40 | 278 ± 47 | 128 ± 47 | 86 ± 40 | 0.75 ± 0.07 | 0.72 ± 0.08 | 0.79 ± 0.10 | 74 ± 7 | |
| Механотерапия + + ЧЭССМ | Левая | 336 ± 30 | 300 ± 48 | 106 ± 48 | 70 ± 30 | 0.79 ± 0.05 | 0.77 ± 0.08 | 0.83 ± 0.07 | 78 ± 6 |
| Правая | 330 ± 31 | 291 ± 48 | 115 ± 48 | 76 ± 31 | 0.78 ± 0.05 | 0.75 ± 0.08 | 0.81 ± 0.08 | 76 ± 6 |
Анализ значимости различий ДПО при разных условиях проведения экспериментов при воображении движений ПС и ЛС проводили методом двухфакторного дисперсионного анализа ANOVA RM, факторы Условие (1/2/3/4) и Стопа (ПС/ЛС). Этот анализ выявил главные эффекты, свидетельствующие о значимости главного эффекта только для фактора Условие, F(3.27) = 12, p < 0.001, η2 = = 0.571, но не для фактора Воображаемая стопа и не для взаимодействия факторов. Следовательно, отличий в ДПО при воображении движения ПС по сравнению с покоем и ЛС по сравнению с покоем не выявлено ни для одного из условий проведения эксперимента. Отличия же ДПО в зависимости от условия проведения эксперимента на основании анализа множественных сравнений таковы:
1. ДПО при всех условиях с дополнительными воздействиями выше, чем при работе с нейроинтерфейсом без них (рис. 2а, б). Все эти различия статистически значимы, за исключением тенденции (р = 0.063) при добавлении механотерапии (т.е. при сравнении усл. 1 и 2) в условиях воображения движений ЛС.
Рис. 2.
Доля правильных ответов при классификации сигналов мозга при воображении движений левой (a) и правой (б) стопы по сравнению с покоем. Звездочки (*) между столбцами – значимые отличия точности классификации сигналов мозга при разных условиях эксперимента: 1 – при работе с нейроинтерфейсом без дополнительных воздействий, 2 – при добавлении механотерапии, 3 – при добавлении ЧЭССМ, 4 – при добавлении обоих воздействий. * – р < 0.05, для тенденций значимости величины р представлены на графиках вместо *. Fig. 2. The accuracy of classification of brain signals during the imagination of movements of the left (a) and the right (б) foot compared to the rest. Asterisks (*) between the columns indicate significant differences in the accuracy of classifying brain signals under different experimental conditions: 1 – when working with the neural interface without additional impact, 2 – with the addition of mechanotherapy, 3 – with the addition of TESCS, 4 – with the addition of both impacts. * – p < 0.05, in a case of trends in significance, p values are presented on the graphs instead of *.
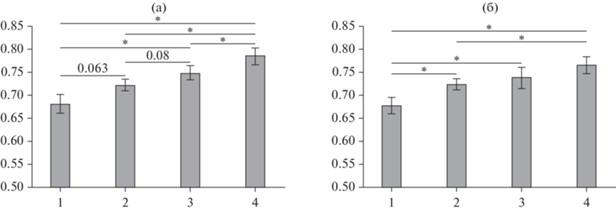
2. При воображении движений как ПС, так и ЛС ДПО выше при совместном воздействии механотерапии и ЧЭССМ (усл. 4), чем при добавлении только механотерапии (усл. 2), т.е. добавление ЧЭССМ к механотерапии значимо увеличивает ДПО (рис. 2 (а, б)).
3. Сравнение усл. 3 и 4 показывает, что добавление механотерапии к ЧЭССМ значимо увеличивает ДПО только при воображении движений ЛС (рис. 2 (а)), кроме того, при воображении движений ЛС есть тенденция (р = 0.08) большей ДПО при добавлении ЧЭССМ, чем механотерапии (рис. 2 (а)).
Несмотря на то, что, согласно инструкции, испытуемые должны были только воображать, но не осуществлять движения в ходе работы с нейроинтерфейсом, у большинства испытуемых была выявлена мышечная активность, наиболее выраженная в ПБМ – той мышце, которая в реальности осуществляет тыльное сгибание стопы, которое следовало воображать в эксперименте (табл. 2). В связи с этим далее будут описаны особенности ЭМГ-активности именно этой мышцы – ПБМ.
Таблица 2.
ЭМГ-активность (в мкВ ± SD) мышц правой (П) и левой (Л) ног (ЧМБ – четырехглавая мышца бедра, ДМБ – двуглавая мышца бедра, ПБМ – передняя большеберцовая мышца, ИМ – икроножная мышца) при разных условиях эксперимента: 1 – при работе с нейроинтерфейсом без дополнительных воздействий, 2 – при добавлении механотерапии, 3 – при добавлении ЧЭССМ, 4 – при добавлении обоих воздействий Table 2. EMG activity (in μV ± SD) of the muscles of the right (П) and left (Л) legs (ЧМБ – quadriceps femoris, ДМБ – biceps femoris, ПБМ – tibialis anterior, ИМ – gastrocnemius) under different experimental conditions: 1 – neural interface control without additional impact, 2 – with the addition of mechanotherapy, 3 – with the addition of TESCS, 4 – with the addition of both impacts
| Условие | ЧМБ Л | ДМБ Л | ПБМ Л | ИМ Л | ЧМБ П | ДМБ П | ПБМ П | ИМ П |
|---|---|---|---|---|---|---|---|---|
| 1 | 1.7 ± 0.4 | 1.7 ± 0.4 | 4.2 ± 3.1 | 1.7 ± 0.3 | 1.8 ± 0.5 | 2.1 ± 0.8 | 4.2 ± 2.3 | 1.7 ± 0.4 |
| 2 | 1.7 ± 0.4 | 1.6 ± 0.3 | 7.0 ± 6.6 | 1.8 ± 0.3 | 1.7 ± 0.5 | 1.8 ± 0.3 | 6.6 ± 4.9 | 1.8 ± 0.3 |
| 3 | 2.0 ± 0.4 | 1.7 ± 0.2 | 3.8 ± 1.9 | 1.6 ± 0.2 | 2.1 ± 0.6 | 1.9 ± 0.5 | 4.0 ± 0.7 | 1.6 ± 0.3 |
| 4 | 2.0 ± 0.4 | 1.8 ± 0.4 | 6.5 ± 4.7 | 1.7 ± 0.3 | 2.2 ± 0.6 | 1.9 ± 0.4 | 6.1 ± 5.1 | 1.7 ± 0.3 |
Активность ПБМ чаще, но не всегда синхронизирована с инструкцией воображать движения. У некоторых испытуемых она возникает при инструкции, но длится дольше и может захватывать еще один или несколько следующих отрезков времени, в которые предъявляются уже другие инструкции. У одного из испытуемых попытки воображать движение вызывали почти непрерывную активность ПБМ. В ряде случаев активность может возникать на мышце, контралатеральной стопе, движение которой воображается, а механотерапия и/или ЧЭССМ синхронизирует активность мышцы с инструкцией и увеличивает амплитуду ЭМГ.
Для количественной оценки этих наблюдений был проведен дисперсионный анализ ЭМГ-активности ПБМ во временные интервалы, когда предъявлялась инструкция воображать сгибание ЛС (Л) или ПС (П), а также при инструкции находиться в покое (R). Двухфакторный дисперсионный анализ ANOVA RM, факторы Условие (1/2/3/4) и Инструкция (Л/П/R), выявил главные эффекты, представленные в табл. 3. Как можно видеть из табл. 3, получено значимое влияние фактора Инструкция (Л/П/R), а также значимое взаимодействие факторов на ЭМГ-активность ПБМ, но не значимое влияние для фактора Условие, т.е. не выявляется значимых изменений в зависимости от наличия/отсутствия стимуляционных воздействий.
Таблица 3.
Главные эффекты двухфакторного дисперсионного анализа ANOVA RM, факторы Условие (1/2/3/4) и Инструкция(Л/П/R) Table 3. Main effects of two-way analysis of variance ANOVA RM Factors condition (1/2/3/4) and instruction (Л/П/R)
| Мышца | Факторы | Tests of Within-Subjects Effects (Гринхауз–Гейзер тест) |
|---|---|---|
| Левая ПБМ | Инструкция | F(1.2, 10.8) = 14.6, p = 0.002, η2 = 0.619 |
| Левая ПБМ | Условие * инструкция | F(2.2, 19.6) = 7.1, p = 0.004, η2 = 0.619 |
| Правая ПБМ | Инструкция | F(1.1, 9.6) = 10.9, p = 0.008, η2 = 0.547 |
| Правая ПБМ | Условие * инструкция | F(2.5, 17.7) = 6.5, p = 0.008, η2 = 0.420 |
Результаты множественных сравнений представлены на рис. 3 и описаны ниже.
Рис. 3.
ЭМГ-активность левой (а) и правой (б) передней большеберцовой мышцы (мкВ) при инструкциях находиться в покое (R), воображать движения левой (Л) и правой (П) стопы. * над столбцами – значимые отличия от ЭМГ при инструкции находиться в покое (р < 0.05); * между соседними столбцами – значимые отличия между ЭМГ при воображении движений правой и левой стопы при одном из условий эксперимента: 1 (при работе с нейроинтерфейсом без дополнительных воздействий) или 2 (при добавлении механотерапии), или 3 (при добавлении ЧЭССМ), или 4 (при добавлении обоих воздействий) (р < 0.05); * между не соседними столбцами – значимые отличия между ЭМГ при разных условиях эксперимента. Для тенденций значимости величины р представлены на графиках вместо *. Fig. 3. EMG activity of the left (а) and right (б) tibialis anterior (µV) when instructed to be at rest (R), to imagine movements of the left (Л) and of the right (П) foot. * above the columns – significant differences in EMG when subject was instructed to be at rest (p < 0.05); * between adjacent columns – significant differences between EMG when subject was instructed to imagine the movements of the right and left foot under one and the same experimental condition: 1 (when working with the neural interface without additional impact), or 2 (with the addition of mechanotherapy), or 3 (with the addition of TESCS), or 4 (with the addition of both impacts) (p < 0.05); * between non-adjacent columns – significant differences between EMG under different experimental conditions. In a case of trends in significance, p values are shown in the graphs instead of *.
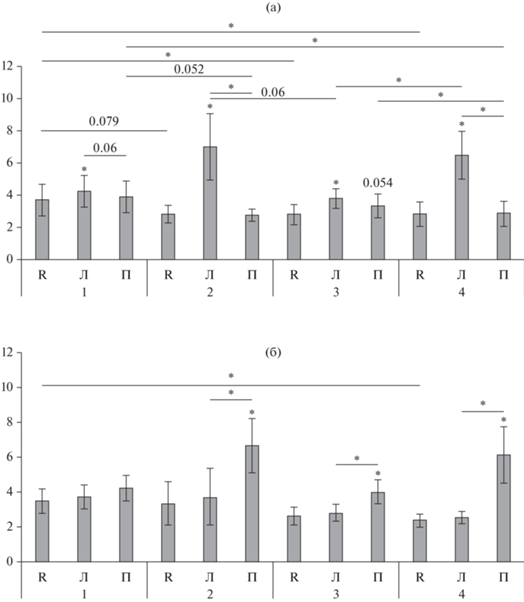
1) При инструкции воображать ипсилатеральные движения (ПС для правой ПБМ и ЛС – для левой ПБМ) ЭМГ-активность ПБМ в среднем по всем испытуемым значимо больше, чем при инструкции находиться в покое для всех четырех условий проведения эксперимента, за исключением ЭМГ-активности правой ПБМ при работе с нейроинтерфейсом без дополнительных воздействий (рис. 3 (б)). При управлении нейроинтерфейсом без дополнительных воздействий увеличение ЭМГ-активности по сравнению с ЭМГ-активностью при инструкции находиться в покое при воображении движений ЛС составляет в среднем по испытуемым 14.8%, при добавлении механотерапии для ПС и ЛС – соответственно 98.3% и 150.0%, при добавлении ЧЭССМ – 51.1% и 35.3%, при добавлении механотерапии и ЧЭССМ одновременно – 156.0% и 129.1%.
2) При инструкции воображать контралатеральные движения стопы ЭМГ-активность как правой, так и левой ПБМ значимо не отличается от ЭМГ-активности при инструкции находиться в покое для всех условий проведения эксперимента.
3) Сравнение ЭМГ-активности ПБМ при воображении движений ипси-и контралатеральной стопы показало, что:
– ЭМГ правой ПБМ (рис. 3 (б)) при воображении движений ипсилатеральной ПС значимо больше, чем при воображении движений контралатеральной ЛС для всех условий, когда имеют место стимуляционные воздействия (на 78.3% при механотерапии, на 42.4% при ЧЭССМ и на 140.3% при одновременном воздействии механотерапии и ЧЭССМ);
– ЭМГ левой ПБМ (рис. 3 (а)) при воображении движений ипсилатеральной ЛС значимо больше, чем при воображении движений контралатеральной ПС при стимуляционных воздействиях, включающих механотерапию: на 39.4% при механотерапии и на 43.8% при одновременном воздействии ЧЭССМ и механотерапии. При работе с нейроинтерфейсом без воздействий имеет место тенденция (р = 0.06), а при добавлении ЧЭССМ значимых отличий нет.
Поскольку двухфакторный анализ не выявил значимых главных эффектов для фактора Условие, с целью детализации влияния условия был дополнительно проведен однофакторный дисперсионный анализ ANOVA RM, фактор Условие (1/2/3/4) по отдельности для правой и левой ПБМ для каждой из инструкций Л, П, и R. При проведении этого анализа были получены значимые главные эффекты для следующих условий (табл. 4): для правой ПБМ – только при условии находиться в покое, для левой ПБМ при инструкции находиться в покое, а также при воображении движений ЛС и ПС.
Таблица 4.
Главные эффекты однофакторных дисперсионных анализов ANOVA RM, фактор Условие (1/2/3/4) Table 4. Main effects of univariate analyses of variance ANOVA RM Factor condition (1/2/3/4)
| Мышца | Инструкция | Tests of Within-Subjects Effects |
|---|---|---|
| Правая ПБМ | Воображать движение ПС (П) | |
| Правая ПБМ | Воображать движение ЛС (Л) | |
| Правая ПБМ | Находиться в покое (R) | F(3.27) = 2.96, p = 0.05, η2 = 0.245 |
| Левая ПБМ | Воображать движение ПС (П) | F(3.27) = 4.8, p = 0.008, η2 = 0.349 |
| Левая ПБМ | Воображать движение ЛС(Л) | F(3.27) = 2.97, p = 0.05, η2 = 0.248 |
| Левая ПБМ | Находиться в покое (R) | F(3.27) = 4.5, p = 0.011, η2 = 0.333 |
Результаты множественных сравнений также представлены на рис. 3 и описаны ниже.
1) Сравнение ЭМГ-активности при разных условиях проведения эксперимента при воображении движений ипсилатеральной стопы не выявило значимых различий.
2) Сравнение ЭМГ-активности при разных условиях проведения эксперимента при воображении движений контралатеральной стопы выявило уменьшение в ЭМГ-активности левой ПБМ при добавлении к работе с нейроинтерфейсом стимуляционных воздействий, включающих механотерапию (значимое при совместных воздействиях механотерапии и ЧЭССМ, тенденция, р = 0.052, при добавлении только механотерапии). Для правой ПБМ значимых отличий не выявлено.
3) Сравнение ЭМГ-активности при разных условиях проведения эксперимента при инструкции находиться в покое выявило уменьшение ЭМГ-активности левой ПБМ при всех видах стимуляционных воздействий (значимое при воздействиях, включающих ЧЭССМ, при добавлении механотерапии – тенденция, р = 0.079), значимое уменьшение ЭМГ-активности правой ПБМ – лишь при совместных воздействиях механотерапии и ЧЭССМ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В условиях управления нейроинтерфейсом были выявлены изменения мозговой и мышечной активности в зависимости от дополнительных стимуляционных воздействий.
ДПО при классификации ЭЭГ-сигналов мозга в условиях работы с кортико-спинальным нейроинтерфейсом при всех дополнительных воздействиях увеличивалась, в большей степени при совместных воздействиях механотерапии и ЧЭССМ. По-видимому, механотерапия и ЧЭССМ приводят к активации кортикальных нейронных сетей, обеспечивающих воображение движений (что проявляется в увеличении ДПО). Влияние механотерапии на изменение ЭЭГ-активности связано, по-видимому, с увеличением восходящего афферентного потока в структуры головного мозга при механотерапии, приводящей к пассивному растяжению мышц, обеспечивающих движение стопы. Увеличение ДПО при ЧЭССМ находится в соответствии с имеющимися в литературе сведениями о влиянии ЧЭССМ на активность головного мозга (Telkes et al., 2020; Ridder et al., 2013; Bentley et al., 2016; McGeady et al., 2021; Steele et al., 2022; Moens et al., 2012; Manson et al., 2022).
По сравнению с ЭМГ-активностью других мышц нижних конечностей, зарегистрированных в нашем эксперименте, наибольшая ЭМГ-активность при управлении нейроинтерфейсом наблюдалась в ПБМ – мышце, обеспечивающей реальное осуществление воображаемого тыльного сгибания стопы. Наличие ЭМГ-активности в мышце при воображении движения соответствует имеющимся в литературе данным о возникновении сублиминальной (неосознаваемой) мышечной активности при воображении движений (Hashimoto, Rothwell, 1999; Gandevia et al., 1997, Dickstein et al., 2005, Guillot et al., 2007).
Активность ПБМ во время инструкции воображать движение ипсилатеральной стопы была значимо увеличена по сравнению с активностью ПБМ во время инструкции находиться в покое при всех условиях проведения эксперимента, за исключением активности правой ПБМ при воображении движений ПС в условиях работы с нейроинтерфейсом без дополнительных стимуляционных воздействий (рис. 3 (б)). Такое отличие в активности правой и левой ПБМ при воображении движений ипсилатеральной стопы может быть связано с межполушарными различиями системы регуляции движений: специализацией правого полушария на формировании целостного представления о состоянии тела – “схемы тела” и движениях, осуществляемых с использованием обратных связей, левого – на регуляции быстрых баллистических движений, мелкой моторики, речи (Harrington, Haaland, 1991; Haaland et al., 2004; Bobrova et al., 2013; 2015; 2017; Sainburg, 2005; Sainburg, Duff, 2006). Кроме того, это отличие может быть связано с асимметрией процессов внимания: из трех разных, но взаимосвязанных сетей внимания (сети оповещения, ориентации и исполнительного контроля (alerting, orienting, and executive control networks)) сеть оповещения асимметрична и включает правую лобную и правую теменную кору, а также таламус (Posner, Rothbart, 2007). Очевидно, что задача воображения движения требует от испытуемого сильной концентрации внимания.
При добавлении стимуляционных воздействий, когда ДПО увеличивалась, активность ПБМ при воображении движений ипсилатеральной стопы была всегда значимо больше, чем в покое. Увеличение активности ПБМ при воображении движения ипсилатеральной стопы по сравнению с покоем в большей степени было выражено при условиях, активирующих пассивное перемещение стопы (т.е. при механотерапии, а также при совместном воздействии механотерапии и ЧЭССМ). Однако значимых отличий от активности ПБМ при воображении движений ипсилатеральной стопы при управлении нейроинтерфейсом без дополнительных воздействий не выявлено. Лишь значимо бОльшие величины ЭМГ-активности при условиях, включающих механотерапию, чем при добавлении ЧЭССМ, выявлены для левой ПБМ (рис. 3 (а)).
Тем не менее значимые различия в активности обеих ПБМ в зависимости от наличия/отсутствия дополнительных воздействий выявлены, но выявлены они для временных интервалов при инструкции находиться в покое, а также для левой ПБМ при инструкции воображать движение противоположной стопы. В эти временные интервалы одновременное добавление механотерапии и ЧЭССМ приводит к уменьшению активности ПБМ по сравнению с таковой при управлении нейроинтерфейсом без дополнительных воздействий. Аналогичный эффект наблюдается для левой ПБМ при ЧЭССМ и в виде тенденции – при добавлении механотерапии. Это, как можно предполагать, связано с тем, что дополнительная стимуляция помогает синхронизировать воображение движений с инструкцией и “вытормозить” мышечную активность в периоды, когда задаваемое инструкцией намерение осуществить конкретное движение отсутствует. Аналогичных сведений в литературе нами не обнаружено, хотя есть сведения о роли сетей спинного мозга, включающих тормозные интернейроны и обеспечивающих торможение движения во время его мысленного воображения (Столбков и др., 2018; Grosprêtre et al., 2016). Такого рода эффекты, по-видимому, важны для формирования адекватных координационных паттернов в “оркестре” (по образному выражению Н.А. Бернштейна) управляющих сигналов от ЦНС при реализации движений.
Рассматривая результаты в целом, отметим, что влияние дополнительных стимуляционных воздействий на ЭМГ-активность было в большей степени выражено для левой, чем для правой ПБМ, причиной чего, как уже предполагалось выше, может быть межполушарная асимметрия системы регуляции движений и внимания (Harrington, Haaland, 1991; Haaland et al., 2004; Bobrova et al., 2013; 2015; 2017; Sainburg, 2005; Sainburg, Duff, 2006; Posner, Rothbart, 2007).
ВЫВОДЫ
1. Апробирована работа с кортико-спинальным нейроинтерфейсом, основанным на кинестетическом воображении тыльного сгибания стопы, в условиях наличия или отсутствия дополнительных стимуляционных воздействий в виде механотерапии и ЧЭССМ.
2. При работе с кортико-спинальным нейроинтерфейсом активность ПБМ – мышцы, осуществляющей в реальности воображение этого движения, выше, чем у остальных мышц нижних конечностей (камбаловидных, латеральных широких мышц бедра и двуглавых мышц бедра).
3. При работе с кортико-спинальным нейроинтерфейсом без дополнительных стимуляционных воздействий активность левой, но не правой ПБМ, выше во временные интервалы, когда испытуемый получал инструкцию воображать движение ипсилатеральной стопы, чем при инструкции находиться в покое. Это отличие, как предполагается, связано с асимметрией системы регуляции движений и внимания.
4. В условиях добавления механотерапии в случае успешного распознавания воображаемого движения стопы (оцененного по ДПО) и/или добавления ЧЭССМ при инструкции воображать ипсилатеральное движение стопы активность обеих ПБМ значимо выше, чем при инструкции находиться в покое.
5. Дополнительные воздействия в виде механотерапии и ЧЭССМ приводят к увеличению ДПО сигналов мозга, что, по-видимому, свидетельствует об активации кортикальных нейронных сетей, обеспечивающих воображение движений.
6. Подключение механотерапии и ЧЭССМ при работе кортико-спинального нейроинтерфейса в большей степени влияет не на активность ПБМ, движение которых воображается, но на синхронизацию их активности с намерением осуществить конкретное движение (в нашем случае – синхронизация с инструкцией), которая проявляется в вытормаживании активности ПБМ, движение которых согласно инструкции не следует воображать в соответствующий временной интервал.
7. Влияние дополнительных стимуляционных воздействий на ЭМГ-активность было в большей степени выражено для левой, чем для правой ПБМ, причиной чего может быть межполушарная асимметрия системы регуляции движений и внимания.
Список литературы
Фролов А.A., Бобров П.Д. Интерфейс мозг-компьютер: Нейрофизиологические предпосылки и клиническое применение. Журн. высш.нервн. деятельности им. И.П. Павлова. 2017. 67 (4): 365–376.
Боброва Е.В., Решетникова В.В., Вершинина Е.А., Гришин А.А., Исаев М.Р., Бобров П.Д., Герасименко Ю.П. Оценка эффективности управления мозг-компьютерным интерфейсом при обучении воображению движений верхних и нижних конечностей. Журн высш.нервн. деятельности им. И.П. Павлова. 2022. 73 (1): 52–61.
Боброва Е.В., Решетникова В.В., Фролов А.А., Герасименко Ю.П. Воображение движений нижних конечностей для управления системами “интерфейс мозг–компьютер”. Журн. высш.нервн. деятельности им. И.П. Павлова. 2019. 69 (5): 529–540.
Богачева И.Н., Мошонкина Т.Р., Боброва Е.В., Гришин А.А., Якупов Р.Н., Балыкин Ю.М., Герасименко Ю.П. Эффект чрескожной электрической стимуляции спинного мозга и механотерапии в регуляции активности мышц ног. Вестник ТвГУ. Серия: Биология и экология. 2015. 2: 7–17.
Бодрова Р.А. Механотерапия с биологической обратной связью: эффективная реабилитация при травме спинного мозга. Доктор.Ру. 2012. 10 (78): 46–47.
Городничев Р.М., Пивоварова Е.А., Пухов А., Моисеев С.А., Савохин А.А., Мошонкина Т.Р., Щербакова Н.А., Килимник В.А., Селионов В.А., Козловская И.Б., Эджертон Р., Герасименко Ю.П. Чрезкожная электрическая стимуляция спинного мозга: неинвазивный способ активации генераторов шагательных движений у человека. Физиология человека. 2012. 38 (2): 46–56.
Даминов В.Д. Роботизированная механотерапия в нейрореабилитации. Вестник АГИУВ. 2013. 3: 83–88.
Столбков Ю.К., Мошонкина Т.Р., Орлов И.В., Козловская И.Б., Герасименко Ю.П. Воображаемые движения как средство совершенствования и реабилитации моторных функций. Успехи физиологических наук. 2018. 49 (2): 45–59.
Alam M., Rodrigues W., Pham B.N., Thakor N.V. Brain-machine interface facilitated neurorehabilitation via spinal stimulation after spinal cord injury: recent progress and future perspectives. Brain Res. 2016. 1646: 25–33.
Bai Z., Fong K.N.K., Zhang J.J., Chan J., Ting K.H. Immediate and long-term effects of BCI-based rehabilitation of the upper extremity after stroke: a systematic review and meta-analysis. J Neuroeng Rehabil. 2020. 17 (1): 57.
Bentley L.D., Duarte R.V., Furlong P.L., Ashford R.L., Raphael J.H. Brain activity modifications following spinal cord stimulation for chronic neuropathic pain: a systematic review. Eur. J. Pain. 2016. 20: 499–511.
Bobrova E.V., Bogacheva I.N., Lyakhovetskii V.A., Fabinskaja A.A., Fomina E.V. Memorization of sequences of movements of the right and left hand by right- and left-handers. Hum. Physiol. 2015. 41: 629–635.
Bobrova E.V., Bogacheva I.N., Lyakhovetskii V.A., Fabinskaja A.A., Fomina E.V. Memorization of sequences of movements of the right or the left hand by right- and left-handers: vector coding. Hum. Physiol. 2017. 43. 13–21.
Bobrova E.V., Lyakhovetskii V.A., Borshchevskaya E.R. The role of “prehistory” in the reproduction of sequential movements of the right and left hands: encoding of positions, movements, and sequence structure. Neurosci. Behav. Physiol. 2013. 43: 56–62.
Bonizzato M., Pidpruzhnykova G., DiGiovanna J., Shkorbatova P., Pavlova N., Micera S., Courtine G. Brain-controlled modulation of spinal circuits improves recovery from spinal cord injury. Nat. Commun. 2018. 9: 1–14.
Bouton C.E. Chapter 22 – Merging brain-computer interface and functional electrical stimulation technologies for movement restoration. Handbook of Clinical Neurology. Eds: Ramsey N.F., Millán J. del R. Elsevier, 2020. 168: 303–309.
Burianová H., Marstaller L., Rich A.N., Williams M.A., Savage G., Ryan M., Sowman P.F. Motor neuroplasticity: A MEG-fMRI study of motor imagery and execution in healthy ageing. Neuropsychologia. 2020. 146: 107539.
Camargo-Vargas D., Callejas-Cuervo M., Mazzoleni S. Brain-computer interfaces systems for upper and lower limb rehabilitation: a systematic review. Sensors. 2021. 21 (13): 4312.
Capogrosso M., Milekovic T., Borton D., Wagner F., Moraud E.M., Mignardot J.B., Buse N., Gandar J., Barraud Q., Xing D., Rey E., Duis S., Jianzhong Y., Ko W.K., Li Q., Detemple P., Denison T., Micera S., Bezard E., Bloch J., Courtine G. A brain-spine interface alleviating gait deficits after spinal cord injury in primates. Nature. 2016. 539: 284–288.
Cardoso V.F., Delisle-Rodriguez D., Romero-Laiseca M.A., Loterio F.A., Gurve D., Floriano A., Valadão C., Silva L., Krishnan S., Frizera-Neto A., Freire Bastos-Filho T. Effect of a brain–computer interface based on pedaling motor imagery on cortical excitability and connectivity. Sensors. 2021. 21 (6): 2020.
Cheron G., Duvinage M., De Saedeleer C., Castermans T., Bengoetxea A., Petieau M., Seetharaman K., Hoellinger T., Dan B., Dutoit T., Sylos L.F., Lacquaniti F., Ivanenko Y. From spinal central pattern generators to cortical network: integrated BCI for walking rehabilitation. Neural Plast. 2012: 375148.
Cui Z., Li Y., Huang S., Wu X., Fu X., Liu F., Wan X., Wang X., Zhang Y., Qiu H., Chen F., Yang P., Zhu S., Li J., Chen W. BCI system with lower-limb robot improves rehabilitation in spinal cord injury patients through short-term training: a pilot study. Cogn. Neurodyn. 2022. 16: 1283–1301.
De Ridder D., Plazier M., Kamerling N., Menovsky T., Vanneste S. Burst spinal cord stimulation for limb and back pain. World Neurosurg. 2013. 80: 642–649.
Dickstein R., Gazit-Grunwald M., Plax M., Dunsky A., Marcovitz E. EMG activity in selected target muscles during imagery rising on tiptoes in healthy adults and poststroke hemiparetic patients. J. Motor Behavior. 2005. 37 (6): 475–483.
Do A.H., Wang P.T., King C.E., Abiri A., Nenadic Z. Brain-computer interface controlled functional electrical stimulation system for ankle movement. J. Neuroeng. Rehabil. 2011. 8:49.
Do A.H., Wang P.T., King C.E., Chun S.N., Nenadic Z. Brain-computer interface controlled robotic gait orthosis. J. Neuroeng. Rehabil. 2013. 10:111.
Donati A., Shokur S., Morya E., Campos D., Moioli R., Gitti C., Augusto P., Tripodi S., Pires C., Pereira G., Brasil F., Gallo S., Lin A., Takigami A., Aratanha M., Bleuler H., Cheng G., Rudolph A., Nicolelis M. Long-term training with a brain-machine interface-based gait protocol induces partial neurological recovery in paraplegic patients. Scientific Reports. 2016. 6: 30383.
Gandevia S.C., Wilson L.R., Inglis J.T., Burke D. Mental rehearsal of motor tasks recruits α-motoneurones but fails to recruit human fusimotor neurones selectively. J. Physiol. 1997. 505 (1): 259–266.
Gao W., Cui Z., Yu Y., Mao J., Xu J., Ji L., Kan X., Shen X., Li X., Zhu S., Hong Y. Application of a brain–computer interface system with visual and motor feedback in limb and brain functional rehabilitation after stroke: case report. Brain Sciences. 2022. 12 (8): 1083.
García-Cossio E., Severens M., Nienhuis B., Duysens J., Desain P., Keijsers N., Farquhar J. Decoding sensorimotor rhythms during robotic-assisted treadmill walking for brain computer interface (BCI) applications. PLoS One. 2015. 10 (12): e0137910.
Geiger D.E., Behrendt F., Schuster-Amft C. EMG muscle activation pattern of four lower extremity muscles during stair climbing, motor imagery, and robot-assisted stepping: a cross-sectional study in healthy individuals. BioMed. Research International. 2019. 2019: 9351689.
Gerasimenko Y., Gorodnichev R., Puhov A., Moshon-kina T., Savochin A., Selionov V., Roy R.R., Lu D.C., Edgerton V.R. Initiation and modulation of locomotor circuitry output with multisite transcutaneous electrical stimulation of the spinal cord in noninjured humans. J. Neurophysiol. 2015. 113 (3): 834–842.
Grishin A.A., Moshonkina T.R., Bobrova E.V., Gerasimenko Yu.P. A device for the rehabilitation therapy of patients with motor pathology using mechanotherapy, transcutaneous electrical stimulation of the spinal cord, and biological feedback. Biomed. Eng. 2019. 53: 227–230.
Grosprêtre S., Lebon F., Papaxanthis C., Martin A. New evidence of corticospinal network modulation induced by motor imagery. J Neurophysiol. 2016. 115 (3): 1279–1288.
Guillot A., Lebon F., Rouffet D., Champely S., Doyon J., Collet C. Muscular responses during motor imagery as a function of muscle contraction types. Internation J. Psychophysiol. 2007. 66 (1): 18–27.
Haaland K.Y. Hemispheric asymmetries for kinematic and positional aspects of reaching. Brain. 2004. 127: 1145–1158.
Harkema S., Gerasimenko Y., Hodes J., Burdick J., Angeli C., Chen Y., Ferreira C., Willhite A., Rejc E., Grossman R.G., Edgerton V.R. Effect of epidural stimulation of the lumbosacral spinal cord on voluntary movement, standing, and assisted stepping after motor complete paraplegia: a case study. Lancet. 2011. 377 (9781): 1938–1947.
Harrington D.L., Haaland K.Y. Hemispheric specialization for motor sequencing: Abnormalities in levels of programming. Neuropsychologia. 1991. 29: 147–163.
Hashimoto R., Rothwell J.C. Dynamic changes in corticospinal excitability during motor imagery,” Exp. Brain Res. 1999. 125 (1): 75–81.
Hramov A.E., Maksimenko V.A., Pisarchik A.N. Physical principles of brain–computer interfaces and their applications for rehabilitation, robotics and control of human brain states. Physics Reports. 2021. 918: 1–133.
Insausti-Delgado A., López-Larraz E., Nishimura Y., Ziemann U., Ramos-Murguialday A. Non-invasive brain-spine interface: continuous control of trans-spinal magnetic stimulation using EEG. Front. Bioeng. Biotechnol. 2022. 10: 975037.
Jayaram V., Barachant A. MOABB: trustworthy algorithm benchmarking for BCIs. Journal of neural engineering. 2018. 15 (6). 066011.
Kaneko F., Hayami T., Aoyama T., Kizuka T. Motor imagery and electrical stimulation reproduce corticospinal excitability at levels similar to voluntary muscle contraction. J. Neuroeng. Rehabil. 2014. 11: 94.
King C.E., Wang P.T., Chui L.A., Do A.H., Nenadic Z. Operation of a brain-computer interface walking simulator for individuals with spinal cord injury. J. Neuroeng. Rehabil. 2013. 10:77.
King C.E., Wang P.T., McCrimmon C.M., Chou C.C.Y., Do A.H., Nenadic Z. Brain-computer interface driven functional electrical stimulation system for overground walking in spinal cord injury participant. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014. 2014: 1238–1242.
King C.E., Wang P.T., McCrimmon C.M., Chou C.C.Y., Do A.H., Nenadic Z. The feasibility of a brain-computer interface functional electrical stimulation system for the restoration of overground walking after paraplegia. J. Neuroeng. Rehabil. 2015. 12: 80.
Li C., Wei J., Huang X., Duan Q., Zhang T. Effects of a brain-computer interface-operated lower limb rehabilitation robot on motor function recovery in patients with stroke. J. Healthcare Engineering. 2021. 2021: 4710044.
Lotte F., Bougrain L., Cichocki A., Clerc M., Congedo M., Rakotomamonjy A., Yger F. A review of classification algorithms for EEG-based brain–computer interfaces: a 10 year update. Journal of neural engineering. 2018. 15 (3): 031005.
Kruse A., Suica Z., Taeymans J., Schuster-Amft C. Effect of brain-computer interface training based on non-invasive electroencephalography using motor imagery on functional recovery after stroke-a systematic review and meta-analysis BMC neurology. 2020. 20 (1): 1–14.
Luu T.P., He Y., Brown S., Nakagome S., Contreras-Vidal J. Gait adaptation to visual kinematic perturbations using a real-time closed-loop brain–computer interface to a virtual reality avatar. J. Neural Eng. 2016. 13: 036006.
Manson G.A., Atkinson D.A., Shi Z., Sheynin J., Karmonik C., Markley R.L., Sayenko D.G. Transcutaneous spinal stimulation alters cortical and subcortical activation patterns during mimicked-standing: A proof-of-concept fMRI study. Neuroimage: Reports. 2022. 2 (2): 100090.
McGeady C., Vučković A., Zheng Y.-P., Alam M. EEG monitoring is feasible and reliable during simultaneous transcutaneous electrical spinal cord stimulation. Sensors. 2021. 21 (19): 6593.
McPherson J.G., Miller R.R., Perlmutter S.I., McPherson J.G., Robert R., Miller S.I.P. Targeted, activity-dependent spinal stimulation produces long-lasting motor recovery in chronic cervical spinal cord injury. Proc. Natl. Acad. Sci. USA. 2015. 78: 12193–12198.
Moens M., Sunaert S., Mariën P., Brouns R., De Smedt A., Droogmans S., Van Schuerbeek P., Peeters R., Poelaert J., Nuttin B. Spinal cord stimulation modulates cerebral function: an fMRI study. Neuroradiology. 2012. 54 (12): 1399–1407.
Mrachacz-Kersting N., Jiang N., Stevenson A.J., Niazi I.K., Kostic V., Pavlovic A., Radovanovic S., Djuric-Jovicic M., Agosta F., Dremstrup K., Farina D. Efficient neuroplasticity induction in chronic stroke patients by an associative brain-computer interface. J. Neurophysiol. 2016. 115 (3): 1410–21.
Mulder T., De Vries S., Zijlstra S. Observation, imagination and execution of an effortful movement: more evidence for a central explanation of motor imagery. Experimental Brain Research. 2005. 163 (3): 344–351.
Nishimura Y., Perlmutter S.I., Fetz E.E. Restoration of upper limb movement via artificial corticospinal and musculospinal connections in a monkey with spinal cord injury. Front. Neural Circuits. 2013. 7: 57.
Page S.J. An overview of the effectiveness of motor imagery after stroke: a neuroimaging approach. The neurophysiological foundations of mental and motor imagery. Eds: Guillot A., Collet C. Oxford: Oxford Academic, 2012. 145–160 pp.
Pérez M.Q., Beltrán E.T.M., Bernal S.L., Celdrán A.H., Pérez G.M. Breaching subjects' thoughts privacy: a study with visual stimuli and brain-computer interfaces. J. Healthc. Eng. 2021. 9 (2021): 5517637.
Personnier P., Paizis C., Ballay Y., Papaxanthis C. Mentally represented motor actions in normal aging. II. The influence of the gravito-inertial context on the duration of overt and covert arm movements. Behavioural Brain Research. 2008. 186 (2): 273–283.
Pino A., Tovar N., Barria P., Baleta K., Múnera M., Cifuentes C.A. Brain–computer interface for controlling lower-limb exoskeletons. in: interfacing humans and robots for gait assistance and rehabilitation. Springer: Cham, 2022. 237–258 pp.
Posner M.I., Rothbart M.K. Research on attention networks as a model for the integration of psychological science. Annu. Rev. Psychol. 2007. 58: 1–23.
Ranganathan V.K., Siemionow V., Liu J.Z., Sahgal V., Yue G.H. From mental power to muscle power—gaining strength by using the mind. Neuropsychologia. 2004. 42 (7): 944–956.
Ren S., Wang W., Hou Z.-G., Liang X., Wang J., Shi W. enhanced motor imagery based brain-computer interface via FES and VR for lower limb. IEEE Trans. Neural Syst. 2020. 28 (8): 1846–1855.
Saha S., Mamun K.A., Ahmed K.I.U., Mostafa R., Naik G.R., Darvishi S., Khandoker A.H., Baumert M. Progress in Brain Computer Interface: Challenges and Potentials. Frontiers in Systems Neuroscience. 2021. 15: P. 4.
Sainburg R.L. Handedness: differential specializations for control of trajectory and position. Exerc. Sport Sci. Rev. 2005. 33: 206–213.
Sainburg R.L., Duff S.V. Does motor lateralization have implications for stroke rehabilitation? J. Rehabil. Res. Dev. 2006. 43: 311.
Steele A.G., Manson G.A., Horner P.J., Sayenko D.G., Contreras-Vidal J.L. Effects of transcutaneous spinal stimulation on spatiotemporal cortical activation patterns: a proof-of-concept EEG study. J. Neural. Eng. 2022. 19 (4): 046001.
Takahashi M., Takeda K., Otaka Y., Osu R., Hanakawa T., Gouko M., Ito K. Event related desynchronization-modulated functional electrical stimulation system for stroke rehabilitation: A feasibility study. J. NeuroEngineering and Rehabilitation. 2012. 9: 56.
Takahashi Y., Kawakami M., Yamaguchi T., Idogawa Y., Tanabe S., Kondo K., Liu M. Effects of leg motor imagery combined with electrical stimulation on plasticity of corticospinal excitability and spinal reciprocal inhibition. Front. Neurosci. 2019. 13: 149.
Telkes L., Hancu M., Paniccioli S., Grey R., Briotte M., McCarthy K., Raviv N., Pilitsis J.G. Differences in EEG patterns between tonic and high frequency spinal cord stimulation in chronic pain patients. Clinical Neurophysiology. 2020. 131 (8): 1731–1740.
Yadav A.P., Li D., Nicolelis M.A.L. A brain to spine interface for transferring artificial sensory information. Sci. Rep. 2020. 10: 900–915.
Yasui T., Yamaguchi T., Tanabe S., Tatemoto T., Takahashi Y., Kondo K., Kawakami M. Time course of changes in corticospinal excitability induced by motor imagery during action observation combined with peripheral nerve electrical stimulation. Exp. Brain Res. 2019. 237: 637–645.
Zimmermann J.B., Jackson A. Closed-loop control of spinal cord stimulation to restore hand function after paralysis. Front. Neurosci. 2014. 8: 87–88.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


