Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 6, стр. 836-850
Половые различия в рабочей памяти на простые зрительные признаки. Анализ связанных с событием потенциалов в пространстве сенсоров и дипольных источников
Е. С. Михайлова 1, *, Л. А. Майорова 1, 2, Н. Ю. Герасименко 1, А. Б. Кушнир 1, К. А. Салтыков 1
1 ФГБУН Институт высшей нервной деятельности и нейрофизиологии Российской академии наук
Москва, Россия
2 Федеральный научно-клинический центр реаниматологии и реабилитологии
Москва, Россия
* E-mail: mikhailovaes@gmail.com
Поступила в редакцию 01.03.2022
После доработки 20.04.2022
Принята к публикации 26.04.2022
- EDN: OQZPJZ
- DOI: 10.31857/S0044467722060065
Аннотация
На группе 38 испытуемых (19 мужчин и 19 женщин) при выполнении “n-back”-задачи рабочей памяти (РП) показано, что нейронные механизмы обнаружения разницы между текущей и удерживаемой в памяти ориентациями у мужчин и у женщин различны. По данным анализа связанных с событием потенциалов только у мужчин в зрительной коре регистрируется увеличение N150, как маркера раннего выявления изменений. Независимо от совпадения/несовпадения текущей и удерживаемой в памяти ориентаций, мужчины по сравнению с женщинами демонстрируют более высокую амплитуду P200 в затылочно-височных областях, а в центральных – рост позитивности в окне 400–500 мс, что может рассматриваться как проявление усиления селективного внимания к ориентациям и привлечения бо̀льших ресурсов зрительной РП. По результатам многомерного анализа дипольной активности у мужчин в детектирование различий текущей и удерживаемой ориентаций вовлечены преимущественно каудальные проекционные области коры, тогда как женщины демонстрируют бо̀льшее участие фронтальных отделов. Полученные данные указывают на важность пола как фактора, влияющего на нейросетевую организацию переработки зрительно-пространственной информации.
Пол является одним из важных биологических факторов, определяющих особенности нейрофункциональной организации как перцептивных функций, так и когнитивных процессов разной степени сложности. Необходимость учета пола при анализе биологических данных уже давно была замечена рядом исследователей, хотя до последнего времени пол не был предметом систематических нейрофизиологических исследований. В этом отношении очень определенно высказался Л. Кехил: “поразительное количество и разнообразие влияний, связанных с полом, на функции мозга указывают на то, что все еще широко распространенное предположение о незначительности влияния пола неоправданно и может тормозить прогресс в области нейронаук” (Cahill, 2006). Высокая статистическая значимость влияния пола на организацию многих форм поведения, которые находятся за пределами непосредственно половых функций, убедительно показана в обзоре (Voyer et al., 2017), обобщающем результаты большого числа нейробиологических и биомедицинских исследований. Важными для понимания морфологических основ половых различий выполнения когнитивных задач, в том числе и зрительно-пространственных, представляются данные о выраженных половых различиях структурного коннектома мозга, полученные методом диффузионно-тензорной визуализации на большой когорте людей (949 человек, из них 521 женщина, возраст от 8 до 22 лет) (Ingalhalikar et al., 2014). Согласно этим данным, мозг мужчин демонстрирует принцип модульности и гораздо меньшую связанность как внутри, так и между полушариями, чем мозг женщин, который, напротив, отличается значительно большими связями как между полушариями, так и между отдельными модулями внутри полушария. Признается, что это уникальное по объему данных и набору методов обработки исследование продемонстрировало фундаментальные половые различия в архитектуре человеческого мозга (Cahill, 2014).
Зрительно-пространственные способности являются той частью поведения человека, где различия между мужчинами и женщинами проявляются наиболее отчетливо. Так, преимущество мужчин экспериментально подтверждено для таких базовых характеристик зрительного восприятия, как острота, порог контрастной чувствительности, оценка направления движения, ориентационная чувствительность (Shaqiri et al., 2018). Одним из наиболее ярких и часто упоминаемых в литературе проявлений половых различий является преимущество мужчин в тесте трехмерного ментального вращения, которое остается неизменно высоким на протяжении десятков лет (Voyer et al.,1995). Успешность теста ментального вращения положительно коррелирует с выполнением других пространственных задач, например, скоростью выучивания сложных маршрутов на картах (Galea, Kimura, 1993) и эффективностью обучения навигации в виртуальном лабиринте (Moffat et al., 1998). Существуют убедительные экспериментальные подтверждения тесной связи механизмов ментального вращения и зрительно-пространственной рабочей памяти (РП) (Christie et al., 2013).
Рабочая память играет ключевую роль во многих сложных поведенческих процессах, поэтому понимание нейрофизиологических основ половых различий РП может предоставить сведения для более обоснованного понимания гендерной специфичности когнитивных функций. Наш интерес к РП на ориентационные характеристики зрительной среды определяется результатами наших ранее проведенных исследований. В работе (Славуцкая и др., 2014) в психофизическом эксперименте, воспроизводящем тест Бентона, женщины показали снижение точности и увеличение времени реакции по сравнению с мужчинами в задании точного определения ориентаций наклонных линий, что указывает на дефицит у них метрических способностей. При регистрации ВП на набор ориентационных решеток (шаг 9 угловых град.) только у мужчин показана ранняя чувствительность затылочной коры к углу наклона (Михайлова и др., 2020). Методом моделирования распределенных внутримозговых дипольных источников компонентов ВП показано, что на ранних стадиях обработки (компоненты Р100 и N150 ВП) у мужчин значимо выше уровень корковой активации в затылочной, височной и теменной областях коры (Крылова и др., 2015). Можно предположить, что половые различия РП будут проявляться не только на ранних этапах анализа, значимость которых для РП подтверждена экспериментально (Harrison, Tong, 2009; Ester et al., 2009; Михайлова и др., 2019), но и на последующих стадиях переработки сигнала.
Целью настоящей работы был анализ функциональной организации РП на ориентации у мужчин и женщин с привлечением метода связанных с событием потенциалов (ССП). Предполагалось, что регистрация ЭЭГ высокой плотности позволит с хорошим временным разрешением оценить зависимую от пола топографию корковой активации на последовательных этапах переработки информации. Моделирование распределенной дипольной активности и ее статистическая обработка предоставит возможность выявить те области коры, вклад которых в общую структуру активационных изменений может определить различные для мужчин и женщин нейростратегии выполнения зрительно-пространственных задач. Применение “n-back”-модели РП мы рассматривали как более чувствительный тест для оценки половых различий этой функции по сравнению с использованной нами ранее моделью отставленного сопоставления образца с эталоном. Задача “n-back” считается валидным тестом при исследовании нейронных коррелятов РП и, в частности, ее гендерной специфики, в связи с возможностью изменять объем удерживаемой в памяти информации и доступом к высокоуровневым процессам управления, например, обновлению содержания памяти (Lejbak et al., 2011).
МЕТОДИКА
Испытуемые. В исследовании приняли участие 38 испытуемых (19 мужчин и 19 женщин) c нормальным или скорректированным до нормы зрением. Средний возраст мужчин 24.5 ± 0.9, женщин – 24.1 ± 0.9 года. Во всех случаях было получено письменное согласие на проведение исследования, согласно протоколу, утвержденному этической комиссией Института высшей нервной деятельности и нейрофизиологии РАН (протокол № 1 от 15 января от 2020 г.). Исследования проводили c 9 до 15 часов.
Стимулы. Стимулы представляли собой прямоугольные контрастные решетки из черных линий на светло-сером фоне (1 цикл/град.): горизонтальных (0 град.), вертикальных (90 град.) и наклонных (45 град.) линий (рис. 1 (а)).
Рис. 1.
Условия эксперимента. (а) – зрительные стимулы – ориентационные решетки горизонтальной, вертикальной и наклонной (45 град.) ориентации. (б) – схема расположения 128 регистрирующих электродов на скальпе. Цифрами обозначены кластеры электродов, в которых проводили анализ компонентов ССП. 1 – лобный, 2 – центральный, 3 – теменной, 4 – височный и 5 – затылочный. (в) – временная последовательность событий в одном блоке эксперимента – сличение текущего (тестового) и удерживаемого в памяти (эталонного) стимулов. Fig. 1. Experimental conditions. (а) – visual stimuli – orientation gratings of horizontal, vertical, and oblique (45 degrees) orientations. (б) – 128 electrode positions on the scalp. Numbers denote the clusters of electrodes in which the components of ERPs were analyzed. 1 – frontal, 2 – central, 3 – parietal, 4 – temporal, and 5 – occipital clusters. (в) – the sequence of events within an experimental trial for the matching of the current and retained in working memory line orientations.
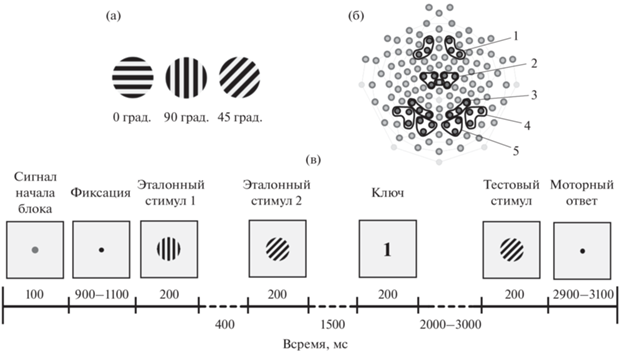
Условия и процедура эксперимента. Во время исследования испытуемый сидел в удобном кресле в затемненной и звукозаглушенной комнате на расстоянии 120 см от экрана монитора Dell E1911c (диагональ 17 дюймов, частота обновления экрана 60 Гц). Размер стимула на экране монитора составлял 6 угловых градусов. Освещенность на уровне глаз – 3 лк. Горизонтальные и вертикальные края корпуса монитора и экрана были закрыты экраном с закругленными краями и круглой апертурой. Предъявление стимулов и регистрацию поведенческих ответов испытуемого осуществляли с помощью программы E-Prime 2.0 (Psychology Software Tools, Inc., USA). Временная схема одного блока эксперимента представлена на рис. 1 (в). Каждый блок состоял из следующих событий: зеленая точка длительностью 100 мс, при появлении который испытуемый должен был сосредоточиться и фиксировать взгляд в центре экрана; черная фиксационная точка, длительность которой в случайном порядке изменялась от 900 до 1100 мс; первый эталонный стимул (200 мс), интервал 400 мс, второй эталонный стимул (200 мс); после периода удержания информации (1500 мс) на экране появлялся “ключ” – цифра 1 или 2, сигнализирующая, с каким из эталонов необходимо сравнивать тестовый стимул. После “ключа” через интервал времени 2000–3000 мс на экране появлялся тестовый стимул (200 мс). Интервал между двумя последовательными блоками в серии варьировал от 2900 до 3100 мс. Весь эксперимент состоял из 114 блоков, в 50% из которых тестовая ориентация совпадала с эталонной, а в 50% не совпадала. Общая длительность эксперимента от 21 до 24 мин в зависимости от длительности варьирующих по времени интервалов между стимулами. Блоки с совпадением и несовпадением предъявлялись в случайном порядке. При совпадении эталонного и тестового стимулов испытуемый должен был нажать на клавишу “1” выносной клавиатуры Response Box (Psychology Software Tools, Inc., USA), при несовпадении – на клавишу “2”. Регистрировали точность, или % правильных ответов, и время двигательной реакции (ВР). Перед экспериментом с испытуемыми проводили тренировочную серию (30 блоков) для знакомства с экспериментальными условиями и тренировки моторному навыку. В этой серии в качестве стимулов использовали изображения букв.
Регистрация и анализ связанных с событием потенциалов. Регистрацию электроэнцефалограммы (ЭЭГ) проводили с помощью 128-канального электроэнцефалографа фирмы Electrical Geodesics Inc. (USA) с использованием шлема Hydro Cel Geodesic Sensor Net. Размер шлема подбирали индивидуально с учетом окружности головы испытуемого. Частота квантования сигнала составляла 500 Гц. В качестве референтного электрода использовали сенсор Cz.
Данные ЭЭГ обрабатывались в программе NetStation 4.5.4 (Electrical Geodesics Inc., USA). Фильтрованные (0.5–45 Гц) записи ЭЭГ каждого испытуемого сегментировали на отрезки длительностью 1300 мс, содержащие 300 мс до предъявления тестового стимула и 1000 мс после. Программно исключали реализации, в которых амплитуда ЭОГ превышала 80 µV. При визуальном анализе исключали фрагменты с ЭМГ и двигательными артефактами. По безартефактным отрезкам ЭЭГ проводили усреднение связанных с событием потенциалов (ССП) на тестовый стимул для правильных ответов. Для усреднения использовано 39.7 ± 2.4 реализаций у мужчин и 44.0 ± ± 2.1 у женщин. Анализ ССП проводили на группе 31 испытуемого (16 мужчин и 15 женщин). Записи девяти испытуемых были исключены в связи с большим (более 50% записи) количеством артефактов.
Программно в NetStation 4.5.4 измеряли адаптивный максимум или минимум компонентов (среднее значение амплитуды в интервале 2 мс до и 2 мс после пика) индивидуальных ССП в кластерах электродов симметричных затылочных (слева электроды №№ 66, 70, 71, справа 76, 83, 84), височных (№№ 58, 59, 65 и 90, 91, 96), теменных (№№ 52, 60, 67 и 77, 85, 92), центральных (№№ 30, 31, 7 и 80, 105, 106), фронтальных (№№ 18, 19, 24 и 4, 10, 124) зон коры (рис. 1 (б)). Приведенные номера сенсоров соответствуют номерам в 128-канальном шлеме Hydro Cel Geodesic Sensor Net. Анализировали следующие компоненты ССП. В затылочном, височном, теменном кластерах – Р100 (окно 60–120 мс), N150 (115–200 мс), Р200 (200–250 мс), N270 (250–320 мс) и P300 (310–370 мс). В центральном кластере – N90 (60–125 мс), Р150 (125–200 мс), N200 (190–250 мс), а для позднего позитивного отклонения измеряли среднюю амплитуду в интервале от 400 до 500 мс. Такой способ измерения амплитуды поздних компонентов рекомендован в литературе (Chen et al., 2019). Во фронтальном кластере измеряли N90 (60–125 мс), Р150 (125–200 мс), N200 (190–250 мс), P250 (250–320 мс), N320 (310–380 мс) и P400 (340–420 мс). При статистической обработке использовали амплитуду компонентов ССП, усредненную по кластерам электродов.
Статистический анализ поведенческих показателей (ВР и точности) и амплитуд компонентов ССП проводили с использованием дисперсионного анализа ANOVA RM с учетом факторов Условие (совпадение и несовпадение эталонной и тестовой ориентаций), Полушарие и Пол. При внутригрупповых post-hoc-сопоставлениях для поправки на множественные сравнения использовали Tukey test, для межгрупповых сопоставлений использовали t-test. Анализ проведен в IBM SPSS Statistics 23 и STATISTICA 10.
Моделирование распределенных дипольных источников компонентов ССП проводили в пакете Brainstorm 3.2 программной среды MatLab. Процедура подробно изложена в статье (Крылова и др., 2015). Для моделирования были взяты индивидуальные ССП для условий совпадения и несовпадения эталонного и тестового стимулов. Моделирование проводили в двух временных интервалах, соответствующих развитию ранних и более поздних компонентов ССП: 50–150 и 150–350 мс от начала тестового стимула. При моделировании объемных распределенных источников ССП проводили усреднение плотности тока источников в упомянутых интервалах с последующей проекцией источников в MNI-пространство. Таким образом для каждого испытуемого были построены карты пространства источников (значений плотности дипольного тока) при совпадении и при несовпадении эталонной и тестовой ориентаций. Далее были построены индивидуальные разностные карты источников (карты при несовпадении эталонной и тестовой ориентаций минус карта при совпадении).
Индивидуальные разностные карты анализировали с применением смешанного дизайна дисперсионного анализа (RM ANOVA 2 × 2) с учетом фактора межгрупповой вариабельности Пол и фактора внутригрупповой вариабельности Время (интервалы 50–150 и 150–350 мсек). Анализ проводили в пакете статистической обработки SPM12 (http://www.fil.ion.ucl.ac.uk/spm/) на платформе MATLAB (версия 2019b; MathWorks). Результаты представлены с выбранным порогом статистической значимости р для групповой вероятности ошибки (FWE – family-wise error) < 0.05 на уровне кластера.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Анализ поведенческих характеристик выполнения задачи сопоставления тестовой и эталонной ориентаций
Проведен дисперсионный анализ RM ANOVA (метод повторных измерений) времени реакции (ВР) и точности (вероятность правильных ответов) с учетом факторов Условие (совпадение и несовпадение эталонной и тестовой ориентаций) и Пол. Установлено, что ВР больше при несовпадении эталонной и тестовой ориентаций, эффект Условия: F(1.36) = 41.06, p < 0.0001, $\eta _{p}^{2}$ = 0.053. Различия значимы как в группе мужчин (725.68 ± 39.53 и 844.41 ± 43.35 мс, p < 0.0001), так и женщин (810.56 ± 55.67 и 952.15 ± 73.25 мс, p < 0.001). Влияние фактора Пол статистически незначимо, хотя приведенные средние по группам значения ВР свидетельствуют о тенденции к более низким значениям у мужчин по сравнению с женщинами. Для точности не было выявлено значимого влияния фактора Пол. И у мужчин, и у женщин точность выполнения задания достаточно высокая: в группе мужчин – 0.95 ± 0.02, в группе женщин – 0.91 ± 0.02.
Анализ ССП при выполнении задачи сличения тестовой и эталонной ориентаций
Результаты дисперсионного анализа амплитуды компонентов ССП представлены в табл. 1.
Таблица 1.
Результаты дисперсионного анализа амплитуды компонентов ССП Table 1. Results RM ANOVA of amplitude of ERP components
| Кластер электродов | Волна | Фактор | df | F | p | ɳ2p |
|---|---|---|---|---|---|---|
| Фронтальный | N90 | Условие × Полушарие × Пол | 1.29 | 7.13 | 0.012 | 0.197 |
| N200 | Полушарие | 1.29 | 5.60 | 0.025 | 0.162 | |
| Условие × Полушарие × Пол | 1.29 | 11.46 | 0.002 | 0.283 | ||
| P250 | Условие × Полушарие × Пол | 1.29 | 4.14 | 0.050 | 0.125 | |
| N320 | Условие × Пол | 1.29 | 8.25 | 0.008 | 0.22 | |
| Центральный | N90 | Условие × Полушарие × Пол | 1.29 | 9.15 | 0.005 | 0.24 |
| P400–500 | Пол | 1.29 | 6.36 | 0.02 | 0.18 | |
| Височный | N150 | Условие | 1.29 | 3.99 | 0.053 | 0.121 |
| Условие × Пол | 1.29 | 4.12 | 0.05 | 0.124 | ||
| P200 | Пол | 1.29 | 7.15 | 0.012 | 0.19 | |
| Полушарие ×Пол | 1.29 | 4.07 | 0.052 | 0.123 | ||
| Теменной | N270 | Условие | 1.29 | 5.87 | 0.02 | 0.168 |
| P300 | Условие | 1.29 | 5.77 | 0.023 | 0.166 | |
| Полушарие | 1.29 | 7.49 | 0.01 | 0.20 | ||
| Затылочный | N150 | Условие | 1.29 | 8.60 | 0.006 | 0.229 |
| Условие × Полушарие | 1.29 | 4.00 | 0.053 | 0.121 | ||
| Условие × Пол | 1.29 | 5.69 | 0.027 | 0.164 | ||
| P200 | Пол | 1.29 | 5.26 | 0.029 | 0.153 |
В затылочном кластере электродов связанные с полом эффекты выявлены для амплитуды компонентов N150 и P200. Для амплитуды N150 они проявлялись как значимый эффект Условия (p = 0.006) в виде бо̀льшей амплитуды N150 при несовпадении тестовой и эталонной ориентаций по сравнению с их совпадением. Влияние Условия зависело от Пола (Условие × Пол, р = 0.027): только в группе мужчин амплитуда N150 больше при несовпадении эталонного и тестового стимулов по сравнению с совпадением (p = 0.003; здесь и далее значимость контрастов по Tukey-test). Близкое к значимому взаимодействие Условие × Полушарие (р = 0.053) проявлялось как наличие значимых различий между условиями совпадения и несовпадения только в правом полушарии (p = 0.0002) и как бо̀льшая амплитуда N150 в правом полушарии по сравнению с левым (p = 0.0002) при условии совпадения эталонной и тестовой ориентаций.
Для амплитуды компонента Р200 эффект фактора Пол – на уровне значимости р = = 0.029. Межгрупповое сопоставление амплитуды Р200, усредненной через два Условия и два Полушария, показало более высокую амплитуду в группе мужчин по сравнению с женщинами (T = 2.29, df = 29, p = 0.029). Межгрупповые различия проиллюстрированы на рис. 2 (а, б). На фрагменте (а) (нижний ряд) приведены усредненные по группам мужчин и женщин ССП правого и левого полушарий для условий совпадения и несовпадения тестового и эталонного стимулов. Отчетливо видно превышение амплитуды Р200 в группе мужчин по сравнению с женщинами. Этот эффект проиллюстрирован на диаграммах средних значений амплитуды Р200 в группах мужчин и женщин для двух условий в двух полушариях (рис. 2 (б), нижний ряд).
Рис. 2.
Половые различия ССП на тестовый стимул в центральном, височном и затылочном кластерах электродов в задаче РП на ориентации. (а) – усредненные по группам мужчин и женщин ССП правого и левого полушарий для условий совпадения и несовпадения эталонной и тестовой ориентаций. ПП – правое полушарие, ЛП – левое полушарие. Черная линия – ССП мужчин, серая – ССП женщин. Сплошная линия – совпадение, пунктирная линия – несовпадение. Окнами выделены компонент Р200 и поздняя позитивность 400–500 мс, для которых на фрагменте (б) приведены диаграммы амплитуд. (б) – ящичные диаграммы “с усами” (box-and-whiskers) (среднее значение, стандартная ошибка среднего и 95%-й доверительный интервал) для амплитуды поздней позитивности в интервале 400–500 мс в центральном кластере (верх рисунка) и амплитуды компонента Р200 ССП в височном (середина) и затылочном (низ) кластерах электродов. Цифрами на горизонтальной оси обозначены сравниваемые группы и ситуации: 1 – мужчины, совпадение эталонного и тестового стимулов; 2 – мужчины, несовпадение; 3 – женщины, совпадение; 4 – женщины, несовпадение. Fig. 2. Sex differences in ERPs to the test stimulus in the central, temporal and occipital clusters of electrodes in the working memory task on orientation. (а) – grand averaged ERPs in the groups of males and females in the right and left hemispheres for conditions of matching and mismatching of the reference and test orientations. ПП – right hemisphere, ЛП – left hemisphere. Black line – ERPs in males, gray line – ERPs in females. Solid line – match, dotted line – mismatch. The highlighted time-windows show the P200 component and late positivity 400-500 ms, the data for which are shown in fragment (б). (б) – box-and-whiskers (mean, standard error of the mean, and 95% confidence interval) for mean values of amplitude of late ERP positivity in the central electrode cluster (top of the figure) and the amplitude of the amplitude of P200 component in the temporal (middle) and occipital (bottom) electrode clusters. The numbers on the horizontal axis indicate for which groups and situations the diagrams are shown: 1 – males, matching of the reference and test stimuli; 2 – males, mismatching of the reference and test stimuli; 3 – females, matching; 4 – females, mismatching.
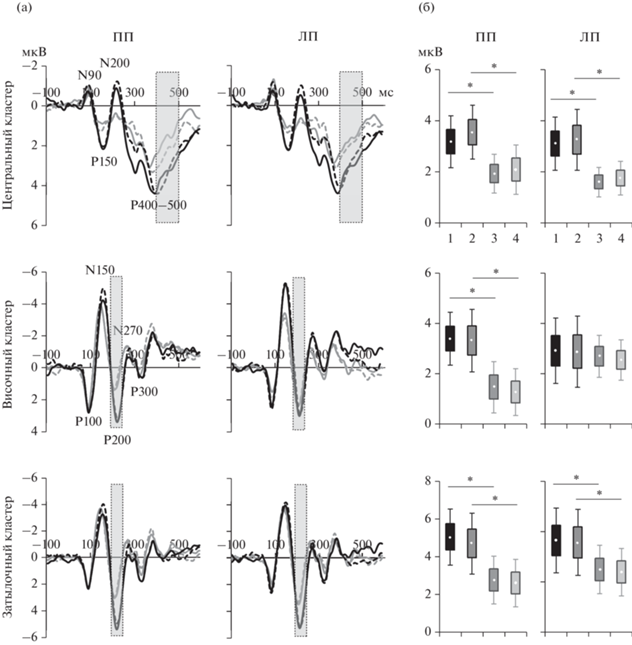
В височном кластере электродов связанные с полом различия обнаружены для амплитуды компонентов N150 и P200. Для компонента N150 основной эффект Условия близок к значимому (р = 0.053). Влияние Условия было неодинаково в группах мужчин и женщин, что подтверждается взаимодействием Условие × Пол (р = 0.05). По результатам post-hoc-сопоставлений только в группе мужчин есть значимое превышение амплитуды N150 при несовпадении эталонного и тестового стимулов относительно их совпадения (р = = 0.03). Сходно с затылочным, в височном кластере электродов амплитуда компонента Р200 выше в группе мужчин по сравнению с женщинами (основной эффект Пола при р = = 0.012). Межгрупповое сопоставление амплитуды Р200, усредненной через два Условия и два Полушария, показало более высокую амплитуду в группе мужчин по сравнению с женщинами (T = 2.67, df = 29, p = 0.012). Этот эффект проявляется в правом полушарии (Полушарие × Пол, р =0.052), что видно на ССП и диаграммах, представленных на рис. 2 (а, б), средний ряд. В правом полушарии амплитуда Р200 выше в группе мужчин по сравнению с женщинами, что подтверждено post-hoc-сопоставлениями (p = 0.03).
В теменном кластере электродов значимые влияния Пола как в виде основного эффекта, так и в виде его взаимодействия с другими факторами не выявлены. Обнаружен эффект Условия на амплитуду компонентов N270 (р = 0.02) и P300 (р = 0.023) в виде бóльшей амплитуды при совпадении по сравнению с несовпадением эталонной и тестовой ориентаций. Амплитуда компонента Р300 выше в правом полушарии, что соответствует значимому эффекту Полушария (р = 0.01). Сходно с затылочными и височными кластерами, в теменном амплитуда компонента Р200 больше в группе мужчин, однако различия не достигают уровня значимости.
В центральном кластере электродов для ранней негативности N90 показано тройное взаимодействие Условие × Полушарие × Пол (р = 0.005), что проявлялось как правополушарное преобладание амплитуды N90 при условии совпадения эталонной и тестовой ориентации (р = 0.04) в группе женщин. Основной эффект Пола (р = 0.02) выявлен для амплитуды медленной позитивности в интервале 400–500 мс после начала стимула. Более высокая амплитуда этой позитивности у мужчин по сравнению с женщинами видна на усредненных ССП (рис. 2 (а), верхний ряд) и на диаграммах средней амплитуды в этом интервале (рис. 2 (б), верхний ряд). Межгрупповые различия амплитуды позитивности в окне 400–500 мс, усредненной через два Условия и два Полушария, по результатам t-test значимы (T = 2.52, df = 29, p = 0.02).
Во фронтальном кластере электродов влияние фактора Пол обнаружено как двойные или тройные взаимодействия. Для амплитуды N90 взаимодействие Условие × Полушарие × Пол (p = 0.012) проявлялось как более высокая амплитуда при несовпадении по сравнению с совпадением эталонной и тестовой ориентаций (p = 0.02) в правом полушарии в группе женщин, но не в группе мужчин. Для амплитуды N200 взаимодействие Условие × Полушарие × Пол (p = 0.002) проявляется в виде преобладания активности правого полушария в ситуации совпадения эталона и теста (р = 0.02) у мужчин и в ситуации несовпадения (р = 0.003) у женщин. Для амплитуды N320 обнаружено взаимодействие Условие × Пол (p = 0.008). Компонент N320 выше у женщин по сравнению с мужчинами при условии совпадения эталонной и тестовой ориентаций (p = 0.005).
Анализ результатов дипольного моделирования
При дисперсионном анализе разностных карт плотности дипольного тока, которые отражают разницу ответов на стимулы, отличающиеся и не отличающиеся от эталонного, значимый эффект фактора Пол (pcorr < 0.05) был обнаружен в ряде анатомических областей головного мозга. Список этих структур приведен в табл. 2. Как видно, это преимущественно структуры, локализованные в затылочной доле (средняя и нижняя затылочные извилины, шпорная борозда и затылочный полюс), в височной доле (верхняя и средняя височные извилины и веретенообразная извилина) и в теменной доле (теменная часть оперкулярной области, надкраевая, угловая и постцентральная извилины, верхняя теменная долька, центральная покрышечная область). В передних отделах коры значимый эффект пола обнаружен в верхней лобной извилине (справа) и заднем сегменте верхней лобной извилины (слева). Эти результаты представлены на рис. 3 (а) в виде карт статистических различий. Отчетливо видна преимущественная локализация половых различий в каудальных отделах коры мозга.
Таблица 2.
ANOVA RM разностных карт дипольных источников (“несовпадающие ориентации > совпадающие ориентации”) Table 2. ANOVA RM of dipole source difference maps (“mismatching orientations > matching orientations”)
| Структуры мозга, входящие в состав кластера | Полуша-рие | Объем кластера (воксели) | Координаты локального максимума | PFWE-corr | F1,26 | Напра-вление эффекта | ||
|---|---|---|---|---|---|---|---|---|
| x | y | z | ||||||
| Верхняя височная извилина, надкраевая извилина, центральная покрышечная область, постцентральная извилина | ЛП | 2859 | –69 | –28 | 1 | 0.000 | 154.35 | M > Ж |
| Теменная покрышечная область, planum temporale, средняя и нижняя затылочная извилина, средняя височная извилина | ПП | 5755 | 53 | –24 | 17 | 0.000 | 114.91 | M > Ж |
| Средняя затылочная извилина, угловая извилина | ЛП | 1095 | –35 | –94 | 15 | 0.000 | 52.94 | M > Ж |
| Верхняя лобная извилина | ПП | 80 | 15 | 62 | 31 | 0.001 | 46.10 | Ж > M |
| Верхняя лобная извилина (задний сегмент) | ЛП | 47 | –9 | 0 | 79 | 0.013 | 32.50 | Ж > M |
| Верхняя теменная долька | ЛП | 17 | –21 | –52 | 73 | 0.024 | 29.30 | M > Ж |
| Шпорная борозда, затылочный полюс | ПП | 7 | 17 | –92 | 5 | 0.025 | 29.16 | M > Ж |
| Веретенообразная извилина | ПП | 5 | 35 | –40 | –7 | 0.045 | 26.27 | M > Ж |
Обозначения: M – мужчины, Ж – женщины; ЛП – левое полушарие, ПП – правое полушарие. Объем кластера приведен в вокселях. Координаты локального максимума приведены для MNI-пространства. Notations: M – male, Ж – female; ЛП – left hemisphere, ПП – right hemisphere. Cluster volume is given in voxels. Coordinates of local maximum are given for MNI-space.
Рис. 3.
Результаты дисперсионного анализа (RM ANOVA 2×2) разностных карт дипольных источников “несовпадающие ориентации > совпадающие ориентации” с факторами Пол и Время. На (а) приведен результат по основному эффекту фактора Пол, на (б) – результаты post-hoc анализа для контрастов “мужчины > женщины” и “женщины > мужчины”. Обозначения: R – правое полушарие, L – левое полушарие. Под картами приведена шкала значений F- и Т-критерия для (а) и (б) соответственно. Fig. 3. Results of analysis of variance (RM-ANOVA 2×2) of dipole source difference maps “mismatched orientations > matched orientations” with the factors “Gender” and “Time”. (a) shows the result for the main effect of the Gender factor, and (б) shows the results of the post-hoc analysis for the “male > female” and “female > male” contrasts. Notes: R – right hemisphere, L – left hemisphere. Below the maps, there is a scale of F- and T-criterion values for (а) and (б), respectively.
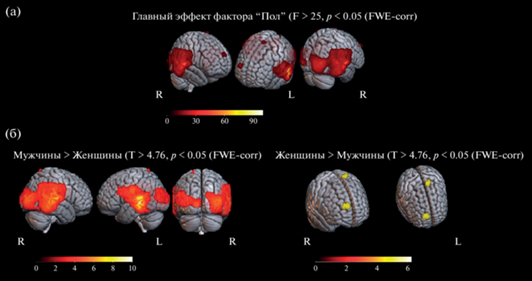
На рис. 3 (б) приведены карты, полученные при post-hoc анализе для двух вариантов контраста: “мужчины > женщины” и “женщины > > мужчины”. Как видно, зоны значимого (pcorr < 0.05) контраста “мужчины > женщины” локализованы в задних отделах коры, что объясняется более высокими значениями у мужчин плотности дипольного тока в этих зонах . Напротив, зоны значимого (pсorr < 0.05) контраста “женщины > мужчины”, при котором более высокие значения плотности дипольного тока регистрируются у женщин, локализованы в передних отделах коры. Список структур, для которых обнаружены значимые различия, приведен в табл. 2. Представлен состав кластеров, размеры, их полушарная принадлежность, координаты их локального максимума, направленность половых различий и их статистическая достоверность. Как видно на рис. 3 (а), половые различия больше выражены в правом полушарии в затылочных, теменных и лобных областях, а в левом полушарии – в височной области. Значимых эффектов для фактора Время и для взаимодействия факторов Время и Пол не обнаружено.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Сопоставление вновь поступившей зрительной информации с хранящейся в рабочей памяти играет важную роль в осуществлении многих когнитивных функций. Эта операция позволяет обнаружить несовпадение зрительных характеристик реальной сцены с теми, которые хранятся в кратковременной памяти, обновить сведения об образе или сцене и, таким образом, получить и закрепить новые знания об окружающей среде. В проведенном нами исследовании установлено, что нейронные механизмы обнаружения различий между текущей и кратковременно удерживаемой в РП ориентациями у мужчин и у женщин различны.
Анализ показателей ВР и точности не обнаружил значимых половых различий. В обеих группах ВР при несовпадении эталонной и тестовой ориентаций выше, чем при их совпадении, что соответствует литературным данным (Yin et al., 2011) и результатам нашего исследования (Михайлова и др., 2017). При отсутствии значимых половых различий, средние по группам значения ВР у мужчин меньше, а значения точности выше по сравнению с этими показателями у женщин, что по направленности соответствует статистически значимым различиям, полученным на бо̀льшей выборке испытуемых (274 человека) в задаче зрительной РП с увеличенным объемом информации (Zilles et al., 2016).
Анализ ССП выявил половые различия в зрительной области коры, где локализованы нейронные структуры, ответственные за восприятие и анализ ориентаций. Они относились к раннему этапу переработки информации – временному окну компонента N150 – и проявлялись как взаимодействие Пол × × Условие. Только в группе мужчин амплитуда N150 оказалась выше при несовпадении по сравнению с совпадением. Аналогичный результат показан для амплитуды компонента N150 в височной коре правого полушария.
По данным ряда исследований, при выполнении задач зрительной РП процессы, разворачивающиеся в диапазоне N150, отражают не только восприятие зрительного сигнала, но и его удержание и извлечение из памяти (Pasternak, Greenlee, 2005; Postle, 2006; Agam, Sekuler, 2007). В настоящей работе мы не только подтвердили результат о значимости ранних процессов в зрительных областях коры для обнаружения изменения текущей ориентации относительно удерживаемой в памяти (Михайлова и др., 2019), но дополнили его сведениями о связи с полом. Можно думать, что преимущество мужчин в раннем детектировании несовпадения текущей и удерживаемой в памяти ориентаций связано с особенностями восприятия этого вида зрительной информации. Как показано нами ранее, в задаче дискриминации ориентаций у мужчин по сравнению с женщинами выше амплитуда ранних компонентов ВП в проекционных областях, шире область локализации их дипольных источников, захватывающая затылочную, теменную и височные области коры (Крылова и др., 2015; Михайлова и др., 2015). Более высокая чувствительность зрительной коры мозга мужчин к ориентационным характеристикам подтверждается данными функциональной МРТ, зарегистрированной при выполнении задачи идентификации ориентаций линий (Gur et al., 2000).
Для амплитуды компонента Р200 дисперсионный анализ выявил основной эффект пола. В затылочном и височном кластерах электродов амплитуда Р200 была значимо выше в группе мужчин по сравнению с женщинами. Что касается функциональной роли компонента Р200, то многие исследователи связывают увеличение Р200 с реакцией на нецелевые стимулы (Lefebvre et al., 2005; Wang et al., 2008; Lenartowicz et al., 2010), в связи с чем компонент Р200 интерпретируется как отражение процесса подавления нерелевантной информации (Philips, Takeda, 2009; Coenen, 2012). Так, например, в работе (Philips, Takeda, 2009) показано, что при выполнении задачи поиска целевого стимула (полоска определенной пространственной ориентации и цвета) в присутствии в зрительном поле дистракторов (полоски других ориентаций и цветов) амплитуда Р200 зависит от числа характеристик, которые отличают дистрактор от значимого стимула. Именно за счет избирательного внимания к этим характеристикам осуществляется подавление незначимой информации и выбор кандидатов для последующего сопоставления с целевым стимулом. Важность событий в затылочной коре в интервале Р200 для имплицитного обнаружения различий между стандартным и измененными иероглифами описана в работе (Zhang et al., 2020). Данные ряда исследований указывают на значимость Р200 как показателя сопоставления информации от сенсорных входов с сохраненной в памяти информацией (Lefebvre et al., 2005; Freunberger et al., 2007).
В ряде работ компонент Р200 рассматривается как возможный нейрофизиологический маркер такого свойства РП, которое в англоязычной литературе обозначается как “capacity”, что может соответствовать терминам “способность”, “вместимость”. Так, в работе (Lefebvre et al., 2005) характеристики Р200 ССП теменных областей коры зависели не только от совпадения/несовпадения текущих и ранее прослушанных цифр, но и от количества удерживаемых в памяти знаков. Аналогичные результаты представлены и в других работах (Philips, Takeda, 2009; Cepeda-Freyre et al., 2020).
Компонент Р200 связывают также со способностью эффективно управлять вниманием. Это убедительно показано в работе (Föcker et al., 2019), в которой при выполнении задачи разделения значимых и незначимых ориентационных решеток испытуемые, играющие в видеоигры, демонстрировали бо̀льшую амплитуду компонента Р200 в центральной области коры по сравнению с неигроками. Авторы связывают это усиление Р200 с высоким уровнем контроля внимания и восприятия, являющимся результатом тренировок. Корреляции Р200 и внимания обсуждают и другие авторы. Например, в задаче обнаружения различий двух последовательных стимулов увеличение объема вводимой информации приводило к росту амплитуды Р200 в затылочных и височных областях, но без снижения производительности РП (Cepeda-Freyre et al., 2020). Предполагается, что отсутствие поведенческого ухудшения может быть результатом регулируемого сверху (Freunberger et al., 2007; Linnert et al., 2016) привлечения дополнительных ресурсов внимания для поддержания эффективности выполнения задачи РП, что и отражается в увеличении амплитуды Р200. Сходный эффект описан в работе (Vogel, Machizawa, 2004).
Таким образом, полученный в нашей работе результат о бо̀льшей амплитуде Р200 в ССП каудальных областей коры у мужчин можно рассматривать как показатель более высокого уровня селективного внимания к ориентационным свойствам пространственной среды. Кроме того, бóльший по амплитуде компонент Р200 в каудальных областях коры у мужчин по сравнению с женщинами может быть проявлением гендерно-обусловленной специфики селективного внимания (Bianco et al., 2020).
Повышение амплитуды у мужчин по сравнению с женщинами обнаружено также для медленной позитивной волны, развивающейся в центральных отведениях; различия значимы в интервале от 400 до 500 мс.
Позитивное отклонение в центрально-теменных областях с пиковой латентностью около 300 мс и позже – один из наиболее частых феноменов, регистрируемых в широком спектре когнитивных задач и обозначаемый традиционно как Р300 (Picton, 1992). Амплитуда Р300 вариабельна и может быть максимальной в диапазоне от 200–250 мс до 800 мс. Согласно литературе, семейство Р300 включает в себя три накладывающихся друг на друга позитивных отклонения: Р3а с пиком около 250 мс, Р3b с пиком около 350 мс и позитивная медленная волна. Все они в равной степени зависят от вероятности появления стимула, но по-разному чувствительны к характеристикам релевантного стимула и имеют разную связь с вниманием (Picton, 1992). Одним из важных факторов, влияющим на латентность пика и длительность волны, считается трудность задания (Picton, 1992; Bledowski et al., 2006; Rawdon et al., 2013), которая модулируется, например, числом стимулов или набором значимых характеристик релевантного сигнала.
В литературе представлены немногочисленные и разноречивые сведения о половых различиях Р300. Так, более высокая амплитуда P300 (P3b) в левой центрально-теменной области у мужчин по сравнению с женщинами описана в “oddball”-парадигме с геометрическими фигурами (Maciejewska, Drzazga, 2019). Сходные данные представлены в (Vaquero et al., 2004). Другие авторы, напротив, сообщают о более высокой амплитуде Р300 у женщин (Deldin et al., 1994; Steffensen et al., 2008). Причины неоднозначности представленных в литературе данных о половых различиях Р300 обсуждаются в работе (Maciejewska, Drzazga, 2019).
Что касается зрительной РП, то Р300 считается важным индикатором кодирования и извлечения информации из памяти. В этом отношении показательна работа (Bledowski et al., 2006), в которой авторы, исследуя хронометрию извлечения информации из памяти, обнаружили, что при более сложном задании отставленного сопоставления в интервале компонента P3b можно выделить два временных промежутка, которые отличаются внутримозговыми источниками. При этом более поздний подкомпонент в бóльшей степени связан с операциями поиска информации в памяти, особенно в сложных задачах, которые не могут быть решены на основании обнаружения простого сходства. В исследованиях с категоризацией объектов авторы обращают внимание на позднее (после 400 мс) позитивное отклонение в центрально-теменных отведениях. Его связывают с операцией сравнения объекта с другими представителями категории, хранящимися в памяти, и считают индексом доступа к хранилищу (Morrison et al., 2015; Rabi et al., 2018).
Для понимания нашего результата о более высокой амплитуде позитивности 400–500 мс в группе мужчин по сравнению с женщинами также важны сведения о положительной связи Р300 с оценками “общих когнитивных способностей” по Векслеру (Gevins, Smith, 2000), а также с индивидуальными оценками “объема памяти”, как общего когнитивного ресурса, не зависящего от материала (Nittono et al., 1999). Люди с бóльшей емкостью РП, как правило, демонстрируют большую амплитуду P300 при кодировании информации. Исходя из изложенного выше, можно предположить, что известное для мужского пола преимущество в выполнении зрительно-пространственных задач, в том числе задач РП, может проявляться как усиление позитивности в диапазоне Р300, необязательно связанное с непосредственной деятельностью, а отражающее “способность” к выполнению этого класса задач. В основе таких более широких возможностей РП у мужчин может лежать гендерно-зависимая специфичность нейросетей РП (Hill et al., 2014; Alarcón et al., 2014; Zilles et al., 2016).
Половые различия нейронных механизмов детектирования изменения текущей ориентации относительно удерживаемой в памяти были обнаружены при анализе карт распределенной дипольной активности. Картирование проводили по показателю разницы между условиями несовпадения и совпадения эталонной и тестовой ориентаций, то есть, по выраженности реакции на ориентацию, отличающуюся от удерживаемой в памяти. Различия между мужчинами и женщинами по этому показателю обнаружены в обширной зоне, включающей затылочную, теменную и височную области билатерально, и более ограниченно – в лобной коре, а именно в верхней лобной извилине. При этом контрасты “мужчины > женщины” значимы для дипольной активности структур каудальных областей, а контрасты “женщины > мужчины” – для дипольной активности префронтальной коры.
Полученные результаты сопоставимы с данными функциональной МРТ – исследований половых различий зрительной РП. Преобладание затылочной активации у мужчин описано в работе (Tschernegg et al., 2017): у мужчин по сравнению с женщинами выше активность в области шпорной борозды и латеральной затылочной коры левого полушария. Наиболее часто описываемый в литературе результат – это бóльший уровень метаболического сигнала в нижнетеменной коре и области предклинья у мужчин по сравнению с женщинами (Todd, Marois, 2005; Zilles et al., 2016). Уровень активности этих областей значимо коррелирует с успешностью выполнения зрительно-пространственных задач (Zilles et al., 2016). Напротив, для женщин в этих задачах характерен более высокий уровень активности префронтальных отделов (Hill et al., 2014; Zilles et al., 2016). В работе Хилл с соавт. (Hill et al., 2014) на основании метаанализа данных выделены связанные с полом особенности активации нейросети рабочей памяти, в целом единой для обоих полов, но с преобладанием активации префронтальных и лимбических структур у женщин и каудальных отделов, преимущественно теменной коры, у мужчин. Важно, что такая гендерно-зависимая специфичность паттерна корковой активации воспроизводится при выполнении заданий с привлечением и зрительно-пространственной, и вербальной РП, что говорит о ее относительной независимости от модальности стимулов (Zilles et al., 2016). Такая устойчивость половых различий нейросетей РП подтверждается гендерной специфичностью нейросетей покоя (Allen et al., 2011; Clemens et al., 2017; de Lacy et al., 2019). В частности, у мужчин по сравнению с женщинами функциональная связанность выше в теменно-затылочных областях, а у женщин – в лобных и височных, а также в мозжечке (Allen et al., 2011; Filippi et al., 2013; Clemens et al., 2017). Возможно, что более высокая коннективность в структурах дорсального и вентрального зрительных путей у мужчин по сравнению с женщинами может лежать в основе бо̀льшей производительности выполнения мужчинами зрительно-пространственных задач (Miller, Halpern, 2014).
ЗАКЛЮЧЕНИЕ
В работе с использованием “n-back”-модели анализировали временные и топографические проявления гендерной специфичности функциональной организации РП на ориентации. Показано, что нейронные механизмы обнаружения различий между текущей и удерживаемой в РП ориентациями у мужчин и у женщин различны. Только у мужчин в зрительных областях коры регистрируется увеличение компонента N150 при несовпадении текущей и удерживаемой в памяти ориентаций, что является нейрофизиологическим маркером раннего обнаружения изменений.
Важным представляется результат более высокой амплитуды компонента P200 в каудальных областях и увеличения позитивного отклонения 400–500 мс в центральных, которые не зависят от условия совпадения/несовпадения. С учетом литературных сведений, можно думать, что у мужчин обработка ориентационных характеристик зрительной среды происходит при большем уровне избирательного внимания и с привлечением бóльших ресурсов РП по сравнению с женщинами. По результатам многомерного анализа дипольной активности, у мужчин в детектирование различий текущей и удерживаемой в РП ориентаций преимущественно вовлечены затылочные, височные и теменные области коры, тогда как женщины демонстрируют бо̀льшее участие фронтальных отделов. Полученные данные указывают на важность пола как фактора, влияющего на нейросетевую организацию переработки зрительно-пространственной информации.
ФИНАНСИРОВАНИЕ
Работа поддержана средствами государственного бюджета по государственному заданию Министерства образования и науки Российской Федерации на 2021–2023 годы. Электрофизиологические исследования выполнены на базе Центра коллективного пользования научным оборудованием для функционального картирования мозга на базе ИВНД и НФ РАН.
Список литературы
Крылова М.А., Изъюров И.В., Герасименко Н.Ю., Чаянов Н.В., Михайлова Е.С. Моделирование источников компонентов зрительных вызванных потенциалов человека в задаче определения ориентации отрезков линий. Журн. высш. нервн. деят. им. И.П. Павлова. 2015. 65(6): 685–698.
Михайлова Е.С., Герасименко Н.Ю., Кушнир А.Б. Психофизические и нейрофизиологические характеристики оценки наклонных ориентаций у мужчин и женщин. Сенсорные системы. 2020. 34(4): 283–298.
Михайлова Е.С., Герасименко Н.Ю., Славуцкая А.В. Сенсорные механизмы ранней дискриминации ориентаций в модели зрительной рабочей памяти. Журн. высш. нервн. деят. им. И.П. Павлова. 2019. 69(5): 577–589.
Михайлова Е.С., Герасименко Н.Ю., Славуцкая А.В., Крылова М.А., Изъюров И.В. Временные и топографические характеристики вызванных потенциалов в ситуации конфликта двух последовательных зрительных стимулов в задаче на зрительную память. Физиология человека. 2017. 43(3): 13–24.
Михайлова Е.С., Герасименко Н.Ю., Крылова М.А., Изъюров И.В., Славуцкая А.В. Механизмы ориентационной чувствительности зрительной системы человека. Сообщение II. Корковые механизмы ранних этапов переработки информации об ориентации линий. Физиология человека. 2015. 41(3): 5–18.
Славуцкая А.В., Герасименко Н.Ю., Михайлова Е.С. Механизмы ориентационной чувствительности зрительной системы человека. Сообщение I. Поведенческие характеристики ориентационной чувствительности. Влияние характера задачи, экспериментальных условий и пола. Физиология человека. 2014. 40(6): 88–97.
Agam Y., Sekuler R. Interactions between working memory and visual perception: an ERP/EEG study. Neuroimage. 2007. 36(3): 933–942.
Alarcón G., Cservenka A., Fair D.A., Nagel B.J. Sex differences in the neural substrates of spatial working memory during adolescence are not mediated by endogenous testosterone. Brain Res. 2014. 1593: 40–54.
Allen E.A., Erhardt E.B., Damaraju E., Gruner W., Segall J.M., Silva R.F., Havlicek M., Rachakonda S., Fries J., Kalyanam R., Michael A.M., Caprihan A., Turner J.A., Eichele T., Adelsheim S., Bryan A.D., Bustillo J., Clark V.P., Feldstein Ewing S.W., Filbey F., Ford C.C., Hutchison K., Jung R.E., Kiehl K.A., Kodituwakku P., Komesu Y.M., Mayer A.R., Pearlson G.D., Phillips J.P., Sadek J.R., Stevens M., Teuscher U., Thoma R.J., Calhoun V.D. A baseline for the multivariate comparison of resting-state networks. Front. Syst. Neurosci. 2011. 5: 2.
Bianco V., Berchicci M., Quinzi F., Perri R.L., Spinelli D., Di Russo F. Females are more proactive, males are more reactive: neural basis of the gender-related speed/accuracy trade-off in visuo-motor tasks. Brain Struct. Funct. 2020. 225(1): 187–201.
Bledowski C., Cohen Kadosh K., Wibral M., Rahm B., Bittner R.A., Hoechstetter K., Scherg M., Maurer K., Goebel R., Linden D.E.J. Mental chronometry of working memory retrieval: a combined functional magnetic resonance imaging and event-related potentials approach. J. Neurosci. 2006. 26(3): 821–829.
Cahill L. Fundamental sex difference in human brain architecture. Proc. Natl. Acad. Sci. U S A. 2014. 111(2): 577–578.
Cahill L. Why sex matters for neuroscience. Nat. Rev. Neurosci. 2006. 7(6): 477–484.
Cepeda-Freyre H.A., Garcia-Aguilar G., Eguibar J.R., Cortes C. Brain processing of complex geometric forms in a visual memory task increases P2 amplitude. Brain Sci. 2020. 10(2): 114.
Chen C.C., Kuo J.C., Wang W.J. Distinguishing the visual working memory training and practice effects by the effective connectivity during n-back tasks: a DCM of ERP study. Front. Behav. Neurosci. 2019. 13: 84.
Christie G.J., Cook C.M., Ward B.J., Tata M.S., Sutherland J., Sutherland R.J., Saucier D.M. Mental rotational ability is correlated with spatial but not verbal working memory performance and P300 amplitude in males. PLoS One. 2013. 8(2): e57390.
Clemens B., Junger J., Pauly K., Neulen J., Neuschaefer-Rube C., Frölich D., Mingoia G., Derntl B., Habel U. Male-to-female gender dysphoria: Gender-specific differences in resting-state networks. Brain Behav. 2017. 7(5): e00691.
Coenen A. Modelling of auditory evoked potentials of human sleep-wake states. Int. J Psychophysiol. Off. J. Int. Organ. Psychophysiol. 2012. 85(1): 37–40.
de Lacy N., McCauley E., Kutz J.N., Calhoun V.D. Multilevel mapping of sexual dimorphism in intrinsic functional brain networks. Front. Neurosci. 2019. 13: 332.
Deldin P.J., Duncan C.C., Miller G.A. Season, gender, and P300. Biol. Psychol. 1994. 39 (1): 15–28.
Ester E.F., Serences J.T., Awh E. Spatially global representations in human primary visual cortex during working memory maintenance. J. Neurosci. 2009. 29(48): 15258–15265.
Filippi M., Valsasina P., Misci P., Falini A., Comi G., Rocca M.A. The organization of intrinsic brain activity differs between genders: a resting-state fMRI study in a large cohort of young healthy subjects. Hum. Brain Mapp. 2013. 34(6): 1330–1343.
Föcker J., Mortazavi M., Khoe W., Hillyard S.A., Bavelier D. Neural correlates of enhanced visual attentional control in action video game players: An event-related potential study. J. Cogn. Neurosci. 2019. 31(3): 377–389.
Freunberger R., Klimesch W., Doppelmayr M., Höller Y. Visual P2 component is related to theta phase-locking. Neurosci. Lett. 2007. 426(3): 181–186.
Galea L.A., Kimura D. Sex differences in route-learning. Pers. Individ. Dif. 1993. 14(1): 53–65.
Gevins A., Smith M.E. Neurophysiological measures of working memory and individual differences in cognitive ability and cognitive style. Cereb. Cortex 2000. 10(9): 829–839.
Gur R.C., Alsop D., Glahn D., Petty R., Swanson C.L., Maldjian J.A., Turetsky B.I., Detre J.A., Gee J., Gur R.E. An fMRI study of sex differences in regional activation to a verbal and a spatial task. Brain Lang. 2000. 74(2): 157–170.
Harrison S.A., Tong F. Decoding reveals the contents of visual working memory in early visual areas. Nature. 2009. 458(7238): 632–635.
Hill A.C., Laird A.R., Robinson J.L. Gender differences in working memory networks: a BrainMap meta-analysis. Biol. Psychol. 2014. 102: 18–29.
Ingalhalikar M., Smith A., Parker D., Satterthwaite T.D., Elliott M.A., Ruparel K., Hakonarson H., Gur R.E., Gur R.C., Verma R. Sex differences in the structural connectome of the human brain. Proc. Natl. Acad. Sci. U S A. 2014. 111(2): 823–828.
Lefebvre C.D., Marchand Y., Eskes G.A., Connolly J.F. Assessment of working memory abilities using an event-related brain potential (ERP)-compatible digit span backward task. Clin. Neurophysiol. Off. J. Int. Fed. Clin. Neurophysiol. 2005. 116(7): 1665–1680.
Lejbak L., Crossley M., Vrbancic M. A male advantage for spatial and object but not verbal working memory using the n-back task. Brain Cogn. 2011. 76: 191–196.
Lenartowicz A., Escobedo-Quiroz R., Cohen J.D. Updating of context in working memory: an event-related potential study. Cogn. Affect. Behav. Neurosci. 2010. 10(2): 298–315.
Linnert S., Reid V., Westermann G. ERP correlates of two separate top-down mechanisms in visual categorization. Int. J. Psychophysiol. 2016. 108: 83.
Maciejewska K., Drzazga Z. Differences in spatio‑temporal distribution of the visual P3b event-related potential between young men and women. Acta Neurobiol. Exp. (Wars). 2019. 79: 25–38.
Miller D.I., Halpern D.F. The new science of cognitive sex differences. Trends Cogn. Sci. 2014. 18(1): 37–45.
Moffat S.D., Hampson E., Hatzipantelis M. Navigation in a “virtual” maze: Sex differences and correlation with psychometric measures of spatial ability in humans. Evol. Hum. Behav. 1998. 19(2): 73–87.
Morrison R.G., Reber P.J., Bharani K.L., Paller K.A. Dissociation of category-learning systems via brain potentials. Front. Hum. Neurosci. 2015. 9.
Nittono H., Nageishi Y., Nakajima Y., Ullsperger P. Event-related potential correlates of individual differences in working memory capacity. Psychophysiology 1999. 36(6): 745–754.
Pasternak T., Greenlee M.W. Working memory in primate sensory systems. Nat. Rev. Neurosci. 2005. 6(2): 97–107.
Philips S., Takeda Y. An EEG/ERP study of efficient versus inefficient visual search. Proceedings of the Annual Meeting of the Cognitive Science Society. 2009. 31.
Picton T.W. The P300 wave of the human event-related potential. J. Clin. Neurophysiol. Off. Publ. Am. Electroencephalogr. Soc. 1992. 9(4): 456–479.
Postle B.R. Working memory as an emergent property of the mind and brain. Neuroscience. 2006. 139(1): 23–38.
Rabi R., Joanisse M.F., Zhu T., Minda J.P. Cognitive changes in conjunctive rule-based category learning: An ERP approach. Cogn. Affect. Behav. Neurosci. 2018. 18(5): 1034–1048.
Rawdon C., Murphy J., Blanchard M.M., Kelleher I., Clarke M.C., Kavanagh F., Cannon M., Roche R.A.P. Reduced P300 amplitude during retrieval on a spatial working memory task in a community sample of adolescents who report psychotic symptoms. BMC Psychiatry. 2013. 13: 125.
Shaqiri A., Roinishvili M., Grzeczkowski L., Chkonia E., Pilz K., Mohr C., Brand A., Kunchulia M., Herzog M.H. Sex-related differences in vision are heterogeneous. Sci. Rep. 2018. 8(1): 7521.
Steffensen S.C., Ohran A.J., Shipp D.N., Hales K., Stobbs S.H., Fleming D.E. Gender-selective effects of the P300 and N400 components of the visual evoked potential. Vision Res. 2008. 48(7): 917–925.
Todd J.J., Marois R. Posterior parietal cortex activity predicts individual differences in visual short-term memory capacity. Cogn. Affect. Behav. Neurosci. 2005. 5(2): 144–155.
Tschernegg M., Neuper C., Schmidt R., Wood G., Kronbichler M., Fazekas F., Enzinger C., Koini M. FMRI to probe sex-related differences in brain function with multitasking. PLoS One. 2017. 12(7): e0181554.
Vaquero E., Cardoso M.J., Vázquez M., Gómez C.M. Gender differences in event-related potentials during visual-spatial attention. Int. J. Neurosci. 2004. 114(4): 541–557.
Vogel E.K., Machizawa M.G. Neural activity predicts individual differences in visual working memory capacity. Nature. 2004. 428(6984): 748–751.
Voyer D., Voyer S., Bryden M.P. Magnitude of sex differences in spatial abilities: a meta-analysis and consideration of critical variables. Psychol. Bull. 1995. 117(2): 250–270.
Voyer D., Voyer S.D., Saint-Aubin J. Sex differences in visual-spatial working memory: A meta-analysis. Psychon. Bull. Rev. 2017. 24(2): 307–334.
Wang A.L., Mouraux A., Liang M., Iannetti G.D. The enhancement of the N1 wave eicited by sensory stimuli presented at very short inter-stimulus intervals is a general feature across sensory systems. PLoS ONE. 2008. 3(12): e3929.
Yin J., Gao Z., Jin X., Ye L., Shen M., Shui R. Tracking the mismatch information in visual short term memory: an event-related potential study. Neurosci. Lett. 2011. 491(1): 26–30.
Zhang X., Yang S., Jiang M. Rapid implicit extraction of abstract orthographic patterns of Chinese characters during reading. PLoS One 2020. 15(2): e0229590–e0229590.
Zilles D., Lewandowski M., Vieker H., Henseler I., Diekhof E., Melcher T., Keil M., Gruber O. Gender differences in verbal and visuospatial working memory performance and networks. Neuropsychobiology. 2016. 73(1): 52–6.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


