Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 6, стр. 880-895
Оптическое картирование зрительной коры: спектральные и амплитудные характеристики вазомоторных колебаний
С. А. Кожухов 1, *, К. А. Салтыков 1, И. В. Бондарь 1
1 Лаборатория физиологии сенсорных систем, Федеральное государственное бюджетное учреждение науки Институт высшей нервной деятельности и нейрофизиологии Российской академии наук
Москва, Россия
* E-mail: sergei.kozhukhov@ihna.ru
Поступила в редакцию 09.11.2021
После доработки 05.04.2022
Принята к публикации 26.04.2022
- EDN: HCAJTE
- DOI: 10.31857/S0044467722060041
Аннотация
Метод оптического картирования по внутреннему сигналу широко используется в современных исследованиях функциональной анатомии коры головного мозга. Однако регистрируемый оптический сигнал, коррелирующий с нейронной активностью, маскируется фоновой активностью, которая может на порядок превышать амплитуду полезного картирующего сигнала. В качестве одного из компонентов фоновой активности в сигнале присутствуют спонтанные колебания частотой от 0.01 до 0.15 Гц, называемые вазомоторными колебаниями. В данной работе были выделены вазомоторные колебания в трех областях интереса: нервной ткани, крупных артериолах и в dura matter. Вазомоторные колебания в области нервной ткани и кровеносных сосудах имеют различные спектральные и амплитудные характеристики. Тем не менее между колебаниями, зарегистрированными в этих областях интереса, наблюдается высокая когерентность. На основе указанных свойств мы пришли к выводу о том, что применение метода главных или независимых компонент позволит получить более точные и подробные функциональные карты.
Метод оптического картирования по внутреннему сигналу (Intrinsic-Signal Optical Imaging) широко используется в современных исследованиях функциональной анатомии коры головного мозга млекопитающих. Впервые этот метод был применен для выявления структуры ориентационных колонок в областях V1 и V2 (Bonhoeffer, Grinvald, 1991). К настоящему времени структура ориентационных модулей в этих корковых областях детально изучена, предложены математические модели, с высокой точностью описывающие процесс распознавания ориентаций в зрительной системе (Kozhukhov et al., 2020) и формирование ориентационной настройки в онтогенезе (Tanaka et al., 2020). Успешным оказалось и применение метода оптического картирования для исследования функциональных модулей в других корковых областях (Sintsov et al., 2017; Tang et al., 2020; Townsend et al., 2020; Xie et al., 2020; Chung et al., 2020; Friedman et al., 2020).
Метод оптического картирования применяется в исследовании на разных видах лабораторных животных: обезьянах (Tang et al., 2020), кошках (Shumikhina et al., 2018; Бугрова, Бондарь, 2019; Tanaka et al., 2020), грызунах (Sintsov et al., 2017; Sintsov et al., 2018; Townsend et al., 2020; Xie et al., 2020; Chung et al., 2021; Padawer-Curry et al., 2021). Определение функциональной микроструктуры коры с помощью этого метода применяется и в прикладных медицинских исследованиях, как для диагностики некоторых заболеваний (Townsend et al., 2020, Chung et al., 2021), так и при проведении нейрохирургических операций (Morone et al., 2017).
В современных исследованиях метод оптического картирования по внутреннему сигналу может применяться как отдельно (Shumikhina et al., 2018; Бугрова, Бондарь, 2019; Tanaka et al., 2020; Friedman et al., 2020; Xie et al., 2020; Chung et al., 2021; Padawer-Carry et al., 2021), так и в сочетании с другими видами неинвазивных исследований, такими как функциональная магнитно-резонансная томография (фМРТ, Morone et al., 2017) и нейровизуализация при помощи потенциал-зависимых красителей (Voltage Sensitive Dyes, VSD; Tang et al., 2020; Townsend et al., 2020).
Главным преимуществом метода является то, что с его помощью можно выделить функциональные модули малых размеров (до 100 мкм) при фактически неограниченной площади картирования. Помимо этого метод обладает относительно высоким временным разрешением – до 100 мс (Lu et al., 2017; Schwartz, Bonhoeffer, 2001). И, наконец, нужно отметить, что этот подход характеризуется низкой себестоимостью и при этом высокой эффективностью. Баланс цены/эффективности связан с необходимостью иметь лишь узкополосный источник света, например, светодиоды, и чувствительную камеру для записи отраженного сигнала, что позволяет регистрировать незначительные локальные изменения отраженного света (M. Sintsov et al., 2017; M.Y. Sintsov et al., 2018).
Для оптического картирования по внутреннему сигналу характерен значительный уровень фоновой активности, который может на порядок превышать амплитуду полезного сигнала. В качестве одного из компонентов фоновой активности в сигнале присутствуют спонтанные колебания частотой от 0.01 до 0.1 Гц, называемые вазомоторными колебаниями (Mayhew et al., 1996; Vermeij et al., 2013; Tong et al., 2019). Источником этих колебаний является сердечно-сосудистая система (Pradhan, Chakravarthy, 2011; Machado et al., 2015). Вазомоторные колебания непосредственно не влияют на активность нейронов, однако их амплитудные и частотные характеристики могут изменяться в зависимости от активности симпатического отдела автономной нервной системы (Julien et al., 1995).
Установлено, что вазомоторные колебания зависят от условий эксперимента: фазы сна (Mayhew et al., 1996), предъявленного зрительного или слухового стимула (Mayhew et al., 1996), возраста испытуемых или когнитивной нагрузки предъявляемых стимулов (Vermeij et al., 2013). Кроме того, пространственно-временная структура проявления вазомоторных колебаний претерпевает во время проведения экспериментов постепенные изменения, причина которых однозначно не установлена.
В нашей работе мы выделили вазомоторные колебания из оптического сигнала, зарегистрированного в области V1, а также проанализировали их мощность и форму спектра. Наша задача состояла в том, чтобы сравнить эти характеристики для колебаний, обнаруженных в топографически различных локусах функциональной карты. Другой задачей является обнаружение причинно-следственной связи между такими колебаниями путем оценки их когерентности, а также коэффициента корреляции между их характеристиками.
МЕТОДИКА
Проведение эксперимента и регистрация сигнала
Опыты были проведены на 28 кошках весом 2.5–4 кг. Животному проводилась непрерывная внутривенная инфузия физраствора, содержащего глюкозу и пропофол (5 мг/мл), со скоростью 1.5–2 мл/час. Оно также было иммобилизировано ардуаном и переведено на искусственное дыхание. Глубина анестезии контролировалась при помощи анализа содержания CO2, оксиметрии, частоты дыхания и сердцебиения. Зрачки глаз животного были расширены при помощи атропина. В глаза кошки были помещены корректирующие контактные линзы для фокусировки глаз на зрительных стимулах, предъявляемых на мониторе компьютера. Череп трепанировали над полями 17 и 18 обоих полушарий. Все потенциально болевые места операционного поля дополнительно обкалывали лидокаином. Протоколы экспериментов были одобрены Этической комиссией Института ВНД и НФ РАН. Экспериментальная процедура детально описана в работе В.С. Бугровой и И.В. Бондаря (Бугрова, Бондарь, 2019).
В работе использовали экспериментальный подход и оборудование, разработанное Валерием Калацким (Kalatsky, Stryker, 2003). Для проведения функционального картирования зрительную кору непрерывно освещали красным светом длиной волны 630 ± 50 нм при помощи источника “холодного света” (Schott KL 1500 HAL, Германия), соединенного со светофильтром. Часть света отражалась от коры и прилегающих сосудов, после чего фиксировалась 16-битной CCD-камерой (Dalsa 1M60P, США) размером 12 × 12 мм с пространственным разрешением 1024 × × 1024 пикс. (в среднем в 1 пикселе было 12.4 мкм). Видеоизображение коры, представлявшее собой изменение интенсивности отраженного света, регистрировалось с разрешением 31.2 кадра/с.
В ходе записи сигнала на жесткий диск частота оцифровки уменьшалась до 7.9 Гц, а разрешение каждого кадра – до 512 × 512 пикс.
Весь эксперимент был поделен на экспериментальные сессии, во время которых изменяли условия зрительной стимуляции, что необходимо для детальной оценки функциональной анатомии коры. В ходе одной сессии осуществлялась непрерывная регистрация сигнала. Было записано 1048 таких сессий для всех кошек (по 7–68 записей на каждое животное). Время начала этих записей выбиралось нами в случайном порядке. Длительность одной сессии составляла от 6 до 10 мин.
Зрительная стимуляция
В 40 сессиях осуществлялась фоновая запись внутреннего сигнала, какие-либо стимулы не применялись. В оставшихся 1008 записях животному в процессе регистрации сигнала предъявлялся зрительный стимул на мониторе с электронно-лучевой трубкой, частота развертки которой составляла 85 Гц.
Стимул представлял собой видеофильм, который проигрывался на экране определенное время, называемое циклом стимуляции. Длительность одного такого цикла составляла примерно 1 мин (медианное значение – 59.90 с, интерквартильный размах от 59.89 до 59.90 с). После того как фильм заканчивался, его воспроизведение повторялось (иначе говоря, начинался следующий цикл стимуляции), и так происходило несколько раз, пока сессия не завершится. В фильмах были показаны простейшие геометрические фигуры. В подавляющем числе экспериментов это были решетки с разной пространственной частотой и контрастом.
Выделение оптического сигнала
В результате проведения эксперимента мы получили последовательность цифровых изображений мозга (или кадров), сделанных через равные временные интервалы, составляющие 0.125 с. Из этой последовательности изображений нами для инициации анализа был взят самый первый кадр (см. пример на рис. 1 (а)). На нем мы отметили три области интереса (region of interest, ROI), которые обозначены на рис. 1 (а) прямоугольниками с цифрами 1, 2, 3. Область интереса 1 (назовем ее ROIткань) включала в себя только непосредственно нервную ткань, а также примыкающие к ней капилляры и мелкие артериолы, невидимые невооруженным глазом. Следующая область (рис. 1 (а-1), или ROIсосуд) содержала только крупную артериолу, которая делила видимую часть полушария на две неравные части. Наконец, область 3, (рис. 1 (а-3), или ROIмп) соответствовала межполушарной области. Сигнал от этой области, по всей видимости, отражал вазомоторные колебания в дорсальном сагиттальном синусе, зашумленные твердой мозговой оболочкой.
Рис. 1.
Пример вазомоторных колебаний. (а) – изображение первичной зрительной коры, зарегистрированное при помощи метода оптического картирования по внутреннему сигналу, на котором прямоугольниками с цифрами 1, 2, 3 отмечены выбранные нами области интереса (ROI): 1 – ROIткань (ROI в нервной ткани), 2 – ROIсосуд (ROI в сосуде), 3 – ROIмп (ROI из области между полушариями). (б) – динамика внутреннего сигнала, зарегистрированного в нервной ткани (рис. (а), ROI № 1). (в) – динамика сигнала, зарегистрированного в сосуде (рис. (а), ROI № 2). (г) – динамика сигнала, зарегистрированного между полушариями (рис. (а), ROI № 3). На рис. (б), (в), (г) по оси абсцисс отмечено время в мин, по оси ординат – относительное изменение интенсивности отраженного света, %. (д) – плотность спектральной мощности сигнала, зарегистрированного в нервной ткани и изображенного на рис. (б). Цифрами отмечены: 1 – вазомоторные колебания, 2 – дыхательный ритм, 3 – сердечный ритм. (е) – плотность мощности сигнала, зарегистрированного в сосуде и изображенного на рис. (в). (ж) – плотность мощности сигнала, зарегистрированного в области между полушариями и изображенного на рис. (г). На рис. (д), (е), (ж) по оси абсцисс отмечена частота в Гц, по оси ординат – плотность спектральной мощности в Гц–1. (з) – сердечный ритм (серая кривая) и его огибающая (черная кривая). По оси ординат – относительная интенсивность отраженного света, %. (и) – динамика частоты сердечных сокращений (ЧСС). По оси ординат – ЧСС в ударах/мин. На рис. (з), (и) по оси абсцисс отмечено время в мин. Понятие относительной интенсивности отраженного света определено в Методике. Fig. 1. An example of vasomotor oscillations. (a) – imaging of the primary visual cortex revealed by means of the intrinsic-signal optical imaging where rectanges with digits denote the following: 1 – neural tissue, 2 – blood vessel, 3 – the region between hemispheres. (б) – dynamics of the intrinsic signal recorded from the neural tissue (Fig. (а), ROI No. 1). (в) – dynamics of the signal recorded from an arteriole (Fig. (а), ROI No. 2). (г) – dynamics of the signal recorded from the region between hemispheres (Fig. (а), ROI No. 3). On fig. (б), (в), (г) abscissa reflects time in minutes while ordinate corresponds to the relative intensity of reflected light, %. (д) – power spectrum density (PSD) of a signal recorded from the neural tissue and shown on Fig. (б). Denoted by digits are: 1 – vasomotor oscillations, 2 – breath rhythm, 3 – heart rhythm. (е) – PSD of a signal recorded from the arteriole and depicted on Fig. (в). (ж) – PSD of a signal recorded between the hemispheres and depicted on Fig. (г). On Fig. (д), (е), (ж) abscissa is for frequency in Hz, ordinate is for PSD in Hz–1. (з) – heart rhythm (grey curve) and its envelope (black curve). Ordinate is for relative intensity of reflected light, %. (и) – dynamics of the heart rate. Ordinate reflects the heart rate in cycles per minute. On Fig. (з), (и): Depicted on abscissa is time in min. Definition of the relative intensity of reflected light is given in Methods.
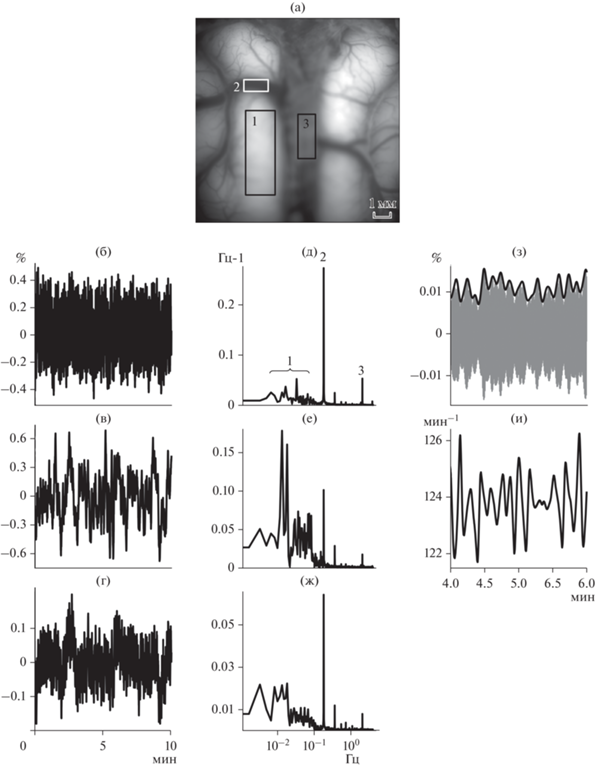
Те же самые ROI были автоматически отмечены на всех остальных кадрах, полученных в ходе сессии, и для каждого кадра мы рассчитали среднее значение интенсивности отраженного света по каждой из трех ROI. Тем самым на основе временнóй последовательности кадров получена временнáя последовательность средних значений отраженных сигналов, или то, как интенсивность отраженного света для конкретной ROI зависит от времени.
От каждой такой зависимости мы оставляли только ту ее часть, которая содержала целое число циклов: она начиналась тогда, когда начинался цикл стимуляции, и заканчивалась, когда другой цикл заканчивался. Затем при помощи метода скользящего среднего с временным окном, равным одному циклу стимуляции, оценивались изолинии наших сигналов, они соответствовали наиболее медленным непериодическим изменениям интенсивности отраженного света. Эти изолинии вычитались из исходных сигналов, и в результате этого выделялись только периодические колебания этой интенсивности (рис. 1 (б, в, г)). Они включали в себя как вызванный ответ коры на зрительный стимул, так и периодические составляющие фоновой активности. Дополнительно мы делили получившиеся сигналы на их среднее по времени, выражая результат в процентах от среднего значения сигнала.
Анализ оптического сигнала
После получения оптического сигнала мы в первую очередь строили его периодограммы при помощи быстрого преобразования Фурье. Примеры таких периодограмм приведены на рис. 1 (д, е, ж). На них отчетливо видно, что зарегистрированные нами изменения дезоксигемоглобина включают в себя вазомоторные колебания, дыхательный и сердечный ритмы: вазомоторным колебаниям соответствовало широкополосное повышение плотности спектральной мощности на участке 0–0.15 Гц (рис. 1 (д-1)), дыхательному ритму – один большой острый пик (рис. 1 (д-2)) на промежутке от 0.17 до 0.25 Гц и следующие за ним пики на частотах, кратных частоте дыхательного ритма, сердечному ритму – более мелкий пик, наблюдаемый в диапазоне свыше 2 Гц (рис. 1 (д-3)).
Все три компонента сигнала располагались в разных частотных диапазонах, а это означает, что их можно выделить из исходного сигнала при помощи различных цифровых фильтров. Вазомоторные колебания были выделены с помощью фильтра Баттерворта десятого порядка с полосой пропускания до 0.15 Гц, а сердечный ритм (рис. 1 (з), серая линия) – с применением фильтра Чебышева I типа четвертого порядка с амплитудой биений в полосе пропускания, не превышающей 0.01 дБ. Полоса пропускания фильтра Чебышева для каждой сессии выбиралась индивидуально на основе анализа периодограмм (рис. 1 (д, е, ж)). Дыхательный ритм мы в работе не рассматривали.
Вазомоторные колебания сердечного ритма
В ряде работ (Machado et al., 2015; Vermeij et al., 2013; Korhonen et al., 2014) были опубликованы сведения о наличии сверхмедленных и медленных изменений сердечного ритма, которые авторы главным образом связывали с влиянием симпатической нервной системы. Так как вазомоторные колебания локальных изменений уровня дезоксигемоглобина (рис. 1 (д-1)) также испытывают модулирующее влияние симпатической нервной системы (Hald et al., 2018), мы исследовали колебания амплитуды и частоты сердцебиения.
Выделение таких колебаний осуществляется при помощи преобразования Гильберта. Оно переводит исходный ритм сердцебиения (рис. 1 (з), серая линия) в некоторую комплексную функцию. Вычисляя модуль такой комплексной функции, можно определить, как менялась по времени огибающая этих ритмов (рис. 1 (з), толстая черная линия), отражавшая изменения их амплитуды. Если вычислить ее аргумент и взять от него производную, то мы увидим, как меняется во времени частота ритма (рис. 1 (и)).
Все полученные таким образом изменения амплитуды и частоты сердечного ритма мы дополнительно пропускали через фильтр Баттерворта десятого порядка с полосой пропускания до 0.15 Гц.
Отделение вазомоторных колебаний от зрительного вызванного ответа. Два частотных диапазона вазомоторных колебаний
В результате применения вышеупомянутых процедур мы получили сигналы, которые содержали в себе смесь вызванных зрительных ответов и фоновой активности, главным образом представленной в виде вазомоторных колебаний. Кроме того, и сами вазомоторные колебания не были однородными, в них выделялось два типа: сверхмедленные (Very-Low-Frequency, VLF) колебания с частотами до 0.05 Гц и медленные (Low Frequency, LF) колебания с частотами от 0.05 до 0.15 Гц. Однако в этом случае мы уже не смогли разделить наш сигнал на отдельные составляющие и поэтому решили построить спектр всего сигнала, используя для этих целей быстрое Фурье-преобразование. Дальнейшие выводы мы делали исключительно на основе анализа этих спектров.
Для такого анализа мы воспользовались тем, что если животному предъявлялся периодический стимул (постоянно повторяющийся фильм), то и вызванный зрительный ответ также должен был иметь периодический характер, а такому сигналу будет соответствовать дискретный спектр, плотность спектральной мощности которого сконцентрирована исключительно на частотах Fs, 2Fs, 3Fs, …, где Fs – частота, соответствующая одному циклу стимуляции. Назовем этот ряд частот гармониками зрительной стимуляции. С другой стороны, вазомоторным колебаниям соответствует непрерывный спектр (Pradhan, Chakravarthy, 2011; см. также рис. 1 (д-1)). А это значит, что плотность спектральной мощности вне гармоник стимуляции будет соответствовать исключительно вазомоторным колебаниям. Исходя из этого соображения мы оценили в нашей спектрограмме: а) площадь под частью спектрограммы, соответствующей частотам до 0.05 Гц, кроме гармоник стимуляции, – это была мощность сверхмедленных колебаний; б) площадь под частью спектрограммы, соответствующей частотам от 0.05 до 0.15 Гц, кроме гармоник стимуляции, – это была мощность медленных колебаний; в) пиковые значения частот сверхмедленных и медленных колебаний.
Когерентность вазомоторных колебаний
Помимо анализа спектральной мощности мы составляли любые возможные комбинации из двух пар сигналов. Примером таких пар сигналов могут быть: отведение от ROIткань – отведение от ROIсосуд, ROIткань – ROIмп, ROIткань – изменения амплитуды сердечного ритма, ROIсосуд – ЧСС и так далее.
Для каждой из этих пар мы вычисляли когерентность. Из нее мы брали усредненные значения этой величины отдельно в VLF- и LF-диапазонах частот. Когерентность двух колебаний – это специальный показатель, который отражает, насколько эти колебания протекают синхронно, а значит, имеют общий источник. Когерентность принимает значение от 0 до 1: когерентность, равная 0, соответствует независимым друг от друга колебаниям, а когерентность, равная единице, – их полной синхронности, которая может указывать на наличие общего источника.
Статистическая обработка данных
Обработка цифровых сигналов производилась с помощью интерпретатора Python 3.8; использовались как стандартные расширения numpy, matplotlib, scipy, pandas, sklearn, openpyxl, pingouin, так и созданный в нашей лаборатории дистрибутив imageanalysis, исходный код которого доступен для скачивания по ссылке: https://www.github.com/serik1987/ihna_kozhuhov_image_analysis.
Когда при сглаживании или фильтрации возникали краевые эффекты, то от начала и от конца сигнала удалялось целое число циклов, из-за чего длительность самого сигнала уменьшалась.
Для уменьшения влияния паразитарного шума на полученные результаты значения всех мощностей, зарегистрированных на одном конкретном животном и с одного канала, усреднялись. Статистический анализ данных производился для уже усредненных значений при помощи пакетов scipy 1.6.0, pandas 1.2.0 и pingouin 5.1.0. Все коэффициенты корреляции рассчитывались по Спирману. Мощности вазомоторных колебаний сравнивались друг с другом при помощи непараметрического теста Фридмана (аналога теста ANOVA для повторных измерений). После положительного результата такого теста с целью получения более детальной информации о различиях мощностей в разных измерениях мы дополнительно осуществляли попарное сравнение при помощи критерия Вилкоксона.
При упоминании значений мощности и частоты колебаний мы сначала приводим ее медианное значение, а затем в скобках – 25%-й и 75%-й персентили.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Пример вазомоторных колебаний
На рис. 1 приведен пример вазомоторных колебаний, зарегистрированных в одном из экспериментов. Мы записали оптический сигнал от областей интереса, которые отмечены на рис. 1 (а) прямоугольниками с цифрами 1, 2, 3. Сами эти сигналы приведены на рис. 1 (б, в, г). На графиках видны вазомоторные колебания, которые особенно четко выявляются в отведениях от сосуда (рис. 1 (в)). Для того чтобы подтвердить их существование, проведено быстрое Фурье-преобразование, после чего построены спектрограммы (рис. 1 (д, е, ж)). На них можно увидеть многократное повышение плотности спектральной мощности на частотах до 0.15 Гц (рис. 1 (д-1)), которое и подтверждает присутствие в нашем сигнале вазомоторных колебаний.
Мы пошли дальше и выделили из оптических сигналов сердечный ритм (рис. 1 (з), серая линия). С помощью преобразования Гильберта мы построили изменения его амплитуды (рис. 1 (з), черная линия) и частоты (рис. 1 (и)). Визуальный анализ подобных изменений также позволяет нам обнаружить, что им свойственны медленные колебания, и такое наблюдение тоже подтверждается при помощи Фурье-преобразования.
Аналогичное повышение плотности спектральной мощности наблюдалось для всех построенных нами спектрограмм как оптического сигнала, так и сердечного ритма, на основании чего можно сделать вывод о том, что вазомоторные колебания были обнаружены нами во всех областях интереса.
Сравнение колебаний, зарегистрированных от разных областей интереса
Мощность колебаний зависит от того, от какого именно отведения эти колебания были зарегистрированы (критерий Фридмана, p < 10–8 для сверхмедленных и p < 10–10 для медленных колебаний).
На рис. 2 (а) приведено сравнение мощностей сверхмедленных (VLF) колебаний уровня дезоксигемоглобина для трех различных ROI: ткани, сосуда и области между полушариями. Из графиков следует, что наибольшей мощностью, медианное значение которой равно 0.25, а интерквартильный интервал – 0.13–0.46, обладают колебания, зарегистрированные от сосуда, затем идут колебания от ROIткань с мощностью 0.056 (0.028–0.124), что достоверно меньше, чем колебания в сосуде (p < 0.000012). Наконец, наименьшей мощностью, равной 0.019 (0.009–0.028), обладает сигнал от dura matter, что также достоверно меньше, чем мощность сигнала от ROIткань (p < 0.0003).
Рис. 2.
Диаграммы размаха значений мощности сверхмедленных (VLF) и медленных (LF) вазомоторных колебаний. (а) – мощность VLF-колебаний, (б) – мощность LF-колебаний, (в) – отношение мощности VLF-колебаний к суммарной мощности всех выделенных нами вазомоторных колебаний.По оси абсцисс обозначены параметры вазомоторных колебаний: “ткань” – уровень дезоксигемоглобина в ROIткань, “сосуд” – уровень дезоксигемоглобина в ROIсосуд, “мп” – уровень дезоксигемоглобина в ROIмп, ЧСС – изменение частоты сердечных сокращений, АСР – изменение амплитуды сердечного ритма. Каждому из приведенных параметров соответствует диаграмма “усатый ящик”; границами ящика служат 25-й и 75-й процентили (первый и третий квартили). Линия в середине ящика обозначает медианное значение. Белыми кружками отмечены данные, выходящие за границы “усов”, или выбросы. В случае, если выбросы не указываются, то границы усов соответствуют максимальному и минимальному значениям. Везде, где отмечены выбросы, границы усов выбраны таким образом, чтобы расстояние от границ ящика до границ усов было в 1.5 раза больше интерквартильного интервала. Звездочками отмечены достоверные различия: * – p < 0.05, ** – p < 0.005, *** – p < 0.0005. Fig. 2. Boxplots of spectrum power values of very-low-frequency (VLF) and low-frequency (LF) oscillations. (а) – VLF oscillations power, (б) – LF oscillations power, (в) – ratio of VLF oscillations power to the total power of vasomotor oscillations. Depicted on abscissa are: “ткань” is for the brain tissue, “сосуд” is for the brain vessel, “мп” is for region between the hemispheres, ЧСС – the heart rate, АСР – the heart rhythm amplitude. A boxplot is given for each of the rhythm: its borders are 25th and 75th procentiles or first and third quartiles. Line in the middle reflects median value. White circles depict outliers. Whiskers borders correspond to the minimum and maximum values when no outliers present. Whisker size is 1.5 times higher than the interquantile range when some outliers were shown. Stars denote reliability values obtained by the Wilcoxon test: * – p < 0.05, ** – p < 0.005, *** – p < 0.0005.
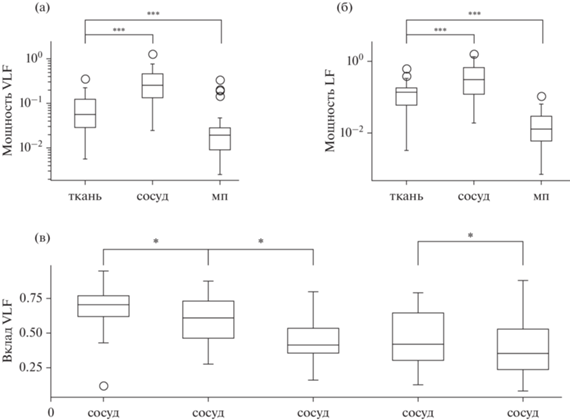
Такая же закономерность свойственна медленным (LF) колебаниям, несмотря на то, что численные показатели для них другие: для сосудов – 0.30 (0.12–0.68), для ROIткань – 0.14 (0.06–0.18, p < 0.0003), для межполушарной области – 0.013 (0.006–0.028, p < < 0.0000009). Подобные различия могут быть обусловлены в том числе и техническими особенностями регистрации оптического сигнала, при которых спектральная мощность регистрируемого сигнала прямо пропорциональна площади той части ROI, которая приходится на систему кровообращения. В связи с этим наиболее объективным показателем, как нам кажется, является вклад сверхмедленного ритма в общую мощность колебаний, который определяется как отношение мощности сверхмедленных колебаний на частоте до 0.05 Гц к общей мощности вазомоторных колебаний (рис. 2 (в)).
Вклад сверхмедленных колебаний, зарегистрированных для разных отведений, достоверно отличается друг от друга (критерий Фридмана, p < 10–7). В изменениях частоты сердечных сокращений (рис. 2 (в), ЧСС) преобладают колебания в диапазоне, аналогичном VLF-колебаниям вазомоторного сигнала, их вклад составляет 0.71 (0.62–0.76). Также колебания VLF-диапазона преобладают при регистрации в межполушарной области, хотя их вклад достоверно ниже (0.61 (0.46–0.73), p < 0.04). Преобладание медленных (LF) колебаний свойственно изменениям амплитуды сердечного ритма (рис. 2 (в), АСР), а также вазомоторным колебаниям, зарегистрированным в сосудах и нервной ткани (рис. 2 (в), сосуд, ткань). В случае изменений амплитуды сердечного ритма вклад VLF-колебаний равен 0.41 (0.35–0.53), что достоверно ниже (p < 0.04) величины этого вклада в колебаниях, зарегистрированных между полушариями. Вклад сверхмедленных колебаний для сигналов, зарегистрированных в сосудах, и колебаний амплитуды сердечного ритма составляет 0.41 (0.35–0.53) и 0.42 (0.30–0.64) соответственно, и значимо не различается. Вклад сверхмедленных колебаний для вазомоторных колебаний, зарегистрированных в ткани мозга (0.35 (0.23–0.53)), значимо меньше (p < 0.03), чем аналогичный показатель для колебаний, зарегистрированных в сосуде: 0.42 (0.30–0.64).
Частоты максимумов (то есть частоты, на которых плотность спектральной мощности была максимальна) для сверхмедленных (VLF) колебаний находились в нижней спектральной области, составляя для нервной ткани 0.008 (0.008–0.039) Гц, для сосуда – 0.025 (0.008–0.042) Гц, для межполушарной области – 0.008 (0.008–0.008) Гц, для АСР – 0.009 (0.008–0.026) Гц, для ЧСС – 0.008 (0.008–0.025) Гц. Для медленных (LF) колебаний они находились в диапазоне около 0.1 Гц: для ткани – 0.092 (0.058–0.109) Гц, для сосуда – 0.075 (0.058–0.108) Гц, для межполушарной области – 0.075 (0.058–0.109) Гц, для АСР – 0.092 (0.075–0.109) Гц, для ЧСС – 0.092 (0.058–0.109) Гц. Частоты колебаний, зарегистрированные в отведениях разных областей, достоверно отличались друг от друга (p < 0.05).
Для выявления взаимосвязи между различными типами выявленных нами вазомоторных колебаний мы провели корреляционный анализ их спектральной мощности и частоты, а также вычислили коэффициенты когерентности между разными колебаниями.
Коэффициент корреляции между характеристиками колебаний, зарегистрированных в различных областях интереса
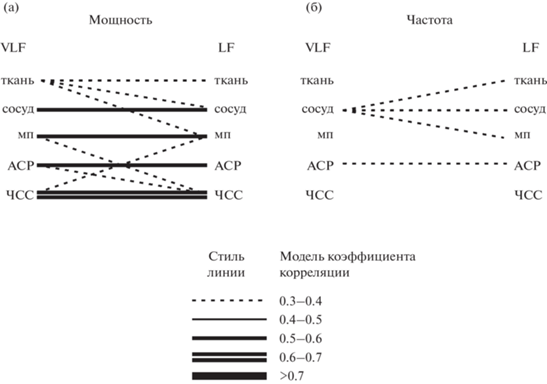
На рис. 3 (а) приведен коэффициент корреляции между мощностями сверхмедленных колебаний. На нем толстая сплошная линия соответствует коэффициенту, который превышает 0.5. Он свойственен для таких пар параметров, как “ЧСС–ткань”, “ткань–сосуд”, “ткань–мп”. Из этого мы можем сделать вывод о том, что эти колебания действительно могут взаимно влиять друг на друга.
Рис. 3.
Коэффициенты корреляции между различными параметрами вазомоторных колебаний: (а) – между спектральными мощностями сверхмедленных ритмов, (б) – между спектральными мощностями медленных ритмов, (в) – между частотами сверхмедленных ритмов, (г) – между частотами медленных ритмов. Обозначения параметров те же, что на рис. 2. Наличие линии, соединяющей два источника, означает, что коэффициент корреляции по Спирману между мощностями или частотами двух колебаний выше, чем 0.3. Стиль и толщина этой линии зависят от того, в каком диапазоне этот коэффициент корреляции находится. Соответствие стиля линии и значения коэффициента корреляции приведено снизу от диаграмм. Fig. 3. Correlations between oscillations recorded from different sources: (а) – correlations between VLF oscillation powers, (б) – between LF oscillation powers, (в) – between VLF oscillation frequencies, (г) – between LF oscillation frequencies. The source names are the same as in Fig. 2. A line connecting two sources means that the correlation between their oscillations is above 0.3. The line style and width depends on the correlation value in a way shown below the figures.
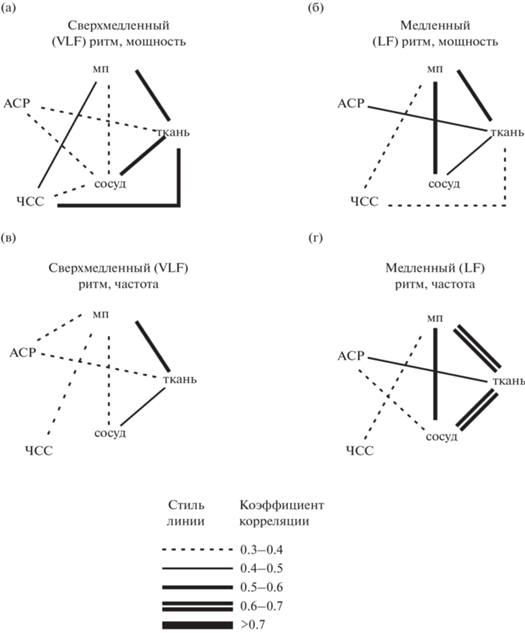
В отличие от сверхмедленных колебаний, медленный (LF) ритм характеризуется более низкими значениями корреляции: значения свыше 0.5 все еше наблюдаются для пар “сосуд–мп”, а также “ткань–мп”, в то время как для пары “ткань–сосуд” он понижается до 0.471, а для пары “ткань–ЧСС” – и вовсе до 0.322.
В отличие от мощностей, частоты колебаний взаимосвязаны друг с другом по совсем иному принципу. Так, для сверхмедленного (VLF) ритма (рис. 3 (в)) высокие значения коэффициента корреляции (более 0.5) свойственны только паре “ткань–мп” (r = 0.508), в то время как для медленных (LF) колебаний (рис. 3 (г)) таких пар гораздо больше: “мп–сосуд”, “мп–ткань”, “сосуд–ткань”, “сосуд–АСР”.
Когерентность между различными колебаниями
На рис. 4 (а, б) отмечено, в скольких случаях между двумя парами колебаний регистрируется достоверная когерентность. Мы видим, что относительно стабильно (более 80% случаев) когерентность регистрируется только между парами “мп–сосуд”, “мп–ткань”, “сосуд–ткань”, в то время как когерентность сигнала, зарегистрированного в этих областях интереса, с колебаниями частоты и амплитуды сердечного ритма встречается значительно реже.
Рис. 4.
Значения когерентности для вазомоторных колебаний разных частотных диапазонов. (а) и (в) – когерентность в диапазоне сверхмедленных (VLF) колебаний, (б) и (г) – когерентность в диапазоне медленных (LF) колебаний. На (а) и (б) отмечено, в скольких записях наблюдались достоверные значения когерентности (p < 0.05). Стиль и толщина линии зависят от процентного соотношения таких записей так, как это показано на шкале между двумя рисунками. На (в) и (г) графически изображены медианные значения когерентности между двумя различными колебаниями. Стиль линии зависит от данного конкретного медианного значения так, как это показано на шкале между графиками. Обозначения параметров те же, что и на рис. 2. Fig. 4. Coherence of vasomotor oscillations recorded from different sources. (а) and (в) depict very-low-frequency (VLF) oscillations and (б) and (г) is for low-frequency (LF) oscillations. Depicted on (а) and (б) is fraction of records where coherence was reliably different from zero (p < 0.05). The line style and width designates proportion of such records in a way shown between the graphs. Shown on (в) and (г) are median coherence values between oscillations recorded from two penetrations. The line style and width designates such a value in a way shown between the graphs. The source names are the same as in Fig. 2.
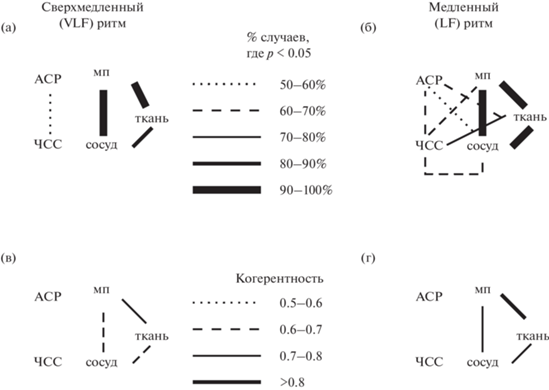
Соответствующие значения когерентности схематично изображены: для сверхмедленных колебаний – на рис. 4 (в), а для медленных – на рис. 4 (г). Мы можем видеть, что оба типа колебаний характеризуются сравнительно высокими значениями когерентностей (выше 0.6) только в парах “мп–ткань”, “мп–сосуд”, “ткань–сосуд”, причем значения коэффициента когерентности для медленных (LF) колебаний выше, чем для сверхмедленных (VLF).
Корреляции между характеристиками сверхмедленных (VLF) и медленных (LF) колебаний
Выявлена также связь между сверхмедленными и медленными колебаниями. Корреляционные связи между значениями спектральных мощностей вазомоторных колебаний представлены на рис. 5 (а), а между значениями их частот – на рис. 5 (б). На рисунках видно, что между спектральными мощностями VLF- и LF-колебаний наблюдаются высокие (более 0.5) значения коэффициентов корреляции (рис. 5 (а)). Другой интересной особенностью этих взаимодействий является то, что высокие корреляционные коэффициенты связывают спектральные мощности одних и тех же вазомоторных колебаний, относящиеся к LF- и VLF-диапазонам.
Рис. 5.
(а) – Коэффициент корреляции между мощностью сверхмедленных (VLF) и медленных (LF) вазомоторных колебаний. (б) – Коэффициент корреляции между частотой сверхмедленных и медленных вазомоторных колебаний. В каждой из диаграмм левый столбец соответствует параметрам VLF-колебаний, а правый столбец – параметрам LF-колебаний. Обозначения параметров те же, что и на рис. 2. Стиль и толщина линий на диаграмме зависит от величины коэффициента корреляции. Соответствие стиля линии и значения коэффициента корреляции приведено снизу от диаграмм. Fig. 5. (а) – Correlation between powers of very-low-frequency (VLF) and low-frequency (LF) oscillations. (б) – Correlation between frequencies of VLF and LF oscillations. On each diagram the left column corresponds to VLF oscillations and the right one is for LF oscillations. Source names are the same as in Fig. 2. The line style and line width designates the correlation coefficient range in a way shown below the graphs.
В отличие от спектральных мощностей, частоты LF-колебаний слабо коррелируют с частотами VLF-колебаний, значения коэффициентов корреляции между парами значений не превышают 0.4.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно современным литературным данным, вазомоторные колебания представляют собой очень медленные (менее шести циклов в минуту) периодические изменения артериального давления (Julien et al., 1995; Takato et al., 1999; Korhonen et al., 2014), амплитуды и частоты сердцебиения (Takato et al., 1999; Machado et al., 2015; Латанов, Панкова, 2018), скорости кровотока (Julien et al., 1995; Burk, Riva, 1998), диаметра просвета сосудов (Peng et al., 2001; Watanabe et al., 2014), концентрации оксида азота (NO; Burk, Riva, 1998; Peng et al., 2001; Hald et al., 2018), норэпинефрина (Hald et al., 2018) и Ca2+ в гладких мышцах эпителия (Peng et al., 2001). Все эти параметры прямо или косвенно связаны как с изменением объема сосудов, так и с соотношением между концентрациями гемоглобина и дезоксигемоглобина в крови (Morone et al., 2017), благодаря чему могут также проявляться и при анализе нейронной активности методами, основанными на регистрации внутреннего сигнала, например, в функциональной магнитно-резонансной томографии (фМРТ; Mitra et al., 1997; Vermeij et al., 2013; Korhonen et al., 2014; Tong et al., 2019; Drew et al., 2020) или инфракрасной спектроскопии (Korhonen et al., 2014).
Мы выявили вазомоторные колебания при анализе внутреннего сигнала оптического картирования в различных областях интереса (рис. 1 (д-1)). Схожим методом вазомоторные колебания были выделены и исследованы Мейхью и соавторами (Mayhew et al., 1996). Мы также выделили вазомоторные колебания амплитуды и частоты (рис. 1 (и)) сердечного ритма, которые были обнаружены и исследованы ранее (Takato et al., 1999; Machado et al., 2015; Латанов, Панкова, 2018).
Типы вазомоторных колебаний
Обычно в нормальном физиологическом состоянии у животных выделяются два частотных диапазона колебаний (Julien et al., 1995; Pradhan, Chakravarthy, 2011; Vermeij et al., 2013; Watanabe et al., 2014; Machado et al., 2015): сверхмедленные (VLF) колебания с частототой до 0.05 Гц и медленные (LF) колебания с частотой от 0.05 до 0.15 Гц. Тех же самых обозначений мы придерживались и в наших экспериментах.
Некоторые исследователи (Julien et al., 1995; Vermeij et al., 2013; Watanabe et al., 2014; Smirni et al., 2019) приходят к выводу о том, что сверхмедленный и медленный ритмы – это два различных колебательных процесса, которые имеют разные источники. Например, Джулиен с соавт. (Julien et al., 1995) продемонстрировал, что VLF- и LF-колебания соответствуют двум четким пикам на спектрограмме. В другой работе (Vermeij et al., 2013) было показано, что на VLF- и LF-ритмы по-разному влияют стресс и когнитивная нагрузка. Ватанабе и соавт. (Watanabe et al., 2014) пришли к заключению, что симпатическая нервная система по-разному модулирует VLF- и LF-ритмы. Наконец, использование вейвлет-анализа позволило установить, что за генерацию VLF- и LF-колебаний отвечают разные механизмы (Smirni et al., 2019).
В нашем исследовании мы получили, что частоты VLF-колебаний очень слабо коррелируют с частотами LF-колебаний (рис. 5 (б)), несмотря на то, что мощности этих колебаний очень сильно друг с другом взаимосвязаны (рис. 5 (а)). Кроме этого, мощности и частоты LF-колебаний, взятых от разных отведений, коррелируют друг с другом не так, как это делают аналогичные показатели для VLF-колебаний (рис. 3). Наконец, медленный и сверхмедленный ритмы имеют разную локализацию: сверхмедленные колебания в большей степени проявляются в изменениях ЧСС, а медленные – в изменениях уровня дезоксигемоглобина тканей (рис. 2 (в)). Таким образом, наши данные подтверждают сделанные в некоторых работах выводы о различных источниках этих типов ритмов (Julien et al., 1995; Vermeij et al., 2013; Watanabe et al., 2014; Smirni et al., 2019).
Вазомоторные колебания можно классифицировать не только по своим частотным диапазонам, но еще и по способу регистрации. Дело в том, что в имеющихся литературных данных достоверно установлено два главных источника их формирования. Одним из них являются клетки гладкой мускулатуры артериол. Каждая такая клетка обладает несколькими осцилляторами, которые позволяют генерировать колебания разных частотных диапазонов (Peng et al., 2001; Pradhan, Chakravarthy, 2011; Hald et al., 2018; Smirni et al., 2019). После того как эти колебания сгенерированы, они могут синхронизироваться друг с другом, а также распространяться вдоль русла сосуда за счет щелевых контактов между мышечными клетками, а также за счет движения кровотока (Pradhan, Chakravarthy, 2011; Hald et al., 2018; Tong et al., 2019). Параллельно с таким источником также действует и другой источник осцилляций, который непосредственно связан с работой симпатической нервной системы и отвечает за возникновение вазомоторных колебаний амплитуды и частоты сердечного ритма (Julien et al., 1995; Machado et al., 2015).
В настоящей работе для выяснения источника вазомоторных колебаний был проведен анализ когерентности между ними (рис. 4). Этот анализ показал отсутствие значительной когерентности между колебаниями амплитуды и частоты сердечного ритма с одной стороны и локальными колебаниями уровня дезоксигемоглобина с другой. Это подтверждает наличие в нашей системе двух различных источников VLF-колебаний и двух источников LF-колебаний.
Однако, несмотря на отсутствие когерентностей между этими двумя параметрами, их мощности очень хорошо друг с другом коррелировали (рис. 3). Это может указывать на наличие общего источника, осуществляющего одновременную модуляцию обоих колебаний. Этим источником может быть симпатическая нервная система, что находит подтверждение в современной литературе (Hald et al., 2018; Julien et al., 1995; Korhonen et al., 2014; Латанов, Панкова, 2018).
Практическое применение полученных результатов
Метод оптического картирования по внутреннему сигналу позволяет зарегистрировать вазомоторные колебания в каждом пикселе карты. В результате мы получили 262 144 сигнала, по одному для каждого пикселя. Каждый из этих сигналов представляет собой изменение во времени относительной концентрации дезоксигемоглобина в некотором пикселе. В нашей работе мы показали (рис. 1), что компонентами этих сигналов являются сверхмедленные и медленные вазомоторные колебания. Вклад колебаний разной частоты в результирующий сигнал зависит от того, относится ли тот или иной пиксель к нервной ткани или к кровеносному сосуду (рис. 2). В то же время колебания, зарегистрированные в кровеносном сосуде, и колебания, зарегистрированные в нервной ткани, обладают высокой степенью когерентности (Mayhew et al., 1996) (см. также рис. 4).
Существуют специальные методики, которые позволяют сигнал в каждом пикселе представить в виде суммы нескольких независимых компонент. К таким методикам относят метод главных компонент (Sintsov et al., 2018), а также метод независимых компонент (Hyvarinen et al., 2001). Сами эти сигналы являются общими для всех пикселей карты. Однако их вклад в результирующий сигнал, или “вес”, уникален для каждого пикселя.
Основываясь на наших данных, мы можем сделать следующие предположения: а) поскольку между вазомоторными колебаниями, зарегистрированными на разных участках карты, имеет место высокая когерентность, а их взаимосвязь с сигналом, вызванным нейронной активностью, слаба, то сверхмедленные и медленные колебания могут быть выделены в отдельные независимые компоненты; б) поскольку процентное соотношение между этими колебаниями различается для кровеносного сосуда и для нервной ткани, то и набор вкладов различных компонент для этих двух участков также будет отличаться.
Таким образом, на основе полученных данных мы предполагаем применение в нашей дальнейшей работе следующей обработки функциональных карт. Сначала из исходного многомерного сигнала выделяются независимые компоненты, а каждый пиксель характеризуется уникальным набором коэффициентов или вкладов этих компонент. Затем на основе различий между этими вкладами отбираются только те пиксели, которые принадлежат исключительно нервной ткани. И, наконец, для анализа сигнала берутся только те компоненты, которые не соответствуют вазомоторным колебаниям. Мы предполагаем, что предложенный нами способ обработки сигналов позволит построить более точные функциональные карты мозга, чем применяемый в настоящее время метод на основе Фурье-анализа (Kalatsky, Stryker, 2003) и последующего выделения прямоугольной ROI.
ВЫВОДЫ
1. В проведенных нами экспериментах были зарегистрированы корковый ответ и вазомоторные колебания, для каждой из составляющих которых был предложен оптимальный режим фильтрации.
2. Вазомоторные колебания, зарегистрированные в области нервной ткани и сосудов, обладают различными амплитудными и спектральными характеристиками.
3. Между параметрами обоих типов вазомоторных сверхмедленных и медленных колебаний, зарегистрированных в области нервной ткани и сосудов, с помощью анализа корреляций и когерентности обнаружены высокозначимые взаимосвязи.
Список литературы
Бугрова В.С., Бондарь И.В. Устойчивость функциональных доменов ориентационной и дирекциональной чувствительности первичной зрительной коры кошки к воздействию пропофола. Журн. высш. нервн. деят. им. И.П.Павлова. 2019. 69(2): 218–229.
Латанов А.В., Панкова Н.Б. Использование метода БОС-коррекции для оптимизации функционального состояния организма человека при высокогорном восхождении. Экология человека. 2018. 4: 22–29.
Bonhoeffer T., Grinvald A. Iso-Orientation Domains in Cat Visual Cortex are Arranged in Pinwheel-Like Patterns. Nature. 1991. 353(6343): 429–431.
Burk D.G., Riva C.E. Vasomotion and spontaneous low-frequency oscillations in blood flow and nitric oxide in cat optic nerve head. Microvasc. Res. 1998. 55(1): 103–112.
Chung D.Y., Oka F., Jin G., Harriott A., Kura S., Aykan S.A., Qin T., Edmiston W.J.3rd, Hang L., Yaseen M.A., Sakadzic S., Boas D.A., Whalen M.J., Ayata C. Subarachnoid Hemorrhage Leads to Early and Persistent Functional Connectivity and Behavioral Changes in Mice. J. Cereb. Blood Flow Metab. 2021. 41(5): 975–985.
Drew P.J., Mateo C., Turner K.L., Kleinfeld D. Ultra-slow oscillations in fMRI and Resting-State Connectivity: Neuronal and Vascular Contributions and Technical Confounds. Neuron. 2020. 107(5): 782–804.
Friedman R.M., Chehade N.G., Roe A.W., Charbawie O.A. Optical Imaging Reveals Functional Domains in Primate Sensorimotor Cortex. Neuroimage. 2020. 221: 117188.
Julien C., Zhang Z.Q., Cerutti C., Barres C. Hemodynamic analysis of arterial pressure oscillations in conscious rats. J. Auton. Nerv. Syst. 1995. 50(3): 239–252.
Hald B.O., Sorensen R.B., Sorensen P.G., Sorensen C.M., Jacobsen J.C.B. Stimulation history affects vasomotor responses in rat mesenteric arterioles. Pflugers Arch. 2019. 471(2): 271–283.
Hyvarinen A., Karhunen J., Oja E. Independent Component Analysis. New York: John Willey & Sons, Inc., 2001. 481 p.
Kalatsky V.A., Stryker M.P. New paradigm for optical imaging: temporally encoded maps of intrinsic signal. Neuron. 2003 May 22; 38(4): 529–45. PMID: https://doi.org/10.1016/s0896-6273(03)00286-112765606
Korhonen V., Hiltunen T., Myllyla T., Wang X., Kantola J., Nikkinen J., Zang Y.-F., LeVan P., Kiviniemi V. Synchronous multiscale neuroimaging environment for critically sampled physiological analysis of brain function: hepta-scan concept. Brain Connect. 2014. 4(9): 677–689.
Kozhukhov S.A., Ivanov R.S., Bugrova V.S., Verkhlyutov V.M., Ushakov V.L. Functional Asymmetry of Local Connections in V1 Orientation Tuning. Procedia Computer Science. 2020. 169: 620–639.
Lu H.D., Chen G., Cai J., Roe A.W. Intrinsic-Signal Optical Imaging of Visual Brain Activity: Tracking of Fast Cortical Dynamics. Neuroimage. 2001. V. 148. P. 160–168.
Machado C.M., Estevez M., Perez-Nellar J., Schiavi A. Residual vasomotor activity assessed by heart rate variabiltiy in a brain-dead case. BMJ Case Rep. 2015. bcr2014205677.
Mayhew J.E.W., Askew S., Zheng Y., Porrill J., Westby G.W.M., Redgrave P., Rector D.M., Harper R.M. Cerebral Vasomotion: a 0.1 Hz-Oscillation in Reflected Light Imaging of Neural Activity. Neuroimage. 1996. 4(4 Pt 1): 183–193.
Mitra P.P., Ogawa S., Hu X., Ugurbil K. The nature of spatiotemporal changes in cerebral hemodynamics as manifested in functional magnetic resonance imaging. Magn. Reson. Med. 1997. 37(4): 511–518.
Morone K.A., Neimat J.S., Roe A.W., Friedman R.M. Review of Functional and Clinical Relevance of Intrinsic Signal Optical Imaging in Human Brain Mapping. Neurophotonics. 2017. 4(3): 031220.
Parawer-Curry J.A., Jahnavi J., Licht D.J., Yodh A.G., Cohen A.S., White B.R. Variability in Atlas Registration of Optical Intrinsic Signal Imaging and its Effect on Functional Connectivity Atlas. J. Opt. Soc. Am. A. Opt. Image Sci. Vis. 2021. 38(2): 245–252.
Pradhan R.K., Chakravarthy V.S. Informational Dynamics of Vasomotion in Microvascular Networks: a Review. Acta. Physiologica. 2011. 201: 193–218.
Peng H., Matchkov V., Ivarsen A., Aalkjaer C., Nilsson H. Hypothesis for the initiation of vasomotion. Circ. Res. 2001. 88(8): 810–815.
Schwartz T.H., Bonhoeffer T. In vivo optical mapping of epileptic foci and surround inhibition in ferret cerebral cortex. Nature Medicine. 2001. V. 7. № 9. P. 1063–1067.
Sintsov M., Suchkov D., Khazipov R., Minlebaev M. Developmental Changes in Sensory-Evoked Intrinsic Signals in the Rat Barrel Cortex. Front. Cell. Neurosci. 2017. V. 11. Art. 392.
Sintsov M.Yu., Suchkov D., Minlebaev M.G. Detection of Intrinsic Optical Signals in the Somatosensory Cortex of Neonatal Rats by Principal Component Analysis. Neurosci. Behav. Physiol. 2018. V. 48. № 5. P. 551–556.
Smirni S., McNeilly A.D., MacDonald M.P., McCrimmon R.J., Khan F. In-vivo correlations between skin metabolic oscillations and vasomotion in wild-type mice and in a model of oxidative stress. Sci. Rep. 2019. 9(1): 186.
Tanaka S., Miyashita M., Wakabayashi N., O’Hashi K., Tani T., Ribot J. Development and Reorganization of Orientation Representation in the Cat Visual Cortex: Experience-Dependent Synaptic Rewiring in Early Life. Front. Neuroinform. 2020. 14: 41.
Takato R., Majahalme S., Tuomisto M., Turjanmaa V. Circadian profile of low-frequency oscillations in blood pressure and heart rate in hypertension. Am. J. Hypertens. 1999. 12(9 Pt 1): 874–881.
Tang R., Song Q., Li Y., Zhang R., Cai X., Lu H.D. Curvature-Processing Domains in Primate V4. Elife. 2020. 9: e57502.
Tong Y., Hocke L.M., Friedrick B.B. Low Frequency Systemic Hemodynamic “Noise” in Resting State BOLD fMRI: Characteristics, Causes, Mitigation, Strategies and Applications. Front. Neurosci. 2019. 13: 787.
Townsend L.B., Jones K.A., Dorsett C.R., Philpot B.D., Smith S.L. Deficits in Higher Visual Area Representations in a Mouse Model of Angelman Syndrome. J. Neurodev. Disord. 2020. 12(1): 28.
Shumikhina S.I., Bondar I.V., Svinov M.M. Dynamics of Stability of Orientation Maps Recorded with Optical Imaging. J. Neurosci. 2018. 374: 49–60.
Vermeij A., Meel-van den Abeelen A.A.S., Kessels R.P.C., van Beek A.H.E.A., Claassen J.A.H.R. Very-Low-Frequency Oscillations of Cerebral Hemodynamics and Blood Pressure are Affected by Aging and Cognitive Load. Neuroimage. 2013. 85(Pt. 1): 608–615.
Watanabe S., Amiya E., Watanabe M., Takata M., Ozeki A., Watanabe A., Kawarasaki S., Nakao T., Hosoya Y., Nagata K., Nagai R., Komuro I. Elevated C-reactive Protein Levels and Enhanced High Frequency Vasomotion in Patients with Ischemic Heart Disease during Brachial Flow-Mediated Dilation. PLoS One. 2014. 9(10): e110013.
Xie H., Chung D.Y., Kura S., Sugimoto K., Aykan S.A., Wu Y., Sakadzic S., Yaseen M., Boas D.A., Ayata C. Differential Effects of Anesthetics on Resting State Functional Connectivity in the Mouse. 2020. 40(4): 875–884.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


