Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 5, стр. 707-716
Вызванные потенциалы среднего мозга человека, появляющиеся после окончания звучания простого тона
А. О. Канцерова 1, *, Л. Б. Окнина 1, Д. И. Пицхелаури 2, В. В. Подлепич 2, Е. Л. Машеров 2, Я. О. Вологдина 1, 2, И. А. Зибер 3
1 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 ФГАУ НМИЦ нейрохирургии им. академика Н.Н. Бурденко Минздрава России
Москва, Россия
3 ФГАОУ ВО Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
* E-mail: anna.kantserova@gmail.com
Поступила в редакцию 06.03.2022
После доработки 03.05.2022
Принята к публикации 27.06.2022
- EDN: SDLXRN
- DOI: 10.31857/S0044467722050082
Аннотация
Исследования активности нейронов у животных показали, что ствол мозга участвует в обработке конца звука. В основе данного исследования лежит анализ реакции среднего мозга человека на окончание подачи звукового стимула. Регистрация электрической активности проводилась при помощи глубинного электрода, расположенного в водопроводе мозга (aqueductus cerebri). Исследование проводилось в рамках интраоперационного мониторинга (ИОМ) с целью минимизации неврологического дефицита в послеоперационном периоде. Представлены результаты анализа вызванных потенциалов, записанных в ответ на простые тоны у 6 пациентов. На вызванных потенциалах вслед за началом звучания стимула были выявлены пики VS, VIS, S1S, S2S, S3S, связанные с проведением нервного импульса по слуховому пути. После окончания звучания стимула выявлялись пики VE, VIE, S1E, S2E, S3E, которые также связаны с проведением нервного импульса по слуховому пути, и пик Е, который с наибольшей вероятностью отражает анализ звуковой информации структурами среднего мозга.
По прогнозам Всемирной организации здравоохранения (ВОЗ), к 2050 году около 2.5 миллиардов людей будут иметь нарушения слуха (ВОЗ, 2021). Физиологические механизмы этих нарушений многочисленны и варьируют от снижения звуковой проводимости в наружном ухе до повреждения структур головного мозга (Michels et al., 2019). В настоящее время наиболее эффективными средствами коррекции слуха признаны слуховые аппараты и кохлеарные импланты (ВОЗ, 2021). Однако эти устройства оказывают помощь только пациентам, у которых есть патологии наружного, среднего и внутреннего уха (Naples, Ruckenstein, 2020), (Valentinuzzi, 2020). При поражениях слухового нерва, а также в случае, когда установка кохлеарного импланта противопоказана, электроды внедряют непосредственно в ствол головного мозга (Dhanasingh, Hochmair, 2021). Эффективность слухового импланта в стволе головного мозга варьирует от детектирования отдельных звуков до распознавания речи (Behr et al., 2014).
Интенсивность естественных звуков быстро меняется. Кроме того, в них присутствуют многочисленные паузы разной длительности. Исследования активности нейронов, участвующих в обработке временных характеристик звуковых стимулов у животных, показали, что начало и конец звука обрабатываются слуховой системой по отдельности двумя разными нейронными системами (Liu et al., 2019). Клетки, относящиеся к системе, где обрабатывается конец звука, найдены в слуховой коре (Baba et al., 2016), (Sołyga, Barkat, 2019), в таламусе (Anderson, Linden, 2016) и в стволе мозга (Akimov et al., 2017), (Kopp-Scheinpflug et al., 2018).
Впервые селективность нейронного ответа по отношению к длительностям звуковых сигналов была найдена в среднем мозге лягушек (Potter, 1965). Однако только в результате нейронной регистрации нижних холмиков летучих мышей было показано, что в основе механизма этого феномена лежит постингибиторное облегчение (Casseday et al., 1994). Предполагаемый нейронный механизм детектирования конца звука заключается в ингибировании нейронов во время звучания стимула и их активации после окончания звука (Alluri et al., 2016).
Данные об обработке конца звукового стимула стволом мозга человека получены в исследовании (Brinkmann, Scherg, 1979) с использованием неинвазивной электроэнцефалографии (ЭЭГ). Были выявлены акустические стволовые off-потенциалы, которые представляют собой серию высокочастотных колебаний, следующих непосредственно после окончания подачи звукового стимула. По своим параметрам они схожи с акустическими стволовыми on-потенциалами, которые возникают сразу после начала подачи звукового стимула. В основе генерации акустических стволовых off-потенциалов лежит последовательное снижение интенсивности разрядов нейронов проводящих слуховых путей после окончания звучания стимула.
Ещe одним способом исследования роли стволовых структур человека в анализе временных характеристик звуковых стимулов является регистрация вызванных потенциалов (ВП) ближнего поля. Для этих целей используют электроды, которые имплантируются по медицинским показаниям для стимуляции стволовых структур (Parsons et al., 2014) и для проведения интраоперационного мониторинга (ИОМ) (Sala et al., 2004). Наибольшую ценность для нейрофизиологии представляют исследования, проводимые совместно с ИОМ. В отличие от используемых для лечения хронической боли стимулирующих электродов, которые погружаются в нервную ткань, при ИОМ погружение в ткань ствола головного мозга не происходит. Используемые современные внутривенные анестетики в большей степени угнетают активность коры больших полушарий, но не оказывают выраженного влияния на ствол головного мозга (Sahinovic et al., 2018).
В основе данного исследования лежит анализ реакции среднего мозга на окончание подачи звукового стимула. Регистрация электрической активности проводилась при помощи глубинного электрода, расположенного в водопроводе мозга (aqueductus cerebri). Исследование проводилось в рамках ИОМ с целью минимизации неврологического дефицита в послеоперационном периоде.
МЕТОДИКА
Данное исследование согласовывается с принципами биомедицинской этики, сформулированными в Хельсинкской декларации. Исследование было одобрено этическим комитетом ФГАУ НМИЦ нейрохирургии им. академика Н.Н. Бурденко Минздрава России (Москва). Все участвовавшие в исследовании пациенты были осведомлены о цели и методах исследования и подписывали добровольное информированное согласие.
Критерии включения пациентов в исследования
В исследование включено 6 пациентов (2 женщины и 4 мужчин), которые проходили хирургическое лечение доброкачественных новообразований стволовых структур головного мозга в НМИЦ нейрохирургии им. акад. Н.Н. Бурденко МЗ РФ (табл. 1). Структуры среднего мозга не были вовлечены в опухолевый процесс ни у одного пациента, что было подтверждено при помощи предоперационной магнитно-резонансной томографии (МРТ). По данным клинического обследования и нейропсихологического тестирования, никто из пациентов не имел патологий слуховой системы и когнитивных нарушений ни до, ни после оперативного лечения. Послеоперационный период у всех пациентов протекал без осложнений. Не было выявлено нарастания очаговой неврологической симптоматики.
Таблица 1.
Характеристика пациентов, принявших участие в исследовании Table 1. Characteristics of patients who participated in the study
| Пациент | Пол | Возраст | Расположение опухоли | Хирургический доступ |
|---|---|---|---|---|
| 1 | Ж | 65 | Левый зрительный бугор | Транскортико-трансвентрикулярный |
| 2 | Ж | 41 | Продолговатый мозг | Медианный субокципитальный |
| 3 | М | 39 | Пинеальная область и продолговатый мозг | Медианный субокципитальный |
| 4 | М | 30 | Третий желудочек | Транскортико-трансвентрикулярный |
| 5 | М | 42 | Четвeртый желудочек | Медианный субокципитальный |
| 6 | М | 52 | Четвeртый желудочек | Медианный субокципитальный |
Хирургическое вмешательство
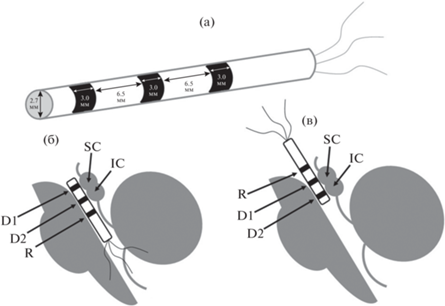
При выполнении хирургического лечения опухолей осуществлялся транскортико-трансвентрикулярный доступ в третий желудочек или медианный субокципитальный доступ в четвeртый желудочек (рис. 1). Вышеописанные хирургические доступы обеспечивали хорошую видимость водопровода мозга. В целях ИОМ в просвет водопровода вставлялся одноразовый электрод производства ООО “Нейроэлект” (Россия). Он состоял из пластиковой, круглой в сечении трубки (диаметр 2.7 мм) и прикреплeнных к ней трeх кольцевых стальных электродов-контактов. Два электрода-контакта (D1, D2) были регистрирующими, располагались в проекции верхних и нижних холмиков (colliculus superior и colliculus inferior) и плотно прилегали к стенкам водопровода мозга. Третий электрод (R) служил референтом, был обернут хирургической марлей во избежание контакта с нервной тканью и находился в III или IV желудочке в зависимости от хирургического доступа (рис. 1). Заземляющий электрод был установлен в проекции плечевого сустава.
Рис. 1.
Схема глубинного электрода и расположения его контактов относительно структур ствола мозга. (а) – схематичное изображение глубинного электрода. (б) – схема расположения контактов глубинного электрода относительно структур ствола мозга при медианном субокципитальном доступе. (в) – схема расположения контактов глубинного электрода относительно структур ствола мозга при транскортико-трансвентрикулярном доступе. D1, D2 – регистрирующие контакты (в водопроводе мозга), R – референт, SC – верхние холмики, IC – нижние холмики. Fig. 1. Scheme of the deep electrode and its position in relation to the structures of the brain. (a) – schematic representation of a deep electrode. (б) – layout of the deep electrode relative to the structures of the brainstem with median suboccipital surgical approach. (в) – layout of the deep electrode relative to the structures of the brainstem with transcortical-transventricular surgical approach. D1, D2, registering contacts (in the aqueductus cerebri); R, referent; SC, superior colliculi; IC, inferior colliculi.
Запись биопотенциалов
Регистрация ЭЭГ проводилась с целью объективизации глубины анестезии во время внутривенной инфузии пропофола и фентанила. Доза пропофола колебалась в пределах 6–9 мг/кг/час и определялась врачом-анестезиологом, исходя из клинических показателей: параметров гомеостаза, стабильности гемодинамики и т.д. В это время на ЭЭГ регистрировались паттерны “вспышка и подавление” (burst-suppression) с индексом подавления 0.3–0.4.
Регистрация вызванных потенциалов (ВП)
Звуковая последовательность подавалась при помощи программы “Presentation” Neurobehavioral Systems, Inc. USA и состояла из 125 стимулов – простых звуковых тонов длительностью 100 мс каждый. Подавалось 5 типов простых тонов разных частот: 600, 800, 1000, 2000 и 4000 Гц – с одинаковой вероятностью встречаемости (по 25 тонов каждой частоты). У всех тонов были одинаковые по длительности восходящая фаза (10 мс), плато (80 мс) и нисходящая фаза (10 мс). Временной интервал между стимулами варьировал в пределах от 1100 до 1170 мс. Тоны подавались бинаурально с использованием накладных наушников. Все тоны имели одинаковую громкость.
Потенциалы регистрировались на оборудовании Нейро-ИОМ-32/S производства “Нейрософт” (Россия). Частота дискретизации составляла 10 000 Гц; фильтр высоких частот – 0.01 Гц; фильтр низких частот – 4000 Гц, сетевой фильтр 50 Гц.
Анализ данных
Полученные записи биопотенциалов были подвергнуты обработке цифровыми фильтрами 2–500 Гц, затем проводился визуальный анализ. К дальнейшему анализу принимались безартефактные участки записи. Усреднение ответов проводилось относительно начала стимула. Предстимульный интервал составлял 100 мс, постстимульный – 300 мс. Ответы усреднялись отдельно по каждому из типов тонов.
С целью исключения “шумовой” природы параметров ВП были сгенерированы псевдоВП. Для их генерации на безартефактном участке нативной кривой без подачи стимулов (фон) были случайным образом расставлены 25 меток, относительно которых проводилось усреднение.
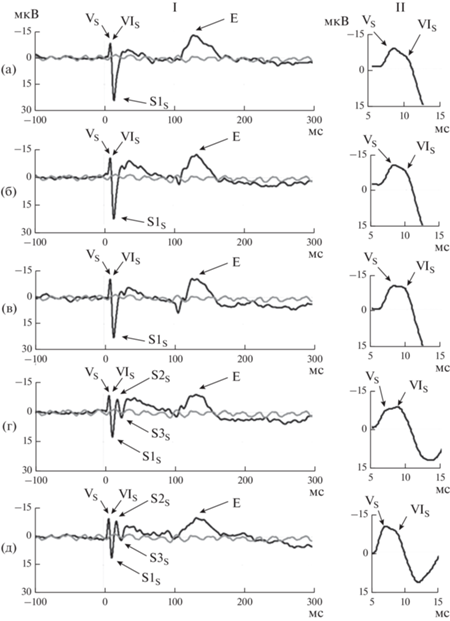
На полученных ВП выделяли три группы пиков: первая регистрировалась сразу за началом стимула, вторая – после его окончания, и третья – высокоамплитудный негативный пик Е (постзвуковой потенциал) (рис. 2). Выполнялось сравнение параметров этих групп пиков.
Рис. 2.
Глубинные ВП, зарегистрированные в ответ на простые тоны различных частот. I – глубинные ВП. II – увеличенные фрагменты глубинных ВП с пиками VS и VIS. (а) – 600 Гц, (б) – 800 Гц, (в) – 1000 Гц, (г) – 2000 Гц, (д) – 4000 Гц. Ответы ВП (черная кривая) приведены в сопоставлении с ответами псевдоВП (серая кривая). Представлены индивидуальные данные пациента 1. Fig. 2. Evoked potentials (EPs) recorded in response to pure tones of different frequencies. I – brainstem EPs. II – enlarged fragments of brainstem EPs with peaks VS and VIS. (а) – 600 Hz, (б) – 800 Hz, (в) – 1000 Hz, (г) – 2000 Hz, (д) – 4000 Hz. EP responses (black curve) are compared with pseudo-EP responses (grey curve). Patient data 1.
Амплитуда пиков в первой и второй группах вычислялась как разница между минимумом и максимумом соседних пиков, входящих в группу. Рассчитывался межпиковый интервал (МПИ) внутри группы.
Латентность первой группы пиков отсчитывали от начала стимула.
Латентности второй группы пиков, следующей за окончанием стимула, отсчитывались от его окончания. Однако выделение группы пиков, регистрирующихся после окончания стимула, было затруднительным. Для улучшения их выделения из шума проводилась цифровая фильтрация фильтром высоких частот (ФВЧ) 25 Гц.
Латентность пика Е отсчитывалась от окончания стимула. Амплитуда пика Е вычислялась относительно предшествующего пику Е максимума кривой.
Для определения положения источников пиков вычислялась разность ВП, записанных на D1 и D2 регистрирующих электродах.
Анализ биопотенциалов проводился в программе “Brainstorm”, в среде MATLAB (Natick, USA). Статистический анализ параметров пиков производился путeм сравнения групп значений методом Краскела-Уоллиса в программе STATISTICA 10 (Tulsa, USA). В статистический анализ включались МПИ и латентность пика Е. Для МПИ сравнение проводилось между VS-S1S, S1S-S2S, S2S-S3S, VE-S1E, S1E-S2E и S2E-S3E, каждая группа анализа включала в себя 5 значений, полученных от каждого пациента, у которого вслед за окончанием звучания тона выделялась группа пиков. Для латентности пика Е сравнение проводилось между ответами на тоны пяти частот, каждая группа анализа включала в себя 6 значений, полученных от каждого пациента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
На ВП на обоих регистрирующих электродах-контактах выделялись:
• Первая группа, следующая за началом стимула, включала пики VS, VIS, S1S, S2S, S3S (S – от английского “start” – “начало”);
• Вторая группа, следующая за окончанием стимула, включала пики VE, VIE, S1E, S2E, S3E (E – от английского “end” – “конец”);
• Третья группа включала высокоамплитудный негативный пик Е с широким основанием, появлявшийся в ответах на все тоны вслед за окончанием стимула.
В первой группе в ответ на стимулы частотой 600, 800 и 1000 Гц выделялись только пики VS, VIS и S1S (рис. 2 (а–в)). В ответ на стимулы частотой 2000 и 4000 Гц выделялись пики VS, VIS, S1S, S2S, S3S (рис. 2 (г–д)). Амплитуда пика S1S уменьшалась с увеличением частоты тона, а амплитуда пика S3S увеличивалась с увеличением частоты тона (рис. 2 (а–д)).
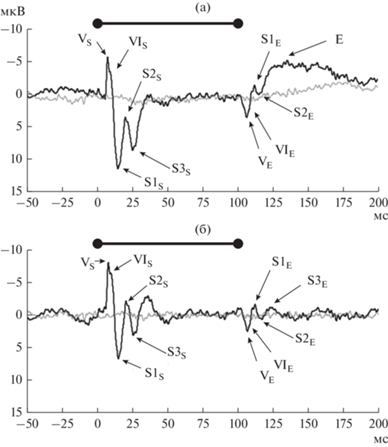
В ответ на стимулы частотой 2000 Гц у пяти из шести пациентов на восходящем фронте пика Е была видна группа высокочастотных колебаний (рис. 3 (а)). При применении полосного фильтра 25–500 Гц к тем же ответам выделилась группа пиков, появлявшаяся вслед за окончанием стимула – вторая группа пиков (рис. 3 (б)). Эта группа выделялась из окружающей его фоновой активности, однако имела меньшую амплитуду по сравнению с первой группой пиков (медиана отношений амплитуд одноимeнных пиков между двумя комплексами равна 0.26), а также по сравнению с пиком Е (медиана отношений амплитуды пика Е к амплитудам пиков второй группы равна 3). Кроме того, полярность пиков второй группы была противоположной полярности пиков первой группы.
Рис. 3.
Глубинные ВП, зарегистрированные в ответ на простой тон частотой 2000 Гц. Применялись фильтры: (а) – 2–500 Гц, (б) – 25–500 Гц. Ответы ВП (черная кривая) приведены в сопоставлении с ответами псевдоВП (серая кривая). Отрезок над графиками отмечает время подачи звукового стимула. Представлены индивидуальные данные пациента 3. Fig. 3. Evoked potentials (EPs) recorded in response to pure tones with a frequency of 2000 Hz. Filters applied: (а) – 2–500 Hz, (б) – 25–500 Hz. EP responses (black curve) are compared with pseudo-EP responses (grey curve). The black bar above the graphs marks the time of the sound stimulus. Patient data 3.
Медианная латентность пика S3E составляла 23.0 мс (Q1–Q3 22.6–23.3 мс). МПИ не отличались между VS-S1S, S1S-S2S, S2S-S3S, VE-S1E, S1E-S2E и S2E-S3E (p > 0.1 по методу Краскела–Уоллиса) (табл. 2). Медианная латентность пика Е составляла 28.9 мс (Q1–Q3 26.2—33.6 мс). Она не отличалась (p > 0.1 по методу Краскела–Уоллиса) между ВП в ответ на стимулы разной частоты (рис. 2).
Таблица 2.
Разница во времени между коротколатентными пиками Table 2. Time difference between short-latency peaks
| Разница между пиками | VS-S1S | S1S-S2S | S2S-S3S | VE-S1E | S1E-S2E | S2E-S3E |
|---|---|---|---|---|---|---|
| Нижний квартиль, мс | 4.9 | 5.5 | 6.5 | 5.6 | 4.4 | 5.8 |
| Медиана, мс | 5.6 | 5.8 | 6.9 | 5.6 | 4.9 | 6.9 |
| Верхний квартиль, мс | 7.1 | 6.4 | 7.2 | 5.8 | 5.2 | 7.2 |
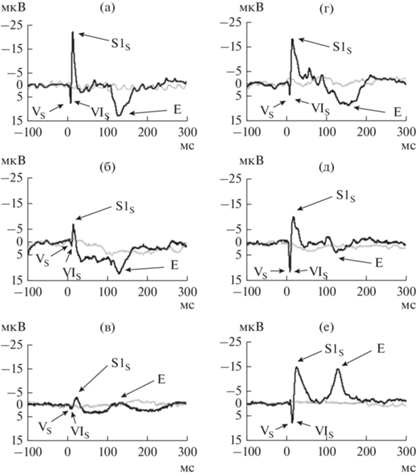
При вычислении разницы потенциалов между двумя регистрирующими электродами-контактами у всех пациентов выделялись те же пики, которые были на исходных ВП, но с обратной полярностью (рис. 4 (а–е)). Пик Е у четырeх пациентов имел обратную полярность относительно исходных ВП (рис. 4 (а, б, г, д)), а у двух – прямую (рис 4 (в, е)).
Рис. 4.
Разница между ВП, записанными с рострального регистрирующего контакта глубинного электрода и с каудального регистрирующего контакта глубинного электрода, в ответ на простой тон частотой 600 Гц. У пациентов: (а) – 1, (б) – 2, (в) – 3, (г) – 4, (д) – 5, (е) – 6. Ответы ВП (черная кривая) приведены в сопоставлении с ответами псевдоВП (серая кривая). Fig. 4. The difference between evoked potentials (EPs) recorded from rostral and caudal recording contacts of the depth electrode in response to pure tone with a frequency of 600 Hz. Patient data: (а) – 1, (б) – 2, (в) – 3, (г) – 4, (д) – 5, (е) – 6. EP responses (black curve) are compared with pseudo-EP responses (grey curve).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В основе настоящего исследования лежит анализ биопотенциалов среднего мозга, зарегистрированных в ответ на простые тоны различной частоты. Запись потенциалов осуществлялась у пациентов, находившихся в анестезии во время проведения хирургического вмешательства, в рамках ИОМ, который проводился с целью минимизации неврологического дефицита в послеоперационном периоде.
На полученных ВП выделялись три группы пиков: одна – следующая за началом, вторая – за окончанием звукового стимула и третья – негативный пик Е, следующий за окончанием стимула (рис. 3). В состав первой группы пиков в ответ на стимулы частотой 600, 800 и 1000 Гц, регистрировались пики VS, VIS, S1S; в ответ на стимулы частотой 2000 и 4000 Гц регистрировались пики VS, VIS, S1S, S2S, S3S. При этом амплитуда пика S1S уменьшалась с увеличением частоты тона, а амплитуда пика S3S увеличивалась с увеличением частоты тона.
Пики VS, VIS, S1S, S2S, S3S были впервые описаны в нашей предыдущей работе (Канцерова и др., 2022). Нами было показано, что пики VS и VIS комплекса, следующего за началом стимула, эквивалентны пикам V и VI акустических стволовых вызванных потенциалов (АСВП), регистрируемых в ответ на щелчок. Кроме того, нами было установлено, что пики S1S, S2S и S3S и пики VS и VIS с наибольшей вероятностью отражают проведение нервного импульса по слуховому пути.
Схожая форма пиков, возникающих в ответ на начало и конец стимула, а также отсутствие статистически достоверных различий в МПИ в обеих группах пиков говорят о схожести нейрофизиологических процессов, лежащих в основе генерации этих двух групп пиков (табл. 2). Противоположная полярность и меньшая амплитуда второй группы пиков по сравнению с первой, является основанием предположить, что они аналогичны стволовым off-потенциалам, регистрируемым со скальповых электродов (Brinkmann, Scherg, 1979). Пики VE, VIE, S1E, S2E, S3E были чeтко видны только в ответ на тон 2000 Гц, так как при этой частоте тона амплитуда пиков S1S и S1E была больше амплитуды пиков S3S и S3E соответственно. Наличие пика S3E в ответ на тон 2000 Гц, а также вышеописанное соотношение амплитуд сформировало специфический паттерн, который позволил выделить низкоамплитудные пики VE, VIE, S1E, S2E, S3E из шума при визуальном анализе ВП (рис. 3).
Обратная полярность пиков (рис. 4), полученных при вычислении разницы сигнала между двумя контакт-электродами (рис. 1) по сравнению с исходными ВП говорит о расположении источника генерации в непосредственной близости от D2, либо ниже него. Таким образом, источник находится на уровне нижних холмиков или каудальнее (рис. 1). Эти факты согласуются с данными исследований по определению источников генерации акустических стволовых on-потенциалов (Shaw, 1995).
Акустические стволовые on-потенциалы отражают проведение слуховой информации по волокнам ствола мозга в вышележащие структуры. Акустические стволовые off-потенциалы отражают последовательное снижение интенсивности разряда нейронов проводящих слуховых путей и, следовательно, также связаны с проведением нервного импульса по слуховым структурам ствола мозга (Brinkmann, Scherg, 1979). Ни те, ни другие потенциалы не дают информации о том, как структуры ствола мозга обрабатывают звуковой стимул.
Пик Е также появляется после окончания звукового стимула, однако его амплитуда в три раза больше амплитуды любого из пиков, которые входят во вторую группу. Латентность последнего из пиков второй группы (S3E) была меньше, чем латентность пика Е, что подтверждается нахождением второй группы пиков на восходящем фронте пика Е (рис. 3). Эти результаты говорят о том, что пик Е является самостоятельным электрофизиологическим феноменом, а не огибающей пиков акустических стволовых off-потенциалов.
В нашей предыдущей работе было показано, что латентности пика Е, отличаются между ответами на тоны различной длительности и сходны в ответах на тоны одинаковой длительности и разной частоты, а также была выдвинута гипотеза о связи генерации пика Е с окончанием звукового стимула (Канцерова и др., 2022). Отсутствие статистически достоверных отличий между всеми характеристиками пика Е в ответ на стимулы разных частот, но одинаковых длительностей подтверждает полученные в предыдущей работе данные и выдвинутую гипотезу (рис. 2).
Наличие пика Е как прямой, так и обратной полярности (рис. 4), полученных при вычислении разницы между D1 и D2 по сравнению с исходными ВП, говорит о том, что источник его генерации расположен либо на уровне D1, либо на уровне D2, либо между ними. Из всех структур среднего мозга с такой локализацией на роль источника генерации пика Е больше всего подходят нижние холмики, так как есть данные о наличии у этой слуховой структуры аналитической активности (Duque et al., 2016).
Опираясь на предполагаемую область генерации пика Е и на отличия пика Е от акустических стволовых потенциалов по морфологии и времени появления, можно выдвинуть гипотезу о том, что пик Е отражает аналитическую активность структур среднего мозга человека, связанную с обработкой звукового стимула.
Данное исследование имеет ряд ограничений. Подобную регистрацию активности структур среднего мозга нельзя провести у здоровых добровольцев, поэтому в работе нет сравнения группы пациентов с контрольной группой. Число зарегистрированных пациентов и количество предъявляемых стимулов диктуется клиническими ограничениями. Малый объeм выборки не позволяет однозначно оценить статистическую достоверность полученных эффектов. При увеличении объeма выборки полученные значения могут изменяться в ту или иную сторону. Определить точное положение регистрирующих контактов глубинного электрода по отношению к структурам среднего мозга не представляется возможным по причине индивидуальных анатомических различий в строении ствола мозга пациентов, а также в связи со спецификой хирургического доступа. Заземляющий электрод располагался в нетипичной позиции, которая являлась компромиссной для одновременной регистрации скальповой и глубинной электрической активности. Предъявляемые простые тоны имели восходящий и нисходящий фронты, вследствие чего не было возможности оценить, через сколько мс после начала подачи стимула пациент действительно начинал слышать тон.
ЗАКЛЮЧЕНИЕ
В работе представлены результаты анализа ВП, записанных в ответ на простые тоны с глубинных электродов-контактов, которые были расположены в среднем мозге. На ВП после окончания звучания стимула были выявлены пики VE, VIE, S1E, S2E, S3E, которые с связаны с проведением нервного импульса по слуховому пути, и пик Е, который с наибольшей вероятностью отражает анализ звуковой информации структурами среднего мозга.
Список литературы
Всемирная организация здравоохранения (ВОЗ). Всемирный доклад по проблемам слуха: резюме [World report on hearing: executive summary]. 2021.
Канцерова А.О., Окнина Л.Б., Пицхелаури Д.И., Подлепич В.В., Машеров Е.Л., Вологдина Я.О. Вызванные потенциалы среднего мозга, ассоциированные с началом и окончанием звучания простого тона. Физиология человека. 2022. 48(3): 5–13.
Akimov A.G., Egorova M.A., Ehret G. Spectral summation and facilitation in on- and off-responses for optimized representation of communication calls in mouse inferior colliculus. European Journal of Neuroscience 2017. 45: 440–459.
Alluri R.K., Rose G.J., Hanson J.L., Leary C.J., Vasquez-Opazo G.A., Graham J.A., Wilkerson J., Knudsen E.I. Phasic, suprathreshold excitation and sustained inhibition underlie neuronal selectivity for short-duration sounds. Proceedings of the National Academy of Sciences 2016. 113: E1927–E1935.
Anderson L.A., Linden J.F. Mind the Gap: Two Dissociable Mechanisms of Temporal Processing in the Auditory System. J Neurosci. 2016. 36(6): 1977–1995.
Baba H., Tsukano H., Hishida R., Takahashi K., Horii A., Takahashi S., Shibuki K. Auditory cortical field coding long-lasting tonal offsets in mice. Scientific Reports 2016. 6: 1–11.
Behr R., Colletti V., Matthies C., Morita A., Nakatomi H., Dominique L., Darrouzet V., Brill S., Shehata-Dieler W., Lorens A., Skarzynski H. New outcomes with auditory brainstem implants in NF2 patients. Otology & neurotology : official publication of the American Otological Society, American Neurotology Society [and] European Academy of Otology and Neurotology 2014. 35: 1844–1851.
Brinkmann R.D., Scherg M. Human auditory on- and off-potentials of the brainstem: Influence of Stimulus Envelope Characteristics. Scandinavian Audiology 1979. 8: 27–32.
Casseday J., Ehrlich D., Covey E. Neural tuning for sound duration: role of inhibitory mechanisms in the inferior colliculus. Science. 1994. 264(5160): 847–850.
Dhanasingh A., Hochmair I. ABI-auditory brainstem implant. Acta Otolaryngol. 2021. 141(sup1): 63–81.
Duque D., Wang X., Nieto-Diego J., Krumbholz K., Malmierca M.S. Neurons in the inferior colliculus of the rat show stimulus-specific adaptation for frequency, but not for intensity. Scientific Reports 2016. 6: 24114.
Kopp-Scheinpflug C., Sinclair J.L., Linden J.F. When Sound Stops: Offset Responses in the Auditory System. Trends in Neurosciences 2018. 41: 712–728.
Liu J., Whiteway M.R., Sheikhattar A., Butts D.A., Babadi B., Kanold P.O. Parallel Processing of Sound Dynamics across Mouse Auditory Cortex via Spatially Patterned Thalamic Inputs and Distinct Areal Intracortical Circuits. Cell Reports 2019. 27: 872–885.e7.
Michels T.C., Duffy M.T., Rogers D.J. Hearing Loss in Adults: Differential Diagnosis and Treatment. American family physician 2019. 100: 98–108.
Naples J.G., Ruckenstein M.J. Cochlear Implant. Otolaryngologic clinics of North America 2020. 53: 87–102.
Parsons C.E., Young K.S., Joensson M., Brattico E., Hyam J.A., Stein A., Green A.L., Aziz T., Kringelbach M. Ready for action: A role for the human midbrain in responding to infant vocalizations. Soc. Cogn. Affect. Neurosci. 2014. 9: 977–984.
Potter H. Patterns of acoustically evoked discharges of neurons in the mesencephalon of the bullfrog. J. Neurophysiol. 1965. 28(6): 1155–1184.
Sahinovic M.M., Struys M.M.R.F., Absalom A.R. Clinical Pharmacokinetics and Pharmacodynamics of Propofol. Clinical pharmacokinetics 2018. 57: 1539–1558.
Sala F., Lanteri P., Bricolo A. Motor evoked potential monitoring for spinal cord and brain stem surgery. Advances and technical standards in neurosurgery 2004. 29: 133–169.
Shaw N.A. The temporal relationship between the brainstem and primary cortical auditory evoked potentials. Progress in Neurobiology 1995. 47: 95–103.
Sołyga M., Barkat T.R. Distinct processing of tone offset in two primary auditory cortices. Scientific Reports. 2019. 9: 1–12.
Swann N.C., De Hemptinne C., Miocinovic S., Qasim S., Ostrem J.L., Galifianakis N.B., Luciano M.S., Wang S., Ziman N., Taylor R., Starr P. Chronic multisite brain recordings from a totally implantable bidirectional neural interface: experience in 5 patients with Parkinson’s disease. Journal of neurosurgery 2018. 128: 605–616.
Valentinuzzi M.E. Hearing Aid History: From Ear Trumpets to Digital Technology. IEEE pulse 2020. 11: 33–36.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


