Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 4, стр. 437-456
Стресс и индивидуальное развитие
Ю. И. Александров 1, 2, *, **, А. И. Булава 1, А. В. Бахчина 1, 3, В. В. Гаврилов 1, 2, М. Г. Колбенева 1, Е. А. Кузина 1, И. И. Знаменская 1, И. И. Русак 2, А. Г. Горкин 1
1 Лаборатория психофизиологии имени В.Б. Швыркова, Институт психологии РАН
Москва, Россия
2 Лаборатория нейрокогнитивных исследований индивидуального опыта института экспериментальной психологии, Московский государственный психолого-педагогический университет
Москва, Россия
3 Кафедра психофизиологии, Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: yuraalexandrov@yandex.ru
** E-mail: aleksandrovji@ipran.ru
Поступила в редакцию 16.09.2021
После доработки 30.11.2021
Принята к публикации 30.11.2021
- EDN: LVFRGS
- DOI: 10.31857/S0044467722040037
Аннотация
В обзоре стрессовое состояние рассмотрено в связи с индивидуальным развитием, в частности, как характеристика начальных этапов формирования новых адаптаций в процессе онтогенеза человека и животных в норме и при “патологии”. Приведены аргументы в пользу рассмотрения стресса как процесса обратимой дедифференциации – понижения сложности актуализированного индивидуального опыта. Это означает временную регрессию, обусловливающую уменьшение вклада систем относительно высоко дифференцированного, сложного поведения в обеспечение текущей активности индивида, что при определенных условиях обеспечивает повышение эффективности формирования поведения. Феноменологически стрессовая регрессия описывается как “возврат” к сформированным на предыдущих стадиях развития формам взаимодействия со средой. Рассматриваются данные собственных экспериментов и литературы, полученные при анализе указанных процессов у человека и животных на поведенческом уровне, при регистрации динамики висцеральной, а также нейронной активности (импульсной и молекулярно-генетической). В результате формулируются эмпирически обоснованные выводы о механизмах и значении дедифференциации (и других системных процессов, связанных с ней) при остром стрессе, а также о том, как меняется системная динамика стресса при его хроническом течении, в том числе в условиях болезни.
В данном обзоре стрессовое состояние будет рассмотрено в связи с индивидуальным развитием, в частности, как характеристика начальных этапов формирования новых адаптаций в процессе развития. Мы рассматриваем индивидуальное развитие как формирование структуры индивидуального опыта. Структура индивидуального опыта описывается как набор элементов функциональных систем (ФС) и отношений между ними. ФС – это комплекс избирательно вовлеченных, распределенных компонентов (клеток мозга и тела), у которых взаимодействие и взаимоотношение приобретает характер взаимоСОдействия, направленного на получение общего полезного приспособительного результата (Анохин, 1975). Развитие тогда можно представить как последовательность системогенезов на всем протяжении онтогенеза. Акт системогенеза – это процесс, при котором образуется новая ФС, встраиваемая в имеющуюся структуру индивидуального опыта. Ее реализация позволяет достичь полезный приспособительный результат в соотношении целостного организма и среды, устранив этим предшествующее научению рассогласование между потребностью и возможностью ее удовлетворить с использованием уже имеющегося опыта. От ранних к поздним этапам онтогенеза образующиеся системы могут обеспечить все более и более сложное, дифференцированное взаимодействие со средой. Данные, полученные при регистрации нейронной и суммарной активности мозга, при анализе поведения у человека и животных других видов, вместе с подробным теоретическим обоснованием указанных представлений были многократно опубликованы (см. в (Александров, 2020; Alexandrov et al., 2018; Кузина, Александров, 2019). С этим представлением согласовывалось предположение о том, что при повышении дифференцированности соотношения организма со средой повышается число деталей среды, которые может использовать индивид для адаптации. Ранее данное теоретически обоснованное гипотетическое положение имело косвенное эмпирическое подтверждение (см., например, (Kolbeneva, Alexandrov, 2016; Alexandrov, Alexandrov, 1993)). В последнее время получены прямые экспериментальные аргументы в пользу этой гипотезы (Александров и др., 2020).
Любое поведение – это одновременная актуализация множества ФС, сформированных на разных этапах индивидуального развития. То есть систем, реализующих поведение более высокой и более низкой дифференцированности. Это – общее правило для системного обеспечения разных поведений и ситуаций. Но соотношение вклада систем более и менее дифференцированного поведения в реализацию текущего поведения может меняться. Так, при усилении эмоций увеличивается вклад систем менее дифференцированного поведения (см. в (Alexandrov et al., 2020a, 2020b; Bakhchina et al., 2018; Kolbeneva, Alexandrov, 2016; Alexandrov, Sams, 2005; Александров и др., 2017a, 2017b)). Данный феномен имеет место и при стрессе.
Стресс мы рассматриваем вслед за Селье как “многоплановую активность организма, направленную на приспособление его к новым условиям, что может быть названо общим адаптационным синдромом” ((Selye, 1936, p. 32); курсив наш). Процесс адаптации развивается, как мы полагаем, особенно выраженно в ситуации рассогласования между потребностью и имеющимся опытом ее удовлетворения, которая возникает в новых для индивида условиях. При этом новые условия могут возникать по внешним или внутренним причинам: за счет модификации внешней или внутренней среды. Такой процесс характеризуется как связанный со стрессом и с увеличением эмоциональности. Поскольку поведение, даже повторяясь, не просто повторяется, а генерируется вновь, проходя стадию организации и при реализации дефинитивного поведения (“повторение без повторения” Н.А. Бернштейн, П.К. Анохин и другие), то можно согласиться с Селье и в том, что стресс характеризует в той или иной мере любое поведение (1979).
В то же время имеется позиция, в которой отмечается, что при подобном рассмотрении теряется специфика стрессового состояния и что стрессовая адаптация имеет место не всегда (Парин, 2021). Можно полагать, что в случае приписывания стресса всем поведенческим ситуациям, в том числе ситуациям реализации дефинитивного поведения, затрудняется выявление специфики состояний, называемых стрессовыми. Поэтому мы будем рассматривать здесь стресс разной интенсивности как состояние, возникающее преимущественно при реализации поведения в ситуации новизны – в ситуации отсутствия соответствующего опыта поведения, но имеющейся при этом необходимости приспособления и/или предотвращения урона для индивида.
Что касается адаптивности стресса, мы полагаем, что организация процессов организма всегда направлена на достижение полезного приспособительного результата (в том числе избегательного). В ситуации стрессовой новизны реализация поведения подобного достижения опосредуется системогенезом: формированием системы необходимого поведения. При этом необязательно выбранный путь достижения может оказаться полезным для данного индивида. Целенаправленное – необязательно целесообразное. В этом аспекте имеется сходство между рассматриваемыми процессами и так называемыми “патологическими”. Последние, как подчеркивали П.К. Анохин (1948), И.В. Давыдовский (1956, 1962), Goldstein К. (1939) и другие, являются не сломом, дезорганизацией нормы, а выработанными в эволюции стратегиями формирования приспособительных поведений; стратегиями, полезными для вида, но необязательно для каждого индивида в каждом отдельном случае.
На основании имеющихся работ в литературе о стрессе, а также собственных данных, демонстрирующих динамику системной организации поведения при повышении уровня (выраженности) эмоций, мы обосновываем гипотезу о том, что стресс является временной, обратимой дедифференциацией. Это – понижение роли систем относительно высоко дифференцированного поведения в обеспечении текущей активности индивида. Такую дедифференциацию можно феноменологически описать как обратимую, врéменную регрессию: “возврат” к сформированным на предыдущих стадиях развития формам взаимодействия со средой. Обеспечивая переход к формированию и реализации более простых форм поведения, временная дедифференциация ускоряет, при оптимальной ее выраженности, адаптацию (см. рисунок). Вероятно, это значение дедифференциации оказалось фактором не только закрепления ее в эволюции как компонента стрессовой адаптации, но и вообще ее возникновения в ситуациях, предполагающих формирование новых и модификацию имеющихся адаптаций в условиях изменения внешней и/или внутренней среды (см. (Alexandrov et al., 2020a, 2020b, Александров и др., 2017b)).
В настоящем обзоре литературы, включающем анализ наших данных и данных других авторов, мы рассматриваем работы, позволяющие а) соотнести эмпирический материал с перечисленными гипотезами; б) сформулировать и обосновать выводы о механизмах и значении дедифференциации (и других системных процессов, связанных с ней) при остром стрессе; в) сформулировать представления о том, как меняется системная динамика стресса при его хроническом течении.
ОСТРЫЙ СТРЕСС
Стресс и отношение к “чужим”: регрессия при решении моральных дилемм у взрослых
В последние годы появляется все больше данных о неоднозначной связи острого стресса с социальным поведением: с одной стороны, при стрессе ожидаемо большую роль начинают играть предубеждения, снижается вариативность в принятии решений (Starcke, Brand, 2012; Wemm, Wulfert, 2017; von Dawans et al., 2018), с другой стороны, может усиливаться просоциальное поведение (von Dawans et al., 2021), распространяющееся, однако, в основном на “своих” (Margittai et al., 2015).
В серии экспериментов мы проверяли гипотезу о том, что состояние стресса у людей характеризуется обратимой системной дедифференциацией (увеличением вклада относительно рано сформированных систем в обеспечение поведения; см. выше), что феноменологически проявляется в предпочтении поведения, сходного со стратегиями решения конфликтов между “своими” и “чужими”, которые свойственны для более раннего возраста: первоочередная поддержка “своего”, даже если он неправ.
Ранее мы показали, что дети до 6 лет склонны поддерживать “своих”, к 9 годам появляются аргументы, почему важно поддерживать “чужих”, к 10–11 годам формируется тенденция поддерживать “жертв” конфликта вне зависимости от того, к какой группе (своей или чужой) они принадлежат (Знаменская и др., 2016).
В исследовании отношения к “чужим” при остром стрессе приняли участие взрослые в возрасте от 22 до 54 лет. В экспериментальной группе стресс индуцировали специальной процедурой (компьютерная игра с демотивирующей обратной связью (см. в (Александров и др., 2017a))), в контрольной группе стресс не индуцировали (игра с адекватной обратной связью), однако и в ней по показателям вариабельности сердечного ритма (ВСР) слепым методом была выявлена подгруппа, названная “ситуационный стресс”. Респондентам предъявлялись моральные дилеммы, описывающие конфликт человека с “чужими” (животными и инопланетянами) по поводу ресурса, который чужим жизненно необходим, а для “своих” лишь повышает качество жизни. Дилемма заключается в противоречии двух принципов: “поддержка своего” либо “поддержка жертвы”. Респонденты выбирали, какую сторону конфликта поддержать, а также оценивали поступок агрессора по пятибалльной шкале от “очень плохой” до “очень хороший” (см. полный текст дилемм и подробное описание процедуры в (Александров и др., 2017b, с. 57–80)).
При сравнении ответов на все дилеммы было получено, что люди в стрессе достоверно чаще поддерживают “своего” в конфликте против “чужих”. Группа “ситуационного стресса” почти по всем дилеммам занимала промежуточное положение. Особенно это проявилось в ответах на гипотетическую дилемму, где человек отбирал ресурс у инопланетян, не убивая их напрямую (в терминологии известной “дилеммы вагонетки” бесконтактный нецеленаправленный вред, то есть морально допустимый). Аналогичный протокол исследования повторили и с другими моделями стресса (экзаменационный стресс и пр.). Достоверных различий между группами людей в стрессе разного генеза обнаружено не было. Это согласуется с представлениями о том, что стрессовое состояние имеет неспецифический характер (Selye, 1936, 1979) и характеризуется снижением дифференцированности актуализированного опыта и, таким образом, увеличением вклада менее дифференцированных систем в поведение.
У людей в стрессе моральные оценки поступка агрессора были более вариативными (от “очень плохо” до “очень хорошо”), чем у людей без стресса (преимущественно “очень плохо” и “плохо”). В группе “ситуационного стресса” наиболее частой оценкой также была оценка “очень плохо”, однако 20% людей выбрали “ни хорошо, ни плохо” и еще 15% – “хорошо” и “очень хорошо”. Возможно, это связано с условиями задачи: люди в состоянии стресса чаще поддерживали агрессора и оценивали его поступок по-разному: могли признавать, что поступок “плохой”, но могли и оправдывать его. Большинство людей без стресса были за “жертву” и оценивали поступок агрессора как однозначно плохой. Состояние стресса, сопровождающееся временной системной дедифференциацией, возможно, снижает чувствительность к нарушению социальных норм, то есть поступок агрессора не воспринимается однозначно. Это согласуется с данными эксперимента, в котором дедифференциацию формировали приемом алкоголя, блокирующим в большей степени активность мозгового обеспечения наиболее дифференцированных систем: дедифференциация затрагивает в первую очередь конвенциональные нормы (см. (Арутюнова, Александров, 2019)).
При сопоставлении результатов по дилемме “Инопланетяне 1” с данными, полученными ранее с участием детей 3–11 лет (Знаменская, Александров, 2019), был обнаружен достоверный тренд: с возрастом снижается поддержка “своего” агрессора, взрослые люди вне действия стресс-факторов достоверно чаще поддерживают “жертв”, хотя они и принадлежат аутгруппе. В то же время взрослые в состоянии стресса достоверно чаще поддерживают “агрессора”, чем дети 10–11 лет, их ответы статистически не отличаются от ответов детей младшего возраста (3–9 лет). Проведенное исследование показало, что в состоянии стресса люди регрессируют к более ранним, “детским” формам поведения, что выражается в предпочтении ими стратегии поддержки “своего”, даже если он поступает несправедливо.
Здесь важно подчеркнуть, что, поскольку развитие необратимо, совпадение с “детскими” формами поведения у взрослых лишь феноменологическое. В данных это отражается в следующем: если сравнить оценки поступка агрессора, поддерживаемого большинством взрослых в состоянии стресса, и детей 5–6 лет, то оказывается, что соотношение крайних и средних оценок достоверно различается в двух этих группах. Взрослые используют разные градации оценок поступка агрессора (т.е. не однозначно хороший или плохой, а, например, “нейтральный”), а большинство детей предпочитает крайние оценки (либо “очень плохо”, либо “очень хорошо”).
В процессе системогенеза ранее сформированные системы реконсолидируются, то есть опыт как целостная структура содержит в каждом элементе в той или иной степени “следы” других элементов, отражающие сформированные при научении межсистемные связи. Следовательно, даже при гипотетической полной дедифференцирующей блокаде полностью “вычесть” новый опыт и вернуться к состоянию, бывшему до его формирования, на предыдущих этапах развития, нельзя.
В исследовании отношения к “чужим” при хроническом стрессе приняли участие взрослые в возрасте от 26 до 54 лет с диагнозами с кодами F40–F48 по МКБ-10: невротические, связанные со стрессом и соматоформные расстройства (Знаменская, Акбирова, 2019). Эта группа психогенных обратимых расстройств характеризуется нарушением адаптации к среде, тревогой, общим эмоциональным неблагополучием, что является признаками стрессового состояния (Коркина и др., 2006). Важным для исследования является отсутствие у этих людей психотических симптомов, слабоумия, выраженного расстройства личности, а также сохранение критичности к собственному состоянию. Это позволяет применять выбранные методики для исследования их отношения к “чужим”. Методика была идентична описанной выше, не использовалась только компьютерная игра для индуцирования стресса, беседа проводилась в форме индивидуального интервью в стационаре психотерапевтического отделения ЦГКБ № 18 г. Казань. Соотношение ответов в группе людей с невротическими расстройствами было ближе к соотношению в контрольной группе (без стресса), чем в группе с острым стрессом (около 80% людей поддерживали жертву в разных дилеммах, а не “своего”). Это может быть объяснено тем, что у них происходит дополнительная адаптация к ситуации болезни, которая позволяет согласовывать собственные моральные суждения и оценки с принятыми в обществе. Это не всегда происходит в ситуации острого, кратковременного стресса, в том числе специально индуцированного. Ниже мы вернемся к обсуждению проблемы адаптации в подобных ситуациях при анализе ситуации хронического заболевания.
Поведенческие эффекты стресса при обучении сложному навыку
В экспериментальных моделях острого стресса на животных поведение также некоторыми авторами (Smith et al., 2016; Wolf, 2017) описывается как временный переход к более “стандартным”, ранее выученным формам. Стрессовая адаптация при обучении рассматривается нами в плане ее конечного результата, т.е. такой модификации системной структуры опыта при формировании ее нового элемента, которая на определенном этапе включала механизмы регрессии (Александров и др., 2017b), связанной со стрессом (Меерсон, Пшенникова, 1988; Селье, 1960). Однако эффекты стресса можно выявить и в процессе чередования разных форм поведения при обучении. В таком случае “глубина” или объем смены наборов систем реализации поведения разной степени дифференцированности может служить показателем “когнитивной” сложности задачи для индивида (Александров и др., 2017b). В отличие от эффектов “хронического” стресса, где подчеркиваются обычно его негативные последствия для обучения и памяти, результаты исследования роли острого стресса более вариативны (Wolf, 2017). Хотя модели “стрессорных” ситуаций у животных (в основном крыс) и людей достаточно различаются (у человека чаще используются “социальные” стрессоры (Gagnon, Wagner, 2016; Wolf, Kluge, 2017; Wolf, 2017; Wolf et al., 2002); см., однако, ниже раздел о влиянии изоляции и скученности на животных), в исследованиях научения как у человека, так и животных был обнаружен также позитивный эффект “стрессового” события не только на формирование новой памяти (Gagnon, Wagner, 2016; Sandi et al., 1997), но и на воспроизведение ранее выученного поведения (Diamond et al., 2007; Smith et al., 2016). При остром стрессе поведение описывается как временный переход к более ранней модели поведения (Smith et al., 2016; Wolf, 2017). Так, после процедуры “угашения”, или нового обучения, стресс приводил к восстановлению ранее выученного поведения (Raio et al., 2014; Kinner et al., 2016), а нахождение в узком цилиндре в течение часа коррелировало с повышением экспрессии нейротрофического фактора роста и лучшим распознаваниям новых объектов (Brivio et al., 2009). С другой стороны, было показано, что эффект ускорения обучения некоторым задачам после кратковременного стресса может оказываться обратимым на более длительных промежутках времени (Hurtubise, Howland, 2016). Надо отметить также, что вышеописанные эффекты острого стресса изучаются, когда последний является “внешним” фактором, который вводится до или после тестирования и не связан с контекстом поведения (Cazakoff et al., 2010). В отличие от этого “внутренний стресс”, присущий самой задаче или ситуации обучения, рассматривается в качестве одного из условий успешной консолидации памяти (Joels et al., 2006; Sandi et al., 1997; Sandi, Pinelo-Nava, 2007) через регуляцию гормонов (глюкокортикоидов, адреналина), которые играют ключевую роль в модуляции частоты нейронов, специфически активных при обучении (Joels et al., 2006; Sandi et al., 1997).
Для оценки состояния животных при решении сложных когнитивных задач, обучение которым может происходить в течение нескольких недель и месяцев, процедуры регистрации физиологических показателей могут являться большим стрессором, чем события, сопровождающие само обучение, особенно если речь идет о формировании пищедобывательных форм поведения. Поэтому обычно используются поведенческие маркеры стресса и тревожности, значение которых необходимо интерпретировать в зависимости от контекста задачи (Snyder et al., 2021). Двумя основными показателями страха и тревожности у грызунов, помимо замирания в особо опасных ситуациях, являются стойки и прыжки (Lever et al., 2006; King, 1999). Стойки появляются в ситуации неопределенности, связанной с новизной или рассогласованием (Lever et al., 2006). Стойки минимальны, с одной стороны, при высоком уровне страха у животных, а с другой – при очень низкой тревожности. Максимальное количество стоек встречается при относительно высоком уровне тревожности (Gray, McNaughton, 2000). Прыжки также возникают в ситуации избегания, аналогичной поведению животных в хроническом гипервозбужденном состоянии (“борись или беги”), и, таким образом, служат показателем “экстремальной тревожности” (King, 1999). На разных этапах обучения самцов капюшонных крыс сложному инструментальному навыку, включающему в себя формирование “правила” смены нескольких последовательностей актов для получения пищи из кормушки (Кузина, Ткаченко, 2021), занимающего от полутора до трех месяцев, нами было обнаружено достоверное увеличение эпизодов избегания (ЭИ; прыжков, стоек, замираний), резко прерывающих реализацию циклического поведения животных. В дефинитивном поведении крысы в течение 15–20 циклов нажимали на две педали из трех в заданной последовательности, после чего эффективная последовательность (ЭП) педалей менялась экспериментатором без внешнего сигнала (ситуация смены). Предыдущая ЭП теряла результативность. Разные животные могли успешно обучиться сменам от 2 до 5 различных ЭП из шести возможных, причем у крыс, усвоивших более 3 разных ЭП, наблюдалось наибольшее число ЭИ. Двумя наиболее частыми условиями, предшествующими ЭИ, был длительный период проб и ошибок во время поиска правильной ЭП или же, наоборот, период безошибочного выполнения данной ЭП. Появление конкретных видов ЭИ не было приурочено к определенному контексту реализации циклического поведения, т.е. наблюдаемые ЭИ не были частью самостоятельно приобретенных паттернов поведенческих актов, не входящих в ЭП, а служили показателем врéменной регрессии к более ранним формам поведения. В тех случаях, когда ЭИ предшествовало длительное (более 7 циклов) выполнение ошибочных циклов, то сразу же за ЭИ, как правило, животные находили верную последовательность. Можно предположить, что смены пищедобывательного поведения на избегание, демонстрируемые животными в ситуации выполнения достаточно сложного для них многокомпонентного навыка, могут быть проявлением временной регрессии, предшествующей пробной активации у модифицированного состава систем нейронов, участвующих в обеспечении этого поведения (Александров, 2005; Александров и др., 2017b). С другой стороны, обнаруженные у крыс при обучении новому и достаточно сложному для них навыку/поведению переходы от успешной его реализации к ЭИ могут быть характерны и для других форм дефинитивного поведения. Так, внешне наблюдаемой смене противоположных форм поведения может предшествовать постепенное изменение уровня актуализации систем нейронов, специализированных относительно новых поведенческих актов, поскольку внешне одно и то же поведение может осуществляться на разном уровне дробности соотношения со средой (Швырков, 1995). Например, успешная реализация сходного инструментального пищедобывательного поведения, в зависимости от возраста или истории обучения животных, может сопровождаться значимо различающимися составами нейронов ретросплениальной коры, специализированных относительно выученного поведения (Горкин и др, 2017; Кузина, Александров, 2019). Было обнаружено также, что на фоне слабого стрессора (белый шум 95 db) у крыс сначала наблюдалось уменьшение частоты разрядов пирамидных нейронов дорсальной префронтальной коры, специфически активных на разных этапах выполнения задачи в Т-образном лабиринте, а затем и падение успешности поведения (Devilbiss et al., 2017). Одновременно с этим увеличивалась активность в большой популяции нейронов, которые не были специфически связаны с этапами реализации выученного поведения. Можно предположить, что постепенное уменьшение активности клеток, специализированных относительно нового поведения, вместе с увеличением доли нейронов, связанных с другими формами поведения, происходит и в других структурах мозга и предшествует снижению эффективности поведения в “слабо” стрессовой ситуации, которая не оценивается индивидом как угрожающая жизни.
Изменения нейронной активности при стрессе, вызванном потерей результативности поведения
Отсутствие результата при реализации прежде успешного поведения приводит к возникновению рассогласования (см. выше). Если это происходит в результате ошибочности действий индивида, то обычно для разрешения этого рассогласования бывает достаточно повторить попытку и получить требуемый результат. В том же случае, когда потеря результативности происходит в результате изменения среды, повторные попытки реализации этого поведения к результату не приводят и возникает основа для развития острого стресса. В последнем случае можно выделить две различные ситуации возможной адаптации индивида к измененной среде. Одна возможность предполагает научение новому поведению в данной среде, которое позволит достигать аналогичный результат. Другая связана с невозможностью получать такой результат и предполагает изменение формы поведения. В серии экспериментов были смоделированы эти две возможности разрешения стрессовой ситуации, возникающей при потере результативности прежде успешного поведения. В этих экспериментах на основе модели циклического инструментального пищедобывательного поведения (ЦИПП) мы ставили животных в ситуацию рассогласования в двух вариантах: “потеря результативности” ранее успешного поведения и физическая “невозможность реализации” ранее успешного поведения. Крысы были предварительно обучены дефинитивному ЦИПП (получение пищевой таблетки в кормушке после нажатия на педаль) на одной из двух сторон экспериментальной клетки. Ситуацию “потери результативности поведения” формировали выключением работы педали, а “невозможность реализации” – путем изъятия педали из экспериментальной клетки. Оказавшись в ситуации “потери результативности”, животные должны были самостоятельно переучиться реализации ЦИПП на другой стороне клетки. В ситуации же с изъятием педали животное лишалось возможности получать пищу в клетке как минимум до конца экспериментальной сессии. Во время экспериментальной сессии проводилась регистрация нейронной активности хронически вживленными микроэлектродами, а также регистрация поведенческих отметок и видеозапись поведения животного для последующего сопоставления импульсации нейронов ретросплениальной коры крысы с поведением.
В результате было показано, что в ситуациях “невозможности реализации” и “потери результативности” поведения наблюдается значительное увеличение количества и длительности реализаций актов непищедобывательного поведения – груминга и актов ориентировочного поведения (вертикальных стоек; см. выше об ЭИ) (Чистова и др., 2018). Хотя увеличение суммарной длительности актов ориентировочно-исследовательского поведения было обнаружено в обеих моделируемых ситуациях, достоверные различия в средней длительности реализации стоек наблюдались только в ситуации “потери результативности”. Такие изменения долей различных форм поведения в совокупности можно интерпретировать как количественный показатель рассогласования и развития стрессового процесса.
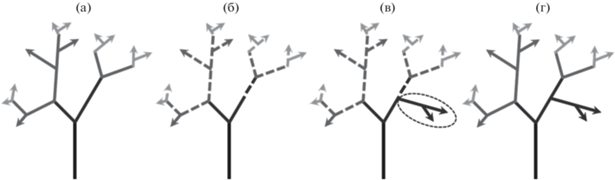
Рис. 1.
Схема, демонстрирующая процесс дедифференциации в структуре индивидуального опыта при стрессе. Стрелки обозначают элементы опыта. Цвет отражает шкалу дифференциации: от черного (низкая дифференциация опыта) до светло-серого (высокая дифференциация). При стрессе происходит временная дедифференциация (регрессия) (переход от (а) к (б)), что способствует формированию нового пути развития (переход к (в), затем к (г) – появляется новая ветвь (в овале), которая представляет новое адаптивное поведение). Пунктирными линиями обозначены деактивированные системы.
Fig. 1. Scheme showing de-differentiation of individual experience. Arrows represent elements of experience. The grey colour reflects the scale of differentiation: from black (low differentiation of experience) to light gray (high differentiation). During stress temporal dedifferentiation (regression) happens (transition from (а) scheme to (б), which facilitates a new way of development (transition to (в) then to (г) – a new branch appears, which represents new adaptive behaviour). Dashed lines represent deactivated systems.
Также были описаны изменения в пищедобывательном поведении животных в ситуации невозможности реализации ранее успешного поведения (Чистова и др., 2018). Обнаружено общее снижение частоты и длительности реализаций актов пищедобывательного и связанного с ним поведения. Кроме того, изменялось и соотношение количества реализуемых актов пищедобывательного и других форм поведения. Животные, поставленные в ситуацию “невозможности реализации”, демонстрировали фрагментацию ЦИПП, например, после пробных актов в углу педали крайне редко подходили к кормушке. Были выделены наиболее часто встречающиеся специфические акты, связанные с модифицированным неэффективным ЦИПП: “обнюхивание отверстия от изъятой педали”, “обнюхивание угла в месте изъятой педали” (Чистова и др., 2018).
Анализ нейронной активности показал, что при “невозможности реализации” поведения большая часть зарегистрированных нейронов (58%) достоверно изменяла частоту импульсной активности при реализации отдельных актов модифицированного ЦИПП по сравнению с актами результативного ЦИПП (Сафразьян и др., 2019). При этом наибольшее число нейронов изменило частоту активности в актах в углу изъятой педали по сравнению с актом результативного нажатия на педаль в дефинитивном поведении. Причем для конкретного нейрона все изменения были однонаправленными, то есть частота активности в разных актах модифицированного ЦИПП или снижалась по сравнению с актами результативного поведения, или увеличивалась.
Относительно изменений нейронной спайковой активности в ситуации “потери результативности” ранее успешного поведения получены сходные результаты (Михайлова и др., 2020; Горкин и др., 2021). Показано, что в данной ситуации 95% нейронов достоверно изменяют частоту активности в отдельных актах ЦИПП по сравнению с дефинитивным поведением. Как и в ситуации “невозможности реализации” поведения у большей части (82%) нейронов изменения однонаправленные. Количество нейронов, изменяющих частоту активности при сравнении частот в актах ЦИПП в первой ситуации “потери результативности” и повторениях этой ситуации (после обучения индивида результативному поведению на другой стороне экспериментальной клетки) достоверно снижается (Михайлова и др., 2021). Отметим, что наибольшие изменения происходят при первичной постановке в ситуацию “потери результативности”, но по мере приобретения опыта успешного разрешения этой ситуации в результате научения в случае повторения данной ситуации она, видимо, перестает вводить индивида в состояние стресса. Временная потеря результативности поведения становится для индивида характеристикой среды, и при повторном наступлении такой ситуации снижается количество изменений, происходящих в нейронной активности. Полученные данные свидетельствуют о том, что при “невозможности реализации” и при “потере результативности” ранее успешного поведения в структуре индивидуального опыта, которая отражается в динамике нейронной активности, происходят изменения, в первую очередь связанные с рассогласованием. Эти изменения соответствуют развитию стресса и являются этапом на пути адаптации к изменившейся среде, завершающимся формированием нового поведения или переходом к хроническому стрессу (см. ниже).
Снижение сложности динамики сердечного ритма при стрессе
Описанные выше поведенческие феномены и изменения нейронной активности характеризуют острый стресс и могут быть рассмотрены как аспекты в описании врéменной системной дедифференциации. Системная дедифференциация также часто описывается как высоко эмоциональное поведение, сниженное внимание к деталям, предпочтение более знакомых и привычных стратегий поведения, принятие решений типичных для более ранних стадий развития, преобладание “интуитивных” объяснений над “рациональными” (Александров и др., 2017a, 2017b). Биохимическое разнообразие медиаторных паттернов нервной системы (НС) при остром стрессе также сводится к превалированию трех каскадов: симпатоадреналового, гипоталамо-гипофизарно-адренокортикального и эндогенного опиоидного (Parin et al., 2014). Это “упрощение” при стрессе выражается и в динамике других физиологических показателей, например, вариабельности сердечного ритма.
Помимо общего функционального состояния организма и адаптационных резервов, ВСР отражает особенности нейровисцеральных взаимодействий, организуемых в поведении (Smith et al., 2017). В рамках системно-эволюционного подхода (см. подробнее (Швырков, 1995; Alexandrov et al., 2005)) ВСР рассматривается как отражение включенности сердца в ФС реализации поведения. ВСР, таким образом, отражает постоянную “адаптацию” активности сердца к активности остальных компонентов актуализируемых общеорганизменных ФС в поведенческом континууме (Bakhchina et al., 2018). На модели публичного выступления (широко распространенный в исследованиях стресса на человеке протокол – the Trier Social Stress Test (Allen et al., 2014)) нами было показано, что энтропийные характеристики ВСР (выборочная энтропия) достоверно снижаются в первые 5–10 мин выступления по сравнению с фоновыми значениями. Энтропийные показатели ВСР отражают нерегулярность, нестационарность, сложность последовательности RR-интервалов (временных интервалов между соседними сокращениями сердца), поэтому можно заключить, что социальный стресс как фактор временной системной дедифференциации сопровождается снижением сложности нейровисцеральных взаимодействий (Bakhchina et al., 2018). Результаты проведенного нами анализа динамики ВСР при стрессе согласуются с имеющимися в литературе примерами снижения сложности динамики сердечного ритма при решении когнитивных задач в ограниченное время (Brindle, 2016; Visnovcova et al., 2014), при экзаменационном стрессе (Melillo et al., 2011), геморрагическом шоке (Batchinsky et al., 2007) и разного рода травмах (Liu et al., 2017). Шок можно рассматривать как крайнюю степень выраженности стресса (Парин и др., 2007), сопоставление изменений сложности динамики сердечного ритма при стрессе (по нашим данным и данным литературы) и при шоке (по данным литературы) демонстрирует закономерно бóльшее (в 4 раза) снижение энтропии сердечного ритма. Это означает, что снижение сложности динамики сердечного ритма и, следовательно (Bakhchina et al, 2018), сложности актуализированного опыта не только качественно, но и количественно связано с интенсивностью стресса (Бахчина, Александров, 2017). Так, например, степень снижения сложности динамики сердечного ритма (по показателю выборочной энтропии) при остром стрессе была прямо пропорционально связана с количеством и с субъективной значимостью негативных, снижающих индивидуальную стрессоустойчивость человека событий в жизни, которые оценивали по опросниковым методикам the Life Experience Survey и Positive and Negative Affect Schedule (Schneider et al., 2021). На это указывает и то, что не только острый стресс, но и ситуации повышенной эмоциональности сопровождаются снижением сложности в ВСР, однако в меньшей степени. Валенца с соавторами (Valenza et al., 2012) использовали изображения из базы IAPS для сопоставления параметров эмоций и показателей ВСР. В результате сложность динамики сердечного ритма (оценивалась аппроксимированной энтропией) была выше при просмотре нейтральных картинок, чем картинок с ненулевым уровнем эмоционального возбуждения (arousal), независимо от их валентности. Отметим, что в наших экспериментах снижение сложности было также выявлено, но не для позитивных, а лишь для негативных изображений, характеризовавшихся высокой эмоциональностью (Савицкая и др., 2020).
Сравнительное исследование эффектов хронического (оценивался по CHUS scale) и острого (формировался ситуацией публичного выступления) стресса на ВСР показало, что сложность динамики сердечного ритма (оценивалась по показателю корреляционной размерности) снижалась при остром стрессе и отрицательно коррелировала с уровнем хронического стресса. Поскольку другие показатели ВСР не были согласованы в своей динамике между сравниваемыми условиями, авторы подчеркнули важную роль показателей сложности в анализе ВСР при исследовании стресса и активности сердца (Schubert et al., 2009). Кроме того, показано, что использование ВСР-биофидбэк-тренингов, направленных на восстановление и развитие сложности динамики сердечного ритма, снижают эффекты стресса и повышают стрессоустойчивость индивида (Deschodt-Arsac, 2020).
Снижение сложности при остром стрессе проявляется и в других физиологических сигналах. По нелинейным показателям сложности динамики дыхательной активности возможно оценить уровень тревожности и стресса на рабочем месте (Tiwari et al., 2019). Энтропия траектории движения глаз снижается при остром стрессе (публичное выступление) и в целом ниже в группе людей с диагностированным посттравматическим стрессовым расстройством (Shiferaw et al., 2019). Энтропия ЭЭГ снижалась при стрессе, сформированном решением когнитивных задач на фоне депривации сна (Alonso et al., 2015).
Таким образом, для ситуации острого стресса характерно снижение сложности в динамике показателей системных психофизиологических процессов. Хронический стресс также сопровождается снижением разнообразия в динамике сердечного ритма. Эти эффекты можно интерпретировать как проявление врéменной системной дедифференциации в организации поведения, имеющей в обоих случаях значение для последующего развертывания индивидуального развития.
ХРОНИЧЕСКИЙ СТРЕСС
Эффекты хронического стресса изоляции и скученности на индивидуальное и совместное научение
Имея в виду только что сказанное о сходной динамике сложности при остром и хроническом стрессе, отметим, что наряду с этим в литературе не раз демонстрировали и различия (вплоть до противоположных) между эффектами острого и хронического стресса на показатели поведения (Katz et al., 1981), метаболизма (Rostamkhani, 2012 и другие характеристики взаимодействия индивида со средой (Metz et al., 2001). Изоляция и скученность формируют хронический стресс и могут тем самым влиять на процессы формирования нового опыта. Мы исследовали влияние хронического стресса изоляции и скученности на скорость научения крысами инструментальному пищедобывательному поведению в одиночку и кооперируя с конспецификом, а также оценивали состояние гипоталамо-гипофизарно-адренокортикальной системы (ГГАКС) и уровни провоспалительных цитокинов и нейротрофинов в крови крыс (Гаврилов и др., 2021).
Установлено, что самцы крыс Long Evans, с месячного возраста содержащиеся в условиях изоляции (1 крыса в клетке) или скученности (8 крыс в одной клетке), при научении их начиная с 3-месячного возраста инструментальному пищедобывательному поведению показывают разные результаты. Изолированные учатся дольше, чем крысы из контрольной группы (4 крысы в клетке) и крысы, содержавшиеся скученно. У последних, в свою очередь, не выявлено достоверных отличий по скорости научения как индивидуальному, так и совместному поведению в сравнении с контрольной группой.
Сопоставляя результаты поведенческого и биохимического исследования, можно констатировать, что мы получили неожиданный результат, который требует дальнейшего анализа. Оказалось, что хронический социальный стресс скученности, объективно более тяжелый как по состоянию ГГКАС, функционально подавленной в этой группе животных, так и по выраженному усилению воспалительных процессов, не влиял на инструментальное обучение в использованной в данной работе парадигме. С другой стороны, хроническая изоляция на фоне адаптированной к этому стрессорному воздействию ГГКАС и отсутствия провоспалительного тренда достоверно ухудшала обучение. Эти данные добавляют новые факты в большой пул работ о неоднозначном влиянии стрессорных факторов на процессы обучения.
Интерпретация этих данных, в частности, может включать и ранее приведенные нами теоретические и эмпирические аргументы в пользу того, что стресс, обусловливая обратимую блокаду части наиболее “сложного” имеющегося у индивида опыта, может, при определенной выраженности, увеличивать скорость и эффективность обучения, упрощать его в новой для индивида ситуации (Александров и др., 2017b).
Повышение дифференцированности взаимодействия со средой как адаптация индивида к хроническому заболеванию
С позиции психологии, психиатрии и медицины хроническое заболевание является травмой, кардинально изменяющей жизнь заболевшего человека (Reddan, Wager, 2019). Наиболее явными являются негативные последствия, возникающие сразу после манифестации заболевания (Jongsma et al., 2011). Например, обнаружено, что у людей с хронической головной болью напряжения ухудшается кратковременная и долговременная память (Mazza et al., 2018), прежде всего зрительно-пространственная (Savarese et al., 2000; Pini et al., 2005), снижается объем слуховой и зрительной памяти, увеличивается число ложных тревог и пропусков значимых сигналов (Чутко и др., 2013), снижается точность движений (Marchand et al., 2014), ухудшается внимание и эффективность обучения (Higgins et al., 2018) по сравнению с людьми, не страдающими хронической болью. Однако человеку, регулярно испытывающему боль, необходимо научиться адаптироваться к ней, распознавать, в каких ситуациях она может возникнуть, и по возможности избегать или облегчать их эффекты, то есть сформировать новые виды поведения, связанные с подобным контролем. У заболевшего человека запускается процесс адаптации к болезни, так называемый посттравматический рост (Infurna, Jayawickreme, 2019; Taku et al., 2021), который является процессом и результатом одновременно.
Результаты исследований указывают на то, что при длительном переживании боли у человека происходит реорганизация активности на всех уровнях от рецепторов кожи (Kuner, Flor, 2017) до всего мозга: переживание острой боли сопровождается активностью иных корковых и подкорковых структур, чем переживание боли, ставшей хронической (Hashmi et al., 2013). При переходе боли в хроническую меняется активность коры головного мозга: чем дольше индивид испытывает хроническую боль, тем обширнее зоны мозга, демонстрирующие активность при актуализации опыта, связанного с поврежденной частью тела (Flor, 2003). Такое длительное переживание боли сопровождается увеличением остроты тактильных ощущений в виде аллодинии и гиперальгезии (Flor, 2003), снижением порогов болевой чувствительности (Bendtsen, 2000; Filatova et al., 2008; Fernández de las Peñas et al., 2021). Можно было предполагать, что снижение порога болевой чувствительности указывает на увеличение дифференцированности поведения, связанного с болью, т.к. индивид начинает испытывать боль при реализации видов поведения, ранее не вызывавших боли, а также при реализации новых видов поведения.
В проведенных нами исследованиях (Колбенева и др., 2017) было показано, что люди, страдающие хронической головной болью напряжения, тратят статистически значимо больше времени (по сравнению с людьми аналогичного возраста, не страдающими хронической болью) на то, чтобы представить и оценить нейтральные и негативные тактильные ощущения (среди которых были крайне негативные, умеренно негативные и слегка негативные), а также крайне негативные зрительные ощущения, нейтральные зрительные ощущения и умеренно негативные слуховые ощущения.
Эти данные указывают на усложнение структуры индивидуального опыта при хронической головной боли напряжения: адаптация к постоянной боли является процессом научения, в ходе которого в структуре индивидуального опыта формируется множество новых систем, связанных прежде всего с тактильными ощущениями и направленных на раннее распознавание боли, поиск возможностей избежать боль или уменьшить ее. Таким образом, поведение, связанное с болью, дифференцируется. Увеличенное количество систем проявляется в замедлении реактивации преимущественно негативно оцениваемого поведения, связанного с тактильными ощущениями.
В связи с тем, что именно кожа содержит значительное количество рецепторов, относящихся к болевым (Гусев и др., 2000), полученные нами результаты позволяют предположить, что данные изменения в структуре индивидуального опыта являются следствием хронического заболевания индивида (длительного опыта переживания боли) и обусловлены увеличением дифференцированности моделей поведения при адаптации к хронической болезни.
Приведенные выше данные позволяют сделать вывод о том, что в результате хронического заболевания у индивида происходит не только обусловленное стрессом первичное снижение дифференцированности взаимодействия со средой во многих сферах жизни, но и постепенное повышение дифференцированности его взаимодействия со средой, обусловленное системогенезом, обеспечивающим адаптацию индивида к хронической болезни, совладание с ней.
Молекулярные механизмы дедифференциации
Для выявления механизмов развития психогенных патологических состояний у людей, проявляющихся в виде симптомокомплексов острых и хронических стрессовых расстройств, соответствующие состояния моделируются на животных. Контроль соответствия моделей изучаемым состояниям осуществляется с помощью методов, которые применимы в исследованиях с участием людей и в экспериментах на животных. К таким методам исследования относится, например, скрининг периферических биомаркеров. Так, в исследованиях показано, что особенностью состояний в стрессовых условиях является изменение уровня синтеза определенных рилизинг-гормонов, провоспалительных цитокинов, нейротрофинов и т.п., выявляемых в крови как у людей, так и у животных при моделировании соответствующих состояний. Экспериментальные модели на животных, имитирующие разные состояния, в том числе широкий круг заболеваний, в частности, с выявлением про- и противовоспалительных цитокинов в циркулирующей крови и сравнением динамики этих показателей в крови человека и животных, обладают “уникальной экологической валидностью” (Goff, 2013). Применение в исследованиях моделей на животных позволяет выявлять динамику изменений физиологических показателей, измерение которых у людей доступно в исключительных случаях, например, выявление тех же уровней про- и противовоспалительных цитокинов в нервной ткани; или же вовсе недоступно, например, некоторые маркеры биохимических процессов в клетках мозга при формировании поведения (такие как белки fos-, jun-, krox-семейств и пр.). В исследовании нейронного обеспечения формирования поведенческих адаптаций в моделях избегания стрессового воздействия (Булава, Александров, 2017; Булава, Гринченко, 2017; Bulava et al., 2020) капюшонных крыс Long-Evans обучали поведению активного избегания электроболевого раздражения. Экспериментальная установка снабжена электродной платформой, состоящей из двух равных секторов. Контроллер платформы автоматически регулирует напряжение в зависимости от электрического сопротивления кожи животного, что позволяет регулировать интенсивность стрессирующего воздействия и нивелировать индивидуальные различия животных по этому параметру (Булава, Волков, Александров, патент на изобретение RU2675174C1). В данной модели обучения электрический ток возрастал в течение 5 с до 1 мА и на этом уровне оставался еще 5 с, затем обрывался. Суммарные 10 с составляли одну пробу. Перед следующей пробой следовала пауза в 10 с. Первые пять дней проводили сессии привыкания к установке, в процессе которых животных поочередно помещали в установку на 30 мин без подачи напряжения. На шестой день проводили сессию обучения навыку активного избегания. Обучение длилось 30 мин и состояло из 90 проб. В каждой пробе активен был только один сектор электродной платформы, в следующей пробе он инактивировался, а активным становился другой сектор. Задача для животного состояла в том, чтобы как можно быстрее покинуть опасную зону. При анализе поведения определяли суммарное время пребывания животного на активном секторе платформы, а также определяли продолжительность пребывания на активном секторе в процессе роста тока и при максимальном раздражении (подробнее об устройстве см. в (Bulava et al., 2020)). По истечении требуемого времени после завершения экспериментальной сессии мозг анестезированных ингаляционным наркозом животных извлекали для последующего выявления Fos-активных нейронов разных структур иммуногистохимическим методом. По результатам анализа поведения обученных животных были выделены две стратегии избегания: 1) частичное избегание или убегание – переход с активного сектора после начала электрораздражения, но до максимальных значений тока (стратегия минимизации риска); 2) полное избегание – переход в паузу между пробами, когда оба сектора не активны. Первая стратегия снижает вероятность получения сильного наказания за счет выбора гарантированного, но слабого. Вторая стратегия наряду с большей эффективностью характеризуется более высоким риском, так как при совершении ошибки, то есть при переходе до начала паузы, животное подвергалось электроболевому воздействию максимальной интенсивности. Была выявлена прямая связь между временем пребывания животного на активном секторе в момент тока максимальной интенсивности и числом c-Fos-положительных нейронов в ядрах таламуса и гипоталамуса, а также обратная – в зонах моторной и ретросплениальной коры. Болевая афферентация, реализуясь через спиноталамические пути, опосредуется активностью нейронов ядер таламуса и гипоталамуса (см. напр., обзор по механизмам невропатической боли, в т.ч. на моделях спинальной травмы у животных (Kang et al., 2020)). Вероятно, это обусловливает выявленное в нашем исследовании большее число нейронов этих структур, вовлекаемых в процесс формирования опыта о событии, сопровождающемся болевой афферентацией. Одновременное снижение числа нейронов коры, вовлекаемых в процесс формирования такого опыта, может свидетельствовать о выраженности стрессовой регрессии, так как процесс дедифференциации, лежащий в ее основе, на нейрональном уровне характеризуется временным снижением показателей активности коры. У самок паттерн активности мозга в данной модели поведения характеризуется значимо меньшим числом c-Fos-позитивных нейронов в зонах коры и большим в подкорковых ядрах в сравнении с самцами. При этом самки значительно чаще выбирали стратегию минимизации риска, снижающую вероятность получения сильного наказания за счет выбора гарантированного, но слабого. В работе Моргадо и др. на модели принятия решения с выбором между меньшим, но гарантированным, и большим, но негарантированным пищевым вознаграждением, показано, что в условиях стресса (при двигательной иммобилизации) животные предпочитали “безопасную” стратегию (меньше, но гарантированно), тогда как у свободноподвижных животных сдвига в предпочтениях не наблюдалось (Morgado, 2014). Вероятно, самки в нашей модели демонстрируют более высокий уровень стресса и стрессовой регрессии, что приводит к сдвигу в предпочтениях более простой стратегии с предсказуемым результатом (Булава, Александров, 2017).
В другой нашей работе с использованием модели обучения крыс трем последовательным инструментальным пищедобывательным навыкам было показано, что в присутствии дистрактора (акустический стресс) значимо чаще выявляются элементы ранее приобретенного опыта (ключевые для получения подкрепления характеристики поведенческих актов, такие как направление побежек от кормушки к соответствующему ранее эффективному инструменту), что является показателем стрессовой регрессии. При этом в отсутствие фактора стресса чаще реализуются акты более поздно приобретенного поведения (Русак, 2017). При использовании схожей модели обучения в исследовании механизмов развития психогенных патологических состояний, проявляющихся в виде симптомокомплексов острых и хронических стрессовых расстройств, был выявлен значимый пролонгированный эффект стресса на динамику формирования нового поведения (Булава и др., 2020). В данном исследовании в качестве модели острого и хронического стресса применяли однократное (1 день/40 минут), либо многократное (14 дней/30 минут) интенсивное неизбегаемое электроболевое раздражение. В первоначальных сериях экспериментов с двухнедельной экспозицией электроболевого стресса, в которых после стрессового периода следовала одна сессия “открытого поля”, выявлено значимо меньше Fos-позитивных нейронов в корковых зонах по сравнению с контрольной группой не подвергавшихся стрессу крыс. Однако таких различий не выявлено у животных, прошедших обучение пищедобывательным навыкам после сессии “открытого поля” в конце стрессового периода. При этом животные групп обучения, подвергшиеся острому/хроническому интенсивному стрессовому воздействию в период до обучения, демонстрируют значительно более низкую скорость научения первому навыку и постепенное снижение этих различий к последнему навыку. То есть наблюдается снижение выраженности дедифференциации и стрессовой регрессии в процессе научения пищедобывательным навыкам после стрессового периода. Таким образом, глубокая (связанная со стрессом высокой интенсивности) и/или затяжная регрессия, а также связанные с ней нейроиммуноэндокринные эффекты, такие как повышение уровней нейростероидов и глутамат-индуцированная активация нейровоспаления (см., напр., обзоры (Гуляева, 2019; Rohleder, 2019; Gulyaeva, 2021)), могут снижать скорость формирования нового поведения. Это связано с тем, что многие медиаторы воспаления обладают плейотропными свойствами, т.е. в зависимости от условий могут оказывать как протективное действие, так и токсическое (Scherbel et al., 1999; Mason et al., 2001). Предполагается, что чрезмерная и/или затяжная продукция медиаторов воспаления может становиться предиктором заболеваний. Например, показано, что нейровоспалением характеризуются начальные стадии многих нейродегенеративных заболеваний (Gahtan, Overmier, 1999), в том числе связанных с возрастными изменениями (Di Benedetto et al., 2017). Медиаторы нейровоспаления являются звеном клеточной гибели в мозге (Harry, Kraft, 2008). Показана их роль в повреждении и гибели нейронов и нейроглии в острых (инсульт, травма и т.д.) и хронических (животные модели болезней Альцгеймера, Паркинсона, рассеянного склероза) состояниях (см. напр., обзоры (Allan, 2000; Aktas et al., 2005; Fourrier et al., 2019)), в том числе таких расстройствах, как депрессия, посттравматическое стрессовое расстройство (Zass et al., 2017), биполярное расстройство (Rosenblat, McIntyre, 2015), шизофрения (Goff, 2013).
В нашей работе, направленной на выявление особенностей мозгового обеспечения домен-специфического опыта (поведения, направленного на избегание или достижение), в результате анализа распределения числа Fos-позитивных клеток в мозге было выявлено снижение числа нейронов ретросплениальной коры (Bulava et al., 2016) и зоны CA1 гиппокампа (Булава, Гринченко, 2017), вовлекаемых в формирование поведения активного избегания по сравнению с пищедобывательным поведением. Таким образом, взаимосвязь между уровнями активации структур неокортекса и ряда подкорковых образований с результативностью поведения позволило рассматривать их как вероятные индикаторы общемозговой организации, обеспечивающей эффективное обучение в данных моделях поведения (Булава и др., 2020; Bulava, Alexandrov, 2021). Так как важную роль в формировании адаптаций в стрессогенных условиях отводят гипоталамо-гипофизарно-надпочечниковой системе и глюкокортикоидным гормонам, а в гиппокампе обнаружена высокая плотность низкоаффинных глюкокортикоидных и высокоаффинных минералокортикоидных рецепторов (локализованных в основном в полях СА1 и СА3), гиппокамп относят к ключевым надгипоталамическим центрам регуляции активности гипоталамо-гипофизарно-надпочечниковой оси (см., напр., (de Kloet, Joëls, 2020)). Вероятно, по этой же причине гиппокамп особенно чувствителен к интенсивному и/или хроническому стрессу. Так, наряду со многими другими изменениями, показана обратимая ретракция дендритных шипиков нейронов гиппокампа, которая при долгосрочном течении связана с повышенной вероятностью их гибели (см. обзор (Gulyaeva, 2021)). Возможно, этот механизм является частью патогенеза хронических тревожно-депрессивных расстройств, при которых наблюдается уменьшение общего объема гиппокампа (см., напр., обзор (Nolan et al., 2020)). В условиях длительного повышения уровней кортикостероидов также показана десенситизация нейронов гиппокампа и коры к действию серотонина (Karten et al., 1999; Villas Boas et al., 2019). Таким образом, изменение уровней нейростероидов и их баланса может лежать в основе механизмов стрессовой регрессии, а также при затяжном течении потенцировать нейровоспаление и стресс-индуцированные расстройства.
ЗАКЛЮЧЕНИЕ
Таким образом, результаты работ, выполняемых в рамках описанного в данной статье системно-эволюционного подхода к стрессу, и данные литературы демонстрируют “упрощение” и “стандартизацию” в системных процессах реализации имеющихся поведенческих актов и формирования нового поведения (системогенез) при стрессе. Такие эффекты, проявляющиеся в поведении, динамике нейронной активности (импульсной и молекулярно-генетической), а также в динамике висцеральных процессов, объединяются в понятии системной дедифференциации – врéменного и обратимого снижения роли систем относительно высоко дифференцированного поведения в обеспечении текущих соотношений индивида со средой. Это обеспечивает переход к более ранним, сформированным относительно раньше в онтогенезе, стратегиям и формам поведения, что, в свою очередь, обеспечивает более эффективное формирование нового опыта. Иными словами, стресс, включая “обратимую блокаду” части наиболее “сложного” (детализированного, трудного в согласовании с новыми элементами) имеющегося у индивида опыта, может, при определенной своей выраженности, увеличивать скорость и эффективность обучения, упрощать его в новой для индивида ситуации. Усложнение, увеличение дифференциации срочно сформированного опыта наступает позднее. В том числе и хронический стресс, в частности, связанный с течением болезни, может сопровождаться постепенным повышением дифференцированности взаимодействий индивида со средой, обусловленным системогенезом, ведущим к пополнению того домена опыта, который необходим для совладания с болезнью.
Список литературы
Александров Ю.И. В.Б. Швырков: формирование новой парадигмы в психологии и смежных науках. Выдающиеся ученые Института психологии РАН. Под ред. А.Л. Журавлева. М.: Институт психологии РАН, 2020. 218–255.
Александров Ю.И. Научение и память: традиционный и системный подходы. Журнал высш. нервн. деятельности им. И.П. Павлова. 2005. 55(6): 842–860.
Александров Ю.И., Носуленко В.Н., Савицкая Т.Ю. Вербальная оценка эмоциональных и нейтральных изображений. Вопросы психологии. 2020. 66(6): 117–130.
Александров Ю.И., Сварник О.Е., Знаменская И.И., Арутюнова К.Р., Колбенева М.Г., Крылов А.К., Булава А.И. Стресс, болезнь и научение как условия регрессии. Вопросы психологии. 2017a. 4: 87–101.
Александров Ю.И., Сварник О.Е., Знаменская И.И., Колбенева М.Г., Арутюнова К.Р., Крылов А.К., Булава А.И. Регрессия как этап развития. М.: Институт психологии РАН, 2017b. 191 с. ISBN: 978-5-9270-0354-9
Анохин П.К. Очерки по физиологии функциональных систем. М.: Медицина, 1975. 448 с.
Анохин П.К. Системогенез как общая закономерность эволюционного процесса. Бюлл. эксп. биол. и мед. 1948. 26(2): 81–99.
Арутюнова К.Р., Александров Ю.И. Мораль и субъективный опыт. Сер. Психология социальных явлений. М.: Институт психологии РАН, 2019. 188 с. ISBN: 978-5-9270-0404-1
Бахчина А.В., Александров Ю.И. Сложность сердечного ритма при временной системной дедифференциации. Экспериментальная психология. 2017. 10(2): 114–130.
Булава А.И., Александров Ю.И. Половой диморфизм в поведении активного избегания крыс, картирование экспрессии гена c-fos. Когнитивное моделирование: Труды V Международного форума по когнитивному моделированию. Часть 2. Когнитивное моделирование в науке, культуре, образовании. CMSCE-2017. Ростов-на-Дону: Фонд науки и образования, 2017. 251–260.
Булава А.И., Волков С.В., Александров Ю.И. Электродная платформа для электроболевой стимуляции животных. Патент на изобретение от 28.12.2017 RU2675174C1. 2017.
Булава А.И., Гринченко Ю.В. Паттерны активаций субрегионов гиппокампа в ситуациях аверсивного и неаверсивного научения. Биомедицинская радиоэлектроника. М.: Радиотехника, 2017. 2: 5–8.
Булава А.И., Назарова А.Г., Гуляева Н.В., Александров Ю.И. Системогенез при психотравмирующем опыте. Способности и ментальные ресурсы человека в мире глобальных перемен. Отв. ред. А.Л. Журавлев, М.А. Холодная, П.А. Сабадош. М.: Институт психологии РАН, 2020. 1527–1537.
Гаврилов В.В., Онуфриев М.В., Моисеева Ю.В., Александров Ю.И., Гуляева Н.В. Хронические социальные стрессы изоляции и скученности у крыс по-разному влияют на научение инструментальному поведению и состояние гипоталамо-гипофизарно-адренокортикальной системы. Журн. высш. нервн. деят. им. И.П. Павлова. 2021. 71(5): 680–689.
Горкин А.Г., Кузина Е.А., Ивлиева Н.П., Соловьева О.А., Александров Ю.И. Паттерны активности нейронов ретросплениальной области коры в инструментальном пищедобывательном поведении у крыс разного возраста. Журн. высш. нервн. деят. им. И.П.Павлова. 2017. 67(3): 334–340.
Горкин А.Г., Михайлова Н.П., Сафразьян Ю.Р. Изменения частоты активности нейронов ретросплениальной коры крыс при повторных потерях результативности поведения. Нейронаука для медицины и психологии: XVII Международный междисциплинарный конгресс. Труды конгресса. М.: МАКС Пресс, 2021. 116.
Гуляева Н.В. Биохимические механизмы и трансляционное значение чувствительности гиппокампа к дистантному фокальному повреждению мозга: цена стрессорного ответа. Биохимия. 2019. 84(11): 1622–1648.
Гусев Е.И., Бурд Г.С., Коновалов А.Н. Неврология и нейрохирургия. М.: Медицина, 2000. 656 с.
Давыдовский И.В. Патологическая анатомия и патогенез болезней человека. М.: МЕДГИЗ, 1956. 1350 с.
Давыдовский И.В. Проблемы причинности в медицине (этиология). М.: Государственное изд-во медицинской литературы, 1962. 176 с.
Знаменская И.И., Акбирова Р.Р. Отношение к “чужим” у людей с невротическими, связанными со стрессом расстройствами. Психология – наука будущего. Материалы VIII Международной конференции молодых ученых. Отв. ред. Е.А. Сергиенко, Н.Е. Харламенкова. М.: Институт психологии РАН, 2019. 183–187.
Знаменская И.И., Марков А.В., Бахчина А.В., Александров Ю.И. Отношение к “чужим” при стрессе: системная дедифференциация. Психологический журнал. 2016. 37(4): 44–58.
Знаменская И.И., Александров Ю.И. Становление нравственного отношения к “чужим” у сельских и городских детей 3–11 лет. Социальная психология и общество. 2019. 10(3): 85–99.
Колбенева М.Г., Мягченкова М.А., Александров Ю.И. Особенности ментальной реактивации тактильно опосредованного опыта у людей с хронической головной болью напряжения. Психологический журнал. 2017. 38(3): 66–80.
Коркина М.В., Лакосина Н.Д., Личко А.Е., Сергеев И.И. Психиатрия: 3-е изд. М.: Медпресс Информ, 2006. 576 с.
Кузина Е.А., Александров Ю.И. Особенности нейронного обеспечения инструментального поведения, сформированного одно- и многоэтапным способами. Журн. высш. нерв. деят. 2019. 69(5): 601–617.
Кузина Е.А., Ткаченко Н.С. Формирование “правила” чередования сложных навыков в ситуации выбора двух и более альтернатив у крыс. Нейронаука для медицины и психологии: XVII Международный междисциплинарный конгресс. Труды конгресса. М.: МАКС Пресс, 2021. 215–216.
Меерсон Ф.3., Пшенникова М.Г. Адаптация к стрессорным ситуациям и физическим нагрузкам. М: Медицина, 1988. 256 с.
Михайлова Н.П., Сафразьян Ю.Р., Горкин А.Г. Изменения активности нейронов ретросплениальной коры крыс при потере результативности пищедобывательного поведения. Нейронаука для медицины и психологии: XVI Международный междисциплинарный конгресс. Труды конгресса. М.: МАКС Пресс, 2020. 331.
Парин С.Б. Стресс, боль и опиоиды. Минск: Дискурс, 2021. 208 с.
Парин С.Б., Яхно В.Г., Цверов А.В., Полевая С.А. Психофизиологические и нейрохимические механизмы стресса и шока: эксперимент и модель. Вестник Нижегородского государственного университета имени Н.И. Лобачевского. 2007. 4: 190–196.
Русак И.И. Поведенческие параметры актуализации ранее сформированного опыта при научении в ситуации стресса у крыс. Психология – наука будущего. Материалы VII Международной конференции молодых ученых. Под ред. А.Л. Журавлева, Е.А. Сергиенко. М.: Институт психологии РАН, 2017. 690–693.
Савицкая Т.Ю., Носуленко В.Н., Александров Ю.И. Динамика сердечного ритма у индивидов при оценке и описании ими эмоционально окрашенных изображений. Экспериментальная психология. 2020. 13(1): 5–19.
Сафразьян Ю.Р., Михайлова Н.П., Горкин А.Г., Александров Ю.И. Динамика мозговой активности при адаптации к невозможности внешней реализации элемента индивидуального опыта. Российский психологический журнал. 2019. 16(2/1): 60–75.
Селье Г. Очерки об адаптационном синдроме. М.: Наука, 1960. 266 с.
Селье Г. Стресс без дистресса. М.: Прогресс, 1979. 124 с.
Чистова Ю.Р., Ивлиева Н.П., Горкин А.Г. Изменения поведенческих показателей в ситуации невозможности реализации элемента индивидуального опыта. Нейрокомпьютеры: разработка, применение. М.: Радиотехника, 2018. 10: 36–38.
Чутко Л.С., Сурушкина С.Ю., Рожкова А.В., Яковенко Е.А., Быкова Ю.Л., Никишина И.С. Астенические расстройства и когнитивные нарушения у пациентов с головной болью напряжения. Журнал неврологии и психиатрии. 2013. 5: 31–35.
Швырков В.Б. Введение в объективную психологию. Нейрональные основы психики. М.: Наука, 1995. 162 с.
Aktas O., Smorodchenko A., Brocke S., Infante-Duarte C., Topphoff U.S., Vogt J., Prozorovski T., Meier S., Osmanova V., Pohl E., Bechmann I. Neuronal damage in autoimmune neuroinflammation mediated by the death ligand TRAIL. Neuron. 2005. 46(3): 421–432.
Alexandrov L.I., Alexandrov Y.I. Changes of auditory-evoked potentials in response to behaviorally meaningful tones induced by acute ethanol intake in altricial nestlings at the stage of formation of natural behavior. Alcohol. 1993. 10(3): 213–217.
Alexandrov Y.I., Feldman B., Svarnik O.E., Znamenskaya I.I., Kolbeneva M.M., Arutyunova K.A., Krylov A.K., Bulava A.I. Regression I. Experimental approaches to regression. J Anal Psychol. 2020a. 65(2): 345–365.
Alexandrov Y.I., Sams M.E. Emotion and consciousness: ends of a continuum. Brain Res Cogn Brain Res. 2005. 25(2): 387–405.
Alexandrov Y.I., Svarnik O.E., Znamenskaya I.I., Kolbeneva M.M., Arutyunova K.A., Krylov A.K., Bulava A.I., Feldman B. Regression II. Development through regression. J Anal Psychol. 2020b. 65(3): 476–496.
Alexandrov Yu.I., Sozinov A.A., Svarnik O.E., Gorkin A.G., Kuzina E.A., Gavrilov V.V. Neuronal bases of systemic organization of behavior. Advances in Neurobiology. In: Cheung-Hoi Yu A., Li L. (eds) Systems Neuroscience. Springer, Cham, 2018. 21: 1–33.
Allan S.M. The role of pro and antiinflammatory cytokines in neurodegeneration. Annals of the New York Academy of Sciences. 2000. 917(1): 84–93.
Allen A.P., Kennedy P.J., Cryan J.F., Dinana T.G., Clarke G. Biological and psychological markers of stress in humans: Focus on the Trier Social Stress Test. Neurosci. Biobehav. Rev. 2014. 38: 94–124.
Alonso J.F., Romero S., Ballester M.R., Antonijoan R.M., Mañanas M.A. Stress assessment based on EEG univariate features and functional connectivity measures. Physiol Meas. 2015. 36(7): 1351–1365.
Bakhchina A.V., Arutyunova K.R., Sozinov A.A., Demidovsky A.V., Alexandrov Y.I. Sample entropy of the heart rate reflects properties of the system organization of behaviour. Entropy. 2018. 20(6): 449.
Batchinsky A.I., William H.C., Kuusela T., Cancio L.C. Loss of complexity characterizes the heart response to experimental hemorrhagic shock in swine. Crit Care Med. 2007. 35(2): 519–525.
Bendtsen L. Central sensitization in tension-type headache — possible pathophysiological mechanisms. Cephalalgia. 2000. 20: 486–508.
Brindle R.C., Ginty A.T., Phillips A.C., Fisher J.P., McIntyre D., Carroll D. Heart rate complexity: A novel approach to assessing cardiac stress reactivity. Psychophysiology. 2016. 53(4): 465–472.
Brivio P., Sbrini G., Riva M.A., Calabrese F. Acute stress induces cognitive improvement in the novel object recognition task by transiently modulating Bdnf in the prefrontal cortex of male rats. Cell. Mol. Neurobiol. 2020. 40: 1037–1047.
Bulava A.I., Alexandrov Y.I. Reconsolidation and Cognitive Novelty. Advances in Intelligent Systems and Computing / Advances in Cognitive Research, Artificial Intelligence and Neuroinformatics. Springer, Cham. 2021. 1358: 504–509.
Bulava A.I., Svarnik O.E., Alexandrov Yu.I. Reconsolidation of the previous memory: Decreased cortical activity during acquisition of an active avoidance task as compared to an instrumental operant food-acquisition task. 10th FENS Forum of Neuroscience. Abstracts. P044609. 2016. № 3493.
Bulava A.I., Volkov S.V., Alexandrov Y.I. A Novel Avoidance Test Setup: Device and Exemplary Tasks. Studies in Computational Intelligence. Springer, Cham. 2020. 856: 159–164.
Cazakoff B.N., Johnson K.J., Howland J.G. Converging effects of acute stress on spatial and recognition memory in rodents: a review of recent behavioral and pharmacological findings. Progress in neuro-psychopharmacology and biological psychiatry. 2010. 34(5): 733–741.
de Kloet E.R., Joëls M. Mineralocorticoid receptors and glucocorticoid receptors in HPA stress responses during coping and adaptation. In Oxford Research Encyclopedia of Neuroscience. 2020.
Deschodt-Arsac V., Blons E., Gilfriche P., Spiluttini B., Arsac L.M. Entropy in Heart Rate Dynamics Reflects How HRV-Biofeedback Training Improves Neurovisceral Complexity during Stress-Cognition Interactions. Entropy. 2020. 22: 317.
Devilbiss D.M., Spencer R.C., Berridge C.W. Stress degrades prefrontal cortex neuronal coding of goal-directed behavior. Cerebral cortex. 2017. 27(5): 2970–2983.
Di Benedetto S., Müller L., Wenger E., Düzel S., Pawelec G. Contribution of neuroinflammation and immunity to brain aging and the mitigating effects of physical and cognitive interventions. Neuroscience and Biobehavioral Reviews. 2017. 75: 114–128.
Diamond D.M., Campbell A.M., Park C.R., Halonen J., Zoladz P.R. The temporal dynamics model of emotional memory processing: a synthesis on the neurobiological basis of stress-induced amnesia, flashbulb and traumatic memories, and the Yerkes-Dodson law. Neural plasticity. 2007. 60803.
Fernández de las Peñas C., Madeleine P., Caminero A.B., Cuadrado M.L., Arendt Nielsen L., Pareja J.A. Generalized neck shoulder hyperalgesia in chronic tension type headache and unilateral migraine assessed by pressure pain sensitivity topographical maps of the trapezius muscle. Cephalalgia. 2010. 30(1): 77–86.
Filatova E., Latysheva N., Kurenkov A. Evidence of persistent central sensitization in chronic headaches: a multi-method study. The Journal of Headache and Pain. 2008. 9(5): 295–300.
Flor H. Cortical reorganisation and chronic pain: implications for rehabilitation. Journal of Rehabilitation Medicine-Supplements. 2003. 41: 66–72.
Fourrier C., Singhal G., Baune B.T. Neuroinflammation and cognition across psychiatric conditions. CNS spectrums. 2019. 24(1): 4–15.
Gagnon S.A., Wagner A.D. Acute stress and episodic memory retrieval: neurobiological mechanisms and behavioral consequences. Annals of the New York Academy of Sciences. 2016. 1369(1): 55–75.
Gahtan E., Overmier J.B. Inflammatory pathogenesis in Alzheimer’s disease: biological mechanisms and cognitive sequeli. Neuroscience & Biobehavioral Reviews. 1999. 23(5): 615–633.
Goff D.C. Future perspectives on the treatment of cognitive deficits and negative symptoms in schizophrenia. World Psychiatry. 2013. 12(2): 99–107.
Goldstein K. The organism. N. Y.: American book, 1939. 533 p.
Gray J.A., McNaughton N. The neuropsychology of anxiety. Oxford University Press, 2000. 73 p.
Gulyaeva N.V. Stress-Associated Molecular and Cellular Hippocampal Mechanisms Common for Epilepsy and Comorbid Depressive Disorders. Biochemistry (Moscow). 2021. 86(6): 641–656.
Harry G.J., Kraft A.D. Neuroinflammation and microglia: considerations and approaches for neurotoxicity assessment. Expert opinion on drug metabolism & toxicology. 2008. 4(10): 1265–1277.
Hashmi J.A., Baliki M.N., Huang L., Baria A.T., Torbey S., Hermann K.M., Schnitzer T.J., Apkarian A.V. Shape shifting pain: chronification of back pain shifts brain representation from nociceptive to emotional circuits. Brain. 2013. 136(9): 2751–2768.
Higgins D.M., Martin A.M., Baker D.G., Vasterling J.J., Risbrough V. The relationship between chronic pain and neurocognitive function: a systematic review. The Clinical journal of pain. 2018. 34(3): 262–275.
Hurtubise L., Howland J.G. Effects of stress on behavioral flexibility in rodents. Neuroscience. 2016. 14(345): 176–192.
Infurna F.J., Jayawickreme E. Fixing the growth illusion: New directions for research in resilience and posttraumatic growth. Current Directions in Psychological Science. 2019. 28(2): 152–158.
Joels M., Pu Z., Wiegert O., Oitzl M.S., Krugers H.J. Learning under stress: how does it work? Trends in Cognitive Science. 2006. 10: 152–158.
Jongsma M.L.A., Postma S.A.E., Souren P., Arns M., Gordon E., Vissers K., Wilder-Smith O., van Rijn C.M., van Goor H. Neurodegenerative properties of chronic pain: cognitive decline in patients with chronic pancreatitis. PLoS ONE. 2011. 6(8): e23363.
Kang J., Cho S.S., Kim H.Y., Lee B.H., Cho H.J., Gwak Y.S. Regional Hyperexcitability and Chronic Neuropathic Pain Following Spinal Cord Injury. Cellular and molecular neurobiology. 2020. 40(6): 861–878.
Karten Y.J.G., Nair S.M., Van Essen L., Sibug R., Joels M. Long-term exposure to high corticosterone levels attenuates serotonin responses in rat hippocampal CA1 neurons. Proceedings of the National Academy of Sciences. 1999. 96(23): 13456–13461.
Katz R.J., Roth K.A., Carroll B.J. Acute and chronic stress effects on open field activity in the rat: implications for a model of depression. Neurosci Biobehav Rev. 1981. 5(2): 247–251.
King S.M. Escape-related behaviours in an unstable elevated and exposed environment. I. A new behavioural model of extreme anxiety. Behavioural brain research. 1999. 98(1): 113–126.
Kinner V.L., Merz C.J., Lissek S., Wolf O.T. Cortisol disrupts the neural correlates of extinction recall. NeuroImage. 2016. 133: 233–243.
Kolbeneva M.G., Alexandrov Y.I. Mental Reactivation and Pleasantness Judgment of Experience Related to Vision, Hearing, Skin Sensations, Taste and Olfaction. PLoS ONE. 2016. 11(7): e0159036.
Kuner R., Flor H. Structural plasticity and reorganisation in chronic pain. Nature Reviews Neuroscience. 2017. 18(1): 20–30.
Lever C., Burton S., O’Keefe J. Rearing on hind legs, environmental novelty, and the hippocampal formation. Reviews in the neurosciences. 2006. 17(1–2): 111–133.
Liu N.T., Salinas J. Machine Learning for Predicting Outcomes in Trauma. Shock. 2017. 48(5): 504–510.
Marchand A.A., Cantin V., Murphy B., Stern P., Descarreaux M. Is performance in goal oriented head movements altered in patients with tension type headache? BMC musculoskeletal disorders. 2014. 15: 179.
Margittai Z., Strombach T., van Wingerden M., Joëls M., Schwabe L., Kalenscher T. A friend in need: Time-dependent effects of stress on social discounting in men. Hormones and Behavior. 2015. 73: 75–82.
Mason J.L., Suzuki K., Chaplin D.D., Matsushima G.K. Interleukin-1β promotes repair of the CNS. Journal of Neuroscience. 2001. 21(18): 7046–7052.
Mazza S., Frot M., Rey A.E. A comprehensive literature review of chronic pain and memory. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 2018. 87: 183–192.
Melillo P., Bracale M., Pecchia L. Nonlinear heart rate variability features for real-life stress detection. Case study: students under stress due to university examination. BioMedical Engineering OnLine. 2011. 10: 96.
Metz G.A., Schwab M.E., Welzl H. The effects of acute and chronic stress on motor and sensory performance in male Lewis rats. Physiol Behav. 2001. 72(1–2): 29–35.
Morgado P., Marques F., Silva M.B., Sousa N., Cerqueira J.J. A novel risk-based decision-making paradigm. Frontiers in Behavioral Neuroscience. 2014. 8: 45.
Nolan M., Roman E., Nasa A., Levins K.J., O’Hanlon E., O’Keane V., Willian Roddy D. Hippocampal and amygdalar volume changes in major depressive disorder: A targeted review and focus on stress. Chronic Stress. 2020. 4: 2470547020944553.
Parin S.B., Bakhchina A.V., Polevaia S.A. A neurochemical framework of the theory of stress. International Journal of Psychophysiology. 2014. 94(2): 230.
Pini L.A., Guidetti G., Brovia D., Pontremoli P., Sarchielli P. Topo-kinesthetic memory in chronic headaches. A new test for chronic patients: preliminary report. The journal of headache and pain. 2005. 6: 448–454.
Raio C.M., Brignoni-Perez E., Goldman R., Phelps E.A. Acute stress impairs the retrieval of extinction memory in humans. Neurobiol. learn. Mem. 2014. 112: 212–221.
Reddan M.C., Wager T.D. Brain systems at the intersection of chronic pain and self-regulation. Neuroscience Letters. 2019. 702: 24–33.
Rohleder N. Stress and inflammation–The need to address the gap in the transition between acute and chronic stress effects. Psychoneuroendocrinology. 2019. 105: 164–171.
Rosenblat J.D., McIntyre R.S. Are medical comorbid conditions of bipolar disorder due to immune dysfunction? Acta Psychiatrica Scandinavica. 2015. 132(3): 180–191.
Rostamkhani F., Zardooz H., Zahediasl S., Farrokhi B. Comparison of the effects of acute and chronic psychological stress on metabolic features in rats. J Zhejiang Univ Sci B. 2012. 13(11): 904–912.
Sandi C., Loscertales M., Guaza C. Experience-dependent facilitating effect of corticosterone on spatial memory formation in the water maze. Eur. J. Neurosci. 1997. 9: 637–642.
Sandi C., Pinelo-Nava M.T. Stress and memory: behavioral effects and neurobiological mechanisms. Neural Plasticity. 2007. 78970.
Savarese M., Prudenzano M.P., Francavilla T., Palumbo M., Nicolodi M., Canova S., Zanchin G., Granella F., Alberti A., Russo S., Cerbo R., Carolei A. Memory functions in patients with chronic daily headache. The journal of headache and pain. 2000. 1: S39–S44.
Scherbel U., Raghupathi R., Nakamura M., Saatman K.E., Trojanowski J.Q., Neugebauer E., Marino M.W., McIntosh T.K. Differential acute and chronic responses of tumor necrosis factor-deficient mice to experimental brain injury. Proceedings of the national academy of sciences. 1999. 96(15): 8721–8726.
Schneider M., Kraemmer M.M., Weber B., Schwerdtfeger A.R. Life events are associated with elevated heart rate and reduced heart complexity to acute psychological stress. Biol Psychol. 2021. 163: 108116.
Schubert C., Lambertz M., Nelesen R.A., Bardwell W., Choi J.-B., Dimsdale J.E. Effects of stress on heart rate complexity—A comparison between short-term and chronic stress. Biological Psychology. 2009. 80(3): 325–332.
Selye H.A. Stress of My Life: A Scientist’s Memoirs. New York: Van Nostrand Reinhold Company. 1979. 267 p.
Selye H.A. syndrome produced by diverse nocuous agents. Nature. 1936. 138(3479): 32.
Shiferaw B., Downey L., Crewther D. A review of gaze entropy as a measure of visual scanning efficiency. Neuroscience & Biobehavioral Reviews. 2019. 96: 353–366.
Smith A.M., Floerke V.A., Thomas A.K. Retrieval practice protects memory against acute stress. Science. 2016. 354(6315): 1046–1048.
Smith R., Thayer J.F., Khalsa S.S., Lane R.D. The hierarchical basis of neurovisceral integration. Neurosci Biobehav Rev. 2017. 75: 274–296.
Snyder C.N., Brown A.R., Buffalari D. Similar tests of anxiety-like behavior yield different results: comparison of the open field and free exploratory rodent procedures. Physiol. Behav. 2021. 230: 113246.
Starcke K., Brand M. Decision making under stress: a selective review. Neuroscience & Biobehavioral Reviews. 2012. 36(4): 1228–1248.
Taku K., Tedeschi R.G., Shakespeare-Finch J., Shakespeare-Finch J., Krosch D., David G., Kehl D., Grunwald S., Romeo A., Di Tella M., Kamibeppu K., Soejima T., Hiraki K., Volgin R., Dhakal S., Zięba M., Ramos C., Nunes R., Leal I., Gouveia P., Silva C.C., Del Prado Chaves P.N., Zavala C., Paz A., Senol-Durak E., Oshio A., Canevello A., Cann A., Calhoun L.G. Posttraumatic growth (PTG) and posttraumatic depreciation (PTD) across ten countries: Global validation of the PTG-PTD theoretical model. Personality and Individual Differences. 2021. 169: 110222.
Tiwari A., Narayanan S., Falk T.H. Breathing Rate Complexity Features for “In-the-Wild” Stress and Anxiety Measurement, 2019 27th European Signal Processing Conference (EUSIPCO). 2019. 1–5.
Valenza G., Allegrini P., Lanata A., Scilingo E.P. Dominant Lyapunov exponent and approximate entropy in heart rate variability during emotional visual elicitation. Front. Neuroeng. 2012. 5: 3.
Villas Boas G.R., Boerngen de Lacerda R., Paes M.M., Gubert P., Almeida W., Rescia V.C., de Carvalho P., de Carvalho A., Oesterreich S.A. Molecular aspects of depression: a review from neurobiology to treatment. Eur. J. Pharmacol. 2019. 851: 99–121.
Visnovcova Z., Mestanik M., Javorka M., Mokra D., Gala M., Jurko A., Calkovska A., Tonhajzerova I. Complexity and time asymmetry of heart rate variability are altered in acute mental stress. Physiol Meas. 2014. 35(7): 1319–1334.
von Dawans B., Strojny J., Domes G. The effects of acute stress and stress hormones on social cognition and behavior: current state of research and future directions. Neuroscience & Biobehavioral Reviews. 2021. 121: 75–88.
von Dawans B., Trueg A., Kirschbaum C., Fischbacher U., Heinrichs M. Acute social and physical stress interact to influence social behavior: The role of social anxiety. PloS ONE. 2018. 13(10): e0204665.
Wolf O.T. Stress and memory retrieval: mechanisms and consequences. Curr. Opinion Behav. Sci. 2017. 4: 40–46.
Wolf O.T., Kluge A. Commentary: Retrieval practice protects memory against acute stress. Front. Behav. Neurosci. 2017. 11: 48.
Wolf O.T., Schommer N.C., Hellhammer D.H., Reischies F.M., Kirschbaum C. Moderate psychosocial stress appears not to impair recall of words learned four weeks prior to stress exposure. Stress. 2002. 5: 59–64.
Zass L.J., Hart S.A., Seedat S., Hemmings S.M., Malan-Müller S. Neuroinflammatory genes associated with post-traumatic stress disorder: implications for comorbidity. Psychiatric genetics. 2017. 27(1): 1–16.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


