Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 3, стр. 421-434
Влияние материнской среды на раннее постнатальное развитие крыс линии OXYS
Т. Н. Игонина 1, О. М. Воронкова 1, Д. С. Рагаева 1, Е. Ю. Брусенцев 1, И. Н. Рожкова 1, Н. Г. Колосова 1, С. Я. Амстиславский 1, *
1 Федеральное государственное бюджетное научное учреждение
“Федеральный исследовательский центр Институт цитологии и генетики
Сибирского отделения Российской академии наук”
г. Новосибирск, Россия
* E-mail: amstis@yandex.ru
Поступила в редакцию 22.10.2021
После доработки 22.10.2021
Принята к публикации 20.12.2021
- EDN: TDLSLW
- DOI: 10.31857/S0044467722020058
Аннотация
Изменение окружающей эмбрион среды во время внутриутробного развития может оказать влияние на постнатальный онтогенез потомков. В данном исследовании у крыс OXYS, являющихся моделью преждевременного старения, было изучено влияние материнской среды на рост новорожденных и развитие их рефлексов, а также на плотность нейронов в префронтальной коре и гиппокампе. Преимплантационные эмбрионы переносили от крыс OXYS к разным самкам-реципиентам: либо крысам линии Wistar, либо гибридам F1 между самками линии Sprague-Dawley и ручными серыми крысами. Полученные нами результаты показали, что в целом неонатальное развитие потомков OXYS, полученных в результате эмбриотрансфера (ЭТ), ускорялось, но это зависело от генотипа приемной матери. Крысята линии OXYS, рожденные и выкормленные гибридными матерями, имели большую массу тела, раньше открывали глаза и демонстрировали ускоренное созревание неонатальных рефлексов, что подтверждалось в реакциях избегания края и отрицательного геотаксиса. Более того, эти потомки имели более низкую плотность нейронов в областях гиппокампа CA1, CA3 и DG по сравнению с контрольной группой OXYS (без ЭТ). Крысята OXYS, рожденные и воспитанные матерями Wistar, раньше демонстрировали зрелую позу и открытие глаз, а также имели более низкую плотность нейронов в области CA3 гиппокампа по сравнению с контрольной группой. Кроме того, эти потомки демонстрировали реакцию отрицательного геотаксиса на более раннем этапе неонатального онтогенеза по сравнению с контролем. В заключение следует отметить, что замена матерей OXYS матерями-реципиентами без генетически обусловленной предрасположенности к преждевременному старению привела к более быстрому созреванию неонатальных рефлексов и изменению плотности нейронов в гиппокампе у потомства.
ВВЕДЕНИЕ
Одной из основных вспомогательных репродуктивных технологий (ВРТ) является пересадка (перенос) эмбрионов в полость матки – эмбриотрансфер (ЭТ), который широко применяют как в медицине, так и в экспериментах на лабораторных животных (Berntsen et al., 2019; Ramos-Ibeas et al., 2019). Гипотеза DOHaD – Developmental Origins of Health and Disease (Barker, 2007) предполагает, что изменения условий внутриутробного развития влияют на постнатальный рост, метаболизм и восприимчивость к заболеваниям во взрослом возрасте; эта гипотеза недавно была распространена и на преимплантационную стадию (Fleming et al., 2015). Несмотря на то что ВРТ в репродуктивной медицине применяются уже на протяжении 40 лет, долгосрочное влияние этих методов на здоровье потомства еще полностью не изучено (Berntsen et al., 2019). Долгосрочные эффекты, связанные с развитием сердечно-сосудистой (Ceelen et al., 2009; Scherrer et al., 2015; Meister et al., 2018) и нервной систем (Rumbold et al., 2017; LaRovere et al., 2019) у детей, рожденных после применения ВРТ, активно обсуждаются в настоящее время. Однако до сих пор неясно, вызваны ли наблюдаемые изменения в этих системах применением ВРТ, или они обусловлены низкой фертильностью (Pontesilli et al., 2015) и наличием хронических заболеваний у родителей (Dayan et al., 2016), а также поздним репродуктивным возрастом матерей (Gleicher et al., 2014), которые принимают участие в ВРТ.
Экспериментальные исследования на лабораторных животных направлены на изучение эффектов репродуктивных технологий в проявлении тех или иных признаков у потомков (Sunde, 2019; Раннева и др., 2020). Как правило, воздействие на экспериментальное животное, моделирующее ситуацию лечения бесплодия в медицине, включает комплекс процедур, таких как суперовуляция, культивирование in vitro и ЭТ (Mainigi et al., 2016; Aljahdali et al., 2020). На внутриутробную среду влияют различные факторы, обусловленные как генотипом матери, так и плода (Chiossi et al., 2016; Burrell, Edozien, 2014). Между тем, важный вопрос, который ставят в некоторых исследованиях, заключается в том, как изменение материнской среды во время процедуры ЭТ влияет на эпигеном (молекулярные метки, регулирующие активность генов) в ходе дальнейшего развития зародышей в новой материнской среде (Rivera et al., 2008) и как это отражается на фенотипе потомков (Lee, Azar, 2010; Igonina et al., 2019).
Процедура переноса эмбрионов суррогатной матери вызывает резкие изменения среды для преимплантационных зародышей и в конечном итоге влияет на программирование развития плода. Эксперименты по ЭТ, проведенные на линиях крыс с гипертензией, таких как SHR (Spontaneous Hypertensive Rat) и ISIAH (Inherited Stress Induced Arterial Hypertension) выявили сильное влияние пренатальной материнской среды на массу тела потомства и их систолическое артериальное давление (Lee, Azar, 2010; Igonina et al., 2019). Недавнее исследование на мышах показало также, что генотип суррогатной матери влияет на массу тела и процент жира в организме потомков (Gerlinskaya et al., 2019).
Крысы OXYS характеризуются преждевременным старением, а также симптомами, сходными с болезнью Альцгеймера человека и некоторыми другими возрастными заболеваниями (Korbolina et al., 2016; Telegina et al., 2019). У крыс OXYS в возрасте 3–5 мес., одновременно с первыми признаками нейродегенерации, возникают изменения поведения, а также нарушения памяти и обучения (Telegina et al., 2019). В неонатальный период крысы OXYS характеризуются задержкой развития нервной системы, сопровождающейся изменениями плотности нейронов в префронтальной коре и гиппокампе, а также отличиями общего уровня метилирования ДНК в исследуемых структурах головного мозга (Igonina et al., 2018). Мы предполагаем, что характерная для этой линии материнская среда осуществляет влияние на развитие нервной системы и созревание мозга у потомков и может быть одним из механизмов, обусловливающим предрасположенность к преждевременному старению крыс OXYS.
Несмотря на то что в некоторых исследованиях была поставлена задача изучить влияние комплекса процедур ВРТ на поведение и развитие мозга потомков (Ecker et al., 2004; Mainigi et al., 2016), до сих пор отсутствуют работы, которые были направлены на оценку специфических эффектов именно ЭТ на эти характеристики. Поскольку особенности раннего постнатального развития и плотность нейронов в отдельных структурах головного мозга у крыс OXYS ранее были нами охарактеризованы (Igonina et al., 2018), данная линия представляет интерес для проведения такого рода исследований. Целью настоящей работы было изучение влияния материнской среды на массу тела потомков и созревание их рефлексов, а также плотность нейронов в префронтальной коре и гиппокампе головного мозга в неонатальный период у крыс OXYS.
МЕТОДИКА
Экспериментальные животные. В эксперименте использовали крыс линий OXYS, Wistar и гибридов F1 между самками Sprague-Dawley и самцами ручных серых крыс, которых содержали в SPF-виварии Института цитологии и генетики в индивидуально вентилируемых клетках (OptiRAT, AnimalCare, США) при температуре 22–24°C и влажности 40–50%; в качестве подстилки использовали опилки. Суточный цикл состоял из 12 ч дня и 12 ч ночи, с восходом в 4 ч утра и закатом в 16 ч. Животные имели постоянный доступ к автоклавированному стандартизированному корму (V1534-300, Sniff, Soest, Германия) и очищенной воде, обогащенной минеральными добавками (“Северянка”, “Экопроект”, Россия). Взрослые самцы и самки крыс в возрасте 12–14 нед. содержались в группах по 2–3 животных перед началом эксперимента. Самцы перед началом спаривания были отсажены в отдельные клетки. Самок с потомством (до 25 дней) также содержали отдельно.
Были сформированы следующие группы животных:
1) Контроль, n = 21 (5 пометов): крысы OXYS, зачатые естественным путем, с уменьшением размера помета до 3–7 детенышей;
2) ЭТ-Wistar, n = 13 (3 помета): крысы OXYS, рожденные после ЭТ самкам Wistar; 4–5 крысят в помете;
3) ЭТ-гибрид, n = 15 (3 помета): крысы OXYS, рожденные после ЭТ гибридным самкам F1 между Sprague-Dawley и ручными серыми крысами; 3–6 детенышей в помете.
Все экспериментальные процедуры были одобрены комиссией по биоэтике Института цитологии и генетики (протокол № 12 от 6 декабря 2012 г.) и согласуются с Европейской конвенцией о защите позвоночных животных, используемых для экспериментальных и других научных целей.
Спаривание доноров и получение эмбрионов. Самок крыс линии OXYS (n = 7) в возрасте 12–16 нед. в период проэструса или эструса ссаживали на ночь с самцами того же вида. Спаривание подтверждалось наличием вагинальной пробки и присутствием сперматозоидов в мазках. День, когда была обнаружена вагинальная пробка/сперматозоиды, считали первым днем после покрытия – post coitum (pc). Спарившихся самок подвергали эвтаназии при помощи CO2 на пятый день pc для сбора эмбрионов на стадии бластоцисты. Рога матки промывали средой FertiCultTMFlushing (FertiPro, Бельгия), как описано ранее (Igonina et al., 2019). Собранные эмбрионы оценивали под стереомикроскопом S8 APO (Leica Microsystems, Германия) с увеличением 80×. Бластоцисты без видимых дефектов и с интактной zona pellucida отбирали для ЭТ, а эмбрионы низкого качества отбраковывали.
Спаривание самок-реципиентов. Самок Wistar (n = 5) и самок гибридных крыс F1 (n = 5), выбранных в качестве реципиентов для экспериментов по ЭТ, ссаживали на стадии проэструса или эструса с вазэктомированными самцами ручных серых крыс с подтвержденной стерильностью. Через 8–12 ч самок проверяли на наличие вагинальной пробки. День обнаружения вагинальной пробки считали первым днем псевдобеременности.
Эмбриотрансфер. Бластоцисты, полученные от крыс OXYS, были перенесены в рог матки самкам-реципиентам на четвертый день их псевдобеременности. С целью анестезии самкам-реципиентам производили внутрибрюшинные инъекции сначала 0.1 мг/кг медетомидина гидрохлорида (Медитин; 1 мг/мл, Апи-Сан, Россия), а затем через 10 мин 50 мг/кг кетамина гидрохлорида (Кетамин; 50 мг/мл, Московский эндокринный завод, Россия). После этого им подкожно вводили 0.02 мл амоксициллина (Амоксициллина тригидрат; 150 мг/мл, Апи-Сан, Россия). Шерсть в месте разреза сбривали с правой стороны спины на расстоянии 1 см от нижнего ребра в вентральном направлении, а кожу обрабатывали 70%-м спиртом. Шкуру и нижележащий мышечный слой в области над маткой разрезали дорсовентрально, в 5 мм от нижнего ребра в каудальном направлении. Висцеральный жир с яичником, яйцеводом и верхней частью рога матки захватывали пинцетом и приподнимали. Эмбрионы (7–10 на самку) переносили в правый рог матки с помощью стеклянного капилляра в 5 мкл среды FertiCultTMFlushing (FertiPro, Бельгия). Разрез зашивали рассасывающимися нитками и присыпали антибиотиком (Амоксициллина тригидрат; Апи-Сан, Россия), затем хирургический шов обрабатывали антисептиком (Acerbin, Montavit Pharmazeutische Fabrik GmbH, Австрия).
Оценка потомства. День родов считали первым после рождения (Д1). Крысят взвешивали на Д6 и Д14 на цифровых весах (OHAUS Scout PRO, США) и ежедневно проверяли открытие глаз, начиная с Д6.
Поддержание позы оценивали, помещая крысят на нескользкую поверхность, и наблюдали за тем, как они поддерживают позу при движении. Незрелая поза характеризуется волочением живота по поверхности и перпендикулярным по отношению к телу расположением передних и задних лап. В случае сформированной зрелой позы крысята могут поднимать живот над поверхностью и передвигаться на всех четырех лапах (Geisler et al., 1993). Соответственно, при демонстрации крысятами зрелой позы тест считался выполненным, а незрелой позы – невыполненным. Крысят тестировали в возрасте с двенадцатого по пятнадцатый день жизни (Д12–Д15).
Рефлексы новорожденных оценивали по стандартной методике, рекомендованной ранее (Nguyen et al., 2017). Крысят оценивали ежедневно, начиная с Д6, с использованием перечисленных ниже тестов.
Рефлекс переворачивания (Д6–Д9): каждого крысенка клали на спину на ровную поверхность. Регистрировали время, необходимое детенышу, чтобы перевернуться на четыре конечности. Время теста 30 с. Этот рефлекс считали сформированным, если время переворачивания не превышало 5 с.
Отрицательный геотаксис (Д7–Д13): каждого крысенка помещали головой вниз на наклонную поверхность, покрытую металлической проволочной сеткой под углом 45 градусов. Тест считали успешно выполненным, когда у детеныша получалось развернуться на 180 градусов и начать ползти по поверхности. Время теста – 180 с.
Реакция избегания края (Д9–Д14): каждого крысенка помещали на ровную приподнятую поверхность (высота 70 см) так, чтобы голова и передние лапы свисали с края. Испытание считали выполненным, когда у детеныша получалось развернуться на 180 градусов и отползти от края. Время теста – 180 с.
Тест “выход из круга” (Д8–Д12): каждый крысенок был помещен в центр круга диаметром 15 см. Тест считали успешно выполненным, когда детеныш мог выйти за пределы круга обеими передними лапами. Время теста – 30 с.
Гистологический анализ и получение изображений. В возрасте шести дней одного или двух крысят из помета каждой группы подвергали эвтаназии при помощи декапитации, выделяли мозг и фиксировали в течение 48 ч в 4%-м параформальдегиде, приготовленном на PBS. Затем мозг с помощью лезвия разделяли на части толщиной 5 мм и помещали в гистологические кассеты. Кассеты с частями мозга подвергали проводке в аппарате карусельного типа Citadel 2000 (Thermo Fisher Scientific, США) в соответствии с рекомендациями производителя. Затем блоки заливали парафиновой средой Histomix Extra (Bio Vitrum, Россия) на станции HistoStar (Thermo Fisher Scientific, США). Для гистологической оценки были получены срезы толщиной 4 мкм префронтальной коры (брегма = +5.64) и гиппокампа (брегма = –2.92) с помощью микротома Microm HM340E (Thermo Fisher Scientific, США) и помещены на предметные стекла. Затем срезы окрашивали по Нисслю для идентификации клеток. Оценивали плотность нейронов в третьем слое префронтальной коры, а также в CA1-, CA2-, CA3-областях и зубчатой извилине (DG) гиппокампа. Получали изображения срезов префронтальной коры и каждой области гиппокампа с помощью микроскопа EclipseCi-L (Nikon, Япония), оснащенного камерой DS-Fi2 (Nikon, Япония). Плотность нейронов рассчитывали вручную при помощи программы ImageJ (NIH, США), как описано ранее (Igonina et al., 2018).
Статистический анализ. Анализ результатов проводили с использованием программы STATISTICA v.6.0. Уровень значимости считали при p < 0.05. Проверку нормальности распределения полученных данных проводили с помощью тестов Колмогорова–Смирнова и Шапиро–Уилка; однородность дисперсий проверяли тестом Левена. Данные по массе тела и плотности нейронов в различных областях головного мозга были проанализированы при помощи ANOVA с последующим анализом post hoc с использованием теста Fisher LSD и представлены как среднее значение ± стандартная ошибка. Результаты общего развития (зрелость позы, реакция отрицательного геотаксиса, день открытия глаз, тесты “избегание края” и “выход из круга”) представлены как доля крысят. Данные были проанализированы с использованием критерия хи-квадрат с поправкой Холма–Бонферрони для множественных сравнений. Результаты по рефлексу переворачивания представлены как медиана с первым и третьим квартилями (Me [Q1; Q3]) и были проанализированы с использованием непараметрического критерия Краскела–Уоллиса.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Общее неонатальное развитие
Гендерных различий в тестируемых параметрах неонатального развития для всех исследуемых групп выявлено не было, поэтому данные для самок и самцов были объединены для дальнейшего статистического анализа. Данные по массе тела представлены на рис. 1 (а). Анализ ANOVA выявил значительное влияние на массу тела таких факторов, как “генотип приемной матери” (F(2, 46) = 43.8, p < 0.001) и “возраст крысенка” (F(1, 46) = = 2071.5, p < 0.001), а также взаимодействие между этими факторами (F(2, 46) = 38.4, p < 0.001). Как показал post hoc тест Fisher LSD, детеныши из группы ЭТ-гибрид весили больше по сравнению с контрольной группой на Д6 (p < 0.05) и Д14 (p < 0.001) и по сравнению с крысятами из группы ЭТ-Wistar на Д14 (p < 0.001).
Рис. 1.
Общее развитие потомков крыс OXYS. По оси абсцисс указан день неонатального развития. (а) – масса тела, (б) – открытие глаз, (в) – формирование зрелой позы. * – p < 0.05, *** – p < 0.001 по сравнению с контролем. +++ – p < 0.001 по сравнению с ЭТ-Wistar.
Fig. 1. General development in offspring of OXYS rats. X-axis indicates day of the neonatal development. (а) – body weight, (б) – eyes opening, (в) – mature posture development. * – p < 0.05, *** – p < 0.001 vs. Control. +++ – p < 0.001 vs. ET-Wistar.
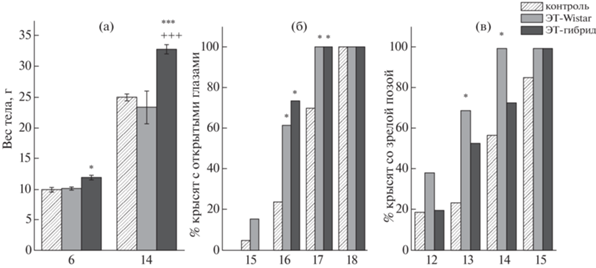
Доля крысят с открытыми глазами была значительно выше по сравнению с контролем в обеих ЭТ-группах на Д16 (p < 0.05) и Д17 (p < 0.05). Кроме того, на Д17 глаза уже были открыты у всех крысят обеих экспериментальных групп. Однако в контрольной группе все детеныши открыли глаза только на Д18 (рис. 1 (б)).
Зрелая поза быстрее формировалась у крысят ЭТ-Wistar по сравнению с контролем (рис. 1 (в)). Доля детенышей, имевших зрелую позу, была в группе ЭТ-Wistar значительно выше по сравнению с контролем на Д13 (p < 0.01) и Д14 (p < 0.01). Кроме того, у всех крысят в группе ЭТ-Wistar уже развилась зрелая поза на Д14, тогда как в контрольной и ЭТ-гибрид группах все детеныши демонстрировали зрелую позу только на Д16.
Развитие рефлексов
Никаких гендерных различий в развитии рефлексов обнаружено не было ни в одной из исследуемых групп; по этой причине данные по самкам и самцам были объединены для дальнейшего статистического анализа. Согласно нашим результатам, время выполнения рефлекса переворачивания у крысят всех трех исследуемых групп не отличается (рис. 2 (а)). Считается, что рефлекс переворачивания полностью сформирован, когда крысенок может выполнить задание менее чем за 5 с (Markus, Petit, 1987). Согласно нашим результатам, у детенышей всех исследуемых групп рефлекс переворачивания полностью сформировался на Д8.
Рис. 2.
Неонатальные рефлексы у потомков крыс OXYS. По оси абсцисс указан день неонатального развития. (а) – рефлекс переворачивания, (б) – тест “выход из круга”, (в) – реакция избегания края, (г) – реакция отрицательного геотаксиса. * –p < 0.05, ** –p < 0.01, *** – p < 0.001 по сравнению с контролем. + –p < 0.05 по сравнению с ЭТ-Wistar.
Fig. 2. Neonatal reflexes in offspring of OXYS rats. X-axis indicates day of the neonatal development. (а) – righting reflex, (б) – gate test, (в) – cliff avoidance reaction, (г) – negative geotactic reaction. * – p < 0.05, ** – p < 0.01, *** – p < 0.001 vs. Control. + – p < 0.05 vs. ET-Wistar.
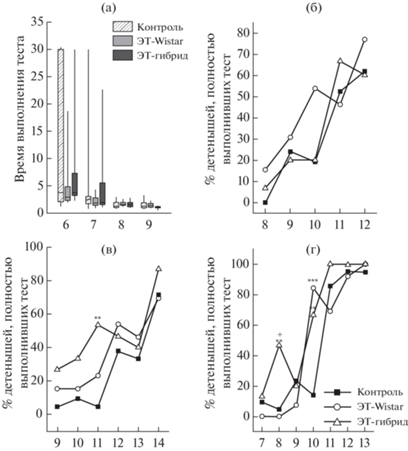
Передвижение у потомков оценивали с помощью теста “выход из круга”. Доля крысят, успешно выполнивших задание, в исследуемых группах не отличалась (рис. 2 (б)).
Во всех трех изученных группах доля детенышей, успешно продемонстрировавших реакцию избегания края, увеличивалась на протяжении всего периода тестирования. Тем не менее доля крысят, выполняющих задание, была выше (p < 0.01) в группе ЭТ-гибрид по сравнению с контролем на Д11 (рис. 2 (в)).
Аналогичным образом доля детенышей, успешно показавших реакцию отрицательного геотаксиса, увеличивалась на протяжении всего периода тестирования во всех трех исследуемых группах (рис. 2 (д)). На Д8 доля детенышей, успешно выполнивших это задание, была выше в группе ЭТ-гибрид по сравнению с контролем (p < 0.01) и с группой ЭТ-Wistar (p < 0.05). На Д10 доля детенышей, успешно продемонстрировавших реакцию отрицательного геотаксиса, была выше в обеих ЭТ-группах по сравнению с контролем (p < 0.001 для ЭТ-Wistar и p < 0.01 для ЭТ-гибрид).
Плотность нейронов в префронтальной коре и гиппокампе
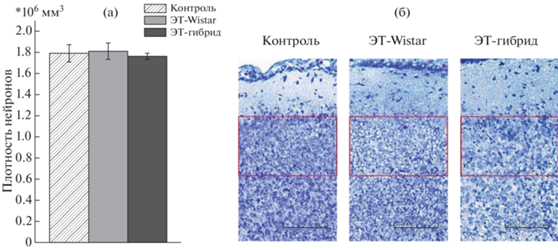
Результаты по плотности пирамидных нейронов в префронтальной коре шестидневных крысят OXYS для всех групп представлены на рис. 3. Однофакторный дисперсионный анализ не выявил влияния фактора “генотип приемной матери” на плотность нейронов в префронтальной коре головного мозга (F (2, 8) < 1).
Рис. 3.
Плотность пирамидных нейронов в префронтальной коре головного мозга крыс OXYS. (а) – плотность нейронов на мм3, (б) – пирамидные нейроны, окрашенные по Нисслю.
Fig. 3. Density of pyramidal neurons in prefrontal cortex in OXYS rats. (а) – density of the neurons per mm3, (б) – Nissl-stained pyramidal neurons.
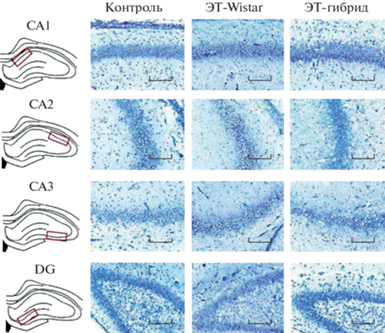
Данные гистологического анализа CA1-, CA2-, CA3- и DG-областей гиппокампа у шестидневных крысят представлены на рис. 4 и 5. Однофакторный дисперсионный анализ показал значительное влияние фактора “генотип приемной матери” на плотность нейронов в CA1- (F (2, 8) = 52.27, p < 0.001), CA3- (F(2, 8) = 36.08, p < 0.001) и DG- (F (2, 8) = 8.17, p < 0.05) областях гиппокампа. В зоне CA2 влияние фактора “генотип приемной матери” было недостоверным (F (2, 8) = 2.07, p > > 0.05). Как показало post hoc сравнение, плотность нейронов в CA1-области была ниже у детенышей группы ЭТ-гибрид по сравнению с крысятами группы ЭТ-Wistar (p < < 0.001) и контрольной группы (p < 0.001) (рис. 4). В зоне CA3 плотность нейронов была ниже в обеих ЭТ-группах по сравнению с контролем (p < 0.001) и в группе ЭТ-гибрид по сравнению с ЭТ-Wistar (p < 0.05) (рис. 4). В DG-области плотность нейронов была ниже у детенышей группы ЭТ-гибрид по сравнению с ЭТ-Wistar (p < 0.01) и контрольной (p < 0.05) группами (рис. 4).
Рис. 4.
Плотность пирамидных нейронов в гиппокампе крыс OXYS. Плотность нейронов в областях CA1, CA2, CA3 и DG представлена в виде числа клеток на мм3. ** – p < 0.01, *** – p < 0.001 по сравнению с контролем. + – p < 0.05, +++ – p < 0.001 по сравнению с группой ЭТ-гибрид.
Fig. 4. Density of pyramidal neurons in hippocampus in OXYS rats. Neuronal density in CA1, CA2, CA3, and the DG area is presented as cell number per mm3. ** – p < 0.01, *** – p < 0.001 vs. Control. + – p < 0.05, +++ – p < 0.001 vs. ET-hybrid.
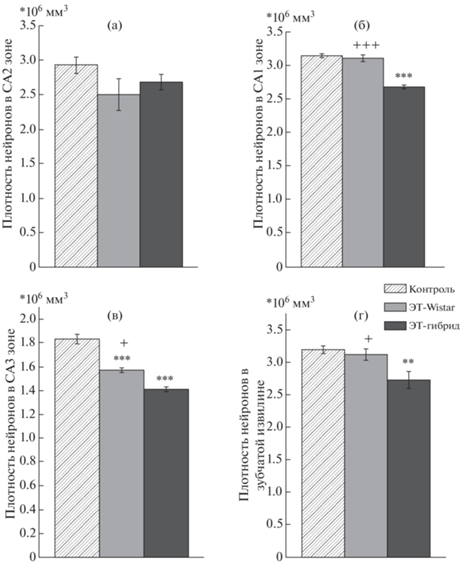
Рис. 5.
Окрашенные по Нисслю пирамидные нейроны в гиппокампе крыс OXYS. На изображениях показаны окрашенные по Нисслю пирамидные нейроны в CA1-, CA2-, CA3- и DG-областях гиппокампа. Увеличение 100×; Шкала = 100 мкм.
Fig. 5. Nissl-stained pyramidal neurons in hippocampus in OXYS rats. The images show Nissl-stained pyramidal neurons in CA1, CA2, CA3, and the DG area of hippocampus. Magnification, 100×; bar = 100 μm.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В работе изучено влияние материнской среды на раннее развитие у крысят OXYS. Наши результаты показывают, что неонатальное развитие у детенышей OXYS стимулируется в случае применения ЭТ, но эти эффекты зависят от генотипа приемной матери. Крысята OXYS, рожденные и выкормленные гибридными матерями, имели большую массу тела по сравнению с детенышами, матерями которых были самки OXYS или Wistar. Ранее было показано, что крысы OXYS показывают более медленный набор массы тела в постнатальный период по сравнению с контрольными крысами линии WAG – Wistar Albino Glaxo (Igonina et al., 2018). Исходя из этого, можно предположить, что гибридные приемные матери могут вносить вклад в компенсацию прибавки массы тела у крысят OXYS в неонатальном периоде. Исследования с использованием ЭТ и кросс-фостеринга показали, что генотип приемной матери влияет на массу тела потомства как во время беременности, так и в раннем постнатальном периоде (Kurnianto et al., 1998; Rhees et al., 1999; Lee, Azar, 2010). Степень материнского влияния зависит от физиологических особенностей приемной матери. Наблюдаемое увеличение массы тела потомков крыс OXYS, рожденных и выращенных гибридными самками, может быть связано с особенностями беременности гибридных самок крыс, способствующими росту плода и плаценты (Matthews, Peel, 1991). Гибридные матери оказали наибольшее влияние на увеличение массы тела потомков, что, вероятно, обусловлено усиленным транспортом питательных веществ во время беременности и периода лактации. Об аналогичных эффектах гибридных матерей на прибавку в массе потомков ISIAH, полученных после ЭТ, сообщалось нами ранее (Igonina et al., 2019).
Изменение материнской среды повлияло на такой показатель общего развития, как открытие глаз у потомков. Крысята OXYS, рожденные и выращенные как самками Wistar, так и гибридными матерями, открывали глаза раньше, чем в контроле. Время открытия глаз – важный показатель общего развития и, в частности, созревания мозга (Yoshii, Sheng, 2003; Heinen et al., 2004). Еще одним важным показателем развития в неонатальном периоде является поддержание зрелой позы, которая формировалась быстрее у детенышей OXYS, рожденных и воспитанных матерями Wistar, по сравнению с естественно зачатыми крысятами OXYS, выращенными их биологическими матерями. Зрелость позы демонстрирует как уровень развития мышц, так и их нервно-мышечной иннервации, а также степень развития мозговых центров, участвующих в регуляции локомоции (Geisler et al., 1993).
Кроме того, материнская среда влияла на развитие некоторых рефлексов в течение первых трех недель постнатальной жизни у детенышей OXYS. Крысята OXYS, рожденные и выращенные гибридными самками, раньше демонстрируют зрелость реакции избегания края и отрицательного геотаксиса по сравнению с контрольной группой. Аналогичным образом детеныши, рожденные и выращенные самками Wistar, уже на Д10 показывали сформированную реакцию отрицательного геотаксиса по сравнению с контрольными животными. Изученные рефлексы считаются индикаторами общего развития и созревания головного мозга, поскольку их выполнение связано с вовлечением различных областей центральной нервной системы (Gouveia et al., 2019). Ранее было показано, что развитие рефлексов у интактных детенышей OXYS замедлено по сравнению с крысятами контрольной линии WAG (Igonina et al., 2018). Настоящее исследование демонстрирует ускоренное созревание некоторых рефлексов у крысят OXYS, рожденных и воспитанных суррогатными матерями, как гибридными, так и Wistar, по сравнению с крысятами, рожденными и воспитанными собственными биологическими матерями.
Как известно, беременность и ранний постнатальный период считаются критическими в онтогенезе млекопитающих из-за быстрой пролиферации клеток, активного развития органов и физиологических систем. Замена материнской среды является одним из возможных факторов, влияющих на программу развития. Эксперименты по ЭТ, проведенные на крысах с гипертонией, подтверждают важность материнской среды как во время беременности, так и в период лактации. Было показано, что гипертензия и повреждение почек, которые характерны для линии SS (Dahl salt-sensitive rats), могут быть ослаблены или замедлены у крысят, рожденных в результате применения ЭТ (Kubisch et al., 1998; 1999). Исследователи пришли к выводу, что внутриматочная материнская среда, но не лактация играет решающую роль для проявления генетической предрасположенности к гипертензии у полученного потомства крыс SS. Точно так же ЭТ от крыс со спонтанной гипертензией SHR самкам нормотензивной линии WKY привел к значительному снижению артериального давления у потомков (Lee, Azar, 2010). В другом исследовании было показано, что материнский внутриутробный и лактационный периоды у SHR критически важны для повышения артериального давления у крыс этой линии, но не влияют на данный параметр у линии WKY (Di Nicolantonio et al., 2006). В нашем предыдущем исследовании было продемонстрировано небольшое ускорение созревания неонатальных рефлексов у потомства гипертензивной линии ISIAH, рожденного и воспитанного гибридными крысами, что, вероятно, также было связано с материнскими эффектами (Igonina et al., 2019).
Помимо материнской среды, сама процедура ЭТ также может влиять на развитие потомства, поскольку связана с хирургическим вмешательством. Ранее было показано, что хирургическое вмешательство, используемое для ЭТ у мышей, оказывает долгосрочное влияние на поведение потомства (Lerch et al., 2016). Более того, самки, рожденные после ЭТ, имели более низкую массу тела и повышенный уровень кортикостерона по сравнению с самцами, что свидетельствует о гендерных различиях (Lerch et al., 2016). Однако в нашем недавнем исследовании на крысах ISIAH было показано, что как ложная операция, имитирующая ЭТ, так и сам ЭТ несколько ускоряет раннее постнатальное развитие потомства (Igonina et al., 2019; Rozhkova et al., 2020). Эти результаты могут указывать на то, что хирургическое вмешательство на ранних сроках беременности, связанное с ЭТ, не является негативным фактором для развития нервной системы потомства. Представленные в данной работе результаты на крысах OXYS подтверждают эти более ранние наблюдения.
Наши результаты показали значительное влияние ЭТ на плотность нейронов в неонатальном периоде OXYS в CA1-, CA3- и DG-областях гиппокампа, но не в CA2-области и не в префронтальной коре. Пирамидный слой гиппокампа у новорожденных крысят состоит из 6–10 рядов нейронов, с возрастом он истончается, а у взрослых крыс он состоит из 2–3 рядов (Altman, Bayer, 1990). После рождения наблюдается рост числа не только пирамидных клеток, но и гранулярных нейронов в DG-области гиппокампа (Altman, Bayer, 1975). Число нейронов в гиппокампе удваивается в течение первой постнатальной недели, а затем снижается на 70% в течение второй недели жизни, одновременно с глиогенезом, и, следовательно, плотность нейронов снижается (Bandeira et al., 2009). Обнаруженное в нашем исследовании снижение плотности в CA1-, CA3- и DG-областях гиппокампа, сопровождающееся более активным общим развитием у детенышей OXYS, рожденных и воспитанных гибридными самками, является показателем ускоренного созревания мозга. Также более активное развитие мозга было обнаружено у крысят OXYS, рожденных и воспитанных самками Wistar, поскольку эти детеныши имели меньшую плотность нейронов в СА3-области гиппокампа и упомянутое выше ускорение созревания рефлексов. Таким образом, потомство, рожденное после ЭТ, характеризуется более быстрым созреванием гиппокампа в обоих случаях, но в основном при использовании гибридных приемных матерей, что подтверждает роль материнского фактора в механизмах программирования развития нервной системы в неонатальном онтогенезе.
Гиппокамп является одной из ключевых областей мозга, участвующих в когнитивной функции. Эта структура особенно подвержена влиянию стресса в раннем онтогенезе; неблагоприятный опыт в раннем возрасте влияет на регуляцию нейрогенеза в DG-зоне (Mirescu et al., 2004). Процедуру ЭТ, использованную в данном исследовании, можно рассматривать как стрессовое воздействие на мать, в частности, из-за хирургического вмешательства.
В нашем предыдущем исследовании на крысах ISIAH было показано, что хирургическое вмешательство, используемое для ЭТ, приводило к повышению уровня кортикостерона у беременных самок и оказало долгосрочное влияние на гиппокамп у взрослого потомства (Rozhkova et al., 2020). В другом исследовании, проведенном на крысах OXYS, изучали эффекты хирургического вмешательства на ранних сроках беременности, и было продемонстрировано снижение плотности пирамидных нейронов в префронтальной коре, CA1- и CA3-областях гиппокампа, а также повышение уровня нейрогенеза в DG у взрослых потомков (Рожкова и др., 2019). Все эти наблюдения указывают на то, что обнаруженные нами изменения мозга потомков, рожденных в результате ЭТ, могут быть связаны с пренатальным хирургическим стрессом.
С другой стороны, собственно материнская среда также может оказывать значительное влияние на развитие гиппокампа. Известно, что уровень материнской заботы влияет на число нейронов в гиппокампе крыс (Liu et al., 2000; Weaver et al., 2002; Bredy et al., 2003). Крысята из потомства тех матерей, которые демонстрируют высокую материнскую заботу, в частности, увеличенную частоту облизывания и вскармливания в течение первой недели после рождения, имели повышенную экспрессию рецептора NMDA и нейротрофического фактора головного мозга (BDNF), усиление холинергической иннервации гиппокампа и обладали лучшей памятью и высокими способностями к пространственному обучению (Liu et al., 2000).
В другой работе было показано, что повышенная забота матери может влиять на пролиферацию клеток и сохранение нейронов в гиппокампе у крыс (Bredy et al., 2003). У потомков из выводков матерей с низким уровнем заботы, напротив, было показано повышение уровня апоптоза и потенциальной потери нейронов в гиппокампе (Weaver et al., 2002).
ЗАКЛЮЧЕНИЕ
В данном исследовании потомство крыс линии OXYS подвергали воздействию комбинации двух факторов, сопряженных с ЭТ: дородовому хирургическому стрессу и замене материнской среды. Оба фактора могут быть причиной обнаруженных в данном исследовании изменений в скорости созревания рефлексов и снижения плотности нейронов в различных областях гиппокампа у потомков, которые можно характеризовать как ускорение развития центральной нервной системы в неонатальном онтогенезе.
Крысы OXYS обладают характерным фенотипом преждевременного старения с ранним проявлением возрастных нарушений, включая патологию, подобную болезни Альцгеймера (Korbolina et al., 2016). У крыс этой линии в раннем возрасте была обнаружена задержка развития гиппокампа, которая может оказывать долгосрочное воздействие, тем самым способствуя нейродегенеративным процессам в более позднем возрасте (Igonina et al., 2018; Rudnitskaya et al., 2019). Результаты настоящего исследования показали, что замена матерей OXYS на суррогатных привела к более быстрому развитию рефлексов и созреванию гиппокампа у потомства. Наши данные свидетельствуют о том, что задержка в развитии нервной системы в раннем постнатальном периоде, характерная для крыс OXYS, определяется, по крайней мере частично, влиянием материнской среды.
Список литературы
Раннева С.В., Брусенцев Е.Ю., Игонина Т.Н., Рагаева Д.С., Рожкова И.Н., Ершов Н.И., Левинсон А.Л., Амстиславский С.Я. Влияние культивирования эмбрионов на онтогенез потомства у млекопитающих. Онтогенез. 2020. 51 (6): 417–439. https://doi.org/10.31857/S0475145020060075
Рожкова И.Н., Брусенцев Е.Ю., Игонина Т.Н., Рагаева Д.С., Петрова О.М., Напримеров В.А., Тихонова М.А., Амстиславская Т.Г., Амстиславский С.Я. Отсроченные эффекты хирургического воздействия в период ранней беременности на развитие мозга у крыс линии OXYS. ЖВНД. 2019. 69 (5): 618–628. https://doi.org/10.1134/S0044467719050101
Aljahdali A., Airina R.K.R.I., Velazquez M.A., Sheth B., Wallen K., Osmond C., Watkins A.J., Eckert J.J., Smyth N.R., Fleming T.P. The duration of embryo culture after mouse IVF differentially affects cardiovascular and metabolic health in male offspring. Hum. Reprod. 2020. 35 (11): 2497–2514. https://doi.org/10.1093/humrep/deaa205
Altman J., Bayer S.A. Prolonged sojourn of developing pyramidal cells in the intermediate zone of the hippocampus and their settling in the stratum pyramidale. J. Compar. Neurol. 1990. 301 (3): 343–364. https://doi.org/10.1002/cne.903010303
Altman J., Bayer S. Postnatal development of the hippocampal dentate gyrus under normal and experimental conditions. The hippocampus. Springer US. 1975. P. 95–122. https://doi.org/10.1007/978-1-4684-2976-3_5
Bandeira F., Lent R., Herculano-Houzel S. Changing numbers of neuronal and non-neuronal cells underlie postnatal brain growth in the rat. Proc. Natl. Acad. Sci. USA. 2009. 106 (33): 14108–14113. https://doi.org/10.1073/pnas.0804650106
Barker D.J. The origins of the developmental origins theory. J. Intern. Med. 2007. 261 (5): 412–417. https://doi.org/10.1111/j.1365-2796.2007.01809.x
Berntsen S., Soderstrom-Anttila V., Wennerholm U.B., Laivuori H., Loft A., Oldereid N.B., Romundstad L.B., Bergh C., Pinborg A. The health of children conceived by ART: “the chicken or the egg?” Hum. Reprod. Update. 2019. 25 (2): 137–158. https://doi.org/10.1093/humupd/dmz001
Bredy T.W., Grant R.J., Champagne D.L., Meaney M.J. Maternal care influences neuronal survival in the hippocampus of the rat. Eur. J. Neurosci. 2003. 18 (10): 2903–2909. https://doi.org/10.1111/j.1460-9568.2003.02965.x
Burrell C., Edozien L.C. Surrogacy in modern obstetric practice. Semin. Fetal. Neonatal. Med. 2014. 19 (5): 272–278. https://doi.org/10.1016/j.siny.2014.08.004
Ceelen M., van Weissenbruch M.M., Prein J., Smit J.J., Vermeiden J.P.W., Spreeuwenberg M., van Leeuwen F.E., Delemarre-van de Waal H.A. Growth during infancy and early childhood in relation to blood pressure and body fat measures at age 8–18 years of IVF children and spontaneously conceived controls born to subfertile parents. Hum. Reprod. 2009. 24: 2788–2795. https://doi.org/10.1093/humrep/dep273
Chiossi G., Costantine M.M., Tamayo E., Hankins G.D., Saade G.R., Longo M. Fetal programming of blood pressure in a transgenic mouse model of altered intrauterine environment. J. Physiol. 2016. 594 (23): 7015–7025. https://doi.org/10.1113/JP272602
Dayan N., Lanes A., Walker M.C., Spitzer K.A., Laskin C.A. Effect of chronic hypertension on assisted pregnancy outcomes: A population-based study in Ontario, Canada. Fertil. Steril. 2016. 105: 1003–1009. https://doi.org/10.1016/j.fertnstert.2015.11.039
Di Nicolantonio R., Koutsis K., Westcott K.T., Wlodek M.E. Relative contribution of the prenatal versus postnatal period on development of hypertension and growth rate of the spontaneously hypertensive rat. Clin. Exp. Pharmacol. Physiol. 2006. 33: 9–16. https://doi.org/10.1111/j.1440-1681.2006.04317.x
Ecker D.J., Stein P., Xu Z., Williams C.J., Kopf G.S., Bilker W.B., Abel T., Schultz R.M. Long-term effects of culture of preimplantation mouse embryos on behavior. Proc. Natl. Acad. Sci. USA. 2004. 101 (6): 1595–1600. https://doi.org/10.1073/pnas.0306846101
Fleming T.P., Velazquez M.A., Eckert J.J. Embryos, DOHaD and David Barker. J. Dev. Orig. Health. Dis. 2015. 6: 377–383. https://doi.org/10.1017/S2040174415001105
Geisler H.C., Westerga J., Gramsbergen A. Development of posture in the rat. Act. Neurobiol. Exp. 1993. 53 (4): 517–524.
Gerlinskaya L.A., Litvinova E.A., Kontsevaya G.V., Feofanova N.A., Achasova K.M., Anisimova M.V., Maslennikova S.O., Zolotykh M.A., Moshkin Y.M., Moshkin M.P. Phenotypic variations in transferred progeny due to genotype of surrogate mother. Mol. Hum. Reprod. 2019. 25 (2): 88–99. https://doi.org/10.1093/molehr/gay052
Gleicher N., Kushnir V.A., Weghofer A., Barad D.H. The “graying” of infertility services: An impending revolution nobody is ready for. Reprod. Biol. Endocrinol. 2014. 12: 1–12. https://doi.org/10.1186/1477-7827-12-63
Gouveia H.J.C.B., Manhaes-de-Castro R., Costa-de-Santana B.J.R., Mendonca C.R., Albuquerque G., Visco D.B., Lacerda D.C., Toscano A.E. Maternal exposure to busulfan reduces the cell number in the somatosensory cortex associated with delayed somatic and reflex maturation in neonatal rats. J. Chem. Neuroanat. 2020. 103: 101710. https://doi.org/10.1016/j.jchemneu.2019.101710
Heinen K., Bosman L.W., Spijker S., van Pelt J., Smit A.B., Voorn P., Baker R.E., Brussaard A.B. GABAA receptor maturation in relation to eye opening in the rat visual cortex. Neuroscience. 2004. 124 (1): 161–171. https://doi.org/10.1016/j.neuroscience.2003.11.004
Igonina T.N., Ragaeva D.S., Petrova O.M., Rozkova I.N., Brusentsev E.Y., Amstislavsky S.Y. Effects of in vitro culture at the preimplantation embryo stage on early development and hypertension in ISIAH rats. Hypertens. Pregnancy. 2019. 38 (4): 208–216. https://doi.org/10.1080/10641955.2019.1647232
Igonina T.N., Ragaeva D.S., Tikhonova M.A., Petrova O.M., Herbeck Y.E., Rozhkova I.N., Amstislavskaya T.G., Amstislavsky S.Y. Neurodevelopment and behavior in neonatal OXYS rats with genetically determined accelerated senescence. Brain Res. 2018. 1681: 75–84. https://doi.org/10.1016/j.brainres.2017.12.021
Korbolina E.E., Zhdankina A.A., Fursova A.Z., Kozhevnikova O.S., Kolosova N.G. Genes of susceptibility to early neurodegenerative changes in the rat retina and brain: analysis by means of congenic strains. BMC Genetics. 2016. 17: 153. https://doi.org/10.1186/s12863-016-0461-7
Kubisch H.M., Gomez-Sanchez E.P. Embryo transfer in the rat as a tool to determine genetic components of the gestational environment. Lab. Anim. Sci. 1999. 49: 90–94.
Kubisch H.M., Mathialagan S., Gomez-Sanchez E.P. Modulation of blood pressure in the Dahl SS/Jr rat by embryo transfer. Hypertension. 1998. 31: 540–545. https://doi.org/10.1161/01.hyp.31.1.540
Kurnianto E., Shinjo A., Suga D. Prenatal and postnatal maternal effects on bodyweight in cross-fostering experiment on two subspecies of mice. Exp. Anim. 1998. 47: 97–103. https://doi.org/10.1538/expanim.47.97
La Rovere M., Franzago M., Stuppia L. Epigenetics and neurological disorders in ART. Int. J. Mol. Sci. 2019. 20: 4169. https://doi.org/10.3390/ijms20174169
Lee J.Y., Azar S.H. Wistar-Kyoto and spontaneously hypertensive rat blood pressure after embryo transfer into different wombs and cross-suckling. Exp. Boil. Med. 2010. 235 (11): 1375–1384. https://doi.org/10.1258/ebm.2010.010081
Lerch S., Tolksdorf G., Schutz P., et al. Effects of embryo transfer on emotional behaviors in C57BL/6 mice. J. Am. Assoc. Lab. Anim. Sci. 2016. 55: 510–519.
Liu D., Diorio J., Day J.C., Francis D.D., Meaney M.J. Maternal care, hippocampal synaptogenesis and cognitive development in rats. 2000. Nat. Neurosci. 3: 799–806. https://doi.org/10.1038/77702
Mainigi M., Rosenzweig J.M., Lei J., Mensah V., Thomaier L., Talbot Jr C.C., Olalere D., Ord T., Rozzah R., Johnston M.V., Burd I. Peri-implantation hormonal milieu: elucidating mechanisms of adverse neurodevelopmental outcomes. Reprod. Sci. 2016. 23 (6): 785–794. https://doi.org/10.1177/1933719115618280
Markus E.J., Petit T.L. Neocortical synaptogenesis, aging, and behavior: lifespan development in the motor-sensory system of the rat. Exp. Neurol. 1987. 96 (2): 262–278. https://doi.org/10.1016/0014-4886(87)90045-8
Matthews J., Peel S. The uterine response in pregnant inbred and non-inbred rats. J. Anat. 1991. 178: 101–113.
Meister T.A., Rimoldi S.F., Soria R., von Arx R., Messerli F.H., Sartori C., et al. Association of assisted reproductive technologies with arterial hypertension during adolescence. J. Am. Coll. Cardiol. 2018. 72: 1267–1274. https://doi.org/10.1016/j.jacc.2018.06.060
Mirescu C., Peters J.D., Gould E. Early life experience alters response of adult neurogenesis to stress. Nat. Neurosci. 2004. 7 (8): 841–846. https://doi.org/10.1038/nn1290
Nguyen A.T., Armstrong E.A., Yager J.Y. Neurodevelopmental reflex testing in neonatal rat pups. JoVE. 2017. 122: e55261. https://doi.org/10.3791/55261
Pontesilli M., Painter R.C., Grooten I.J., Van Der Post J.A., Mol B.W., Vrijkotte T.G.M., Repping S., Roseboom T.J. Subfertility and assisted reproduction techniques are associated with poorer cardiometabolic profiles in childhood. Reprod. Biomed. Online. 2015. 30: 258–267. https://doi.org/10.1016/j.rbmo.2014.11.006
Ramos-Ibeas P., Heras S., Gomez-Redondo I., Planells B., Fernandez-Gonzalez R., Pericuesta E., Laguna-Barraza R., Perez-Cerezales S., Gutierrez-Adan A. Embryo responses to stress induced by assisted reproductive technologies. Mol. Reprod. Dev. 2019. 86 (10): 1292–1306. https://doi.org/10.1002/mrd.23119
Rhees B.K., Ernst C.A., Miao C.H., Atchley W.R. Uterine and postnatal maternal effects in mice selected for differential rate of early development. Genetics. 1999. 153: 905–917. https://doi.org/10.1093/genetics/153.2.905
Rivera R.M., Stein P., Weaver J.R., Mager J., Schultz R.M., Bartolomei M.S. Manipulations of mouse embryos prior to implantation result in aberrant expression of imprinted genes on day 9.5 of development. Hum. Mol. Genet. 2008. 17 (1): 1–14. https://doi.org/10.1093/hmg/ddm280
Rozhkova I., Brusentsev E., Igonina T., Ragaeva D., Petrova O., Tikhonova M., Akopyan A., Amstislavskaya T., Antonov Ye., Amstislavsky S. Sham surgical embryo transfer affects offspring neurodevelopment and manifestation of hypertensive phenotype in ISIAH rats. Hypertens. Pregnancy. 2020. 39 (3): 283–294. https://doi.org/10.1080/10641955.2020.1762894
Rudnitskaya E.A., Kozlova T.A., Burnyasheva A.O., Kolosova N.G., Stefanova N.A. Alterations of hippocampal neurogenesis during development of Alzheimer’s disease-like pathology in OXYS rats. Exp. Gerontol. 2019. 115: 32–45. https://doi.org/10.1016/j.exger.2018.11.008
Rumbold A.R., Moore V.M., Whitrow M.J., Oswald T.K., Moran L.J., Fernandez R.C., et al. The impact of specific fertility treatments on cognitive development in childhood and adolescence: a systematic review. Hum. Reprod. 2017. 32: 1489–1507. https://doi.org/10.1093/humrep/dex085
Scherrer U., Rexhaj E., Allemann Y., Sartori C., Rimoldi S.F. Cardiovascular dysfunction in children conceived by assisted reproductive technologies. Eur. Heart. J. 2015. 36: 1583–1589. https://doi.org/10.1093/eurheartj/ehv145
Sunde A. Embryo culture and phenotype of the offspring. In Vitro Fertilization. 2019. 877–889. https://doi.org/10.1007/978-3-319-43011-9_74
Telegina D.V., Suvorov G.K., Kozhevnikova O.S., Kolosova N.G. Mechanisms of neuronal death in the cerebral cortex during aging and development of Alzheimer’s disease-like pathology in rats. Int. J. Mol. Sci. 2019. 20 (22): E5632. https://doi.org/10.3390/ijms20225632
Weaver I.C., Grant R.J., Meaney M.J. Maternal behavior regulates long-term hippocampal expression of BAX and apoptosis in the offspring. J. Neurochem. 2002. 82 (4): 998–1002. https://doi.org/10.1046/j.1471-4159.2002.01054.x
Yoshii A., Sheng M.H., Constantine-Paton M. Eye opening induces a rapid dendritic localization of PSD-95 in central visual neurons. Proc. Nat. Acad. Sci. 2003. 100 (3): 1334–1339. https://doi.org/10.1093/eurheartj/ehv145
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


