Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 1, стр. 87-99
Предпосылки и особенности использования воображения движения и интерфейса мозг-компьютер в реабилитации при детском церебральном параличе
И. Р. Федотова 1, П. Д. Бобров 1, 2, *
1 Институт высшей нервной деятельности и нейрофизиологии Российской академии наук
Москва, Россия
2 Российский Национальный Исследовательский Медицинский Университет им. Н.И. Пирогова
Москва, Россия
* E-mail: bobrov.pavel@ihna.ru
Поступила в редакцию 07.04.2021
После доработки 27.05.2021
Принята к публикации 05.10.2021
- EDN: WMPLQU
- DOI: 10.31857/S004446772201004X
Аннотация
В работе приводится анализ литературы, посвященной различным аспектам применения воображения движений и технологии “интерфейс мозг-компьютер” в реабилитации детей с диагнозом ДЦП. Дается описание компенсаторных механизмов восстановления двигательной функции при повреждении областей моторной сети мозга в раннем периоде жизни. Описываются способы объективного контроля способности детей к воображению движений, обоснование возможности тренировки воображения движений у детей с ДЦП, в частности, с применением ИМК, а также возможные факторы, затрудняющие реализацию ИМК у детей с ДЦП. Приводятся результаты клинических исследований эффективности ИМК в реабилитации при ДЦП. Несмотря на то что число работ в рассмотренной области достаточно ограниченно, результаты рассмотренных исследований позволяют сделать вывод о том, что тренировка воображения движений с помощью ИМК потенциально применима в реабилитации детей с ДЦП и может быть достаточно эффективной.
ВВЕДЕНИЕ
Детский церебральный паралич (ДЦП) – это гетерогенная группа нарушений движения и осанки, связанных с непрогрессирующим повреждением головного мозга, которое произошло на ранних этапах развития ребенка (внутриутробный период и первые 2 года жизни). Европейская клиническая классификация ДЦП (SCPE, 2000) выделяет: 1) спастический паралич: односторонний (гемиплегия), двусторонний (диплегия, квадриплегия); 2) дискинетический; 3) атаксический (Айкарди и др., 2013).
Как правило, ДЦП сопровождается широким классом достаточно серьезных сенсорных нарушений, иногда может наблюдаться умственная отсталость, эпилепсия (Kułak, Sobaniec, 2003; Kułak, Sobaniec, 2004; Mutch et al., 1992), т.е. патология затрагивает не только двигательную систему. Хотя классификация ДЦП сфокусирована на моторных симптомах, это состояние часто сопровождается нарушением познавательной способности, внимания, социального поведения, психоневрологическими нарушениями (Fennell, Dikel, 2001; Odding et al., 2006; Straub, Obrzut, 2009), серьезными нарушениями восприятия собственного и чужого тела (Frassinetti et al., 2012).
Для того чтобы оценить степень и локализацию поражения, а также пластические изменения в мозге при реабилитации и восстановлении у детей с ДЦП, используются стандартные функциональные и структурные методы нейровизуализации. Функциональные методы используют анализ нейрофизиологических сигналов, регистрируемых при помощи электроэнцефалографии (ЭЭГ), магнитоэнцефалографии (МЭГ) или других показателей нейронной активности, таких как изменение концентрации окисленного и неокисленного гемоглобина, регистрируемое при помощи функциональной магнитно-резонансной томографии (фМРТ) или спектроскопии в ближнем инфракрасном диапазоне (БИКС). Пластичность может оцениваться также по изменениям в структурных МРТ-изображениях кортикальной мантии или волокон белого вещества при использовании диффузионной тензорной визуализации и трактографии (Reid et al., 2015). Для проверки состояния моторного выхода используется транскраниальная магнитная стимуляция (ТМС) (de Almeida Carvalho Duarteet al., 2017).
Помимо исследования пластических изменений в ходе восстановления двигательной функции, с практической точки зрения важно понять, какие методики восстановления движения могут быть эффективны в случае ДЦП. В последнее время появились работы, показывающие, что одной из таких методик может быть тренировка с использованием интерфейсов “мозг-компьютер” (ИМК) – систем, в основе которых лежит классификация регистрируемой активности мозга, что позволяет подкреплять активное решение различных когнитивных задач или воображение различных движений при помощи зрительной, слуховой, тактильной или проприоцептивной обратной связи.
Поэтому целью данной работы было обоснование возможности использования ИМК для восстановления двигательной функции у детей с ДЦП. Задачами работы были: описание возможных механизмов компенсации двигательных нарушений при ДЦП, оценка по литературным данным способности здоровых детей и детей с ДЦП к кинестетическому воображению движений, а также анализ работ, касающихся применения ИМК в реабилитации людей с диагнозом ДЦП.
НАРУШЕНИЯ И ИХ КОМПЕНСАЦИЯ ПРИ ДЦП
Разрушения, происшедшие в мозге на ранних этапах развития ребенка и приведшие к ДЦП, с течением времени могут частично компенсироваться.
Рассмотрим компенсаторные возможности на примере первичных моторных областей. При различных видах ДЦП часто наблюдается та или иная степень разрушения первичной моторной области и кортикально-спинальных проводящих путей как с одной стороны, так иногда и с обеих сторон (de Almeida Carvalho Duarte et al., 2017). Подобные нарушения кортико-спинальной проводимости могут компенсироваться за счет прорастания аксонов. Так, в работе (Carr et al., 1993) было показано образование новых моторных путей на ранних этапах развития от неповрежденной ипсилатеральной моторной коры к паретичной руке в случае одностороннего пареза. Корко-спинномозговые аксоны с ипсилатеральной стороны при этом аномально разветвлялись и проецировались в гомологичные пулы двигательных нейронов с обеих сторон спинного мозга. Компенсаторное прорастание аксонов было продемонстрировано при различных видах ДЦП: гемиплегии (Carr et al., 1993; Wittenberg, 2009), спастической диплегии (Maegaki et al., 1999; Wittenberg, 2009), атетоидном двустороннем ДЦП (Maegaki et al., 1999).
Компенсация пораженного полушария может происходить как за счет формирования моторных проекций, ипсилатеральных по отношению к пораженной руке, так и смещения контралатерального моторного представительства пораженной руки, т.е. изменения топографии ее представительства (Basu et al., 2010; de Almeida Carvalho Duarte et al., 2017; Maegaki et al., 1999).
В зависимости от тяжести поражения, от того, является ли оно односторонним или двусторонним, от асимметрии двустороннего поражения, могут наблюдаться различные варианты таких компенсаций (de Almeida Carvalho Duarte et al., 2017; Staudt et al., 2002; Thickbroom et al., 2001). В результате пораженная рука может иметь как представительство в обоих полушариях, так и только в ипсилатеральном полушарии в случае серьезного повреждения контралатерального. При этом афферентная сенсорная проекция от пораженной руки была найдена только в пораженном полушарии (Thickbroom et al., 2001). Из-за этого, по всей видимости, может создаваться ситуация межполушарной диссоциации, что, в свою очередь, может быть также причиной двигательных расстройств ввиду нарушения сенсомоторной интеграции.
Что касается областей двигательной сети, отличных от первичных моторных, то в ряде работ была обнаружена большая активация некоторых из них при выполнении моторных задач у детей с ДЦП по сравнению со здоровыми детьми. Так, в работе (Shin et al., 2012) при помощи анализа степени синхронизации и десинхронизации ритмов ЭЭГ на разных отведениях было показано, что выполнение и кинестетическое воображение движения вызывает повышенную активацию премоторной коры и дополнительной моторной области у детей с ДЦП по сравнению со здоровыми детьми. При этом увеличение тяжести ДЦП сопровождалось увеличением вовлеченности этих областей. В обзоре (de Almeida Carvalho Duarte et al., 2017) также отмечается стабильная активация указанных областей у детей с ДЦП во время выполнения как активных, так и пассивных движений поврежденной конечностью. Для взрослых людей, перенесших инсульт, считается, что повышенная активация этих областей говорит об их компенсаторной роли при нарушении нормальной работы двигательной сети (Rehme et al., 2012). Похоже, что это верно и в случае детей с ДЦП.
В случае, когда указанные области пострадали в результате поражения, имеются данные о компенсаторной активации сохранных гомологичных областей. Так, при помощи фМРТ и ТМС у детей с ДЦП наблюдалась активация премоторной коры, ипсилатеральной пораженной руке, при произвольном движении этой рукой (Staudt et al., 2002). Также, по данным фМРТ, у взрослых испытуемых с неонатальным параличом плечевого сплетения наблюдалась повышенная активация ипсилатеральной премоторной области по сравнению со здоровыми испытуемыми во время воображения сгибания пораженной руки (Anguelova et al., 2017). При этом в целом активность коры у этих пациентов была значительно выше по сравнению со здоровыми испытуемыми во время воображения сгибания руки, и она увеличивалась в зависимости от степени поражения и мышечной слабости. Кроме того, по данным ЭЭГ в задаче кинестетического воображения или совершения движений у детей с ДЦП наблюдалась более обширная активация коры по сравнению с фокальной активацией у здоровых детей (Shin et al., 2012).
Все эти данные хорошо согласуются с результатами исследований, в которых изучалась активация мозга во время выполнения и воображения движения у взрослых постинсультных больных с гемиплегией (Jang et al., 2005; Kimberley et al., 2006; Rehme et al., 2012).
Таким образом, выше описаны свидетельства различных компенсаций с целью восстановления утраченных функций у детей с ДЦП, которые в общих чертах сходны с компенсаторными процессами, наблюдаемыми у пациентов после инсульта, с той, возможно, разницей, что при поражениях мозга в начале развития в случае ДЦП компенсаторные возможности шире. Можно предположить, что у детей с ДЦП при поражении различных областей коры, участвующих в двигательных задачах, по аналогии с первичной моторной областью возможна компенсация их утраченных функций за счет включения в работу гомологичных областей другого полушария, как это было показано в случае инсульта (Caria et al., 2011; Ono et al., 2015; Ramos-Murguialday et al., 2013). Тогда вовлечение полушария, ипсилатерального пораженной конечности, областей в нем, гомологичных пораженным контралатеральным областям, а также усиленное вовлечение сохранных областей моторной сети для выполнения двигательных задач – это общее в компенсаторных моментах в случае инсульта и ДЦП.
Одним из широко применяемых методов восстановления движения после инсульта является кинестетическое воображение движений (Мокиенко и др., 2013). Далее под воображением движения, если его тип не указан явно, подразумевается именно кинестетическое воображение. Обоснованием для попыток применения тренировки с воображением движений у людей с теми или иными повреждениями мозга, приведшими к двигательной недостаточности, является факт участия одних и тех же областей в организации движения при его выполнении и при кинестетическом воображении, за исключением лишь моторного выхода, который в последнем случае тормозится (Grezes, Decety, 2001; Hétu et al., 2013). Следовательно, можно пытаться восстановить активацию всей последовательности используемых в двигательных задачах областей без реального движения, что особенно актуально в случае, когда выполнение движения сильно затруднено или невозможно. Например, кинестетическое воображение применялось для восстановления двигательной функции у детей с нарушением координации движений (Wilson et al., 2016; Wilson et al., 2002), что позволяет предположить успешность применения его у детей и с другими двигательными нарушениями.
К настоящему моменту была показана клиническая эффективность тренировок воображения движений с использованием интерфейса “мозг-компьютер” при восстановлении двигательной функции у постинсультных больных (Ang et al., 2015; Ang et al., 2011; Bai et al., 2020; Frolov et al., 2017b; Ono et al., 2014; Ramos-Murguialday et al., 2013; Кондур и др., 2018). Однако, как будет показано ниже, в случае детей с ДЦП применение подобной тренировки требует дополнительного учета ряда факторов по сравнению со здоровыми взрослыми, а также со взрослыми пациентами после инсульта. Вопросы, которые при этом встают в первую очередь, – это: в каком возрасте ребенок способен к кинестетическому воображению, насколько нарушена эта функция у детей с ДЦП и каковы возможные методические и технические сложности применения у них этого подхода.
ВОЗМОЖНОСТЬ ПРИМЕНЕНИЯ ВООБРАЖЕНИЯ ДВИЖЕНИЯ ДЛЯ РЕАБИЛИТАЦИИ ДЕТЕЙ С ДЦП
Распространенным методом проверки, способен ли человек воображать движение, является задача Парсонса Hand Laterality Judgment (HLJ) (Parsons, 1994). В этой задаче необходимо судить о латеральности предоставляемых изображений кистей рук как можно быстрее, определяя, изображена левая или правая рука. Другой распространенной парадигмой тестирования данной способности является задача ментальной хронометрии. В ней участник проинструктирован выполнить простое движение и после этого кинестетически представить выполнение того же самого движения с подачей сигнала об окончании воображения.
Как отмечается в обзоре (Spruijt et al., 2015), в ряде работ с использованием указанных методик было установлено, что дети с нормальным развитием в возрасте от 5 до 7 лет уже способны к воображению движений. Эта способность улучшается у детей с нормальным развитием в период от 5 до 12 лет (Caeyenberghs et al., 2009a; Caeyenberghs et al., 2009b; Funk et al., 2005; Molina et al., 2008). Авторы обзорного исследования (Spruijt et al., 2015) пришли к выводу, что тренировка c воображением движений является потенциально возможным методом детской реабилитации начиная с 5 лет, а с 10 лет этот метод можно применять более эффективно.
Подобные тренировки в таком возрасте как у здоровых детей, так и у детей с ДЦП должны проводиться в контексте, который имеет значение для ребенка. Кроме того, продолжительность внимания у маленьких детей ограничена. По причине большей утомляемости, чем у взрослых, а также возможных проблем с рабочей памятью, особенно у детей с ДЦП (Jenks et al., 2009), необходимо применение коротких тренировочных сессий. Ребенок не должен быть перегружен инструкциями, как это имеет место у взрослых, желательно, чтобы обучение проводилось более скрыто, в игровой форме.
Трудности, которые испытывают дети с ДЦП при выполнении движений, не сводятся только к непосредственной сложности физического движения на последнем этапе работы мышц. Как отмечалось выше, ДЦП является следствием ранних повреждений мозга, при которых нарушения носят гораздо более широкий характер. В связи с этим в работе (Ferrari, 2019) были рассмотрены возможные источники ошибок у детей с ДЦП в задаче выполнения движения. Согласно этой работе, у ребенка с ДЦП могут быть выявлены как минимум шесть различных источников ошибок. Для эффективного реабилитационного вмешательства необходимо признать и оценить роль каждой из них. В статье представлена идеомоторная модель составляющих движения с тем, чтобы выявить, на каких этапах могут возникнуть сбои и ошибки, приводящие к дефициту движения у больных ДЦП.
У детей с ДЦП нарушения касаются практически всех составляющих идеомоторной модели. Нарушена мотивация, больные испытывают меньше удовольствия от перемещения, чем здоровые, нарушена способность к воображению движений (см. ниже), нарушены кортикальные механизмы планирования и осознания движения в целом, причем это касается и сохранной руки при одностороннем парезе. При ДЦП может нарушаться способность инициировать, направлять и завершать действие как с временной, так и с пространственной точек зрения. Субъект плохо умеет организовать действие, координировать относительные элементарные движения. Далее, при ДЦП существуют колоссальные изменения опорно-двигательного аппарата: костей, мышц, связок, присутствует диспропорция его частей. Если, условно, дать такой опорно-двигательный аппарат здоровому ребенку, то он не сможет с ним правильно выполнять движения. Существуют ошибки сравнения результата действия с ожиданием. У детей с ДЦП нарушена и сенсорная система восприятия результата движения: нарушены и проприорецепторы, и центральные механизмы. У них плохая интеграция между намерением движения и зрительной и проприоцептивной информацией, связанной с совершенным действием, и это может представлять собой важное функциональное расстройство. Авторы статьи еще раз подчеркнули, что ДЦП – системная патология, происходящая из поражения головного мозга.
Таким образом, источников двигательных ошибок у детей с ДЦП много, даже по сравнению с постинсультными больными. И тренировать в процессе реабилитации, по всей видимости, необходимо все системы, ответственные за движение, работа которых нарушена и приводит к ошибкам. Возможное нарушение кинестетического воображения движений у детей с ДЦП является лишь одним из перечисленных выше нарушений, над ликвидацией которого надо работать в процессе реабилитации таких детей.
НАРУШЕНИЕ СПОСОБНОСТИ К ВООБРАЖЕНИЮ ДВИЖЕНИЯ У ДЕТЕЙ С ДЦП
Как отмечалось в предыдущем разделе, основными методами оценки способности к воображению движений являются задача HLJ и ментальная хронометрия. Предполагается, что в задаче HLJ участники мысленно вращают собственную руку, сопоставляя ее положение с увиденной картинкой. При этом время вращения должно увеличиваться для изображений рук, которые повернуты ладонями наружу, а не внутрь. Парсонс (Parsons, 1994) предположил, что длительное время реакции для повернутых наружу рук отражает биомеханические ограничения, возникающие при мысленном вращении собственной руки в соответствии с предъявленным изображением руки. Если время вращения действительно увеличивается, то считается, что пациенты совершают кинестетическую ментальную ротацию собственной руки для решения задачи HLJ (Daprati et al., 2010; Shenton et al., 2004). Напротив, отсутствие различия во времени вращения для двух различных положений рук указывает на то, что участники не используют стратегию воображения движения для решения задачи о латеральности кисти (Steenbergen et al., 2013).
Часто при тестировании с помощью HLJ участнику не даются конкретные инструкции о способе решения задачи, конкретные команды представлять движение своей руки (Spruijt et al., 2015), поэтому в данном случае говорят о неявном воображении движений.
Однако исследования (Lust et al., 2016; Spruijt et al., 2013) показали, что неявные задачи, такие как HLJ, все же не являются абсолютно подходящими для оценки способности к воображению движения у пациентов с ДЦП, поскольку пациенты могут использовать альтернативные стратегии, например, визуальную, т.е. вращение руки, воображаемое с точки зрения третьего лица, или применять абстрактное правило для вынесения суждения о латеральности.
Задачу кинестетического воображения для пациентов можно сделать явной при помощи ментальной хронометрии. В ней участники проинструктированы выполнить простое движение и после этого кинестетически представить, что они выполняют то же самое движение. Высокое соответствие между продолжительностью фактического и воображаемого движения, окончание которого сигнализируется самим участником исследования, принимается как свидетельство способности испытуемых к кинестетическому воображению движения (Choudhury et al., 2007; Decety, Jeannerod, 1995). В этой задаче тестируется другой тип воображения движения, а именно явное. Исследования, использующие задачу ментальной хронометрии, показали, что способность здоровых детей к явному воображению движений постепенно улучшается, по крайней мере, до 12 лет, о чем свидетельствуют увеличение с возрастом временной конгруэнтности и соблюдение закона Фитца (Caeyenberghs et al., 2009a; Crognier et al., 2013).
В работе (Errante et al., 2019) при использовании задачи ментальной хронометрии было показано, что способность к явному воображению движений у детей с односторонним ДЦП сохранена, о чем свидетельствовала корреляция между продолжительностью фактических и воображаемых движений. Правда, как отмечалось в работе, не все дети с ДЦП продемонстрировали такую хорошую взаимосвязь.
По данным (Lust et al., 2016) дети с односторонним ДЦП демонстрируют затруднения в задачах, которые связаны с использованием неявного воображения движений, в то время как способность к явному воображению у них сохранена (оценено с помощью Praxis Imagery Questionnaire, PIQ). Это согласуется результатами исследований, говорящими, что у детей с ДЦП существуют затруднения при решении задачи HLJ (Steenbergen et al., 2013) и что при решении этой задачи они совершают больше ошибок, чем нормально развивающиеся дети (Souto et al., 2020).
В работе (van Elk et al., 2010) наблюдалось более медленное выполнение задачи HLJ пациентами с гемиплегией по сравнению со здоровыми испытуемыми и при этом с худшими результатами для поврежденной руки. Это сопровождалось снижением негативности, связанной с мысленным вращением (rotation-related negativity, RRN) в париетальных областях, которая была еще и отсрочена у участников с ДЦП по сравнению с участниками контроля. При этом участники с относительно легкими нарушениями показали более выраженный RRN во время вращения, чем участники с более серьезными нарушениями. Считается, что уменьшение амплитуды и увеличение латентности RPN является еще одним свидетельством нарушения механизмов неявного воображения движений у больных с ДЦП.
В обзоре (Di Rienzo et al., 2014) было исследовано влияние нескольких форм повреждения головного мозга на количественные оценки способности к воображению движений. Авторы сделали вывод, что нарушение схемы тела в первую очередь влияет на неявное воображение. Тогда наблюдаемая в работах картина его дефицита может быть истолкована как проблема схемы тела, а не нарушения способности к кинестетическому воображению движения (Di Rienzo et al., 2014).
Результаты (Jongsma et al., 2016) подтверждают, что у детей при одностороннем церебральном параличе неявное воображение движений было нарушено для пораженной руки, в то время как для непораженной сохранялось.
Что касается явного воображения, то, в отличие от работ, приведенных выше, в работе (Iosa et al., 2014) было показано его нарушение у детей с ДЦП. Было обнаружено, что у них существенно страдает кинестетическое воображение ходьбы в задаче ментальной хронометрии.
Изложенные выше данные относительно способности детей с ДЦП к воображению движений касаются одностороннего поражения мозга. Много меньше исследований было относительно этой способности у детей с диплегией. В работе (Butti et al., 2019) продемонстрирована хоть и ухудшенная, но возможность визуального и кинестетического воображения движения у детей со спастической диплегией. По данным (Molina et al., 2015) участники с гемиплегией или диплегией могут использовать явное воображение, когда их просят представить ходьбу к цели, расположенной на небольшом расстоянии. И эта способность ухудшается по сравнению со способностью, наблюдаемой у здоровых участников, когда расстояние увеличивается. В работе (Lust et al., 2016) были получены аналогичные результаты об относительно сохранной способности к воображению движений у детей со спастической диплегией.
Таким образом, из приведенных работ можно сделать вывод, что дети с ДЦП в принципе способны воображать движения, хотя и в меньшей степени по сравнению со здоровыми детьми. Результаты согласуются с мнением Craje´ и соавт. (Craje et al., 2010b) о том, что эта способность не является феноменом “все или ничего”. Явное воображение при этом у них страдает меньше, чем неявное. При воображении движения более поврежденной руки дети с ДЦП сталкиваются с большими трудностями, чем для менее поврежденной, по крайней мере для задачи HLJ, возможно, по причине большего нарушения представления о пораженной части тела. То, что способность к воображению движений у детей с ДЦП частично нарушена, проявляется и в исследованиях по планированию движения (Steenbergen, Gordon, 2006; Steenbergen et al., 2013). В этих работах обнаружено, что при выполнении движения захвата и поворота объекта на заданный угол дети с ДЦП, в отличие от нормально развивающихся детей, не всегда правильно выбирают первоначальный тип захвата, чтобы предотвратить неудобную позу в конце движения. Даже у детей с диплегией способность к кинестетическому воображению сохраняется, хотя и является ухудшенной. Это означает, что терапию, использующую воображение движений, можно пытаться проводить и в этой группе пациентов.
ПРИМЕНЕНИЕ ТРЕНИРОВОК ВООБРАЖЕНИЯ ДВИЖЕНИЯ И ИМК ДЛЯ РЕАБИЛИТАЦИИ БОЛЬНЫХ С ДЦП
Приведенные данные показывают, что применение тренировок кинестетического воображения движений, в частности, с ИМК, для улучшения двигательных функций у детей с ДЦП кажется вполне возможным, подобно тому, как это уже достаточно широко применяется для реабилитации больных после инсульта. Однако работ по применению ИМК, основанного на воображении движений (ИМК-ВД), для реабилитации детей с ДЦП в литературе практически не встречается, а количество работ по применению других видов ИМК (P300, SSVEP и т.д.) и для других целей, например, для коммуникации, у детей с ДЦП также крайне ограничено.
В работе (Taherian et al., 2016) было осуществлено обучение использованию интерфейса “мозг-компьютер” для коммуникации. В статье описан единичный случай успешного обучения с помощью ИМК-ВД правой и левой руки взрослого пациента со спастическим квадраплегическим церебральным параличом. Через шесть недель после обучения участник все еще мог контролировать ИМК и использовать его для ввода предложения на беспроводном устройстве.
Было также показано, что дефицит планирования движения у маленьких детей с односторонним ДЦП можно уменьшить тренировкой с биологической обратной связью (Craje et al., 2010a).
В работе (Daly et al., 2013) была исследована возможность контроля взрослыми испытуемыми с ДЦП над двумя видами ИМК: на основе модуляции сенсомоторного ритма и на основе SSVEP. При этом в случае ИМК, основанного на модуляции сенсомоторного ритма, использовались четыре различные задачи: кинестетическое воображение движения любой руки, кинестетическое воображение движения ног, мысленное выполнение арифметических действий, слово-буквенная ассоциация. Восемь испытуемых с ДЦП из 14 смогли контролировать по крайней мере один из двух видов ИМК со статистически значимым уровнем точности без предварительного обучения (шесть пользователей могли контролировать ИМК, основанный на модуляции ритма, а три – ИМК-SSVEP, один из этих испытуемых мог с равным успехом контролировать оба ИМК). Авторами был сделан вывод, что ИМК могут контролироваться лицами с ДЦП, но необходимо решить многие проблемы, прежде чем будет достигнуто их практическое применение.
В работе (Cabral-Sequeira et al., 2016) было оценено влияние тренировок с воображением движений на обучение в задаче прицеливания пораженной рукой у подростков с односторонним ДЦП. Описанные тренировки приводили к уменьшению времени движения и более прямому перемещению руки к цели, причем у подростков как с правосторонним, так и левосторонним гемипарезом.
Как отмечалось в недавней работе (Errante et al., 2019), использование кинестетического воображения в качестве тренинга может помочь при реабилитации детей с ДЦП. Использование воображения движений вместе с электрофизиологическими методами и шкалами поведения, которые обеспечивают лучшую характеристику пациента, может позволить выбрать тип воображения (явное или неявное) и задачи (простые или сложные действия), более подходящие для персональной тренировки.
Данных о клинической эффективности ИМК-ВД в реабилитации двигательных нарушений у детей с ДЦП не так много. В работе (Kim, Lee, 2016) проводилась функциональная электростимуляция (FES), основанная на ИМК у детей возраста 4–9 лет со спастическим ДЦП. Испытуемые в группе ИМК-FES проходили тренировку шести типов движений, таких как разгибание пальца, разгибание запястья и др., по 30 мин в день, 5 раз в неделю в течение 6 нед. Контрольная группа проходила тренировку движений с электростимуляцией, но без ИМК в течение того же времени. В результате в группе ИМК-FES было отмечено более существенное увеличение степени десинхронизации сенсомоторных ритмов во время воображения движения и рост индекса концентрации внимания, оцененного по показаниям фронтальных ЭЭГ-отведений. К сожалению, авторы не пользовались никакими клиническими шкалами для оценки состояния двигательной функции, что не позволяет сравнить клиническую эффективность примененной методики с другими методами реабилитации.
В работе (Ларина и др., 2019) с участием двух групп детей школьного возраста с ДЦП – основной (30 человек) и контрольной (20 человек) – было показано, что добавление в курс санаторно-курортной реабилитации тренировок с использованием комплекса, включающего экзоскелеты кистей и ИМК-ВД, привело к достоверному снижению спастичности, повышению мышечной силы и улучшению бытовых навыков. Вывод о снижении спастичности в основной группе был сделан на основе достоверного уменьшения баллов модифицированной шкалы Эшворта с 3 [2; 3] до 2 [1; 2] и баллов шкалы Тардье с 3 [2; 3] до 2 [1; 2]. Увеличение мышечной силы для паретичной руки у пациентов основной группы показано при помощи Британской шкалы мышечной силы (MRCS): ее показатель достоверно увеличился с 2.3 [2; 3] до 3 [2; 3]. Бытовые навыки оценивались по модифицированной шкале Френчай, которая показала улучшение с 37 [22.75; 63; 75] до 45 [30; 72.75].
Следует отметить, что на настоящий момент работа (Ларина и др., 2019) представляет наиболее массовое опубликованное клиническое исследование эффективности реабилитационной технологии “ИМК+экзоскелет” у детей с ДЦП, а также является первым в России исследованием с успешным применением ИМК-ВД для реабилитации детей с ДЦП.
В работе (Бобров и др., 2020) с участием 14 детей-пациентов установлено, что применение ИМК-ВД и экзоскелетного комплекса приводит к достоверному улучшению двигательных функций по шкалам ARAT и Fugl-Meyer. Достоверно положительный прирост баллов шкалы Fugl-Meyer, рассчитанный как разница показателей после процедур и до процедур, составил 7 [2; 11] для активных движений руки, 5 [1; 6] для проксимальных отделов и 2.5 [0; 5] для кисти. Достоверно положительный прирост баллов шкалы ARAT составил 7.5 [1; 31] для общей суммы баллов, 1.5 [0; 12] для шарового и 1.5 [0; 8] для цилиндрического захвата. В тесте Джебсена-Тейлора достоверные изменения – уменьшение времени выполнения задания – наблюдались для 3 из 7 задач: имитации кормления (–1 [‒4.13; 0.25] сек.), перестановки легких и тяжелых банок (–1 [–2; 0] с в обоих случаях).
Как отмечалось ранее, существуют различные сложности применения ИМК-ВД у детей c ДЦП: возраст, с которого дети способны к воображению движений, особенности детского развития, возможное нарушение механизмов кинестетического воображения у детей с ДЦП. К перечисленным сложностям применения этого метода у детей можно добавить также технические сложности, связанные с меньшей амплитудой мю-ритма, а также c более слабой десинхронизацией мю-ритма у детей и у детей с ДЦП.
Так, даже у здоровых детей десинхронизация мю-ритма в задачах, связанных с движением, и последующая его синхронизация могут быть менее выражены, чем у подростков и взрослых (Démas et al., 2019). Кроме того, у пациентов с односторонним ДЦП также наблюдается уменьшение выраженности десинхронизации и последующей синхронизации мю-ритма по сравнению со здоровыми испытуемыми (Daly et al., 2014), а также может быть обнаружена нетипичная топография мю-ритма по сравнению со здоровыми испытуемыми того же возраста, вследствие, например, смещения топографии представительства конечности (Basu et al., 2010; de Almeida Carvalho Duarte et al., 2017; Maegaki et al., 1999). Паттерны модуляции еще более вариабельны при двустороннем ДЦП (Démas et al., 2019). Поэтому разработка ИМК для людей с ДЦП и, в частности, для детей с ДЦП может сталкиваться с дополнительными проблемами, помимо тех, которые встречаются при предоставлении ИМК здоровым людям.
В работе (Daly et al., 2014) более детально описаны проблемы применения ИМК, основанного на модуляции сенсомоторных ритмов при воображении движений, у взрослых испытуемых с ДЦП. Пользователи с ДЦП демонстрировали более низкие уровни активации моторной коры во время воображения движений, что выражалось в более низких уровнях подавления мю-ритма и в меньшей функциональной связности.
В работе (Larina et al., 2020), продолжающей исследование (Ларина и др., 2019), был проведен анализ ритмов ЭЭГ в альфа-диапазоне на различных отведениях при управлении экзоскелетным комплексом через ИМК-ВД детьми с ДЦП. Наблюдалась увеличенная активация коры. Также были продемонстрированы различия между детьми с левополушарным и правополушарным поражением в степени реактивности альфа-ритма на париетальных отведениях. Отмечается снижение этих различий в ходе реабилитационных процедур.
В работе (Бобров и др., 2020) при помощи анализа независимых компонент ЭЭГ показано, что для большинства детей с ДЦП источники мю-ритма в первичных сенсомоторных областях имеют топографию, схожую с топографией этих источников у здоровых испытуемых (рис. 1). Эти источники были найдены в 72% записей для полушария, контралатерального менее паретичной руке, и для 64% записей для полушария, контралатерального более паретичной руке. Также отмечается снижение пиковой частоты мю-ритма в пораженном полушарии, что характерно и для постинсультных больных (Frolov et al., 2017a).
Рис. 1.
Топографические карты источников мю-ритма в левом (а) и правом (б) полушарии по данным (Бобров и др., 2020). Карты преобразованы в изображения в градациях серого, более темные области соответствуют электродам с большим вкладом источника в сигнал. Также приводятся спектральные плотности активности данных источников в состоянии покоя (сплошные черные), при воображении раскрытия левой кисти (сплошные светлые линии) и при воображении раскрытия правой кисти (прерывистые черные линии). При усреднении спектральные плотности нормированы на мощность активности в альфа-диапазоне в состоянии покоя.
Fig. 1. Topographic maps of mu-rhythm sources located in the left (a) and right (б) hemisphere according to (Бобров и др., 2020). The maps are converted into grayscale images with darker regions corresponding to the EEG recording sites with greater mu-source contribution into the recorded signal. Also, power spectral densities of the mu-rhythm source activities are shown. Dark solid lines correspond to the resting state, gray solid lines correspond to left hand motor imagery and the dark dotted lines correspond to right hand motor imagery. The PSD’s were divided by alpha band power during the rest, prior to averaging.
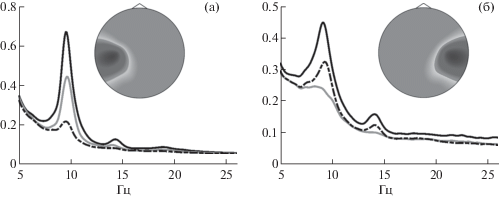
Как отмечается в обзорной работе (Vuckovic et al., 2014), производительность систем ИМК для людей с неврологическими проблемами заметно ниже производительности аналогичных систем, протестированных на здоровых людях. Обзор охватывает исследования по пяти различным группам пациентов: инсульт, повреждение спинного мозга, аутизм, церебральный паралич и боковой амиотрофический склероз, в которых пытались применять ИМК с целью двигательной реабилитации или коммуникации пациентов. Общим знаменателем для всех этих групп пациентов является то, что они страдают от неврологического дефицита и, как следствие, системы ИМК при этом работают с сигналами, которые могут быть существенно изменены по сравнению с сигналами, полученными у здоровых людей. Это подтверждается и результатами (Бобров и др., 2020), говорящими, что, хотя средняя вероятность правильного распознавания выполняемых задач при управлении ИМК-ВД у детей с ДЦП была выше случайного уровня, этот показатель у них был в среднем ниже, чем у взрослых здоровых испытуемых и постинсультных больных.
В работах (Kübler, 2008; Li et al., 2010; Nam et al., 2012), хотя и на примере ИМК, основанных на регистрации вызванного ответа P300, демонстрируется, что показатели точности управления ИМК имеют тенденцию к ухудшению по мере увеличения тяжести нарушений. В работе (Nam et al., 2012) при участии пациентов с ДЦП и с боковым амиотрофическим склерозом были обнаружены существенные отличия в показателях ИМК у пациентов с двигательной инвалидностью от показателей здоровых испытуемых. Наблюдались также различные картины когерентности ЭЭГ на различных частотах у больных и здоровых испытуемых при выполнении задач ИМК. Был сделан вывод, что испытуемые с физическими нарушениями, видимо, задействуют больше кортикальных областей, чтобы компенсировать трудности, вызванные их двигательной недостаточностью, отражая менее эффективную стратегию для решения задачи ИМК.
ЗАКЛЮЧЕНИЕ
К настоящему моменту уровень доказательности для применения ИМК-ВД при восстановлении двигательной функции у взрослых больных с различными двигательными нарушениями сильно возрос, особенно для реабилитации больных после инсульта. Тем не менее данные об эффективности этой технологии при реабилитации детей с ДЦП все еще малочисленны.
Согласно рассмотренным литературным данным, применение ИМК-ВД для двигательной реабилитации детей с ДЦП сопряжено с рядом методических трудностей. Не окончательно сформированная способность к воображению движений у детей, а также нарушение ее у детей с ДЦП, дефицит внимания у этой группы детей, когнитивные нарушения, нарушение восприятия своего тела – это далеко не полный перечень проблем, которые необходимо учитывать у данной группы пациентов. К тому же более слабая десинхронизация в первичных сенсомоторных областях, чем у здоровых детей, и, тем более, у взрослых, а также возможное смещение представительства конечности как следствие компенсаторных процессов обрисовывают потенциальные технические сложности применения ИМК-ВД у этой группы больных.
Вероятно, по этим причинам список работ по применению ИМК-ВД для двигательной реабилитации детей с ДЦП сильно ограничен. В обзоре приведены как одиночные работы, показывающие полезность тренировки с воображением движений у детей с ДЦП и улучшение способности у них к движению после тренировок, так и ряд клинических исследований технологии “ИМК+экзоскелет”. Рассмотрены и отдельные работы по применению ИМК для улучшения коммуникационных возможностей пациентов с ДЦП. Описанные результаты позволяют сделать оптимистичные выводы об эффективности процедуры. Дополнительной пользой применения ИМК в ходе реабилитации является то, что при использовании данной технологии регистрируется и визуализируется активность мозга, соответствующая тем задачам, которые пациент выполняет для управления интерфейсом. Эти данные, собираемые в ходе каждой процедуры, позволяют оценить степень активации областей мозга, участвующих в выполнении этих задач, а также изменение характера этой активации в ходе всего курса тренировок.
Работа выполнена в рамках государственного задания Министерства образования и науки Российской Федерации на 2021–2023 гг.
Список литературы
Айкарди Ж., Мартин Б., Кристофер Г. Заболевания нервной системы у детей. М: БИНОМ, 2013, 496 с.
Бобров П.Д., Бирюкова Е.В., Поляев Б.А., Лайшева О.А., Усачева Е.Л., Соколова А.В., Михайлова Д.И., Дементьева К.Н., Федотова И.Р. Реабилитация больных с детским церебральным параличом с помощью экзоскелета кисти, управлвемого интерфейсом “мозг-компьютер”. Вестник Российского государственного медицинского университета. 2020. (2020 (4)), 34–41.
Кондур А.А., Котов С.В., Турбина Л.Г., Бирюкова Е.В., Куликов М.А., Фролов А.А., Зайцева Е.В. Особенности применения неинвазивного интерфейса мозг-компьютер + экзоскелет кисти в клинической практике у пациентов после инсульта. XIV международный междисциплинарный конгресс “Нейронаука для медицины и психологии”, 2018. 264.
Ларина Н., Корсунская Л., Власенко С. Комплекс “Экзокисть-2” в реабилитации верхней конечности при детском церебральном параличе с использованием неинвазивного интерфейса “мозг-компьютер”. Нервно-мышечные болезни. 2019. 9 (4): 44–50.
Мокиенко О., Черникова Л., Фролов А., Бобров П. Воображение движения и его практическое применение. Журнал высшей нервной деятельности им. И.П. Павлова. 2013. 63 (2): 195–204.
Ang K.K., Chua K.S., Phua K.S., Wang C., Chin Z.Y., Kuah C.W., Low W., Guan C. A Randomized Controlled Trial of EEG-Based Motor Imagery Brain-Computer Interface Robotic Rehabilitation for Stroke. Clin EEG Neurosci. 2015. 46(4): 310–320.
Ang K.K., Guan C., Chua K.S.G., Ang B.T., Kuah C.W.K., Wang C., Phua K.S., Chin Z.Y., Zhang H. A large clinical study on the ability of stroke patients to use an EEG-based motor imagery brain-computer interface. Clinical EEG and Neuroscience. 2011. 42 (4): 253–258.
Anguelova G.V., Rombouts S., van Dijk J.G., Buur P.F., Malessy M.J.A. Increased brain activation during motor imagery suggests central abnormality in Neonatal Brachial Plexus Palsy. Neurosci Res. 2017. 123: 19–26.
Bai Z., Fong K.N.K., Zhang J.J., Chan J., Ting K.H. Immediate and long-term effects of BCI-based rehabilitation of the upper extremity after stroke: a systematic review and meta-analysis. J Neuroeng Rehabil. 2020. 17 (1): 57.
Basu A., Graziadio S., Smith M., Clowry G.J., Cioni G., Eyre J.A. Developmental plasticity connects visual cortex to motoneurons after stroke. Ann Neurol. 2010. 67 (1): 132–136.
Butti N., Montirosso R., Giusti L., Piccinini L., Borgatti R., Urgesi C. Early Brain Damage Affects Body Schema and Person Perception Abilities in Children and Adolescents with Spastic Diplegia. Neural Plast. 2019. 1678984.
Cabral-Sequeira A.S., Coelho D.B., Teixeira L.A. Motor imagery training promotes motor learning in adolescents with cerebral palsy: comparison between left and right hemiparesis. Experimental Brain Research. 2016. 234 (6): 1515–1524.
Caeyenberghs K., Tsoupas J., Wilson P.H., Smits-Engelsman B.C. Motor imagery development in primary school children. Dev Neuropsychol. 2009. 34 (1): 103–121.
Caeyenberghs K., Wilson P.H., Van Roon D., Swinnen S.P., Smits-Engelsman B.C. Increasing convergence between imagined and executed movement across development: evidence for the emergence of movement representations. Developmental Science. 2009. 12 (3): 474–483.
Caria A., Weber C., Brotz D., Ramos A., Ticini L.F., Gharabaghi A., Braun C., Birbaumer N. Chronic stroke recovery after combined BCI training and physiotherapy: a case report. Psychophysiology. 2011. 48 (4): 578–582.
Carr L.J., Harrison L.M., Evans A.L., Stephens J.A. Patterns of central motor reorganization in hemiplegic cerebral palsy. Brain. 1993. 116 (Pt 5) (5): 1223–1247.
Choudhury S., Charman T., Bird V., Blakemore S.J. Development of action representation during adolescence. Neuropsychologia. 2007. 45 (2): 255–262.
Craje C., Aarts P., Nijhuis-van der Sanden M., Steenbergen B. Action planning in typically and atypically developing children (unilateral cerebral palsy). Res Dev Disabil. 2010. 31 (5): 1039–1046.
Craje C., van Elk M., Beeren M., van Schie H.T., Bekkering H., Steenbergen B. Compromised motor planning and Motor Imagery in right Hemiparetic Cerebral Palsy. Res Dev Disabil. 2010. 31 (6): 1313–1322.
Crognier L., Skoura X., Vinter A., Papaxanthis C. Mental representation of arm motion dynamics in children and adolescents. PloS one. 2013. 8 (8), e73042.
Daly I., Billinger M., Laparra-Hernandez J., Aloise F., Garcia M.L., Faller J., Scherer R., Muller-Putz G. On the control of brain-computer interfaces by users with cerebral palsy. Clin Neurophysiol. 2013. 124 (9): 1787–1797.
Daly I., Faller J., Scherer R., Sweeney-Reed C.M., Nasuto S.J., Billinger M., Muller-Putz G.R. Exploration of the neural correlates of cerebral palsy for sensorimotor BCI control. Front Neuroeng. 2014. 7: 20.
Daprati E., Nico D., Duval S., Lacquaniti F. Different motor imagery modes following brain damage. Cortex. 2010. 46 (8): 1016–1030.
de Almeida Carvalho Duarte N., Collange Grecco L.A., Zanon N., Galli M., Fregni F., Santos Oliveira C. Motor Cortex Plasticity in Children With Spastic Cerebral Palsy: A Systematic Review. J Mot Behav. 2017. 49 (4): 355–364.
Decety J., Jeannerod M. Mentally simulated movements in virtual reality: does Fitt’s law hold in motor imagery? Behavioural brain research. 1995. 72 (1–2): 127–134.
Démas J., Bourguignon M., Périvier M., De Tiège X., Dinomais M., Van Bogaert P. Mu rhythm: State of the art with special focus on cerebral palsy. Annals of physical and rehabilitation medicine. 2019.
Di Rienzo F., Collet C., Hoyek N., Guillot A. Impact of neurologic deficits on motor imagery: a systematic review of clinical evaluations. Neuropsychol Rev. 2014. 24 (2): 116–147.
Errante A., Bozzetti F., Sghedoni S., Bressi B., Costi S., Crisi G., Ferrari A., Fogassi L. Explicit Motor Imagery for Grasping Actions in Children With Spastic Unilateral Cerebral Palsy. Front Neurol. 2019. 10: 837.
Fennell E.B., Dikel T.N. Cognitive and neuropsychological functioning in children with cerebral palsy. J Child Neurol. 2001. 16 (1): 58–63.
Ferrari A. From movement to action: a new framework for cerebral palsy. Eur J Phys Rehabil Med. 2019. 55 (6): 852–861.
Frassinetti F., Fiori S., D’Angelo V., Magnani B., Guzzetta A., Brizzolara D., Cioni G. Body knowledge in brain-damaged children: a double-dissociation in self and other’s body processing. Neuropsychologia. 2012. 50 (1): 181–188.
Frolov A.A., Aziatskaya G.A., Bobrov P.D., Luykmanov R.K., Fedotova I.R., Húsek D., Snašel V. Electrophysiological brain activity during the control of a motor imagery-based brain–computer interface. Human Physiology. 2017. 43 (5): 501–511.
Frolov A.A., Mokienko O., Lyukmanov R., Biryukova E., Kotov S., Turbina L., Nadareyshvily G., Bushkova Y. Post-stroke Rehabilitation Training with a Motor-Imagery-Based Brain-Computer Interface (BCI)-Controlled Hand Exoskeleton: A Randomized Controlled Multicenter Trial. Front Neurosci. 2017. 11: 400.
Funk M., Brugger P., Wilkening F. Motor processes in children’s imagery: the case of mental rotation of hands. Dev Sci. 2005. 8 (5): 402–408.
Grezes J., Decety J. Functional anatomy of execution, mental simulation, observation, and verb generation of actions: a meta-analysis. Hum Brain Mapp. 2001. 12 (1): 1–19.
Hétu S., Grégoire M., Saimpont A., Coll M.-P., Eugène F., Michon P.-E., Jackson P.L. The neural network of motor imagery: an ALE meta-analysis. Neuroscience & Biobehavioral Reviews. 2013. 37 (5): 930–949.
Iosa M., Zoccolillo L., Montesi M., Morelli D., Paolucci S., Fusco A. The brain’s sense of walking: a study on the intertwine between locomotor imagery and internal locomotor models in healthy adults, typically developing children and children with cerebral palsy. Frontiers in human neuroscience. 2014. 8: 859.
Jang S.H., You S.H., Hallett M., Cho Y.W., Park C.M., Cho S.H., Lee H.Y., Kim T.H. Cortical reorganization and associated functional motor recovery after virtual reality in patients with chronic stroke: an experimenter-blind preliminary study. Arch Phys Med Rehabil. 2005. 86 (11): 2218–2223.
Jenks K.M., de Moor J., van Lieshout E.C. Arithmetic difficulties in children with cerebral palsy are related to executive function and working memory. J Child Psychol Psychiatry. 2009. 50 (7): 824–833.
Jongsma M.L., Baas C.M., Sangen A.F., Aarts P.B., Van der Lubbe R.H., Meulenbroek R.G., Steenbergen B. Children with unilateral cerebral palsy show diminished implicit motor imagery with the affected hand. Developmental Medicine & Child Neurology. 2016. 58 (3): 277–284.
Kim T.W., Lee B.H. Clinical usefulness of brain-computer interface-controlled functional electrical stimulation for improving brain activity in children with spastic cerebral palsy: a pilot randomized controlled trial. J Phys Ther Sci. 2016. 28 (9): 2491–2494.
Kimberley T.J., Khandekar G., Skraba L.L., Spencer J.A., Van Gorp E.A., Walker S.R. Neural substrates for motor imagery in severe hemiparesis. Neurorehabil Neural Repair. 2006. 20 (2): 268–277.
Kübler A., Birbaumer N. Brain–computer interfaces and communication in paralysis: Extinction of goal directed thinking in completely paralysed patients? Clinical Neurophysiology. 2008. 119 (11): 2658–2666.
Kułak W., Sobaniec W. Spectral analysis and coherence EEG in children with cerebral palsy diplegia spastica. Przegl Lek. 2003. 60: 1–5.
Kułak W., Sobaniec W. Cerebral palsy in children in north-eastern Poland. Journal of Pediatric Neurology. 2004. 2 (2): 79–84.
Larina N., Nacharova M., Korsunskaya L., Vlasenko S., Pavlenko V. Changes in EEG patterns in the α-frequency band following BCI-based therapy in children with cerebral palsy. Bulletin of RSMU. 2020. 4: 15–20.
Li Y., Nam C.S., Shadden B.B., Johnson S.L. A P300-based brain–computer interface: Effects of interface type and screen size. Intl. Journal of Human–Computer Interaction. 2010. 27 (1): 52–68.
Lust J.M., Wilson P.H., Steenbergen B. Motor imagery difficulties in children with Cerebral Palsy: A specific or general deficit? Res Dev Disabil. 2016. 57, 102–111.
Maegaki Y., Maeoka Y., Ishii S., Eda I., Ohtagaki A., Kitahara T., Suzuki N., Yoshino K., Ieshima A., Koeda T., Takeshita K. Central motor reorganization in cerebral palsy patients with bilateral cerebral lesions. Pediatr Res. 1999. 45 (4 Pt 1): 559–567.
Molina M., Kudlinski C., Guilbert J., Spruijt S., Steenbergen B., Jouen F. Motor imagery for walking: a comparison between cerebral palsy adolescents with hemiplegia and diplegia. Research in Developmental Disabilities. 2015. 37: 95–101.
Molina M., Tijus C., Jouen F. The emergence of motor imagery in children. J Exp Child Psychol. 2008. 99 (3): 196–209.
Mutch L., Alberman E., Hagberg B., Kodama K., Perat M.V. Cerebral palsy epidemiology: where are we now and where are we going? Developmental Medicine & Child Neurology. 1992. 34 (6): 547–551.
Nam C.S., Woo J., Bahn S. Severe motor disability affects functional cortical integration in the context of brain–computer interface (BCI) use. Ergonomics. 2012. 55 (5): 581–591.
Odding E., Roebroeck M.E., Stam H.J. The epidemiology of cerebral palsy: incidence, impairments and risk factors. Disabil Rehabil. 2006. 28 (4): 183–191.
Ono T., Shindo K., Kawashima K., Ota N., Ito M., Ota T., Mukaino M., Fujiwara T., Kimura A., Liu M. Brain-computer interface with somatosensory feedback improves functional recovery from severe hemiplegia due to chronic stroke. Frontiers in neuroengineering. 2014. 7: 19.
Ono T., Tomita Y., Inose M., Ota T., Kimura A., Liu M., Ushiba J. Multimodal sensory feedback associated with motor attempts alters BOLD responses to paralyzed hand movement in chronic stroke patients. Brain Topogr. 2015. 28 (2): 340–351.
Parsons L.M. Temporal and kinematic properties of motor behavior reflected in mentally simulated action. J Exp Psychol Hum Percept Perform. 1994. 20 (4): 709–730.
Ramos-Murguialday A., Broetz D., Rea M., Laer L., Yilmaz O., Brasil F.L., Liberati G., Curado M.R., Garcia-Cossio E., Vyziotis A., Cho W., Agostini M., Soares E., Soekadar S., Caria A., Cohen L.G., Birbaumer N. Brain-machine interface in chronic stroke rehabilitation: a controlled study. Ann Neurol. 2013. 74 (1): 100–108.
Rehme A.K., Eickhoff S.B., Rottschy C., Fink G.R., Grefkes C. Activation likelihood estimation meta-analysis of motor-related neural activity after stroke. Neuroimage. 2012. 59 (3): 2771–2782.
Reid L.B., Rose S.E., Boyd R.N. Rehabilitation and neuroplasticity in children with unilateral cerebral palsy. Nat Rev Neurol. 2015. 11 (7): 390–400.
Shenton J.T., Schwoebel J., Coslett H.B. Mental motor imagery and the body schema: evidence for proprioceptive dominance. Neurosci Lett. 2004. 370 (1): 19–24.
Shin Y.K., Lee D.R., Hwang H.J., You S.J., Im C.H. A novel EEG-based brain mapping to determine cortical activation patterns in normal children and children with cerebral palsy during motor imagery tasks. NeuroRehabilitation. 2012. 31 (4): 349–355.
Souto D.O., Cruz T.K.F, Fontes P.L.B, Haase V. G. Motor imagery in children with unilateral cerebral palsy: a case–control study. Developmental Medicine & Child Neurology. 2020. 62 (12): 1396–1405.
Spruijt S., Jouen F., Molina M., Kudlinski C., Guilbert J., Steenbergen B. Assessment of motor imagery in cerebral palsy via mental chronometry: the case of walking. Res Dev Disabil. 2013. 34 (11): 4154–4160.
Spruijt S., van der Kamp J., Steenbergen B. Current insights in the development of children’s motor imagery ability. Frontiers in psychology. 2015. 6: 787.
Staudt M., Grodd W., Gerloff C., Erb M., Stitz J., Krageloh-Mann I. Two types of ipsilateral reorganization in congenital hemiparesis: a TMS and fMRI study. Brain. 2002. 125 (Pt 10): 2222–2237.
Steenbergen B., Gordon A.M. Activity limitation in hemiplegic cerebral palsy: evidence for disorders in motor planning. Dev Med Child Neurol. 2006. 48 (9): 780–783.
Steenbergen B., Jongbloed-Pereboom M., Spruijt S., Gordon A.M. Impaired motor planning and motor imagery in children with unilateral spastic cerebral palsy: challenges for the future of pediatric rehabilitation. Dev Med Child Neurol. 2013. 55 Suppl 4: 43–46.
Straub K., Obrzut J.E. Effects of cerebral palsy on neuropsychological function. Journal of Developmental and Physical Disabilities. 2009. 21 (2): 153.
Taherian S., Selitskiy D., Pau J., Davies T.C., Owens R.G. Training to use a commercial brain-computer interface as access technology: a case study. Disability and Rehabilitation: Assistive Technology. 2016. 11 (4): 345–350.
Thickbroom G.W., Byrnes M.L., Archer S.A., Nagarajan L., Mastaglia F.L. Differences in sensory and motor cortical organization following brain injury early in life. Ann Neurol. 2001. 49 (3): 320–327.
van Elk M., Craje C., Beeren M.E., Steenbergen B., van Schie H.T., Bekkering H. Neural evidence for compromised motor imagery in right hemiparetic cerebral palsy. Front Neurol. 2010. 1: 150.
Vuckovic A., Pineda J.A., LaMarca K., Gupta D., Guger C. Interaction of BCI with the underlying neurological conditions in patients: pros and cons. Front Neuroeng. 2014. 7: 42.
Wilson P.H., Adams I.L., Caeyenberghs K., Thomas P., Smits-Engelsman B., Steenbergen B. Motor imagery training enhances motor skill in children with DCD: A replication study. Res Dev Disabil. 2016. 57: 54–62.
Wilson P.H., Thomas P.R., Maruff P. Motor imagery training ameliorates motor clumsiness in children. J Child Neurol. 2002. 17 (7): 491–498.
Wittenberg G.F. Motor mapping in cerebral palsy. Dev Med Child Neurol. 2009. 51 Suppl 4: 134–139.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


