Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 5, стр. 591-604
Морфофункциональный подход в изучении особенностей префронтальной коры у подростков
1 Лаборатория нейрофизиологии когнитивной деятельности, ФГБНУ “Институт возрастной физиологии Российской академии образования”
Москва, Россия
2 Кафедра анатомии человека, ФГАОУ ВО “Российский университет дружбы народов”
Москва, Россия
* E-mail: tsekhmistrenko_ta@pfur.ru
Поступила в редакцию 18.11.2020
После доработки 19.12.2020
Принята к публикации 22.12.2020
Аннотация
Статья посвящена изучению у подростков возрастных морфофункциональных особенностей зон префронтальной коры большого мозга, участвующих в реализации зрительной (фронтальное глазодвигательное поле 8) и речедвигательной (поля 44 и 45 зоны Брока) функций, а также коры в области латеральной поверхности лобного полюса (поле 10) и медиального паралимбического отдела префронтальной коры (поле 32/10). Постмортальный материал был получен от 60 людей (52 мужского и 8 – женского пола) трех возрастных групп: I – дети от 8 до 12 лет (n = 30), II – подростки от 13 до 16 лет (n = 15), III – молодые люди от 17 лет до 21 года (n = 15). В III и V слоях коры изучали размеры пирамидных нейронов, особенности фиброархитектоники, удельные объемы нейронов и внутрикорковых волокон, определяли глио-сосудистый индекс. Применяли гистологические методики, компьютерный морфометрический и стереологический анализ. Результаты исследования показали, что возрастные микроструктурные изменения префронтальной коры наблюдаются у подростков, что приводит к усложнению ее морфофункциональной организации по сравнению с детьми.
Изучение структурной организации нейронного аппарата имеет большое значение для понимания специфики функционирования различных корковых зон в процессе развития мозга человека и формирования его регуляторных функций. Актуальной проблемой возрастной нейроморфологии является изучение структурных преобразований коры большого мозга человека на разных этапах постнатального онтогенеза. Особенности мозговой организации когнитивной деятельности и формирование управляющих систем, контролирующих наиболее сложные формы адаптивного поведения, в существенной степени обусловлены ходом постнатального морфогенеза неокортекса (Мачинская, 2014, 2015; Фарбер, Бетелева, 2011). Неравномерное возрастное созревание коры и подкорковых структур обусловливает неодинаковую степень их участия в мозговой деятельности посредством локальных и системных связей, что и определяет специфику их взаимных влияний на разных этапах индивидуального развития (Dubois et al., 2008a, 2008b; Kostovic, Judas, 2006).
С помощью количественных оценок комплекса макро- и микроструктурных параметров коры становится возможным определение временны́х границ наиболее значимых ее изменений, выявление специфики развития цитоархитектонических полей с различной функциональной направленностью, изучение своеобразия дифференцировки слоев и подслоев различных корковых зон, а также особенностей роста и дифференцировки клеток разного типа и их компонентов в пределах каждого слоя.
Наибольший интерес такой морфофункциональный подход представляет в микроанатомических исследованиях коры большого мозга у детей 8–12 лет, а также у подростков и юношей, когда наблюдается постепенная стабилизация многих среднестатистических параметров, характеризующих возрастные изменения внутрикорковых структурных компонентов (Blakemore, 2012; Tsekhmistrenko et al., 2017). Системную деятельность мозга и его функцию как целостного органа в значительной мере определяют возрастные изменения нейронов и межнейрональных связей (Paus et al., 1999). Особый интерес представляет изучение возрастных особенностей нейроархитектоники коры в III и V слоях – наружной и внутренней пирамидных пластинках. Нейроны этих слоев, а также комплекс их внутрикорковых, межкорковых и корково-подкорковых связей обеспечивают наиболее сложно протекающие процессы системной мозговой деятельности, которые определяют как морфофункциональную специализацию отдельных корковых зон, так и архитектуру их функционального взаимодействия.
Морфофункциональный подход к изучению строения коры больших полушарий реализован в ряде концепций структурно-функциональной организации мозга, которые осуществляются при тесном взаимодействии проекционных, ассоциативных, интегративно-пусковых и лимбико-ретикулярных систем (Фарбер, 2014; Kanwisher, 2010; Van den Heuvel, Sporns, 2011; Khundrakpam et al, 2013; Pessoa, 2014). В коре большого мозга морфологическим субстратом первой инстанции такого многоуровневого взаимодействия является нейрон, следующей ступенью — группа нейронов и, наконец, нервный центр коркового типа.
В последние годы в качестве базового компонента нейросетей на корковом уровне многими исследователями рассматриваются нейроваскулярные единицы морфофункциональной организации коры (Venkat et al., 2016). В отличие от нейронных микромодулей они включают не только дискретные скопления нейронов разного типа – клеточные группировки, но и комплекс локализованных рядом с ними волокнистых структур, глиальных клеток и внутрикорковых сосудов. Нейронные кластеры совместно с глио-сосудистым компонентом фактически представляют собой нейротрофические или нейроваскулярные единицы в составе цитоархитектонического слоя или его отдельного подслоя. В количественном отношении как глия, так и сосуды в передних отделах коры большого мозга с возрастом также претерпевают изменения. Было показано, что усложнение строения астроцитарной глии положительно коррелирует со степенью обработки информации в ее нейронном окружении (Senitz et al., 1995). Вопрос о том, какими из вышеперечисленных компонентов коры и в какой степени определяются возрастные структурные преобразования у подростков в период полового созревания, морфофункциональной перестройки систем организма, а также психической деятельности и поведения в целом, представляет интерес и может быть изучен с применением классических гистологических количественных методик исследования.
Цель исследования заключалась в изучении возрастных морфологических изменений корковых формаций мозга на гистологических препаратах префронтальной коры у подростков, а также у детей 8–12 лет и у юношей, с применением компьютерного анализа изображений микроструктуры коры, количественных и стереометрических методик. В связи с этим в задачу исследования входило изучение в коре большого мозга возрастных изменений удельных объемов нейронов и внутрикорковых волокон, а также глиоцитов и кровеносных сосудов, с целью выявления их количественных соотношений. В качестве рабочей гипотезы предполагали, что такой комплексный морфофункциональный подход позволит выявить особенности постнатальных преобразований не только в системе структур, непосредственно участвующих в информационных процессах, но и в системе образований, регулирующих трофические и метаболические процессы в коре.
МЕТОДИКА
С помощью гистологических и количественных методик были изучены фрагменты коры большого мозга, полученные из 60 левых больших полушарий от трупов людей (52 мужского и 8 женского пола) в возрасте от 8 лет до 21 года, погибших без травм мозга. Сбор секционного материала производился в судебно-медицинских моргах г. Москвы и Московской области. Сбор материала разрешен этической комиссией Института возрастной физиологии РАО, решение № 4 от 15 февраля 1996 г.
Фрагменты ткани мозга вырезали, руководствуясь Атласом цитоархитектоники коры большого мозга человека (Атлас цитоархитектоники..., 1955). В префронтальной коре исследовали речедвигательные поля 44 и 45 (зона Брока), передний отдел фронтального глазодвигательного поля 8, поле 10 лобного полюса в переднелатеральном отделе префронтальной коры, а также прелимбическое поле 32/10 (передняя дорсальная поясная кора по K. Brodmann) на медиальной поверхности лобной доли. При выборе полей учитывалась не только их функциональная специализация, но и различие в степени влияния на их развитие со стороны групп генов, осуществляющих контроль над формированием лобных долей больших полушарий (Chen et al., 2011; Docherty et al., 2015).
Материал исследования в соответствии с отечественной возрастной периодизацией (АПН СССР, 1965) распределяли в три возрастные группы, в том числе: группу детей в предшествующем подросткам возрасте от 8 до 12 лет (n = 30 левых полушарий большого мозга), группу подростков от 13 до 16 лет (n = 15) и группу юношей от 17 лет до 21 года (n = 15). Фиксацию мозга производили в 10%-ном нейтральном формалине с последующим обезвоживанием в спиртах восходящей концентрации. Парафиновые срезы толщиной 10 мкм изготовляли во фронтальной плоскости и окрашивали крезиловым фиолетовым по Нисслю, а также импрегнировали нитратом серебра методом Петерса в модификации (Антонова, Степанова, 1973). Часть материала в отдельных фрагментах обрабатывали методом Гольджи в модификации (Антонова, 1967), после чего серийные срезы с целлоидиновых блоков толщиной 100 мкм, изготовленные во фронтальной проекции, заключали в бальзам.
Методом компьютерной морфометрии с применением технологии Image Tools (National Institutes of Health, USA) и программы геометрических измерений микрообъектов ImageExpert™ Gauge (NEXSYS, Россия) на микроскопе Биолам-15 ЛОМО® с встроенной USB-камерой UCMOS01300KPA (Altami, Россия) в наружной пирамидной пластинке коры (III3 подслой) и внутренней пирамидной пластинке (V1 подслой) измеряли площадь профильного поля пирамидных нейронов на срезе, а также высоту и ширину нейронов с четко видимыми ядром, ядрышком и цитоплазмой. При изучении размеров нейронов анализируют, как правило, величину профильного поля (срединного среза) тел нейронов, но не их объем (Боголепова и др., 2015). Тем не менее известно, что при росте размеров трехмерного объекта величина его объема изменяется в большей степени, чем площадь срединного сечения (Бескин, 1971). Объем тела – важная количественная характеристика метаболического и функционального потенциала нейрона. В связи с этим в префронтальной коре человека на поздних этапах восходящего онтогенеза мы изучали возрастную динамику изменений размеров пирамидных нейронов, анализируя объемы тел пирамидных нейронов. Объем конусовидного клеточного тела (V) для каждого пирамидного нейрона вычисляли по формуле:
где Н – длина нейрона, а – ширина нейрона.Объем выборки для каждого среза составлял не менее 10 нейронов, для каждого гистологического препарата – не менее 40, для каждого индивидуума – не менее 5 препаратов, для каждого годового возрастного промежутка – не менее 3 индивидуумов, для каждой возрастной группы – не менее 3000 вычислений объемов нейронов в каждом из исследованных полей. Для вычисления процентного соотношения пирамидных нейронов разного объема было выделено 8 размерных групп нейронов. К мелким нейронам отнесли 2 группы: 1 – от 101 до 1100 мкм3, 2 – от 1101 до 2100 мкм3. К средним нейронам отнесли 3 группы: 3 – от 2101 до 3100 мкм3, 4 – от 3101 до 4100 мкм3, 5 – от 4101 до 5100 мкм3. К наиболее крупным отнесли также 3 группы: 6 – от 5101 до 6100 мкм3, 7 – от 6101 до 7100 мкм3 и 8 – от 7101 до 8100 мкм3. Статистический анализ полученных количественных данных производили с использованием пакета программ SigmaPlot 13.0 (SYSTAT Software, USA), интегрированного с MS Excel, вычисляя среднегрупповые величины изучаемых параметров и стандартные ошибки средних, при этом проверяли соблюдение нормальности распределения величин в сравниваемых выборках, анализировали распределение вероятностей количественных признаков (Ланг, Сесик, 2016). Значимость различий между среднегрупповыми показателями разных возрастных групп определяли с применением двухвыборочного t-критерия Стьюдента. Различия считали значимыми при P ≥ 95% (p < 0.05).
Объемные соотношения структурных элементов коры в разных полях и в различных возрастных группах определяли с помощью стереологического метода (Стефанов, Кухаренко, 1989) в собственной модификации (Цехмистренко и др., 2019б). Выявляли удельные объемы нейронов, волокон, глиоцитов и сосудов в III3 и V1 подслоях коры при увеличении 15×40 при помощи встроенной в программу 4-узловой оптической сетки со случайным шагом. Среднее число узлов (точек) морфометрической сетки, случайно попавших на исследуемые структуры, определяло их среднюю долю общего объема ткани (в %). Также вычисляли удельный объем экстрацеллюлярного матрикса и неточно опознаваемых объектов, который в итоге в среднем не превышал 3.26 ± 0.4%. Всего производилось по 850–1080 измерений изучаемых структурных компонентов в каждой возрастной группе при достижении критерия надежности P ≥ 95%. С целью унификации количественных данных, полученных с различных срезов, использовалась формула А. Аберкромби (Автандилов, 1990) для подсчета истинного числа микрообъектов с учетом толщины среза. Значимость различий между средними величинами изучаемых параметров различных возрастных групп или разных корковых полей в одной возрастной группе определяли методами вариационной статистики с вычислением ошибки средней и доверительного интервала с уровнем значимости Р ≥ 95% (Стрелков, 1986).
В переходном периоде от детства к подростковому возрасту в организме происходят существенные гормональные изменения, которые в значительной степени затрагивают метаболические процессы в корковых формациях и подкорковых нервных центрах головного мозга (Физиология развития ребенка, 2010). Можно предположить, что на этом возрастном отрезке особенно большое значение для нормальной жизнедеятельности нейронов в коре большого мозга приобретают глиоциты, в частности астроцитарная глия, тесно функционально связанная с внутрикорковыми кровеносными сосудами. Поэтому в полях префронтальной коры нами проанализировано относительное содержание глии и сосудов на уровне III3 подслоя. Для оценки возрастных изменений глиального и сосудистого компонентов микроструктуры коры рассчитывали среднегрупповой глио-сосудистый индекс, отражающий отношение удельного объема внутрикорковой глии к удельному объему микрососудов на уровне анализируемого цитоархитектонического слоя.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
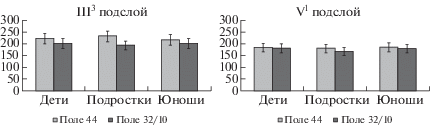
Цито- и фиброархитектоника. Установлено, что по среднегрупповому показателю профильных полей пирамидных нейронов у детей, подростков и юношей не существует значимых различий (рис. 1). По этому показателю пирамидные нейроны достигают дефинитивного уровня развития к 8–12 годам, а их размеры после 7 лет в среднем стабилизируются, что совпадает с данными и других авторов (Боголепова, Малофеева, 2014).
Рис. 1.
Площадь профильных полей пирамидных нейронов в III3 и V1 подслоях полей 44 и 32/10 префронтальной коры большого мозга человека на различных этапах постнатального онтогенеза. Здесь и на риc. 5 по оси абсцисс – возрастные группы: дети – от 8 до 12 лет, подростки – от 13 до 16 лет, юноши – от 17 лет до 21 года. По оси ординат – среднегрупповые показатели площади профильных полей пирамидных нейронов (в мкм2). Вертикальные отрезки – доверительный интервал (при уровне значимости p < 0.05).
Fig. 1. The area of profile fields of pyramidal neurons in III3 and V1 sublayers of the fields 44 and 32/10 of the human prefrontal cortex at various stages of postnatal ontogenesis. Here and on fig. 5 on the x-axis – age groups: children – from 8 to 12 years, adolescents – from 13 to 16 years, young men – from 17 to 21 years. On the y-axis – the mid-group indicators of the profile fields of pyramidal neurons (in μm2). Vertical bars represent the confidence interval (at the level of significance p < 0.05).
Однако изучение цито- и фиброархитектоники в различных полях префронтальной коры показало, что у детей 8–12 лет и подростков в сравнении с более ранними возрастными периодами на препаратах, окрашенных по Гольджи, во всех исследованных полях увеличивалась разветвленность дендритов пирамидных нейронов, нарастало разнообразие их пространственного распределения (Цехмистренко и др., 2019а) (рис. 2).
Рис. 2.
Нейроархитектоника префронтальной коры в области поля 10: (а) – ребенок 3 лет, (б) – подросток 13 лет. Видны пучки апикальных и базальных дендритов пирамидных нейронов III и V слоев. Импрегнация нитратом серебра по Гольджи. Ув. 9 × 10.
Fig. 2. Neuroarchitectonics of the prefrontal cortex in the field 10: (a) a 3-year-old child, (б) an adolescent 13-year-old. The bundles of apical and basal dendrites of pyramidal neurons of layers III and V are visible. Impregnation with silver nitrate by Golgi. Magnification 9 × 10.

Между протяженностью дендритных арборизаций и развитием тел пирамидных нейронов существует тесная морфофункциональная связь (Baars, Gage, 2010), которая находит отражение в количественных изменениях перикарионов пирамидных нейронов в наружной и внутренней пирамидных пластинках.
Возрастные изменения объемов пирамидных нейронов изучали на примере полей 45, 8 и 10 префронтальной коры. В III3 подслое наружной пирамидной пластинки у детей 8–12 лет среднегрупповые показатели объемов пирамидных нейронов в полях 8 и 45 не имели значимых различий (табл. 1).
Таблица 1.
Объем пирамидных нейронов в III3 подслое префронтальной коры большого мозга человека на разных этапах постнатального онтогенеза (M + m) (μm3) Table 1. The volume of pyramidal neurons in the III3 sublayer of the human prefrontal cortex at different stages of postnatal ontogenesis (M + m) (μm3)
| Область коры | Дети | Подростки | Юноши |
|---|---|---|---|
| Поле 8 | 2243.9 ± 45.2 | 2336.6 ± 53.7 | 2351.2 ± 56.8 |
| Поле 45 | 2216.4 ± 39.9 | 2241.6 ± 32.6 | 2259.9 ± 54.4 |
| Поле 10 | 1889.6 ± 34.3* | 2083.4 ± 45.4*# | 2150.2 ± 50.0^ |
Примечание: различия значимы (при уровне значимости p < < 0.05) по сравнению с: * другими полями одной возрастной группы; # тем же полем предыдущей возрастной группы; ^ полем 8 в одной и той же возрастной группе. Note: differences are significant (at the significance level p < 0.05) compared to: * other fields in the same age group; # the same field of the previous age group; ^ field 8 in the same age group.
По сравнению с полями 8 и 45 в поле 10 лобного полюса величина пирамидных нейронов была в среднем в 1.2 раза меньше. Индивидуальные средние показатели у разных индивидуумов в группе детей варьировали в поле 8 от 1646.5 ± 88.7 до 2681.4 ± 142.9 мкм3, в поле 45 – от 1696.9 ± 84.2 до 2610.5 ± 126.6 мкм3, в поле 10 – от 1503.3 ± 78.6 до 2288.4 ± 118.5 мкм3. У подростков 13–16 лет объемы пирамидных нейронов в полях 8 и 45 в среднем не изменялись по сравнению с показателями детей 8–12 лет. В поле 10, играющем большую роль в управлении когнитивными процессами, объемы нейронов увеличились в 1.1 раза, однако, несмотря на значимый прирост, были в 1.1 раза меньше, чем в других полях этой же возрастной группы. У подростков минимальные индивидуальные показатели объемов пирамидных нейронов во всех исследованных полях увеличились в 1.1–1.2 раза по сравнению с детьми 8–12 лет. В целом индивидуальные показатели внутри группы подростков варьировали в поле 8 от 1910.6 ± 95.4 до 2607.3 ± ± 137.8 мкм3, в поле 45 – от 1921.5 ± 112.2 до 2344.8 ± 104.1 мкм3, в поле 10 от 1832.0 ± 89.3 до 2421.3 ± 132.7 мкм3. У юношей в возрасте от 17 лет до 21 года объемы пирамидных нейронов во всех исследованных полях префронтальной коры в среднем оставались стабильными и не отличались от показателей, выявленных у детей и подростков. Различия между объемами пирамидных нейронов в поле 10 и остальными полями у юношей были такими же, как и у подростков. Индивидуальные показатели внутри группы юношей варьировали в поле 8 от 2057.5 ± 107.2 до 2714.0 ± ± 152.6 мкм3, в поле 45 – от 1930.2 ± 91.8 до 2558.1 ± 125.0 мкм3, в поле 10 от 1838.0 ± 96.4 до 2410.0 ± 130.6 мкм3.
Количественный анализ показал, что различия индивидуальных средних объемов пирамидных нейронов III3 подслоя в изученных полях у детей колеблются в пределах ±18–26% от средней величины всей возрастной группы. У подростков диапазон индивидуальной изменчивости сужается по сравнению с детьми. Вариабельность объема нейронов в наружной пирамидной пластинке коры у подростков 13–16 лет составляет в среднем ±5–18% и наиболее выражена во фронтальном глазодвигательном поле 8, наименее – в речедвигательном поле 45 зоны Брока. У юношей происходит “унификация” диапазона индивидуальных различий размеров пирамидных нейронов: они в среднем индивидуально варьируют во всех исследованных полях префронтальной коры не более чем на ±12–15% от среднегрупповой величины.
Изучение распределения пирамидных нейронов по размерным классам в III3 подслое показало, что во всех возрастных группах преобладали мелкие по объему нейроны, суммарное содержание которых варьировало у детей в пределах от 56 до 73%, у подростков составляло 66–68%, у юношей – 54–58%. У подростков по сравнению с детьми в поле 8 перераспределение размеров нейронов в сторону их увеличения происходило в пределах мелкоклеточных классов, а содержание нейронов среднего размера нарастало незначительно (рис. 3).
Рис. 3.
Относительное содержание пирамидных нейронов разного объема в подслое III3 полей 8, 10 и 45 префронтальной коры. По оси абсцисс – размерные группы: 1 – от 101 до 1100 мкм3, 2 – 1101–2100 мкм3, 3 – 2101–3100 мкм3, 4 – 3101–4100 мкм3, 5 – 4101–5100 мкм3, 6 – 5101–6100 мкм3, 7 – 6101–7100 мкм3 и 8 – 7101–8100 мкм3); по оси ординат – процентное содержание нейронов. Светлые столбики – дети 8–12 лет, серые столбики – подростки 13–16 лет, темные столбики – юноши от 17 лет до 21 года. Вертикальные отрезки – ошибка средней; # – различия значимы (при р < 0.05) по сравнению с аналогичным полем предыдущей возрастной группы; + – появление наиболее крупных нейронов.
Fig. 3. The relative content of the pyramid neurons of different volume into the III3 sublayer in the fields 8, 10 and 45 of the prefrontal cortex. On the x-axis - dimensional groups: 1 – from 101 to 1100 μm3, 2 – 1101–2100 μm3, 3 – 2101–3100 μm3, 4 – 3101–4100 μm3, 5 – 4101–5100 μm3, 6 – 5101–6100 μm3, 7 – 6101–7100 μm3 and 8 – 7101–8100 μm3); according to the y-axis is the percentage of neurons. Light columns - children 8–12 years old, gray columns – adolescents 13–16 years old, dark columns - young men from 17 years to 21 years. Vertical bars – an average error; # – differences are meaningful (at p < 0.05) compared to the same field of the previous age group; + – the appearance of the largest neurons.
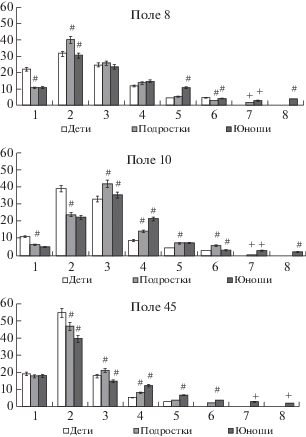
В полях 45 и 10 содержание средних по размеру нейронов увеличивалось по сравнению с детьми. При этом содержание 4-го и 5-го размерных классов составило 12–22% от всей популяции нейронов. У юношей во всех полях содержание нейронов мелкого размера изменялось незначительно. Однако у юношей по сравнению с подростками перераспределение нейронов в пределах крупноклеточных классов приводило к появлению одиночных нейронов наиболее крупного объема в диапазоне от 6101 до 8100 мкм3, которые составили 5–7% от общего числа нейронов.
В отличие от III3 подслоя коры в V1 подслое внутренней пирамидной пластинки уже у детей 8–12 лет четко прослеживаются различия между полями по среднегрупповым показателям объемов пирамидных нейронов. Наибольший среднегрупповой объем пирамидных нейронов наблюдался во фронтальном глазодвигательном поле 8, тогда как аналогичные показатели в полях 10 и 45 были в 1.1–1.3 раза меньше (табл. 2).
Таблица 2.
Объем пирамидных нейронов в V1 подслое префронтальной коры большого мозга человека на разных этапах постнатального онтогенеза (M + m) (μm3) Table 2. The volume of pyramidal neurons in the V1 sublayer of the human prefrontal cortex at different stages of postnatal ontogenesis (M + m) (μm3)
| Область коры | Дети | Подростки | Юноши |
|---|---|---|---|
| Поле 8 | 1700.4 ± 19.5* | 1763.2 ± 38.4* | 1771.3 ± 50.1* |
| Поле 45 | 1263.8 ± 19.7* | 1280.3 ± 30.2* | 1354.4 ± 36.9*# |
| Поле 10 | 1576.9 ± 20.0* | 1595.8 ± 39.3* | 1559.6 ± 41.6* |
Примечание: * – различия значимы (при уровне значимости p < 0.05) между показателями разных полей в каждой из возрастных групп, а также # – по сравнению с аналогичным показателем у детей 8–12 лет. Note: * – differences are significant (at a significance level of p < 0.05) between the indicators of different fields in each age group, and # – in comparison with the same indicator in children 8–12 years old.
В V1 подслое средние индивидуальные показатели в группе детей 8–12 лет варьировали в поле 8 от 1483.6 ± 92.2 до 1928.8 ± 115.7 мкм3, в поле 45 – от 1001.4 ± 62.2 до 1453.2 ± ± 101.7 мкм3, в поле 10 – от 1378.2 ± 82.7 до 1836.4 ± 91.8 мкм3. Размах колебаний средних индивидуальных показателей объемов пирамидных нейронов у детей составлял не более ±7–12% от среднегрупповой величины. У подростков 13–16 лет объемы пирамидных нейронов во всех полях в среднем не изменялись по сравнению с показателями детей, а региональные различия между полями по средним объемам пирамидных нейронов сохранялись. Стабильным оставался и диапазон вариабельности индивидуальных показателей в каждом из полей. К 13–14 годам в нижних слоях коры, так же как и в верхних, отмечалось усиление клеточного полиморфизма. Дендритная система пирамидных нейронов и интернейронов отличалась высокой степенью сложности и специализированной пространственной ориентацией дендритных букетов и аксонных коллатералей.
У юношей от 17 лет до 21 года в полях 8 и 10 среднегрупповой объем пирамидных нейронов и диапазон их индивидуальной изменчивости оставались стабильными и не отличались от показателей, выявленных во внутренней пирамидной пластинке коры у детей и подростков. Однако в поле 45 объем пирамидных нейронов в V1 подслое коры был в 1.1 раза больше по сравнению с аналогичным показателем у детей 8–12 лет. При этом во внутренней пирамидной пластинке поля 45 наблюдался сдвиг в сторону больших значений индивидуальных показателей. У юношей средний индивидуальный объем нейронов в поле 45 варьировал от 1148.7 ± 60.4 до 1575.5 ± ± 110.3 мкм3. В подслое V1 поля 45 коры большого мозга так же, как и в подслое III3, уже у подростков по сравнению с детьми 8–12 лет, увеличивалось содержание нейронов, относящихся к средним размерным группам. У подростков этот процесс сопровождался также сокращением на 7–8% числа мелких нейронов и появлением 1–2% нейронов наиболее крупноклеточных групп с показателями объема пирамидных нейронов в диапазоне от 5101 до 6100 мкм3. Позднее у юношей эти изменения приводили к значимому росту среднегруппового размерного показателя в 1.1 раза по сравнению с детьми.
У подростков к 14 годам наблюдаются пространственная специализация и асимметрия в развитии базальных и апикальных дендритных букетов пирамидных нейронов III слоя, отмечается нарастание ветвлений до 5–6 порядков, в поле 10 на базальных и боковых дендритах грацильных нейронов – до 9 порядков. Отчетливо прослеживается развитие характерных для нейронов префронтальной коры боковых дендритных арборизаций на теле пирамидных нейронов III3 и III2 подслоев, а также в проксимальном отделе их верхушечных дендритов.
Изучение фиброархитектоники на уровне V слоя префронтальной коры как на вентролатеральной поверхности, так и на медиальной поверхности лобной доли показало, что среднегрупповые показатели толщины радиарных пучков проекционных внутрикорковых волокон у детей, подростков и юношей не имеют значимых отличий и варьируют в разных полях в диапазоне от 11.4 ± 0.2 до 14.0 ± 1.1 мкм. Расстояние между пучками радиарных волокон в изученных полях во всех возрастных группах варьирует от 55 до 75 и более мкм. Однако в паралимбическом поле 32/10 среднегрупповой показатель расстояния между пучками оказался в 1.2 раза больше по сравнению с детьми 8–12 лет. К 17–20 годам во всех исследованных полях префронтальной коры внутрикорковый волокнистый компонент включает разнообразные по калибру горизонтальные и косые волокна.
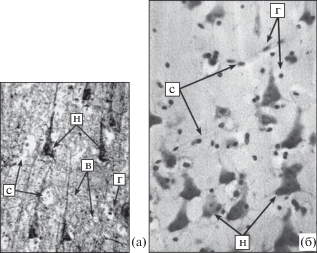
Стереометрический анализ микроструктурных компонентов. На микроструктурном уровне компоненты сетей формируются нейронами и нейронными кластерами, однако взаимодействие между ними и их функционирование обеспечиваются нейроглией и кровеносными сосудами. Сюда нужно отнести также внутрикорковые волокна, опосредующие межнейронные связи, и другие компоненты фиброархитектоники, участвующие в информационных взаимодействиях между нейронами, сосудами мягкой мозговой оболочки и внутрикорковыми сосудами (рис. 4).
Рис. 4.
Микроструктура подслоя III3 поля 10 префронтальной коры большого мозга подростка 16 лет. Н – тела нейронов, В – внутрикорковые волокна, С – кровеносные сосуды, Г – глиоциты. (а) – импрегнация нитратом серебра по Петерсу с докраской крезиловым фиолетовым по Нисслю; (б) – окраска крезиловым фиолетовым по Нисслю. Ув. 20 × 10.
Fig. 4. Microstructure of III3 sublayer of field 10 of the prefrontal cortex of an adolescent 16-year-old brain. H – neuronal bodies, B – intracortical fibers, C – blood vessels, Г – gliocytes. (a) silver nitrate impregnation according to Peters with Nissl cresyl violet staining; (б) cresyl violet staining according to Nissl. Magnification. 20 × 10.
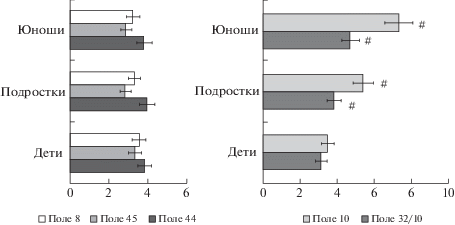
Изучение соотношения микроструктурных компонентов в III3 подслое префронтальной коры показало, что удельные объемы нейронов и волокон в области фронтального глазодвигательного поля 8 не имеют значимых различий между исследованными возрастными группами. В поле 8 удельный объем волокон у детей, а также у подростков и юношей был в 1.9–2.5 раза больше по сравнению с удельным объемом нейронов (рис. 5).
Рис. 5.
Удельный объем нейронов и внутрикорковых волокон в III3 подслое полей 44, 45 (речедвигательная кора), поля 8 (фронтальное глазодвигательное поле), поле 10 (кора лобного полюса) и 32/10 (паралимбическое поле) префронтальной коры большого мозга человека на различных этапах постнатального онтогенеза. По оси абсцисс: см. примечание к рис. 1. По оси ординат – среднегрупповые показатели (в %). Вертикальные отрезки – доверительный интервал (при уровне значимости p < 0.05). # – различия значимы по сравнению с аналогичным показателем у детей.
Fig. 5. Specific volume of neurons and intracortical fibers in III3 sublayer of fields 44, 45 (speech-motor cortex), field 8 (frontal oculomotor field), field 10 (frontal pole cortex), and 32/10 (paralimbic field) of human prefrontal cortex at different stages of postnatal ontogenesis. On the x-axis: see note to Fig. 1. Y-axis: group mean values (in %). Vertical bars – confidence interval (at significance level p < 0.05). # – differences are significant compared to the same indicator in children.
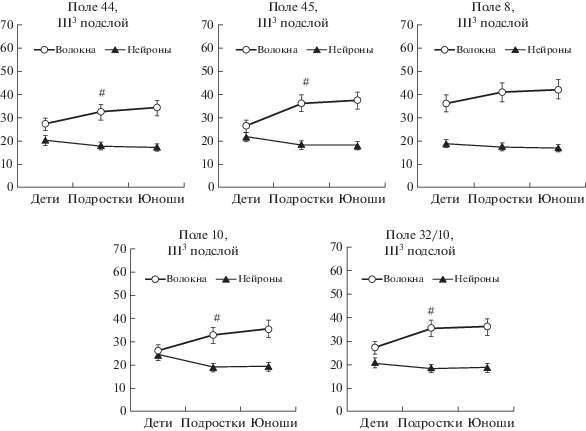
В остальных исследованных полях префронтальной коры наблюдались значимые отличия между детьми и подростками как по соотношению удельных объемов нейронов и волокон в наружной пирамидной пластинке, так и по относительному содержанию в ней внутрикорковых волокон. У детей в речедвигательном поле 44, расположенном в заднем отделе зоны Брока в покрышечной части нижней лобной извилины, и в паралимбическом поле 32/10 на медиальной поверхности лобной доли удельный объем волокон был в 1.3 раза больше, чем удельный объем нейронов. В филогенетически более новых областях коры – в поле 45, занимающем передний отдел зоны Брока в треугольной части нижней лобной извилины, и в поле 10 на латеральной поверхности лобного полюса – нейроны и волокна составляли равные по удельным объемам компоненты коры. У подростков в слое III исследованных полей префронтальной коры отмечались значимые изменения в соотношении этих микроструктурных компонентов. В полях 44 и 32/10 наблюдалось увеличение удельного объема волокон в 1.2–1.3 раза по сравнению с показателями детей 8–12 лет, а в полях 10 и 45 относительное содержание внутрикорковых волокон нарастало в 1.3–1.4 раза по сравнению с детьми. При этом у подростков почти во всех исследованных локусах префронтальной коры удельный объем волокон был больше в 1.7–2.0 раза по сравнению с нейронами. Исключение составило поле 8, в котором удельный объем волокон уже у детей был больше, чем нейронов, в 2.4 раза. Таким образом, у подростков 13–16 лет отмечается значимый прирост внутрикорковых волокон в III3 подслое, активно включенном в распределенные управляющие нейронные сети, контролирующие наиболее сложные регуляторные процессы, протекающие в префронтальной коре.
Принято считать, что V слой коры, включенный преимущественно в систему проекционных связей, в постнатальном онтогенезе развивается раньше, а стабилизация количественных параметров его микроструктурных компонентов происходит по срокам быстрее, чем в III слое. Чтобы убедиться в этом, мы провели стереометрическое исследование удельных объемов нейронов и волокон в V1 подслое внутренней пирамидной пластинки в функционально различных полях. Установлено, что в речедвигательных полях 44 и 45, в поле 10 на переднелатеральной поверхности лобного полюса и в паралимбическом поле 32/10 префронтальной коры на уровне V1 подслоя у подростков наблюдался значимый прирост относительного содержания волокон в 1.2–1.3 раза по сравнению с детьми. Из этого следует, что в префронтальной коре выявленная нами динамика изменений содержания внутрикорковых волокон в III и V цитоархитектонических слоях у подростков по сравнению с детьми 8–12 лет носит закономерный характер и комплексно затрагивает все компоненты распределенных нейрональных сетей, составляющих основу управляющих систем мозга. Следует также отметить, что в поле 8, в отличие от остальных полей префронтальной коры, мы не обнаружили возрастных изменений, так как уже у детей микроструктура фронтального глазодвигательного поля отличается высоким относительным содержанием внутрикорковых волокон.
Изучение отношения удельного объема внутрикорковой глии к удельному объему микрососудов в наружной пирамидной пластинке префронтальной коры позволило установить, что у детей, подростков и юношей глио-сосудистый индекс не имеет значимых возрастных изменений во фронтальном глазодвигательном поле 8, а также в речедвигательных полях 44 и 45. В то же время в полях 10 и 32/10 глио-сосудистый индекс значимо нарастает (рис. 6).
Рис. 6.
Глио-сосудистый индекс, отражающий отношение удельных объемов глиоцитов к удельному объему внутрикорковых сосудов в III3 подслое полей префронтальной коры на различных этапах постнатального онтогенеза. По оси абсцисс: величина среднегруппового индекса в условных единицах. По оси ординат: дети – от 8 до 12 лет, подростки – от 13 до 16 лет, юноши – от 17 лет до 21 года. Горизонтальные отрезки – доверительный интервал (при уровне значимости p < 0.05). # – различия значимы по сравнению с аналогичным показателем на предыдущем возрастном этапе.
Fig. 6. Glio-vascular index reflecting the ratio of the specific volume of gliocytes to the specific volume of intracortical vessels in the III3 sublayer of the prefrontal cortex fields at different stages of postnatal ontogenesis. X-axis: group mean index value in conditional units. Y-axis: children – from 8 to 12 years old, adolescents – from 13 to 16 years old, young men – from 17 to 21 years old. Horizontal bars are confidence intervals (at a significance level of p < 0.05). # – differences are significant compared to the same indicator at the previous age stage.
Анализ возрастной динамики изменений удельного объема глиоцитов и кровеносных внутрикорковых микрососудов показал, что в исследованных полях префронтальной коры глио-сосудистый компонент у детей 8–12 лет составляет 45–52% от ткани мозга. У подростков и юношей этот гистофизиологический показатель несколько снижается, достигая к 21 году 40–47% в основном за счет уменьшения удельного объема микрососудов и нарастания удельного объема внутрикорковых волокон.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Изучение структурных преобразований цито-, нейро- и фиброархитектоники показало, что значимые изменения объемов пирамидных нейронов префронтальной коры происходят не только на ранних этапах жизни, но и у подростков, а также у юношей. Поле 10 лобного полюса является наиболее поздно созревающей в постнатальном онтогенезе зоной префронтальной коры (Цехмистренко и др., 2019а). Обнаруженное нами значимое нарастание объемов нейронов в III3 подслое поля 10 на латеральной поверхности лобного полюса, а также в V1 подслое речедвигательного поля 45 у подростков по сравнению с детьми 8–12 лет служит аргументом в пользу того, что процесс формирования микроструктуры префронтальной коры и ее корково-корковых связей не завершается у детей и продолжается в пубертатном периоде. У подростков значимость коры лобного полюса повышается для реализации таких функций, как координация последовательности действий во временном континууме, поддержание рабочей памяти, контроль психоэмоциональных аспектов поведения, смена установки на конкретный вид деятельности (Dumontheil et al., 2008; Leh et al., 2010).
Речедвигательные поля зоны Брока не только контролируют сложные артикуляционные механизмы, но и вовлечены в реализацию высших психических функций совместно с другими отделами префронтальной коры. Речедвигательные поля также тесно взаимодействуют с премоторной корой, паралимбическими корковыми зонами в области островка и парагиппокампальной извилины, корой нижней теменной дольки и верхней височной извилины, а также мультимодальными областями коры вокруг внутритеменной борозды (Gerbella et al., 2010; Margulies, Petrides, 2013). Эти взаимодействия осуществляются во многом благодаря реципрокным внутрикорковым и межкорковым волокнам, источником которых являются пирамидные нейроны III и V цитоархитектонических слоев. По нашему мнению, такой количественный параметр, как среднегрупповой объем тела пирамидных нейронов, можно рассматривать в качестве одного из структурных дескрипторов, позволяющих оценивать уровень морфофункционального развития коры большого мозга не только у детей, но и у подростков и юношей. Таким образом, перераспределение числа пирамидных нейронов в сторону более крупноклеточных классов, отмеченное нами в полях 10 и 45 у подростков и юношей, является следствием не только дальнейшей функциональной специализации префронтальной коры, но и одновременно нарастания ее значимости в системной деятельности мозга в целом.
Изучение усредненных объемов пирамидных нейронов у отдельных индивидуумов показало, что в каждой из возрастных групп наблюдаются значимые индивидуальные различия. Существует мнение, что по мере взросления индивидуальные различия по комплексу морфологических параметров организма в популяции нарастают. Этот процесс рассматривается как следствие влияния не только наследственных, но и средовых факторов (Kedlian et al., 2019). Однако, анализируя среднегрупповые показатели объемов пирамидных нейронов в наружной пирамидной пластинке префронтальной коры, включенной в сложные ассоциативные нейросети, мы обнаружили, что наиболее вариабельными по изучаемому параметру являются нейроны в коре у детей 8–12 лет.
Как показали результаты исследования, не только у детей, но и у подростков и юношей происходит перераспределение содержания нейронов в пределах размерных классов, которое в различных полях префронтальной коры имеет специфические особенности. Появление наиболее крупных пирамидных нейронов происходит во всех полях именно у подростков и юношей, что, по нашему мнению, характерно в первую очередь для префронтальной коры. Такие нейроны имеют особенно обширные рецептивные поля и рассматриваются как полисенсорные мультифункциональные нейроны со смешанной селективностью (Mansouri et al., 2006), способные эффективно вовлекаться в активность функционально специализированных нейросетей, обеспечивая реализацию наиболее сложных регуляторных процессов с участием префронтальной коры в качестве важнейшего компонента управляющих систем мозга.
Изучение особенностей фиброархитектоники позволило установить, что ее возрастные преобразования наблюдаются у детей вплоть до 12 лет и продолжаются у подростков (Tsekhmistrenko et al., 2004). Усложнение фиброархитектоники коры во всех исследованных полях в коре у подростков и юношей по сравнению с детьми 8–12 лет происходит за счет развития внутрикорковых волокнистых структур. По-видимому, увеличение удельного объема волокнистого компонента коры на микроструктурном уровне приводит к нарастанию расстояния между пучками в V слое префронтальной коры в паралимбическом поле 32/10 у юношей по сравнению с детьми.
В префронтальной коре в период от 13 до 16 лет происходит усложнение дендритных арборизаций нейронов, особенно четко выраженное в зоне Брока и коре лобного полюса, что свидетельствует о нарастании системных связей с другими корковыми зонами. Это наблюдение интересно в связи с данными исследований возрастных особенностей речевой функции по темпам и качеству артикуляции, в соответствии с которыми артикуляционные возможности и развитие речемоторных функций у подростков 13 лет значимо выше по сравнению с детьми 4–7-летнего возраста (Nip, Green, 2013).
Анализ результатов изучения соотношения микроструктурных компонентов коры больших полушарий свидетельствует о том, что у подростков и юношей по сравнению с детьми 8–12 лет отмечается снижение удельного объема микрососудов, которое сопровождается нарастанием относительного содержания глиального компонента префронтальной коры. Из этого не следует, что в постнатальном онтогенезе снижается уровень васкуляризации лобной коры путем снижения количества внутрикорковых сосудов. Наблюдаемые изменения объемных соотношений являются следствием изменений относительного содержания всех микроструктурных компонентов коры в целом. По мере постнатального развития и этапного перехода от детского возраста к взрослому происходит повышение надежности и экономизация функций организма (Маркосян, 1969). Вероятно, нарастание удельного объема глиоцитов отражает оптимизацию метаболических процессов в коре в условиях повышения с возрастом ее функциональной активности при реализации все более сложных механизмов мозговой деятельности. Об этом у подростков свидетельствует показанное нами ранее нарастание вариабельности содержания нуклеиновых кислот в астроцитах по сравнению с детьми 8–11 лет, а также появление значительной фракции свободно лежащих глиоцитов с высоким суммарным содержанием нуклеиновых кислот (Семенова и др., 2010). Возможно, снижение с возрастом удельных объемов внутрикорковых сосудов в сочетании с синхронным нарастанием глиального компонента носит системный, генетически запрограммированный и в известной степени компенсаторный характер. Основанием для этого предположения служит многообразие известных путей влияния астроцитарной глии на тонус внутрикорковых артериол (Filosa, Alddings, 2013).
ЗАКЛЮЧЕНИЕ
Таким образом, как показано на примере ряда цитоархитектонических полей, не только на этапе детства, но и у подростков и юношей по мере роста и развития происходят сопряженные микроструктурные изменения префронтальной коры, приводящие к закономерным преобразованиям ее морфофункциональной организации. Направленность этих преобразований в топографически и функционально различных корковых зонах носит сходный характер, но вместе с тем имеются зональные отличия по темпам и срокам возрастных изменений. Полученные данные свидетельствуют о ряде специфических морфофункциональных перестроек нейро- и фиброархитектоники префронтальной коры у подростков и юношей, являющихся микроструктурной основой совершенствования высших регуляторных систем, управляющих наиболее сложными формами мозговой деятельности. В филогенетически и функционально отличающихся отделах экранных структур мозга у подростков осуществляются структурные преобразования, направленные, в первую очередь, на окончательное формирование компонентов нейронных сетей. По ряду параметров, характеризующих количественные и качественные изменения, наиболее значительные синхронные структурные преобразования у подростков отмечаются к 13–14 годам. Увеличивающийся с возрастом полиморфизм эфферентных нейронов и интернейронов, образующих элементарные морфофункциональные объединения в системе распределенных нейросетей, является следствием развития и специализации функций высших корковых формаций. Выраженная локальная специализация микроструктур разного уровня является результатом нарастания у подростков региональных и транскортикальных связей, обслуживающих регуляторные процессы в корковых структурах мозга, управляющих когнитивной деятельностью и целенаправленным поведением.
Публикация подготовлена при поддержке Программы стратегического академического лидерства РУДН.
This paper has been supported by the RUDN University Strategic Academic Leadership Program.
Список литературы
Автандилов Г.Г. Медицинская морфометрия. М.: Медицина, 1990. 384 с.
Антонова А.М. Модификация метода Гольджи с применением вольфрамовокислого натрия. Бюлл. эксперим. биол. 1967. 63 (3): 123–124.
Антонова А.М., Степанова С.Б. Модификация метода Петерса применительно к цитологическим исследованиям. Бюлл. эксперим. биол. 1973. 75 (4): 122–124.
Атлас цитоархитектоники коры большого мозга человека. Под редакцией С.А. Саркисова, И.Н. Филимонова, Е.П. Кононовой, Н.С. Преображенской, Л.А. Кукуева и др. М.: Медгиз, 1955. 280 с.
Бескин Л.Н. Стереометрия. М.: Просвещение, 1971. 412 с.
Боголепова И.Н., Малофеева Л.И. Мозг мужчины, мозг женщины. М.: ФГБУ “НЦН” РАМН, 2014. 300 с.
Боголепова И.Н., Малофеева Л.И., Агапов П.А., Малофеева И.Г. Морфометрические исследования цитоархитектоники префронтальной коры мозга женщин. Фундаментальные исследования. 2015. 2 (25): 5583–5587.
Ланг Т.А., Сесик М. Как описывать статистику в медицине. М.: Практическая медицина, 2016. 480 с.
Маркосян А.А. Основы морфологии и физиологии организма детей и подростков. М.: Медицина, 1969. 575 с.
Мачинская Р.И. Управляющие системы мозга и их морфофункциональное созревание у детей. Мозговые механизмы формирования познавательной деятельности в предшкольном и младшем школьном возрасте М.-Воронеж: МПСУ, МОДЭК, 2014: 157–220.
Мачинская Р.И. Управляющие системы мозга. Журнал высшей нервной деятельности им. И.П. Павлова. 2015. 65 (1): 33–60. https://doi.org/10.7868/S0044467715010086
Семенова Л.К., Васильева В.А., Цехмистренко Т.А., Шумейко Н.С. Структурные преобразования коры головного мозга человека в постнатальном онтогенезе. Физиология развития ребенка. М.-Воронеж: МПСИ, МОДЭК, 2010: 132–200.
Стефанов С.Б., Кухаренко Н.С. Ускоренные способы количественного сравнения морфологических признаков и систем. Благовещенск: ВСХИ, 1989. 65 с.
Стрелков Р.Б. Экспресс-метод статистической обработки экспериментальных и клинических данных. М.: II МОЛГМИ, 1986. 86 с.
Фарбер Д.А. Системная мозговая организация зрительного восприятия и ее формирование в онтогенезе. Мозговые механизмы формирования познавательной деятельности в предшкольном и младшем школьном возрасте. М.-Воронеж: МПСУ, МОДЭК, 2014: 65–95.
Фарбер Д.А., Бетелева Т.Г. Формирование мозговой организации рабочей памяти в младшем школьном возрасте. Физиология человека. 2011. 37 (1): 5–15.
Физиология развития ребенка. Под ред. М.М. Безруких, Д.А. Фарбер. М.-Воронеж: МПСИ, МОДЭК, 2010. 768 с.
Цехмистренко Т.А., Васильева В.А., Обухов Д.К., Шумейко Н.С. Строение и развитие коры большого мозга. М.: Спутник+, 2019а. 538 с.
Цехмистренко Т.А., Обухов Д.К., Васильева В.А., Мазлоев А.Б., Шумейко Н.С. Структурные возрастные преобразования нейронных группировок коры большого мозга и мозжечка у детей. Журнал анатомии и гистопатологии. 2019б. 8 (4): 42–48.
Baars B.J., Gage N.M. Neurons and their connections. Cognition, Brain, and Consciousness. Introduction to Cognitive Neuroscience. 2nd Edition. Elsevier: Academic Press, 2010. P. 62–92. https://doi.org/10.1016/C2009-0-01556-6
Blakemore S.J. Imaging brain development: the adolescent brain. Neuroimage. 2012. 61 (2): 397–406. https://doi.org/10.1016/j.neuroimage.2011.11.080
Chen C.H., Panizzon M.S., Eyler L.T., Jernigan T.L., Thompson W., Fennema-Notestine C., Jak A.J., Neale M.C., Franz C.E., Hamza S., Lyons M.J., Grant M.D., Fischl B., Seidman L.J., Tsuang M.T., Kremen W.S., Dale A.M. Genetic influences on cortical regionalization in the human brain. Neuron. 2011. 72 (4): 537–544. https://doi.org/10.1016/j.neuron.2011.08.021
Docherty A.R., Sawyers C.K., Panizzon M.S., Neale M.C., Eyler L.T., Fennema-Notestine C., Franz C.E., Chen C.-H., McEvoy L.K., Verhulst B., Tsuang M.T., Kremen W.S. Genetic network properties of the human cortex based on regional thickness and surface area measures. Front Hum Neurosci. 2015. 9: 440. https://doi.org/10.3389/fnhum.2015.00440
Dubois J., Dehaene-Lambertz G., Perrin M., Mangin J.F., Cointepas Y., Duchesnay E., Le Bihan D., Hertz-Pannier L. Asynchrony of the early maturation of white matter bundles in healthy infants: quantitative landmarks revealed noninvasively by diffusion tensor imaging. Hum Brain Mapp. 2008a. 29 (1): 14–27. http://doi.wiley.com/10.1002/hbm.20363
Dubois J., Dehaene-Lambertz G., Soares C., Cointepas Y., Le Bihan D., Hertz-Pannier L. Microstructural correlates of infant functional development: example of the visual pathways. J Neurosci. 2008b. 28 (8): 1943–1948. https://doi.org/10.1523/JNEUROSCI.5145-07.2008
Dumontheil I., Burgess P.W., Blakemore S.J. Development of rostral prefrontal cortex and cognitive and behavioural disorders. Dev. Med. Child Neurol. 2008. 50(3): 168–181. https://doi.org/10.1111/j.1469-8749.2008.02026.x
Filosa J., Alddings J. Astrocyte regulation of cerebral vascular tone. AJP Heart and Circulatory Physiology. 2013. 305 (5): H609–H619. https://doi.org/10.1152/ajpheart.00359.2013
Gerbella M., Belmalih A., Borra E., Rozzi S., Luppino G. Cortical connections of the macaque caudal ventrolateral prefrontal areas 45A and 45B. Cerebral Cortex. 2010. 20 (1). 141–168. https://doi.org/10.1093/cercor/bhp087
Kanwisher N. Functional specificity in the human brain: a window into the functional architecture of the mind. Proc Natl Acad Sci U S A. 2010. 107 (25): 11163–11170. https://doi.org/10.1073/pnas.1005062107
Kedlian V.R., Donertas H.M., Thornton J.M. The widespread increase in inter-individual variability of gene expression in the human brain with age. Aging (Albany NY). 2019. 11 (8): 2253–2280. https://doi.org/10.18632/aging.101912
Khundrakpam B.S., Reid A., Brauer J., Carbonell F., Lewis J. and Brain Development Cooperative Group. Developmental Changes in Organization of Structural Brain Networks. Cerebral Cortex. 2013. 23 (9): 2072–2085. https://doi.org/10.1093/cercor/bhs187
Kostovic I., Judas M. Prolonged coexistence of transient and permanent circuitry elements in the developing cerebral cortex of fetuses and preterm infants. Dev Med Child Neurol. 2006. 48 (5): 388–393. https://doi.org/10.1017/S0012162206000831
Leh S.E., Petrides M., Strafella A.P. The neural circuitry of executive functions in healthy subjects and Parkinson’s disease. Neuropsychopharmacology. 2010. 35 (1): 70–85. https://doi.org/10.1038/npp.2009.88
Mansouri F.A., Matsumoto K., Tanaka K. Prefrontal cell activities related to monkeys' success and failure in adapting to rule changes in a Wisconsin Card Sorting Test analog. J Neurosci. 2006. 26 (10): 2745–2756. https://doi.org/10.1523/JNEUROSCI.5238-05.2006
Margulies D.S., Petrides M. Distinct parietal and temporal connectivity profiles of ventrolateral frontal areas involved in language production. J. Neurosci. 2013. 33 (42): 16846–16852. https://doi.org/10.1523/JNEUROSCI.2259-13.2013
Nip I.S.B., Green J.R. Increases in Cognitive and Linguistic Processing Primarily Account for Increases in Speaking Rate with Age. Child Dev. 2013. 84 (4): 1324–1337. https://doi.org/10.1111/cdev.12052
Paus T., Zijdenbos A., Worsley K., Collins D.L., Blumenthal J., Giedd J.N., Rapoport J.L., Evans A.C. Structural Maturation of Neural Pathways in Children and Adolescents: In Vivo Study. Science. 1999. 283 (5409): 1908–1911. https://doi.org/10.1126/science.283.5409.1908
Pessoa L. Understanding brain networks and brain organization. Phys Life Rev. 2014. 11 (3): 400–435. https://doi.org/10.1016/j.plrev.2014.03.005
Senitz D., Reichenbach A., Smithy T.G. Surface complexity of human neocortical astrocytic cells: changes with development, aging and dementia. J Hirnforsch. 1995. 36 (4): 531–537.
Tsekhmistrenko T.A., Vasil’eva V.A., Shumeǐko N.S., Vologirov A.S. Quantitative changes in fibro-architectonics of the human cerebral cortex from birth to 12 years of age. Neuroscience and Behavioral Physiology. 2004. 34 (9): 983–988. https://doi.org/10.1134/S0362119710010032
Tsekhmistrenko T.A., Vasilyeva V.A., Shumeiko N.S. Structural Rearrangements of the Cerebral Cortex in Children and Adolescents. Human Physiology. 2017. 43 (2): 123–131. https://doi.org/10.1134/S0362119717020153
Van den Heuvel M.P., Sporns O. Rich-club organization of the human connectome. J Neurosci. 2011. 31 (44): 15775–15786. https://doi.org/10.1523/JNEUROSCI.3539-11.2011
Venkat P., Chopp M., Chen J. New Insights Into Coupling and Uncoupling of Cerebral Blood Flow and Metabolism in the Brain. Croat Med J. 2016. 57 (3): 223–228. https://doi.org/10.3325/cmj.2016.57.223
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


