Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 5, стр. 605-619
Особенности развития коры мозга человека во втором триместре гестации
Е. И. Краснощекова 1, *, **, П. А. Зыкин 1, Л. А. Ткаченко 1, Е. А. Козубенко 1, Н. А. Костин 2, Е. А. Цветков 1, Р. А. Насыров 3, А. Д. Харазова 1
1 Кафедра цитологии и гистологии, Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
2 Ресурсный центр “Развитие молекулярных и клеточных технологий”,
Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
3 Кафедра патологической анатомии с курсом судебной медицины,
Санкт-Петербургский государственный педиатрический университет
Санкт-Петербург, Россия
* E-mail: e.krasnozchekova@spbu.ru
** E-mail: krasnelena@gmail.com
Поступила в редакцию 30.11.2020
После доработки 26.02.2021
Принята к публикации 02.03.2021
Аннотация
Цель работы – изучить закономерности постмиграционного развития нейронов, сопутствующих стратификации дорзальной предцентральной и верхней височной областей неокортекса плодного мозга человека. Исследовано 10 экземпляров мозга плодов 20–26 нед гестации, блоки ткани залиты в парафин, изготовлены серийные срезы, каждый 10-й срез окрашен по Нисслю. Остальные подвергнуты иммуноокрашиванию с антителами к МАР2, слой-специфичным белкам SATB2, FOXP1 и CTIP2, рилину и N200. В 4 случаях дополнительные блоки не заливали в парафин, обрабатывая методами Сlarity или MALDI IMS. С 20-й по 26-ю неделю внутриутробного развития в кортикальной пластинке изученных областей коры нейроны, иммунопозитивные к антителам слой-специфичных транскрипционных факторов, приурочены к разным этажам корковой пластинки: SATB2+ – к верхнему, FOXP1+ и CTIP2+ – к нижнему. Количественная оценка уровней максимальной плотности SATB2+, FOXP1+ и CTIP2+ нейронов позволила выделить эмбриональные слои eII, eIII, eV, eVI и субпластинку. В исследованном периоде в кортикальной пластинке обеих областей численность нейронов, иммунопозитивных к МАР2, демонстрирует положительную динамику. Первый кластер МАР2+ пирамидных клеток отмечен у 20-недельных плодов в слое eV, к 26-й неделе формируется кластер слоя eIII. Анализ результатов иммуноокрашивания крупных блоков коры фетального мозга человека свидетельствует о сложной пространственной организации маргинальной зоны, с локализацией рилин-позитивных клеток Кахаля–Ретциуса у поверхности и волоконного сплетения в глубине маргинальной зоны. Совокупность всех полученных данных свидетельствует о том, что две анатомически удаленные области коры – предцентральная и верхняя височная – в первой половине плодного периода развиваются синхронно.
Модельные исследования чрезвычайно ценны для понимания закономерностей онтогенеза мозга, но многие морфологические и цитохимические характеристики неокортекса человека не воспроизводятся в полной мере на моделях (Cozzi et al., 2020). Кора полушарий большого мозга человека обладает уникальными структурно-функциональными особенностями, полное понимание которых может быть раскрыто при изучении плодного периода развития. Закономерности кортикогенеза в мозге человека в первом триместре гестации гомологичны другим млекопитающим, в том числе лабораторным грызунам, и исследованы достаточно полно, тогда как второй и третий триместры изучены слабо (Bayer, Altman, 1991).
Уже в начале второго триместра цитоархитектоника перивентрикулярной зоны мозга человека иная, чем у грызунов, и помимо вентрикулярной и субвентрикулярной зон включает еще и наружную вентрикулярную зону (Kalebic et al., 2019; Molnár et al., 2019). Прогениторные клетки синтезируют белок TBR2, который обеспечивает их дифференцировку в глутаматергические проекционные нейроны (Hevner, 2019; Kalebic et al., 2019). У человека и других млекопитающих с гирифицированным мозгом численность таких нейронов выше, чем в лисэнцефальном мозге мыши (Kalebic et al., 2019; Molnár et al., 2019). При нарушении экспрессии TBR2 в плодном периоде возникает тяжелая кортикальная мальформация – микроцефалия с полимикрогирией (Baala et al., 2007). Патологии такого рода сопровождаются нарушением структурно-функциональной специализации нейронов корковой пластинки.
Особенность развития неокортекса млекопитающих заключается в том, что слои корковой пластинки формируются изнутри наружу (Rakic, 1988). Однако дальнейшая специализация нейронов и гетерогенность зон коры полушарий, описанная в мозге плодов человека в раннем и среднем периодах онтогенеза (Поляков, 1937), остаются слабо исследованными. В своей фундаментальной работе Г.И. Поляков первым установил важную закономерность: в середине внутриутробного периода целостное развитие коры по принципу радиарности переходит к “….развитию по принципу региональности и ареальности” (Поляков, 1937).
Ранняя, у человека в первом триместре, ареализация коры полушарий большого мозга млекопитающих происходит в передне-заднем и латеро-медиальном направлениях, что позволило создать протокарты (от “прототипа” и “карты”) закладок зрительной, слуховой и соматосенсорной зон неокортекса (Rakic, 1988, 2009; Pletikos et al., 2014). Несмотря на сходство протокарт человека и грызунов, обнаружены отличия в реципрокной экспрессии генов COUP-TFI, COUP-TFII и SP8. У человека на 8–12-й неделе гестации экспрессия SP8 и COUP-TFI широко перекрывается в вентрикулярной зоне закладок первичных сенсорных проекций: зрительной, слуховой и соматосенсорной (Alzu’bi et al., 2017), – а у мыши такое перекрытие очень незначительно (Borello et al., 2013). В коре полушарий мозга плода человека 9–10 нед гестации экспрессия COUP-TFI самая высокая в височной области, незначительно ниже в затылочной, наиболее низкая – в теменной и лобной. В этом периоде обратную тенденцию имеет экспрессия ROBO1, которая выше всего в лобной, ниже в теменной, низкая в височной и затылочной областях коры полушарий мозга человека (Alzu’bi et al., 2017; Ip et al., 2011).
Уточнить корреляты протокарт во втором-третьем триместрах гестации человека позволяют МРТ-исследования. Путем сканирования аутопсийного мозга плодов 12–22 нед гестации были уточнены представления о хронологии развития борозд и извилин (Zhang et al., 2013; Im, Grant, 2019; Yun et al., 2019). В интервале от 12 до 16 нед начинается закладка первичных борозд, и к 22-й неделе гестации удается идентифицировать большинство из них. Поскольку к таким бороздам приурочены закладки проекционных сенсорных и моторного полей неокортекса, их можно считать границами основных областей полушарий, соответствующих протокартам. При этом признаки межполушарной асимметрии и полового диморфизма на этапе закладки борозд не обнаружены.
Методами диффузионно-тензорной МРТ и внутриутробной функциональной МРТ мозга плодов второго и третьего триместров гестации установлено, что межполушарные связи коры полушарий мозга начинают формироваться уже во втором триместре гестации ( Huang et al., 2009). Такое раннее становление межполушарных связей косвенно указывает на то, что второй триместр является критическим для структурно-функциональной дифференцировки клеток коры полушарий мозга с высокой вероятностью их повреждения неблагоприятными воздействиями (Turk et al., 2019). Гетерохронное развитие отдельных областей коры с периодами повышенной уязвимости нейронов и глии необходимо учитывать при анализе причин патологий мозга внутриутробного генеза (Goergen et al., 2019). Наиболее очевидный путь получения необходимых сведений об этом – исследование мозга плода современными методами визуализации. К таким методам, несомненно, относятся все варианты магнитно-резонансной томографии, комплексное применение которых позволило сформировать новое направление, известное как патоконнектомика – область исследования нарушенных связей развивающегося мозга при внутриутробном и посмертном сканировании (Zhang et al., 2013; Jakab et al., 2019). Однако разрешающая способность даже высокопольных сканеров недостаточна для изучения кортикогенеза на уровне клеточных слоев и отдельных нейронов, для этого необходимы современные методы иммунофлуоресцентной микроскопии. В настоящее время механизмы дифференцировки проекционных нейронов во время эмбриогенеза изучены на животных. Проекционные нейроны образуют два основных класса: клетки верхних слоев, аксоны которых образуют корково-корковые связи, и нейроны глубоких слоев, инициирующие субкорковые проекции. Клетки, которые в будущем сформируют глубокие слои коры, экспрессируют транскрипционные факторы Fezf2 и Ctip2, клетки-предшественники верхних слоев коры синтезируют Satb2. При этом Fezf2/Ctip2 и Satb2 блокируют активность друг друга, что гарантирует будущую позицию нейронов в конкретном слое коры, а также траекторию проекций, которые сформируют их аксоны (Leone, 2008). В то же время вопрос постмиграционной дифференцировки нервных клеток коры мозга человека относится к наименее изученным, так как цито- и хемоархитектонику пренатального мозга человека исследовать сложно, главным образом из-за проблем со стандартизацией постмортемного плодного материала.
Цель настоящей работы – изучение особенностей развития нейронов на начальных этапах постмиграционной дифференцировки и стратификации неокортекса дорсальной предцентральной и верхней височной областей полушарий мозга плода человека. Новизна подхода заключается в сравнительном исследовании развития топографически удаленных друг от друга областей коры полушарий, которые относятся к разным функциональным системам мозга. Такой анализ позволяет проверить особенности пренатального развития коры полушарий мозга тех областей неокортекса, которые приурочены к первичным бороздам и топографически удалены друг от друга.
МЕТОДИКА
Характеристика материала
Исследовано десять левых полушарий мозга плодов человека в возрасте от 20 до 26 нед гестации из архива СПбГПМУ с соблюдением положений закона № 8-ФЗ, приказа МЗ РФ № 354 от 06.06.2013, с одобрением этического комитета СПбГПМУ (протоколы № 6/5 от 10.06.2014; № 2/5 от 06.02.2019). Весь материал с постмортемным сроком не более 24 ч по заключению патологоанатома не имел неврологических патологий и кровоизлияний, показал отрицательную реакцию на герпес-вирусы (1-й, 4-й и 5-й типы). Материал фиксировали в 4%-ном растворе параформальдегида на 0.1 М фосфатном буфере pН 7.4. Сроки хранения материала в фиксаторе были различны – от 1 нед до 3.5 лет. Выделенные из мозга фрагменты височной и лобной долей мозга заливали в парафин, серийные фронтальные срезы толщиной 12 мкм готовили на микротоме “Leica” RM 2245 (Leica Microsystems, Германия). Для последующего исследования срезы через один окрашивали крезиловым фиолетовым по Нисслю или подвергали иммуногистохимической (ИГХ) обработке. Хорошо известны трудности, с которыми сталкиваются исследователи архивного аутопсийного материала, особенно это справедливо в отношении иммуногистохимической обработки, поскольку из-за длительного хранения в формалиновых фиксаторах многие антигены становятся недоступны для анализа, а в тканях образуются интенсивно флуоресцирующие соединения. Мы тоже столкнулись с этими трудностями, результаты иммунофлуоресцентных реакций и окраски по Нисслю представлены в табл. 1.
Иммуногистохимия
Иммунофлуоресцентные исследования проводили с применением антител, которые ранее показали хороший результат при обработке ткани фетального мозга человека второго-третьего триместров гестации (Saito et al., 2011): Satb2 (special AT-rich binding protein 2) маркирует те нейроны слоев II–IV, аксоны которых образуют корково-корковые проекции; Ctip2 (C2H2-type zinc finger protein) маркирует нейроны слоев V and VI, которые дают начало субкорковым проекциям; Foxp1 (factor of the winged-helix/forkhead family) синтезируется в нейронах слоев III–V. Кроме того, применили антитела, использование которых отработано ранее при исследовании ткани фетального мозга человека (Tkachenko et al., 2016): MAP2 (microtubuleassociated protein 2) маркирует сому и дендриты нейронов; N200 (neurofilament 200) маркирует аксоны и дендриты нейронов; рилин (Reln) – регуляторный гликопротеин – избирательно синтезируется нейронами Кахаля–Ретциуса маргинальной зоны коры.
Иммуногистохимическую обработку ткани проводили на стеклах по оригинальному протоколу:
1) Предварительно депарафинированные срезы промывали в Трис-буфере pH 7.4. Восстановление эпитопов проводили с использованием ретривера (2100 Antigen Retriever, Aptum Biologics Ltd, Великобритания), где препараты в течение 10 мин находились в Трис-EDTA-буфере pH 9.0 при повышенном давлении и температуре 121°С с последующим медленным остыванием до комнатной температуры.
2) Для снижения автофлуоресценции часть препаратов подвергали процедуре фотовыцветания в течение 24 ч в установке собственной конструкции (Козубенко и др., 2021).
3) Для визуализации ядер клеток препараты инкубировали в водном растворе DAPI (1 нг/мл) в течение 45 мин.
4) Для блокировки реактивных сайтов неспецифических белков препараты на протяжении 2 ч инкубировали в вертикальной камере (Thermo Shandon Sequenza) с блокирующим раствором следующего состава: 0.3% Tритон X-100; 10% нормальной козьей сыворотки (NGS, Sigma G9023) на Трис-буфере pH 74.
5) Инкубацию с первичными антителами проводили в течение 12 ч в вертикальной камере при 4°C. Для первичных антител использовали следующее оптимальное разведение: анти-CTIP2 1: 100 (Abcam ab18465 RRID:AB_2064130), анти-FOXP1 1:100 (Abcam ab16645, RRID:AB_732428), анти-SATB2 1: 50 (Abcam ab51502, RRID:AB_882455), анти-MAP2 1: 100 (Sigma M9942, RRID:AB_477256), анти-МАР2 (MAP2, 1: 200, Sigma-Aldrich Cat# M9942 RRID:AB_477256), анти-N200 (1: 250, Sigma-Aldrich Cat# N4142 RRID:AB_477272), анти-рилин (Reln, 1: 250, Millipore Cat# MAB5366 RRID:AB_2285132).
6) Инкубация срезов с вторичными антителами проходила во влажной камере в течение 2 ч при температуре 37°С. Использовали вторичные антитела, конъюгированные с флуорохромами, в разведении 1: 250 для Alexa488 (коза-анти-кролик IgG Alexa488 Molecular Probes A-11008, RRID:AB_143165), Alexa568 (коза-анти-крыса IgG Alexa568, AbCam ab175710, RRID:AB_2832918) и Alexa647 (коза-анти-мышь IgG Alexa647 AbCam ab150115, RRID:AB_2687948). Первичные и вторичные антитела разводили блокирующим раствором следующего состава: 0.3% Tритон X-100; 1% нормальная козья сыворотка (NGS, Sigma G9023) на Трис-буфере pH 7.4.
7) Неспецифическое связывание вторичных антител контролировали инкубацией препаратов с нормальной сывороткой соответствующих животных (мышь, крыса, кролик) в концентрации, близкой к используемой концентрации первичных антител. Препараты заключались в 80%-ный глицерин на Трис-буфере с pH 7.4.
Делипидизация по методу Сlarity с последующим иммуномаркированием нейронов в толстых срезах ткани
Традиционные подходы с использованием тонких гистологических срезов не позволяют полностью идентифицировать сложную трехмерную структуру дендритного древа нервных клеток. Толщину среза ограничивают непрозрачность ткани из-за рассеивания света на границах сред с большой разницей коэффициента преломления, например, на липидных мембранах, и глубина проникновения антител. Методы оптического просветления позволяют решить эти проблемы. В настоящем исследовании использован способ делипидизации фрагментов коры мозга объемом до 0.5 см3 в водной среде – Сlarity (Chung et al., 2013), оптимизированный для работы с фетальным мозгом, длительно фиксированным в формалине. Исследовали маргинальную зону височной области коры мозга трех плодов в возрасте 25–26 недель гестации. До обработки ткань хранилась в 4%-ном растворе параформальдегида на 0.1 М PB с pH 7.4 в течение 3.5 лет. Иммуномечение проводили с антителами к МАР2, рилину и N200.
Микроскопы и программное обеспечение
Препараты исследовали с помощью флуоресцентных микроскопов Leica DM 5500, Leica DMI 6000 с камерой DFC365FX и конфокального микроскопа Leica TCS SP5 ( Leica Microsystems, Германия) с использованием “синего”, “зеленого”, “красного”, “инфракрасного” фильтр-кубов со следующими характеристиками: синий (A4) – эмиссия 470/40, возбуждение 360/40; зеленый (L5) – эмиссия 527/30, возбуждение 480/40; красный (Y3) – эмиссия 610/75, возбуждение 535/50; инфракрасный (Y5) – эмиссия 700/75, возбуждение 620/60. Анализ изображений был проведен с помощью свободно доступного программного обеспечения FIJI11. Изображения во всех трех каналах были получены при увеличении ×20. Для автоматической съемки, фокусировки и сшивки изображений отдельных полей зрения использовали свободно доступное программное обеспечение управления микроскопом MicroManager 2.022. Средняя площадь изображений, смонтированных из нескольких полей зрения, составила ~ 2 см2.
Съемку всех препаратов проводили при одинаковых настройках микроскопа, лампы возбуждающего света и камеры. Подсчет иммунопозитивных ядер нейронов осуществляли по ранее описанной методике (Zykin et al., 2018; Krasnoshchekova et al., 2020). Оценивали количество ИГХ-позитивных и окрашенных DAPI ядер на площади ~1.5 мм2 каждого среза. По полученным данным строили графики распределения иммунопозитивных клеток в поперечнике коры. Оценивали процентное отношение иммунопозитивных ядер нейронов к количеству ядер всех клеток, окрашенных DAPI в каждом из слоев корковой пластинки.
Метод матричной лазерной десорбционной ионизации имиджинговой масс-спектрометрии (MALDI IMS)
Для изучения липидного состава коры использованы блоки височной доли полушарий тех образцов мозга, которые подвергали иммуноокрашиванию. Блоки заключали в 3%-ный раствор легкоплавкой агарозы и изготавливали срезы толщиной 100 мкм с помощью вибратома Leica VT1200S. Срезы монтировали на токопроводящие стекла, обработанные 0.1%-ным раствором поли-L-лизина. Распределение липидов исследовали методом матричной лазерной десорбционной ионизации имиджинговой масс-спектрометрии (MALDI IMS), который используется для анализа биологических образцов, обеспечивая визуализацию распределения молекул в анатомических структурах. Исследование аутопсийного фиксированного материала затруднено тем, что MALDI-IMS в основном выполняется на криостатированных тканях без предварительной фиксации. Формалиновая фиксации вызывает подавление сигнала от молекул липидов (Kajimura et al., 2016) и требует оптимизации протокола, который был отработан авторами и опубликован ранее (Зыкин и др., 2019). Исследование проведено на масс-спектрометре MALDI-TOF Bruker Ultraflextreme с программным обеспечением Bruker FlexControl v. 3.3 и FlexImaging v. 3.0. Оценивали данные по распределению липидов в зонах коры височной доли полушарий мозга, полученные при использовании матрицы DAN в положительном и отрицательном режимах ионизации.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Для выполнения поставленных задач проведено сравнительное исследование следующих областей коры больших полушарий мозга: дорсо-латеральной предцентральной, вдоль центральной борозды, и верхней височной по границе с латеральной бороздой. В зависимости от линейки антител, использованных в ходе иммуногистохимического маркирования, дополнительных методов исследования и гестационного возраста плода (см. табл. 1) описание материала скомпоновано следующим образом: в первый раздел включены 3 случая в возрасте 20–22 нед; во второй – 3 случая в возрасте 23–24 нед; в третий – 4 случая в возрасте 25–26 нед; в четвертом разделе анализируются результаты иммуномаркирования нейронов коры полушарий мозга плодов 20–26 нед гестации антителами к МАР2.
Таблица 1.
Сведения об экспериментальном материале Table 1. Details of experimental materials
| Сведения о методах обработки материала и антителах, использованных при проведении иммуногистохимических реакций | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| № | Возраст (нед) | Nissl | МАР2 | FOXP1 | SATB2 | CTIP2 | N200 | Reln | MALDI | Сlarity |
| 1 | 20–22 | Х(+++) | Х (+++) | Х(+++) | Х(+) | Х(+++) | Х(–) | Х(+++) | ||
| 2 | 20–22 | Х(++) | Х(+++) | Х(–) | Х(–) | Х(–) | Х(–) | Х(–) | Х | |
| 3 | 20–22 | Х(++) | Х(+++) | Х(–) | Х(–) | Х(–) | Х(–) | Х(–) | Х | |
| 4 | 23–24 | Х(+++) | Х(+++) | Х(+++) | Х(+++) | Х(+++) | Х(+++) | Х(+) | ||
| 5 | 23–24 | Х(+++) | Х(+++) | Х(–) | Х(–) | Х(+++) | Х(+) | Х(++) | ||
| 6 | 23–24 | Х(+++) | Х(+++) | Х(+) | Х(+++) | Х(+) | Х(+) | Х(+) | ||
| 7 | 25–26 | Х(+++) | Х(++) | Х(+) | Х(+) | Х(+) | Х(+++) | Х(+++) | Х | |
| 8 | 25–26 | Х(++) | Х(+++) | Х(++) | Х(-) | Х(-) | Х(+++) | Х(+++) | Х | |
| 9 | 25–26 | Х(++) | Х(+++) | Х(+) | Х(+) | Х(+) | Х(+++) | Х(+++) | Х | |
| 10 | 25–26 | Х(++) | Х(+) | Х(++) | Х(+) | Х(+) | Х(–) | Х(–) | ||
Примечание: сравнительная эффективность окраски по Нисслю и ИГХ-реакции отмечены (–), (+), (++) или (+++); положительный или отрицательный результат ИГХ-реакции на каждом образце подтвержден не менее трех раз. Note: the comparative efficiency of Nissl staining and IHC-reaction is marked by (–), (+), (++) or (+++); a positive or negative result of the IHC reaction on each sample was confirmed at least three times.
В результате анализа препаратов мозга 20–22-недельных плодов, окрашенных по методу Ниссля, установлено, что в коре обеих исследованных областей можно выделить три зоны: маргинальную, бедную клеточными элементами, плотноклеточную корковую пластинку, более редкоклеточную субпластинку, которая плавно переходит в интермедиальную зону. Толщина коры, включая маргинальную зону и субпластинку до границы с интермедиальной зоной в предцентральной области, составила 1100 ± 31 мкм, в височной – 970 ± 14 мкм. Графики значений оптической плотности подкрепили визуальные наблюдения (рис. 1 (а)).
Рис. 1.
Цитоархитектоника коры верхней височной области (а) и распределение липидов на фронтальном срезе височной доли (б) мозга человека 21 нед гестации. На (а) – срез височной доли, окрашенный по Нисслю, цитоархитектоника коры верхней височной области и график оптической плотности. Обозначения: MZ – маргинальная зона, CP – корковая пластинка, SP – субпластинка. CP дополнительно выделена цветом в соответствии с границами кластера фосфадилхолина PC(30:0). На (б) – распределение детектированных липидов на срезе. Отмечены фосфадилхолины, кластеры которых приурочены к корковой пластинке височной области.
Fig. 1. Cytoarchitectonics of the upper temporal region (а) and the distribution of certain lipids on the frontal section of the temporal lobe (b) of the brain of a human fetus at 21 weeks of gestation. (а) – section of the temporal lobe, stained according to Nissl, cytoarchitectonics of the upper temporal region and a graphics of optical density. Designations: MZ – marginal zone, CP – cortical plate, SP – subplate. The CP is additionally highlighted in color in accordance with the boundaries of the phosphadylcholine PC cluster (30:0). (b) – distribution of the detected lipids on the section; phosphadylcholines which are confined to the cortical plate of the temporal cortex are highlighted by a dashed circles.
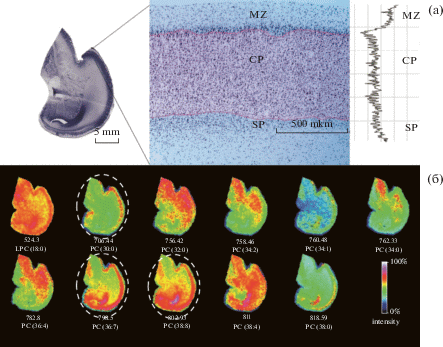
Граница корковой пластинки с маргинальной зоной и субпластинкой подтверждается данными имиджинговой масс-спектрометрии (MALDI IMS). Липиды головного мозга демонстрируют широкое биохимическое и функциональное разнообразие, а также, в зависимости от свойств, избирательную приуроченность к определенным ядрам или слоям серого вещества, к белому веществу разных отделов мозга. Из тех липидов, которые удалось идентифицировать в образцах коры височной доли мозга плодов 20–22 нед гестации, оказались фосфодилхолины, при этом три из них: PC(30:0), PC(36:7), PC(38: 8) – выделены только в кортикальной пластинке (рис. 1 (б)), но не в маргинальной зоне и субпластинке, что подтверждает данные цитоархитектоники.
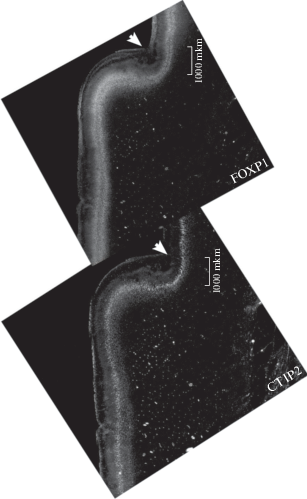
Данные о более сложном строении корковой пластинки получены методом иммуногистохимии с антителами к CTIP2 и FOXP1, SATB2. Иммуномаркирования высокого качества удалось добиться только на одном образце височной доли с высокой плотностью CTIP2+ и FOXP1+ ядер нейронов (см. табл. 1), тем не менее результат заслуживает анализа, так как убедительно демонстрирует диверсификацию CTIP2+ и FOXP1+ нейронов. Реконструкция нескольких полей зрения верхней височной области коры площадью около 0.5 см2 (рис. 2) наглядно иллюстрирует, что FOXP1+ нейроны представлены во всей корковой пластинке, но их совокупность разделена полосой, в которой плотность таких клеток заметно снижается. Уровень с низкой плотностью FOXP1+ ядер совпадает по глубине залегания с зоной максимальной плотности CTIP2+ нейронов.
Рис. 2.
Взаимодополняющие кластеры CTIP2+ и FOXP1+ нейронов коры височной области мозга человека 20 нед гестации. Стрелка указывает на латеральную борозду, верхняя височная область – слева от борозды.
Fig. 2. Complementary groups of CTIP2+ and FOXP1+ neurons in the temporal cortex of the brain of the fetus at 20 weeks of gestation. The arrow indicates the lateral gyrus, the superior temporal region to the left of the arrow.
В возрасте 23–24 нед гестации стратификация корковой пластинки в верхней височной и предцентральной областях коры усложняется. На препаратах, окрашенных по Нисслю, слой eII становится более плотноклеточным, чем ниже расположенные слои, которые выделить цитоархитектонически не удается. В этот период начавшаяся стратификация коры сопровождается ее утолщением до 1450 ± 18 мкм в предцентральной и до 1104 ± 23 мкм в височной областях.
Иммуногистохимическое выявление нейронов корковой пластинки предцентральной и височной областей коры проводили с использованием антител к слой-специфичным транс-крипционным факторам: CTIP2, SATB2, FOXP1. Поскольку в исследуемый период цитоархитектонически сложно выделить слои корковой пластинки, при подсчете ИГХ+ элементов на изображение анализируемого участка коры предварительно наносили сетку из ячеек с длиной стороны 164 мкм. Такую же сетку наносили на соседний срез, окрашенный по Нисслю. Благодаря этому приему стало возможным проследить динамику численности иммунопозитивных клеток по поперечнику коры, определить более высокую плотность маркированных элементов на определенном уровне коры и таким образом получить представление о формировании слоев корковой пластинки. По поперечнику коры полушарий мозга плодов 23–24 нед гестации маркированные нейроны распределялись следующим образом: SATB2+ превалировали в верхней части корковой пластинки, CTIP2+ и FOXP1+ – в ее нижней части. Количественная оценка SATB2+, CTIP2+ и FOXP1+ клеток показала, что самая высокая плотность CTIP2+ ядер обнаружена на глубине 660–990 мкм предцентральной области коры и 425–920 мкм – височной. Максимум FOXP1+ ядер установлен на глубине 600–1000 мкм предцентральной коры и 400–950 мкм – височной. Максимальная плотность SATB2+ нейронов установлена на глубине 200–650 мкм предцентральной и 95–600 мкм височной областей (рис. 3). Зоны распределения всех трех маркеров перекрываются, поэтому для определения границ слоев мы ориентировались на те уровни, в которых плотность ИГХ+ нейронов была максимальна. По компактному расположению SATB2+, CTIP2+ и FOXP1+ элементов установлены предполагаемые границы цитоархитектонических слоев на препаратах, окрашенных по Нисслю (рис. 4). Дальнейшее исследование проводили с учетом назначенных границ слоев еII-еVI корковой пластинки. Дополнительно оценивали количество иммунофлуоресцентных ядер нейронов относительно общей численности всех ядер, окрашенных DAPI, в каждом из слоев обеих исследованных областей. В предцентральной области максимальное количество FOXP1+ элементов отмечено в глубокой части слоя еV и в слое еVI, где оно достигало 12%, а в слое еII и субпластинке снижалось до 3%; максимум CTIP2+ клеток установлен в слое еV – 5%, в слое еIII и еVI – сокращался до 3%; численность SATB2+ нейронов в слое еIII достигала 13% и падала до 6% в слоях еII и еVI. В верхней височной области максимум FOXP1+ элементов отмечен в слое еV и пограничном уровне слоя еVI, где он составил 8%, а в слоях еII и еVI снижался до 3%; численность CTIP2+ ядер в слоях еV и еVI была одинакова и составила около 5%, сокращаясь до 1% в слоях еII и субпластинке; численность SATB2+ нейронов в слое еIII достигала 12%, падала до 6% в слоях еII и еVI. Таким образом, выделение слоев по численному доминированию нейрохимически однородных клеток возможно даже тогда, когда цитоархитектонические признаки слоев еще не выражены.
Рис. 3.
Количество иммунопозитивных клеток на разных уровнях коры дорcолатеральной предцентральной (а) и верхней височной (б) областей полушарий мозга человека 23–24 нед гестации. По оси Х – толщина коры в мкм. По оси Y – количество иммунопозитивных клеток.
Fig. 3. The distribution of immunopositive cells at different levels of the cortex of the dorso-lateral precentral (а) and superior temporal (б) regions of the cerebral cortex of a human fetus at 23–24 weeks of gestation. X-axis is the thickness of the cortex (mkm). Y-axis is the number of immunopositive cells.
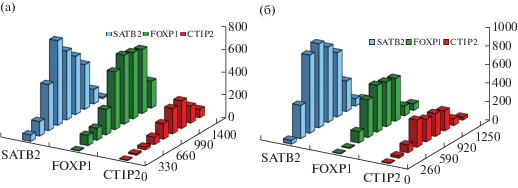
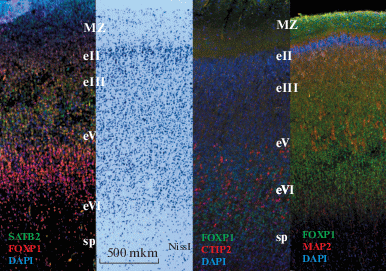
Рис. 4.
Стратификация коры дорсо-латеральной предцентральной области полушарий мозга человека 23–24 нед гестации по локализации иммунопозитивных нейронов и при окраске по Нисслю. Обозначения: MZ – маргинальная зона, eII – слой II, eIII – слой III, eV – слой V, eVI – слой VI корковой пластинки, SP – субпластинка.
Fig. 4. Stratification of the dorso-lateral precentral cortex of the fetus at 23–24 weeks of gestation by the localization of immunopositive neurons and by Nissl staining. Designations: MZ – marginal zone, eII – layer II, eIII – layer III, eV – layer V, eVI – layer VI of the cortical plate, SP – subplate.
В возрасте 25–26 нед гестации стратификация кортикальной пластинки в верхней височной и предцентральной областях коры практически не усложнялась по сравнению с описанным выше сроком 23–24 нед. На препаратах, окрашенных по Нисслю, отмечено утолщение коры до 1550 ± 28 мкм в предцентральной и до 1150 ± 18 мкм в височной областях. На материале этого возраста не удалось получить высококачественных результатов иммуногистохимической обработки с антителами к слой-специфичным транс-крипционным факторам. Несмотря на то что локализация SATB2+, CTIP2+ и FOXP1+ элементов была сходной со сроком 23–24 нед гестации в обеих областях коры, интенсивность реакции и плотность иммунопозитивных ядер нейронов оказались низкими, оценить их количественный состав не удалось.
Как уже отмечалось выше, те маркеры транскрипционных факторов, которые применялись в исследовании, отражают функциональную характеристику проекционных нейронов в соответствии со связями, которые формируют их аксоны – нисходящие субкорковые или корково-корковые. Морфологию таких нейронов возможно исследовать по экспрессии МАР2 – белка, ассоциированного с микротрубочками и специфичного только для нейронов (Минин, Кулик, 2004; Bennett et al., 2013). Поскольку нами предварительно были определены границы слоев кортикальной пластинки, развитие МАР2-пирамидных нейронов анализировали с учетом их залегания в определенном слое (рис. 4).
В корковой пластинке верхней височной и предцентральной областей коры мозга плодов 20–22 нед гестации МАР2-позитивные нейроны располагались компактно, образуя в предцентральной коре пласт толщиной около 170 ± 25 мкм, а в височной – около 250 ± 35 мкм. Такие МАР2+ клетки имели вытянутую округло-треугольную форму сомы, короткие, извитые неветвящиеся апикальные дендриты. В дальнейшем, вплоть до конца второго триместра, наблюдали заметное увеличение количества МАР2+ нейронов и расширение зоны поперечника, которую они занимали в корковой пластинке, до 500 ± ± 39 мкм в предцентральной и 450 ± 42 мкм в височной областях 25–26-недельных плодов. Все иммунопозитивные клетки были пирамидными, по площади профильного поля их можно было разделить на мелкие (45–90 мкм2), средние (100–190 мкм2) и крупные (200–380 мкм2). Анализ локализации нейронов, относящихся к каждому из трех размерных классов, показал, что средние и мелкие равномерно распределены по поперечнику зоны МАР2+ клеток, а крупные залегают в глубине (рис. 5).
Рис. 5.
МАР2-позитивные нейроны в коре дорсо-латеральной предцентральной области полушарий мозга человека 20 (а) и 26 (б) нед гестации. Обозначения: eIII, eV – слои III и V корковой пластинки.
Fig. 5. MAP2-positive neurons in the dorsal precentral region of the cerebral cortex of fetuses at 20 (а) and 26 (б) weeks of gestation. Designations: eIII, eV – layers III and V of the cortical plate.

После совмещения изображений срезов, окрашенных по Нисслю и обработанных ИГХ с антителами к МАР2, стало очевидным, что уровень крупных МАР2+ пирамид совпадает со слоем eV, который предварительно выделен по максимальной плотности CTIP2+ элементов, а средних и мелких МАР2+ нейронов – со слоем eIII с высокой плотностью SATB2+ ядер. Такая же очередность дифференцировки и локализация МАР2-позитивных нейронов в слоях eIII и eV характерны и для коры верхней височной области большого мозга.
Несмотря на то что мы не смогли добиться устойчивого иммуноокрашивания со всеми маркерами для каждого срока гестации и всех исследованных случаев, результаты, полученные разными методами, дополняют друг друга, подтверждая синхронность и общую закономерность стратификации верхней височной и предцентральной коры в период с 20-й по 26-ю неделю гестации.
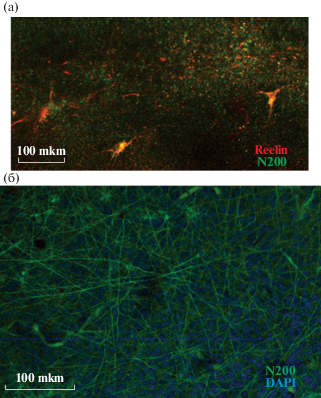
Ключевую роль в регуляции начальных этапов стратификации коры выполняют клетки Кахаля–Ретциуса маргинальной зоны. В коре мозга человека строение этих нейронов, их нейрохимические характеристики изучены слабо. При этом маргинальная зона коры фетального мозга имеет сложную пространственную организацию, в связи с чем для ее исследования требуется иммуноокрашивание более толстых, чем принято обычно, срезов. С помощью такой обработки удалось выявить клетки Кахаля–Ретциуса, что подтверждается их рилин-позитивностью, помимо этого они иммунопозитивны к МАР2. Нейроны Кахаля–Ретциуса имели треугольную форму тела с площадью профильного поля от 100 до 250 мкм2. От сомы клетки отходили от 3 до 5 дендритов, широко ветвящихся параллельно поверхности коры, и один нисходящий отросток, тела нейронов залегали в поверхностной части маргинальной зоны. Волоконное сплетение ниже зоны локализации клеток Кахаля–Ретциуса состояло из идущих параллельно пиальной поверхности коры взаимно пересекающихся N200+ отростков (рис. 6). Полученные результаты свидетельствуют о том, что маргинальная зона содержит те структурные компоненты – рилин-позитивные нейроны Кахаля–Ретциуса и сплетение горизонтальных волокон, которые регулируют миграцию нейробластов в кору.
Рис. 6.
Организация маргинальной зоны коры верхней височной области полушарий мозга человека 25–26 нед гестации по результатам иммунофлуоресцентного маркирования крупного (762 × 762 × 180 мкм) фрагмента ткани. (а) – клетки Кахаля–Ретциуса поверхностного уровня маргинальной зоны. (б) – волоконное сплетение глубокого уровня маргинальной зоны.
Fig. 6. Organization of the marginal zone of the temporal region of fetal cerebral cortex at 25–26 weeks of gestation, results of immunostaining of a large block (762 × 762 × 180 mkm) of tissue after optical clearing. (а) – Cajal–Retzius cells of the surface level of the marginal zone. (б) – fiber plexus of the deep level of the marginal zone.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе показано, что в течение 20–26 нед гестации две области коры полушарий мозга человека: дорсо-латеральная предцентральная вдоль центральной борозды и верхняя височная по границе с латеральной бороздой – развиваются синхронно, хотя топографически они удалены друг от друга и относятся к разным функциональным системам мозга. Этот факт подтверждает принцип регионального кортикогенеза в среднем периоде гестации (Поляков, 1937), а также ранее выдвинутое предположение о том, что первичные борозды указывают на сходство развития прилежащих к ним областей коры полушарий мозга (Zhang et al., 2013). О том же свидетельствуют особенности функционального коннектома (совокупности проводящих трактов) мозга плода человека, в котором к концу второго триместра беременности визуализируются некоторые межполушарные и субкорковые тракты (Turk et al., 2019). Авторы справедливо полагают, что становление трактов зависит от уровня развития отдельных регионов коры полушарий мозга и для полного понимания закономерностей становления связей нужны маркеры созревания нейронов.
В данной работе описаны некоторые особенности созревания неокортекса, выявленные с помощью иммуногистохимических маркеров. Установлено, что в период с 20-й по 26-ю неделю гестации в обеих исследованных областях мигрировавшие в корковую пластинку клетки избирательно синтезируют транскрипционные факторы, определяющие их положение в конкретном слое и тип проекционных связей, которые они образуют, – субкорковые или корково-корковые. В течение исследованного периода происходит утолщение коры, но преимущественная приуроченность SATB2+ нейронов к слоям eII и eIII, а FOXP1+ и CTIP2+ – к слоям eV и eVI – не изменялась. Морфология этих клеток – форма сомы, специфика дендритного древа – свидетельствует о том, что они являются пирамидными проекционными нейронами, динамика их развития, приуроченность, в зависимости от размера, к разным слоям коры подтверждают характер генерируемых ими связей – корково-корковые или субкорковые и корково-спинальные.
Помимо сведений о морфологии нейронов, иммуногистохимическое выявление МАР2 – белка, ассоциированного с микротрубочками, может служить маркером критического периода развития пирамидных клеток, в течение которого нейроны высоко чувствительны к воздействию неблагоприятных факторов среды. Основанием для такого предположения является то, что синтез МАР2 характеризует начало активного дендрогенеза и включение клетки в нейронные сети, а этому сопутствует ослабление нейропротекторных механизмов (Kaech et al., 1996; Fontaine-Lenoir et al., 2006). Гибель нейронов в коре мозга у человека как результат осложненной беременности не доказана, но патологические последствия развития олигодендроцитов и активности нейроглии у детей с проблемами периода внутриутробного онтогенеза, включая недоношенность, известны (Кудряшова и др., 2019; Shaw et al., 2021). Очевидно, что судьбы нейронов и глии неразрывно связаны, а это позволяет анализировать возможность маркирования критического периода развития нейронов по состоянию элементов цитоскелета. Согласно результатам настоящего исследования, в корковой пластинке предцентральной и височной областей коры полушарий мозга первые МАР2+ пирамидные клетки отмечены у 20-недельных плодов в слое eV, к 26-й неделе формируются нейроны слоя eIII, а это предположительно указывает на то, что критические сроки развития нейронов слоев eIII и eV приходятся на разные периоды гестации.
Правомерность выдвинутого предположения о критических сроках развития нейронов подтверждают исследования И.А. Журавина и соавт. (Vasilev et al., 2016). Исследователи доказали, что постмитотическая дифференцировка проекционных нейронов энторинальной коры полушарий мозга крыс происходит на 14-м и 18-м дне эмбриогенеза. Экспериментальная гипоксия в эти дни приводила к тому, что в первый месяц после рождения плотность пирамидных нейронов в коре мозга крысят снижена по сравнению с контрольными животными.
С широким внедрением в клиническую практику методов МРТ-диагностики появились убедительные факты избирательных повреждений кортикоспинальных и межполушарных трактов коры полушарий, вызванных неблагоприятными факторами внутриутробного развития. Так, генез детского церебрального паралича, который считают олицетворением детской неврологии, обусловлен проблемами пренатального периода развития, в том числе недоношенностью (Ермолина и др., 2016). Дефицит моторного поведения у этих детей коррелирует с замедленным созреванием, нарушением структуры и траектории кортикоспинального тракта (Papadelis et al., 2019). Гораздо шире, согласно данным МРТ, распространены отклонения в структуре межполушарных связей, которые чаще всего описывают как агенезии (полное или частичное отсутствие) или гипоплазии (недоразвитие) мозолистого тела (Bekiesinska-Figatowska et al., 2017; Koerte et al., 2018; Lieb, Ahlhelm, 2018). Выраженные гипоплазии мозолистого тела часто обнаруживают у детей, развивавшихся в измененных условиях гестации, например, рожденных женщинами с гипотиреозом, с фетальным алкогольным синдромом и недоношенных (Lebel et al., 2008; Samadi et al., 2008; Tkachenko et al., 2008). Оценка демографических факторов риска развития агенезий и гипоплазий мозолистого тела у детей, клинически значимой и относительно частой категории нарушений развития мозга, свидетельствует о том, что одной из главных причин является недоношенность плода (Glass et al., 2008). Гипоплазии мозолистого тела часто дополняют пороки развития кортикоспинальных трактов при ДЦП (Краснощекова и др., 2016; Back et al., 2001).
Описанные нарушения проводящих трактов – пирамидного и мозолистого тела – согласуются с высказанным предположением о критических периодах развития проекционных нейронов слоев eV и еIII коры полушарий мозга человека в конце второго триместра внутриутробного онтогенеза.
Новизна полученных в настоящей работе результатов очевидна, и они лишь отчасти подтверждают данные ранее выполненного исследования по пренатальному развитию предцентральной области коры мозга человека (Saito et al., 2011).
ВЫВОДЫ
1. В период с 20-й по 26-ю неделю внутриутробного развития в предцентральной и верхней височной областях коры полушарий нейроны, идентифицированные по экспрессии транскрипционных факторов, приурочены к разным слоям корковой пластинки: SATB2-позитивные – к слоям eII, eIII, FOXP1-позитивные и CTIP2-позитивные – к слоям eV, eVI.
2. Во втором триместре внутриутробного развития в корковой пластинке предцентральной и верхней височной областей коры полушарий мозга человека пирамидные нейроны, идентифицированные по экспрессии белка, ассоциированного с микротрубочками (МАР2), появляются в слое eV у 20-недельных, в слое eIII – у 26-недельных плодов.
3. Совокупность полученных данных свидетельствует о том, что две топографически удаленные области коры полушарий мозга человека – предцентральная и верхняя височная – развиваются синхронно.
Работа выполнена на оборудовании ресурсного центра молекулярных и клеточных технологий (МиКТ) Научного Парка СПбГУ (Проект № 109-306).
Список литературы
Васильев Д.С., Туманова Н.Л., Калинина Д.С. Пренатальная гипоксия приводит к нарушению формирования нервной ткани энторинальной области коры мозга крыс. Рос. физиол. журнал. 2020. 106 (10): 1–12.
Ермолина Ю.В., Намазова-Баранова Л.С., Мамедьяров А.М., Аникин А.В., Маслова О.И. Роль диффузионной тензорной магнитно-резонансной томографии и трактографии в диагностике структурных повреждений головного мозга у детей с церебральными параличами. Вопросы современной педиатрии. 2016. 15 (2): 141–147.
Зыкин П.А., Ткаченко Л.А., Аксенова Л.Е., Смолина Т.Ю., Краснощекова Е.И. Исследование липидов мозга человека в пренатальном периоде развития методом Малди-визуализации. Морфология, 2019. 155 (2): 125.
Козубенко Е.А., Зыкин П.А., Краснощекова Е.И., Ткаченко Л.А., Федосеева К.Н., Харазова А.Д. Методика понижения автофлуоресценции ткани фетального мозга человека и количественная оценка эффекта фотовыцветания. Бюл. эксп. биол. мед. 2021. 171 (1): 122–128.
Краснощекова Е.И., Зыкин П.А., Ткаченко Л.А., Александрова Т.А., Ялфимов А.Н. Возрастная динамика развития мозолистого тела детей и ее особенности при детском церебральном параличе. Бюл. эксп. биол. и мед. 2016. 161 (6): 816–820.
Кудряшова И.В., Степаничев М.Ю., Гуляева Н.В. Неонатальный провоспалительный стресс и созревание межклеточной коммуникации в гиппокампе. Журнал высшей нервной деятельности им. И.П. Павлова. 2019. 69 (6): 680–699.
Минин А.А., Кулик А.В. Внутриклеточный транспорт. Принципы регуляции. Успехи биологической химии. 2004. 44: 225–262.
Поляков Г.И. Ранний и средний онтогенез коры большого мозга человека. М., 1937. 57 с.
Alzu’bi A., Lindsay S.J., Harkin L.F., McIntyre J., Lisgo S.N., Clowry G.J. The transcription factors COUP-TFI and COUP-TFII have distinct roles in arealisation and GABAergic interneuron specification in the early human fetal telencephalon. Cereb. Cortex 2017. 27: 4677–4690.
Baala L., Briault S., Etchevers H.C., Laumonnier F., Natiq A., Amiel J., Boddaert N., Picard C., Sbiti A., Asermouh A., Attié-Bitach T., Encha-Razavi F., Munnich A., Sefiani A., Lyonnet S. Homozygous silencing of T-box transcription factor EOMES leads to microcephaly with polymicrogyria and corpus callosum agenesis. Nat. Genet. 2007. 39: 454–456.
Back S.A., Luo N.L., Borenstein N.S., Levine J.M., Volpe J.J., Kinney H.C. Late oligodendrocyte progenitors coincide with the developmental window of vulnerability for human perinatal white matter injury. J. Neurosci. 2001. 21: 1302–1312.
Bayer S.A., Altman J. Neocortical Development. 1991. New York: Raven Press. 255 p.
Bekiesinska-Figatowska M., Duczkowska A., Szkudlinska-Pawlak S., Duczkowski M., Madzik J., Cabaj A., Krupa K., Peczkowski P., Bragoszewska H. Diffusion restriction in the corticospinal tracts and the corpus callosum in neonates after cerebral insult. Brain Dev. 2017. 39 (3): 203–210.
Borello U., Madhavan M., Vilinsky I., Faedo A., Pierani A., Rubenstein J., Campbell K. Sp8 and COUPTF1. Cerebral cortex. 2014. 24 (6): 1409–21: 1409–1421.
Chung K., Wallace J., Kim S.Y., Kalyanasundaram S., Andalman A.S., Davidson T.J., Mirzabekov J.J., Zalocusky K.A., Mattis J., Denisin A.K., Pak S., Bernstein H., Ramakrishnan C., Grosenick L., Gradinaru V., Deisseroth K. Structural and molecular interrogation of intact biological systems. Nature. 2013. 497 (7449): 332–337.
Cozzi B., Bonfant L., Canali E., Minero M. Brain Waste: The Neglect of Animal Brains// Front. Neuroanat. 2020. 12. Art. 573934.
Glass H.C., Shaw G.M., Ma C., Sherr E.H. Agenesis of the corpus callosum in California 1983-2003: a population-based study. Am. J. Med. Genet. 2008. 146: 2495–2500.
Fontaine-Lenoir V., Chambraud B., Fellous A., David S., Duchossoy Y., Baulieu E-E., Robel P. Microtubule-associated protein 2 (MAP2) is a neurosteroid receptor. PNAS. 2006. 103 (12): 4711–4716.
Goergen S.K., Alibrahim E., Govender N., Stanislavsky A., Abel C., Prystupa S., Collett J., Shelmerdine S.C., Arthurs O.J. Diagnostic assessment of foetal brain malformations with intraterine MRI versus perinatal post-mortem MRI. Neuroradiol. 2019. 61 (8): 921–934.
Hevner R.F. Intermediate progenitors and Tbr2 in cortical development. J Anat. 2019. 235 (3): 616–625.
Huang H., Xue R., Zhang J., Ren T., Richards L.J., Yarowsky P., Miller M.I., Mori S. Anatomical Characterization of Human Fetal Brain Development with Diffusion Tensor Magnetic Resonance Imaging. J. of Neurosci. 2009. 29 (13): 4263–4273.
Im K., Grant P.E. Sulcal pits and patterns in developing human brains. Neuroimage. 2019. 185: 881–890.
Ip B.K., Bayatt N.I., Howard N. J., Lindsay S., Clowry G.J. The Corticofugal Neuron-Associated Genes ROBO1, SRGAP1, and CTIP2 Exhibit an Anterior to Posterior Gradient of Expression in Early Fetal Human Neocortex Development. Cerebral Cortex. 2011. 21 (6): 1369–1407.
Jakab A. Developmental Pathoconnectomics and Advanced Fetal MRI. Top. Magn. Reson. Imaging. 2019. 28: 275–284.
Kaech S., Ludin B., Matus A. Expressing Neuronal Microtubule-Associated Proteins. Neuron. 1996. 17: 1189–1199.
Kajimura J., Ito R., Manley N.R., Hale L.P. Optimization of Single- and Dual-Color Immunofluorescence Protocols for Formalin-Fixed, Paraffin-Embedded Archival Tissues. J. Hist. Cytochem. 2016. 64 (2): 112–124.
Kalebic N., Gilardi C., Stepien B., Wilsch-Bräuninger M., Long K.R., Namba T., Florio M., Langen B., Lombardot B., Shevchenko A., Kilimann M.W., Kawasaki H., Wimberger P., Huttner W.B. Neocortical expansion due to increased proliferation of basal progenitors is linked to changes in their morphology. Cell Stem.Cell. 2019. 24: 535–550.
Koerte I., Pelavin P., Kirmess B., Fuchs T., Berweck S., Laubender R.P., Borggraefe I., Schroeder S., Danek A., Rummeny C., Reiser M., Kubicki M., Shenton M.E., Ertl-Wagner B., Heinen F. Anisotropy of transcallosal motor fibers indicates functional impairment in children with periventricular leukomalacia. Dev. Med. Child. Neurol. 2011. 53 (2): 179–186.
Krasnoshchekova E.I., Zykin P.A., Tkachenko L.A., Baskakov A.V., Tsvetkov E.A., Nasyrov R.A. Morphological and Neurochemical Characteristics of the Subicular Complex of the Human Brain in the Fetal Period. Neurosci. Behav. Physiol. 2020. 50 (4): 522–525.
Lebel C., Rasmussen C., Wyper K., Walker L., Andrew G., Yager J, Beaulieu C. Brain diffusion abnormalities in children with fetal alcohol spectrum disorder. Alcohol. Clin. Exp. Res. 2008. 32 (10): 1732–1740.
Leone D.P., Srinivasan K., Chen B., Alcamo E., McConnell S.K. The determination of projection neuron identity in the developing cerebral cortex. Curr. Opin. Neurobiol. 2008. 18 (1): 28–35.
Lieb J.M., Ahlhelm F.J. Agenesis of the corpus callosum. Radiologe. 2018. 58: 636–645.
Molnár Z., Clowry G., Nenad C., Alzu’bi A., Bakken T., Hevner R.F., Hüppi P.S., Kostović I., Rakic P., Anton E.S., Edwards D., Garcez P., Hoerder-Suabedissen A., Kriegstein A. Human cerebral cortex development. J Anat. 2019. 235 (3): 432–451.
Papadelis C., Kaye H., Shore B., Snyder B., Grant P.E., Rotenberg A. Maturation of Corticospinal Tracts in Children With Hemiplegic Cerebral Palsy Assessed by Diffusion Tensor Imaging and Transcranial Magnetic Stimulation. Front. Hum. Neurosci. 2019. 24 (13): Art. 254.
Pletikos M., Sousa A.M., Sedmak G., Meyer K.A., Zhu Y., Cheng F., Li M., Kawasawa Y.I., Sestan N. Temporal specification and bilaterality of human neocortical topographic gene expression. Neuron. 2014. 81: 321–332.
Rakic P. Specification of cerebral cortical areas. Science. 1988. 241: 170–176.
Rakic P. Evolution of the neocortex: a perspective from developmental biology. Nat. Rev. Neurosci. 2009. 10: 724–735.
Saito T., Hanai S., Takashima S., Nakagawa E., Okazaki S., Inoue T., Miyata R., Kyoko Hoshino K., Akashi T., Sasaki M., GotoY., Hayashi M., Itoh M. Neocortical Layer Formation of Human Developing Brains and Lissencephalies:Consideration of Layer-Specific Marker Expression.Cereb. Cortex. 2011. 21: 588–596.
Samadi A., Skocic J., Rovet J. Children born to women treated for hypothyroidism during pregnancy show abnormal corpus callosum development. Thyroid. 2015. 25 (5): 494–502.
Shaw J.C., Crombie G.K., Palliser H.K., Hirst J.J. Impaired Oligodendrocyte Development Following Preterm Birth: Promoting GABAergic Action to Improve Outcomes. Front. Pediatr. 2021. 9: Art. 618052.
Tkachenko L.A, Toronova N.O., Krasnoshchekova E.I., Zykin P.A., Aleksandrov T.A., Yalfimov A.N. A comparative MRI-based morphometric study of the corpus callosum in term and preterm infants. Human Physiol. 2014. 40 (1): 29–34.
Tkachenko L.A., Zykin P.A., Nasyrov R.A., Krasnoshchekova E.I. Distinctive features of the human marginal zone and Cajal-Retzius cells: comparison of morphological and immunocytochemical features at midgestation. Front. Neuroanat. 2016. 10: Art. 26
Turk E., Heuvel M.I., Benders M.J., de Heus R., Franx A., Manning J.H., Hect J.L., Hernandez-Andrade E., Hassan S.S., Romero R., Kahn R.S., Thomason M.E., Heuvel M.P. Functional Connectome of the Fetal Brain. J. Neuroscience. 2019. 39 (49): 9716–9724.
Yun H.J., Chung A.W., Vasung L., Yang E., Tarui T., Rollins C.K., Ortinau C.M., Grant P.E., Im K. Automatic labeling of cortical sulci for the human fetal brain based on spatio-temporal information of gyrification. Neuroimage. 2019. 188: 473–482.
Zhang Z., Hou X., Lin G., Teng H., Meng F., Zang F., F. Fang, S. Liu. Development of the Fetal Cerebral Cortex in the Second Trimester: Assessment with 7T Postmortem MRImagin. AJNR Am. J. Neuroradiol. 2013. 34 (7): 1462–1467.
Zykin P.A., Moiseenko I.A., Tkachenko L.A., Nasyrov R.A., Tsvetkov E.A., Krasnoshchekova E.I. Peculiarities of Cyto- and Chemoarchitectonics of Human Entorhinal Cortex during the Fetal Period. Bull Exp. Biol. Med. 2018. 164 (4): 497–501.
Vasilev D.S., Dubrovskaya N.M., Tumanova N.L., Zhuravin I.A. Prenatal hypoxia in different periods of embryogenesis differentially affects cell migration, neuronal plasticity and rat behavior in postnatal ontogenesis. Front. Neurosci. 2016. 10: Art. 126.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


