Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 2, стр. 286-292
Оксид азота необходим для лабилизации (дестабилизации) обстановочной памяти у крыс
А. Х. Винарская 1, А. Б. Зюзина 1, *, П. М. Балабан 1
1 Федеральное государственное бюджетное учреждение науки Институт высшей нервной деятельности
и нейрофизиологии РАН
Москва, Россия
* E-mail: lucky-a89@mail.ru
Поступила в редакцию 05.10.2020
После доработки 18.12.2020
Принята к публикации 22.12.2020
Аннотация
Хорошо известно, что оксид азота (NO) участвует в формировании сигнальной памяти на стимулы разной модальности. Мы исследовали участие оксида азота в процессе реконсолидации (повторной консолидации долговременной памяти при напоминании) условно-рефлекторной обстановочной памяти страха у крыс. После одного сеанса обучения животные демонстрировали достоверное увеличение замирания при предъявлении условного контекста. Реактивация этой памяти на фоне блокады синтеза новых белков циклогексимидом приводила к достоверному снижению времени замирания на условный контекст у крыс. Введение селективного блокатора нейрональной NO-синтазы 3-бром-7-индазола в условиях реактивации памяти на фоне блокады синтеза белка предотвращало ослабление условно-рефлекторной реакции замирания, что было показано при последующем тестировании животных в условном контексте. Вместе с тем введение 3-бром-7-индазола без реактивации не вызывало достоверных изменений в показателях условно-рефлекторного замирания у крыс. Полученные результаты позволяют предположить, что оксид азота участвует в лабилизации условно-рефлекторной обстановочной памяти страха при напоминании и, следовательно, является необходимым компонентом запуска процесса реконсолидации.
ВВЕДЕНИЕ
Согласно современным представлениям, существующая стабильная консолидированная память может быть изменена после реактивации памяти (напоминания) (Haubrich, Nader, 2018), в результате чего наблюдается временная лабилизация (дестабилизация) памяти и запускается процесс повторной консолидации (реконсолидации) (Lee et al., 2017; Kida, 2019). На этапе лабилизации память становится восприимчивой (лабильной) к действию амнестических агентов и требует синтеза белка для своей стабилизации (Nader et al., 2000). Важно подчеркнуть, что только в лабильном состоянии после реактивации (напоминания) память может быть восприимчива к внешним воздействиям. Так, в работе Мизанина (Misanin et al., 1968) было показано, что электрошок, примененный после предъявления условного стимула, приводил к амнезии у обученных животных, в то время как электрошок без напоминания не приводил к изменениям в памяти.
В ряде исследований было показано, что для перехода памяти из стабильного в лабильное состояние в результате реактивации необходимо участие оксида азота. Его роль в механизмах синаптической пластичности, обучении и памяти неоднократно описывалась (Antonov et al., 2007; Lisboa et al., 2015; Bradley, Steinert, 2016; Chen et al., 2016; Hott et al., 2017; Li et al., 2017; Zhang et al., 2017; Cai et al., 2018; Dyer et al., 2019; Noriega-Prieto et al., 2019; Bingor et al., 2020; Song et al., 2020). Недавно на наземных моллюсках было показано, что оксид азота необходим для дестабилизации (лабилизации) обстановочной памяти и запуска процесса реконсолидации (Balaban et al., 2014). Балабан с коллегами продемонстрировали, что реактивация памяти при комбинированном введении блокатора синтеза белка анизомицина и ингибиторов NO-синтазы (или скавенджеров оксида азота) не приводила к ухудшению долговременной обстановочной памяти, т.е. реконсолидация не запускалась в отсутствие оксида азота, в то время как введение анизомицина до или сразу после реактивации памяти достоверно ухудшало обстановочную оборонительную память (Gainutdinova et al., 2006; Balaban et al., 2014). Схожие данные о роли оксида азота в реконсолидации памяти у грызунов были получены Баль и соавт. (Bal et al., 2017а). Они продемонстрировали, что при напоминании (реактивации памяти) в условиях блокады синтеза белка введение селективных блокаторов нейрональной NO-синтазы 3-бром-7-нитроиндазол (3-бр7-ни) или ARL предотвращало ухудшение памяти на сигнальный стимул. Исследований по изучению роли NO в запуске процесса реконсолидации обстановочной памяти у грызунов не проводилось. Кроме того, Баль и соавт. (Bal et al., 2017б) удалось показать, что оксид азота может регулировать убиквитин-зависимую протеасомную деградацию белков в культивированных нейронах гиппокампа, что можно рассматривать наряду с локальным нитрозилированием белков в синапсе как предположительный механизм, благодаря которому оксид азота обеспечивает дестабилизацию памяти после реактивации.
Основываясь на предыдущих исследованиях роли оксида азота в реконсолидации долговременной сигнальной и обстановочной памяти у различных видов животных, мы предположили, что реактивация памяти (напоминание) индуцирует производство оксида азота за счет активации NO-синтазы. Далее оксид азота запускает процесс лабилизации (дестабилизации) памяти, что делает возможным модификацию реактивированной памяти с дальнейшей повторной консолидацией (реконсолидацией) памяти. В настоящем исследовании мы проверили данную гипотезу о вовлечении оксида азота в процесс лабилизации контекстной памяти при реконсолидации, используя процедуру напоминания. Задачей данного исследования было определить влияние системного введения селективного ингибитора нейрональной NO-синтазы 3-бр7-ни на поддержание и реконсолидацию условно-рефлекторного обстановочного страха у крыс, а также расширить имеющиеся литературные сведения о роли оксида азота в процессах памяти. Мы провели эксперименты по выработке условно-рефлекторной обстановочной памяти страха у крыс линии Long-Evans. Обнаружено, что блокада синтеза белка циклогексимидом (ЦГМ) при напоминании приводила к нарушению долговременной контекстной памяти в соответствии с ранее показанными эффектами ингибиторов синтеза белка. Однако одновременная блокада синтеза белка и синтеза оксида азота нейрональной NO-синтазой предотвращала ухудшение долговременной памяти об обстановке. Полученные данные совпадают с результатами, полученными для сигнальной памяти у грызунов (Bal et al., 2017а), и позволяют предположить, что синтез оксида азота может регулировать реконсолидацию, обеспечивая лабилизацию (дестабилизацию) сигнальной и контекстной памяти при напоминании.
МЕТОДИКА
Объект исследования
Опыты проводили на 32 крысах-самцах линии Long-Evans массой 260–360 г, полученных из филиала института биоорганической химии РАН в Пущино. Животных содержали в виварии при обычном 12-часовом световом режиме со свободным доступом к воде и стандартному корму. В экспериментах соблюдали принципы гуманности, изложенные в директивах Европейского Сообщества (2010/63/ЕU), и положения ИВНД и НФ РАН о работе с экспериментальными животными.
Введение веществ
Ингибитор синтеза белка ЦГМ (Sigma-Aldrich) растворяли в 0.9% NaCl и вводили подкожно в дозе 2.8 мг/кг. Селективный ингибитор нейрональной NO-синтазы 3-бром-7-нитроиндазол (3-бр7-ни) (Enzo Life Sciences) растворяли в 100% ДМСО и вводили внутрибрюшинно в дозе 10 мг/кг. Все препараты вводили сразу после напоминания в объеме 0.1 мл на 100 г веса тела крыс. Контрольные препараты вводили подкожно (физиологический раствор для ЦГМ) и внутрибрюшинно (100% ДМСО для 3-бр7-ни).
Выработка и тестирование условно-рефлекторного страха
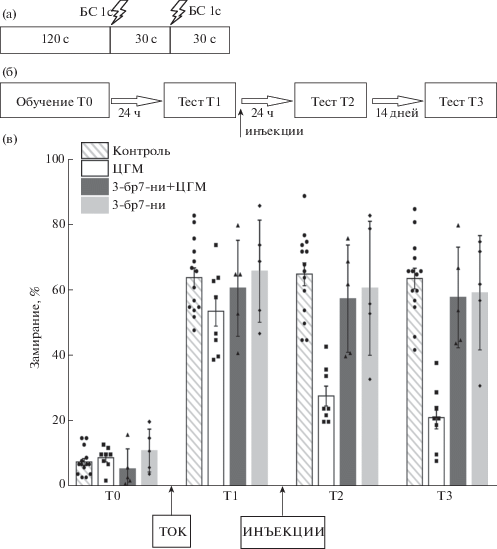
Опыты проводили в камере Startle and Fear Combined System производства PanLab Harvard Apparatus. Внутренняя камера размером 28 × 28 × 28 см, куда помещали животное, располагалась на 4 датчиках, фиксирующих движения крысы. В экспериментах использовали определенный вид контекста: темные стены + решетчатый пол. Животных обучали и тестировали в одном и том же контексте. При обучении после 120-секундного исследовательского периода (тест Т0) предъявляли два электрокожных раздражения лап через решетку пола (1 с, 0.06 мА) с 30-с межстимульным интервалом, после чего следовал 30-с исследовательский период (рис. 1 (а)). Через 24 ч после обучения тестировали условно-рефлекторный страх в условном контексте (тест Т1), при этом животных помещали в условный контекст на 180 с. На основании времени замирания в тесте Т1 судили об успешности обучения. Немедленно после теста Т1 животным вводили либо ДМСО/физиологический раствор (группа “контроль”, n = 14), либо ДМСО/ЦГМ (группа ЦГМ, n = 8), либо 3-бр7-ни/ЦГМ (группа 3-бр7-ни + + ЦГМ, n = 5), либо 3-бр7-ни/физиологический раствор (группа 3-бр7-ни, n = 5). Через 24 ч после введения веществ животных снова помещали в условный контекст на 180 с для тестирования (тест Т2). Через 14 дней (день 17) животные всех групп были помещены в условный контекст на 180 с для тестирования (тест T3) (рис. 1 (б)).
Рис. 1.
(а) – Протокол обучения. БС – безусловный раздражитель, электрошок. (б) – Протокол эксперимента. Т0 – тест до обучения, Т1 – тест 24 ч после обучения (препараты вводили сразу после реактивации памяти – теста Т1), Т2 – тест 24 ч после введения препаратов, Т3 – тест спустя 15 дней после введения препаратов. (в) – Усредненные данные о влиянии селективного ингибитора NO-синтазы 3-бр7-ни и блокатора синтеза белка ЦГМ на реконсолидацию памяти. Крысы, получавшие ЦГМ (n = 8) сразу после напоминания (тест Т1), показали достоверное снижение реакции замирания в тестах Т2 и Т3. Введение 3-бр7-ни одновременно с ЦГМ предотвращало ослабление условно-рефлекторной реакции замирания при последующем тестировании животных (тест Т2, Т3, группа 3-бр7-ни+ЦГМ, n = 5). Введение 3-бр7-ни не вызывало достоверных изменений в показателях условно-рефлекторного замирания у крыс (группа 3-бр7-ни, n = 5). Контрольная группа (n = 14) демонстрировала хорошую память на протяжении всех тестовых сессий. Данные представлены как среднее ± стандартная ошибка среднего. По оси ординат процент времени замирания. Достоверность была установлена на уровне p < 0.05.
Fig. 1. (а) – Training protocol. US – unconditioned stimulus, foot shock. (б) – Schematic representation of the experiment protocol. T0 – test before training, T1 – test 24 hr after training (drugs were administered immediately after memory reactivation – test T1), T2 – test 24 hr after drug administration, T3 – test 15 days after drug administration. (в) – Averaged data on effects of the NO-synthase selective inhibitor 3-bromo-7-indazole and protein synthesis blocker cycloheximide on memory reconsolidation. Rats that received cycloheximide (group CXM, n = 8) immediately after the reminder (test T1) showed a significant decrease in the freezing level in tests T2, T3. Administration of 3-bromo-7-nitroindazole simultaneously with cycloheximide prevented weakening of the conditioned freezing response during subsequent testing T2, T3 (group 3-br7ni + CXM, n = 5). 3-bromo-7-indazole administration only did not cause significant changes in a conditioned freezing response in rats (group 3-br7-ni, n = 5). The control group (n = 14) demonstrated good memory throughout all test sessions. Data are presented as means ± ± SEM. The ordinate is the percentage of freezing time. The significance was set at p < 0.05.
Активность каждой крысы записывали на видео и количественно оценивали в режиме офлайн. Память на условный стимул измерялась как замирание, прекращение движения помимо дыхания. Подсчитывали процент времени замирания от общего времени нахождения в условном контексте ( (продолжительность замирания/общая продолжительность) × 100).
Статистическая обработка данных
Для статистической оценки учитывались только животные, которые пережили все этапы исследования. Ни одно здоровое животное не было исключено из наших расчетов. Как правило, смертность от ЦГМ составляла примерно 30% от всех крыс, которым вводили ЦГМ.
При сопоставлении времени замирания крыс в процессе выработки и тестирования условно-рефлекторного страха у крыс разных групп использовали дисперсионный анализ (ANOVA/MANOVA), когда исследуемая переменная представлена несколькими измерениями. Исследовали влияние фактора “группы” при выработке рефлекса и при последующих тестированиях. При post hoc анализе использовали критерий Бонферрони. Для обработки результатов использовали стандартную программу STATISTICA 10.0. Все данные представлены как среднее значение ±S.E.M. Различия считали достоверными при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В настоящем исследовании мы проверили гипотезу о вовлечении оксида азота в процесс лабилизации контекстной памяти при реконсолидации, используя процедуру напоминания. Как показано на рис. 1 (в), все группы крыс демонстрировали схожие низкие показатели замирания до обучения. Предъявление двух электрокожных раздражений лап в условном контексте привело к достоверному увеличению замирания во всех группах (F (1,28) = 485.78, p < 0.001 для эффекта тестового испытания). Сразу после Т1 крысам вводили вещества. При тестировании через 24 ч после введения препаратов (тест Т2) ANOVA выявил достоверный основной эффект группы (T2, F (3,28) = 7.939, p < 0.001). Post-hoc-сравнения показали, что группа ЦГМ показала достоверно меньшее замирание по сравнению с контрольной группой (р < 0.0001), с группой 3-бр7-ни+ЦГМ (р = 0.0020), а также с группой 3-бр7-ни (р = 0.0003). Процент замирания групп “контроль”, 3-бр7-ни+ЦГМ и 3-бр7-ни не различался в тестовой сессии T2. При тестировании спустя 14 дней (тест Т3) ANOVA выявил достоверный основной эффект группы (T2, F (3,28) = 19.588, p < < 0.001). Крысы из группы ЦГМ по-прежнему демонстрировали достоверно более слабую реакцию замирания на условный контекст, чем контрольные животные (post-hoc анализ, р < 0.0001), животные группы 3-бр7-ни + ЦГМ (post-hoc анализ, р < 0.0001), и животные группы 3-бр7-ни (post-hoc анализ, р < < 0.0001). Post-hoc анализ не выявил различий между уровнем замирания животных групп “контроль”, 3-бр7-ни+ЦГМ и 3-бр7-ни. Животные этих групп демонстрировали высокие показатели замирания (хорошую память) на протяжении всех тестовых сессий.
Таким образом, полученные данные демонстрируют, что одновременная блокада активности NO-синтазы и синтеза белка после реактивации памяти предотвращает ухудшение памяти, которое обычно наблюдалось при реактивации памяти при блокаде синтеза белка. Наши результаты предполагают, что синтез оксида азота необходим для дестабилизации памяти.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящее время существует множество доказательств участия оксида азота в синаптической пластичности, обучении и памяти (Antonov et al., 2007; Lisboa et al., 2015; Bradley, Steinert, 2016; Chen et al., 2016; Hott et al., 2017; Li et al., 2017; Zhang et al., 2017; Cai et al., 2018; Dyer et al., 2019; Noriega-Prieto et al., 2019; Bingor et al., 2020; Song et al., 2020). Однако пока мало что известно о взаимосвязи производства оксида азота и процесса дестабилизации памяти при напоминании. В настоящем исследовании мы проверили гипотезу о вовлечении оксида азота в процесс лабилизации контекстной памяти при реконсолидации, используя процедуру напоминания.
Нами было показано, что реактивация памяти на фоне блокады синтеза новых белков ЦГМ приводила к достоверному снижению времени замирания на условный контекст у крыс (рис. 1 (в), группа ЦГМ), т.е. к нарушению обстановочной памяти страха. Введение селективного блокатора NO-синтазы 3-бр7-ни в условиях реактивации памяти при блокаде синтеза белков предотвращало ослабление условно-рефлекторной реакции замирания при последующем тестировании животных в условном контексте (рис. 1 (в), группа 3-бр7-ни + ЦГМ). Иными словами, одновременная блокада синтеза белка и производства оксида азота при напоминании предотвращала ухудшение обстановочной памяти страха. Условно-рефлекторный страх обстановки – это особый вид памяти со своими механизмами (Izquierdo et al., 2016; Chaaya et al., 2018). Следует отметить, что в данной работе впервые показана важность оксида азота для дестабилизации именно условно-рефлекторной обстановочной памяти страха у грызунов при напоминании. Эти данные полностью соответствуют недавно опубликованным результатам, касающимся влияния блокады синтеза оксида азота на реконсолидацию обстановочной оборонительной памяти у наземных моллюсков (Balaban et al., 2014). В этом исследовании напоминание на фоне инъекции блокатора синтеза белка анизомицина приводило к ухудшению обстановочной оборонительной памяти, в то время как напоминание при комбинированном введении анизомицина и любого из ингибиторов NO-синтазы: L-NNA, L-NAME или скавенджера оксида азота PTIO – не вызывало ухудшения долговременной обстановочной памяти. Наши данные соответствуют результатам ранее проведенного исследования (Bal et al., 2017а), где было продемонстрировано, что при напоминании (реактивации памяти) введение селективных блокаторов NO-синтазы 3-бр7-ни или ARL в условиях блокады синтеза белка предотвращало ухудшение памяти на сигнальный стимул.
Следует отметить, что в настоящем исследовании введение 3-бр7-ни не вызывало достоверных изменений в показателях условно-рефлекторного замирания у крыс (рис. 1 (в), группа 3-бр7-ни), т.е. сам по себе 3-бр7-ни не влиял на процесс реконсолидации памяти. Это согласуется с рядом ранее опубликованных работ (Balaban et al., 2014; Bal et al., 2017а; Chen et al., 2016).
Хотя полученные результаты и подтверждают роль оксида азота в лабилизации памяти, следует помнить, что лабилизация памяти – это сложный многоступенчатый процесс, требующий, вероятно, нескольких сигнальных каскадов. Так, в одной из недавних работ (Jarome et al., 2016) было показано, что CaMKII контролирует инициирование процесса реконсолидации памяти посредством регуляции убиквитин-опосредованной деградации белков; ингибирование CaMKII полностью нивелировало нарушения памяти, которые возникали в результате блокады синтеза белка после напоминания. Эффект предотвращения дестабилизации памяти в условиях блокады синтеза белка и реактивации памяти был показан также при одновременном введении блокатора деградации белка (Lee et al., 2008; Jarome et al., 2011). В более ранних работах было показано, что блокада бета-адренорецепторов во время реактивации нарушает процесс реконсолидации. Эти результаты предполагают, что реактивация памяти запускает зависящий от бета-рецепторов каскад внутриклеточных событий, что позволяет реорганизовать существующую память (Przybyslawski et al., 1999).
ЗАКЛЮЧЕНИЕ
Наши результаты показывают, что блокада синтеза оксида азота полностью предотвращает ухудшение контекстной условно-рефлекторной памяти страха, вызванное ингибированием синтеза белка при реконсолидации. Основываясь на этих данных, мы предполагаем, что локальное повышение концентрации оксида азота, активируемое в результате реактивации памяти, является важным событием, которое приводит к дестабилизации памяти, что делает возможной модификацию реактивированной памяти. В целом полученные результаты подтверждают гипотезу о роли оксида азота в процессе лабилизации условно-рефлекторной памяти страха при реконсолидации у грызунов. Кроме того, схожесть механизмов действия оксида азота на память беспозвоночных и позвоночных животных доказывает консервативность клеточных механизмов памяти и обучения у животных в целом.
Работа частично поддержана грантом РФФИ 17-00-00216 и грантом МОН 075-15-2020-801.
Список литературы
Antonov I., Ha T., Antonova I., Moroz L.L., Hawkins R.D. Role of nitric oxide in classical conditioning of siphon withdrawal in Aplysia. J. Neurosci. 2007. 27 (41): 10993–11002.
Bal N.V., Rysakova M.P., Vinarskaya A.K., Ivanova V., Zuzina A.B., Balaban P.M. Cued memory reconsolidation in rats requires nitric oxide. Eur. J. Neurosci. 2017a. 45 (5): 643–647.
Bal N., Roshchin M., Salozhin S., Balaban P. Nitric oxide upregulates proteasomal protein degradation in neurons. Cell Mol. Neurobiol. 2017б. 37 (5): 763–769.
Balaban P.M., Roshchin M., Timoshenko A.K., Gainutdinov K.L., Bogodvid T.K., Muranova L.N., Zuzina A.B., Korshunova T.A. Nitric oxide is necessary for labilization of a consolidated context memory during reconsolidation in terrestrial snails. Eur. J. Neurosci. 2014. 40 (6): 2963–2970.
Bingor A., Haham N., Thornton C., Stern-Bach Y., Yaka R. Zeta Inhibitory Peptide attenuates learning and memory by inducing NO-mediated downregulation of AMPA receptors. Nat. commun. 2020. 11 (1): 1–11.
Bradley S.A., Steinert J.R. Nitric oxide-mediated posttranslational modifications: impacts at the synapse. Oxid. Med. Cell. Longev. 2016. 2016: 5681036.
Cai C.Y., Chen C., Zhou Y., Han Z., Qin C., Cao B., Tao Y., Bian X.L., Lin Y.H., Chang L., Wu H.Y., Luo C.X., Zhu D.Y. PSD-95-nNOS coupling regulates contextual fear extinction in the dorsal CA3. Sci. Rep. 2018. 8 (1): 12775.
Chaaya N., Battle A.R., Johnson L.R. An update on contextual fear memory mechanisms: transition between amygdala and hippocampus. Neurosci. Biobehav. Rev. 2018. 92: 43–54.
Chen W., Yan M., Wang Y., Wang X., Yuan J., Li M. Effects of 7-nitroindazole, a selective neural nitric oxide synthase inhibitor, on context-shock associative learning in a two-process contextual fear conditioning paradigm. Neurobiol. Learn. Mem. 2016. 134 (Pt B): 287–293.
Dyer R.R., Ford K.I., Robinson RAS. The roles of S-nitrosylation and S-glutathionylation in Alzheimer’s disease. Methods Enzymol. 2019. 626: 499–538.
Gainutdinova T.Kh., Tagirova R.R., Ismailova A.I., Muranova L.N., Gainutdinov Kh.L., Balaban P.M. Protein synthesis-dependent reactivation of a contextual conditioned reflex in the common snail. Neurosci. Behav. Physiol. 2006. 36 (2): 203–207.
Haubrich J., Nader K. Memory reconsolidation. Curr. Top. Behav. Neurosci. 2018. 37: 151–176.
Hott S.C., Gomes F.V., Uliana D.L., Vale G.T., Tirapelli C.R., Resstel L.B. Bed nucleus of the stria terminalis NMDA receptors and nitric oxide modulate contextual fear conditioning in rats. Neuropharmacology. 2017. 112 (Pt A): 135–143.
Izquierdo I., Furini C.R., Myskiw J.C. Fear memory. Physiol. Rev. 2016. 96 (2): 695–750.
Jarome T.J., Werner C.T., Kwapis J.L., Helmstetter F.J. Activity dependent protein degradation is critical for the formation and stability of fear memory in the amygdala. PLoS One. 2011. 6 (9): e24349.
Jarome T.J., Ferrara N.C., Kwapis J.L., Helmstetter F.J. CaMKII regulates proteasome phosphorylation and activity and promotes memory destabilization following retrieval. Neurobiol. Learn. Mem. 2016. 128: 103–109.
Kida S. Reconsolidation/destabilization, extinction and forgetting of fear memory as therapeutic targets for PTSD. Psychopharmacology (Berl). 2019. 236 (1): 49–57.
Lee S.H., Choi J.H., Lee N., Lee H.R., Kim J.I., Yu N.K., Choi S.L., Lee S.H., Kim H., Kaang B.K. Synaptic protein degradation underlies destabilization of retrieved fear memory. Science. 2008. 319 (5867): 1253–1256.
Lee J.L.C., Nader K., Schiller D. An update on memory reconsolidation updating. Trends Cogn. Sci. 2017. 21 (7): 531–545.
Li J., Han Z., Cao B., Cai C.Y., Lin Y.H., Li F., Wu H.Y., Chang L., Luo C.X., Zhu D.Y. Disrupting nNOS-PSD-95 coupling in the hippocampal dentate gyrus promotes extinction memory retrieval. Biochem. Biophys. Res. Commun. 2017. 493 (1): 862–868.
Lisboa S.F., Gomes F.V., Silva A.L., Uliana D.L., Camargo L.H., Guimarães F.S., Cunha F.Q., Joca S.R., Resstel L.B. Increased contextual fear conditioning in iNOS knockout mice: additional evidence for the involvement of nitric oxide in stress-related disorders and contribution of the endocannabinoid system. Int. J. Neuropsychopharmacol. 2015. 18 (8): pyv005.
Misanin J.R., Miller R.R., Lewis D.J. Retrograde amnesia produced by electroconvulsive shock after reactivation of a consolidated memory trace. Science. 1968. 160 (3827): 554–555.
Nader K., Schafe G.E. Le Doux J.E. Fear memories require protein synthesis in the amygdala for reconsolidation after retrieval. Nature. 2000. 406 (6797): 722–726.
Noriega-Prieto J.A., Maglio L.E., Gallero-Salas Y., Fernández de Sevilla D. Nitric oxide-dependent LTD at infralimbic cortex. Neuroscience. 2019. 418: 149–156.
Przybyslawski J., Roullet P., Sara S.J. Attenuation of emotional and nonemotional memories after their reactivation: role of beta adrenergic receptors. J. Neurosci. 1999. 19 (15): 6623–6628.
Song S., Lee J., Park S., Choi S. Fear renewal requires nitric oxide signaling in the lateral amygdala. Biochem. Biophys. Res. Commun. 2020. 523 (1): 86–90.
Zhang L., Yuan H.J., Cao B., Kong C.C., Yuan F., Li J., Ni H.Y., Wu H.Y., Chang L., Liu Y., Luo C.X. MGE-derived nNOS+ interneurons promote fear acquisition in nNOS-/- mice. Biochem. Biophys. Res. Commun. 2017. 493 (4): 1560–1566.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


