Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 2, стр. 147-163
Участие ядер гипоталамуса в формировании ассоциаций “объект–место” на нейронах поля СА2 гиппокампа (гипотетический механизм)
И. Г. Силькис *
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: isa-silkis@mail.ru
Поступила в редакцию 31.05.2020
После доработки 29.11.2020
Принята к публикации 22.12.2020
Аннотация
Предложен возможный механизм формирования отображений ассоциаций “объект–место” на нейронах гиппокампа, базирующийся на пластических перестройках эффективности синаптической передачи, которые зависят от нейромодуляторов, синтезируемых в нейронах различных ядер гипоталамуса, проецирующихся в поле СА2 гиппокампа. Афферентный вход из супрамамиллярного ядра в поле СА2 способствует формированию отображений ассоциаций на нейронах полей СА2 и СА1, поскольку облегчает индукцию длительной потенциации эффективности передачи в пути СА2–СА1 и суммацию возбуждения, поступающего из полей СА3 и СА2 в поле СА1. В отображения ассоциаций “объект–место” в поле СА2 включена информация о запахах, поступающая в поле СА2 из обонятельной луковицы через паравентрикулярное и супраоптическое ядра гипоталамуса. Нейроны этих ядер синтезируют вазопрессин и окситоцин, которые облегчают индукцию длительной потенциации синаптических входов к пирамидным нейронам поля СА2, что способствует формированию отображений ассоциаций “объект–место” на этих нейронах и на их клетках-мишенях в поле СА1, связанном с префронтальной корой через таламическое ядро reuniens. По мере продвижения сигналов из зубчатой извилины через поля СА3 и СА2 в поле СА1 на нейронах этих областей формируются усложняющиеся отображения ассоциаций “объект–место”. Уникальность связей поля СА2 позволяет ему вносить существенный вклад в кодирование и запоминание не только контекстуальной, но и социальной информации. Следствия предлагаемого механизма согласуются с известными результатами экспериментальных исследований. Понимание механизмов гиппокамп-зависимой памяти может быть полезным при направленном поиске препаратов для ослабления тех симптомов болезней Паркинсона и Альцгеймера, которые вызваны атрофией пирамидных нейронов в поле СА2.
Список сокращений: ГК – гранулярная клетка; ДП – длительная потенциация; ЗИ – зубчатая извилина; ПН – пирамидный нейрон; СМЯ – супрамамиллярное ядро гипоталамуса; ЭК – энторинальная кора
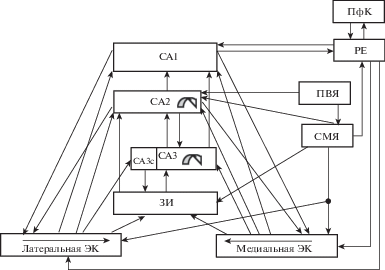
Общепринято, что гиппокампальная формация играет важную роль в обработке информации об объекте (его местоположении и физических свойствах) и в формировании эпизодической памяти (т.е. хранении и извлечении из памяти информации об эпизоде). Это мнение базируется на результатах нейробиологических исследований, которые показали, что гиппокамп критически вовлечен в быстрое кодирование ассоциаций между элементами и их расположением в определенном контексте (т.е. ассоциаций “объект–место”); в кодирование эпизодов как последовательности событий и включение эпизодов в систему поддержания памяти (Eldridge et al., 2005, Nadel, Moscovitch, 1998). Гиппокамп участвует не только в запоминании эпизодов, но и в их воспроизведении (Nadel, Moscovitch, 1998). Благодаря взаимодействию гиппокампа с корой вспоминание является сложным процессом, а не просто извлечением запомненной в коре семантической информации. С точки зрения предложенного ранее механизма участия гиппокампа в обработке информации, в активности нейронов этой структуры формируется отображение эпизода в целом, тогда как в каждой из областей новой коры обрабатывается и хранится информация, специфичная для этой области (Силькис, 2011). Новая кора выполняет часть тех функций, которые до ее образования реализовывались в гиппокампе (архикортексе). Вследствие отсутствия связей между гиппокампом и новой корой это взаимодействие осуществляется через таламическое ядро reuniens, которое реципрокно связано и с нейронами поля СА1 гиппокампа, и с медиальной префронтальной корой (McKenna, Vertes, 2004) (рис. 1). Современные исследования показали, что ядро reuniens вносит вклад в обучение, укрепление памяти и гибкость поведения (Barker, Warburton, 2015; Cassel et al., 2013). Формирование и хранение отображений ассоциаций “объект–место” в активности нейронов гиппокампа базируется на пластических перестройках эффективности синаптической передачи между нейронами разных частей гиппокампа, которые являются звеньями классического трисинаптического пути (Силькис, 2009; Силькис, 2011). Этот путь начинается в энторинальной коре (ЭК), из которой сигналы по перфорантным волокнам поступают в зубчатую извилину (ЗИ), затем по мшистым волокнам сигналы от гранулярных клеток зубчатой извилины (ГК) поступают в поле СА3, а из него по коллатералям Шаффера в поле СА1. Из поля СА1 активность передается в другие структуры, а также возвращается в ЭК (рис. 1).
Рис. 1.
Схема передачи сигналов через гиппокампальную формацию. ЭК – энторинальная кора; ЗИ – зубчатая извилина; СА3, СА2, СА1 – поля гиппокампа; ПфК – префронтальная кора; РЕ – таламическое ядро reuniens; СМЯ и ПВЯ – супрамамиллярное и паравентрикулярное ядра гипоталамуса. Стрелки – возбудительные связи между структурами.
Fig. 1. A scheme of signal transmission through the hippocampal formation. ЭК – entorhinal cortex; ЗИ – dentate gyrus; CA3, CA2, CA1 – hippocampal fields; ПфК – prefrontal cortex; PE – thalamic nucleus reuniens; СМЯ and ПВЯ – supramammillary and paraventricular nuclei of the hypothalamus. Arrows – excitatory connections between structures.
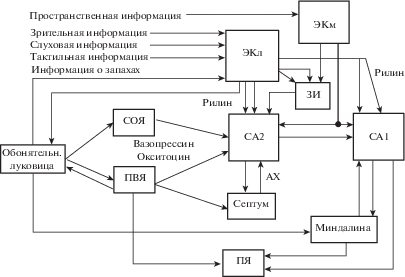
В последние годы усилилось внимание к исследованию вклада гиппокампального поля СА2 в обработку информации и формирование следов памяти (Piskorowski, Chevaleyre, 2018). Поле СА2 обладает уникальными свойствами, которые позволяют ему участвовать в кодировании контекстуальной и социальной информации. Память социального узнавания играет важную роль в выживании разных видов, поскольку позволяет правильно идентифицировать сородичей, партнеров и потенциальных врагов и понимать намерения других (Chiang et al., 2018). Без социальной памяти последующие встречи лишены какой-либо исторической информации (Smith et al., 2016). Современные исследования показали, что в активности нейронов поля СА2 кодируется также пространственная информация в условиях неподвижности (Robert et al., 2018). Кроме того, нейроны поля СА2 контролируют возбудимость нейронов во всей сети гиппокампа (Robert et al., 2018). В отличие от нейронов соседних полей СА3 и СА1, в поле СА2 поступает афферентация из супрамамиллярного ядра гипоталамуса (СМЯ). Кроме того, в поле СА2 из обонятельной луковицы через паравентрикулярное и супраоптическое ядра гипоталамуса поступает информация о запахах (Piskorowski, Chevaleyre, 2018) (рис. 2). Нейроны обонятельной луковицы проецируются и в слой II латеральной части ЭК (Leitner et al., 2016), куда поступает также зрительная, слуховая и тактильная информация, тогда как пространственная информация поступает преимущественно в медиальную часть ЭК. Нейроны СМЯ иннервируют также ЗИ и ЭК. Результирующее действие СМЯ на ГК является возбуждающим, хотя в ЗИ нейроны СМЯ иннервируют и тормозные интернейроны (Hashimotodani et al., 2018). Если разряды нейронов СМЯ совпадают по времени с сигналами из ЭК, срабатывание ГК возрастает. Из этого следует, что СМЯ влияет на обработку сигналов в ЗИ (Hashimotodani et al., 2018; Nakanishi et al., 2001). Анализ возможных механизмов влияния СМЯ на активность ГК и пирамидных нейронов (ПН) поля СА2 гиппокампа был проведен в предшествующей работе (Силькис, Маркевич, 2020).
Рис. 2.
Схема поступления разномодальной информации, включая информацию о запахах, в нейронную сеть гиппокампа. ЭКл и ЭКм – латеральная и медиальная части энторинальной коры; СОЯ – супраоптическое ядро гипоталамуса; ПЯ – прилежащее ядро (вентральный стриатум). АХ – ацетилхолин. Открытые стрелки, нейромодуляторные входы. Остальные обозначения как на рис. 1.
Fig. 2. A scheme of the receipt of multimodal information, including information about odors, into the neural network of the hippocampus. ЭКл and ЭКм – lateral and medial parts of the entorhinal cortex; СОЯ – supraoptic nucleus of the hypothalamus; ПЯ – nucleus accumbens (ventral striatum). AX – acetylcholine. Open arrows, neuromodulatory inputs. Other abbreviations are as in the Fig. 1.
Задачей настоящей работы являлся анализ возможных механизмов влияния различных ядер гипоталамуса на формирование нейронных отображений ассоциаций “объект–место” в поле СА2 гиппокампа, а также в связанном с ним поле СА1, из которого информация об эпизоде через таламическое ядро reuniens поступает в префронтальную кору.
ОСОБЕННОСТИ ФОРМИРОВАНИЯ НЕЙРОННЫХ ОТОБРАЖЕНИЙ АССОЦИАЦИЙ “ОБЪЕКТ–МЕСТО” В РАЗНЫХ ПОЛЯХ ГИППОКАМПАЛЬНОЙ ФОРМАЦИИ
Современные представления о функциональной роли разных частей гиппокампа в кодировании информации изложены в обзоре (Senzai, 2019). Ранее нами проведен анализ некоторых особенностей формирования отображений ассоциаций “объект–место” на нейронах ЗИ и полей СА3 и СА1 гиппокампа, но не поля СА2 (Силькис, 2009). Были использованы известные данные о том, что сигналы, несущие информацию о свойствах объекта и его местоположении, двумя потоками поступают в разные слои ЗИ. В самой внешней трети молекулярного слоя оканчиваются волокна из слоя II латеральной ЭК, несущие информацию о физических свойствах объекта, а в средней трети оканчиваются аксоны нейронов слоя II медиальной ЭК, через которую в ЗИ поступает пространственная информация. Эти ГК не возбуждают друг друга. Полагают, что на нейронах ЗИ осуществляется разделение паттернов информации, поступающей из ЭК (Danielson et al., 2017; Goodsmith et al., 2017; Senzai, Buzsáki, 2017). Поскольку пространственная информация поступает в гиппокамп примерно на 20 мс раньше, чем непространственная, в ЗИ и поле СА3 первоначально обрабатывается только пространственная информация, нами предположено, что ассоциации “объект–место” начинают формироваться в ЗИ позднее, благодаря возвращению возбуждения из поля СА3с (Силькис, 2011) (рис. 1). Теоретическое моделирование показало, что возвратное возбуждение, поступающее в ЗИ из поля СА3с, может способствовать разделению паттернов в ЗИ (Myers, Scharfman, 2011). Перфорантные волокна из ЭК и мшистые волокна из ЗИ оканчиваются в разных слоях поля СА3, причем одно мшистое волокно иннервируют небольшую популяцию ПН (примерно 14) (Acsady et al., 1998). Пачечный разряд одной ГК может вызвать синхронные разряды группы ПН поля СА3, аксонные окончания которых образуют разветвленную ауто-ассоциативную сеть (Mishra et al., 2016; Senzai, Buzsáki, 2017). Полагают, что за счет функционирования этой сети нейроны областей СА3а и СА3b участвуют в кодировании пространственной информации, которая включает ассоциации (Kesner, 2007).
Первоначально формирование отображений ассоциаций “объект–место” происходит на ГК. Затем информация об ассоциациях по мшистым волокнам передается в поле СА3, где на нее накладывается информация, поступающая из ЭК. Благодаря этому на ПН поля СА3 формируются отображения более сложных ассоциаций “объект–место”. В этом процессе важным является усиление активности ГК вследствие индукции НМДА-зависимой длительной потенциации (ДП) эффективности возбудительных входов к ГК, что способствует разделению контекстных паттернов (McHugh et al., 2007). У генно-модифицированных мышей с отсутствием этих рецепторов способность разделять два сходных контекста была нарушена и была снижена контекст-зависимая модуляция срабатывания ПН поля СА3, когда животных перемещали из одного окружения в другое (McHugh et al., 2007).
Сигналы от ПН поля СА3, на которых сформировались отображения усложненных отображений ассоциаций “объект–место”, передаются в поле СА1. В дорзальной части поля СА1 на отображения ассоциаций накладывается поступающая из латеральной ЭК непространственная информация, тогда как в вентральной части поля СА1 на отображения ассоциаций накладывается поступающая из медиальной ЭК пространственная информация. В результате на ПН поля СА1 формируются нейронные отображения ассоциаций “объект–место” еще более высокого порядка (Силькис, 2011). Как отмечено во введении, для запоминания эпизодической информации важно взаимодействие гиппокампа с новой корой и парагиппокампальными областями коры (Eichenbaum, 2004). Каждая из этих областей вносит свой уникальный вклад в процессы памяти. Корковые области высшего порядка обеспечивают обработку сенсорной, моторной и когнитивной информации. Парагиппокампальная область, включающая ЭК, способствует конвергенции этой информации и поддержанию нейронных отображений информации в коре, а в активности нейронов гиппокампа кодируются и связываются вместе составляющие эпизода (Eichenbaum, 2004). Такая иерархическая обработка информации позволяет избежать комбинаторного взрыва и обеспечивает хранение (запоминание) и извлечение из памяти накапливаемых в течение жизни ассоциаций на ограниченном числе нейронов. Если бы при передаче информации происходило комбинированное связывание сенсорных признаков, то увеличение их количества вызывало бы быстрый рост числа возможных комбинаций, так что для отображения нарастающего числа ассоциаций “объект–место” необходимо было бы экспоненциальное увеличение числа нейронов.
В отличие от полей СА3 и СА1, в которые поступает зрительная, слуховая и тактильная информация об объекте, в поле СА2 из обонятельной луковицы через паравентрикулярное и супраоптическое ядра гипоталамуса поступает также информация о запахах (Piskorowski, Chevaleyre, 2018) (рис. 2). Кроме того, нейроны обонятельной луковицы проецируются в слой II латеральной ЭК (рис. 2), где иннервируют нейроны, содержащие рилин и кальбиндин. Первые проецируются в гиппокамп, а вторые – в обонятельную область коры (Leitner et al., 2016). Благодаря наличию входа из обонятельной луковицы, информация о запахах может включаться в нейронные отображения ассоциаций “объект–место” в поле СА2 и затем переноситься в поле СА1.
Как отмечено во введении, информация об ассоциациях “объект–место” передается из гиппокампа в префронтальную кору через таламическое ядро reuniens, нейроны которого реципрокно связаны с нейронами как поля СА1, так и префронтальной коры (McKenna, Vertes, 2004) (рис. 1, 3). Возбудительный вход из ядра reuniens в поле СА1 является сильным. Его стимуляция приводит к индукции ДП на входе ядро reuniens – поле СА1 (Cassel, Pereira de Vasconcelos, 2015), а стимуляция в тета-ритме входа из медиальной ЭК в поле СА1 способствовала индукции гетеросинаптической ДП на входе ядро reuniens – поле СА1 (Vu et al., 2020). По-видимому, этому эффекту способствует конвергенция аксонных окончаний нейронов ядра reuniens и ЭК на одних и тех же участках дендритного дерева ПН поля СА1 (Dolleman-van der Weel et al., 2017). По мнению авторов работы (Barker, Warburton, 2018), ядро reuniens активно влияет на процесс обработки информации во время формирования памяти об ассоциациях “объект–место”. Это заключение базируется на данных о том, что повреждение ядра reuniens значительно ухудшало долговременную память, необходимую для распознавания предмета в определенном локусе пространства, тогда как память на распознавание только предмета или только локуса сохранялась (Barker, Warburton, 2018).
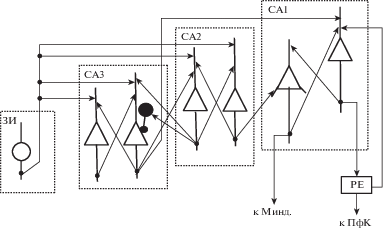
Рис. 3.
Схема передачи сигналов из зубчатой извилины через поля СА2 и СА3 в поле СА1. Минд. – миндалина. Незакрашенные треугольники и большие кружки – возбудительные нейроны; большой черный кружок – ГАМКергический нейрон; линия, оканчивающаяся маленьким черным кружком – тормозный вход. Остальные обозначения как на рис. 1.
Fig. 3. A scheme of signal transmission from the dentate gyrus through the CA2 and CA3 fields into the CA1 field. Минд. – amygdala. Open triangles and large circles – excitatory neurons; big black circle – GABAergic neuron; a line ending with a small black circle – inhibitory input. Other abbreviations are as in the Fig. 1.
ОСОБЕННОСТИ ОРГАНИЗАЦИИ СВЯЗЕЙ ПОЛЯ СА2 С НЕЙРОНАМИ ДРУГИХ ЧАСТЕЙ ГИППОКАМПА И С ЭНТОРИНАЛЬНОЙ КОРОЙ
Поскольку поле СА2 участвует в продвижении информации об ассоциациях “объект–место” через гиппокамп (рис. 3), важно учитывать особенности связей этого поля с соседними полями СА1 и СА3, а также другими структурами. В поле СА2 оканчиваются перфорантные волокна из слоя II ЭК, коллатерали Шаффера из поля СА3, а также аксонные коллатерали нейронов гипоталамических ядер СМЯ, паравентрикулярного и супраоптического (Benoy et al., 2018; Cui et al., 2013; Piskorowski, Chevaleyre, 2018) (рис. 1 и 2). Возбуждение из ЭК, поступающее на дистальные дендриты ПН поля СА2, является более сильным, по сравнению с сигналами из поля СА3, которые поступают на проксимальные дендриты, так что в синапсах ЭК-СА2 может индуцироваться НМДА-зависимая ДП (Chevaleyre, Siegelbaum, 2010). Несмотря на то что перфорантные волокна оканчиваются на сходных участках дендритного дерева ПН полей СА2 и СА1 (Piskorowski, Chevaleyre, 2012), вход ЭК-СА2 является более эффективным, так как перфорантные волокна образуют на дендритах ПН поля СА2 в 3 раза больше контактов, чем на дендритах ПН поля СА1 (Srinivas et al., 2017). При стимуляции перфорантных волокон регистрируемый в нейронах поля СА2 ВПСП был в 5–6 раз больше по амплитуде, чем в поле СА1. Кроме того, в поле СА2, но не в поле СА1, могли наблюдаться разряды ПН (Srinivas et al., 2017). Пирамидные нейроны поля СА2, как и поля СА1, посылают проекции обратно в глубокие слои ЭК (Rowland et al., 2013) (рис. 1). Благодаря этому сигналы от отображений ассоциаций “объект–место” из полей СА2 и СА1 могут влиять на активность нейронов ЭК и способствовать циркуляции этой информации в сети, связывающей ЭК с гиппокампом (рис. 1).
Наличие взаимодействий между ПН поля СА2 (Shinohara et al., 2012) может способствовать формированию и сохранению в поле СА2 аттракторных состояний, отображающих ассоциации “объект–место”, аналогично тому, как это происходит за счет рекуррентных связей в поле СА3. Аксонные коллатерали ПН поля СА2 широко ветвятся и в поле СА3 (Mercer et al., 2007), причем возбуждение поступает не только на ПН, но и на входные тормозные интернейроны. Показано, что результирующее действие со стороны поля СА2 на ПН поля СА3 может быть ингибирующим (Boehringer et al., 2017). Авторы указанной работы полагают, что торможение со стороны поля СА2 способствует поддержанию физиологического уровня возбуждения ПН поля СА3 и улучшению отображений полей места. Когда активность нейронов поля СА2 блокировали, активность ПН поля СА3, отображающая поля места, существенно увеличивалась (Boehringer et al., 2017), что должно ухудшать точность отображения полей места. В свою очередь, афферентное торможение со стороны поля СА3 при определенных условиях может препятствовать появлению возбудительных реакций у ПН поля СА2 (Chevaleyre, Siegelbaum, 2010; Nasrallah et al., 2015). Однако активность ПН в поле СА2 контролируется сетью тормозных интернейронов (Robert et al., 2018). Поскольку тормозные интернейроны слоя ориенс поля СА2 иннервируют другие тормозные интернейроны этого поля, мишенями которых являются ПН, может происходить растормаживание. Из анализа, проведенного в работе (Силькис, Маркевич, 2020), следует, что вход из СМЯ в поле СА2 может способствовать растормаживанию ПН этого поля.
Отмечено, что организация проекций СА2-СА1 отличается от проекций СА3-СА1 (Dudek et al., 2016) и что эффективность синаптической связи СА2-СА1 велика (Chevaleyre, Siegelbaum, 2010). Аксонные ветвления ПН поля СА2 образуют примерно 20% всех контактов на базальных дендритах того ряда ПН поля СА1, который расположен ближе к слою ориенс. Эти ПН проецируются в миндалину и прилежащее ядро (вентральный стриатум), т.е. в лимбические структуры (рис. 2, 3). Полагают, что благодаря этому они участвуют в кодировании информации, связанной с эмоциями и социальным поведением (Lee et al., 2014; Okuyama et al., 2016). Базолатеральное ядро миндалины, в свою очередь, влияет на активность нейронов поля СА2, но это влияние является опосредованным, так как нейроны миндалины не проецируются в поле СА2 (см. (Piskorowski, Chevaleyre, 2018)). С одной стороны, показано, что активация нейронов базолатерального ядра миндалины приводит к увеличению активности тормозных интернейронов в слое ориенс полей СА2 и СА3, но не в поле СА1 (Gisabella et al., 2009). С другой стороны, введение антагониста ГАМКа-рецепторов пикротоксина в базолатеральную миндалину (что имитирует изменения, характерные для шизофрении) приводило к значительному уменьшению тормозного тока в ПН поля СА2 (Berretta, Benes, 2006). Такое уменьшение тормозного тока может являться следствием растормаживания и должно приводить к увеличению активности ПН поля СА2. Не исключено, что в отсутствие патологий влияние со стороны миндалины препятствует усилению растормаживания ПН и увеличению их активности. Это может снижать чрезмерную эмоциональную окраску нейронных отображений ассоциаций “объект–место”, формируемых на ПН поля СА2.
ВКЛАД ЯДЕР ГИПОТАЛАМУСА В ФОРМИРОВАНИЕ НЕЙРОННЫХ ОТОБРАЖЕНИЙ АССОЦИАЦИЙ “ОБЪЕКТ–МЕСТО” В ГИППОКАМПЕ
Поскольку нейроны СМЯ иннервируют ЗИ и поле СА2 гиппокампа, это ядро гипоталамуса должно вносить определенный вклад в активность нейронов указанных частей гиппокампа и формирование отображений ассоциаций “объект–место”. Примечательно, что одна группа нейронов СМЯ проецируется преимущественно в поле СА2, а другая – в ЗИ, и очень редко (2.7%) один и тот же нейрон СМЯ иннервирует обе области (Chen et al., 2020). При этом большинство клеток СМЯ, проецирующихся в ЗИ, экспрессируют и глутамат, и ГАМК, тогда как большинство клеток СМЯ, проецирующихся в поле СА2, экспрессируют только глутамат (Chen et al., 2020). Из этих данных следует, что СМЯ различным образом влияет на ЗИ и поле СА2. С учетом известных данных о функциональной организации возбудительных и тормозных взаимодействий в нейронной сети, включающей СМЯ, гиппокамп, перегородку и ЭК, в предшествующей работе был проведен анализ возможных механизмов влияния СМЯ на прохождение сигналов через гиппокампальную формацию (Силькис, Маркевич, 2020). Из этого анализа следует, что одновременная активация СМЯ и ЭК, а также растормаживание могут способствовать индукции ДП на перфорантных входах к ГК и к ПН поля СА2. При поступлении сигналов из ЭК нейроны ЗИ и поля СА2 активируются практически одновременно (Bartesaghi et al., 2006). Благодаря ассоциативности вход из СМЯ может способствовать индукции ДП не только в синапсах ЭК-СА2 и СА3-СА2, но и в синапсах ЗИ-СА2 (Dasgupta et al., 2017). Поскольку глутаматергический вход из СМЯ способствует индукции ДП эффективности входов к ПН поля СА2 как из ЭК, так и из поля СА3, это приводит к увеличению активности нейронов поля СА2 и их возбуждающего действия на ПН поля СА1 (Chevaleyre, Siegelbaum, 2010). Авторы указанной работы пришли к заключению, что цепь ЭК-СА2-СА1 играет важную роль в гиппокамп-зависимой памяти. Когда вход из поля СА2 в поле СА1 активен, усиливается связь СА3-СА1 (Nasrallah et al., 2019). Таким образом, глутаматергический вход из СМЯ в гиппокамп облегчает прохождение сигналов через все его поля.
Для клеток СМЯ, проецирующихся в ЗИ, не выявлено значимых статистических различий по количеству входов к ним из разных областей мозга (Chen et al., 2020). Однако у клеток СМЯ, проецирующихся в поле СА2, было значительно больше входов из областей, связанных с социальными событиями, в частности, из паравентрикулярного ядра гипоталамуса (Resendez et al., 2020) и медиальной преоптической зоны гипоталамуса (которая связана с родительским поведением) (Wu et al., 2014). Полагают, что эти входы позволяют нейронам СМЯ интегрировать социально значимую информацию в контекст и модулировать процессы запоминания (Chen et al., 2020). В указанной работе отмечено, что СМЯ является уникальным в том, что оно реагирует на широкий спектр новых стимулов. На трансгенных мышах показано, что нейроны СМЯ, которые проецируются в ЗИ, активируются при появлении нового контекста, тогда как нейроны СМЯ, проецирующиеся в поле СА2, активируются при неожиданном изменении социального окружения. Показано, что поступление информации о новизне в эти структуры влияет на контекстную или социальную гиппокамп-зависимую память (Chen et al., 2020).
Кроме того, нейроны СМЯ моносинаптически иннервируют таламическое ядро reuniens (Vertes, 1992) (рис. 1). Полагают, что СМЯ участвует в усилении входов из ЭК в ЗИ, а ядро reuniens – в усилении входов из поля СА3 и ЭК в поле СА1, и что это усиление способствует передаче информации, ее кодированию и, возможно, запоминанию (Vertes, 2015). Благодаря особенностям организации эфферентных проекций, СМЯ может влиять на формирование нейронных отображений ассоциаций “объект–место” в поле СА1 как за счет возбуждения нейронов ЗИ и поля СА2, так и через таламическое ядро reuniens. Поскольку ядро reuniens иннервирует не только поле СА1, но и ЭК (Dolleman-van der Weel, Witter, 1996), оно может участвовать в формировании усложненных отображений ассоциаций “объект–место” во всех полях гиппокампа, а также способствовать циркуляции возбуждения в цепи ЭК-гиппокамп. Полагают, что благодаря связям с медиальной префронтальной корой, а также наличию входов из периринальной коры, миндалины и других структур, ядро reuniens играет критически важную роль в передаче к нейронам поля СА1 и префронтальной коры лимбической информации (эмоциональной и когнитивной) (McKenna, Vertes, 2004; Vertes, 2006).
Как отмечено ранее, индукция ДП эффективности синаптической передачи между нейронами разных частей гиппокампа способствует облегчению прохождения сигналов через гиппокамп и формированию в каждой из его частей нейронных отображений ассоциаций “объект–место” (Силькис, 2009). В предшествующих работах был проведен анализ влияний таких нейромодуляторов, как серотонин, норадреналин, ацетилхолин, кортизол, дофамин, на эффективность синаптической передачи в гиппокампе (Силькис, 2008). Также на эффективность передачи влияет нейропептид орексин, который выделяется из аксонных терминалей небольшой группы нейронов латерального гипоталамуса в состоянии бодрствования. Орексин может облегчить индукцию ДП синаптической передачи в гиппокампе, воздействуя на чувствительные к нему постсинаптические рецепторы, которые располагаются на нейронах ЗИ и поля СА1 (Силькис, 2012).
Знак модификации эффективности возбудительных и тормозных синаптических входов к нейронам разных полей гиппокампа (т.е. индукция ДП или длительной депрессии) можно определить с помощью сформулированных ранее унифицированных правил модуляции (Силькис, 2002). Направленность изменений зависит от типов постсинаптических рецепторов, чувствительных к каждому из нейромодуляторов, и от концентрации последних (Силькис, 2008). Результаты применения этих правил модуляции согласуются с известными данными экспериментальных исследований влияний различных нейромодуляторов на синаптическую пластичность в гиппокампе. Поскольку на клетках поля СА2 высокая плотность рецепторов, чувствительных ко многим нейромодуляторам (Benoy et al., 2018; Chevaleyre, Piskorowski, 2016; Du-dek et al. 2016), они должны влиять на эффективность синаптических входов к ПН этого поля и, следовательно, на формирование отображений ассоциаций “объект–место”. Нейромодуляторы могут влиять и на активность синаптических входов к нейронам ядра reuniens, куда из туберальной части гипоталамуса поступает орексин (Peyron et al., 1998). Поскольку для запоминания информации требовался синтез белков в ядре reuniens, было предположено, что это ядро является не просто релейным, а участвует в запоминании, так как облегчает взаимодействия между гиппокампом и медиальной префронтальной корой (Barker, Warburton, 2018).
ОСОБЕННОСТИ УЧАСТИЯ ПОЛЯ СА2 В ФОРМИРОВАНИИ АССОЦИАЦИЙ “ОБЪЕКТ–МЕСТО” И В СОЦИАЛЬНОЙ ПАМЯТИ
Информация о запахах может поступать из обонятельной луковицы в латеральную ЭК, а из нее – в разные части гиппокампа (рис. 2). Те нейроны латеральной ЭК, в которых синтезируется рилин, значительно лучше реагируют на определенные запахи и лучше вовлечены в их различение, чем остальные нейроны (Leitner et al., 2016). Рилин воздействует на рецепторы ApoER2, которые располагаются на постсинаптической мембране и образуют комплексы с НМДА- рецепторами. Потенциирующее действие рилина на эффективность возбудительной передачи проявлялось в увеличении тока через НМДА- и АМПА-рецепторы на нейронах гиппокампа (Rogers, Weeber, 2008). Отмечено, что хотя нейроны, иммунореактивные к рилину, имеются во всех полях СА гиппокампа, их плотность наибольшая в пирамидном и радиальном слоях поля СА2 (Botcher et al., 2014). Показано на взрослых мышах, что при классическом обусловливании рилин увеличивает выраженность ДП в гиппокампе (Pujadas et al., 2010). Следует отметить, что содержащие рилин нейроны латеральной ЭК иннервируют также ГК, на которых имеются рецепторы типа ApoER2 (Deller et al., 1999; Drakew, 2002). Поэтому не исключено, что выделение рилина способствует индукции ДП и в синапсах ЭК-ГК, а вследствие увеличения активности ГК усилится их влияние на вышележащие поля гиппокампа. Из вышеизложенного следует, что участие латеральной ЭК может способствовать включению информации о запахах в нейронные отображения ассоциаций “объект–место” в разных частях гиппокампа.
Имеются экспериментальные свидетельства того, что в иннервирующих поле СА2 нейронах паравентрикулярного и супраоптического ядер гипоталамуса синтезируются аргинин-вазопрессин и окситоцин, которые, как полагают, играют ключевую роль в социальной памяти (Piskorowski, Chevaleyre, 2018). При этом отмечено, что экспрессирующие окситоцин нейроны различным образом реагируют на социальные и несоциальные стимулы (Resendez et al., 2020). Нейроны паравентрикулярного и супраоптического ядер иннервируют также миндалину, которая реципрокно связана с полем СА1 (рис. 2). Входы из миндалины и поля СА1 конвергируют на нейронах вентральной части стриатума – прилежащего ядра (рис. 2), являющегося частью лимбической цепи (см. (Piskorowski, Chevaleyre, 2018)). Эта цепь участвует в выборе поведения (Силькис, 2014). Показано, что во время материнства окситоцин влияет на синаптическую передачу в гиппокампе (Tomizawa et al., 2003) и участвует в процессах обучения и памяти (Takahashi et al., 2020). Обзор современных данных о влиянии вазопрессина и окситоцина на функционирование гиппокампа, социальное поведение и когнитивную деятельность представлен в работе (Cilz et al., 2019). Чувствительные к окситоцину рецепторы располагаются во всех полях гиппокампальной формации, но наибольшая их плотность – в поле СА2 и верхней части поля СА3 (СА3а), где они преимущественно располагаются на глутаматергических нейронах. Поскольку экспрессия окситоциновых рецепторов сильно различается у разных видов, полагают, что это может лежать в основе межвидовых различий в социальном поведении (Cilz et al., 2019). Вазопрессиновые рецепторы также обнаружены во всех частях гиппокампальной формации, причем наибольшая плотность Avpr1b – рецепторов – в поле СА2, где они располагаются на глутаматергических клетках (Stevenson, Caldwell, 2012). Эти рецепторы имеются также в миндалине, паравентрикулярном ядре гипоталамуса и обонятельной луковице, куда также проецируется паравентрикулярное ядро (Roper et al., 2011; Young et al., 2006) (рис. 2).
Активируемые окситоцином и вазопрессином рецепторы связаны с Gq/11- белками и участвуют в регуляции содержания Са2+ в клетке, а также в активации протеинкиназы С (Kii et al., 2018). В согласии с правилами модуляции (Силькис, 2002) показано, что агонист Avpr1b-рецепторов, как и окситоцин, способствует индукции ДП эффективности синаптических входов к ПН поля СА2, причем эта НМДА-зависимая ДП связана с постсинаптическими процессами и активацией протеинкиназ (Pagani et al., 2015). Отмечено, что эта ДП индуцировалась только в поле СА2, но не в поле СА1 (Lin et al., 2018; Pagani et al., 2015) (по-видимому, из-за малого числа окситоциновых рецепторов в поле СА1). Благодаря проекциям из паравентрикулярного и супраоптического ядер в поле СА2 и облегчению индукции ДП под действием вазопрессина и окситоцина, эти нейромодуляторы, как и рилин, могут способствовать формированию на нейронах данного поля отображений ассоциаций “объект–место”, в которые включена информация о запахах, характерных для определенного локуса пространства и его обитателей в текущий момент времени. Показано, что вход из передней части поля СА2/СА3 в заднюю часть поля СА1 играет важную роль в задаче на дискриминацию социальных стимулов и социальное узнавание, тогда как вход из передней части поля СА2/СА3 в переднюю часть поля СА1 участвует в дискриминации стимулов, не связанных с социальными событиями (Raam et al., 2017). Эти данные указывают на специализацию в кодировании информации у разных групп нейронов поля СА2 и связанных с ними нейронов поля СА1. Существующие данные указывают на то, что в глубоком слое дорзальной части поля СА1 (слое СА1с), расположенном ближе к полю СА2, кодируется пространственная информация, в поле СА1b кодируется последовательность событий, а на нейронах вышележащего слоя СА1а, расположенного ближе к субикулюму, кодируется непространственная информация (Masurkar et al., 2020). Авторы указанной работы связали такую функциональную специализацию с различной организацией корковых входов к ПН разных слоев поля СА1. Показано, что аксоны ПН поля СА3 оканчиваются на апикальных дендритах того ряда ПН поля СА1, который располагается ближе к слою радиатум, тогда как аксонные ветвления ПН поля СА2 оканчиваются на базальных дендритах того ряда ПН поля СА1, который расположен ближе к слою ориенс (Cui et al., 2013; Dudek et al., 2016; Kohara et al., 2014; Shinohara et al., 2012) (рис. 3). Вследствие этого на нейроны разных слоев поля СА1 поступает информация от разных отображений ассоциаций “объект–место”, сформированных в полях СА2 и СА3. В пользу того, что они отличаются, могут свидетельствовать результаты работ (Alexander et al., 2016; Wintzer et al., 2014), в которых показано, что при изменении контекста в знакомом окружении (замена одного объекта на новый) активный клеточный ансамбль в поле СА2 существенно меняется, тогда как изменения активности нейронов в полях СА1 и СА3 не так значительны. Полагают, что благодаря своим уникальным связям поле СА2 может играть роль интерфейса между активностью мозга, связанной как с эмоциями, так и с высшими когнитивными функциями (Chevaleyre, Piskorowski, 2016), в которых участвует префронтальная кора. Авторы работы (Alexander et al., 2016) постулировали, что в активности нейронов поля СА2 уже существующее отображение пространства модулируется с учетом социальных и новых стимулов. Предлагаемый в настоящей работе механизм позволяет объяснить, каким образом в активности нейронов поля СА2 может происходить связывание разных параметров контекста. На основании данных о том, что поля места ПН поля СА2 в меньшей степени кодируют пространственную информацию, чем нейроны полей СА1 и СА3, и что эти поля места сильнее меняются с течением времени (часы-дни), чем в ответ на изменение контекста, было предположено, что нейронные ансамбли поля СА2 могут играть важную роль в кодировании течения времени (Mankin et al., 2015).
СВИДЕТЕЛЬСТВА В ПОЛЬЗУ СУЩЕСТВЕННОГО ВКЛАДА ПОЛЯ СА2 ГИППОКАМПА И ЯДЕР ГИПОТАЛАМУСА В ЭПИЗОДИЧЕСКУЮ И СОЦИАЛЬНУЮ ПАМЯТЬ
Если предлагаемый гипотетический механизм формирования отображений ассоциаций “объект–место” в гиппокампе и, в частности, в поле СА2 верен, ослабление эффективности синаптической передачи через это поле, а также ослабление спайковой активности ПН поля СА2 и их связей с полем СА1 гиппокампа могут ухудшить эпизодическую и социальную память и привести к неврологическим расстройствам. Повреждение ядра reuniens, связывающего поле CА1 с префронтальной корой, также должно привести к нарушениям тех видов памяти, которые связаны с обеими структурами. Нарушить запоминание информации и ее извлечение из памяти может и ослабление растормаживания, которое играет существенную роль в усилении активности ПН поля СА2. Поскольку индукция ДП эффективности возбудительных входов к нейронам поля СА2 зависит от рилина, вазопрессина и окситоцина, синтезируемых ядрами гипоталамуса, отсутствие входов из этих ядер в гиппокамп или блокирование чувствительных к указанным веществам рецепторов должны ухудшать эпизодическую и социальную память.
Эти следствия предлагаемого механизма согласуются с известными из литературы результатами экспериментальных исследований. Так, показано, что нарушение функционирования тормозных цепей в поле СА2 (которые обеспечивают растормаживание (Силькис, Маркевич, 2020)) приводит к специфическим психиатрическим заболеваниям (Botcher et al., 2014). Различные манипуляции с ядром reuniens, такие как его повреждение, временная инактивация или оптогенетическая стимуляция, приводят к изменениям когнитивных функций, особенно для задач, выполнение которых чувствительно к повреждениям и гиппокампа, и медиальной префронтальной коры (Cassel, Pereira de Vasconcelos, 2015). В частности, при повреждении ядра reuniens нарушалось отображение окружающей среды на нейронах поля СА1 гиппокампа (Cholvin et al., 2018). Прерывание взаимодействия гиппокампа с медиальной префронтальной корой или временная инактивация ядра reuniens при выполнении задач на запоминание ассоциаций “объект–место” препятствовали как кодированию, так и извлечению из памяти этих ассоциаций (Barker, Warburton, 2015; Barker, Warburton, 2018). Примечательно, что повреждение ядра reuniens приводило к нарушению отдаленной, но не недавно приобретенной контекстной памяти (Quet et al., 2020). Полагают, что повреждение ядра reuniens может нарушить перестройку кортикальных связей, за счет которых поддерживаются удаленные воспоминания (Klein et al., 2019).
На важную роль поля СА2 в формировании некоторых видов гиппокамп-зависимых форм поведения и социальной памяти указано в работе (Hitti, Siegelbaum et al., 2014). Показано, что для социальной памяти необходимо корректное функционирование обонятельной системы, частью которой является поле СА2, в котором формируются и затем могут извлекаться из памяти ассоциации между обонятельными сигналами и социальными взаимодействиями (Stevenson, Caldwell, 2014; Young et al., 2006). Одним из важных свойств нейронов поля СА2 является участие в социальном узнавании, т.е. в определении знакомых сородичей или особей, не относящихся к данному виду (Tzakis, Holahan, 2019). В пользу участия поля СА2 в социальном поведении свидетельствуют данные о том, что прекращение активности нейронов поля СА2 нарушает распознавание социальной информации (Stevenson, Caldwell, 2014). Память о социальных событиях базируется не только на нейронах дорзальной части поля СА2, но и на их клетках-мишенях в вентральной части поля СА1 (Meira et al., 2018). Показано, что наличие активности в дорзальной части поля СА2 критично для кодирования, консолидации и извлечения из памяти информации о социальных событиях (Meira et al., 2018).
Имеются данные, свидетельствующие о важности для обучения и запоминания индукции ДП на нейронах гиппокампа, на которых формируются отображения ассоциаций “объект–место”. Так, на генно-модифицированных мышах показано, что усиление эффективности синаптических входов к ПН поля СА2 приводит к улучшению запоминания новых объектов и более быстрому гиппокамп-зависимому обучению в бассейне Морриса (Lee et al., 2010). На важный вклад веществ, синтезируемых нейронами гипоталамических ядер, в индукцию ДП в гиппокампе, а также в процессы памяти и обучения указывают, в частности, данные о том, что увеличение ДП в поле СА1 под действием рилина коррелирует с усилением ассоциативного и пространственного обучения и с улучшением запоминания (Rogers et al., 2011). Генно-модифицированные мыши с отсутствием рилиновых рецепторов хуже выполняли задачи на обучение и память (Beffert et al., 2005), и у них была нарушена контекстуальная память (Weeber, 2002). На то, что рилин участвует в процессах, связанных с памятью, и что плотность рилиновых рецепторов наибольшая в пирамидном слое поля СА2, указано в работе (Botcher et al., 2014). Таким образом, рилин сильнее всего может влиять на функционирование нейронов в поле СА2. На мышах в свободном поведении показано, что если социальные стимулы возбуждают выделяющие окситоцин нейроны паравентрикулярного ядра гипоталамуса, то улучшается выполнение задач на социальный выбор, тогда как подавление активности указанных нейронов ухудшало типичное социальное предпочтение (Resendez et al., 2020). Введение окситоцина в желудочки мозга не только способствовало индукции ДП, но и улучшало пространственное поведение, тогда как введение антагониста окситоциновых рецепторов этому препятствовало (Tomizawa et al., 2003). У генно-модифицированных мышей с отсутствием окситоциновых рецепторов в поле СА2 нарушалась как индукция ДП на входе из ЭК к ПН поля СА2, так и долговременная память социального узнавания (Lin et al., 2018). Социальная память существенно улучшалась, если во время запоминания информации оптогенетически стимулировали выделяющие вазопрессин нейроны паравентрикулярного ядра гипоталамуса (Smith et al., 2016). Этот эффект блокировался в присутствии антагонистов вазопрессиновых рецепторов в поле СА2 (Smith et al., 2016). У мышей с отсутствием вазопрессиновых рецепторов или после использования антагониста этих рецепторов наблюдали слабую социальную агрессию (Pagani et al., 2015). О важной роли вазопрессина в таких видах социального поведения грызунов, как социальная память, социальная мотивация, социальные формы агрессии, свидетельствуют и результаты работы (Stevenson, Caldwell, 2012). В пользу участия СМЯ в процессах запоминания могут служить данные о том, что временная инактивация этого ядра нарушала способность крыс решать задачи, требующие участия рабочей памяти (Aranda et al., 2006). Показано также, что для извлечения из памяти пространственной информации требуется активация глутаматергических проекций из СМЯ в ЗИ (Li et al., 2020).
Следует отметить, что предлагаемый механизм базируется на результатах экспериментов, проведенных на животных (преимущественно на грызунах), поскольку только такие опыты дают возможность на уровне отдельных нейронов выявить корреляцию между изменением эффективности синаптической передачи и обучением или запоминанием. Существующие методы визуализации активности в мозге человека позволяют оценивать степень возбуждения больших групп нейронов, причем с очень низким временным разрешением. С нашей точки зрения, использование результатов экспериментов на животных допустимо, поскольку механизм модуляции эффективности синаптической передачи, базирующийся на внутриклеточных процессах, является унифицированным (Силькис, 2002) и не зависит от того, находятся ли нейроны в мозге человека или животного. Кроме того, строение гиппокампа и организация афферентных входов в эту структуру у человека и грызунов сходны.
ЗАКЛЮЧЕНИЕ
Поскольку поле СА2 играет важную роль в функционировании гиппокампа, повреждение нейронов этого поля или их недостаточная активация могут привести к различным неврологическим нарушениям. Так, обнаружено, что при болезни Паркинсона, в особенности на поздних стадиях заболевания, атрофируется лимбическая система, включая поле СА2 гиппокампа, ЭК, лимбические ядра таламуса и ядра миндалины (Braak et al., 1996). Полагают, что по атрофии клеток в поле СА2 можно дифференцировать различные нейродегенеративные стадии болезни Паркинсона (Pang et al., 2019). Поздние стадии болезни Паркинсона могут совпадать с начинающейся болезнью Альцгеймера, которая характеризуется нарушением когнитивных функций (Braak et al., 1996). При болезни Альцгеймера в гиппокампе также наблюдается атрофия клеток, особенно в полях СА2 и СА1, а также в связанном с ними базолатеральном ядре миндалины (Tang et al., 2016). При болезни Альцгеймера атрофия в полях СА1, СА2 и СА4 больше, чем в контрольной группе пожилых людей (Madusanka et al., 2019). Поскольку клетками-мишенями ПН поля СА2 являются нейроны поля СА1, было предположено, что нарушения контекстуальной памяти при болезнях Паркинсона и Альцгеймера связаны и с изменениями функционирования нейронов поля СА1 (Adamowicz et al., 2017). С точки зрения предлагаемого в настоящей работе механизма, ослабление контекстуальной памяти на поздней стадии болезни Паркинсона и при болезни Альцгеймера в значительной степени может быть связано с тем, что атрофия ПН в поле СА2 препятствует формированию адекватных отображений ассоциаций “объект–место” не только в этом поле, но и в поле СА1, в которое проецируются ПН поля СА2.
Сниженные реакции на социально значимые стимулы связывают с аутизмом (Resendez et al., 2020). Примечательно, что у мышей с аномальным социальным поведением уменьшено число нейронов, выделяющих окситоцин, причем поведение этих мышей можно было улучшить с помощью агонистов окситоциновых рецепторов. (Resendez et al., 2020). Авторы работы (Kubota et al., 1996) высказали предположение, что, поскольку агонисты окситоциновых рецепторов способствуют индукции ДП в гиппокампе, потенциально они могут рассматриваться в качестве веществ, улучшающих нарушения памяти при болезни Паркинсона. При болезни Альцгеймера нарушение ДП может быть вызвано бета-амилоидами Aβ25-35. На срезах гиппокампа показано, что окситоцин препятствует такому нарушению ДП (Takahashi et al., 2020). Полагают, что фармакологическое воздействие с помощью агонистов на вазопрессиновые Avpr1b-рецепторы в поле СА2 потенциально может быть полезным для улучшения социальной памяти при разных видах деменции (Smith et al., 2016). Показано, что при патологической бета-амилоидной нагрузке меняется и активность нейронов ядра reuniens (Walsh et al., 2020), в результате чего должна ухудшиться связь гиппокампа с префронтальной корой.
С изменениями характера гиппокампальной активности, приводящими к когнитивным и социальным дисфункциям, связывают ряд нейропсихиатрических заболеваний. Так, показано, что при нейропсихиатрических заболеваниях меняется активность нейронов в поле СА2 (Robert et al., 2018). Посмертные исследования поля СА2 у больных шизофренией выявили ряд специфических изменений (Piskorowski et al., 2016). В частности, наблюдались снижение числа тормозных интернейронов и ослабление афферентного торможения, а также изменение свойств ПН поля СА2. В них гораздо тяжелее было вызвать генерацию спайка (Piskorowski et al., 2016). Эти данные указывают на изменения функционирования не только ПН, но и тормозной системы в поле СА2. С помощью функционального магнитного резонанса показано, что при шизофрении и биполярном расстройстве уменьшен объем всех областей СА гиппокампа, причем в разных полях изменения отличались. Например, при шизофрении в левой части полей СА2/СА3 изменения были меньше, чем при биполярном расстройстве (Haukvik et al., 2018).
Таким образом, существующие данные позволяют полагать, что исследование изменений в поле CA2 при нейродегенеративных заболеваниях представляет особый интерес в связи с важной ролью этого поля в когнитивной деятельности, особенно в социальной памяти и в различении объектов (Pang et al., 2019). Поскольку результаты настоящей работы способствуют пониманию механизмов, лежащих в основе участия поля СА2 и всей гиппокампальной формации в процессах памяти, они могут быть полезны для направленного поиска препаратов, ослабляющих симптомы некоторых нейродегенеративных заболеваний, связанных с аномальным функционированием этой структуры.
Список литературы
Силькис И.Г. Унифицированный постсинаптический механизм влияния различных нейромодуляторов на модификацию возбудительных и тормозных входов к нейронам гиппокампа (Гипотеза). Успехи физиол. наук. 2002. 33 (1): 40–56.
Силькис И.Г. Особенности функционирования гиппокампальной формации при бодрствовании и парадоксальном сне. Журнал высшей нервной деятельности им. И.П. Павлова. 2008. 58 (3): 261–275.
Силькис И.Г. Участие трисинаптического гиппокампального пути в формировании нейронных отображений ассоциаций “объект–место” (аналитический обзор). Журнал высшей нервной деятельности им. И.П. Павлова. 2009. 59 (6): 645–661.
Силькис И.Г. Иерархическая система обработки и хранения данных об ассоциациях “объект–место” в гиппокампе (Гипотеза). Журнал высшей нервной деятельности им. И.П. Павлова. 2011. 61 (1): 645–663.
Силькис И.Г. Возможные механизмы влияния орексина на функционирование гиппокампа и пространственное обучение (аналитический обзор). Журнал высшей нервной деятельности им. И.П. Павлова. 2012. 62 (4): 389–400.
Силькис И.Г. Механизмы взатиозависимого влияния префронтальной коры, гиппокампа и миндалины на функционирование базальных ганглиев и выбор поведения. Журнал высшей нервной деятельности им. И.П. Павлова. 2014. 64 (1): 82–100.
Силькис И.Г., Маркевич В.А. Возможные механизмы влияния супрамамиллярного ядра на функционирование зубчатой извилины и поля СА2 гиппокампа (роль растормаживания). Нейрохимия. 2020. 37 (4): 1–10.
Acsady L., KamondiA., Sik A., Freund T., Buzsaki G. GABAergic cells are the major postsynaptic targets of mossy fibers in the rat hippocampus. J. Neurosci. 1998. 18 (9): 3386–3403.
Adamowicz D.H., Roy S., Salmon D.P., Galasko D.R., Hansen L.A., Masliah E., Gage F.H. Hippocampal α-synuclein in dementia with Lewy bodies contributes to memory impairment and is consistent with spread of pathology. J. Neurosci. 2017. 37 (7): 1675–1684.
Alexander G.M., Farris S., Pirone J.R., Zheng C., Colgin L.L., Dudek S.M. Social and novel contexts modify hippocampal CA2 representations of space. Nat. Commun. 2016. 7: 10300.
Aranda L., Santín L.J., Begega A., Aguirre J.A., Arias J.L. Supramammillary and adjacent nuclei lesions impair spatial working memory and induce anxiolitic-like behavior. Behav. Brain Res. 2006. 167 (1): 156–164.
Bartesaghi R., Migliore M., Gessi T. Input-output relations in the entorhinal cortex-dentate-hippocampal system: evidence for a non-linear transfer of signals. Neuroscience. 2006. 142 (1): 247–265.
Benoy A., Dasgupta A., Sajikumar S. Hippocampal area CA2: an emerging modulatory gateway in the hippocampal circuit. Exp. Brain Res. 2018. 236 (4): 919–931.
Berretta S., Benes F.M. A rat model for neural circuitry abnormalities in schizophrenia. Nat. Protoc. 2006. 1(2): 833–889.
Boehringer R., Polygalov D., Huang A.J.Y., Middleton S.J., Robert V., Wintzer M.E., Piskorowski R.A., Chevaleyre V., McHugh T.J. Chronic loss of CA2 transmission leads to hippocampal hyperexcitability. Neuron. 2017. 94 (3): 642–655.
Barker G.R., Warburton E.C. A Critical role for the nucleus reuniens in long-term, but not short-term associative recognition memory formation. J. Neurosci. 2018. 38 (13): 3208–3217.
Barker G.R., Warburton E.C. Object-in-place associative recognition memory depends on glutamate receptor neurotransmission within two defined hippocampal-cortical circuits: a critical role for AMPA and NMDA receptors in the hippocampus, perirhinal, and prefrontal cortices. Cereb. Cortex. 2015. 25 (2): 472–481.
Beffert U., Weeber E.J., Durudas A., Qiu S., Masiulis I., Sweatt J.D., Li W.P., Adelmann G., Frotscher M., Hammer R.E., Herz J. Modulation of synaptic plasticity and memory by reelin involves differential splicing of the lipoprotein receptor Apoer2. Neuron. 2005. 47 (4): 567–579.
Botcher N.A., Falck J.E., Thomson A.M., Mercer A. Distribution of interneurons in the CA2 region of the rat hippocampus. Front. Neuroanat. 2014. 8: 104.
Braak H., Braak E., Yilmazer D., de Vos R.A., Jansen E.N., Bohl J. Pattern of brain destruction in Parkinson’s and Alzheimer’s diseases. J. Neural. Transm. (Vienna). 1996. 103 (4): 455–490.
Cassel J.C., Pereira de Vasconcelos A. Importance of the ventral midline thalamus in driving hippocampal functions. Prog. Brain Res. 2015. 219: 145–161.
Cassel J.C., Pereira de Vasconcelos A., Loureiro M., Cholvin T., Dalrymple-Alford J.C., Vertes R.P. The reuniens and rhomboid nuclei: neuroanatomy, electrophysiological characteristics and behavioral implications. Prog. Neurobiol. 2013. 111: 34–52.
Chen S., He L., Huang A.J.Y., Boehringer R., Robert V., Wintzer M.E., Polygalov D., Weitemier A.Z., Tao Y., Gu M., Middleton S.J., Namiki K., Hama H., Therreau L., Chevaleyre V., Hioki H., Miyawaki A., Piskorowski R.A., McHugh T.J.A hypothalamic novelty signal modulates hippocampal memory. Nature. 2020. 586 (7828): 270–274.
Chevaleyre V., Piskorowski R.A. Hippocampal area CA2: an overlooked but promising therapeutic target. Trends Mol. Med. 2016. 22 (8): 645–655.
Chevaleyre V., Siegelbaum S.A. Strong CA2 pyramidal neuron synapses define a powerful disynaptic cortico-hippocampal loop. Neuron. 2010. 66 (4): 560–572.
Chiang M.C., Huang A.J.Y., Wintzer M.E., Ohshima T., McHugh T.J. A role for CA3 in social recognition memory. Behav. Brain Res. 2018. 354: 22–30.
Cholvin T., Hok V., Giorgi L., Chaillan F.A., Poucet B. Ventral midline thalamus is necessary for hippocampal place field stability and cell firing modulation. J. Neurosci. 2018. 38 (1):158–172.
Cilz N.I., Cymerblit-Sabba A., Young W.S. Oxytocin and vasopressin in the rodent hippocampus. Genes Brain Behav. 2019. 18 (1): e12535.
Cui Z., Gerfen C.R., Young W.S. 3rd. Hypothalamic and other connections with dorsal CA2 area of the mouse hippocampus. J. Comp. Neurol. 2013. 521 (8): 1844–1866.
Danielson N.B., Turi G.F., Ladow M., Losonczy A. In vivo imaging of dentate gyrus mossy cells in behaving mice. Neuron. 2017. 93 (3): 552–559.
Dasgupta A., Baby N., Krishna K., Hakim M., Wong Y.P., Behnisch T., Soong T.W., Sajikumar S. Substance P induces plasticity and synaptic tagging/capture in rat hippocampal area CA2. Proc. Natl. Acad. Sci. USA. 2017. 114 (41): E8741–E8749.
Deller T., Drakew A., Frotscher M. Different primary target cells are important for fiber lamination in the fascia dentata: a lesson from reeler mutant mice. Exp. Neurol. 1999. 156 (2): 239–253.
Dolleman-van der Weel M.J., Lopes da Silva F.H., Witter M.P. Interaction of nucleus reuniens and entorhinal cortex projections in hippocampal field CA1 of the rat. Brain Struct. Funct. 2017. 222 (5): 2421–2438.
Drakew A., Deller T., Heimrich B., Gebhardt C., Del Turco D., Tielsch A., Förster E., Herz J., Frotscher M. Dentate granule cells in reeler mutants and VLDLR and ApoER2 knockout mice. Exp. Neurol. 2002. 176 (1): 12–24.
Dudek S.M., Alexander G.M., Farris S. Rediscovering area CA2: unique properties and functions. Nat. Rev. Neurosci. 2016. 17 (2): 89–102.
Eichenbaum H. Hippocampus: Cognitive processes and neural representations that underlie declarative memory. Neuron. 2004. 44 (1): 109–120.
Eldridge L.L., Engel S.A., Zeineh M.M., Bookheimer S.Y., Knowlton B.J. A dissociation of encoding and retrieval processes in the human hippocampus. J. Neurosci. 2005. 25 (13): 3280–3286.
Gisabella B., Cunningham M.G., Bolshakov V.Y., Benes F.M. Amygdala-dependent regulation of electrical properties of hippocampal interneurons in a model of schizophrenia. Biol. Psychiatry. 2009. 65 (6): 464–472.
Goodsmith D., Chen X., Wang C., Kim S.H., Song H., Burgalossi A., Christian K.M., Knierim J.J. Spatial representations of granule cells and mossy cells of the dentate gyrus. Neuron. 2017. 93 (3): 677–690.
Hashimotodani Y., Karube F., Yanagawa Y., Fujiyama F., Kano M. Supramammillary nucleus afferents to the dentate gyrus co-release glutamate and GABA and potentiate granule cell output. Cell Rep. 2018. 25 (10): 2704–2715.e4.
Haukvik U.K., Tamnes C.K., Söderman E., Agartz I. Neuroimaging hippocampal subfields in schizophrenia and bipolar disorder: A systematic review and meta-analysis. J. Psychiatr. Res. 2018. 104: 217–226.
Hitti F.L., Siegelbaum S.A. The hippocampal CA2 region is essential for social memory. Nature. 2014. 508 (7494): 88–92.
Kesner R.P. Behavioral functions of the CA3 subregion of the hippocampus. Learn. Mem. 2007. 14 (11): 771–781.
Kii I., Hirahara-Owada S., Yamaguchi M., Niwa T., Koike Y., Sonamoto R., Ito H., Takahashi K., Yokoyama C., Hayashi T., Hosoya T., Watanabe Y. Quantification of receptor activation by oxytocin and vasopressin in endocytosis-coupled bioluminescence reduction assay using nanoKAZ. Anal. Biochem. 2018. 549: 174–183.
Klein M.M., Cholvin T., Cosquer B., Salvadori A., Le Mero J., Kourouma L., Boutillier A.L., Pereira de Vasconcelos A., Cassel J.C. Ventral midline thalamus lesion prevents persistence of new (learning-triggered) hippocampal spines, delayed neocortical spinogenesis, and spatial memory durability. Brain Struct. Funct. 2019. 224 (4): 1659–1676.
Kohara K., Pignatelli M., Rivest A.J., Jung H.Y., Kitamura T., Suh J., Frank D., Kajikawa K., Mise N., Obata Y., Wickersham I.R., Tonegawa S. Cell type-specific genetic and optogenetic tools reveal hippocampal CA2 circuits. Nat. Neurosci. 2014. 17 (2): 269–279.
Kubota Y., Kimura T., Hashimoto K., Tokugawa Y., Nobunaga K., Azuma C., Saji F., Murata Y. Structure and expression of the mouse oxytocin receptor gene. Mol. Cell. Endocrinol. 1996. 124 (1–2): 25–32.
Lee S.H., Simons S.B., Heldt S.A., Zhao M., Schroeder J.P., Vellano C.P., Cowan D.P., Ramineni S., Yates C.K., Feng Y., Smith Y., Sweatt J.D., Weinshenker D., Ressler K.J., Dudek S.M., Hepler J.R. RGS14 is a natural suppressor of both synaptic plasticity in CA2 neurons and hippocampal-based learning and memory. Proc. Natl. Acad. Sci. USA. 2010. 107 (39): 16994–16998.
Lee S.H., Marchionni I., Bezaire M., Varga C., Danielson N., Lovett-Barron M., Losonczy A., Soltesz I. Parvalbumin-positive basket cells differentiate among hippocampal pyramidal cells. Neuron. 2014. 82 (5): 1129–1144.
Leitner F.C., Melzer S., Lütcke H., Pinna R., Seeburg P.H., Helmchen F., Monyer H. Spatially segregated feedforward and feedback neurons support differential odor processing in the lateral entorhinal cortex. Nat. Neurosci. 2016. 19 (7): 935–944.
Lin Y.T., Hsieh T.Y., Tsai T.C., Chen C.C., Huang C.C., Hsu K.S. Conditional deletion of hippocampal CA2/CA3a oxytocin receptors impairs the persistence of long-term social recognition memory in mice. J. Neurosci. 2018. 38 (5): 1218–1231.
Madusanka N., Choi H.K., So J.H., Choi B.K., Park H.G. One-year follow-up study of hippocampal subfield atrophy in alzheimer’s disease and normal aging. Curr. Med. Imaging Rev. 2019. 15 (7): 699–709.
Mankin E.A., Diehl G.W., Sparks F.T., Leutgeb S., Leutgeb J.K. Hippocampal CA2 activity patterns change over time to a larger extent than between spatial contexts. Neuron. 2015. 85 (1): 190–201.
Masurkar A.V., Tian C., Warren R., Reyes I., Lowes D.C., Brann D.H., Siegelbaum S.A. Postsynaptic integrative properties of dorsal CA1 pyramidal neuron subpopulations. J. Neurophysiol. 2020. 123 (3): 980–992.
McKenna J.T., Vertes R.P. Afferent projections to nucleus reuniens of the thalamus. J. Comp. Neurol. 2004. 480 (2): 115–142.
McHugh T.J., Jones M.W., Quinn J.J., Balthasar N., Coppari R., Elmquist J.K., Lowell B.B., Fanselow M.S., Wilson M.A., Tonegawa S. Dentate gyrus NMDA receptors mediate rapid pattern separation in the hippocampal network. Science. 2007. 317 (5834): 94–99.
Meira T., Leroy F., Buss E.W., Oliva A., Park J., Siegelbaum S.A. A hippocampal circuit linking dorsal CA2 to ventral CA1 critical for social memory dynamics. Nat. Commun. 2018. 9 (1): 4163.
Mercer A., Trigg H.L., Thomson A.M. Characterization of neurons in the CA2 subfield of the adult rat hippocampus. J. Neurosci. 2007. 27 (27): 7329–7338.
Mishra R.K., Kim S., Guzman S.J., Jonas P. Symmetric spike timing-dependent plasticity at CA3-CA3 synapses optimizes storage and recall in autoassociative networks. Nat. Commun. 2016. 7: 11552.
Myers C.E., Scharfman H.E. Pattern separation in the dentate gyrus: a role for the CA3 backprojection. Hippocampus. 2011. 21 (11): 1190–1215.
Nasrallah K., Piskorowski R.A., Chevaleyre V. Inhibitory plasticity permits the recruitment of CA2 pyramidal neurons by CA3. eNeuro. 2015, 2 (4): 1–12.
Nakanishi K., Saito H., Abe K. The supramammillary nucleus contributes to associative EPSP-spike potentiation in the rat dentate gyrus in vivo. Eur. J. Neurosci. 2001. 13 (4): 793–800.
Nadel L., Moscovitch M. Hippocampal contributions to cortical plasticity. Neuropharmacology. 1998. 37 (4-5): 431–439.
Nasrallah K., Therreau L., Robert V., Huang A.J.Y., McHugh T.J., Piskorowski R.A., Chevaleyre V. Routing hippocampal information flow through parvalbumin interneuron plasticity in area CA2. Cell Rep. 2019. 27 (1): 86–98. e3.
Okuyama T., Kitamura T., Roy D.S., Itohara S., Tonegawa S. Ventral CA1 neurons store social memory. Science. 2016. 353 (6307): 1536–1541.
Pagani J.H., Zhao M., Cui Z., Avram S.K., Caruana D.A., Dudek S.M., Young W.S. Role of the vasopressin 1b receptor in rodent aggressive behavior and synaptic plasticity in hippocampal area CA2. Mol. Psychiatry. 2015. 20 (4): 490–499.
Pang C.C., Kiecker C., O’Brien J.T., Noble W., Chang R.C. Ammon’s horn 2 (CA2) of the hippocampus: a long-known region with a new potential role in neurodegeneration. Neuroscientist. 2019. 25 (2): 167–180.
Peyron C., Tighe D.K., van den Pol A.N., de Lecea L., Heller H.C., Sutcliffe J.G., Kilduff T.S. Neurons containing hypocretin (orexin) project to multiple neuronal systems. J. Neurosci. 1998. 18 (23): 9996–10015.
Piskorowski R.A., Chevaleyre V. Synaptic integration by different dendritic compartments of hippocampal CA1 and CA2 pyramidal neurons. Cell Mol. Life Sci. 2012. 69 (1): 75–88.
Piskorowski R.A., Chevaleyre V. Memory circuits: CA2. Curr. Opin. Neurobiol. 2018. 52: 54–59.
Piskorowski R.A., Nasrallah K., Diamantopoulou A., Mukai J., Hassan S.I., Siegelbaum S.A., Gogos J.A., Chevaleyre V. Age-dependent specific changes in area CA2 of the hippocampus and social memory deficit in a mouse model of the 22q11.2 deletion syndrome. Neuron. 2016. 89 (1): 163–176.
Pujadas L., Gruart A., Bosch C., Delgado L., Teixeira C.M., Rossi D., de Lecea L., Martínez A., Delgado-García J.M., Soriano E. Reelin regulates postnatal neurogenesis and enhances spine hypertrophy and long-term potentiation. J. Neurosci. 2010. 30 (13): 4636–4649.
Quet E., Majchrzak M., Cosquer B., Morvan T., Wolff M., Cassel J.C., Pereira de Vasconcelos A., Stéphan A. The reuniens and rhomboid nuclei are necessary for contextual fear memory persistence in rats. Brain Struct. Funct. 2020. 225 (3): 955–968.
Raam T., McAvoy K.M., Besnard A., Veenema A.H., Sahay A. Hippocampal oxytocin receptors are necessary for discrimination of social stimuli. Nat. Commun. 2017. 8 (1): 2001.
Resendez S.L., Namboodiri V.M.K., Otis J.M., Eckman L.E.H., Rodriguez-Romaguera J., Ung R.L., Basiri M.L., Kosyk O., Rossi M.A., Dichter G.S., Stuber G.D. Social stimuli induce activation of oxytocin neurons within the paraventricular nucleus of the hypothalamus to promote social behavior in male mice. J. Neurosci. 2020. 40 (11): 2282–2295.
Robert V., Cassim S., Chevaleyre V., Piskorowski R.A. Hippocampal area CA2: properties and contribution to hippocampal function. Cell Tissue Res. 2018. 373 (3): 525–540.
Rogers J.T., Rusiana I., Trotter J., Zhao L., Donaldson E., Pak D.T., Babus L.W., Peters M., Banko J.L., Chavis P., Rebeck G.W., Hoe H.S., Weeber E.J. Reelin supplementation enhances cognitive ability, synaptic plasticity, and dendritic spine density. Learn. Mem. 2011. 18 (9): 558–564.
Rogers J.T., Weeber E.J. Reelin and apoE actions on signal transduction, synaptic function and memory formation. Neuron Glia Biol. 2008. 4 (3): 259–270.
Roper J., O’Carroll A.M., Young W. 3rd, Lolait S. The vasopressin Avpr1b receptor: molecular and pharmacological studies. Version 2. Stress. 2011. 14 (1): 98–115.
Rowland D.C., Weible A.P., Wickersham I.R., Wu H., Mayford M., Witter M.P., Kentros C.G. Transgenically targeted rabies virus demonstrates a major monosynaptic projection from hippocampal area CA2 to medial entorhinal layer II neurons. J. Neurosci. 2013. 33 (37): 14889–14898.
Senzai Y. Function of local circuits in the hippocampal dentate gyrus-CA3 system. Neurosci. Res. 2019. 140: 43–52.
Senzai Y., Buzsáki G. Physiological properties and behavioral correlates of hippocampal granule cells and mossy cells. Neuron. 2017. 93 (3): 691–704.
Shinohara Y., Hosoya A., Yahagi K., Ferecskó A.S., Yaguchi K., Sík A., Itakura M., Takahashi M., Sik A., Tamamaki N., and Freund T.F. Complete axon arborization of a single CA3 pyramidal cell in the rat hippocampus, and its relationship with postsynaptic parvalbumin-containing interneurons. Eur. J. Neurosci. 1993. 5 (12): 1719–1728.
Smith A.S., Williams Avram S.K., Cymerblit-Sabba A., Song J., Young W.S. Targeted activation of the hippocampal CA2 area strongly enhances social memory. Mol. Psychiatry. 2016. 21 (8): 1137–1144.
Srinivas K.V., Buss E.W., Sun Q., Santoro B., Takahashi H., Nicholson D.A., Siegelbaum S.A. The dendrites of CA2 and CA1 pyramidal neurons differentially regulate information flow in the cortico-hippocampal circuit. J. Neurosci. 2017. 37 (12): 3276–3293.
Stevenson E.L., Caldwell H.K. The vasopressin 1b receptor and the neural regulation of social behavior. Horm. Behav. 2012. 61 (3): 277–282.
Stevenson E.L., Caldwell H.K. Lesions to the CA2 region of the hippocampus impair social memory in mice. Eur. J. Neurosci. 2014. 40 (9): 3294–3301.
Takahashi J., Yamada D., Ueta Y., Iwai T., Koga E., Tanabe M., Oka J.I., Saitoh A. Oxytocin reverses Abeta-induced impairment of hippocampal synaptic plasticity in mice. Biochem Biophys. Res. Commun. 2020. 528 (1): 174–178.
Tang X., Qin Y., Wu J., Zhang M., Zhu W., Miller M.I. Shape and diffusion tensor imaging based integrative analysis of the hippocampus and the amygdala in Alzheimer’s disease. Magn. Reson. Imaging. 2016. 34 (8): 1087–1099.
Tomizawa K., Iga N., Lu Y.F., Moriwaki A., Matsushita M., Li S.T., Miyamoto O., Itano T., Matsui H. Oxytocin improves long-lasting spatial memory during motherhood through MAP kinase cascade. Nat. Neurosci. 2003. 6 (4): 384–390.
Tzakis N., Holahan M.R. Social memory and the role of the hippocampal CA2 region. Front. Behav. Neurosci. 2019. 13: 233.
Vertes R.P. PHA-L analysis of projections from the supramammillary nucleus in the rat. J. Comp. Neurol. 1992. 326 (4): 595–622.
Vertes R.P. Interactions among the medial prefrontal cortex, hippocampus and midline thalamus in emotional and cognitive processing in the rat. Neuroscience. 2006. 142 (1): 1–20.
Vertes R.P. Major diencephalic inputs to the hippocampus: supramammillary nucleus and nucleus reuniens. Circuitry and function. Prog. Brain Res. 2015. 219: 121–144.
Vu T., Gugustea R., Leung L.S. Long-term potentiation of the nucleus reuniens and entorhinal cortex to CA1 distal dendritic synapses in mice. Brain Struct. Funct. 2020. 225 (6): 1817–1838.
Vyleta N.P., Borges-Merjane C., Jonas P. Plasticity-dependent, full detonation at hippocampal mossy fiber–CA3 pyramidal neuron synapses. eLife. 2016. 5: e17977.
Walsh D.A., Brown J.T., Randall A.D. Neurophysiological alterations in the nucleus reuniens of a mouse model of Alzheimer’s disease. Neurobiol. Aging. 2020. 88: 1–10.
Weeber E.J., Beffert U., Jones C., Christian J.M., Forster E., Sweatt J.D., Herz J. Reelin and ApoE receptors cooperate to enhance hippocampal synaptic plasticity and learning. J. Biol. Chem. 2002. 277 (42): 39944–39952.
Wintzer M.E., Boehringer R., Polygalov D., McHugh T.J. The hippocampal CA2 ensemble is sensitive to contextual change. J. Neurosci. 2014. 34 (8): 3056–3066.
Wu Z., Autry A.E., Bergan J.F., Watabe-Uchida M., Dulac C.G. Galanin neurons in the medial preoptic area govern parental behaviour. Nature. 2014. 509 (7500): 325–330.
Young W.S., Li J., Wersinger S.R., Palkovits M. The vasopressin 1b receptor is prominent in the hippocampal area CA2 where it is unaffected by restraint stress or adrenalectomy. Neuroscience. 2006. 143 (4): 1031–1039.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


