Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 4, стр. 413-436
Развивающийся мозг как мишень экспериментального воздействия при моделировании патологических процессов
Н. Б. Панкова 1, *, А. В. Латанов 2
1 Федеральное государственное бюджетное научное учреждение
“Научно-исследовательский институт общей патологии и патофизиологии”,
лаборатория физико-химической и экологической патофизиологии
Москва, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”, кафедра высшей нервной деятельности
Москва, Россия
* E-mail: nbpankova@gmail.com
Поступила в редакцию 17.04.2018
После доработки 27.09.2018
Принята к публикации 20.11.2018
Аннотация
В обзоре рассмотрены подходы к моделированию нарушений функций мозга, оцениваемых во взрослом состоянии, методом направленного воздействия в перинатальный период. Рассмотрены модели нервно-психических расстройств, связанных с нарушением динамики развития головного мозга, и модели заболеваний, характерных для зрелого возраста. Показано, что фармакологическое воздействие на развивающийся мозг индуцирует отсроченные поведенческие сдвиги, противоположные тем, которые вызывают используемые препараты при их введении взрослым животным (например, развитие депрессивного состояния при перинатальном введении антидепрессантов). Рассматривается история создания таких экспериментальных моделей и их возможные патофизиологические механизмы. Показана значимость подобных научных изысканий для практического здравоохранения.
Современная патологическая физиология широко использует методы работы in vitro, включая миниатюрные процессы микрофлюидики [Мыльникова и др., 2017]. Однако моделирование патологических состояний на животных является основным методом в изучении системных процессов, в частности, лежащих в основе нервно-психических заболеваний.
В отношении болезней нервной системы (разделы G00-G09 по Международной классификации болезней МКБ-10) патологическая физиология применяет подход, традиционный для соматических заболеваний – моделирование на основе этиологии и патогенеза с оценкой объективных проявлений патологических процессов в нервной ткани. При этом соблюдаются основные принципы моделирования:
− модель и заболевание имеют общие патогенетические механизмы;
− модель обеспечивает проявление клинических признаков заболевания;
− в модельной ситуации “заболевание” может быть купировано стандартными клиническими методами.
Сложнее с моделированием патологии психики (раздел F00–F99 по Международной классификации болезней МКБ-10): на сегодняшний день существует общепринятое мнение, что психопатология – исключительно человеческое свойство. Это отражено в формулировке ВОЗ [http://www.who.int/topics/mental_health/ru/]: “Психическое здоровье – это состояние благополучия, в котором человек реализует свои способности, может противостоять обычным жизненным стрессам, продуктивно работать и вносить вклад в свое сообщество. В этом позитивном смысле психическое здоровье является основой благополучия человека и эффективного функционирования сообщества”. Соответственно, основные методы диагностики в психиатрии – это клиническое наблюдение и беседа, что в принципе невозможно при работе с животными.
Однако существует и биологическая психиатрия – раздел науки, использующий биологический подход, целью которого является изучение биологических причин и механизмов развития (этиологии и патогенеза) психических расстройств, а также биологические методы их лечения и коррекции. Биологическая психиатрия основана на классических подходах патологической физиологии, постулирующих, что модель является аналогом болезни человека. Патофизиологические подходы к моделированию психических заболеваний основаны на этиологии (генетические модели, экспериментальные поведенческие модели) и на известных патогенетических механизмах (экспериментальные фармакологические модели). В качестве признаков развития у животного состояния, близкого или аналогичного психическому заболеванию человека, используют поведенческие, нейрохимические и электрофизиологические проявления. При этом выбор способа моделирования может быть использован для более глубокого изучения этиологии и патогенеза заболеваний человека.
В этом контексте особый интерес представляет изучение возможности отсроченного влияния на функциональное состояние головного мозга у взрослых животных методом направленного воздействия на него в раннем онтогенезе, включая пренатальную стадию.
РАЗВИТИЕ ГОЛОВНОГО МОЗГА В ОНТОГЕНЕЗЕ
Появившиеся в последние десятилетия новые методы исследований и визуализации позволили расширить понимание известных закономерностей развития головного мозга человека: периодизацию, гетерохронность, гетеродинамность, адаптивность, наличие критических и сенситивных периодов [Сонькин, 2003; Gale et al., 2004; Tau, Peterson, 2010]. Доказано, что хотя пролиферация и миграция нервных клеток завершаются в основном в пренатальный период (за исключением зубчатой извилины и субвентрикулярной зоны), постнатальные процессы также играют весьма существенную роль в развитии мозга [Stiles, Jernigan, 2010]. Важна динамика формирования контактов между нервными структурами и миелинизации нервных волокон [Gogtay et al., 2004; Tau, Peterson, 2010], результатом чего является формирование вертикальных (от спинного мозга и стволовых образований головного мозга, обеспечивающих жизненно важные функции, к коре больших полушарий) и горизонтальных (от проекционных отделов, включающихся в обеспечение элементарных контактов с внешним миром уже с момента рождения, к ассоциативным, ответственным за сложные формы психической деятельности) функциональных систем, реализующих работу собственно головного мозга и нервное управление остальным организмом. Важны факторы окружающей среды, оказывающие модулирующее влияние на развитие и функциональное созревание мозга ребенка [Gluckman, Hanson, 2007; Stiles, Jernigan, 2010; Zhang, Meaney, 2010; Ismail et al., 2017]. Использование метода МРТ позволило показать, что морфологические изменения в головном мозге человека продолжаются и в подростковом периоде – в виде утончения коры головного мозга, особенно в теменной коре [Tamnes et al., 2017]. Именно в этот критический период наиболее часто дебютируют психические расстройства, не связанные с нарушениями динамики онтогенеза [Paus et al., 2008].
Новые направления научных изысканий последних десятилетий (функциональная геномика, эпигеномика, транскриптомика и др.) рассматривают процесс развития и созревания головного мозга как многоуровневую систему регуляции экспрессии генов [Parikshak et al., 2015]. Уровни экспрессии генов сильно варьируют в зависимости от стадии развития или старения, областей мозга и типов клеток. При этом как молекулярный, так и фенотипический уровни экспрессии могут быть модифицированы под влиянием разных факторов – генетических, эпигенетических, фармакологических. В последние годы большое внимание уделяется факторам эпигенетическим – изменяющим состояние хроматина и тем самым оказывающим влияние на экспрессию генов, но не затрагивающих собственно генетический материал ДНК [Bale, 2015; Tran, 2017]. Основными видами эпигенетических влияний на сегодняшний день считают метилирование ДНК, модификацию гистоновых белков, ремоделирование генома и экспрессию генов микроРНК [Weber-Stadlbauer, 2017].
МОРФОЛОГИЧЕСКИЕ ДАННЫЕ ОБ ОНТОГЕНЕТИЧЕСКОМ РАЗВИТИИ МОЗГА ГРЫЗУНОВ
Развитие головного мозга грызунов, которых чаще всего используют для моделирования патологии нервной системы человека, в принципе подчиняется тем же закономерностям, что и у человека, хотя и проходит в гораздо более сжатые сроки. В обобщенном виде основные временные рамки онтогенеза мозга крыс представлены в обзоре D. Rice и S. Barone [Rice, Barone, 2000]. Так, у крыс основные изменения массы головного мозга проходят в первые 20 дней постнатального развития. Однако нейрогенез в каждой структуре имеет свои особенности по количественным и временным параметрам: раньше всего этот процесс завершается в структурах спинного и продолговатого мозга – к 17-му дню эмбриогенеза, к 19–20-му дню нейрогенез завершается в таламусе, энторинальной и пириформной коре, а также полях СА1 и СА3 гиппокампа, к моменту рождения – в миндалине и неокортексе, а после рождения продолжается в зубчатой извилине и в мозжечке. Процесс созревания синапсов (по морфометрическим данным) продолжается в течение трех недель постнатального развития. Пролиферативные процессы у олигодендроцитов и миелинизация нервных волокон, как в мозге, так и на периферии у крыс длится не менее месяца, т.е. как и у человека захватывает подростковый период. Соответственно, в ранний постнатальный период у этих животных происходит постепенное появление разных форм поведения и способности выполнять разные задачи: торможение частичного подкрепления – с 12–14 дней, избегание аверсивных обонятельных стимулов – с 18 дней, обучение в водном лабиринте Морриса – с 21–23 дней, отсроченное чередование – с 21–27 дней, пространственная навигация – с 22–25 дней, выработка условных рефлексов с отрицательным подкреплением (на основе страха) – с 25 дней, привыкание к новизне – с 25–30 дней, выработка реакции пассивного избегания – с 25–30 дней, пространственное чередование – с 27–30 дней, латентное торможение – с 32 дней [Rice, Barone, 2000].
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ КОРРЕЛЯТЫ ОНТОГЕНЕТИЧЕСКИХ ИЗМЕНЕНИЙ В МОЗГЕ ГРЫЗУНОВ
Динамику онтогенетического развития и созревания структур головного мозга можно проследить не только в морфологических исследованиях и по поведенческим тестам, но и по электрофизиологическим показателям [McHail, Dumas, 2015]. Так, достаточно давно было описано, что окончательное становление общей электрической активности гиппокампа завершается лишь к концу третьей недели жизни крыс [Leblanc, Bland 1979; Воронин и др., 1982]. В те же годы появились исследования, показавшие, что синапсы мшистых волокон гиппокампа крыс начинают приобретать взрослые характеристики с седьмого дня, а к 15-му дню в поле СА3 регистрируется фокальный потенциал с дефинитивными параметрами [Bliss et al., 1974]. Свойства кратковременной пластичности гиппокампа кроликов достигают окончательных параметров не ранее 25 дней после рождения [Крючкова, 1980; 1983], у крыс – примерно в те же сроки [Зубова и др., 1989]. Оказалось, что позже всех в гиппокампе созревает система возвратного торможения – к месячному возрасту у крысят [Swann et al., 1989] и к 10–12 дню у мышат [Фёдоров, 1990]. При этом последствия электролитического [Семёнова, 1986] или иммунологического [Зубова, Окнина, 1988] разрушения гиппокампа крыс до этого срока вызывает поведенческие нарушения, противоположные последствиям гиппокампэктомии у взрослых животных.
Дальнейшие исследования показали важную роль онтогенетического развития глутаматных рецепторов. Так, в 2010 г. в работе L. Volk [Volk et al., 2010] на генетической модели недостаточности модуляции глутаматных АМПА-рецепторов в системе коллатералей Шаффера было показано, что потеря PICK1 (протеин, взаимодействующий с C-киназой 1) не оказывает существенного влияния на синаптическую пластичность у новорожденных мышей, но ухудшает некоторые формы долговременной потенциации и различные формы долговременной депрессии у взрослых мышей. В работе M.G. Blair [Blair et al., 2013], посвященной изучению постнатального онтогенеза глутаматных АМПА-рецепторов гиппокампа методом регистрации популяционных ответов, показано, что гиппокамп крыс “включается” в конце третьей постнатальной недели жизни. Основой для этого процесса, по мнению авторов, служат сдвиг в составе АМПА-рецепторов (появление GluA3) и усиление их ассоциации с белковыми комплексами.
КРИТИЧЕСКИЕ И СЕНСИТИВНЫЕ ПЕРИОДЫ В РАЗВИТИИ ГОЛОВНОГО МОЗГА ГРЫЗУНОВ
Для грызунов, как и для человека, в онтогенетическом развитии характерно наличие критических и сенситивных периодов. Так, момент рождения переводит энергообеспечение головного мозга с анаэробного гликолитического пути на аэробный путь с использованием более эффективных реакций окислительного фосфорилирования [Surin et al., 2013]. Это одна из причин, почему рождение является важнейшим критическим периодом. Недостаточность энергообеспечения может быть причиной нарушения развития головного мозга [Grantham-McGregor, Baker-Henningham, 2005].
Часть критических периодов связана с изменением функционирования нейромедиаторных систем. В контексте моделирования нервно-психических заболеваний наибольший интерес представляет динамика онтогенеза систем серотонина (5-НТ) и дофамина (ДА) у грызунов, обобщенная в обзоре D. Suri и соавт. [Suri et al., 2015]. Известно, что первые 5-НТ-нейроны появляются на 12-й день беременности, и на следующий день гестации уже начинают выделять нейромедиатор. Максимальное количество 5-HT синтезируется в мозге новорожденных в течение первой постнатальной недели, после чего уровень секреции снижается, достигая взрослых величин к 15-му дню постнатального онтогенеза. У крыс и мышей пресинаптические компоненты рецепторов к 5-НТ появляются на 12-й день эмбриогенеза, а их функциональное созревание длится до 21-го постнатального дня. Важно, что рецепторы к 5-НТ появляются до того, как 5-НТ-афференты достигнут своих целей, что позволяет им воспринимать информацию от плаценты [Suri et al., 2015].
Гораздо дольше у грызунов идет созревание ДАергической системы. Первые ДАергические нейроны появляются в среднем мозге на 12–15-й дни эмбиогенеза. Первые рецепторы к ДА экспрессируются на 14-й день гестации у крыс и на 12-й день у мышей, однако их способность связывать нейромедиатор возрастает в течение 28–40 дней постнатального развития, после чего снижается и достигает стабильных уровней в возрасте около двух месяцев [Suri et al., 2015].
Столь длительные сроки пре- и постнатального созревания моноаминергических нейромедиаторных систем предполагают их программирующее и модулирующее участие в динамике развития головного мозга и в том числе возможность изменения такой динамики вследствие изменения концентрации нейромедиаторов. Показано, что воздействие на 5-НТергическую систему в пренатальный период вызывает неоднозначные поведенческие сдвиги, которые зависят от генетического фона, вида фармакологического воздействия на беременную самку, и от среды, в которой проходит постнатальное развитие потомства [Oberlander, 2012]. Воздействие на моноаминергические нейромедиаторные системы в постнатальный период вызывает более определенные последствия, которые можно объединить в 3 группы [Suri et al., 2015]:
− Любая манипуляция, которая повышает эффективность 5-НТергической системы в раннем онтогенезе (у мышей – с рождения до четвертого дня жизни), ухудшает соматосенсорное созревание коры и зрительной системы.
− Любая манипуляция, которая повышает эффективность 5-НТергической системы в ранний постнатальный период (у мышей – со 2-го до 11-го дня жизни), усиливает поведенческие проявления тревоги и депрессии при снижении познавательных способностей у взрослых животных.
− Любая манипуляция, которая повышает эффективность ДАергической системы в подростковом возрасте (у мышей – с 22-го до 41-го дня жизни), увеличивает агрессивность и реактивность взрослых животных, тогда как повышение эффективности 5-НТергической системы в тот же период приводит к противоположным результатам [Suri et al., 2015].
Соответственно, любое генетическое, экологическое или фармакологическое воздействие на нейромедиаторные системы в критические и сенситивные периоды раннего постнатального развития будет влиять на развитие сенсорных систем и поведение животных во взрослом состоянии [Lovic et al., 2013; Suri et al., 2015; Green et al., 2017]. Основой таких изменений являются механизмы нейронной пластичности [Ismail et al., 2017].
ОБЩИЕ ПРИНЦИПЫ МОДЕЛИРОВАНИЯ ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ ПРИ ВОЗДЕЙСТВИИ НА РАЗВИВАЮЩИЙСЯ МОЗГ
Условно исследования в этой области можно разделить на 1) моделирование заболеваний, связанных с нарушением развития нервной системы (Neurodevelopmental Disorders), и 2) использование психоактивных фармакологических препаратов для моделирования нервно-психических расстройств, больше характерных для зрелого мозга.
Согласно Международной классификации болезней МКБ-10 и Диагностическому и статистическому руководству по психическим расстройствам DSM-5 [Harris, 2014; Parikshak et al., 2015] к заболеваниям, обусловленным нарушениями нормальной динамики развития нервной системы, относят интеллектуальные расстройства и нарушения коммуникативности, расстройства аутического спектра (РАС), синдром дефицита внимания с гиперактивностью (СДВГ), проблемы с обучением, двигательные нарушения (включая тики), эпилепсию и шизофрению. Когортные медицинские наблюдения показывают, что в этиологии этих заболеваний преобладают (до 50%) средовые факторы [Brown, 2011; Hadjkacem et al., 2016; Karam et al., 2016; Mulligan et al., 2013; Saez et al., 2018; Steer et al., 2014], хотя также велика (20–25%) и доля генетических факторов [Al-Mamari et al., 2015; Karam et al., 2015; Parikshak et al., 2015]. Для моделирования таких заболеваний используют разнообразные методы изменения динамики развития нервной системы: химические вещества, фармакологические препараты, нейроиммунизацию, дистрессовые воздействия на беременных самок и на детенышей.
Ко второй группе относятся модели различных форм депрессивных и тревожных расстройств, основанные на химическом или фармакологическом воздействии на определенные локусы нейромедиаторных систем [Ainsworth et al., 2015; Beyer, Freund, 2017].
Патогенетические механизмы обоих вариантов моделирования, помимо специфических черт, включают и общие моменты: эпигенетические влияния [Nestler et al., 2016; Ricq et al., 2016; Richetto et al., 2017], нарушения иммунитета и наличие химических факторов воспаления [Клюшник и др., 2016; Meehan et al., 2016; Ronovsky et al., 2016; Arad et al., 2017], эндокринные нарушения [Kanungo et al., 2013; Dirven et al., 2017; Moog et al., 2017] (рис. 1(а)). В свою очередь, общность патогенетических механизмов часто приводит к коморбидности различных форм патологии, наблюдаемых в клинике: депрессии и тревоги [Zheng et al., 2016; Шавловская, Кузнецов, 2018], шизофрении и депрессии и [Pješčić et al., 2014; Смулевич и др., 2015; Belvederi et al., 2015; Kucerova et al., 2015], СДВГ и депрессии [Meinzer et al., 2014; Худина, Дмитриев, 2017], РАС и депрессии [Gotham et al., 2015], РАС, эпилепсии и СДВГ [Альбицкая и др., 2016], эпилепсии и нервно-психических расстройств [Котов, 2013; Ридер и др., 2016; Mazarati et al., 2017] (рис. 1 (б)).
Рис. 1.
Схемы, иллюстрирующие полиэтиологичность (а) и наличие общих патогенетических механизмов (б) у психических заболеваний.
Fig. 1. Illustrative diagrams for the polyetiology (a) and for the common pathogenetic mechanisms (б) in mental disorders.
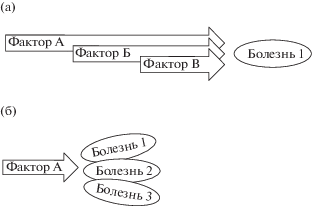
Соответственно, использование в моделировании нарушений работы мозга методов воздействия на общие патогенетические механизмы также приводит к одновременному появлению поведенческих проявлений, характерных для разных форм патологии.
МОДЕЛИ ИЗМЕНЕНИЙ ВОЗРАСТНОЙ ДИНАМИКИ РАЗВИТИЯ НЕРВНОЙ СИСТЕМЫ. ПОСЛЕДСТВИЯ РАННЕЙ НЕЙРОИММУНИЗАЦИИ
Наличие гистогематических барьеров создает предпосылки к использованию “забарьерных” антигенов для целенаправленного иммунологического воздействия на органы, изолированные в зрелом возрасте от иммунной системы. В частности, для нейроиммунизации используют мозгоспецифические антигены – белки S100 и 14-3-2, конъюгированные с белком нейромедиаторы (которые сами по себе являются гаптенами), а также другие антигены, специфичные для нервной ткани [Крыжановский, 2002]. Возможность целенаправленного воздействия на развивающийся мозг обоснована данными о повышении проницаемости гемато-энцефалического барьера и нарушении функций головного мозга у потомства нейроиммунизированных крыс [Трекова и др., 1979].
Использование такого метода показало, что иммунизация взрослых крыс и крысят в возрасте 5–12 дней цитозольными белками гиппокампа и неокортекса приводит к иммунологическому “выключению” структур мозга с соответствующими поведенческими [Зубова, Окнина, 1988] и электрофизиологическими [Зубова и др., 1989] проявлениями. Иммунизация беременных самок мышей основным белком миелина вызывает задержку физического развития мышат и нарушает их способность к обучению [Морозов и др., 2007]. Аналогичные последствия зафиксированы при иммунизации беременных самок мышей фактором роста нервов [Морозов и др., 2011], причем с одновременным нарушением у потомства коммуникативного поведения [Родионов и др., 2012].
ПОСЛЕДСТВИЯ ИЗМЕНЕНИЯ ИММУННОГО СТАТУСА БЕРЕМЕННЫХ САМОК И ДЕТЕНЫШЕЙ В РАННИЙ ПОСТНАТАЛЬНЫЙ ПЕРИОД
Известно, что вирусные инфекции матери во время беременности могут стать причиной развития у потомства РАС [Atladóttir et al., 2012] и шизофрении [Patterson, 2009]. Клинические данные свидетельствуют также об активации как врожденного, так и приобретенного иммунитета у детей, страдающих РАС [Клюшник и др., 2012], и о вовлеченности нарушений иммунной системы в патогенез психоэмоционального стресса [Кудрявцева и др., 2017]. Эти феномены являются основой для другого пути воздействия на развивающийся мозг – изменения иммунного статуса беременной самки или непосредственно детенышей в первые дни постнатального онтогенеза [Harvey, Boksa, 2012; Meyer, Feldon, 2012]. Для этой цели используют как вирусные агенты, так и искусственные иммуногены, например, полиинозиновую-полицитидиловую кислоту (Poly IC) – синтетический аналог двухцепочечной РНК, ассоциируемой с вирусной инфекцией. Кроме того, возможно применение цитокинов – гормоноподобных медиаторов межклеточного взаимодействия в иммунной системе [Harvey, Boksa, 2012].
Подход эффективен в моделировании шизофрении [Meehan et al., 2017], РАС [Fernández de Cossío et al., 2017], депрессии [Arad et al., 2017; Ronovsky et al., 2017], эпилепсии и болезни Паркинсона [Harvey, Boksa, 2012].
Возможными патофизиологическими механизмами влияния нейроиммунизации на возрастную динамику развития нервной системы считают непосредственное воздействие на медиаторные системы, а также их эпигенетическую модификацию.
Так, показано, что введение крысам Poly IC не оказывает влияния на показатели тревожности и способность к обучению, но усиливает ДА-опосредуемую гиперактивность, и, наоборот, снижает глутамат-опосредуемую гиперактивность [Vorhees et al., 2015], а также ускоряет оборот ДА и снижает связывание ДА с рецепторами типа D2 (но не D1) в стриатуме [Ozawa et al., 2006]. Однако полученный эффект характерен только для потомства самок, чувствительных к воздействию и отвечающих на иммуностимуляцию снижением массы тела [Missault et al., 2014]. Иммунизация беременных самок мышей Poly IC приводила к развитию у потомства агедонии, характерной для депрессивных состояний [Reisinger et al., 2016]. На молекулярном уровне у мышат выявлено повышение уровня ацетилирования гистоновых белков гиппокампа (при снижении количественных показателей деацетилазы гистонов) и повышение уровня экспрессии внутриклеточных транспортеров 5-НТ, что играет важную роль в патогенезе депрессии. Эти данные были интерпретированы авторами как эпигенетическая модуляция [Reisinger et al., 2016].
Аналогичное воздействие на беременных самок мышей приводило к изменению у потомства во взрослом состоянии уровня метилирования ДНК в префронтальной коре – в генных локусах, связанных с регуляцией синтеза ГАМК (Dlx1, Lhx5, Lhx8), в локусах сигнального пути Wnt, регулирующего эмбриогенез и дифференцировку клеток (Wnt3, Wnt8a, Wnt7b), и в локусах развития нервной ткани (Efnb3, Mid1, Nlgn1, Nrxn2) [Richetto et al., 2017].
Метилирование ДНК, наряду с модификацией гистоновых белков, ремоделированием генома и экспрессией генов микроРНК входит в число основных путей эпигенетической модификации [Weber-Stadlbauer, 2017]. Как показывают когортные медицинские исследования, “нормальность” протекания таких процессов особенно важна для правильной последовательности и стадийности функционального развития и созревания в антенатальный период головного мозга [Lillycrop et al., 2015] и всего организма в целом [Eriksson, 2007)]. Экспериментальное же воздействие на иммунную систему беременных самок приводит к стойким изменениям эпигенома потомства, создавая основу для трансгенерационных изменений в поведении [Weber-Stadlbauer et al., 2017], хотя конкретные механизмы таких преобразований (с участием цитокинов, фолиевой кислоты или микробиома) пока не выходят за рамки гипотез [Weber-Stadlbauer, 2017].
Наличие эпигенетических механизмов в реализации последствий изменения иммунного статуса беременных самок по крайней мере частично объясняет широкий спектр клинических последствий такого вмешательства. В эксперименте же описываемые результаты, по-видимому, ограничиваются выбранными авторами методами оценки поведенческих и биохимических показателей (в соответствии с целями проводимых исследований). Хотя более широкий набор используемых методов позволил показать, что по крайней мере часть моделей обладает половой избирательностью. Так, введение кормящим самкам (на четвертый день после родов) Poly IC приводила к изменениям у них содержания цитокинов в крови и мозге, и появлению у потомков-самцов поведенческих признаков шизофрении (постоянное латентное торможение и проблемы с переучиванием на фоне недостаточности ДА), а у потомков-самок – поведенческих признаков депрессии (возрастание времени неподвижности в тесте принудительного плавания и сахарозной агедонии на фоне избытка ДА) [Arad et al., 2017]. Иммунизация самок мышей бактериальным липополисахаридом привела к РАС-подобным изменениям в поведении только потомков-самцов на фоне возрастания числа шипиков на дендритах нейронов зубчатой извилины и снижению экспрессии в гиппокампе микроглиальных рецепторов CX3CR1 [Fernández de Cossío et al., 2017].
ПОСЛЕДСТВИЯ ДИСТРЕССОВЫХ ВОЗДЕЙСТВИЙ НА БЕРЕМЕННЫХ САМОК И ДЕТЕНЫШЕЙ
Стрессирующее воздействие экстремальной или субэкстремальной силы и/или длительности (дистресс) на мать во время беременности, как правило, сопровождающееся аффективными нарушениями, оказывает выраженное негативное воздействие на развитие потомства – как у людей, так и у животных [Talge et al., 2007; Chen, Baram, 2016]. Последствиями такого воздействия являются сдвиги в динамике развития нервной системы, когнитивные нарушения, морфологические изменения в миндалине и префронтальной коре, изменения в работе гипоталамо-гипофизарно-адреналовой оси и систем автономной регуляции [Van den Bergh et al., 2017]. Морфологические микро- и макроизменения в ряде структур головного мозга человека, грызунов и приматов (в гиппокампе, миндалине, мозолистом теле, передней комиссуре, коре головного мозга, мозжечке и гипоталамусе), обусловленные перинатальным стрессом, обобщены в обзоре A. Charil и соавт. [Charil et al., 2010]: в разных экспериментальных моделях описаны уменьшение объема структур, сокращение числа клеток и шипиков на дендритах, нарушение нейрогенеза, функциональные нарушения в виде изменений специфических форм поведения.
Одним из наиболее распространенных дистрессовых воздействий на развивающийся организм является курение матери. Клинические наблюдения свидетельствуют о негативном влиянии такого образа жизни беременной женщины на массу тела ребенка при рождении и функциональные возможности его мозга в последующей жизни [Küpers et al., 2015; Кельмансон, 2017]. Впрочем, как и употребление беременными женщинами алкоголя [Varadinova, Boyadjieva, 2015]. Использование современных исследовательских технологий в клинике позволило доказать эпигенетический характер влияний курения матери на здоровье ребенка [Küpers et al., 2015; Кельмансон, 2017]. В связи с широким распространением “рекреационного наркотика” “Экстази” (препарат амфетаминового ряда 3,4-метилендиоксиметамфетамин – МДМА) проведено изучение его влияния на взрослых и при перинатальном использовании беременными женщинами. Выявлено, что употребление вещества вызывает истощение 5-НТергической системы головного мозга [McCann et al., 2000], которое закономерно приводит к развитию когнитивных дефицитов, изменениям структуры сна и нейроэндокринной регуляции, и может быть визуализировано методами фармакологической МРТ [Schouw et al., 2012].
В эксперименте на мышах доказано, что физический стресс в виде вдыхания сигаретного дыма беременными самками приводит к патологическим изменениям в поведении их потомства: повышение до субнормального уровня тревожности в новой ситуации, нарушения пространственного обучения и референтной памяти, не изменяя при этом показателей в тестах оценки страха или депрессии [Amos-Kroohs et al., 2013]. В эксперименте на взрослых крысах также описаны последствия применения МДМА в виде нарушения процессов пространственного обучения и памяти [Able et al., 2006]. Неонатальное применение МДМА приводит к снижению массы тела детенышей, повышению уровня кортикостерона и мозгового нейротрофического фактора (BDNF) при снижении в их мозге содержания 5-НТ. Причем такое снижение содержания нейромедиатора первоначально компенсируется, но во взрослом состоянии вновь появляется [Skelton et al., 2008]. При раннем постнатальном применении (11–20 дни жизни) МДМА оказывает выраженное и длительное действие на развивающийся мозг. Установлено, что у таких животных во взрослом состоянии нарушаются терморегуляция и когнитивные процессы [Cohen et al., 2005].
В экспериментах с МДМА также было выявлено, что для целенаправленного воздействия на развивающийся мозг есть свои “окна” – возрастные периоды раннего постнатального онтогенеза, когда наблюдаются наиболее выраженные изменения в поведении животных в последующем [Skelton et al., 2012]. Так, для крыс линии Sprague-Dawley снижение локомоторной активности наблюдалось при введении МДМА с 6-го по 15-й дни жизни, изменения акустической стартл-реакции и снижение индуцированной МК-801 гиперактивации – при введении в первые 10 дней, наиболее выраженный и длительный когнитивый дефицит – при введении МДМА с 11-го по 20-й дни жизни. Сроки совпадают с критическими периодами раннего онтогенеза для индукции поведенческих нарушений у грызунов при воздействии на 5-НТергическую систему [Suri et al., 2015].
Важно, что потенциально опасными для развития мозга являются как физический, так и специфический для человека психосоциальный стресс. Потомство матерей, переживших психосоциальный стресс во время беременности, отличается замедленным созреванием плода, нарушениями в эмоциональной и когнитивной сфере после рождения, а также уменьшенным объемом областей мозга, ассоциированных со способностью к обучению у 6–8-летних детей [Sandman et al., 2012]. О наличии такого стресса у матерей судят по уровню гормонов стресса, а также по наличию признаков тревожности и депрессии. В клинике показано, что высокая тревожность матери в антенатальный период коррелирует с нарушениями у новорожденных эмоционального состояния и регуляции внимания [Chong et al., 2016]. Есть данные о связи некоторых гаплотипов гена катехол-O-метилтрансферазы (фермента, участвующего в метаболизме моноаминов) с наличием корреляции антенатальной тревожности матери и толщиной теменной коры у потомства [Qiu et al., 2015b].
Модель гестационного стресса широко используется для имитации у потомства депрессивных и тревожных расстройств [Zheng et al., 2016]. Вариантом такого подхода является моделирование депрессивного состояния у беременных самок. В клинике методом МРТ выявлены морфологические изменения структур головного мозга у потомства женщин, страдавших во время беременности от депрессии. Так, у новорожденных есть тенденция к изменениям объемов правого гиппокампа и миндалины, а также толщины неокортекса [Wang et al., 2018]. У детей в возрасте 6–14 дней выявлены изменения в правой миндалине [Rifkin-Graboi et al., 2013]. У детей в возрасте 6 мес методом функциональной МРТ выявлено возрастание количественных показателей связей левой миндалины со структурами лимбической системы, что характерно для большой депрессии у подростков и взрослых [Qiu et al., 2015a]. У потомства в возрасте 4–5 лет также выявлены изменения в правой миндалине, причем в большей мере – у девочек [Wen et al., 2017], и сниженные показатели толщины неокортекса [Lebel et al., 2016].
Причиной столь высокой чувствительности организма плода и ребенка к стрессорным ситуациям считаются индуцированные глюкокортикоидами эндокринные изменения, которые программируют онтогенез [Talge et al., 2007; O’Donnell et al., 2009; Buschdorf, Meaney, 2015]. Для случая с гестационной депрессией это подтверждено клиническими данными: у женщин, страдающих во время беременности от депрессии, присутствуют нарушения экспрессии гена FKBP5 [Wang et al., 2018], регулирующего чувствительность глюкокортикоидного рецептора [Binder, 2009]. Такие сдвиги могут быть временными или сохраняться в постнатальной жизни с последствиями для роста и развития тканей как до, так и после рождения [Fowden, Forhead, 2004].
Известно, что глюкокортикоиды являются важным переключателем развития, приводящим к изменениям в регуляции генов, которые необходимы для нормального роста и созревания. Эффекты программирования, опосредованного глюкокортикоидами, очевидны в последующих поколениях, и передача этих изменений может происходить как по материнской, так и по отцовской линии [Moisiadis, Matthews, 2014a]. Искусственное повышение уровня глюкокортикоидов в организме матери или последствия лечения синтетическими глюкокортикоидами могут привести к долгосрочному “перепрограммированию” функций гипоталамо-гипофизарно-надпочечниковой оси и поведения потомства по эпигенетическим механизмам (через метилирование ДНК, ацетилирование гистонов, экспрессию микроРНК, влияние на экспрессию генов) [Moisiadis, Matthews, 2014b; Григорьян, Гуляева, 2015]. Такие влияния по крайней мере частично могут отвечать за трансгенерационные эффекты антенатального воздействия глюкокортикоидов на неврологическую, сердечно-сосудистую и метаболическую функции [Eriksson, 2007; Moisiadis, Matthews, 2014b].
Ключевую роль в опосредовании эффектов воздействия глюкокортикоидов на развитие оси гипоталамуса-гипофизарно-надпочечниковой оси плода и долгосрочный риск заболевания играет плацента [O’Donnell et al., 2009; Braun et al., 2013]. Более 20 лет назад было показано, что плацентарный барьер защищает плод от высоких уровней глюкокортикоидов у матери с участием 11β-гидроксистероиддегидрогеназы, которая превращает активные глюкокортикоиды в неактивные продукты. Однако клинические данные свидетельствуют о том, что высокий уровень циркулирующего материнского кортизола во время беременности отрицательно коррелирует с весом при рождении, что указывает на то, что избыточные глюкокортикоиды могут обходить плацентарный барьер. Причиной функциональной недостаточности плацентарных ферментов могут быть стресс матери, ее недоедание и болезни. Важно отметить, что проводимые в последние годы исследования на людях показывают связь высокого уровня кортизола у матери во время беременности с запрограммированными результатами у потомства в детском возрасте, включая повышенное артериальное давление, поведенческие расстройства, а также изменения структуры мозга, выявляемые новыми методами визуализации [Reynolds, 2013].
Экспериментальным доказательством принципиальной возможности постнатальной эпигенетической модуляции стресс-индуцируемого поведения можно считать данные T.Y. Zhang [Zhang et al., 2013] о различиях в экспрессии генов рецепторов глюкокортикоидов в гиппокампе животных, родившихся от матерей с разным паттерном родительского поведения (разной частотой вылизывания и груминга детенышей).
Еще одним патогенетическим механизмом изменения под действием дистресса динамики развития мозга является дисфункция гипоталамо-гипофизарно-тиреоидной оси, также оказывающей программирующее влияние на развитие нервной системы [Moog et al., 2017]. Клинические данные свидетельствуют о том, что гестационный гипотиреоз, широко распространенный в большинстве стран, может быть причиной развития у потомства таких нарушений психики, как СДВГ и РАС [Andersen et al., 2014]. Предполагается, что в основе нарушений динамики развития мозга плода могут лежать вызванные гипотиреозом функциональные последствия – нарушения пролиферации, миграции и дифференциации нейронов (особенно – ГАМКергических нейронов неокортекса, гиппокампа и мозжечка), нарушения дифференции олигодендроцитов (и соответственно – миелинизации нервных волокон), снижение содержания моноаминов во всем мозге, нарушения свойств долговременной пластичности в гиппокампе [Moog et al., 2017].
Воздействие на тиреоидную эндокринную систему матери, как и в случае с глюкокортикоидами, может быть использовано для моделирования патологии не только мозга, но и других систем организма. Так, создание гипотиреоза у беременных самок путем добавления в питьевую воду блокатора образования тиреоидных гормонов 6-пропил-2-тиоурацила индуцирует у потомства к возрасту 10–12 нед исчезновение опосредуемого NO эндотелия антиконтрактильного эффекта [Gaynullina et al., 2017]. Хотя при этом уровни тиреоидных гормонов, тиреотпропина, метаболитов NO и артериального давления не изменялись.
Доказанное участие в опосредовании эффектов гестационного стресса на динамику и результат развития мозга потомства по крайней мере двух эндокринных осей предполагает, что у плодов и новорожденных развивается адаптивный ответ организма на условия жизни в виде репрограммирования эпигенома [Bale, 2015]. В процессе возможна также и роль окситоцина, который в норме оказывает противовоспалительное и нейропротективное действие [Zinni et al., 2018]. Конкретными эпигенетическими механизмами являются экспрессия регуляторных микроРНК, изменения метилирования разных участков ДНК, модификация гистоновых белков [Babenko et al., 2015].
ИСПОЛЬЗОВАНИЕ ХИМИЧЕСКИХ ВЕЩЕСТВ В МОДЕЛИРОВАНИИ РАС
В последние десятилетия наблюдается рост распространенности РАС, и к настоящему времени показатель достигает 1–1.5% детской выборки [Иваницкая и др., 2015]. Причиной этому может быть как появление новых методов клинической диагностики, так и нововведения в педиатрии, в частности, слишком плотный график детских прививок, нарушающий нейроиммунные отношения в перинатальный период [Визель, 2013]. Клинические данные свидетельствуют о корреляционной связи РАС с осложнениями в родовом периоде (стремительные роды, или, наоборот, затянутые), низким весом новорожденных и послеродовыми инфекциями дыхательных путей [Hadjkacem et al., 2016].
Полиэтиологичность группы заболеваний предполагает и множественность подходов для моделирования. В обзоре K.C. Kim и соавт. [Kim et al., 2016] рассматриваются модели, основанные на разрушении некоторых мозговых структур (миндалины, мозжечка, медиальной префронтальной коры), воздействие на беременных самок (инфицирование или введение вальпроевой кислоты), генетические модели (в отношении BDNF, 7-дегидростерол редуктазы, моноаминоксидазы (МАО) A, окситоцина, транспортера 5-НТ и ряда других белков и пептидов). Имеющиеся данные о связи аутизма с дефицитом в организме больных детей цинка [Bjorklund, 2013; Crăciun et al., 2016; Curtin et al., 2018], и соответственно нарушениями в цинк-зависимой экспрессии ряда генов также могут стать основой для создания нокаутных генетических моделей.
В моделях РАС с пренатальным введением химических веществ наибольшей популярностью пользуется вальпроевая кислота, блокирующая гистондеацетилазы, что модифицирует экспрессию многих генов [Малышев и др., 2015]. Результатом такого экспериментального вмешательства становятся нарушения поведения у животных, близкие к комплексу симптомов РАС у человека. Так, показано, что пренатальное введение (на 13-й день гестации) высокой дозы вальпроевой кислоты вызывает выраженные отклонения в поведении крысят на 36-й день их постнатального развития и негативно воздействует на формирование их внутривидовых реакций, что выражается в снижении социальных контактов, предпочтении несоциального объекта социальному, а также в нарушении локомоторного и ориентировочно-исследовательского поведения, пространственной памяти и повышенной тревожности [Капица и др., 2017]. Нарушенный поведенческий паттерн сохраняет свою значимость и на 56-й день жизни крысят (подростковый возраст), что проявляется в выраженном дефиците в тесте социального взаимодействия, гиперактивном поведении в знакомых условиях среды, в повышении уровня тревожности в приподнятом крестообразном лабиринте и в грубом нарушении врожденного оборонительного поведения в присутствии аверсивного страх-индуцированного запаха хищника в Y-образном лабиринте [Капица и др., 2018].
МОДЕЛИРОВАНИЕ ЗАБОЛЕВАНИЙ ВЗРОСЛОГО ВОЗРАСТА. ПРИНЦИПЫ МОДЕЛИРОВАНИЯ ДЕПРЕССИВНЫХ И ТРЕВОЖНЫХ РАССТРОЙСТВ
Моделирование депрессивных расстройств на животных как таковое имеет достаточно давнюю историю. В классическом обзоре P. Willner [Willner, 1984] рассмотрены уже 18 моделей, основанных на вмешательстве в работу моноаминергических систем мозга, и на провокации депрессивно-подобных форм поведения путем создания определенных средовых условий (дистресса), а также использование хронического мягкого стресса. В современных обзорах на эту тему сохранились нейрохимический подход (изменение содержания моноаминов) и использование средовых факторов [Малиновская и др., 2016; Beyer, Freund, 2017; Латанов и др., 2018], а также добавились модели по изменению материнского иммунного статуса – в таких моделях депрессивно-подобное поведение формируется у потомства, причем компенсация возможна только у второго поколения [Beyer, Freund, 2017]. Моделирование тревожности включает только использование различных средовых факторов – неприятных (и часто болезненных), дискомфортных, или неожиданных [Kumar et al., 2013].
Современные теории патогенеза депрессивных и тревожных расстройств, помимо обсуждения доказанной многолетними клиническими и экспериментальными данными роли различных нейромедиаторных систем, включают положение о том, что одной из причин развития форм патологии может быть нарушение нейрогенеза в гиппокампальной области [Miller, Hen, 2015]. Показано, что в клинике большой депрессии и при моделировании депрессии у взрослых людей и животных нарушается нейрогенез, в частности – в зубчатой извилине, одном из афферентных входов гиппокампа [Gandy et al., 2017]. Лечение же антидепрессантами, наоборот, ускоряет добавление в гиппокамп новых нейронов. Причем, как показано в эксперименте, нейрогенез усиливается только тогда, когда животные подвергаются стрессу [Miller, Hen, 2015]. Причиной такого усиления могут быть эпигенетические механизмы, регулирующие экспрессию генов, в том числе задействованных в реализации депрессивного состояния [Григорьян, Гуляева, 2015; Deussing, Jakovcevski, 2017]. Следовательно, различные стрессирующие воздействия являются значимыми для вероятности развития депрессии, реализуя свой эффект через эпигенетические механизмы (изменение экспрессии глюкокортикоидного рецептора, метилирование ДНК, ацетилирование гистоновых белков) [Deussing, Jakovcevski, 2017].
МОДЕЛИРОВАНИЕ ДЕПРЕССИИ МЕТОДОМ ФАРМАКОЛОГИЧЕСКОГО ВОЗДЕЙСТВИЯ НА РАЗВИВАЮЩИЙСЯ МОЗГ
Моделирование депрессии методом фармакологического воздействия на развивающийся мозг – объект, отличающийся по своим свойствам от мозга взрослых животных, – также имеет достаточно длительную историю. Первые упоминания о принципиальной возможности такого типа моделирования патологических процессов встречаются еще в 1982 г., в работах G. Vogel, и обобщены в его работе 1990 г. [Vogel et al., 1990]. Было показано, что введение новорожденным крысам трициклического антидепрессанта кломипрамина, блокирующего обратный захват 5-НТ, и норадреналина (НА), провоцирует у этих животных во взрослом состоянии формирование ряда поведенческих и электрофизиологических признаков депрессивного состояния. В частности, по тестам открытого поля, показателям агрессивного и сексуального поведения (ослабление сексуального, агрессивного поведения и реакции самостимуляции и усиление защитного поведения), а также по характерным перестройкам структуры сна – возрастанию представленности REM-сна [Vogel et al., 1988].
Аналогичные последствия были описаны и при введении новорожденным зимелидина (антидепрессант из группы ингибиторов обратного захвата 5-НТ – SSRIs), дезипрамина (антидепрессант, блокирующий обратный захват НА, ДА и 5-НТ, а также обладающий холинолитической и антигистаминной активностью), иприндола (атипичный трициклический антидепрессант с выраженной антигистаминной активностью) [Vogel, Hagle, 1996]. В работах других авторов было показано, что неонатальное введение крысятам кломипрамина увеличивает время иммобилизации в тесте принудительного плавания – классическом тесте для оценки степени сформированности депрессивного состояния у животных [Velazquez-Moctezuma, Diaz Ruiz, 1992]. Аналогичный эффект описан для селективного блокатора обратного захвата 5-НТ Lu 10-134-C [Hansen et al., 1997].
В недавних исследованиях также подтверждено, что перинатальное (самкам в период от шестого до 21-го дня беременности и детенышам от первого до 20-го дня после рождения) введение крысам антидепрессанта из группы SSRIs циталопрама приводит к нарушениям поведения во взрослом состоянии [Sprowles et al, 2016]: крысы, получавшие циталопрам, обучались хуже, чем контрольные в водном лабиринте Морриса и во время пробы без платформы, но не при реверсивном обучении, переключении или при сигнальном обучении в том же лабиринте; они проводили меньше времени в центре открытого поля, меньше времени плавали до состояния неподвижности в тесте “вынужденного плавания”, у них была усилена реакция акустического испуга, и оказалась снижена способность к зоо-социальному взаимодействию. Последнее, наряду с нарушениями способности к обучению, характерно для РАС. В последующих исследованиях лаборатории было показано, что аналогичные последствия вызывает перинатальное введение и других антидепрессантов – флуоксетина (также из группы SSRIs) и бупропиона – ингибитора обратного захвата НА [Sprowles et al., 2017].
Сходные результаты получены на мышах: показано, что однократное введение четырехнедельным мышатам антидепрессантов из группы SSRIs (кломипрамина, флувоксамина и пароксетина) приводит к развитию у них к возрасту 10 нед ряда депрессивно-подобных изменений в поведении, специфичных для каждого из препаратов [Yamada, 2016].
Работы по использованию в моделировании депрессии методом воздействия на развивающийся мозг других групп фармакологических препаратов, проводятся Н.А. Крупиной [Крупина и др., 2016]. В частности, изучены последствия хронического неонатального введения крысятам ингибиторов пролилэндопептидазы и дипептидилпептидазы-IV – ферментов, вовлеченных в патогенез аффективно-тревожных нарушений. Показано, что такие воздействия индуцируют у крыс уже во взрослом состоянии эмоционально-поведенческие расстройства, включая усиление депрессивности, тревожности и агрессии.
ПАРАДОКСАЛЬНЫЕ ЭФФЕКТЫ АНТИДЕПРЕССАНТОВ, ПРИМЕНЯЕМЫХ В АНТЕНАТАЛЬНОМ ПЕРИОДЕ, И ИХ ВОЗМОЖНЫЕ ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ
В работах G. Vogel впервые было показано, что воздействие антидепрессантов на развивающийся мозг приводит не к снижению выраженности депрессивного поведения, как это должно быть у взрослого животного, а к прямо противоположному результату – развитию депрессивного состояния, хотя и отсрочено. Современные исследования подтверждают этот факт на разных животных и с использованием разных антидепрессантов [Sprowles et al, 2016; Yamada, 2016].
Поскольку наиболее распространенными антидепрессантами, используемыми для воздействия на развивающийся мозг в моделировании депрессии во взрослом состоянии, являются препараты группы SSRIs, достаточно много работ посвящено поиску патогенетических механизмов феномена именно с участием 5-НТ. Так, в уже упомянутом обзоре А.М. Suri и соавт. [Suri et al., 2015] отдельно выделяется группа экспериментальных манипуляций, повышающих эффективность 5-НТергической системы в ранний постнатальный период, что усиливает поведенческие проявления тревоги и депрессии при снижении познавательных способностей у взрослых животных. В обзоре M.E. Glover и S.M. Clinton [Glover, Clinton, 2016] указывается, что наиболее вероятной мишенью таких влияний 5-НРергической системы являются функциональное развитие и созревание гиппокампа – ключевой структуры лимбической системы, регулирующей эмоциональное поведение, способность к коммуникациям и обучению, с нарушением нейрогенеза в этой структуре.
Изучение молекулярных механизмов пренатального воздействия антидепрессантов из группы SSRIs показало, что у потомства самок крыс, подвергшихся во время беременности воздействию препаратов в сочетании со стрессом, наблюдаются не только поведенческие признаки развития депрессивно-подобного состояния (по результатам теста принудительного плавания), но и снижается уровень экспрессии гиппокампального BDNF, причем оба результата оказались корелляционно связаны [Boulle et al., 2016]. Как известно, BDNF в целом мозге регулирует развитие, пластичность и выживание ДАергических, холинергических и 5-НТергических нейронов, а также участвует в регуляции глутаматергической и ГАМКергической передачи и широко экспрессируется во всем мозге млекопитающих [Zheleznyakova et al., 2016]. В клинике уровень метилирования ДНК-промоторов BDNF используется как биомеркер ряда нейропсихиатрических расстройств (большая депрессия, биполярное расстройство, тревожные расстройства, шизофрения, булимия, РАС) [Kundakovic et al., 2015]. Для клинических исследований важно, что уровни метилирования ДНК у конкретных промоторов BDNF коррелируют в различных тканях, например, в мозге и в периферической крови [Ikegame et al., 2013]. Считается, что полипептид играет одну из ключевых ролей в патогенезе депрессии, его содержание снижается в мозге больных и при моделировании депрессивного состояния у животных, и восстанавливается при лечении антидепрессантами [Гудашева и др., 2017]. Механизм действия BDNF во взрослом гиппокампе включает активацию 5-НТ передачи [Deltheil et al., 2008]. Участие в реализации антидепрессивных свойств различных препаратов модификации экспрессии генов могут объяснять, по крайней мере, частично, длительную задержку в проявлении антидепрессивной активности – до нескольких недель.
В развивающемся мозге снижение экспрессии гена BDNF в гиппокампе, в частности, вследствие перинатального введения метилртути (MeHg), вызывает постоянные изменения в обучении и мотивационном поведении у мышей [Onishchenko et al., 2008]. Изменения могут быть купированы уже у взрослых животных антидепрессантом из группы SSRIs флуоксетином.
Однако изменения экспрессии гена BDNF в гиппокампе могут быть вызваны не только перинатальным применением антидепрессантов, но и гестационным стрессом [Zheng et al., 2016].
Сравнительное изучение пренатального и постнатального введения животным ингибиторов обратного захвата моноаминов имипрамина, дезипрамина и хлоримипрамина, а также ингибиторов МАО показало, что выраженным действием обладает не острое, а субхронические введение этих препаратов [Drago et al., 1985]. Причем эффективными для индукции последующих поведенческих нарушений являются как пренатальные инъекции (10 дней беременности до родов), так и постнатальное введение (с первого по пятый дни жизни). Важно, что ни один из этих препаратов не нарушал в последующей взрослой жизни полового поведения, однако применение ингибиторов МАО было эффективным для подавления двигательной активности в открытом поле, но во всех случаях под влиянием препаратов происходило торможение выработки реакции активного избегания во взрослой жизни.
Эксперименты с созданием модели депрессии путем введения антидепрессанта кломипрамина новорожденным животным были дополнены изучением экспрессии гена циклооксигеназы (СОХ-2, фермент, участвующий в синтезе медиаторов воспаления) в мозге крыс [Cassano et al., 2006]. Обнаружено, что у подросших животных, подвергнутых такому воздействию неонатально, проявляются депрессивные симптомы поведения, а также уменьшается уровень BDNF, снижаются экспрессия гена СОХ-2 и содержание кодируемого им белка в гиппокампе. Как видно, связь между ключевым ферментом в синтезе простагландинов и биологическими и поведенческими депрессивными изменениями открывает интересную линию исследований молекулярных оснований депрессии и ее потенциального лечения с помощью иммуномодулирующих препаратов.
Следует отметить, что парадоксальные эффекты перинатального воздействия фармакологических препаратов наблюдаются не только в отношении антидепрессантов. Так, моделирование гестационного гипотиреоза при помощи тиамазола (аналога пропилтиоурацила) вызывает у потомства значимые изменения в сердечно-сосудистой системе: возрастание систолического и диастолического артериального давления, возрастание мощности диапазона низких частот LF в спектре вариабельности систолического артериального давления, что при неизменном уровне чувствительности спонтанного артериального барорефлекса может свидетельствовать об изменении автономного баланса в сторону усиления симпатических влияний [Santos et al., 2012]. Данные клинические признаки характерны для гиперфункции щитовидной железы.
КЛИНИЧЕСКИЕ ДАННЫЕ О СОСТОЯНИИ ДЕТЕЙ, РОДИВШИХСЯ ОТ МАТЕРЕЙ, ПРИНИМАВШИХ ВО ВРЕМЯ БЕРЕМЕННОСТИ ПСИХОАКТИВНЫЕ ПРЕПАРАТЫ
Как оказалось, отсроченный эффект приема фармакологических препаратов, используемых для лечения психических расстройств матери, характерен не только для эксперимента. Клинические исследования показывают, что дети, родившиеся от матерей, употреблявших во время беременности антидепрессанты из группы SSRIs (для купирования депрессии или тревожности), в подростковом возрасте демонстрируют признаки социальной дезадаптации и имеют повышенный риск развития депрессии [Glover, Clinton, 2016]. В когортном лонгитюдном исследовании на выборке более 145 000 наблюдений за 12 лет (Квебек, Канада, 1998–2009 гг.) выявлено, что использование антидепрессантов, особенно из группы SSRIs, во время второго и/или третьего триместра увеличивает риск развития РАС у детей даже после компенсации депрессии у матери [Boukhris et al., 2016]. В более позднем мета-анализе клинических данных (более 117 000 случаев, Франция) подтверждено наличие связи между употреблением матерью во время беременности антидепрессантов и последующим возрастанием риска развития аутизма у потомства [Mezzacappa et al., 2017]. Хотя вопрос, является ли данный феномен следствием применения лекарственных препаратов, или отражает генетическую предрасположенность к психическим нарушениям, остается открытым. Однако есть основания предполагать, что, как и в экспериментальных моделях, принимаемые матерью препараты, особенно из группы SSRIs, проходят через плацентарный барьер, попадают в мозг плода, где нарушают работу 5-НТергической системы, и таким образом изменяют динамику его онтогенетического развития [Gingrich et al., 2017].
Наблюдения за детьми и подростками показывают, что стрессовые воздействия в критические периоды, в том числе в пренатальный период, приводят к альтерации индивидуального онтогенеза [Казин и др., 2000]. Этот феномен характеризуется тем, что непосредственно во время действия стресса и/или сразу после него клинические признаки патологии у ребенка отсутствуют. Однако в отдаленных периодах, уже во взрослом состоянии, у человека возникают проблемы с возможностью творческого труда или обнаруживается отсутствие (несформированность) психологических качеств. Примером может служить рост распространенности психического инфантилизма, становящегося большой проблемой уже у подростков и часто приводящего к личным драмам и суициду [Буторин, Бенько, 2016].
Широкое распространение психических заболеваний остро ставит вопрос о ведении беременности больных женщин. К сожалению, большинство клинических наблюдений ограничиваются лишь годом после родов, и поэтому считается, что применение женщинами антидепрессантов (за исключением группы SSRIs) во время беременности достаточно безопасно, хотя в ряде случаев у новорожденных наблюдаются синдром отмены и некоторые транзиторные соматические расстройства (дыхательные нарушения, нестабильность терморегуляции, судороги) [Ornoy et al., 2017]. Использование же антидепрессантов из группы SSRIs, как и в модельных экспериментах на животных, приводит к неоднозначным отсроченным поведенческим последствиям, зависящим как от психического состояния матери во время беременности, так и от средовых условий новорожденного ребенка жизни [Rotem-Kohavi, Oberlander, 2017]. Морфологические исследования (методом функциональной МРТ) мозга новорожденных свидетельствуют о том, что применение матерью во время беременности антидепрессантов из группы SSRIs приводит к широко распространенным микроизменениям белого вещества, отсутствующим как в контроле, так и у детей, родившихся от матерей, страдавших во время беременности депрессией, но не принимавших антидепрессантов [Jha et al., 2016].
В случае применения нейролептиков также не описано доказанных негативных воздействий на здоровье плода, хотя оценка отставленных эффектов обычно отсутствует (часто по причине психических проблем у матери). Обзор данных литературы по осложнениям при употреблении беременными женщинами антипсихотических препаратов второго поколения (атипичных нейролептиков) выявил лишь транзиторные когнитивные нарушения, компенсируемые к концу первого года жизни, и наиболее выраженные в случае применения вальпроата натрия [Costoloni et al., 2014; Haskey, Galbally, 2017]. Наиболее безопасными для лечения депрессии у беременных женщин признаны препараты лития – стабилизаторы настроения. Механизм действия этих препаратов включает изменение экспрессии генов, продукты которых участвуют в регуляции содержания нейромедиаторов (5-НТ, ДА, глутамата), вторичных посредников (фосфатидилинозитола, цАМФ, протеинкиназы С), нейропротекторов (BDNF, киназы гликогенсинтазы 3β) [Rybakowski, 2013]. Следует, однако, признать, что серьезный анализ последствий для потомства приема беременными женщинами разных типов антидепрессантов (блокаторов обратного захвата 5-НТ и/или НА), в разной дозе и на разных стадиях беременности, пока находится на стадии декларации о намерениях [Singal et al., 2016].
Однако ведение беременности предполагает соблюдение баланса между интересами матери и ребенка. Так, на выборке в более чем 25 000 наблюдений показано, что у женщин, страдающих депрессией, но отказавшихся на время беременности от приема антидепрессантов, повышается риск преждевременных родов, рождения детей с низкой массой тела и утяжеления собственного заболевания [Jarde et al., 2016]. Следовательно, заключение о целесообразности применения психоактивных лекарственных средств должно приниматься лишь при тщательном и детальном изучении всех возможных последствий как для матери, так и для ребенка.
ЗАКЛЮЧЕНИЕ
В целом метод целенаправленного воздействия на разные органы развивающегося организма, включая воздействие на головной мозг, как модель формирования патологического состояния, остается актуальным для научных исследований, и востребованным практическим здравоохранением.
Как следует из обзора, патофизиологические исследования последних лет базируются на принципах функциональной геномики, в соответствии с которыми предполагается, что клетки регулируют свою жизнедеятельность через механизмы экспрессии генов. Другим основополагающим принципом моделирования нервно-психических расстройств является представление о регулирующей и программирующей роли гормонов в процессах онтогенеза. При этом значительная часть исследователей склоняется к мысли о ключевой роли эпигенетических влияний в раннем возрасте на последующий онтогенез нервной системы и психики [Tran, 2017]. И, как нам кажется, потенциал изучения влияния эпигенетических механизмов (воздействующих на хроматин и тем самым изменяющим экспрессию генов, но не изменяющих ДНК) на онтогенез далеко не исчерпан, особенно в контексте запросов клинической медицины. Поскольку распространенность функциональных расстройств нервной системы и психической сферы достигает пугающих величин 164.5‰ среди дошкольников и 508–680‰ – среди учащихся 1–9-х классов [Намазова-Баранова и др., 2014]. А отсроченное развитие у детей состояния, прямо противоположного ожидаемому согласно механизму действия фармакологических препаратов, для клиницистов оказывается неприятным сюрпризом.
Список литературы
Альбицкая Ж.В., Дворянинова В.В., Касимова Л.Н. Коморбидная патология при расстройствах аутистического спектра у детей. Сибирский вестник психиатрии и наркологии. 2016. 1 (90): 38–42.
Буторин Г.Г., Бенько Л.А. Синдромы невропатии и психического инфантилизма в структуре психических расстройств детского возраста. Сибирский психологический журнал. 2016. 60: 108–119.
Визель Т.Г. Аутизм и прививки: кто прав? Вестник угроведения. 2013. 2 (12): 148–160.
Воронин Л.Г., Зубова О.Б., Будук-оол Л.К. Динамика становления биоэлектрической активности головного мозга у крыс в онтогенезе. Научные доклады высшей школы, биологические науки. 1982. 6: 44–48.
Григорьян Г.А., Гуляева Н.В. Стресс-реактивность и стресс-устойчивость в патогенезе депрессивных расстройств: роль эпигенетических механизмов. Журнал высшей нервной деятельности им. И.П. Павлова. 2015. 65 (1): 19–32. https://doi.org/10.7868/S0044467715010037
Гудашева Т.А., Тарасюк А.В., Поварнина П.Ю., Середенин С.Б. Мозговой нейротрофический фактор и его низкомолекулярные миметики. Фармакокинетика и фармакодинамика. 2017. 3: 3–13.
Зубова О.Б., Окнина Н.Б. Функциональные характеристики развивающегося мозга после ранней постнатальной иммунизации: анализ поведения. Журнал высшей нервной деятельности им. И.П. Павлова. 1988. 38 (2): 305–312.
Зубова О.Б., Окнина Н.Б., Никитина Г.М., Кузнецов Ю.Б., Кулаичев А.П. Сравнительная характеристика кратковременной пластичности в гиппокампе взрослых и развивающихся крыс. Журнал высшей нервной деятельности им. И.П. Павлова. 1989. 39 (5): 968–970.
Иваницкая Л.Н., Леднова М.И., Пустовая О.В., Хатламаджиян В.Р. Синдром раннего детского аутизма. Обзор литературы. Валеология. 2015. 3: 116–127.
Казин Э.М., Блинова Н.Г., Литвинова Н.А. Основы индивидуального здоровья человека: введение в общую и прикладную валеологию. М.: ВЛАДОС, 2000. 192 с.
Капица И.Г., Иванова Е.А., Воронина Т.А., Калинина А.П. Влияние трифтазина на поведение молодых взрослых крыс с фетальным вальпроатным синдромом. Патогенез. 2018. 16(2): 56–63.
Капица И.Г., Иванова Е.А., Воронина Т.А., Процун Г.В. Влияние трифтазина на проявления расстройств аутистического спектра у крыс с фетальным вальпроатным синдромом. Фармакокинетика и фармакодинамика. 2017. 3: 34–38.
Кельмансон И. Курение матери во время беременности как фактор риска для развития плода и ребенка. Врач. 2017. 8: 2–6.
Клюшник Т.П., Андросова Л.В., Симашкова Н.В., Зозуля С.А., Отман И.Н., Коваль-Зайцев А.А. Состояние врожденного и приобретенного иммунитета у детей с психотическими формами расстройств аутистического спектра. Журнал неврологии и психиатрии им. C.C. Корсакова. 2011. 111 (8): 41–45.
Клюшник Т.П., Андросова Л.В., Симашкова Н.В., Зозуля С.А., Отман И.Н., Шушпанова О.В., Макарова Л.О., Дупин А.М. Состояние иммунной системы в континууме расстройств аутистического и шизофренического спектра. Вестник Совета молодых ученых и специалистов Челябинской области. 2016. 3 (2 (13)): 62–66.
Котов А.С. Тревога у страдающих эпилепсией пациентов. Журнал неврологии и психиатрии им. C.C. Корсакова. 2013. 113 (4-2): 41–44.
Крупина Н.А., Хлебникова Н.Н., Орлова И.Н. Эмоционально-мотивационные расстройства у крыс как следствие действия дипротина А и ситаглиптина в первую неделю постнатального развития. Журнал высшей нервной деятельности им. И.П. Павлова. 2016. 66 (3): 367–381. https://doi.org/10.7868/S0044467716030059
Крыжановский Г.Н. Дизрегуляторная патология. М.: Медицина, 2002. 632 с.
Крючкова Н.А. Функциональное созревание синапсов мшистых волокон гиппокампа в онтогенезе кролика. Нейрофизиология. 1980. 12 (3): 246–253.
Крючкова Н.А. Кратковременная и длительная потенциация в афферентных путях гиппокампа новорожденных кроликов. Нейрофизиология. 1983. 15 (2): 161–169.
Кудрявцева Н.Н., Шурлыгина А.В., Галямина А.Г., Смагин Д.А., Коваленко И.Л., Попова Н.А., Николин В.П., Ильницкая С.И., Мельникова Е.В., Труфакин В.А. Иммунопатология смешанного тревожно/депрессивного расстройства: экспериментальный подход к исследованию иммунодефицитных состояний (обзор). Журнал высшей нервной деятельности им. И.П. Павлова. 2017. 67 (6): 671–692. https://doi.org/10.7868/S0044467717060016
Латанов А.В., Коршунов В.А., Майоров В.И., Серков А.Н. Серотонин и дофамин в биологических моделях депрессии. Журнал высшей нервной деятельности им. И.П. Павлова. 2018. 68 (4): 415–428. https://doi.org/10.1134/S0044467718040081
Малиновская Н.А., Моргун А.В., Лопатина О.Л., Панина Ю.А., Волкова В.В., Гасымлы Э.Д., Таранушенко Т.Е., Салмина А.Б. Стресс раннего периода жизни: последствия для развития головного мозга. Журнал высшей нервной деятельности им. И.П. Павлова. 2016. 66 (6): 643–668. https://doi.org/10.7868/S0044467716050051
Малышев А.В., Аббасова К.Р., Аверина О.А., Соловьёва Л.Н., Гедзун В.Р., Гуляев М.В., Дубынин В.А. Экспериментальная модель аутистического расстройства: индуцированный фетальный вальпроатный синдром. Вестник Московского университета. Серия 16: Биология. 2015. 3: 8–12.
Морозов С.Г., Грибова И.Е., Клюшник Т.П., Сидякин А.А., Гнеденко Б.Б., Торопыгин И.Ю., Фадеев Д.А., Зозуля С.А., Коверная Е.И., Сарманова З.В. Влияние повышенного уровня антител к основному белку миелина у самок мышей на постнатальное развитие и поведенческие реакции потомства. Бюллетень экспериментальной биологии и медицины. 2007. 144 (10): 432–436.
Морозов С.Г., Сидякин А.А., Аникина О.М., Грибова И.Е., Клюшник Т.П. Влияние антител к фактору роста нервов и основному белку миелина у самок мышей на постнатальное развитие потомства. Патогенез. 2011. 9 (1): 27–29.
Мыльникова А.Н., Колесов Д.В., Московцев А.А., Соколовская А.А., Кубатиев А.А. Клеточные микрофлюидные технологии для биомоделирования патологий. Патогенез. 2017. 15(4): 4–12. https://doi.org/10.25557/GM.2018.4.9743
Намазова-Баранова Л.С., Кучма В.Р., Ильин А.Г., Сухарева Л.М., Рапопорт И.К. Заболеваемость детей в возрасте от 5 до 15 лет в Российской Федерации. Медицинский совет. 2014. 1: 6–10.
Ридер Ф.К., Даниленко О.А., Гришкина М.Н., Кустов Г.В., Акжигитов Р.Г., Лебедева А.В., Гехт А.Б. Депрессия и эпилепсия: коморбидность, патогенетическое сходство, принципы терапии. Журнал неврологии и психиатрии им. C.C. Корсакова. 2016. 116 (9–2): 19–24.
Родионов А.Н., Лобанов А.В., Морозов С.Г., Сидякин А.А., Аникина О.М., Грибова И.Е., Рыбаков А.С., Проценко А.Н., Мурашев А.Н., Клюшник Т.П. Влияния высокого уровня антител к ФРН в раннем эмбриогенезе на формирование поведения мышей в постнатальном периоде развития. Патологическая физиология и экспериментальная терапия. 2012. 56 (3): 68–74.
Семёнова Т.П. Возрастные особенности адаптивного поведения гиппокампэктомированных крыс. Механизмы адаптивного поведения. Л., 1986: 54–57.
Смулевич А.Б., Брико Н.И., Андрющенко А.В., Романов Д.В., Шуляк Ю.А., Бражников А.Ю., Герасимов А.Н., Меликпашаян А.Э., Миронова Е.В., Пушкарев Д.Ф. Коморбидность депрессии и расстройств неаффективного шизофренического спектра: клинико-эпидемиологическое исследование ЭДИП. Журнал неврологии и психиатрии им. C.C. Корсакова. 2015. 115 (11–2): 6–19.
Сонькин В.Д. 100 лет физиологии развития. Новые исследования. 2003. 1 (4): 24–35.
Трекова H.A., Майзелис М.Я., Коган Р.Д. Изменение состояния гематоэнцефалического барьера при экспериментальной нейросенсибилизации. Журнал невропатологии и психиатрии им. С.С. Корсакова. 1979. 79 (7): 872–875.
Фёдоров Н.Б. Развитие системы возвратного торможения в поле СА1 гиппокампа в ранний постнатальный период. Бюллетень экспериментальной биологии и медицины. 1990. 110 (11): 451–452.
Худина Ю.С., Дмитриев М.Н. Коморбидность проявлений синдрома дефицита внимания с гиперактивностью и биполярного аффективного расстройства у молодежи. Архивариус. 2017. 1 (16): 33–37.
Шавловская О.А., Кузнецов С.Л. Коррекция тревожных нарушений: фокус на коморбидного пациента. Терапевтический архив. 2018. 90 (4): 67–71.
Able J.A., Gudelsky G.A., Vorhees C.V., Williams M.T. 3,4-Methylenedioxymethamphetamine in adult rats produces deficits in path integration and spatial reference memory. Biol. Psychiatry. 2006. 59 (12): 1219–1226. https://doi.org/10.1016/j.biopsych.2005.09.006
Ainsworth B., Marshall J.E., Meron D., Baldwin D.S., Chadwick P., Munafò M.R., Garner M. Evaluating psychological interventions in a novel experimental human model of anxiety. J. Psychiatr. Res. 2015. 63: 117–122. https://doi.org/10.1016/j.jpsychires.2015.02.001
Al-Mamari W., Al-Saegh A., Al-Kindy A., Bruwer Z., Al-Murshedi F., Al-Thihli K. Diagnostic Yield of Chromosomal Microarray Analysis in a Cohort of Patients with Autism Spectrum Disorders from a Highly Consanguineous Population. J. Autism Dev. Disord. 2015. 45 (8): 2323–2328. https://doi.org/10.1007/s10803-015-2394-9
Amos-Kroohs R.M., Williams M.T., Braun A.A., Graham D.L., Webb C.L., Birtles T.S., Greene R.M., Vorhees C.V., Pisano M.M. Neurobehavioral phenotype of C57BL/6J mice prenatally and neonatally exposed to cigarette smoke. Neurotoxicol. Teratol. 2013. 35: 34-45. https://doi.org/10.1016/j.ntt.2013.01.001
Andersen S.L., Laurberg P., Wu C.S., Olsen J. Attention deficit hyperactivity disorder and autism spectrum disorder in children born to mothers with thyroid dysfunction: a Danish nationwide cohort study. BJOG. 2014. 121 (11): 1365–1374. https://doi.org/10.1111/1471-0528.12681
Arad M., Piontkewitz Y., Albelda N., Shaashua L., Weiner I. Immune activation in lactating dams alters sucklings' brain cytokines and produces non-overlapping behavioral deficits in adult female and male offspring: A novel neurodevelopmental model of sex-specific psychopathology. Brain Behav. Immun. 2017. 63: 35–49. https://doi.org/10.1016/j.bbi.2017.01.015
Atladóttir H.Ó., Henriksen T.B., Schendel D.E., Parner E.T. Autism after infection, febrile episodes, and antibiotic use during pregnancy: an exploratory study. Pediatrics. 2012. 130 (6): e1447-54. https://doi.org/10.1542/peds.2012-1107
Babenko O., Kovalchuk I., Metz G.A. Stress-induced perinatal and transgenerational epigenetic programming of brain development and mental health. Neurosci Biobehav Rev. 2015. 48: 70–91. https://doi.org/10.1016/j.neubiorev.2014.11.013
Bale T.L. Epigenetic and transgenerational reprogramming of brain development. Nat. Rev. Neurosci. 2015. 16 (6): 332–344. https://doi.org/10.1038/nrn3818
Belvederi Murri M., Respino M., Innamorati M., Cervetti A., Calcagno P., Pompili M., Lamis D.A., Ghio L., Amore M. Is good insight associated with depression among patients with schizophrenia? Systematic review and meta-analysis. Schizophr. Res. 2015. 162 (1–3): 234–247. https://doi.org/10.1016/j.schres.2015.01.003
Beyer D.K.E., Freund N. Animal models for bipolar disorder: from bedside to the cage. Int. J. Bipolar Disord. 2017. 5 (1): 35. https://doi.org/10.1186/s40345-017-0104-6
Binder E.B. The role of FKBP5, a co-chaperone of the glucocorticoid receptor in the pathogenesis and therapy of affective and anxiety disorders. Psychoneuroendocrinology. 2009. 34 Suppl 1: S186–195. https://doi.org/10.1016/j.psyneuen.2009.05.021
Bjorklund G. The role of zinc and copper in autism spectrum disorders. Acta Neurobiol. Exp (Wars). 2013. 73 (2): 225–236.
Blair M.G., Nguyen N.N., Albani S.H., L’Etoile M.M., Andrawis M.M., Owen L.M., Oliveira R.F., Johnson M.W., Purvis D.L., Sanders E.M., Stoneham E.T., Xu H., Dumas T.C. Developmental changes in structural and functional properties of hippocampal AMPARs parallels the emergence of deliberative spatial navigation in juvenile rats. J. Neurosci. 2013. 33 (30): 12218–12228. https://doi.org/10.1523/JNEUROSCI.4827-12.2013
Bliss T.V., Chung S.H., Stirling R.V. Proceedings: Structural and functional development of the mossy fibre system in the hippocampus of the post-natal rat. J. Physiol. 1974. 239 (2): 92P–94P.
Boukhris T., Sheehy O., Mottron L., Bérard A. Antidepressant Use During Pregnancy and the Risk of Autism Spectrum Disorder in Children. JAMA Pediatr. 2016. 170 (2): 117–124. https://doi.org/10.1001/jamapediatrics.2015.3356
Boulle F., Pawluski J.L., Homberg J.R., Machiels B., Kroeze Y., Kumar N., Steinbusch H.W.M., Kenis G., van den Hove D.L.A. Developmental fluoxetine exposure increases behavioral despair and alters epigenetic regulation of the hippocampal BDNF gene in adult female offspring. Horm Behav. 2016. 80: 47–57. https://doi.org/10.1016/j.yhbeh.2016.01.017
Braun T., Challis J.R., Newnham J.P., Sloboda D.M. Early-life glucocorticoid exposure: the hypothalamic-pituitary-adrenal axis, placental function, and long-term disease risk. Endocr. Rev. 2013. 34 (6): 885–916. https://doi.org/10.1210/er.2013-1012
Brown A.S. The environment and susceptibility to schizophrenia. Prog. Neurobiol. 2011. 93 (1): 23–58. https://doi.org/10.1016/j.pneurobio.2010.09.003
Buschdorf J.P., Meaney M.J. Epigenetics/Programming in the HPA Axis. Compr Physiol. 2015. 6 (1): 87–110. https://doi.org/10.1002/cphy.c140027
Cassano P., Hidalgo A., Burgos V., Adris S., Argibay P. Hippocampal upregulation of the cyclooxygenase-2 gene following neonatal clomipramine treatment (a model of depression). Pharmacogenomics. J. 2006. 6 (6): 381–387. https://doi.org/10.1038/sj.tpj.6500385
Charil A., Laplante D.P., Vaillancourt C., King S. Prenatal stress and brain development. Brain Res Rev. 2010. 65 (1): 56–79. https://doi.org/10.1016/j.brainresrev.2010.06.002
Chen Y., Baram T.Z. Toward Understanding How Early-Life Stress Reprograms Cognitive and Emotional Brain Networks. Neuropsychopharmacology. 2016. 41 (1): 197–206. https://doi.org/10.1038/npp.2015.181
Chong S.C., Broekman B.F., Qiu A., Aris I.M., Chan Y.H., Rifkin-Graboi A., Law E., Chee C.Y., Chong Y.S., Kwek K.Y., Saw S.M., Gluckman P.D., Meaney M.J., Chen H. Anxiety and depression during pregnancy and temperament in early infancy: findings from a multi-ethnic, Asian, prospective birth cohort study. Infant Ment. Health J. 2016. 37 (5): 584–98. https://doi.org/10.1002/imhj.21582
Cohen M.A., Skelton M.R., Schaefer T.L., Gudelsky G.A., Vorhees C.V., Williams M.T. Learning and memory after neonatal exposure to 3,4-methylenedioxymethamphetamine (ecstasy) in rats: interaction with exposure in adulthood. Synapse. 2005. 57 (3): 148–159. https://doi.org/10.1002/syn.20166
Costoloni G., Pierantozzi E., Goracci A., Bolognesi S., Fagiolini A. [Mood stabilisers and pregnancy outcomes – a review]. Psychiatr. Pol. 2014. 48 (5): 865–887. [Article in Polish]
Crăciun E.C., Bjørklund G., Tinkov A.A., Urbina M.A., Skalny A.V., Rad F., Dronca E. Evaluation of whole blood zinc and copper levels in children with autism spectrum disorder. Metab. Brain Dis. 2016. 31 (4): 887–890. https://doi.org/10.1007/s11011-016-9823-0
Curtin P., Austin C., Curtin A., Gennings C., Arora M. (for the Emergent Dynamical Systems Group), Tammimies K., Willfors C., Berggren S., Siper P., Rai D., Meyering K., Kolevzon A., Mollon J., David A.S., Lewis G., Zammit S., Heilbrun L., Palmer R.F., Wright R.O., Bölte S., Reichenberg A. Dynamical features in fetal and postnatal zinc-copper metabolic cycles predict the emergence of autism spectrum disorder. Sci. Adv. 2018. 4(5): eaat1293.
Deltheil T., Guiard B.P., Cerdan J., David D.J., Tanaka K.F., Repérant C., Guilloux J.P., Coudoré F., Hen R., Gardier A.M. Behavioral and serotonergic consequences of decreasing or increasing hippocampus brain-derived neurotrophic factor protein levels in mice. Neuropharmacology. 2008. 55 (6): 1006–1014. https://doi.org/10.1016/j.neuropharm.2008.08.001
Deussing J.M., Jakovcevski M. Histone Modifications in Major Depressive Disorder and Related Rodent Models. Adv. Exp. Med. Biol. 2017. 978: 169–183. https://doi.org/10.1007/978-3-319-53889-1_9
Dirven B.C.J., Homberg J.R., Kozicz T., Henckens M.J.A.G. Epigenetic programming of the neuroendocrine stress response by adult life stress. J. Mol. Endocrinol. 2017. 59 (1): R11–R31. https://doi.org/10.1530/JME-17-0019
Drago F., Continella G., Alloro M.C., Scapagnini U. Behavioral effects of perinatal administration of antidepressant drugs in the rat. Neurobehav. Toxicol. Teratol. 1985. 7 (5): 493–497.
Eriksson J.G. Epidemiology, genes and the environment: lessons learned from the Helsinki Birth Cohort Study. J. Intern. Med. 2007. 261 (5): 418–425. https://doi.org/10.1111/j.1365-2796.2007.01798.x
Fernández de Cossío L., Guzmán A., van der Veldt S., Luheshi G.N. Prenatal infection leads to ASD-like behavior and altered synaptic pruning in the mouse offspring. Brain Behav. Immun. 2017. 63: 88–98. https://doi.org/10.1016/j.bbi.2016.09.028
Fowden A.L., Forhead A.J. Endocrine mechanisms of intrauterine programming. Reproduction. 2004. 127 (5): 515–526. https://doi.org/10.1530/rep.1.00033
Gale C.R., O’Callaghan F.J., Godfrey K.M., Law C.M., Martyn C.N. Critical periods of brain growth and cognitive function in children. Brain. 2004. 127 (Pt 2): 321–329. https://doi.org/10.1093/brain/awh034
Gandy K., Kim S., Sharp C., Dindo L., Maletic-Savatic M., Calarge C. Pattern Separation: A Potential Marker of Impaired Hippocampal Adult Neurogenesis in Major Depressive Disorder. Front. Neurosci. 2017. 11: 571. eCollection 2017.https://doi.org/10.3389/fnins.2017.00571
Gaynullina D.K., Sofronova S.I., Selivanova E.K., Shvetsova A.A., Borzykh A.A., Sharova A.P., Kostyunina D.S., Martyanov A.A., Tarasova O.S. NO-mediated anticontractile effect of the endothelium is abolished in coronary arteries of adult rats with antenatal/early postnatal hypothyroidism. Nitric Oxide. 2017. 63: 21–28. https://doi.org/10.1016/j.niox.2016.12.007
Gingrich J.A., Malm H., Ansorge M.S., Brown A., Sourander A., Suri D., Teixeira C.M., Caffrey Cagliostro M.K., Mahadevia D., Weissman M.M. New Insights into How Serotonin Selective Reuptake Inhibitors Shape the Developing Brain. Birth Defects Res. 2017. 109 (12): 924–932. https://doi.org/10.1002/bdr2.1085
Glover M.E., Clinton S.M. Of rodents and humans: A comparative review of the neurobehavioral effects of early life SSRI exposure in preclinical and clinical research. Int. J. Dev. Neurosci. 2016. 51: 50–72. https://doi.org/10.1016/j.ijdevneu.2016.04.008
Gluckman P.D., Hanson M.A. Developmental plasticity and human disease: research directions. J. Intern. Med. 2007. 261 (5): 461–471. https://doi.org/10.1111/j.1365-2796.2007.01802.x
Gogtay N., Giedd J.N., Lusk L., Hayashi K.M., Greenstein D., Vaituzis A.C., Nugent T.F. 3rd, Herman D.H., Clasen L.S., Toga A.W., Rapoport J.L., Thompson P.M. Dynamic mapping of human cortical development during childhood through early adulthood. Proc. Natl. Acad. Sci. U S A. 2004. 101 (21): 8174–8179. https://doi.org/10.1073/pnas.0402680101
Gotham K., Unruh K., Lord C. Depression and its measurement in verbal adolescents and adults with autism spectrum disorder. Autism. 2015. 19 (4): 491–504. https://doi.org/10.1177/1362361314536625
Grantham-McGregor S., Baker-Henningham H. Review of the evidence linking protein and energy to mental development. Public Health Nutr. 2005. 8 (7A): 1191–1201.
Green C.G., Babineau V., Jolicoeur-Martineau A., Bouvette-Turcot A.A., Minde K., Sassi R., St-André M., Carrey N., Atkinson L., Kennedy J.L., Steiner M., Lydon J., Gaudreau H., Burack J.A., Levitan R., Meaney M.J., Wazana A.; Maternal Adversity, Vulnerability, and Neurodevelopment Research Team. Prenatal maternal depression and child serotonin transporter linked polymorphic region (5-HTTLPR) and dopamine receptor D4 (DRD4) genotype predict negative emotionality from 3 to 36 months. Dev. Psychopathol. 2017. 29 (3): 901–917. https://doi.org/10.1017/S0954579416000560
Hadjkacem I., Ayadi H., Turki M., Yaich S., Khemekhem K., Walha A., Cherif L., Moalla Y., Ghribi F. Prenatal, perinatal and postnatal factors associated with autism spectrum disorder. J. Pediatr. (Rio J.). 2016; 92 (6): 595–601. https://doi.org/10.1016/j.jped.2016.01.012
Hansen H.H., Sánchez C., Meier E. Neonatal administration of the selective serotonin reuptake inhibitor Lu 10-134-C increases forced swimming-induced immobility in adult rats: a putative animal model of depression? J. Pharmacol. Exp. Ther. 1997. 283 (3): 1333–1341.
Harris J.C. New classification for neurodevelopmental disorders in DSM-5. Curr. Opin. Psychiatry. 2014. 27 (2): 95–97. https://doi.org/10.1097/YCO.0000000000000042
Harvey L., Boksa P. Prenatal and postnatal animal models of immune activation: relevance to a range of neurodevelopmental disorders. Dev. Neurobiol. 2012. 72 (10): 1335–1348. https://doi.org/10.1002/dneu.22043
Haskey C., Galbally M. Mood stabilizers in pregnancy and child developmental outcomes: A systematic review. Aust. N. Z. J. Psychiatry. 2017. 51 (11): 1087–1097. https://doi.org/10.1177/0004867417726175
Ikegame T., Bundo M., Murata Y., Kasai K., Kato T., Iwamoto K. DNA methylation of the BDNF gene and its relevance to psychiatric disorders. J Hum. Genet. 2013. 58 (7): 434–438. https://doi.org/10.1038/jhg.2013.65
Ismail F.Y., Fatemi A., Johnston M.V. Cerebral plasticity: Windows of opportunity in the developing brain. Eur. J. Paediatr. Neurol. 2017. 21 (1): 23–48. https://doi.org/10.1016/j.ejpn.2016.07.007
Jarde A., Morais M., Kingston D., Giallo R., MacQueen G.M., Giglia L., Beyene J., Wang Y., McDonald S.D. Neonatal Outcomes in Women With Untreated Antenatal Depression Compared With Women Without Depression: A Systematic Review and Meta-analysis. JAMA Psychiatry. 2016. 73 (8): 826–837. https://doi.org/10.1001/jamapsychiatry.2016.0934
Jha S.C., Meltzer-Brody S., Steiner R.J., Cornea E., Woolson S., Ahn M., Verde A.R., Hamer R.M., Zhu H., Styner M., Gilmore J.H., Knickmeyer R.C. Antenatal depression, treatment with selective serotonin reuptake inhibitors, and neonatal brain structure: A propensity-matched cohort study. Psychiatry Res. Neuroimaging. 2016. 253: 43–53. https://doi.org/10.1016/j.pscychresns.2016.05.004
Kanungo S., Soares N., He M., Steiner R.D. Sterol metabolism disorders and neurodevelopment-an update. Dev. Disabil. Res. Rev. 2013. 17 (3): 197–210. https://doi.org/10.1002/ddrr.1114
Karam S.M., Barro A.J., Matijasevich A., Dos Santos I.S., Anselmi L., Barros F., Leistner-Segal S., Félix T.M., Riegel M., Maluf S.W., Giugliani R., Black M.M. Intellectual Disability in a Birth Cohort: Prevalence, Etiology, and Determinants at the Age of 4 Years. Public Health Genomics. 2016. 19(5): 290–297. https://doi.org/10.1159/000448912
Karam S.M., Riegel M., Segal S.L., Félix T.M., Barros A.J., Santos I.S., Matijasevich A., Giugliani R., Black M. Genetic causes of intellectual disability in a birth cohort: a population-based study. Am. J. Med. Genet. A. 2015. 167(6): 1204–1214. https://doi.org/10.1002/ajmg.a.37011
Kim K.C., Gonzales E.L., Lázaro M.T., Choi C.S., Bahn G.H., Yoo H.J., Shin C.Y. Clinical and Neurobiological Relevance of Current Animal Models of Autism Spectrum Disorders. Biomol Ther (Seoul). 2016. 24 (3): 207–243. https://doi.org/10.4062/biomolther.2016.061
Kucerova J., Babinska Z., Horska K., Kotolova H. The common pathophysiology underlying the metabolic syndrome, schizophrenia and depression. A review. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc. Czech Repub. 2015. 159 (2): 208–214. https://doi.org/10.5507/bp.2014.060
Kumar V., Bhat Z.A., Kumar D. Animal models of anxiety: a comprehensive review. J. Pharmacol. Toxicol. Methods. 2013. 68 (2): 175–183. https://doi.org/10.1016/j.vascn.2013.05.003
Kundakovic M., Gudsnuk K., Herbstman J.B., Tang D., Perera F.P., Champagne F.A. DNA methylation of BDNF as a biomarker of early-life adversity. Proc. Natl. Acad. Sci. U S A. 2015. 112 (22): 6807–6813. https://doi.org/10.1073/pnas.1408355111
Küpers L.K., Xu X., Jankipersadsing S.A., Vaez A., la Bastide-van Gemert S., Scholtens S., Nolte I.M., Richmond R.C., Relton C.L., Felix J.F., Duijts L., van Meurs J.B., Tiemeier H., Jaddoe V.W., Wang X., Corpeleijn E., Snieder H. DNA methylation mediates the effect of maternal smoking during pregnancy on birthweight of the offspring. Int. J. Epidemiol. 2015. 44 (4): 1224–1237. https://doi.org/10.1093/ije/dyv048
Lebel C., Walton M., Letourneau N., Giesbrecht G.F., Kaplan B.J., Dewey D. Prepartum and Postpartum Maternal Depressive Symptoms Are Related to Children’s Brain Structure in Preschool. Biol Psychiatry. 2016. 80 (11): 859–868. https://doi.org/10.1016/j.biopsych.2015.12.004
Leblanc M.O., Bland B.H. Developmental aspects of hippocampal electrical activity and motor behavior in the rat. Exp. Neurol. 1979. 66 (2): 220–237.
Lillycrop K.A., Costello P.M., Teh A.L., Murray R.J., Clarke-Harris R., Barton S.J., Garratt E.S., Ngo S., Sheppard A.M., Wong J., Dogra S., Burdge G.C., Cooper C., Inskip H.M., Gale C.R., Gluckman P.D., Harvey N.C., Chong Y.S., Yap F., Meaney M.J., Rifkin-Graboi A., Holbrook J.D.; Epigen Global Research Consortium, Godfrey K.M. Association between perinatal methylation of the neuronal differentiation regulator HES1 and later childhood neurocognitive function and behaviour. Int. J. Epidemiol. 2015. 44 (4): 1263–1276. https://doi.org/10.1093/ije/dyv052
Lovic V., Belay H., Walker C.D., Burton C.L., Meaney M.J., Sokolowski M., Fleming A.S. Early postnatal experience and DRD2 genotype affect dopamine receptor expression in the rat ventral striatum. Behav. Brain Res. 2013. 237: 278–82. https://doi.org/10.1016/j.bbr.2012.09.046
McCann U.D., Eligulashvili V., Ricaurte G.A. (+/-)3,4-Methylenedioxymethamphetamine ('Ecstasy')-induced serotonin neurotoxicity: clinical studies. Neuropsychobiology. 2000. 42 (1): 11–16. https://doi.org/10.1159/000026665
McHail D.G., Dumas T.C. Multiple forms of metaplasticity at a single hippocampal synapse during late postnatal development. Dev. Cogn. Neurosci. 2015. 12: 145–154. https://doi.org/10.1016/j.dcn.2015.01.009
Meehan C., Harms L., Frost J.D., Barreto R., Todd J., Schall U., Shannon Weickert C., Zavitsanou K., Michie P.T., Hodgson D.M. Effects of immune activation during early or late gestation on schizophrenia-related behaviour in adult rat offspring. Brain Behav. Immun. 2017. 63: 8–20. https://doi.org/10.1016/j.bbi.2016.07.144
Meinzer M.C., Pettit J.W., Viswesvaran C. The co-occurrence of attention-deficit/hyperactivity disorder and unipolar depression in children and adolescents: a meta-analytic review. Clin. Psychol. Rev. 2014. 34 (8): 595–607. https://doi.org/10.1016/j.cpr.2014.10.002
Meyer U., Feldon J. To poly(I:C) or not to poly(I:C): advancing preclinical schizophrenia research through the use of prenatal immune activation models. Neuropharmacology. 2012. 62 (3): 1308–1321. https://doi.org/10.1016/j.neuropharm.2011.01.009
Mezzacappa A., Lasica P.A., Gianfagna F., Cazas O., Hardy P., Falissard B., Sutter-Dallay A.L., Gressier F. Risk for Autism Spectrum Disorders According to Period of Prenatal Antidepressant Exposure: A Systematic Review and Meta-analysis. JAMA Pediatr. 2017. 171 (6): 555–563. https://doi.org/10.1001/jamapediatrics.2017.0124
Miller B.R., Hen R. The current state of the neurogenic theory of depression and anxiety. Curr. Opin. Neurobiol. 2015. 30: 51–58. https://doi.org/10.1016/j.conb.2014.08.012
Missault S., Van den Eynde K., Vanden Berghe W., Fransen E., Weeren A., Timmermans J.P., Kumar-Singh S., Dedeurwaerdere S. The risk for behavioural deficits is determined by the maternal immune response to prenatal immune challenge in a neurodevelopmental model. Brain Behav. Immun. 2014. 42: 138–146. https://doi.org/10.1016/j.bbi.2014.06.013
Moisiadis V.G., Matthews S.G. Glucocorticoids and fetal programming part 1: Outcomes. Nat. Rev. Endocrinol. 2014. 10 (7): 391–402. https://doi.org/10.1038/nrendo.2014.73
Moisiadis V.G., Matthews S.G. Glucocorticoids and fetal programming part 2: Mechanisms. Nat. Rev. Endocrinol. 2014. 10 (7): 403–411. https://doi.org/10.1038/nrendo.2014.74
Moog N.K., Entringer S., Heim C, Wadhwa P.D., Kathmann N., Buss C. Influence of maternal thyroid hormones during gestation on fetal brain development. Neuroscience. 2017. 342: 68-100. https://doi.org/10.1016/j.neuroscience.2015.09.070
Mulligan A., Anney R., Butler L., O’Regan M., Richardson T., Tulewicz E.M., Fitzgerald M., Gill M. Home environment: association with hyperactivity/impulsivity in children with ADHD and their non-ADHD siblings. Child Care Health Dev. 2013. 39 (2): 202–212. https://doi.org/10.1111/j.1365-2214.2011.01345.x
Nestler E.J., Peña C.J., Kundakovic M., Mitchell A., Akbarian S. Epigenetic Basis of Mental Illness. Neuroscientist. 2016. 22 (5): 447–463. https://doi.org/10.1177/1073858415608147
Oberlander T.F. Fetal serotonin signaling: setting pathways for early childhood development and behavior. J. Adolesc. Health. 2012. 51 (2 Suppl): S9–16. https://doi.org/10.1016/j.jadohealth.2012.04.009
O’Donnell K., O’Connor T.G., Glover V. Prenatal stress and neurodevelopment of the child: focus on the HPA axis and role of the placenta. Dev. Neurosci. 2009. 31 (4): 285–292. https://doi.org/10.1159/000216539
Onishchenko N., Karpova N., Sabri F., Castrén E., Ceccatelli S. Long-lasting depression-like behavior and epigenetic changes of BDNF gene expression induced by perinatal exposure to methylmercury. J. Neurochem. 2008. 106 (3): 1378–1387. https://doi.org/10.1111/j.1471-4159.2008.05484.x
Ornoy A., Weinstein-Fudim L., Ergaz Z. Antidepressants, Antipsychotics, and Mood Stabilizers in Pregnancy: What Do We Know and How Should We Treat Pregnant Women with Depression. Birth Defects Res. 2017. 109 (12): 933–956. https://doi.org/10.1002/bdr2.1079
Ozawa K., Hashimoto K., Kishimoto T., Shimizu E., Ishikura H., Iyo M. Immune activation during pregnancy in mice leads to dopaminergic hyperfunction and cognitive impairment in the offspring: a neurodevelopmental animal model of schizophrenia. Biol. Psychiatry. 2006. 59 (6): 546–554.https://doi.org/10.1016/j.biopsych.2005.07.031
Parikshak N.N., Gandal M.J., Geschwind D.H. Systems biology and gene networks in neurodevelopmental and neurodegenerative disorders. Nat. Rev. Genet. 2015. 16 (8): 441–458. https://doi.org/10.1038/nrg3934
Patterson P.H. Immune involvement in schizophrenia and autism: etiology, pathology and animal models. Behav. Brain Res. 2009. 204 (2): 313–321. https://doi.org/10.1016/j.bbr.2008.12.016
Paus T., Keshavan M., Giedd J.N. Why do many psychiatric disorders emerge during adolescence? Nat. Rev. Neurosci. 2008. 9 (12): 947–957. https://doi.org/10.1038/nrn2513
Pješčić K.D., Nenadović M.M., Jašović-Gašić M., Trajković G., Kostić M., Ristić-Dimitrijević R. Influence of psycho-social factors on the emergence of depression and suicidal risk in patients with schizophrenia. Psychiatr. Danub. 2014. 26 (3): 226–230.
Qiu A., Anh T.T., Li Y., Chen H., Rifkin-Graboi A., Broekman B.F., Kwek K., Saw S.M., Chong Y.S., Gluckman P.D., Fortier M.V., Meaney M.J. Prenatal maternal depression alters amygdala functional connectivity in 6-month-old infants. Transl. Psychiatry. 2015. 5: e508. https://doi.org/10.1038/tp.2015.3
Qiu A., Tuan T.A., Ong M.L., Li Y., Chen H., Rifkin-Graboi A., Broekman B.F., Kwek K., Saw S.M., Chong Y.S., Gluckman P.D., Fortier M.V., Holbrook J.D., Meaney M.J. COMT haplotypes modulate associations of antenatal maternal anxiety and neonatal cortical morphology. Am. J. Psychiatry. 2015. 172 (2): 163–172. https://doi.org/10.1176/appi.ajp.2014.14030313
Reisinger S.N., Kong E., Khan D., Schulz S., Ronovsky M., Berger S., Horvath O., Cabatic M., Berger A., Pollak D.D. Maternal immune activation epigenetically regulates hippocampal serotonin transporter levels. Neurobiol. Stress. 2016. 4: 34–43. eCollection 2016 Oct.
Reynolds R.M. Glucocorticoid excess and the developmental origins of disease: two decades of testing the hypothesis–2012 Curt Richter Award Winner. Psychoneuroendocrinology. 2013. 38 (1): 1–11. https://doi.org/10.1016/j.psyneuen.2012.08.012
Rice D., Barone S. Jr. Critical periods of vulnerability for the developing nervous system: evidence from humans and animal models. Environ. Health Perspect. 2000. 108 Suppl 3: 511–533.
Richetto J., Massart R., Weber-Stadlbauer U., Szyf M., Riva MA., Meyer U. Genome-wide DNA Methylation Changes in a Mouse Model of Infection-Mediated Neurodevelopmental Disorders. Biol. Psychiatry. 2017. 81 (3): 265–276. https://doi.org/10.1016/j.biopsych.2016.08.010
Ricq E.L., Hooker J.M., Haggarty S.J. Toward development of epigenetic drugs for central nervous system disorders: Modulating neuroplasticity via H3K4 methylation. Psychiatry Clin Neurosci. 2016. 70 (12): 536–550. https://doi.org/10.1111/pcn.12426
Rifkin-Graboi A., Bai J., Chen H., Hameed W.B., Sim L.W., Tint M.T., Leutscher-Broekman B., Chong Y.S., Gluckman P.D., Fortier M.V., Meaney M.J., Qiu A. Prenatal maternal depression associates with microstructure of right amygdala in neonates at birth. Biol. Psychiatry. 2013. 74 (11): 837–844. https://doi.org/10.1016/j.biopsych.2013.06.019
Ronovsky M., Berger S., Molz B., Berger A., Pollak D.D. Animal Models of Maternal Immune Activation in Depression Research. Curr. Neuropharmacol. 2016. 14 (7): 688–704.
Ronovsky M., Berger S., Zambon A., Reisinger S.N., Horvath O., Pollak A., Lindtner C., Berger A., Pollak D.D. Maternal immune activation transgenerationally modulates maternal care and offspring depression-like behavior. Brain Behav. Immun. 2017. 63: 127–136. https://doi.org/10.1016/j.bbi.2016.10.016
Rotem-Kohavi N., Oberlander T.F. Variations in Neurodevelopmental Outcomes in Children with Prenatal SSRI Antidepressant Exposure. Birth Defects Res. 2017. 109 (12): 909–923. https://doi.org/10.1002/bdr2.1076
Rybakowski J.K. Genetic influences on response to mood stabilizers in bipolar disorder: current status of knowledge. CNS Drugs. 2013. 27 (3): 165–73. https://doi.org/10.1007/s40263-013-0040-7
Saez M., Barceló M.A., Farrerons M., López-Casasnovas G. The association between exposure to environmental factors and the occurrence of attention-deficit/hyperactivity disorder (ADHD). A population-based retrospective cohort study. Environ. Res. 2018. 166: 205–214. https://doi.org/10.1016/j.envres.2018.05.009
Sandman C.A., Davis E.P., Buss C., Glynn L.M. Exposure to prenatal psychobiological stress exerts programming influences on the mother and her fetus. Neuroendocrinology. 2012. 95 (1): 7–21. https://doi.org/10.1159/000327017
Santos S.O., Loureiro S.M., Alves I.G., Jesus C.S., Santos P.R., Santos M.R., Dias D.P., Santana-Filho V.J., Badauê-Passos D.Jr. Experimental gestational hypothyroidism evokes hypertension in adult offspring rats. Auton. Neurosci. 2012. 170 (1-2): 36–41. https://doi.org/10.1016/j.autneu.2012.07.004
Schouw M.L., Gevers S., Caan M.W., Majoie C.B., Booij J., Nederveen A.J., Reneman L. Mapping serotonergic dysfunction in MDMA (ecstasy) users using pharmacological MRI. Eur. Neuropsychopharmacol. 2012. 22 (8): 537–545. https://doi.org/10.1016/j.euroneuro.2011.12.002
Singal D., Brownell M., Chateau D., Ruth C., Katz L.Y. Neonatal and childhood neurodevelopmental, health and educational outcomes of children exposed to antidepressants and maternal depression during pregnancy: protocol for a retrospective population-based cohort study using linked administrative data. BMJ Open. 2016. 6 (11): e013293. https://doi.org/10.1136/bmjopen-2016-013293
Skelton M.R., Graham D.L., Schaefer T.L., Grace C.E., Braun A.A., Burns L.N., Amos-Kroohs R.M., Williams M.T., Vorhees C.V. Distinct periods of developmental sensitivity to the effects of 3,4-(±)-methylenedioxymethamphetamine (MDMA) on behaviour and monoamines in rats. Int. J. Neuropsychopharmacol. 2012. 15 (6): 811–824. https://doi.org/10.1017/S1461145711000952
Skelton M.R., Williams M.T., Vorhees C.V. Developmental effects of 3,4-methylenedioxymethamphetamine: a review. Behav. Pharmacol. 2008. 19 (2): 91–111. https://doi.org/10.1097/FBP.0b013e3282f62c76
Sprowles J.L.N., Hufgard J.R., Gutierrez A., Bailey R.A., Jablonski S.A., Williams M.T., Vorhees C.V. Differential effects of perinatal exposure to antidepressants on learning and memory, acoustic startle, anxiety, and open-field activity in Sprague-Dawley rats. Int. J. Dev. Neurosci. 2017. 61: 92–111. https://doi.org/10.1016/j.ijdevneu.2017.06.004
Sprowles J.L., Hufgard J.R., Gutierrez A., Bailey R.A., Jablonski S.A., Williams M.T., Vorhees C.V. Perinatal exposure to the selective serotonin reuptake inhibitor citalopram alters spatial learning and memory, anxiety, depression, and startle in Sprague-Dawley rats. Int. J. Dev. Neurosci. 2016. 54: 39–52. https://doi.org/10.1016/j.ijdevneu.2016.08.007
Steer S., Pickrell W.O., Kerr M.P., Thomas R.H. Epilepsy prevalence and socioeconomic deprivation in England. Epilepsia. 2014. 55 (10): 1634–1641. https://doi.org/10.1111/epi.12763
Stiles J., Jernigan T.L. The basics of brain development. Neuropsychol. Rev. 2010. 20 (4): 327–348. https://doi.org/10.1007/s11065-010-9148-4
Suri D., Teixeira C.M., Cagliostro M.K., Mahadevia D., Ansorge M.S. Monoamine-sensitive developmental periods impacting adult emotional and cognitive behaviors. Neuropsychopharmacology. 2015. 40 (1): 88–112. https://doi.org/10.1038/npp.2014.231
Surin A.M., Khiroug S., Gorbacheva L.R., Khodorov B.I., Pinelis V.G., Khiroug L. Comparative analysis of cytosolic and mitochondrial ATP synthesis in embryonic and postnatal hippocampal neuronal cultures. Front. Mol. Neurosci. 2013. 5: 102. https://doi.org/10.3389/fnmol.2012.00102
Swann J.W., Brady R.J., Martin D.L. Postnatal development of GABA-mediated synaptic inhibition in rat hippocampus. Neuroscience. 1989. 28 (3): 551–561.
Talge N.M., Neal C., Glover V; Early Stress, Translational Research and Prevention Science Network: Fetal and Neonatal Experience on Child and Adolescent Mental Health. Antenatal maternal stress and long-term effects on child neurodevelopment: how and why? J. Child Psychol. Psychiatry. 2007. 48 (3–4): 245–261. https://doi.org/10.1111/j.1469-7610.2006.01714.x
Tamnes C.K., Herting M.M., Goddings A.L., Meuwese R., Blakemore S.J., Dahl R.E., Güroğlu B., Raznahan A., Sowell E.R., Crone E.A., Mills K.L. Development of the Cerebral Cortex across Adolescence: A Multisample Study of Inter-Related Longitudinal Changes in Cortical Volume, Surface Area, and Thickness. J. Neurosci. 2017. 37 (12): 3402–3412. https://doi.org/10.1523/JNEUROSCI.3302-16.2017
Tau G.Z., Peterson B.S. Normal development of brain circuits. Neuropsychopharmacology. 2010. 35 (1): 147–168. https://doi.org/10.1038/npp.2009.115
Tran N.Q.V., Miyake K. Neurodevelopmental Disorders and Environmental Toxicants: Epigenetics as an Underlying Mechanism. Int. J. Genomics. 2017. 2017: 7526592. https://doi.org/10.1155/2017/7526592
Van den Bergh B.R.H., van den Heuvel M.I., Lahti M., Braeken M., de Rooij S.R., Entringer S., Hoyer D., Roseboom T., Räikkönen K., King S., Schwab M. Prenatal developmental origins of behavior and mental health: The influence of maternal stress in pregnancy. Neurosci. Biobehav. Rev. 2017. pii: S0149-7634(16)30734-5. https://doi.org/10.1016/j.neubiorev.2017.07.003
Varadinova M., Boyadjieva N. Epigenetic mechanisms: A possible link between autism spectrum disorders and fetal alcohol spectrum disorders. Pharmacol. Res. 2015. 102: 71–80. https://doi.org/10.1016/j.phrs.2015.09.011
Velazquez-Moctezuma J., Diaz Ruiz O. Neonatal treatment with clomipramine increased immobility in the forced swim test: an attribute of animal models of depression. Pharmacol. Biochem. Behav. 1992. 42 (4): 737–739.
Vogel G., Hagler M. Effects of neonatally administered iprindole on adult behaviors of rats. Pharmacol. Biochem. Behav. 1996. 55 (1): 157–161.
Vogel G., Hartley P., Neill D., Hagler M., Kors D. Animal depression model by neonatal clomipramine: reduction of shock induced aggression. Pharmacol. Biochem. Behav. 1988. 31 (1): 103–106.
Vogel G., Neill D., Hagler M., Kors D. A new animal model of endogenous depression: a summary of present findings. Neurosci. Biobehav. Rev. 1990. 14 (1): 85–91.
Volk L., Kim C.H., Takamiya K., Yu Y., Huganir R.L. Developmental regulation of protein interacting with C kinase 1 (PICK1) function in hippocampal synaptic plasticity and learning. Proc. Natl. Acad. Sci. USA. 2010. 107 (50): 21784–21789. https://doi.org/10.1073/pnas.1016103107
Vorhees C.V., Graham D.L., Braun A.A., Schaefer T.L., Skelton M.R., Richtand N.M., Williams M.T. Prenatal immune challenge in rats: effects of polyinosinic-polycytidylic acid on spatial learning, prepulse inhibition, conditioned fear, and responses to MK-801 and amphetamine. Neurotoxicol. Teratol. 2015. 47: 54–65. https://doi.org/10.1016/j.ntt.2014.10.007
Wang C., Shen M., Guillaume B., Chong Y.S., Chen H., Fortier M.V., Meaney M.J., Qiu A. FKBP5 Moderates the Association between Antenatal Maternal Depressive Symptoms and Neonatal Brain Morphology. Neuropsychopharmacology. 2018. 43 (3): 564–570. https://doi.org/10.1038/npp.2017.232
Weber-Stadlbauer U. Epigenetic and transgenerational mechanisms in infection-mediated neurodevelopmental disorders. Transl. Psychiatry. 2017. 7 (5): e1113. https://doi.org/10.1038/tp.2017.78
Weber-Stadlbauer U., Richetto J., Labouesse M.A., Bohacek J., Mansuy I.M., Meyer U. Transgenerational transmission and modification of pathological traits induced by prenatal immune activation. Mol. Psychiatry. 2017. 22 (1): 102–112. https://doi.org/10.1038/mp.2016.41
Wen D.J., Poh J.S., Ni S.N., Chong Y.S., Chen H., Kwek K., Shek L.P., Gluckman P.D., Fortier M.V., Meaney M.J., Qiu A. Influences of prenatal and postnatal maternal depression on amygdala volume and microstructure in young children. Transl. Psychiatry. 2017. 7 (4): e1103. https://doi.org/10.1038/tp.2017.74
Willner P. The validity of animal models of depression. Psychopharmacology (Berl). 1984. 83 (1): 1–16.
Yamada K. Single Exposure to Antidepressants during Infancy Is Associated with Delayed Behavioral Changes in C57BL/6 Mice. World Journal of Neuroscience. 2016. 06: 151–164. https://doi.org/10.4236/wjns.2016.62019
Zhang T.Y., Labonté B., Wen X.L., Turecki G., Meaney M.J. Epigenetic mechanisms for the early environmental regulation of hippocampal glucocorticoid receptor gene expression in rodents and humans. Neuropsychopharmacology. 2013. 38 (1): 111–123. https://doi.org/10.1038/npp.2012.149
Zhang T.Y., Meaney M.J. Epigenetics and the environmental regulation of the genome and its function. Annu. Rev. Psychol. 2010. 61: 439–466, C1-3. https://doi.org/10.1146/annurev.psych.60.110707.163625
Zheleznyakova G.Y., Cao H., Schiöth H.B. BDNF DNA methylation changes as a biomarker of psychiatric disorders: literature review and open access database analysis. Behav. Brain Funct. 2016. 12 (1): 17. https://doi.org/10.1186/s12993-016-0101-4
Zheng Y., Fan W., Zhang X., Dong E. Gestational stress induces depressive-like and anxiety-like phenotypes through epigenetic regulation of BDNF expression in offspring hippocampus. Epigenetics. 2016. 11 (2): 150–162. https://doi.org/10.1080/15592294.2016.1146850
Zinni M., Colella M., Batista Novais A.R., Baud O., Mairesse J. Modulating the Oxytocin System During the Perinatal Period: A New Strategy for Neuroprotection of the Immature Brain? Front Neurol. 2018. 9: 229. eCollection 2018.https://doi.org/10.3389/fneur.2018.00229
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


