Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 4, стр. 395-412
НАРУШЕНИЯ ТЕТА- И ГАММА-ОСЦИЛЛЯЦИЙ В МОЗГЕ С ПАТОЛОГИЯМИ, ХАРАКТЕРНЫМИ ДЛЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА И ВИСОЧНОЙ ЭПИЛЕПСИИ
В. Ф. Кичигина *
ФГБНУ Институт теоретической и экспериментальной биофизики РАН
г. Пущино, Россия
* E-mail: vkitchigina@gmail.com
Поступила в редакцию 04.04.2018
После доработки 25.07.2018
Принята к публикации 24.09.2018
Аннотация
Тета- и гамма-осцилляции, регистрируемые в гиппокампе и неокортексе, необходимы для осуществления когнитивных функций мозга; их нарушения выявлены при многих нейрологических и психиатрических заболеваниях. Наиболее распространенными формами нейродегенеративных заболеваний, характеризующихся прогрессивными нарушениями познавательных функций, являются болезнь Альцгеймера (БА) и височная эпилепсия (ВЭ). Ранняя диагностика этих заболеваний очень важна для их успешного лечения. Чтобы найти ранние биомаркеры этих патологий, было проведено множество исследований; однако в настоящее время остается большая потребность в таких маркерах, которые отражали бы изменения функционирования мозга в миллисекундных интервалах времени, чтобы получить информацию о специфических когнитивных нарушениях, свойственных пациентам с определенными нейропатологиями. В настоящем обзоре рассматриваются данные литературы, указывающие, что когерентный анализ осцилляторных тета- и гамма-активностей может быть использован при ранней диагностике ВЭ и БА. Эти данные демонстрируют, что в мозге с развивающимся эпилептическим очагом наблюдаются специфические нарушения когерентности тета- и гамма-осцилляций в гиппокампальной, гиппокампально-энторинальной, гиппокампально-префронтальной и гиппокампально-септальной сетях. На моделях БА обнаружены существенные изменения тета–гамма когерентности в субикулуме, структуре, являющейся выходной для гиппокампа; кроме этого, выявлены специфические нарушения когерентности тета- и гамма-осцилляций в гиппокампально-париетальной и гиппокампально-префронтальной сетях. Ассимиляция данных, выявленных посредством когерентного анализа, с фактами, обнаруженными с помощью когнитивных тестов, может помочь в ранней диагностике нейропатологий с дефицитом познавательных функций.
Известно, что тета- и гамма-осцилляции тесно связаны с когнитивными процессами. Тета-ритм (4–12 Гц) представляет собой высокоамплитудные осцилляции в гиппокампе и окружающих его лимбических структурах во время исследовательского поведения и парадоксального сна [Vanderwolf, 1969; Livanov et al., 1977; Bland, 1986; Vinogradova, 1995; Виноградова и др., 2000; Buzsáki, 2002]. Тета осцилляции регистрируются также в неокортексе, где они особенно отчетливы во фронтально-медиальных областях [Livanov et al., 1977; Книпст, 1993; Klimesch et al., 1997; Kahana et al., 1999; Jensen, Tesche, 2002; Canolty et al., 2006; Guderian et al., 2009] и в субкортикальных структурах [Кабанова и др., 2011; Pare et al., 2002; Nerad, McNaughton, 2006; Magill et al., 2006; DeCoteau et al. 2007]. Тета-ритм участвует в обеспечении процессов внимания [Vinogradova, 1995; Vinogradova, 2001], а также в формировании и извлечении эпизодической и пространственной памяти [Hasselmo, 2005]. Гамма-осцилляции (30–100 Гц) обычно регистрируются одновременно с тета-ритмом в гиппокампе [Bragin et al., 1995; Strogatz, 2003; Montgomery et al., 2008] и в нео-кортексе (чаще всего во фронтальных и париетальных областях [Bouyer et al., 1981; Benhenane 2010]. Гамма-осцилляции, как предполагается, играют роль в механизмах внимания [Fries, 2009; Jutras et al., 2009] и удержания информации в памяти во время выполнения когнитивных задач [Sauseng et al., 2009; Sridharan, Knudsen, 2015].
Ключевым компонентом когнитивных процессов являются взаимодействия между структурами мозга [Ливанов и др., 1967; Книпст, 1993; Engel et al., 2001; Igarashi et al., 2014]. Накапливающиеся данные указывают, что одним из фундаментальных механизмов коммуникации между структурами являются ритмы мозга; это доказывается синхронизацией ритмических локальных полевых потенциалов (ЛПП) в различных областях мозга при выполнении задач, где необходимо участие внимания и памяти [Ливанов и др., 1967; Takehara-Nishiuchi McNaughton, 2008; Livanov et al., 1977; Fell et al., 2001; Varela et al., 2001; Buzsáki, 2004; Павлыгина и др., 2007; Vinck et al., 2016; Astasheva et al., 2016; Bott et al., 2016] и возрастающей при этом кросс-корреляции нейронных осцилляций [Tabuchi et al., 2000; Engel et al., 2001; Igarashi et al., 2014]. Синхронизация ЛПП в разных областях мозга оказывает существенное влияние на способность этих областей взаимодействовать друг с другом [Astasheva et al., 2016]; объединяя активность пространственно разделенных, но функционально связанных нейронов, она также обеспечивает механизмы формирования клеточных ансамблей и их пространственно-временнóй координации [Harris et al., 2003; Colgin, Moser 2010; Wiley, 2010; Igarashi et al., 2014]. Кроме того, осцилляции могут рассматриваться как механизм ритмических изменений нейронной возбудимости [Volgushev et al., 1998; Fries, 2005].
Гипотеза о коммуникации разных областей мозга посредством синхронизации [Livanov et al., 1977; Fries, 2005] в настоящее время широко поддерживается [Jensen et al., 2007; Mitchell et al., 2008; Rutishauser et al., 2010; Wang, 2010; Colgin et al., 2009; Colgin, 2011, 2015; Doesburg et al., 2012; Igarashi et al., 2014; Astasheva et al., 2016]. По этой гипотезе анатомические связи могут быть эффективными или неэффективными в зависимости от наличия или отсутствия ритмической синхронизации [Fries, 2005; Bastos et al., 2015].
КОГЕРЕНТНОСТЬ ТЕТА- И ГАММА-РИТМОВ
Кортикальные структуры генерируют большое количество осцилляций различной частоты. В то время как высокочастотные ритмы отражают локальную нейронную активность, в низкочастотных осцилляциях участвуют широко распределенные по мозгу области [Canolty, Knight, 2010]. Внешние для организма или внутренние стимулы могут вызывать синхронизацию ритмов и таким образом приводить к формированию нового явления более высокого порядка, известного как фазовое сцепление (“phase coupling”), или фазовая когерентность. Стандартная фазовая когерентность выявляет относительное постоянство фазовых различий между двумя осцилляциями одной и той же частоты, т.е. внутричастотную когерентность, или синхронность (см. рис. 1) [Rodriguez еt al., 1999; Lachaux et al., 1999; Hurtado et al., 2004]. Было показано, что фазовая когерентность отражает различные когнитивные процессы у людей [Canolty et al., 2006; Cavanagh et al., 2009; Axmacher et al., 2010], обезьян [Canolty et al., 2010], крыс [Montgomery, Buzsáki, 2007; Montgomery et al., 2008; Tort et al., 2008, 2009; Nàcher et al., 2013] и мышей [Wulff et al., 2009]. Интенсивное изучение внутричастотной фазовой когерентности между осцилляциями в разных областях мозга обусловлено ее предполагаемой ролью в регуляции межструктурных коммуникаций [Womelsdorf et al., 2006; Siegel et al., 2009; Gregoriou et al., 2009]. В то же время кросс-частотная фазовая когерентность (см. рис. 2) может быть механизмом для регуляции коммуникаций в разных пространственно-временных шкалах [Palva et al., 2005; 2010; Holz et al., 2010].
Рис. 1.
Эпилептогенез вызывает изменения тета-когерентности между различными областями мозга. (а) – иллюстрация внутричастотной (фазово-фазовой) тета-когерентности между двумя областями мозга (i и ii); слева: синтетические данные, используемые для иллюстрации тета-ритма; справа: спектр тета-когерентности в двух структурах определяет степень фазовой “сцепленности”. (б) – репрезентативная активность в гиппокампе эпилептической крысы, регистрируемая в str. pyramidale (sp), lacunosum moleculare (slm), и moleculare (ml) во время ходьбы. (в) – поведенческие данные для крыс во время исполнения задачи на эпизодическую память. Показано распределение времени исследования объектов во время теста для контрольной и эпилептической групп; на вставке представлены объекты, используемые в задаче (А1 – старый знакомый стационарный объект, А2 – старый знакомый перемещенный, В1 – недавний, т.е. показанный через 50 мин, знакомый стационарный объект, B2 – недавний знакомый перемещенный). Видно, что в контрольной группе время изучения разных объектов сильно разнится, но практически не отличается в эпилептической группе. (в') – фазовая тета-когерентность между слоями гиппокампа (SLM и ML) во время исследования крысами объектов в тесте на эпизодически-подобную память; показаны средние значения тета-когерентности для всей сессии (сплошная линия) и стандартное отклонение (пунктирные линии) в контроле (слева) и у эпилептических животных (справа). Заметно, что в контрольной группе крыс тета-когерентность между слоями гиппокампа во время исследования объектов высокая, но значительно снижается в эпилептической группе. (г) – тета-активность в гиппокампе и МСДБ синхронно возрастает в период перед судорогами. Слева направо: гистограммы спектральной плотности (СП) для ЛПП гиппокампа; автокоррелограммы (АК) и СП для нейронной активности МСДБ; вверху – контроль, внизу – перед судорогами. На СП: по оси ординат – спектральная мощность, относительные единицы; по оси абсцисс – частота, от 0.5 до 30 Гц; на АК: по оси ординат – величина постоянной времени затухания ритмического процесса (ĩ или индекс ритмичности), с; по оси абсцисс – время, от 0 до 1 с. Адаптировано с получением разрешения из Buzsaki and Watson, 2012 (а), Inostrosa et al., 2012 (б) и (в), и Kitchigina, Butuzova, 2009 (г).
Fig. 1. Theta coherence between brain areas changes during epileptogenesis. (а) – Illustration of within-frequency phase coupling of theta oscillations between two brain areas (i and ii); to the left: synthetic data used for theta rhythm illustration; to the right: coherence spectrum between two signals can determine the strength of theta phase coupling. (б) – Representative hippocampal activity of an epileptic rat recorded in the stratum pyramidale (sp), lacunosum moleculare (slm), and moleculare (ml) during walking. (в) – Behavioral data for rats during the performance the episodic-like memory task. Distribution of exploratory times per object in the test phase for the control and epileptic groups. The inset represents the object configuration in the task (А1 – old familiar stationary; А2 – old familiar displaced, В1 – recent (shown 50 min later) familiar stationary, B2 – recent familiar displaced). (в') – Theta coherence between hippocampal SLM–ML layers during exploration of each individual object in the episodic-like memory task; the mean values of theta coherence per object within the mean (solid line) and standard deviation (discontinuous lines) for the whole session in the control and epileptic animals are shown. (г) – Theta activity increase synchronously in the hippocampus and MSDB before seizures. From left to the right: spectral histograms (SP) for hippocampal LFP; autocorrelograms (AC) and SP for neuronal activity of MSDB; above – background, below – before seizures. Adapted with permission from Buzsaki and Watson, 2012 (а), Inostrosa et al., 2012 (б) and (в), and Kitchigina, Butuzova, 2009 (г).
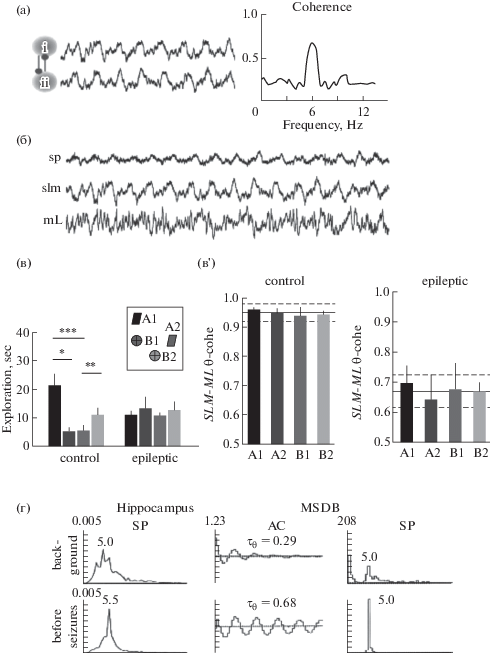
Рис. 2.
Тета–гамма кросс-частотная когерентность (КЧК) и ее нарушение у крыс с моделью БА. Схематическая иллюстрация кросс-частотной фазово-фазовой (а) и фазово-амплитудной (б) когерентностей. (а) – гамма-осцилляции в двух областях мозга (i and ii) синхронизируются гиппокампальным (HI) тета-ритмом (слева). Видно, что гамма волны возникают в одной и той же фазе тета-волны. (б) – схематическая модель фазово-амплитудной кросс-частотной сцепленности. Гамма осцилляции имеют бóльшую амплитуду на возбудительной фазе тета-волны (близко к вершине), чем на тормозной фазе тета-волны (близко к впадине). (в) – амплитуда гамма-осцилляций в поле СА3 гиппокампа возрастает по мере обучения; показано распределение гамма-амплитуды в зависимости от фазы тета-волны в течение первых двадцати проб (слева) и в течение последних двадцати проб (справа). (г) – сверху вниз: Оригинальные ЛПП (вверху), фильтрованные тета (4–12 Гц) и гамма (25–100 Гц) осцилляции, огибающая гамма-волн, тета-фаза у АРР23 и нормальных (non-tg) крыс; представлены репрезентативные сигналы от 5 животных каждого генотипа. (д) – фазово-амплитудные гистограммы (модуляция гамма-амплитуды фазой тета-волны) для гиппокампальных ЛПП, регистрируемых у здоровых крыс и у крыс с моделью БА (APP23, помечено звездочками); видно отсутствие модуляции у АРР23 крыс. (е) – индекс модуляции, рассчитанный для фазово-амплитудного распределения, показанного на (д). Адаптировано с получением разрешения из Buzsáki and Watson, 2012 (а), Kirihara et al., 2012 (б) Tort et al., 2009 (в) и Ittner et al., 2014 (г–е).
Fig. 2. Theta–gamma cross-frequency coupling (CFC) and its alteration in a rat model of TLE. (а) – Schematic illustration of cross-frequency phase-phase coupling. Gamma oscillations in two brain areas (i and ii) are synchronized by the hippocampal (HI) theta (to the left). One can see that the gamma waves always arise at the same phase of the theta wave. (б) – A schematic model of phase–amplitude cross-frequency coupling. Gamma oscillations are large in the excitatory phase of theta wave (near the top) and small in the inhibitory phase of theta wave (near the bottom). (в) – Theta modulation of gamma amplitude in the CA3 region during exploration increases with learning; the mean gamma amplitude per theta phase averaged over the first (left) and last 20 trials is shown (right). (г) – Raw EEG (LFP), band pass filtered signals for theta (4–12 Hz) and gamma (25–100 Hz) oscillations, gamma amplitude envelope and theta phase in APP23 and non-transgenic (non-tg) mice. Representative signals from 5 animals per genotype are shown. (д) – Phase–amplitude plot computed for hippocampal LFPs recorded in non-transgenic (non-tg) and APP23 mice (means ± s.e.m.). (е) – Modulation index computed for the phase–amplitude distributions shown in (д). Adapted with permission from Buzsáki and Watson, 2012 (а), Kirihara et al., 2012 (б) Tort et al., 2009 (в) и Ittner et al., 2014 (г-е, Open Access).
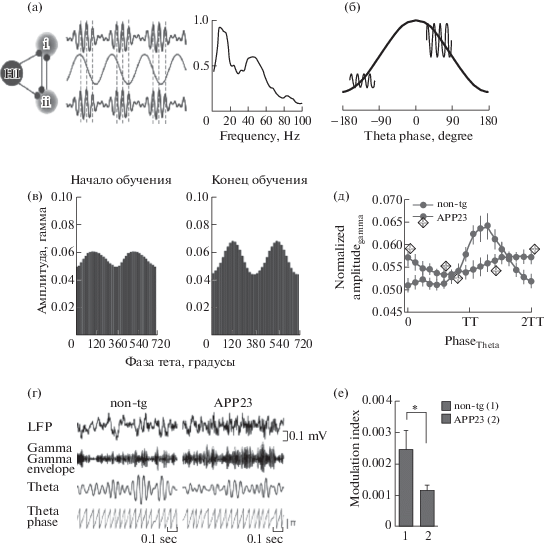
Одним из наиболее изученных явлений когерентности тета- и гамма-осцилляций является фазово-фазовая кросс-частотная когерентность (фазово-фазовая КЧК), или “n:m” фазовое сцепление, когда несколько гамма-циклов (m) совмещаются с одним тета-циклом (n) (рис. 2 (а)) [Tass et al., 1998; Belluscio et al., 2012; Zheng and Zhang, 2013; Xu et al., 2013; 2015; Zheng et al., 2016]. Фазово-фазовая КЧК обеспечивает, как предполагается, физиологический механизм для взаимодействия существенно различающихся по частоте активностей. Явление фазово-фазовой тета-гамма когерентности означает, что гамма-волны определенной частоты всегда возникают в одну и ту же фазу тета-волн. Предполагается, что фазово-фазовая КЧК принимает участие в когнитивных процессах, таких, как внимание и память [Lisman, Idiart, 1995; Schack, Weiss, 2005; Sauseng et al., 2008, 2009; Holz et al., 2010; Fell, Axmacher, 2011]. Более десяти лет назад Лисманом и Идиартом была предложена интересная нейронная модель, в которой емкость рабочей памяти (“7 ± 2”) определялась количеством гамма-циклов в одном тета-цикле (“n:m”) [Lisman, Idiart, 1995]. Позднее эта гипотеза была детализирована [Jensen, Lisman, 2005; Lisman, 2005; Lisman, Buzsáki, 2008; Lisman, Jensen, 2013], но ее сущность осталась той же. Самые последние исследования указывают на то, что гиппокамп действительно использует механизм кодирования информации посредством фазово-фазовой тета-гамма когерентности [Belluscio et al., 2012; Zheng, Zhang, 2013; Xu et al., 2013, 2015; Zheng et al., 2016; но см. Scheffer-Teixeira, Tort, 2016]. Кроме этого, как предполагается, фазово-фазовая тета-гамма КЧК может облегчать передачу информации, а также зависящую от спайкового тайминга пластичность [Markram et al., 1997; Fell, Axmacher, 2011].
Вторым не менее хорошо изученным явлением когерентности тета- и гамма-осцилляций является фазово-амплитудная кросс-частотная когерентность (фазово-амплитудная КЧК), или “nested”-осцилляции, когда амплитуда гамма-волны зависит от того, в какую фазу тета-волны она возникает (рис. 2, б) [Soltesz, Deschênes, 1993; Bragin et al., 1995; Lisman, Idiart, 1995; Buzsáki et al., 1983; Canolty et al., 2006; Tort et al., 2008, 2009, 2010; Sauseng et al., 2009; Canolty, Knight, 2010; Scheffer-Teixeira et al., 2016]. Это явление отражает главный “закон”, лежащий в основе иерархической системы мозговых ритмических генераторов: он заключается в том, что фаза более медленных колебаний модулирует амплитуду более быстрых осцилляций [Bragin et al., 1995; Buzsáki, 2006; Buzsaki, Mizuseki, 2014]. В гиппокампе гамма- и тета-осцилляции обычно обнаруживают значительную фазово-амплитудную КЧК [Tort et al., 2008, 2009; Newman et al., 2013]. В здоровом мозге людей и грызунов степень тета-гамма “сцепленности” возрастает по мере обучения при выполнении когнитивных задач (рис. 2, в) [Tort et al., 2008; 2009; Lega et al., 2016].
Известно, что многие нейрологические и психиатрические заболевания ассоциируются с нарушениями осцилляторной активности [Kirihara et al., 2012; Froriep et al., 2012; Bakker, et al., 2012; Inostroza et al., 2013; Lauren et al., 2015]. Однако несмотря на то что эта проблема изучается уже несколько десятилетий, механизмы нарушения когерентности ритмов, лежащих в основе развития таких патологий, как БА и ВЭ, остаются не раскрытыми.
В настоящем обзоре анализируются клинические и экспериментальные данные по изменениям тета- и гамма-осцилляций при височной эпилепсии и болезни Альцгеймера у людей и на моделях этих заболеваний. Такой анализ может пролить свет на возможные связи между нейронными повреждениями и нарушениями осцилляций при этих болезнях, а также помочь разработке новых подходов для ранней диагностики рассматриваемых патологий.
НАРУШЕНИЯ КОГЕРЕНТНОСТИ ТЕТА- И ГАММА-РИТМОВ ТИПИЧНО ДЛЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА И ВИСОЧНОЙ ЭПИЛЕПСИИ
Изменения когерентности ритмов в эпилептическом мозге
Эпилепсия является заболеванием, характеризующимся возрастанием нейронной возбудимости, клеточной гибелью и образованием аберрантных связей в мозге (см. обзор [Morimoto et al., 2004]). Наиболее распространенной и фармакологически резистентной формой фокальной эпилепсии у взрослых считается височная эпилепсия. У пациентов с ВЭ выявлено селективное и значительное нарушение эпизодической (автобиографической) памяти, для которой характерно то, что запоминаемые события располагаются во временнóм контексте во время кодирования информации [Dupont et al., 2000]. Так же, как и люди, эпилептические животные в значительной степени обнаруживают селективное повреждение эпизодически-подобной памяти при сохранности у них других форм гиппокамп-зависимой памяти [Helmstaedter, 2000; Burgess et al., 2002; Tulving, 2002].
Гиппокампальная сеть. Анализ ЛПП, зарегистрированных в гиппокампе у здоровых пациентов во время исполнения тестов на эпизодическую память (память на “что, где, когда” происходило), выявил резкое повышение гамма-осцилляций перед успешным запоминанием событий [Lega et al., 2011; 2016]. В то же время в гиппокампе пациентов с ВЭ, напротив, в этом случае наблюдалось снижение мощности гамма-ритма [Lega et al., 2015]. Таким образом, при исполнении тестов на эпизодическую память у людей с ВЭ обнаружена реверсия типичных изменений гиппокампальных гамма-осцилляций. Кроме этого, было показано [Inostroza et al., 2013], что у крыс с дефицитом эпизодически-подобной памяти, вызванным введением каината (которое провоцирует развитие эпилептического очага), в гиппокампе наблюдается редукция мощности тета-ритма и тета-когерентности вдоль оси поле CA1-зубчатая фасция. Конкретнее, у эпилептических животных наблюдалось снижение когерентности тета-осцилляций между str. lacunosum-moleculare (SLM) поля CА1 и str. moleculare (ML) зубчатой фасции по сравнению с контрольными крысами (рис. 1 (б), (в)). Inostroza и соавт. полагают, что поскольку в SLM и ML заканчиваются прямые входы от III и II слоев энторинальной коры и от контралатерального гиппокампа, то дискоординация этих входов у эпилептических животных является наиболее вероятной причиной нарушения у них эпизодической памяти [Inostroza et al., 2013].
Гиппокампально-энторинальная сеть. Известно, что ключевым механизмом эпизодической памяти является синхронизация нейрональной активности в сети гиппокамп-энторинальная кора; именно этот механизм повреждается при ВЭ [Helmstaedter, 2002]. У свободно-подвижных эпилептических животных с каиновой моделью ВЭ было выявлено изменение тета-когерентности между энторинальной корой (ЭК) и зубчатой фасцией (ЗФ) во время интериктальной фазы [Froriep et al., 2012]. А именно, у эпилептических мышей тета-активность в ЭК отставала по фазе от активности в ЗФ; в то же время у здоровых животных активность между ЭК и ЗФ была синхронной, что проявлялось в отчетливом внутричастотном фазовом сцеплении. Используя компьютерную модель, авторы предположили, что гибель гиппокампальных нейронов нарушает взаимодействия гиппокампальных подсетей, что вызывает ЭК-ЗФ дискоординацию [Froriep et al., 2012].
В здоровом мозге входы от медиальной и латеральной ЭК через темпороаммонов и перфорирующий пути вызывают разряды гиппокампальных нейронов, которые отражают интегрированное представительство пространственной [O’Keefe, Nadel, 1978; Komorowski et al., 2009; Neunuebel, Knierim, 2012] и временнóй информации [Mankin et al., 2012; Kraus et al., 2013; Kitamura et al., 2014], а также недавний опыт [Frank et al., 2000; Wood et al., 2000]. Это нейронное кодирование точно организовано во временнóй шкале, что осуществляется текущими осцилляциями, особенно тета- и гамма-ритмами [Bland, Oddie, 2001; Hasselmo et al., 2002; Huxter et al., 2008; Mizuseki et al., 2009; Easton et al., 2012; Buzsáki, Moser, 2013; Lisman, Jensen, 2013]. Тщательное измерение проксимо-дистальной когерентности тета-активности в дорзальном гиппокампе здоровых и эпилептических крыс выявило, что у нормальных животных более сильная синхронизация между темпороаммоновым и перфорирующим входами наблюдается возле СА3 (в проксимальных локусах), в то время как у эпилептических – возле субикулума (в дистальных локусах) [Lauren et al., 2015]. Этот противоположный тренд у крыс с патологией ассоциировался с реорганизацией темпороаммонова и перфорирующего путей, которая сопровождала выявленную впоследствии гибель гиппокампальных клеток. Lauren и соавт. также продемонстрировали нарушение у эпилептических крыс временнóй координации сигналов, приходящих в гиппокамп от ЭК с задержкой в несколько тета-циклов на проксимальном и дистальном концах гиппокампа. Таким образом, авторы показали, что проксимо-дистальная организация разных входов в гиппокамп от ЭК играет важную роль в функционировании височной области мозга и что в эпилептическом мозге она повреждается [Lauren et al., 2015].
Гиппокампально-префронтальная сеть. Как упоминалось выше, тета- и гамма-осцилляции в норме присутствуют в гиппокампе и медиальной префронтальной коре (мПФК) и синхронно изменяются при выполнении различных когнитивных задач [Tort et al., 2008; Benhenane et al., 2010]. Гиппокампальные тета-волны обычно сцеплены с тета-волнами мПФК [Benhenane et al., 2010] и модулируют гамма-осцилляции в гиппокампе и префронтальной коре во время когнитивного поведения [Siapas et al., 2005; Jones, Wilson, 2005; Tort et al., 2008]. У животных с моделью ВЭ, провоцированной стимуляцией перфорирующего пути, наблюдались аномальные изменения в сети гиппокамп–мПФК при регистрации полевой активности у крыс со спонтанными судорогами [Broggini et al., 2016]. Авторы выявили, что возвратные судороги ослабляют текущий гиппокампальный тета-ритм; в то же время непосредственно перед генерацией самих судорог тета-когерентность между гиппокампом и мПФК сильно возрастает. Одновременно с возрастанием тета-синхронности усиливается кросс-частотная сцепленность между тета в гиппокампе и гамма в мПФК. Используя показатель причинности Грэнжера (Granger causality), авторам удалось показать, что увеличение синхронности осцилляций в гиппокампе и мПФК в преиктальной фазе провоцировалось гиппокампальной сетью [Broggini et al., 2016]. Слишком сильная синхронность между тета в гиппокампе и гамма в префронтальной коре могла быть причиной аномальной пластичности в мПФК сетях [Zheng and Zhang, 2015], которая, как предполагается, в свою очередь вызывала изменения, наблюдаемые у нейронов этой области неокортекса [Tang and Loke, 2010].
Гиппокампально-септальная сеть. Регистрация ЛПП в гиппокампе и медиальном септальном комплексе (медиальное септальное ядро и ядро диагонального пучка Брока, МСДБ) выявила, что в этих областях здорового мозга тета-осцилляции обычно синхронны [Nerad, McNaughton, 2006; Асташева, Кичигина, 2009; Кабанова и др., 2011]. Как правило, амплитуда тета-осцилляций в МСДБ была ниже, чем в гиппокампе, но частота тета-ритма сильно не различалась. Тета-когерентность между гиппокампом и МСДБ была достаточно высокой: фазовый анализ активности у здоровых животных не выявил существенного (<10 мс) однонаправленного сдвига между фазами тета-волн в этих структурах [Nerad, McNaughton, 2006; Кабанова и др., 2011]. У хронических эпилептических животных значительное снижение мощности тета-ритма было обнаружено в гиппокампе [Arabadzisz et al., 2005; Colom et al., 2006; Dugladze et al., 2007; Асташева, Кичигина, 2009; Marcelin et al., 2009] и МСДБ [Синельникова, 2012]; это наблюдалось у разных видов животных и на разных моделях эпилепсии. Кроме этого, на пилокарпиновой модели ВЭ было обнаружено снижение синхронности септальных и гиппокампальных ЛПП [García-Hernández et al., 2010]. Однако на модели ВЭ, генерированной киндлингом перфорирующего пути, было показано повышение тета-синхронности между гиппокампом и МСДБ [Кабанова, 2011]. Более того, на этой модели ВЭ у кроликов наблюдалось драматическое повышение тета-осцилляций одновременно в гиппокампе и МСДБ непосредственно перед (не более чем за 20 с) возникновением судорожной активности (рис. 1 (г) [Kitchigina, Butuzova, 2009]. Это явление напоминает события, показанные для гиппокампально-префронтальной сети перед началом судорог у животных с аналогичной моделью ВЭ [Broggini et al., 2016]. Интересно, что на модели ВЭ, провоцированной у морской свинки киндлингом перфорирующего пути, взаимодействия между гиппокампом и МСДБ при эпилептогенезе изменялись на противоположные: в начале киндлинга МСДБ опережала гиппокамп по фазе тета-волны, а после формирования патологического очага МСДБ отставала от гиппокампа [Кабанова и др., 2011]. В добавление к этому взаимоотношения между ритмическими залпами септальных нейронов и фазами гиппокампальных тета-волн во время спонтанных судорог изменялись на противоположные по сравнению к интериктальными [Kitchigina, Butuzova, 2009], т.е. эти отношения зависели от состояния мозга.
Ранее было показано, что естественный тета-ритм, вызванный, например, сенсорными стимулами, предотвращает возникновение судорог во время действия эпилептогенных факторов [Colom et al., 2006; Kitchigina, Butuzova, 2009]. В то же время чрезмерная тета-синхронность между МСДБ и гиппокампом приводила к генерации судорожной активности [Kitchigina, Butuzova, 2009]. Таким образом, для предотвращения развития судорог необходим строгий контроль уровня тета-синхронности в системе гиппокамп-МСДБ.
Нарушение когерентности ритмов при болезни Альцгеймера и на моделях БА
Изменения тета- и гамма-ритмов в мозге с БА патологией. БА представляет собой прогрессирующее нейродегенеративное заболевание, при котором наблюдаются необратимые нарушения когнитивных функций, особенно памяти. Этиология БА неизвестна, и в настоящее время в медицине отсутствуют надежные способы лечения этого заболевания. В начале этого века появилась так называемая “амилоидная гипотеза” [Selkoe, 2000; Palop, Mucke, 2010], в которой предполагается, что бета амилоидный (Aβ) пептид, главный компонент амилоидных бляшек, ответственен за нарушения когнитивных функций при БА [Palop, Mucke, 2010; Francis et al., 2010]. Однако в последние годы этой гипотезе были противопоставлены факты, свидетельствующие о том, что в основе этиологии БА могут лежать нарушения метаболизма белка АРР (amyloid precursor protein), являющегося предшественником бета амилоида и концентрирующегося в нейронных синапсах, а также прогрессирование этих нарушений за счет параллельно развивающейся патологии тау-белка (см. обзор [Kametani, Hasegawa, 2018]). Более того, недавно было обнаружено, что амилоидные бляшки выявляют способность связывать вновь образующиеся бета-амилоиды [Gureviciene et al., 2017], т.е. обладают протекторным свойством.
При БА нарушаются различные формы памяти [Didic et al., 2011]. Однако они нарушаются и при других нейродегенеративных заболеваниях. Предполагается, что выраженный пространственный дефицит в некоторой степени может помочь идентифицировать пациентов с большим риском развития БА и отличить их от субъектов с другими болезнями, при которых также нарушается память [Lithfous et al., 2013]. У людей и грызунов пространственное представительство в мозге ассоциируется с модуляцией тета-ритма и тета-гамма сцепленности [Huxter et al., 2003; Bott et al., 2016]. По данным ряда работ, у пациентов с БА, в противоположность субъектам с нормальным старением, в активности кортикальных структур обнаруживается возрастание мощности медленных осцилляций (в частности, тета-ритма) и снижение мощности быстрых осцилляций (гамма-ритма) [Herrmann, Demiralp, 2005; van der Hiele et al., 2007; Czigler et al., 2008; Moretti et al., 2010]. Однако в других работах, напротив, были обнаружены возрастание мощности гамма-ритма и отсутствие изменений тета-осцилляций [Caravaglios et al., 2010; Wang et al., 2017]. Некоторые авторы отмечали, что изменения в ЭЭГ пациентов с различными видами деменции также могут характеризоваться подобными сетевыми нарушениями [Herrmann, Demiralp, 2005]. Кроме этого, в противоположность данным, полученным на пациентах, у трансгенных мышей с моделью БА (Tg5xFAD мышей) было выявлено снижение выраженности как тета, так и гамма-ритмов; в этом случае снижение мощности осцилляций предшествовало падению способности к обучению пространственным задачам [Schneider et al., 2014]. Более того, у трансгенных APP23 мышей, другой модели БА, продемонстрированы изменения ритмов (по сравнению с контролем), противоположные таковым у БА пациентов: значительное снижение мощности тета-ритма (имеющего частоту ~10 Гц) и повышение мощности гамма-осцилляций (с частотой 25–50 Гц) [Ittner et al., 2014]. Таким образом, снижение или повышение выраженности тета- и гамма-осцилляций как таковых может быть неспецифичным для этой патологии [Herrmann, Demiralp, 2005].
Изменения тета-гамма когерентности показательны для мозга с патологией, характерной для болезни Альцгеймера. Возможно, что наиболее убедительными свидетельствами нарушений ритмов в мозге с БА патологией являются изменения тета-гамма КЧК. Так, у людей с БА выявлено повышение кросс-частотной сцепленности между гамма и низкочастотными (в частности, тета) полосами активности по сравнению со здоровыми добровольцами [Wang et al., 2017]. Кроме этого, у взрослых трансгенных (APP23) свободно перемещающихся мышей наблюдалось нарушение модуляции гамма-осцилляций гиппокампальным тета-ритмом (рис. 2 (г–е) [Ittner et al., 2014]. Важно, что эти изменения наблюдались до образования амилоидных бляшек. Более того, у значительной части мышей с другой моделью БА (трансгенных TgCRND8 мышей) в месячном возрасте обнаружено существенное изменение тета–гамма сцепленности в субикулуме, структуре, являющейся выходной для гиппокампа [Goutagny et al., 2013]. Такое “разъединение” обнаруживалось до проявления каких-либо гистологических нарушений, в частности, образования амилоидных бляшек. Кроме этого, у используемых в экспериментах молодых мышей (в возрасте 1 мес) экспрессируется чрезвычайно низкий уровень бета-амилоида. Goutagny и соавт. [2013] полагают, что нарушение тета–гамма КЧК в субикулуме может рассматриваться как наиболее ранний биомаркер развивающейся БА. Такое предположение противоречит существующей (упоминавшейся выше) гипотезе, где заявлялось, что дефицит памяти и сетевые нарушения на моделях БА у животных вызываются гиперпродукцией растворимого бета-амилоида [Palop, Mucke, 2010; Francis et al., 2010; Scott et al., 2012].
Интересно, что хотя АРР, как считается в настоящее время, вовлечен в патофизиологию БА, дефицит этого белка у мышей вызывает нарушения когнитивных функций [Seabrook et al., 1999; Senechal et al., 2008]; это подтверждает, что в здоровом мозге АРР играет существенную роль в работе нейронных сетей. В недавнем исследовании у нокаутных по АРР мышей была обнаружена существенно сниженная тета–гамма сцепленность ЛПП, регистрируемых в дорзальном гиппокампе и париетальной коре; кроме этого, у этих нокаутных мышей была значительно нарушена гиппокампально-префронтальная КЧК [Zhang et al., 2016]. Эти изменения могут играть роль в возникновении когнитивных нарушений у животных с дефицитом АРР. Таким образом, APP важен для взаимодействия ритмов, генерируемых в различных полосах частот. Факты, изложенные выше, возможно означают, что между функционированием АРР в здоровом мозге и мозге с БА патологией существует лишь очень тонкая граница.
В работе Tanninen и соавт. [2017] было протестировано, является ли агрегация гиперфосфорилированного тау-белка в энторинальной коре (как пре-клинического признака БА) причиной нарушения координации ЛПП между эфферентными для этой области структурами – гиппокампом и прелимбической мПФК. У здоровых животных было выявлено усиление фазово-фазовой сцепленности тета- и гамма-осцилляций в этих двух областях во время ассоциативного обучения (крысы обучались ассоциировать два стимула, разделенные коротким временным интервалом). В отличие от нормальных крыс, у тау-экспрессирующих животных в гиппокампе и мПФК обнаружено значительное ослабление вызванного стимулом тета-ритма. Кроме этого, несмотря на то что сохранялось нормальное запоминание, связанная с обучением сцепленность осцилляций между гиппокампом и мПФК снижалась; в то же время в пределах mPFC усиливалась тета–гамма фазово-амплитудная когерентность. Авторы полагают, что тау-агрегация в энторинальной коре вызывает во время обучения аберрантную активность в обширных нейронных сетях, в которые вовлечена эта структура [Tanninen et al., 2017]. Полученные результаты указывают на нарушения нейронных осцилляций в преклинической стадии развития БА, что может приводить к прогрессированию заболевания.
СХОДСТВА И РАЗЛИЧИЯ НАРУШЕНИЙ В МОЗГЕ С НЕЙРОПАТОЛОГИЯМИ, ХАРАКТЕРНЫМИ ДЛЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА И ВИСОЧНОЙ ЭПИЛЕПСИИ
Сходство в нарушениях осцилляторной активности в БА/ВЭ мозге (в частности, нарушения тета-гамма когерентности в гиппокампально-кортикальных сетях) позволяет предполагать, что эти заболевания имеют некоторые общие свойства.
Потенциальная связь между ВЭ и БА подтверждается экспериментальными и клиническими данными. Так, старение является общим и хорошо установленным фактором риска для эпилепсии и БА [Armon et al., 2000; Maguire, Frith, 2003; Amatniek et al., 2006; Bernardi et al., 2010; Born, 2015; Chan et al., 2015]. Кроме этого, БА может быть важной причиной развития эпилепсии, что показано у пожилых людей [Armon et al., 2000; Bird et al., 2005; Bernardi et al., 2010; Palop, Mucke, 2016] и у животных с моделью БА [Bezzina et al., 2015; Chan et al., 2015]. У пациентов с БА фактор риска для развития судорог или других форм эпилептиформной активности в 5–10 раз выше, чем у таковых с другими заболеваниями [Amatniek et al., 2006]. Хотя судорожная патология раньше рассматривалась как вторичная по отношению к БА, затем было показано, что активность нейронов регулирует их чувствительность к бета-амилоидам [Palop et al., 2007; Palop and Mucke, 2010; Bero et al., 2011]; более того, повышенная нейронная возбудимость увеличивает генерацию Aβ [Cirrito et al., 2008]. Эпилептиформная активность может способствовать развитию когнитивных нарушений, а редукция эпилептиформных разрядов в гиппокампе улучшает когнитивную деятельность у пациентов с амнезией [Bakker et al., 2012]. Сходные признаки когнитивных и поведенческих нарушений при ВЭ и БА описаны в недавней работе [Chin, Scharfman, 2013].
Накопленные клинические данные указывают на большое число случаев возникновения ВЭ как сопутствующего заболевания у БА пациентов: становится все более явным, что БА ассоциируется с нейрональной гипервозбудимостью, являющейся одной из основных причин развития эпилепсии [Eichler, Meier, 2008; Noebels, 2011; Saito et al., 2012; Varga et al., 2014]. Гипервозбудимость, так же как сетевая гиперсинхронность в эпилептическом мозге, связаны с сильной активацией NMDA рецепторов [Abdul-Ghani еt al., 1996; Albowitz еt al., 1997; Akaike, Himori, 2002; Ahmed et al., 2005; Medeiros, Moraes, 2014; Amiri еt al., 2016]. В частности, показано, что неселективный антагонист NMDA рецепторов MK801 может снижать возбудимость и повышать судорожный порог у животных, которым вводился пентилентетразол [Ahmed et al., 2005; Amiri еt al., 2016]. Напротив, в экспериментах на животных с моделью БА (трансгенных АРР23 мышах) MK801 существенно повышал гиперсинхронность в гиппокампе, хотя у контрольных животных это не выявлялось [Ittner et al., 2014]. Это позволяет считать, что активация NMDA рецепторов в гиппокампе трансгенных APP мышей ослабляет гиперсинхронизацию и эпилептиформную активность. Таким образом, значение NMDA рецепторов может быть различным в мозге с ВЭ и БА патологиями.
В гиппокампе, одном из основных локусов гибели нейронов в мозге с БА или ВЭ, сетевая гиперсинхронизация и эпилептиформная активность могут быть результатом формирования обширных аберрантных межнейронных связей. Такое патологическое ремоделирование было обнаружено как у эпилептических, так и у трансгенных APP мышей [Palop et al., 2007; Palop, Mucke, 2010; Vogt et al., 2011]. Аберрантная реконструкция может быть причиной изменений осцилляторной активности и когерентности ритмов мозга у пациентов с ВЭ либо БА патологиями.
ЗАКЛЮЧЕНИЕ
Известно, что основной проблемой диагностики нейродегенеративных заболеваний является выявление нейронных повреждений на начальных стадиях их развития. К настоящему времени имеются определенные достижения в использовании таких методов в ранней диагностике ВЭ и БА, как измерения цереброспинальной жидкости и плазмы, а также позитронно-эмиссионная томография. Однако остается большая потребность в биомаркерах, которые отражали бы изменения в функционировании мозга в течение очень коротких интервалов времени, таких, как миллисекунды, чтобы получить информацию о прогрессирующем когнитивном дефиците [Yener, Başar, 2013]. Магнитоэнцефалография (позволяющая неинвазивно с высокой точностью локализовать источники нейронной активности, в том числе патологической), дающая наибольшее временнóе разрешение, при использовании когерентного анализа в комбинации с визуализацией мозга, дающей большое пространственное разрешение, может быть перспективным подходом для ранней диагностики этих заболеваний. Так, при эпилептизации мозга выявлены специфические нарушения взаимодействий тета- и гамма-ритмов в гиппокампальной, гиппокампально-энторинальной, гиппокампально-префронтальной и гиппокампально-септальной сетях. На модели БА обнаружено существенное изменение тета–гамма сцепленности в субикулуме, структуре, являющейся выходной для гиппокампа; кроме этого, показана сниженная тета–гамма когерентность между гиппокампом и париетальной корой, а также между гиппокампом и префронтальной корой.
Возможно, что в будущем специфические нарушения когерентности будут служить четким маркером повреждения селективных групп нейронов в мозге и позволят направлять терапевтические воздействия строго к определенным нейронным локусам для предотвращения развития болезни, избегая в то же время возникновения побочных эффектов. Кроме клинического аспекта, исследования нарушений когерентных осцилляций будут способствовать более глубокому пониманию механизмов развития БА и ВЭ и механизмов функционирования мозга в целом.
Работа была поддержана грантом РФФИ (№ 18-015-00157-а) и совместным грантом РФФИ и Министерства инноваций и инвестиций Московской области (№ 17-44-500312 р_а).
Список литературы
Асташева Е.В., Кичигина В.Ф. Активация глутаматергической системы медиальной септальной области ускоряет эпилептогенез. Журн. высш. нерв. деят. 2009. Т. 59 (6): 749–754.
Виноградова О.С., Кичигина В.Ф., Кудина Т.А., Кутырева Е.В. Осцилляторные тета процессы в нейронах септо-гипокампальной системы и их модуляция стволовыми структурами. Успехи современной биологии. 2000. 120: 103–112.
Кабанова И.В. Когерентный и фазовый анализ тета осцилляций в септо-гиппокампальной системе при эпилептогенезе. Магистерская диссертация. Московский физико-технический институт (Государственный университет). 2011.
Кабанова И.В., Синельникова В.В., Попова И.Ю., Кичигина В.Ф., Алиев Р.Р. Когерентный и фазовый анализ тета осцилляций в септо-гиппокампальной системе во время судорог. Журн. Высш. нерв. деят. 2011. 61: 763–768.
Книпст И.Н. Слагаемые коркового биоэлектрического поля больших полушарий головного мозга. Докл. акад. наук 1993. 333: 801–804.
Ливанов М.Н., Кравченко В.А., Королькова Т.А. Функциональное значение корреляции биопотенциалов коры головного мозга. Бюлл. эксп. биол. мед. 1967. 63: 14–19.
Павлыгина Р.А., Сахаров Д.С., Давыдов В.И. ЭЭГ характеристики, определяющие качество последующего распознавания зрительных образов. Физиология человека 2007. 33: 34–40.
Синельникова В.В. Диссертация на соискание степени кандидата биологических наук. Институт теоретической и экспериментальной биофизики РАН. 2012.
Abdul-Ghani A.S., Attwell P.J., Bradford H.F. The anti-epileptic effect of 3-aminopropylarsonate on electrically-kindled and N-methyl-D-aspartate-kindled amygdala. Brain Res. 1996. 742: 305–312.
Adler G., Brassen S., Jajcevi A. EEG coherence in Alzheimer’s dementia. J. Neural. Transm. Vienna, Austria. 2003. 110: 1051–1058.
Ahmed M.M., Ari M., Chikuma T., Kato T. Pentylenetetrazol-induced seizures affect the levels of prolyl oligopeptidase, thimet oligopeptidase and glial proteins in rat brain regions, and attenuation by MK-801 pretreatment. Neurochem. Int. 2005. 47: 248–259.
Akaike N., Himori N. Excitatory amino acid-elicited tonic convulsions in mice and N-methyl-D-aspartate receptor activation: role of Ca(2+) influx and involvement of intracellular Ca(2+)-dependent biochemical processes. Pharmacology 2002. 66: 136–143.
Albowitz B., König P., Kuhn U. Spatiotemporal distribution of intracellular calcium transients during epileptiform activity in guinea pig hippocampal slices. J. Neurophysiol. 1997. 77: 491–501.
Amatniek J.C., Hause W.A., DelCastillo-Castaneda C., Jacobs D.M., Marde K., Bell K., Albert M., Brandt J., Stern Y. Incidence and predictors of seizures in patients with Alzheimer’s disease. Epilepsia 2006. 47: 867–872.
Amiri S., Haj-Mirzaian A., Amini-khoe H., Momeny M., Shirzadian A., Rahimi-Balaei M., Zarrinrad G., Ghazi-Khansari M., Azizi R., Dehpour A.R., Mehr S.E. NMDA receptor antagonists attenuate the proconvulsant effect of juvenile social isolation in male mice. Brain Res Bull. 2016. 121: 158–168.
Arabadzisz D., Antal K., Parpan F., Emri Z., Fritschy J.-M. Epileptogenesis and chronic seizures in a mouse model of temporal lobe epilepsy are associated with distinct EEG patterns and selective neurochemical alterations in the contralateral hippocampus. Exp. Neurol. 2005.194: 76–90.
Armon C., Peterson G.W., Liwnicz B.H. Alzheimer’s disease underlies some cases of complex partial status epilepticus. J. Clin. Neurophysiol. 2000. 17: 511–518.
Astasheva E., Kitchigina V., Astashev M. Analysis of oscillations in the brain during sensory stimulation: cross-frequency relations. Lecture Notes in Computer Science. 2016. 9719: 673–680.
Axmacher N., Henseler M.M., Jensen O., Weinreich I., Elger C.E., Fell J. Cross-frequency coupling supports multi-item working memory in the human hippocampus. Proc. Natl. Acad. Sci. U.S.A. 2010. 107: 3228–3233.
Bastos A.M., Vezol J., Fries P. Communication through coherence with inter-areal delays. Curr. Opin. Neurobiol. 2015. 31: 173–80.
Bakker A., Krauss G.L., Albert M.S., Speck C.L., Jones L.R., Stark C.E., et al. Reduction of hippocampal hyperactivity improves cognition in amnestic mild cognitive impairment. Neuron 2012. 74: 467–474.
Belluscio M.A., Mizuseki K., Schmidt R., Kempter R., Buzsáki G. Cross-frequency phase-phase coupling between θ and γ oscillations in the hippocampus. J. Neurosci. 2012. 32: 423–35.
Benchenane K., Peyrache A., Khamass M., Tierney P.L., Gioanni Y., Battaglia F.P., Wiener S.I. Coherent theta oscillations and reorganization of spike timing in the hippocampal- prefrontal network upon learning. Neuron 2010. 66: 921–936.
Bernardi S., Scaldaferri N., Vanacore N., Trebbastoni A., Francia A., D’Amico A., Prencipe M. Seizures in Alzheimer’s disease: a retrospective study of a cohort of outpatients. Epileptic Disord. 2010. 12: 16–21.
Bero A.W., Yan P., Roh J.H., Cirrito J.R., Stewart F.R., Raichle M.E., Lee J.M., Holtzman D.M. Neuronal activity regulates the regional vulnerability to amyloid-beta deposition. Nat. Neurosci. 2011. 14: 750–756.
Bezzina C., Verret L., Juan C., Remaud J., Halley H., Rampon C., Dahan L. Early onset of hypersynchronous network activity and expression of a marker of chronic seizures in the Tg2576 mouse model of Alzheimer’s disease. PLoS One. 2015. 10. e0119910.
Bird S.B., Orr P.G., Mazzola J.L., Brush D.E., Boyer E.W. Levofloxacin-related seizure activity in a patient with Alzheimer’s disease: assessment of potential risk factors. J. Clin. Psychopharmacol. 2005. 25: 287–288.
Bland B. The physiology and pharmacology of hippocampal formation theta rhythms. Prog Neurobiol. 1986. 26: 1–54.
Bland B.H., Oddie S.D. Theta band oscillation and synchrony in the hippocampal formation and associated structures: the case for its role in sensorimotor integration. Behav Brain Res. 2001. 127: 119–136.
Born H.A. Seizures in Alzheimer’s disease. Neuroscience. 2015. 286: 251–263.
Bott J.B., Muller M.A., Jackson J., Auber J., Casse J.C., Mathis C., Goutagny R. Spatial Reference Memory is Associated with Modulation of Theta-Gamma Coupling in the Dentate Gyrus. Cereb. Cortex. 2016. 26: 3744–3753.
Bouyer J., Montaron M., Rougeu A. Fast fronto-parietal rhythms during combined focused attentive behaviour and immobility in cat: cortical and thalamic localizations. Electroencephalogr. Clin. Neurophysiol. 1981. 51: 244–252.
Bragin A., Jandó G., Nádasdy Z., Hetke J., Wise K., Buzsáki G. Gamma (40–100 Hz) oscillation in the hippocampus of the behaving rat. J. Neurosci. 1995. 15: 47–60.
Broggini A.C.S., Esteves I.M., Romcy-Pereira R.N., Leite J.P., Leão R.N. Pre-ictal increase in theta synchrony between the hippocampus and prefrontal cortex in a rat model of temporal lobe epilepsy. Exp Neurol. 2016. 279: 232–242.
Burgess N., Maguire E., O’Keefe J. The human hippocampus and spatial and episodic memory. Neuron 2002. 35: 625–41.
Buzsáki G. Theta oscillations in the hippocampus. Neuron 2002. 33: 325–340.
Buzsáki G. Large-scale recording of neuronal ensembles. Nat. Neurosci. 2004. 7: 446–451.
Buzsáki G., Leung L.W., Vanderwolf C.H. Cellular bases of hippocampal EEG in the behaving rat. Brain Res. 1983. 287: 139–171.
Buzsáki G., Moser E.I. Memory, navigation and theta rhythm in the hippocampal-entorhinal system. Nat. Neurosci. 2013. 16: 130–138.
Buzsáki G., Wang X.J. Mechanisms of gamma oscillations. Annu. Rev. Neurosci. 2010. 35: 203–225.
Canolty R., Edward E., Dala S., Soltan M., Nagarajan S., Kirsch H., Berger M., Barbaro N., Knight R. High gamma power is phase-locked to theta oscillations in human neocortex. Science. 2006. 313: 1626–1628.
Canolty R.T., Knight R.T. The functional role of cross-frequency coupling. Trends Cogn. Sci. 2010. 14: 506–515.
Caravaglios G., Castro G., Costanzo E., Di Maria G., Mancuso D., Muscoso E.G. Theta power responses in mild Alzheimer’s disease during an auditory oddball paradigm: lack of theta enhancement during stimulus processing. J. Neural Transm. 2010. 117: 1195–1208.
Cavanagh J.F., Cohen M.X., Allen J.J. Prelude to and resolution of an error: EEG phase synchrony reveals cognitive control dynamics during action monitoring. Neurosci. 2009. 29: 98–105.
Chan J., Jones N.C., Bush A.I., O’Brien T.J., Kwan P. A mouse model of Alzheimer’s disease displays increased susceptibility to kindling and seizure-associated death. Epilepsia. 2015. 56: e73–77.
Chin J., Scharfman H.E. Shared cognitive and behavioral impairments in epilepsy and Alzheimer’s disease and potential underlying mechanisms. Epilepsy Behav. 2013. 26: 343–351.
Colgin L.L. Oscillations and hippocampal-prefrontal synchrony. Curr. Opin. Neurobiol. 2011. 21: 467–474.
Colgin L.L. Theta-gamma coupling in the entorhinal-hippocampal system. Curr. Opin. Neurobiol. 2015. 31: 45–50.
Colgin L.L., Denninger T., Fyhn M., Hafting T., Bonnevie T., Jensen O., Moser M.B., Moser E.I. Frequency of gamma oscillations routes flow of information in the hippocampus. Nature. 2009. 462: 353–357.
Colgin L.L., Moser E.I. Gamma oscillations in the hippocampus. Physiology (Bethesda). 2010. 25: 319–329.
Colom L.V., Garcia-Hernandez A., Castaceda M.T., Perez-Cordova M.G., Garrido-Sanabria E.R. Septohippocampal networks in chronically epileptic rats: potential antiepileptic effects of theta rhythm generation. J. Neurophysiol. 2006. 95: 3645–3653.
Czigler B., Csikos D., Hidasi Z., Anna Gaal Z., Csibri E., Kis E., Salacz P., Molnar M. Quantitative EEG in early Alzheimer’s disease patients – power spectrum and complexity features. Int. J. Psychophysiol. 2008. 68: 75–80.
DeCoteau W.E., Thorn C., Gibson D.J., Courtemanche R., Mitra P., Kubota Y., Graybiel A.M. Learning-related coordination of striatal and hippocampal theta rhythms during acquisition of a procedural maze task. Proc. Nat.l Acad. Sci. U. S. A. 2007. 104: 5644–5649.
Didic M., Barbeau E.J., Felician O., Tramoni E., Guedj E., Poncet M., Ceccaldi M. Which memory system is impaired first in Alzheimer’s disease? J. Alzheimers Dis. 2011. 27: 11–22.
Doesburg S.M., Vinette S.A., Cheung M.J., Pang E.W. Theta-Modulated Gamma-Band Synchronization Among Activated Regions During a Verb Generation Task. Front. Psychol. 2012. 1431: 77–85.
Dugladze T., Vida I., Tort A.B., Gross A., Otahal J., Heinemann U., Kopel N.J., Glovel T. Impaired hippocampal rhythmogenesis in a mouse model of mesial temporal lobe epilepsy. Proc. Natl. Acad. Sci. USA. 2007. 104: 17530–17535.
Dupon S., Van de Moortele P., Samson S., Hasboun D., Poline J., Adam C., Lehéricy S., Le Bihan D., Samso Y., Baulac M. Episodic memory in left temporal lobe epilepsy: a functional MRI study. Brain. 2000. 123: 1722.
Easton A., Douchamps V., Eacot M., Lever C. A specific role for septohippocampal acetylcholine in memory? Neuropsychologia. 2012. 50: 3156–3168.
Eichler S.A., Meier J.C. E-I balance and human diseases – from molecules to networking. Front. Mol. Neurosci. 2008. 1, 2. eCollection.
Engel A., Fries P., Singer W. Dynamic predictions: oscillations and synchrony in top-down processing. Nat. Rev. Neurosci. 2001. 2: 704–716.
Fell J., Axmacher N. The role of phase synchronization in memory processes. Nat. Rev. Neurosci. 2011.12: 105–118.
Fell J., Klaver P., Lehnertz K., Grunwald T., Schaller C., Elger C.E., Fernández G. Human memory formation is accompanied by rhinal-hippocampal coupling and decoupling. Nat. Neurosci. 2001. 4: 1259–1264.
Francis B.M., Kim J., Barakat M.E., Fraenk S., Yucel Y.H., Peng S., Michalski B., Fahnestock M., McLaurin J., Mount H.T. Object recognition memory and BDNF expression are reduced in young TgCRND8 mice. Neurobiol. Aging. 2010. 33: 555–563.
Frank L.M., Brown E.N., Wilson M. Trajectory encoding in the hippocampus and entorhinal cortex. Neuron. 2000. 27: 169–178.
Fries P. A mechanism for cognitive dynamics: neuronal communication through neuronal coherence. Trends Cogn. Sci. 2005. 9: 474–480.
Fries P. Neuronal gamma-band synchronization as a fundamental process in cortical computation. Ann. Rev. Neurosci. 2009. 32: 209–224.
Friston K.J. Another Neural Code? Neuroimage. 1997. 5: 213–220.
Froriep U.P., Kumar A., Cosandier-Rimélé D., Häussler U., Kilias A., Haas C.A., Eger U. Altered Ɵ coupling between medial entorhinal cortex and dentate gyrus in temporal lobe epilepsy. Epilepsia. 2012. 53: 1937–1947.
Garcia-Hernandez A., Bland B.H., Facell J.C., Colom L.V. Septohippocampal networks in chronic epilepsy. Exp. Neurol. 2010. 222: 86–92.
Goutagny R., Gu N., Cavanagh C., Jackson J., Chabot J.-G., Quirion R., Krantic S., Williams S. Alterations in hippocampal network oscillations and theta-gamma coupling arise before Aβ overproduction in a mouse model of Alzheimer’s disease. Eur. J. Neurosci. 2013. 37: 1896–1902.
Gregoriou G.G., Gotts S.J., Zhou H., Desimone R. High-frequency, long-range coupling between prefrontal and visual cortex during attention. Science. 2009. 324: 1207–1210.
Guderian S., Schott B.H., Richardson-Klavehn A., Düzel E. Medial temporal theta state before an event predicts episodic encoding success in humans. Proc. Natl. Acad. Sci. USA 2009. 106: 5365–5370.
Gureviciene I., Gurevicius K., Mugantseva E., Kislin M., Khiroug L., Tanila H. Amyloid Plaques Show Binding Capacity of Exogenous Injected Amyloid-β. J. Alzheimers Dis. 2017. 55: 147–157.
Harris K.D., Csicsvari J., Hirase H., Dragoi G., Buzsáki G. Organization of cell assemblies in the hippocampus. Nature. 2003. 424: 552–556.
Hasselmo M.E. What is the function of hippocampal theta rhythm? – Linking behavioral data to phasic properties of field potential and unit recording data. Hippocampus. 2005. 15: 936–949.
Hasselmo M.E., Bodelόn C., Wyble B.P. A proposed function for hippocampal theta rhythm: separate phases of encoding and retrieval enhance reversal of prior learning. Neural Comput. 2002. 14: 793–817.
Helmstaedter C. Effects of chronic epilepsy on declarative memory systems. Prog. Brain Res. 2002. 135: 439–53.
Herrman C.S., Demiralp T. Human EEG gamma oscillations in neuropsychiatric disorders. Clin. Neurophysiol. Off. J. Int. Fed. Clin. Neurophysiol. 2005. 116: 2719–2733.
Holz E.M., Glennon M., Prendergast K., Sauseng P. Theta–gamma phase synchronization during memory matching in visual working memory. NeuroImage. 2010. 52: 326–335.
Hurtado J.M., Rubchinsky L.L., Sigvardt K.A. Statistical method for detection of phase-locking episodes in neural oscillations. Journal of Neurophysiology 2004. 91: 1883–1898.
Huxter J., Burgess N., O’Keefe J. Independent rate and temporal coding in hippocampal pyramidal cells. Nature 2003. 425: 828–832.
Huxter J.R., Senior T.J., Allen K., Csicsvari J. Theta phase-specific codes for two-dimensional position, trajectory and heading in the hippocampus. Nat. Neurosci. 2008. 11: 587–594.
Igarashi K.M., Lu L., Colgin L.L., Moser M.B., Moser E.I. Coordination of entorhinal-hippocampal ensemble activity during associative learning. Nature. 2014. 510: 143–147.
Inostroza M., Brotons-Mas J.R., Laurent F., Cid E. de la Prida L.M. Specific impairment of “what-where-when” episodic-like memory in experimental models of temporal lobe epilepsy. J. Neurosci. 2013. 33: 17749–17762.
Ittner A.A., Gladbach A., Bertz J., Suh L.S., Ittner L.M. p38 MAP kinase-mediated NMDA receptor-dependent suppression of hippocampal hypersynchronicity in a mouse model of Alzheimer’s disease. Acta Neuropathol. Commun. 2014. 2: 149.
Jensen O., Kaiser J., Lachaux J.P. Human gamma-frequency oscillations associated with attention and memory. Trends Neurosci. 2007. 30: 7317–7324.
Jensen O., Lisman J.E. Hippocampal sequence-encoding driven by a cortical multi-item working memory buffer. Trends Neurosci. 2005. 28: 67–72.
Jensen O., Tesche C. Frontal theta activity in humans increases with memory load in a working memory task. Eur. J. Neurosci. 2002. 15: 1395–1399.
Jones M.W., Wilson M.A. Theta rhythms coordinate hippocampal-prefrontal interactions in a spatial memory task. PLoS Biol. 2005. 3 (12): e402.
Jutras M.J., Fries P., Buffalo E.A. Gamma-band synchronization in the macaque hippocampus and memory formation. J. Neurosci. 2009. 29: 12521–12531.
van der Hiele K., Vei A.A., van der Welle A., van der Grond J., Westendorp R.G., Bollen E.L., van Buchem M.A., van Dijk J.G., Middelkoop H.A. EEG and MRI correlates of mild cognitive impairment and Alzheimer’s disease. Neurobiol. Aging. 2007. 28: 1322–1329.
Kahana M.J., Sekuler R., Caplan J.B., Kirsche M., Madsen J.R. Human theta oscillations exhibit task dependence during virtual maze navigation. Nature. 1999. 399: 781–784.
Kametani F., Hasegawa M. Reconsideration of amyloid hypothesis and tau hypothesis in Alzheimer’s disease. Front. Neurosci. 2018. 12: 25–36.
O’Keefe J., Nadel L. The hippocampus as a cognitive map. Oxford, UK: Oxford UP. 1978.
Kirihara K., Rissling A.J., Swerdlow N.R., Braff D.L., Light G.A. Hierarchical organization of gamma and theta oscillatory dynamics in schizophrenia. Biol. Psychiatry. 2012. 71: 873–880.
Kitamura T., Pignatelli M., Suh J., Kohara K., Yoshiki A., Abe K., Tonegawa S. Island cells control temporal association memory. Science. 2014. 343: 896–901.
Kitchigina V.F., Butuzova M.V. Theta activity of septal neurons during different epileptic phases: The same frequency but different significance? Exp. Neurol. 2009. 216: 449–458.
Klimesch W., Doppelmayr M., Schimke H. Ripper B. Theta synchronization and alpha desynchronization in a memory task. Psychophysiology. 1997. 34: 169–176.
Komorowski R.W., Manns J.R., Eichenbau H. Robust conjunctive item-place coding by hippocampal neurons parallels learning what happens where. J. Neurosci. 2009. 29: 9918–9929.
Kraus B.J., Robinson R.J. 2nd, White J.A., Eichenbaum H., Hasselmo M.E. Hippocampal “time cells”: time versus path integration. Neuron. 2013. 78: 1090–1101.
Lachaux J.P., Rodriguez E., Martinerie J., Varela F.J. Measuring phase synchrony in brain signals. Human Brain Mapping. 1999. 8: 194–208.
Lauren F., Brotons-Mas J.R., Cid E., Lopez-Pigozz D., Valero M., Gal B., de la Prida L.M. Proximodistal structure of theta coordination in the dorsal hippocampus of epileptic rats. J. Neurosci. 2015. 35: 4760–4775.
Lega B., Burke J., Jacob J., Kahana M.J. Slow-theta-to-gamma phase-amplitude coupling in human hippocampus supports the formation of new episodic memories. Cereb. Cortex. 2016. 26: 268–278.
Lega B., Dionisio S., Bingaman W., Naj I., Gonzalez-Martinez J. The gamma band effect for episodic memory encoding is absent in epileptogenic hippocampi. Clin. Neurophysiol. 2015. 126: 866–872.
Lega B., Jacobs J., Kahana M. Human hippocampal theta oscillations and the formation of episodic memories. Hippocampus. 2011. 22: 748–761.
Lisman J. The theta/gamma discrete phase code occuring during the hippocampal phase precession may be a more general brain coding scheme. Hippocampus. 2005. 15: 913–922.
Lisman J., Buzsáki G. A neural coding scheme formed by the combined function of gamma and theta oscillations. Schizophrenia Bulletin. 34: 2008. 974–980.
Lisman J.E., Jensen O. The theta-gamma neural code. Neuron. 2013. 77: 1002–1016.
Lisman J.E., Idiart M.A. Storage of 7 +/– 2 short-term memories in oscillatory subcycles. Science. 1995. 267: 1512–1515.
Lithfous S., Dufou A., Després O. Spatial navigation in normal aging and the prodromal stage of Alzheimer’sdisease: insights from imaging and behavioral studies. Ageing Res.Rev. 2013. 12: 201–213.
Livanov M.N., Krylov V.Yu., Ostrjakova T.V., Shulgina G.I. Slow field potential oscillations as one of the basic mechanisms of integrative activity of neurons [proceedings]. Act. Nerv. Super. (Praha) 1977. 19: 43–44.
Magill P.J., Sharott A., Bolam J.P., Brown P. Delayed synchronization of activity in cortex and subthalamic nucleus following cortical stimulation in the rat. J. Physiol. 2006. 574: 929–946.
Maguire E.A., Frith C.D. Aging affects the engagement of the hippocampus during autobiographical memory retrieval. Brain. 2003.126 (Pt 7): 1511–1523.
Mankin E.A., Sparks F.T., Slayyeh B., Sutherland R.J., Leutge S., Leutgeb J.K. Neuronal code for extended time in the hippocampus. Proc. Natl. Acad. Sci. USA. 2012. 109: 19462–19467.
Marcelin B., Chauvière L., Becker A., Migliore M., Esclapez M., Bernard C. h channel-dependent deficit of theta oscillation resonance and phase shift in temporal lobe epilepsy. Neurobiol. Dis. 2009. 33: 36–47.
Markram H., Lübke J., Frotscher M., Sakmann B. Regulation of synaptic efficacy by coincidence of postsynaptic APs and EPSPs. Science. 1997. 275: 213–215.
Medeiros D.C., Moraes M.F. Focus on desynchronization rather than excitability: a new strategy for intraencephalic electrical stimulation. Epilepsy Behav. 2014. 38: 32–36.
Mitchell D.J., McNaughton N., Flanagan D., Kirk I.J. Frontal-midline theta from the perspective of hippocampal “theta”. Prog. Neurobiol. 2008. 86: 156–185.
Mizuseki K., Sirota A., Pastalkova E., Buzsáki G. Theta oscillations provide temporal windows for local circuit computation in the entorhinalhippocampal loop. Neuron. 2009. 64: 267–280.
Montgomery S.M., Buzsáki G. Gamma oscillations dynamically couple hippocampal CA3 and CA1 regions during memory task performance. PNAS. 2007. 104: 14495–14500.
Montgomery S.M., Sirota A., Buzsáki G. Theta and gamma coordination of hippocampal networks during waking and rapid eye movement sleep. J. Neurosci. 2008. 28, 6731–6741.
Moretti D.V., Pievani M., Geroldi C., Binetti G., Zanetti O., Rossini P.M., Frisoni G.B. EEG markers discriminate among different subgroup of patients with mild cognitive impairment. Am. J. Alzheimers Dis. 2010. 25: 58–73.
Morimoto K., Fahnestock M., Racine R.J. Kindling and status epilepticus models of epilepsy: rewiring the brain. Prog. Neurobiol. 2004. 73: 1–60.
Nácher V., Ledberg A., Deco G., Romo R. Coherent delta-band oscillations between cortical areas correlate with decision making. PNAS. 2013. 110: 15085–15090.
Nerad L., McNaughton N. The septal EEG suggests a distributed organization of the pacemaker of hippocampal theta in the rat. Eur. J. Neurosci. 2006. 24: 155–166.
Neunuebel J.P., Knierim J.J. Spatial firing correlates of physiologically distinct cell types of the rat dentate gyrus. J. Neurosci. 2012. 32: 3848–3858.
Newman E.L., Gillet S.N., Climer J.R., Hasselmo M.E. Cholinergic blockade reduces theta-gamma phase amplitude coupling and speed modulation of theta frequency consistent with behavioral effects on encoding. J. Neurosci. 2013. 33: 19635–19646.
Noebels J. A perfect storm: Converging paths of epilepsy and Alzheimer’s dementia intersect in the hippocampal formation. Epilepsia. 2011. 52 Suppl 1: 39–46.
Palop J.J., Chin J., Roberson E.D., Wang J., Thwin M.T., Bien-L, N., Yoo J., Ho KO., Yu G.Q., Kreitzer A., Finkbeiner S., Noebels J.L., Mucke L. Aberrant excitatory neuronal activity and compensatory remodeling of inhibitory hippocampal circuits in mouse models of Alzheimer’s disease. Neuron. 2007. 55: 697–711.
Palop J.J., Mucke L. Amyloid-b–induced neuronal dysfunction in Alzheimer’s disease: From synapses toward neural networks. Nat. Neurosci. 2010. 13: 812–818.
Palop J.J., Mucke L. Network abnormalities and interneuron dysfunction in Alzheimer disease. Nat. Rev. Neurosci. 2016. 17: 777–792.
Palva J.M., Palva S., Kail K. Phase synchrony among neuronal oscillations in the human cortex. J. Neurosci. 2005. 25: 3962–3972.
Palva J.M., Monto S., Kulashekhar S., Palva S. Neuronal synchrony reveals working memory networks and predicts individual memory capacity. Proc. Natl. Acad. Sci. U.S.A. 2010. 107: 7580–7585.
Pare D., Collins D.R., Pelletier J.G. Amygdala oscillations and the consolidation of emotional memories. Trends Cognit. Sci. 2002. 6: 306–314.
Rodriguez E., George N., Lachaux J.P., Martinerie J., Renault B., Varela F.J. Perception’s shadow: long-distance synchronization of human brain activity. Nature. 1999. 397: 430–433.
Rutishauser U., Ross I.B., Mamelak A.N., Schuman E.M. Human memory strength is predicted by theta-frequency phase-locking of single neurons. Nature. 2010. 464: 903–907.
Saito Y., Inoue T., Zhu G., Kimura N., Okada M., Nishimura M., Kimura N., Murayama S., Kaneko S., Shigemoto R., Imoto K., Suzuki T. Hyperpolarization-activated cyclic nucleotide gated channels: a potential molecular link between epileptic seizures and Aβ generation in Alzheimer’s disease. Mol. Neurodegener. 2012. 7: 50.
Sauseng P., Klimesch W., Gruber W.R., Birbaumer N. Cross-frequency phase synchronization: a brain mechanism of memory matching and attention. NeuroImage. 2008. 40: 308–317.
Sauseng P., Klimesch W., Heise K.F., Gruber W.R., Hol E., Kari A.A., Glennon M., Gerloff C., Birbaumer N., Hummel F.C. Brain oscillatory substrates of visual short-term memory capacity. Curr. Biol. 2009. 19: 1846–1852.
Schack B., Weiss S. Quantification of phase synchronization phenomena and their importance for verbal memory processes. Biological Cybernetics. 2005. 92: 275–287.
Selkoe D.J. Toward a comprehensive theory for Alzheimer’s disease. Hypothesis: Alzheimer’s disease is caused by the cerebral accumulation and cytotoxicity of amyloid b-protein. Ann. N. Y. Acad. Sci. 2000. 924: 17–25.
Scheffer-Teixeira R., Tort A.B. On cross-frequency phase-phase coupling between theta and gamma oscillations in the hippocampus. Elife. 2016. 5: pii: e20515.
Schneider F., Baldau K., Wetzel W., Reymann K.G. Behavioral and EEG changes in male5xFAD mice. Physiol. Behav. 2014. 135: 25–33.
Seabrook G.R., Smith D.W., Bowery B.J., Easter A., Reynolds T., Fitzjohn S.M., Morton R.A., Zheng H., Dawson G.R., Sirinathsinghji D.J., Davies C.H., Collingridge G.L., Hill R.G. Mechanisms contributing to the deficits in hippocampal synaptic plasticity in mice lacking amyloid precursor protein. Neuropharmacology. 1999. 38: 349–359.
Senechal Y., Kelly P.H., Dev K.K. Amyloid precursor protein knockout mice show age-dependent deficits in passive avoidance learning. Behav. Brain Res. 2008.186: 126–132.
Scott L., Feng J., Kiss T., Needle E., Atchison K., Kawabe T.T., Milici A.J., Hajos-Korcsok E., Riddell D., Hajo, M. Age-dependent disruption in hippocampal theta oscillation in amyloid-beta overproducing transgenic mice. Neurobiol. Aging. 2012. 33: 1481: e13–1481.e23.
Siapas A.G., Lubenov E.V., Wilson M.A. Prefrontal phase locking to hippocampal theta oscillations. Neuron. 2005. 46: 141–151.
Siegel M., Warden M.R., Miller E.K. Phase-dependent neuronal coding of objects in short-term memory. Proc. Natl. Acad. Sci. U.S.A. 2009. 106: 21341–21346.
Soltesz I., Deschênes M. Low- and high-frequency membrane potential oscillations during theta activity in CA1 and CA3 pyramidal neurons of the rat hippocampus under ketamine-xylazine anesthesia. J. Neurophysiol. 1993. 70: 97–116.
Sridharan D., Knudsen E.I. Gamma oscillations in the midbrain spatial attention network: linking circuits to function. Curr. Opin. Neurobiol. 2015. 31: 189–198.
Strogatz S.H. Nonlinear Dynamics and Chaos: With Applications to Physics, Biology, Chemistry and Engineering. Cambridge, MA, Perseus Books Publishing. 2003.
Tabuchi E.T., Mulder A.B., Wiener S.I. Position and behavioral modulation of synchronization of hippocampal and accumbens neuronal discharges in freely moving rats. Hippocampus. 2000. 10: 717–728.
Takehara-Nishiuchi K., McNaughton B.L. Spontaneous changes of neocortical code for associative memory during consolidation. Science. 2008. 322: 960–963.
Tang F.R., Loke W.K. Cyto-, axo- and dendro-architectonic changes of neurons in the limbic systemin themouse pilocarpine model of temporal lobe epilepsy. Epilepsy Res. 2010. 89: 43–51.
Tanninen S.E., Nouriziabari B., Morrissey M.D., Bakir R., Dayton R.D., Klein R.L., Takehara-Nishiuchi K. Entorhinal tau pathology disrupts hippocampal-prefrontal oscillatory coupling during associative learning. Neurobiol. Aging 2017. 58: 151–162.
Tass P., Rosenblum M.G., Weule J., Kurths J., Pikovsky A., Volkmann J., Schnitzler A., Freund H-J. Detection of n:m phase locking from noisy data: application to magnetoencephalography. Phys. Rev. Lett. 1998. 81: 3291.
Tort A.B.L., Komorowski R., Eichenbaum H., Kopell N. Measuring phase-amplitude coupling between neuronal oscillations of different frequencies. J. Neurophysiol. 2010. 104: 1195–1210.
Tort A.B.L., Komorowski R. W., Mann, J. R., Kopell N.J., Eichenbaum H. Theta–gamma coupling increases during the learning of item–context associations. Proc. Natl. Acad. Sci. U.S.A. 2009. 106: 20942–20947.
Tort A.B.L., Krame M.A., Thorn C., Gibson D.J., Kubota Y., Graybiel A.M., Kopell N.J. Dynamic cross-frequency couplings of local field potential oscillations in rat striatum and hippocampus during performance of a T-maze task. Proc. Natl. Acad. Sci. U. S. A. 2008. 105: 20517–20522.
Tulving E. Episodic memory: from mind to brain. Annu. Rev. Psychol. 2002. 53: 1–25.
Vanderwolf C. Hippocampal electrical activity and voluntary movement in the rat. Electroencephalogr. Clin. Neurophysiol. 1969. 26: 407–418.
Varela F., Lachaux J., Rodriguez E., Martinerie J. The brain-web: phase synchronization and large-scale integration. Nat. Rev. Neurosci. 2001. 2: 229–239.
Varga E., Juhász G., Bozsó Z., Penke B., Fülöp L., Szegedi V. Abeta (1-42) enhances neuronal excitability in the CA1 via NR2B subunit-containing NMDA receptors. Neural Plast. 2014: 584314.
Vinck M., Bos J.J., Van Mourik-Donga L.A., Oplaat K.T., Klein G.A., Jackson J.C., Gente L.J., Pennart C.M. Cell-type and state-dependent synchronization among rodent somatosensory, visual, perirhinal cortex, and hippocampus CA1. Front. Syst. Neurosci. 2016. 29: 187.
Vinogradova O.S. Expression, control, and probable functional significance of the neuronal theta-rhythm. Prog. Neurobiol. 1995. 45: 523–583.
Vinogradova O.S. Hippocampus as comparator: role of the two input and two output systems of the hippocampus in selection and registration of information. Hippocampus. 2001. 11: 578–598.
Vogt D.L., Thomas D., Galvan V., Bredesen D.E., Lamb B.T., Pimplikar S.W. Abnormal neuronal networks and seizure susceptibility in mice overexpressing the APP intracellular domain. Neurobiol. Aging 2011. 132: 1725–1729.
Volgushev M., Chistiakova M., Singer W. Modification of discharge patterns of neocortical neurons by induced oscillations of the membrane potential. Neuroscience. 1998. 83: 15–25.
Wang X.J. Neurophysiological and computational principles of cortical rhythms in cognition. Physiol. Rev. 2010. 90, 1195–1268.
Wang J., Fang Y., Wang X., Yang H., Yu X., Wang H. Enhanced gamma activity and cross-frequency interaction of resting-state electroencephalographic oscillations in patients with Alzheimer’s disease. Front. Aging Neurosci. 2017. 9: 243.
Wiley B.G. Neural syntax: cell assemblies, synapsembles, and readers. Neuron 2010. 68: 362–385.
Womelsdorf T., Fries P., Mitra P.P., Desimone R. Gamma-band synchronization in visual cortex predicts speed of change detection. Nature. 2006. 439: 733–736.
Wood E.R., Dudchenko P.A., Robitsek R.J., Eichenbaum H. Hippocampal neurons encode information about different types of memory episodes occurring in the same location. Neuron. 2000. 27: 623–633.
Wulff P., Ponomarenko A.A., Bartos M., Korotkova T.M., Fuchs E.C., Bähner F., Both M., Tort A.B., Kopell N.J., Wisden W., Monyer H. Hippocampal theta rhythm and its coupling with gamma oscillations require fast inhibition onto parvalbumin-positive interneurons. Proc. Natl. Acad. Sci. USA. 2009. 106: 3561–3566.
Yener G.G., Başar E. Biomarkers in Alzheimer’s disease with a special emphasis on event-related oscillatory responses. Suppl. Clin. Neurophysiol. 2013. 62: 237–273.
Zheng C., Bieri K.W., Hsiao Y.T., Colgin L.L. Spatial sequence coding differs during slow and fast gamma rhythms in the hippocampus. Neuron. 2016. 89: 398–408.
Zheng C., Zhang T. Alteration of phase-phase coupling between theta and gamma rhythms in a depression-model of rats. Cognitive Neurodynamics. 2013. 7: 167–172.
Zheng C., Zhang T. Synaptic plasticity-related neural oscillations on hippocampus-prefrontal cortex pathway in depression. Neuroscience. 2015. 292: 170–180.
Xu X., Liu C., Li Z., Zhang T. Effects of hydrogen sulfide on modulation of theta-gamma coupling in hippocampus in vascular dementia rats. Brain Topography. 2015. 28: 879–894.
Xu X., Zheng C., Zhang T. Reduction in LFP cross-frequency coupling between theta and gamma rhythms associated with impaired STP and LTP in a rat model of brain ischemia. Frontiers in Computational Neuroscience. 2013. 7: 27.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


