Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 3, стр. 364-381
НАРУШЕНИЕ КОГНИТИВНЫХ ФУНКЦИЙ У КРЫС ВИСТАР В МОДЕЛИ ДОКЛИНИЧЕСКОЙ СТАДИИ БОЛЕЗНИ ПАРКИНСОНА
И. Н. Абдурасулова 1, 2, *, И. В. Екимова 1, М. В. Чернышев 1, А. В. Мацулевич 1, 2, Ю. Ф. Пастухов 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 ФГБНУ “Институт экспериментальной медицины”
Санкт-Петербург, Россия
* E-mail: i_abdurasulova@mail.ru
Поступила в редакцию 15.03.2018
После доработки 23.07.2018
Принята к публикации 24.09.2018
Аннотация
Доклиническая стадия болезни Паркинсона (БП), когда в мозге еще сохранена большая часть дофаминергических нейронов нигростриатной системы и не исчерпаны компенсаторные механизмы, представляет наиболее эффективное “терапевтическое окно”. Поэтому в последние годы большое внимание уделяется поиску ранних маркеров нейродегенеративного процесса и разработке экспериментальных моделей. В задачу исследования входил анализ ранних поведенческих изменений, отражающих нарушения в когнитивной и эмоциональной сферах при моделировании домоторной стадии БП у крыс, и выявление наиболее информативных тестов. Использована разработанная в лаборатории модель пролонгированной (до 21 дня) доклинической стадии БП у крыс на основе нарастающего угнетения убиквитин-протеасомной системы головного мозга, индуцированного двукратным интраназальным введением специфического ингибитора протеасом лактацистина. Для оценки когнитивных нарушений использовали тесты “распознавание новых объектов”, “Y-образный лабиринт” и парадигму “что – где – когда”. Оценку тревожности проводили в тестах “приподнятый крестообразный лабиринт” и “открытое поле”. Установлено, что введение лактацистина ухудшает у крыс пространственную память, эпизодическую память и распознавание нового объекта на фоне транзиторного повышения уровня тревожности. Полученные данные позволяют предполагать, что нарушения в когнитивной и эмоциональной сферах могут быть ранними признаками развития нейродегенерации в головном мозге.
ВВЕДЕНИЕ
Болезнь Паркинсона (БП) является хроническим нейродегенеративным заболеванием. Для клинической стадии БП характерны моторные дисфункции: тремор покоя, мышечная ригидность, гипокинезия и постуральная неустойчивость, которые проявляются вследствие дефицита дофамина в стриатуме после гибели 50–60% дофамин (ДА)-ергических нейронов нигростриатной системы мозга [Угрюмов, 2014; Tissingh et al., 1998]. Позднее начало лечения БП во многом объясняет его неэффективность.
Кроме двигательных дисфункций клиническая стадия БП характеризуется спектром немоторных симптомов – нарушениями в эмоционально-волевой и когнитивной сфере, связанными с дегенерацией мезолимбического и мезокортикального пути [Иллариошкин, 2007]. Предполагается, что именно эти нарушения могут быть ранними маркерами начавшегося нейродегенеративного процесса [Elgh et al., 2009; Mamikonyan et al., 2009]. Доклиническая стадия заболевания, когда в мозге еще сохранена большая часть ДА-нейронов и не исчерпаны компенсаторные механизмы, представляет наиболее эффективное “терапевтическое окно”, поэтому в последние годы большое внимание уделяется изучению тех немоторных симптомов БП, которые предшествуют двигательным нарушениям. Для ускорения разработки технологии доклинической диагностики БП особую актуальность представляют исследования психоэмоциональных нарушений в моделях доклинической стадии БП у животных.
Наиболее часто для этой цели используется модель БП, индуцированная многократными введениями низких доз нейротоксина МФТП (1-метил-4-фенил-1,2,3,6-тетрагидропиридин) обезьянам и грызунам [Le et al., 2014; Mingazov et al., 2017; Schneider, 1990; Tadaiesky et al., 2008; Ugrumov et al., 2011; Verhave et al., 2011]. Однако существенным недостатком МФТП-модели является отсутствие у животных одного из ключевых патоморфологических признаков БП – образования в нейронах черной субстанции телец Леви, подобных тельцам Леви у пациентов с БП и содержащих агрегированный α-синуклеин в качестве одного из основных компонентов. Кроме того, в МФТП-модели слабо выражена дегенерация нейронов в недофаминергических структурах головного мозга, вовлеченных в патогенез БП, поэтому выявляемые немоторные симптомы скорее всего полностью не отражают спектр характерных для БП немоторных нарушений.
В настоящее время общепризнано, что ослабление активности убиквитин-протеасомной системы является одним из ключевых молекулярных механизмов патогенеза БП [Пастухов и др., 2014; Ciechanover et al., 2017; Maiti et al., 2017]. Недавно на основе этого механизма с помощью интраназального введения ингибитора протеасом лактацистина (ЛЦ) создана новая модель дисфункции протеасомной системы головного мозга, имитирующая доклиническую стадию БП у крыс. Модель воспроизводит основные патоморфологические и нейрохимические признаки доклинической стадии БП: допороговый уровень нейродегенерации в нигростриатной и экстранигральных системах головного мозга (обонятельные луковицы, голубое пятно, вентральная область покрышки среднего мозга) по сравнению с уровнем клинической стадии, снижение содержания дофамина в дорсальном стриатуме, не превышающее пороговых значений, отсутствие моторных феноменов, наличие в выживших нейронах телец Леви, развитие нейровоспаления [Екимова и др. 2016a; Плаксина и др., 2017; Карпенко и др., 2017]. Важно отметить, что новая модель ингибирования протеасом головного мозга воспроизводит симптомы нарушений сна, предшествующие клинической стадии БП [Екимова и др. 2016б; Пастухов и др., 2013; Пастухов и др., 2017]. Ранее на этой модели у крыс в качестве раннего признака БП нами выявлено нарушение неассоциативного обучения [Абдурасулова и др., 2017], которое проявлялось при гибели 30% ДА-ергических аксонов в префронтальной коре.
В настоящей работе мы использовали комплекс методов по оценке спектра когнитивных нарушений (пространственную и непространственную память, эпизодическую память) и тревожности, которые, как предполагают, могут выявляться у пациентов с БП на домоторной стадии заболевания [Pfeiffer et al., 2014; Pirogovsky-Turk et al., 2015; Dere et al., 2010; Shiba et al., 2000; Weisskopf et al., 2003; Bower et al., 2010].
Задача исследования – провести поиск ранних поведенческих изменений, отражающих нарушения в когнитивной и эмоциональной сферах поведения при моделировании доклинической стадии БП у крыс, и определить наиболее информативные тесты.
МЕТОДИКА
Животные
Работа выполнена на 22 самцах крыс популяции Вистар в возрасте 7 мес. и массой тела 340–360 г. Манипуляции с животными проводили с соблюдением принципов биоэтических правил. Для моделирования доклинической стадии БП крысам (n = 11) вводили специфический ингибитор ферментативной активности протеасом ЛЦ (Enzo Life Sciences, США) в дозе 100 мкг/8 мкл в каждую ноздрю дважды с недельным интервалом: суммарная кумулятивная доза на одну крысу составила 400 мкг. Контрольной группе животных (n = 11) вводили растворитель ЛЦ (апирогенный фосфатный буфер).
Поскольку в популяции встречаются крысы с высокой и низкой исследовательской активностью, которая связана с уровнем дофамина [Mällo et al., 2007], было проведено “фоновое” тестирование крыс в арене “открытого поля” (см. “методы”), по результатам которого крыс распределили на две равновесные группы с учетом пройденной дистанции (8.7 ± 0.6 м и 8.5 ± 0.7 м), количества стоек (10.8 ± 2.1 и 10.7 ± 2.4) и обследованных “норок” (16.4 ± 3.6 и 15.7 ± 3.1).
Поведенческие тесты
Каждый из тестов по оценке поведения проводился в отдельный день. Крыс за 12 ч до тестирования переносили в помещение, где располагалась соответствующая установка. За 1 ч до теста проводили адаптацию крыс к режиму освещенности. После тестирования каждого животного установки дезодорировали 3% раствором перекиси водорода. Последовательность проведения манипуляций с животными и тестов представлена в табл. 1. Проводилась видеорегистрация тестов с последующей обработкой этологических показателей и траектории локомоции с помощью компьютерной программы видеотрекинга EthoVision® XT (Noldus Inc., USA) и программы ручной обработки видеоматериала RealTimer 1.21 (“НПК Открытая Наука”, Москва) для анализа сложных этологических паттернов.
Таблица 1.
Структура эксперимента Table 1. Structure of the experiment
| Дни | –6 | –5 | –4 | –3 | –2 | –1 | 0 | 1 | 7 | 9 | 10 | 11 | 12 | 14 | 15 | 18 | 19 | 20 | 21 | 22 | 23 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Манипуляции/тесты | хэндлинг | ОП1 | ПКЛ1 | ЛЦ1 | ЛЦ2 | ОП2 | РНО | Y | ПКЛ2 | ЧГК | Y | ОП3 | ПКЛ3 | ||||||||
Примечание: ОП (1–3) – тест “открытое поле”, 1 – фоновое тестирование, 2 и 3 – тестирования после введения лактацистина (ЛЦ) в соответствующий день; ПКЛ (1–3) – тест “приподнятый крестообразный лабиринт”, 1 – фоновое тестирование, 2 и 3 – тестирования после введения ЛЦ в соответствующий день; ЛЦ1 и ЛЦ2 – первое и второе введение ЛЦ; РНО – тест “распознавание новых объектов”; Y – тест “Y- образный лабиринт”; ЧГК – тест “что – где – когда”. Note: OП (1–3) – “open field” test, 1 – background test, 2 and 3 – tests after lactacystin (ЛЦ) administration at the corresponding day. ПКЛ (1–3) – “elevated plus maze” test, 1 – background test, 2 and 3 – tests after lactacystin (ЛЦ) administration at the corresponding day; ЛЦ1 and ЛЦ2 – first and second administration of ЛЦ; РНО – “new object recognition” test; Y – “Y-maze” test; ЧГК – “what – where – when” test.
Тест “открытое поле”
Тест использовался для оценки двигательной и ориентировочно-исследовательской активностей, а также эмоционального состояния (тревожности) животных.
Тестирование проводили в круглой арене (ООО “НПК Открытая наука”, Россия), изготовленной из неламинированного поливинилхлорида черного цвета, с освещенностью 35 лк. Диаметр арены 97 см, высота стенок 42 см, в полу арены проделаны 13 отверстий (“норки”) диаметром 2 см. Область арены поделена на 12 секций периферической (преферентной) зоны и 7 секций центральной (аверсивной) зоны. Длительность теста – 5 мин. Тест проводили 3 раза: 1 – фоновое тестирование (до введений ЛЦ), 2 – тестирование на 9-й день и 3 – на 22-й день после первого введения ЛЦ. Для формирования равноценных групп при фоновом тестировании оценивали показатели: пройденная дистанция, количество стоек и обследованных норок. Для оценки тревожности во всех тестовых сессиях использовали такой показатель, как процентное отношение числа пересеченных центральных секций арены к общему числу секций. Указанный количественный параметр поведения является наиболее информативным при оценке уровня тревожности в тесте “открытое поле” и позволяет исключить возможное влияние двигательной активности и габитуации [Буреш и др., 1991; Asano Y., 1986; Flint 2003; Meyer et al. 2006].
Распознавание новых объектов (РНО)
Тест основан на естественном стремлении грызунов исследовать новое, используется для исследования внимания, измеряет способность животного обнаруживать изменение в физических свойствах объекта или в его пространственном расположении. Выполнение тестовой задачи не требует внешней мотивации, вознаграждения или наказания [Leger et al., 2013]. Животное должно обратить внимание на окружающую среду и запомнить предметы во время ознакомительной сессии, а после 24 ч задержки помнить знакомый объект и отличить его во время теста от нового объекта [Bevins, Besheer 2006].
Тестирование проводили в течение трех дней подряд, на 10-й, 11-й и 12-й дни после первого введения ЛЦ. Для проведения теста использовали арену “открытого поля”, длительность каждой тестовой сессии составляла 7 мин. В первый день крыс приучали к арене, регистрацию параметров не осуществляли. На второй день в противоположных областях арены на расстоянии 30 см от борта размещали 2 идентичных предмета и регистрировали время контакта животных с предметами. Через 24 ч животное снова помещалось в арену, где в тех же позициях были расположены предметы: “домашний объект” (ДО) – предмет первого предъявления, а второй предмет заменен на “новый объект” (НО); регистрировали время контакта с предметами в секундах.
В качестве предъявляемых предметов использовались нейтральные предметы – стеклянные сосуды разной формы (цилиндрические и грушевидные). Для исключения предпочтения одного из предметов половине животных из каждой группы первоначально предъявлялись два предмета № 1, а второй половине группы – два предмета № 2. Затем в качестве “нового” объекта первой половине животных предъявлялся предмет № 2, а второй – предмет № 1 [de Lima et al., 2005; Bertaina-Anglade et al., 2006]. После каждого тестирования арену и предметы обрабатывали 3% раствором перекиси водорода. Две крысы из группы ЛЦ, не обследовавшие предметы в какой-либо день теста, были исключены из анализа.
Коэффициент дискриминации (КД) рассчитывали по формуле: суммарное время обследования НО/(суммарное время обследования НО + суммарное время обследования ДО) *100 [Li et al., 2013].
Y-образный лабиринт
Тест применяется для оценки рабочей пространственной памяти, использована парадигма исследования спонтанного чередования рукавов лабиринта. Тестирование проводили на 14-й и 21-й дни после первого введения ЛЦ.
Установка представляет собой лабиринт с тремя равнозначными рукавами 50 × 16 × 31 см. После помещения крысы в лабиринт, она начинает обследовать новое пространство, поочередно посещая каждый рукав. Регистрировались количество и последовательность заходов крысы в рукава лабиринта за 8 мин теста и вычислялся коэффициент спонтанных альтернаций (Кs) по формуле: Ks = R/A × 100%, где “R” – количество правильных альтернаций (три последовательных входа в рукава лабиринта без повторов), “А” – максимально возможное количество альтернаций (общее количество заходов в рукава минус 2) [Hidaka et al., 2011].
Тест “что – где – когда”
Тест применяется для оценки эпизодической памяти. Использовали парадигму L. Fellini, F. Morellini [2013] в модификации, в качестве аппетентного стимула предъявлялась самка, а вместо агрессивного самца в качестве негативного стимула для запоминания – запах хищника (кота), который вызывает специфическую реакцию страха-тревоги [Rosen et al., 2008]. Тестирование осуществляли в течение трех дней подряд на 18–20-й день после первого введения ЛЦ.
Тест проводили в арене квадратной формы 60 × 60 см с высотой бортов 25 см, освещенностью 35 лк. Арена поделена на три зоны прозрачными перегородками с отверстиями для свободного прохода животного. Каждое животное тестировали 5 раз по 10 мин (рис. 3 (а)). В первый день животное помещалось в арену для адаптации, в углах интереса арены располагались пустые контейнеры. Определялась предпочитаемая животным зона арены (угол). На 2-й день тестирование проводилось дважды: сначала животному в непредпочитаемом углу предъявлялся стимул 1 (самка), во второй угол помещался аналогичный пустой контейнер, регистрировалось время, проведенное в зоне предъявления стимула. Через три часа животное повторно помещалось в арену, в которой в предпочитаемом углу предъявлялся стимул 2 (запах кота), в противоположный угол помещался пустой контейнер, регистрировалось время, проведенное в зоне стимула. На следующий день тестирование также проводилось дважды во время предъявления первого и второго стимула в предыдущий день, но на месте предъявления стимулов были пустые контейнеры. Регистрировалось время, проведенное в каждой зоне, и вычислялся индекс предпочтения (Р) целевой зоны по формуле: Р = время, проведенное в целевой зоне/время, проведенное в зоне пустого контейнера.
Запах кота предъявлялся в виде белых гранул наполнителя с мочой кота, помещенных в прозрачный стеклянный сосуд, соответствующий по размеру очертаниям самки.
Оба стимула при предъявлении накрывались пластиковыми контейнерами с отверстиями для проникновения запахов. В ознакомительной сессии и сессиях без предъявления стимулов использовалась другая пара контейнеров, чтобы избежать случайного попадания остаточных следов запахов.
В отличие от теста “распознавание новых объектов”, где животным предъявлялись нейтральные предметы, в данном тесте для запоминания использовались эмоционально значимые зрительно-обонятельные стимулы: самка (аппетентный стимул) и запах мочи кота (негативный стимул). Известно, что животные способны различать по запаху пол и состояние животных не только своего, но и других видов [Halpin, 1986].
Одна контрольная крыса и одна крыса с ЛЦ не заходили в одну из целевых зон и были исключены из расчета.
Приподнятый крестообразный лабиринт
Тест “приподнятый крестообразный лабиринт” (ПКЛ) предназначен для оценки уровня тревожно-подобного поведения животного [Pellow et al., 1985; Walf et al., 2007], для чего вычисляется соотношение времени, проведенного в открытых рукавах ко времени, проведенному в закрытых рукавах [Lister, 1990; Holmes et al. 2003]. Установка ПКЛ представляла собой крестообразную пластиковую конструкцию, приподнятую на высоту 50 см от пола. Лабиринт состоял из двух закрытых (преферентных) рукавов (ЗР) освещенностью 20 лк и двух открытых (аверсивных) рукавов (ОР) освещенностью 35 лк. Длина каждого из рукавов составляла 50 см с высотой бортов для ЗР 40 см. Тест начинался с помещения животного в центр пересечения четырех рукавов, после чего производилась видеорегистрация в течение 5 мин. Оценивались количественные и временные характеристики активности животного в рукавах лабиринта. Основными параметрами анализа поведения являлись: входы в закрытые рукава, входы в открытые рукава, их сумма и соотношение, а также вытягивание тела в сторону открытых рукавов. Число вытягиваний тела (оценка риска) относится к категории этологических показателей тревожности в ПКЛ наряду с такими показателями, как время и процентное отношение числа входов в “открытые рукава” лабиринта ко всем входам [Molewijk et al., 1995, Rodgers et al., 1995, Calatayud et al., 2004].
Статистический анализ
Статистическую обработку данных осуществляли с помощью программы “Statistica 10.0”. Для выявления различий между группами в тестах, проводимых однократно, использовали однофакторный дисперсионный анализ с апостериорным тестом Фишера, для тестов, проводимых неоднократно, – дисперсионный анализ с повторными измерениями. Примененный статистический критерий приводится в подписях к рисункам. Различия считали достоверными при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Оценка гиппокамп-зависимой непространственной и пространственной памяти
Сравнение средних значений коэффициентов дискриминации (Кд) в тесте “распознавание новых объектов” показало, что введение ЛЦ приводит к нарушению способности дифференцировать “новый” и “старый” объект. В целом Кд в группе ЛЦ был ниже, чем в контрольной группе (F (1; 18) = 5.044; p = 0.039) (рис. 1 (а)), однако отмечалась большая вариативность значений, поэтому были выделены подгруппы (табл. 2).
Рис. 1.
Нарушение распознавания “нового” объекта крысами после введения лактацистина. Обозначения:
ФБР – фосфатно-буферный раствор (контрольная группа, n = 11); ЛЦ – лактацистин (экспериментальная группа, n = 9); (а) – группа, получавшая ЛЦ, все крысы; (б) – группа, получавшая ЛЦ, поделенная
на крыс с ненарушенным распознаванием (ЛЦ1) и с нарушенным распознаванием (ЛЦ2). Данные
представлены как среднее значение ± стандартная ошибка; $\blacktriangle $ – индивидуальные значения, * – отличия от контрольной группы, p < 0.05;  – отличия от контрольной группы и группы ЛЦ1, p < 0.01 (однофакторный дисперсионный анализ с апостериорным тестом Фишера).
– отличия от контрольной группы и группы ЛЦ1, p < 0.01 (однофакторный дисперсионный анализ с апостериорным тестом Фишера).
Fig. 1. Impairment of new object recognition in rats after lactacystin administration. Notations:
ФБР – phosphate buffer solution (control group, n = 11); ЛЦ – lactacystin (experimental group, n = 9); (a) – the group treated with ЛЦ, all rats; (б) – group treated with ЛЦ, divided
into rats with non-impaired/non-disrupted recognition (ЛЦ1) and rats with impaired/disrupted
recognition (ЛЦ2). Data presented as mean ± standard error; $\blacktriangle $ – individual values, * – difference from control group, p < 0.05;  – difference from control group and ЛЦ group, p < 0.01 (one-way ANOVA with post-hoc LSD Fisher test)
– difference from control group and ЛЦ group, p < 0.01 (one-way ANOVA with post-hoc LSD Fisher test)
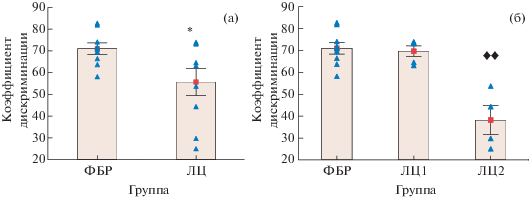
Таблица 2.
Распределение крыс на подгруппы на основании выявленных нарушений в тестах “распознавание новых объектов” и “что – где – когда” Table 2. Distribution of rats to subgroups on the basis of detected disorders in the tests “new objects recognition” and “what – where – when”
| Крысы, получавшие ЛЦ (n = 11) | Тест | |
|---|---|---|
| “распознавание новых объектов” | “что – где – когда” | |
| 1 | ЛЦ1 | ЛЦ1 |
| 2 | ЛЦ2 | ЛЦ2 |
| 3 | ЛЦ2 | ЛЦ2 |
| 4 | ЛЦ1 | ЛЦ1 |
| 5 | ЛЦ1 | ЛЦ1 |
| 6 | ЛЦ2 | Не заходил в целевые зоны (исключен из расчета) |
| 7 | ЛЦ1 | ЛЦ1 |
| 8 | Не обследовал предметы (исключен из расчета) | ЛЦ1 |
| 9 | Не обследовал предметы (исключен из расчета) | ЛЦ2 |
| 10 | ЛЦ2 | ЛЦ1 |
| 11 | ЛЦ1 | ЛЦ2 |
У части крыс (55.6%) Кд, как и в контрольной группе, составил более 50% (ЛЦ1), а у другой части (44.4%) – менее 50% (ЛЦ2) (F(2; 17) = 16.912; p = 0.0001), что свидетельствует о наличии нарушенной способности дифференцировать “старый”/“новый” объект только в группе ЛЦ2 (рис. 1 (б)).
Низкий Кд в подгруппе ЛЦ2 не был связан с низкой исследовательской активностью крыс или предпочтением определенного места, поскольку в ознакомительной сессии эти крысы в равной степени обследовали оба предмета, как и контрольные крысы: число подходов к первому и второму предметам составило соответственно 9.9 ± 2.6 и 9.7 ± 1.4 раз (в контрольной группе – 9.0 ± 1.6 и 8.9 ± 2.3 раз), общее время обследования предметов – 22.6 ± 6.6 с и 26.2 ± 4.8 с (в контрольной группе 24.8 ± 5.1 с и 22.8 ± 7.8 с).
Таким образом, нарушение непространственной памяти (распознавание нового объекта) наблюдалось у 44.4% крыс, получавших ЛЦ.
В тесте “Y-образный лабиринт” у крыс, получавших ЛЦ, нарушения поведения отмечались у большего числа животных, чем в тесте “распознавание новых объектов”.
Двигательная активность (количество заходов в рукава лабиринта) у крыс этой группы была сопоставима с крысами контрольной группы (16.3 ± 1.3 и 14.8 ± 1.3 раз соответственно), однако крысы, получавшие ЛЦ, совершали больше ошибок при чередовании заходов в рукава лабиринта, в результате коэффициент спонтанных альтернаций (Кs) в этой группе составил 64.8% против 80.8% в контрольной группе (F(1; 20)=16.7; p = = 0.0006) (рис. 2 (а)). Низкое значение Кs у крыс подопытной группы свидетельствует о нарушении рабочей пространственной памяти. Доля животных из группы ЛЦ, имевших значение Ks меньше, чем у животных контрольной группы, составила 90.9%.
Рис. 2.
Уменьшение доли правильных спонтанных альтернаций у крыс в тесте “Y-образный лабиринт” после введений ЛЦ. Обозначения: (а) – тест на 14-й день; (б) – тест на 21-й день. ФБР – фосфатно-буферный раствор (контрольная группа, n = 11); ЛЦ – лактацистин (экспериментальная группа, n = 11); Данные представлены как среднее значение ± стандартная ошибка; $\blacktriangle $ – индивидуальные значения, ** – отличия от контрольной группы, p < 0.01 (дисперсионный анализ с повторными измерениями и апостериорным тестом Фишера).
Fig. 2. A decrease in the proportion of correct spontaneous alternations in rats in the “Y-maze” test after the ЛЦ (lactacystin) administration. Notations: (a) – test on the 14-th day; (б) – test on the 21-st day. ФБР – phosphate buffer solution (control group, n = 11); ЛЦ – lactacystin (experimental group, n = 11). Data presented as mean ± ± standard error; $\blacktriangle $ – individual values, ** – difference from control group, p < 0.01 (repeated measures ANOVA with post-hoc LSD Fisher test)
При повторном тестировании через неделю (21-й день) у животных обеих групп отмечалось незначительное снижение двигательной активности, что отразилось меньшим числом заходов в рукава лабиринта, однако коэффициент спонтанных альтернаций в каждой группе достоверно не изменился по сравнению с предыдущим тестом (F (1; 20) = = 0.327; p = 0.574), но, как и в первом тесте, отличался у крыс, получавших ЛЦ, от крыс контрольной группы (p = 0.0017) (рис. 2 (б)). То есть усугубления нарушений памяти у крыс из группы ЛП по сравнению с первым тестом не наблюдалось.
Оценка эпизодической памяти
В использованной парадигме “что – где – когда”, как и в тесте “распознавание новых объектов”, наблюдалась неодинаковая реакция крыс на предъявляемые стимулы и при проверке памятного следа на эти события. Это послужило основанием выделить подгруппы в соответствие с этой реакцией (табл. 2).
60% крыс (ЛЦ1) при предъявлении стимулов (самки или запаха кота) реагировали соответствующей поведенческой реакцией (обнюхивание, контакт с контейнером в первом случае, груминг и избегание – во втором случае). Полученная реакция, как и время, проводимое в зоне предъявления, были сопоставимы с соответствующими показателями крыс контрольной группы: 332 ± 15 с и 356 ± ± 36 с при первом тесте; 220 ± 55 с и 208 ± 49 с при втором тесте соответственно в группе ЛЦ1 и контрольной группе. То есть при предъявлении аппетентного стимула эти крысы проводили в целевой зоне больше времени (55.3% и 59.3% времени теста), чем при предъявлении негативного стимула (36.7% и 34.7% времени теста). Однако, если при предъявлении самки (II сессия) крысы ЛЦ1 демонстрировали сходный с контрольными крысами пространственно-временной паттерн пребывания в разных зонах арены, то при предъявлении запаха кота (III сессия) зона большего пребывания у этих крыс была другая. Контрольные крысы дольше находились в центральной зоне арены, а крысы ЛЦ1 – в зоне, где ранее была самка (p = 0.03). На рис. 3 (б) представлено время, проведенное крысами в разных зонах арены, в процентах от общего времени каждой тестовой сессии.
Остальные крысы, получавшие ЛЦ (ЛЦ2), существенно меньше, чем животные контрольной группы (p = 0.018) и группы ЛЦ1 (p = 0.027) находились в целевой зоне при предъявлении аппетентного стимула. Они лишь 10% времени (60 ± 9 с) обследовали самку и 65.7% времени (394 ± 66 с) проводили в зоне, которую предпочитали в ознакомительной сессии (рис. 3 (б)). Однако при предъявлении запаха кота время пребывания в целевой зоне 2, которая была предпочитаемой в двух предыдущих сессиях, сокращалось до 20% (120 ± 19 с). Достоверных различий по времени пребывания крыс в разных зонах арены в сессию предъявления негативного стимула между группами не наблюдалось.
При проверке памятного следа выявлены достоверные различия между группами по времени нахождения в целевых зонах: IV сессия – F (2; 17) = 9.274; p = 0.009; V сессия – F(2; 17) = 4.433; p = 0.027.
В сессию IV крысы контрольной группы, не обнаружив стимула в целевой зоне 1, вели активную поисковую деятельность, о чем свидетельствует равномерное обследование всех зон арены. Суммарное время, проведенное животными в целевой зоне, составило 208 ± 58 с (34% от времени теста), что в 3 раза больше, чем время, проведенное крысами ЛЦ1 (69 ± 19 с; p = 0.029) и ЛЦ2 (45 ± 12 с; p = = 0.037). В сессию V контрольные крысы большую часть времени – 60.2% (361 ± 41 с) проводили в центральной зоне, практически одинаково посещая обе зоны, где предъявлялись стимулы (рис. 3 (б)). Похожий паттерн демонстрировали крысы ЛЦ2, однако крысы ЛЦ1 больше времени проводили в зоне 2, где ранее был запах кота (269 ± 93 с – 44.8% от времени; p = 0.037), чем крысы других групп.
Рис. 3.
Схема тестирования (а) и время, проведенное в разных зонах арены во все дни тестирования
(б) и индекс предпочтения целевой зоны (в). Обозначения: I – ознакомительная сессия;
II – сессия предъявления самки в зоне 1 ( ); III – сессия предъявления запаха кота в зоне 2 (
); III – сессия предъявления запаха кота в зоне 2 ( ); IV – сессия, проведенная в то же время, что и II, но без предъявления стимула,
целевая зона – 1; V – сессия, проведенная в то же время, что и III, но без предъявления
стимула, целевая зона– 2;
); IV – сессия, проведенная в то же время, что и II, но без предъявления стимула,
целевая зона – 1; V – сессия, проведенная в то же время, что и III, но без предъявления
стимула, целевая зона– 2;  – пустой контейнер; ФБР – фосфатно-буферный раствор (контрольная группа, n = 10); ЛЦ – лактацистин (экспериментальная группа: ЛЦ1 – n = 6; ЛЦ2 – n = 4). В блоке (б) – представлено время в % от общей длительности тестовой сессии
(600 сек), ↔ – различия по времени пребывания в целевой зоне между группами, p < 0.05; однофакторный дисперсионный анализ с апостериорным тестом Фишера; в блоке
(в) – данные представлены как среднее значение ± стандартная ошибка, отличия от контрольной
группы, * – p < 0.05; отличия от контрольной группы и группы ЛЦ1,
– пустой контейнер; ФБР – фосфатно-буферный раствор (контрольная группа, n = 10); ЛЦ – лактацистин (экспериментальная группа: ЛЦ1 – n = 6; ЛЦ2 – n = 4). В блоке (б) – представлено время в % от общей длительности тестовой сессии
(600 сек), ↔ – различия по времени пребывания в целевой зоне между группами, p < 0.05; однофакторный дисперсионный анализ с апостериорным тестом Фишера; в блоке
(в) – данные представлены как среднее значение ± стандартная ошибка, отличия от контрольной
группы, * – p < 0.05; отличия от контрольной группы и группы ЛЦ1,  – p < 0.05 (однофакторный дисперсионный анализ с апостериорным тестом Фишера).
– p < 0.05 (однофакторный дисперсионный анализ с апостериорным тестом Фишера).
Fig. 3. The testing protocol (a) and the time spent in different arena zones for all days
of testing (б) and the preference index of the target zone (в). Notations: I – trial
session; II – session of female presentation in the zone 1 ( ); III – session of cat odor presentation in the zone 2 (
); III – session of cat odor presentation in the zone 2 ( ); IV – session spent at the same time as II, but without stimulus presentation, the
target zone – 1; V – session spent at the same time as III, but without stimulus presentation,
the target zone – 2;
); IV – session spent at the same time as II, but without stimulus presentation, the
target zone – 1; V – session spent at the same time as III, but without stimulus presentation,
the target zone – 2;  – empty container; ФБР – phosphate buffer solution (control group, n = 10); ЛЦ – lactacystin (experimental group: ЛЦ1 – n = 6; ЛЦ2 – n = 4). (б) block presents data indicating time as % of total duration of test session
(600 sec), ↔ – time difference of staying in the target zone between groups, p < 0.05; one-way analysis of variance with a posteriori Fisher’s test. (в) block presents
data as mean ± standard error, difference from control group, * – p < 0.05; difference from control group and ЛЦ1 group,
– empty container; ФБР – phosphate buffer solution (control group, n = 10); ЛЦ – lactacystin (experimental group: ЛЦ1 – n = 6; ЛЦ2 – n = 4). (б) block presents data indicating time as % of total duration of test session
(600 sec), ↔ – time difference of staying in the target zone between groups, p < 0.05; one-way analysis of variance with a posteriori Fisher’s test. (в) block presents
data as mean ± standard error, difference from control group, * – p < 0.05; difference from control group and ЛЦ1 group,  – p < 0.05 (one-way ANOVA with post-hoc LSD Fisher test).
– p < 0.05 (one-way ANOVA with post-hoc LSD Fisher test).
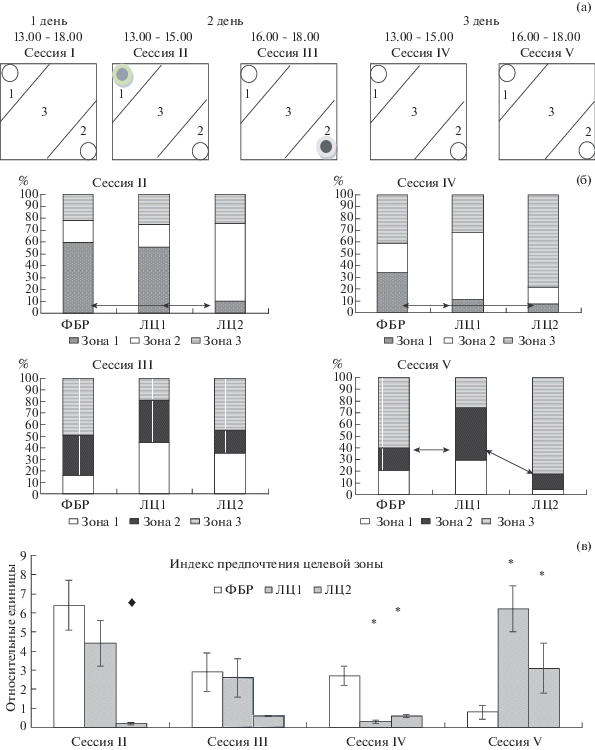
Интересно, что в обеих тестовых сессиях на памятный след крысы, получавшие ЛЦ, демонстрировали сходный пространственно-временной паттерн пребывания в арене, однако крысы ЛЦ1 больше времени проводили в зоне 2, где предъявлялся запах кота, а крысы ЛЦ2 предпочитали центральную зону целевым (82% времени).
Индекс предпочтения целевой зоны (выбор из двух возможных зон) отражает правильность реагирования крыс на предъявляемый стимул и памятный след на этот стимул (рис. 3 (в)). Сходная реакция крыс ЛЦ1 с контрольными крысами при предъявлении стимулов свидетельствует об отсутствии нарушений обоняния у крыс, поэтому их реакция, отличная от контрольных крыс, в тестовых сессиях на памятный след демонстрирует наличие нарушений памяти. Крысы ЛЦ2 не проявляли интереса к самке, но их реакция на негативный стимул показывает, что и у этих животных нарушения обоняния не наблюдалось. Крысы ЛЦ2 реагировали на предъявление стимулов иначе, чем крысы ЛЦ1: для крыс ЛЦ1 более значимым оказался стимул “самка” (половая мотивация), а для крыс ЛЦ2 – стимул “запах кота” (мотивация страха). Однако при проверке памятного следа все крысы, получавшие ЛЦ, реагировали сходным образом, отличным от контрольных крыс. То есть крысы ЛЦ1 и ЛЦ2 частично помнили “что” произошло (значимый стимул разный), но не помнили “где” и “когда”, тогда как контрольные крысы помнили, “что” произошло ранее, “где” произошло и “когда”.
Оценка тревожности
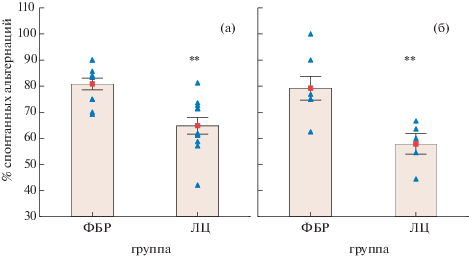
Анализ поведения крыс в тестах “открытое поле” и “приподнятый крестообразный лабиринт” проводился до введения ЛЦ (фоновое тестирование) и затем дважды после введения ЛЦ (см. табл. 1). По данным фонового тестирования между крысами контрольной группы и крысами до введения ЛЦ отсутствовали значимые различия по всем регистрируемым поведенческим показателям. Однако после введения ЛЦ у крыс отмечалось повышение уровня тревожности по сравнению с контрольными крысами в тесте “открытое поле” (F 2; 40) = 4.202; p = 0.37) и “приподнятый крестообразный лабиринт” (F (2; 40) = = 4.0036; p = 0.039) при отсутствии двигательных нарушений.
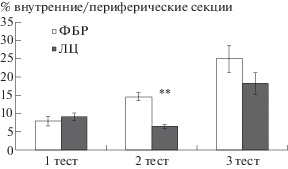
В арене “открытого поля” выявлено повышение уровня тревожно-подобного поведения по сравнению с контрольной группой (ФБР) на девятый день после первого введения ЛЦ. Это выражалось в уменьшении численного значения показателя “отношение числа пересеченных центральных секций арены (7.4 ± 1.8 и 4.2 ± 1 соответственно в группе ФБР и ЛЦ) к числу пересеченных периферических секций (45 ± 5 и 54.5 ± 4.2 соответственно в группе ФБР и ЛЦ)” (p = = 0.002), а также процентного отношения числа пересеченных центральных секций арены (7.4 ± 1.8 и 4.2 ± 1 соответственно в группе ФБР и ЛЦ) к общему числу секций (52.4 ± 10.2 и 58.5 ± 4 соответственно в группе ФБР и ЛЦ) (p = 0.005) (рис. 4). Указанный количественный параметр поведения в тесте ОП характеризует тревожность, поскольку в нем нивелировано влияние двигательной активности [Буреш и др., 1991]. Выявленная тенденция сохранялась и на 21-й день после первого введения ЛЦ, однако не имела статистически значимого подтверждения (рис. 4).
Рис. 4.
Увеличение уровня тревожности у крыс, получавших ЛЦ по показателю процентного отношения числа пересеченных центральных секций арены к общему числу секций в тесте “открытое поле”. Обозначения: ФБР – фосфатно-буферный раствор (контрольная группа, n = 11); ЛЦ – лактацистин (экспериментальная группа, n = 11); ** – различия между группами, p < 0.01 (дисперсионный анализ с повторными измерениями и апостериорным тестом Фишера).
Fig. 4. An increase in anxiety in rats treated with ЛЦ by percentage of the number of sections crossed in central area of the arena to the total number of sections crossed in the “open field” test. Notations: ФБР – phosphate buffer solution (control group, n = 11); ЛЦ – lactacystin (experimental group, n = = 11); ** – significant difference between groups, p < 0.01 (repeated measures ANOVA with post-hoc LSD Fisher test).
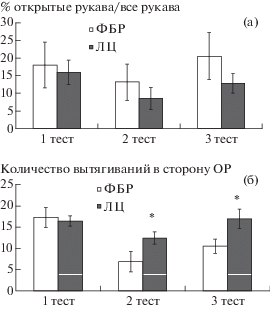
При оценке уровня тревожности в тесте “приподнятый крестообразный лабиринт” нам не удалось обнаружить различий между группами по стандартным показателям, таким как число (табл. 3), время и процентное отношение числа входов в “открытые рукава” лабиринта ко всем входам (рис. 5 (а)) ни в одной из проводимых сессий. Однако в этом тесте, как и в тесте “открытое поле”, выявлен анксиогенный эффект ЛЦ. Статистически значимые различия между исследуемыми группами животных наблюдались уже на ранних сроках (15-й день после первого введения ЛЦ), когда животные, получавшие ЛЦ, демонстрировали большее число вытягиваний тела в сторону “открытых рукавов” по сравнению с контролем (p = 0.032). Данный эффект сохранялся и при последующем тестировании животных на 23-й день (p = 0.033) (рис. 5 (б)).
Таблица 3.
Число входов в рукава ПКЛ Table 3. Number of inputs to arms of a plus maze
| № теста | Закрытый рукав | Открытый рукав | ||
|---|---|---|---|---|
| Контрольная группа | ЛЦ группа | Контрольная группа | ЛЦ группа | |
| 1 | 10.8 ± 1.2 | 10.5 ± 0.9 | 6.3 ± 1.6 | 6.9 ± 1.2 |
| 2 | 6.5 ± 0.9 | 8.1 ± 1.0 | 4.1 ± 1.1 | 6.2 ± 11 |
| 3 | 7.0 ± 1.3 | 9.2 ± 1.8 | 6.3 ± 1.8 | 6.9 ± 1.6 |
Примечание: Данные представлены как среднее значение ± стандартная ошибка; 1 – фоновое тестирование; 2 – тест на 15-й день после введения ЛЦ; 3 – тест на 23-й день после введения ЛЦ. Note: Data are presented as mean ± standard error; 1 – background testing; 2 – test on the 15th day after the administration of ЛЦ; 3 – test on the 23rd day after administration of ЛЦ.
Рис. 5.
Показатели тревожности у крыс после введения ЛЦ в тесте “приподнятый крестообразный лабиринт”. Обозначения: (а) – арифметический показатель соотношения времени в ОР/ЗР, где ОР – открытые рукава, ЗР – закрытые рукава, (б) – количество вытягиваний в сторону ОР; ФБР – фосфатно-буферный раствор (контрольная группа, n = 11); ЛЦ – лактацистин (экспериментальная группа, n = 11); * – различия между группами, p < 0.05 (дисперсионный анализ с повторными измерениями и апостериорным тестом Фишера).
Fig. 5. The level of anxiety in rats after ЛЦ administration in the “elevated plus maze” test. Notations: (a) – arithmetic ratio in the ОР/ЗР, where ОР – open arms, ЗР – closed arms, (б) – number of stretch-attend postures towards the ОР; ФБР – phosphate buffer solution (control group, n = 11); ЛЦ – lactacystin (experimental group, n = 11); * – significant differences between groups, p < 0.05 (repeated measures ANOVA with post-hoc LSD Fisher test)
Таким образом, полученные результаты тестирования крыс в арене “открытого поля” и “приподнятом крестообразном лабиринте” в разные периоды развивающейся доклинической стадии разработанной модели БП показали, что исследуемые животные проявляют признаки усиления тревожно-подобного поведения, причем на более раннем временном отрезке наблюдений они выражены ярче. Следует подчеркнуть, что выявленные нарушения когнитивных функций и повышение тревожности проявлялись до развития моторных симптомов, которые обнаруживаются в наших экспериментах через неделю после третьего введения ЛЦ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе для анализа когнитивных функций и эмоционального поведения использована модель пролонгированной (до 21 дня) доклинической стадии БП у крыс среднего возраста, созданная нами ранее путем интраназального введения ингибитора протеасом ЛЦ [Екимова и др. 2016 a, б; Плаксина и др., 2017; Абдурасулова и др., 2017; Карпенко и др., 2017; Пастухов и др., 2017, Plaksina et al., 2017; Плаксина, Екимова, 2018]. Для модели характерны основные патологические признаки доклинической стадии БП: 1) снижение концентрации дофамина в стриатуме на 56% по сравнению с контролем не достигает порогового снижения на 70–80%, характерного для клинической стадии БП; 2) отсутствие нарушений в моторном поведении животных; 3) уменьшение на 23% количества тел ДА-ергических нейронов в компактной части черной субстанции (кчЧС) и на 13% их аксонов в дорсальном стриатуме по сравнению с контролем не достигает порогового уровня 50–70%, типичного для клинической стадии БП; 4) наличие нейродегенеративного процесса в экстранигральных структурах головного мозга (в обонятельных луковицах, голубом пятне и вентральной области покрышки среднего мозга), поражающихся в доклинической стадии БП; 5) образование в нейронах указанных структур телец Леви, подобных тельцам Леви у пациентов с БП. В проведенном исследовании при моделировании доклинической стадии БП у крыс идентифицирован спектр когнитивных нарушений и эмоционального поведения, которые могут быть проявлениями начавшегося нейродегенеративного процесса. Выявление ранних маркеров БП важно для своевременного начала нейропротективной терапии, а разработка адекватных экспериментальных моделей – для апробации новых лекарственных средств.
Умеренное ухудшение когнитивных функций, по крайней мере, одного когнитивного домена отмечается у многих пациентов на ранней клинической стадии БП при изменении уровня дофамина в стриатуме [Elgh et al., 2009; Mamikonyan et al., 2009; Lam et al., 2011]. Экспериментальные исследования с модуляцией ДА-ергической передачи фармакологическими агентами показали, что как снижение, так и усиление этой функции негативно сказываются на когнитивных процессах, свидетельствуя о необходимости определенного уровня активности этой системы для обеспечения нормальной когнитивной деятельности [Floresco, 2013].
Когнитивные нарушения на ранней клинической стадии БП гетерогенны по проявлению, существенно влияют на качество жизни пациентов, развиваются до моторных проявлений и считаются предвестниками проявления впоследствии деменции [Biundo et al., 2016]. Наиболее часто на стадии БП с незначительными моторными проявлениями у пациентов отмечается ослабление эпизодической памяти (у 69%), исполнительных функций (у 54%), ухудшение зрительно-пространственной ориентации (у 46%), рабочей памяти/внимания (у 35%) [Pfeiffer et al., 2014].
Хотя считается, что БП связана с дегенерацией ДА-ергических нейронов в кчЧС, в последние годы показана также гибель нейронов другой ергичности: холинергических в базальных ядрах Мейнерта [Bohnen, Albin, 2011], норадренергических – в голубоватом пятне [Vazey, Aston-Jones, 2012] и серотонинергических – в ядрах шва [Fox et al., 2009]. Кроме того, обнаружена дизрегуляция глутаматергической системы при БП [Griffith et al., 2008; Marino et al., 2003]. Поскольку все эти нейромедиаторные системы наряду с ДА-ергическими вовлечены в регуляцию когнитивных функций, в основе когнитивного дефицита могут быть нарушения в любой из этих систем, или изменения баланса нейромедиаторов. Использование функциональных методов визуализации при исследовании пациентов с БП показывает вовлечение префронтальной коры [Owen, 2004], гиппокампа [Bruck et al., 2004] и миндалины [Ray, Strafella, 2012] наряду со стриатумом в формирование когнитивного дефицита.
В исследовании нами обнаружено, что при моделировании доклинической стадии БП уже через 2 нед после первого введения ЛЦ у крыс отмечается спектр когнитивных нарушений (ухудшение пространственной и эпизодической памяти), которые характерны для ранней клинической стадии БП. Ранее на этой модели показано также нарушение неассоциативного обучения у крыс [Абдурасулова и др., 2017]. Когнитивный дефицит развивался не у всех крыс, и в разных тестах он мог выявляться не у одних и тех же животных, что вполне логично, поскольку животные не были генетически однородными. Использование популяции крыс Вистар, а не линейных животных в большей степени отражает генетическое разнообразие среди людей и позволяет выявить более полный спектр нарушений.
Наиболее общим проявлением последствий введения ЛЦ являлось ухудшение пространственной ориентации, выявленное в тесте “Y-образный лабиринт” у 91% крыс. Можно полагать, что патофизиологической основой появления ранних симптомов нарушения пространственной памяти при моделировании доклинической стадии БП у крыс является функциональный дефицит ДА-ергической трансмиссии в вентральном и дорзальном стриатуме, префронтальной коре головного мозга, развивающийся вследствие деструктивных изменений в обонятельных луковицах, кчЧС, вентральной области покрышки среднего мозга [Екимова и др., 2016а, Абдурасулова и др., 2017, Плаксина и др., 2017].
Известно, что нарушения в “Y-образном лабиринте” связаны с изменениями внеклеточного уровня дофамина в префронтальной коре [Li et al., 2010]. Ранее нами выявлена гибель трети ДА-ергических нейронов в вентральной тегментальной области среднего мозга и их аксонов в префронтальной коре в этой модели доклинической стадии БП [Абдурасулова и др., 2017], что может быть причиной дисфункции префронтального кортекса.
Уменьшение числа правильных спонтанных альтернаций в “Y-образном лабиринте” у крыс на доклинической стадии может быть также обусловлено гиперактивацией нигростриатной ДА-ергической системы, которая предшествует развитию клинических проявлений БП в данной модели [Плаксина и др., 2017]. Такая ситуация, например, отмечается у трансгенных по гену α-синуклеина Thy1-aSyn мышей (генетическая модель БП), у которых в молодом возрасте (6 мес.) выявляется гиперактивация ДА-ергической системы [Lam et al., 2011], а в возрастном интервале 5–9 мес. наблюдается нарушение чередования посещения рукавов в тесте “Y-образный лабиринт” [Magen et al., 2012]. Кроме того, не исключено, что причиной нарушения пространственной памяти в наших опытах может быть образование в нейронах кчЧС агрегированных комплексов α-синуклеина, которые формируются при моделировании доклинической стадии БП у крыс [Плаксина, Екимова, 2018]. После введения МФТП у мышей не наблюдается образования агрегатов α-синуклеина и не происходит нарушений спонтанных альтернаций [Moriguchi et al., 2012].
Наконец, выявляемый когнитивный дефицит в этот период может быть обусловлен изменениями в активности других нейромедиаторных систем, в частности, ацетилхолинергической. Показано, что нарушения поведения в тестах “Y-образный лабиринт”, а также “распознавание новых объектов” могут быть вызваны повреждением холинергической системы, поскольку введение скополамина – антагониста мускариновых рецепторов – снижает способность животных решать эти задачи [Wall, Messier, 2002; Barker, Warburton, 2008; Botton еt al., 2010]. Имеются данные, что снижение активности холинацетилтрансферазы – ключевого фермента синтеза ацетилхолина – в префронтальной коре способствует проявлению когнитивного дефицита у пациентов с БП [Mattila et al., 2001].
Сходные с выявленными нами изменения когнитивного поведения в тесте “распознавание новых объектов” наблюдали Sy et al. [2010] у крыс после двусторонней инъекции MФТП в кчЧС. При этом показано, что нарушение способности распознавать новый объект сопряжено с возрастанием количества активированной микроглии и снижением плотности пирамидальных нейронов в CA1 поле гиппокампа. Эти данные согласуются с клиническими наблюдениями активации микроглии и увеличением уровней провоспалительных цитокинов, наблюдаемых в кчЧС, скорлупе и гиппокампе пациентов с БП [Sawada et al., 2006].
Обнаруженные нарушения в тесте “распознавание новых объектов” в лактацистиновой модели доклинической стадии БП свидетельствуют о наличии трудностей у крыс в распознавании внешнего вида и особенностей предметов, а снижение числа правильных спонтанных альтернаций – о нарушениях пространственной ориентации. Нарушения визуального распознавания объектов некоторыми авторами рассматриваются в качестве одного из самых ранних симптомов проявления БП [Laatu et al. 2004]. Интересно, что при наличии нарушений распознавания нейтральных объектов распознавание объектов (“что”) с запахом в парадигме “что – где – когда” у крыс сохранялось, однако нарушался контекст объекта (“где” и “когда”). Тест оценивает память, подобную эпизодической памяти человека, нарушение которой – наиболее общий признак ранней стадии БП и предполагается как риск-фактор последующих серьезных когнитивных нарушений, вплоть до деменции [Broeders et al., 2013; Muslimovic et al., 2005]. Исполнительные аспекты эпизодической памяти регулируют внимание и рабочую память и опосредуются фронтостриарными сетями (прежде всего дорсолатеральным префронтальным нейронным кругом), связывающими кору больших полушарий с базальными ганглиями [Davidson et al., 2006; Rugg et al., 2002], которые, в свою очередь, модулируются восходящими системами мезокортикального ДА-ергического пути, а также холинергическими проекциями из базального ядра Мейнерта, серотонинергическими проекциями от ядра шва и норадренергическими проекциями из голубого пятна [Kertesz, McMonagle, 2009].
Поскольку изменения тревожности в тесте “открытое поле” были отчетливее на самых ранних этапах после введения ЛЦ (девятый день), вероятно, обнаруженный анксиогенный эффект у опытных животных является транзиторным и неярко выраженным. По-видимому, ранние проявления тревожности у животных связаны со стресс-реакцией на дезориентацию в пространстве и по мере привыкания к состоянию со временем ослабевают. В пользу этого предположения свидетельствует также тот факт, что у подопытных животных в тесте “приподнятый крестообразный лабиринт” изменения тревожно-подобного поведения наблюдались только по показателю, характеризующему оценку животным степени риска (осторожность), – вытягивания тела в сторону открытых рукавов.
Некоторые авторы рассматривают показатель “число вытягиваний тела в сторону открытого рукава” как проявление тревожности и относят его к достаточно чувствительному, наряду со стандартными показателями оценки тревожности, такими как время и процентное отношение числа входов в “открытые рукава” лабиринта [Molewijk et al., 1995; Rodgers et al., 1995; Calatayud et al., 2004]. Однако более надежно сделать вывод о наличии тревожности можно при условии сочетания изменений по нескольким показателям одновременно [Flint, 2003].
Несовпадения результатов при оценке тревожности в тестах “открытое поле” и “приподнятый крестообразный лабиринт” отмечают также другие авторы [Судаков и др., 2013; Anchan et al., 2014], что может отражать выявление разных аспектов проявления тревожности в этих тестах.
В целом доля животных (42%) с наиболее выраженными признаками повышения тревожно-подобного поведения вписывается в диапазон 25–50%, выявляемый у пациентов с БП по данным разных авторов [Dissanayaka et al., 2010; Goetz, 2010; Leentjens et al., 2011; Nègre-Pagès et al., 2010].
Следует отметить, что у пациентов с только что установленным диагнозом БП повышение тревожности ассоциировано с когнитивными нарушениями [Dissanayaka et al., 2017], что мы наблюдаем у животных в модели доклинической стадии БП, индуцированной ЛЦ. Нейрохимической основой проявления тревожности у крыс в данной модели могут быть деструктивные изменения в НА-ергической системе голубого пятна [Plaksina et al., 2017].
ВЫВОДЫ
1. В модели пролонгированной (до 21 дня) доклинической стадии БП у крыс, созданной на основе нарастающего угнетения убиквитин-протеасомной системы головного мозга путем двукратного интраназального введения специфического ингибитора протеасом ЛЦ, установлено ухудшение пространственной и эпизодической памяти, а также распознавания “нового” объекта. Выявленные нарушения встречаются у экспериментальных животных в разных сочетаниях.
2. Нарушения в когнитивной сфере сопряжены с транзиторным повышением уровня тревожности.
3. Подобранная батарея тестов позволяет наиболее полно оценивать многообразие когнитивного дефицита и эмоциональных нарушений в модели доклинической стадии БП у крыс и может быть использована для мониторинга и оценки эффективности проводимого лечения.
4. Полученные нами данные позволяют предполагать, что нарушения в когнитивной и эмоциональной сферах могут быть ранними признаками развития нейродегенерации в головном мозге и могут быть рекомендованы для клинических исследований для установления их статуса ранних маркеров БП.
Исследование выполнено при поддержке гранта Российского научного фонда (проект № 16-15-00278).
Список литературы
Абдурасулова И.Н., Екимова И.В., Мацулевич А.В., Газизова А.Р., Клименко В.М., Пастухов Ю.Ф. Нарушение неассоциативного обучения у крыс в экспериментальной модели доклинической стадии болезни Паркинсона. ДАН. 2017. 476 (3): 353–356.
Буреш Я., Бурешова О., Хьюстон Д.П. Методики и основные эксперименты по изучению мозга и поведения. 1991. М.: “Высшая школа”. С. 119–122.
Екимова И.В., Плаксина Д.В., Лапшина К.В., Газизова А.Р., Пастухов Ю.Ф. Патологические и компенсаторные процессы в новой модели доклинической стадии болезни Паркинсона у крыс. Acta Naturae. 2016а. Спецвыпуск 1: 50.
Екимова И.В., Симонова В.В., Гузеев М.А., Лапшина К.В., Чернышев М.В., Пастухов Ю.Ф. Изменения характеристик сна в модели доклинической стадии болезни Паркинсона у крыс, созданной на основе ослабления активности убиквитин-протеасомной системы головного мозга. Журнал эволюционной биохимии и физиологии. 2016б. 52 (6): 413–422.
Иллариошкин С.Н. Немоторные проявления болезни Паркинсона. Ж. Нервы. 2007. 1: 7–9.
Карпенко М.Н., Муружева З.М., Пестерева Н.С., Екимова И.В. Инфекционная гипотеза болезни Паркинсона. Российский физиологический журнал им. И.М. Сеченова. 2017. 103 (8): 841–853.
Пастухов Ю.Ф. Изменения характеристик парадоксального сна – ранний признак болезни Паркинсона. Журн. высш. нервн. деят. 2013. 63 (1): 75–85.
Пастухов Ю.Ф., Екимова И.В., Чеснокова А.В. Молекулярные механизмы патогенеза болезни Паркинсона и перспективы превентивной терапии. Нейродегенеративные заболевания – от генома до целостного организма. Часть I. Моторная функция и ее регуляция в норме и при патологии / под ред. М.В. Угрюмова. М: Научный мир. 2014. Т. 1. С. 316–356.
Пастухов Ю.Ф., Симонова В.В., Чернышев М.В., Гузеев М.А., Шемякова Т.С., Екимова И.В. Признаки нарушений сна и поведения, сигнализирующие о начальном этапе нейродегенерации в модели болезни Паркинсона. Журнал эволюционной биохимии и физиологии. 2017. 53 (5): 383–386.
Плаксина Д.В., Екимова И.В. Возрастные особенности альфа-синуклеиновой патологии в головном мозге при моделировании доклинической стадии болезни Паркинсона у крыс. Российский физиологический журнал им. И.М. Сеченова. 2018. 104 (6): 709–716.
Плаксина Д.В., Екимова И.В., Карпенко М.Н., Пастухов Ю.Ф. Оценка функционального состояния нигростриатной системы мозга в экспериментальной модели доклинической стадии болезни Паркинсона у крыс. Журнал эволюционной биохимии и физиологии. 2017. 53 (5): 386–388.
Судаков С.К., Назарова Г.А., Алексеева Е.В., Башкатова В.Г. Определение уровня тревожности у крыс: Расхождение результатов в тестах “открытое поле”, “крестообразный приподнятый лабиринт” и тесте Фогеля. Бюлл. Эксперим. Биол. Мед. 2013. 155(3): 268–270.
Угрюмов М.В. Нейродегенеративные заболевания: от генома до целостного организма. М.: Научный мир. 2014. С. 22–44.
Anchan D., Clark S., Pollard K., Vasudevan N. GPR30 activation decreases anxiety in the open field test but not in the elevated plus maze test in female mice. Brain Behav. 2014. 4 (1): 51–59. https://doi.https://doi.org/10.1002/brb3.197.
Asano Y. Characteristics of open field behaviour of Wistar and Sprague–Dawley rats. Exp. Anim. 1986. 35 (4): 505–508.
Barker G.R., Warburton E.C. Critical role of the cholinergic system for object-in-place associative recognition memory. Learn. Mem. 2008. 16 (1): 8–11. https://doi. https://doi.org/10.1101/lm.1121309.
Bertaina-Anglade V., Enjuanes E., Morillon D., Drieu la Roshelle C. The object recognition task in rats and mice: a simple and rapid model in safety pharmacology to detect amnestic properties of a new chemical entity. J. Pharmacol. Toxicol. Methods. 2006. 54 (2): 99–105. https:// doi.https://doi.org/10.1016/j.vascn.2006.04.001.
Bevins R.A., Besheer J. Object recognition in rats and mice: A one-trial non-matching-to-sample learning task to study ‘recognition memory. Nat. Protoc. 2006. 1 (3): 1306–1311. https:// doi.https://doi.org/10.1038/nprot.2006.205.
Biundo R., Weis L., Antonini A. Cognitive decline in Parkinson’s disease: the complex picture. NPJ Parkinsons Dis. 2016. 2: 16018. https:// doi.https://doi.org/10.1038/npjparkd.2016.18.
Bohnen N.I., Albin R.L. The cholinergic system and Parkinson disease. Behav. Brain Res. 2011. 221 (2): 564–573. https://doi.https://doi.org/10.1016/j.bbr.2009.12.048.
Botton P.H., Costa M.S., Ardais A.P., Mioranzza S., Souza D.O., da Rocha J.B., Porciuncula L.O. Caffeine prevents disruption of memory consolidation in the inhibitory avoidance and novel object recognition tasks by scopolamine in adult mice. Behav. Brain Res. 2010. 214 (2): 254–259. https://doi.https://doi.org/10.1016/j.bbr.2010.05.034.
Bower J.H., Grossardt B.R., Maraganore D.M., Ahlskog J.E., Colligan R.C., Geda Y.E., Therneau T.M., Rocca W.A. Anxious personality predicts an increased risk of Parkinson’s disease. Mov. Disord. 2010. 25 (13): 2105–2113. https://doi.https://doi.org/10.1002/mds.23230.
Broeders M., Velseboer D.C., de Bie R., Speelman J.D., Muslimovic D., Post B., de Haan R., Schmand B. Cognitive change in newly-diagnosed patients with Parkinson’s disease: A 5-year follow-up study. J. Int. Neuropsychol. Soc. 2013. 19 (6): 695–708. https://doi.https://doi.org/10.1017/S1355617713000295.
Bruck A., Kurki T., Kaasinen V., Vahlberg T., Rinne J.O. Hippocampal and prefrontal atrophy in patients with early non-demented Parkinson’s disease is related to cognitive impairment. J. Neurol. Neurosurg. Psychiatry. 2004. 75 (10): 1467–1469. https://doi.https://doi.org/10.1136/jnnp.2003.031237.
Calatayud F., Belzung C., Aubert A. Ethological validation and the assessment of anxiety-like behaviours: methodological comparison of classical analyses and structural approaches. Behav Processes. 2004. 67 (2): 195–206. https:// doi.https://doi.org/10.1016/j.beproc.2004.04.002.
Ciechanover A., Kwon Y.T. Protein Quality Control by Molecular Chaperones in Neurodegeneration. Front Neurosci. 2017. 11:185. https:// doi.https://doi.org/10.3389/fnins.2017.00185.
Davidson P.S., Troyer A.K., Moscovitch M. Frontal lobe contributions to recognition and recall: Linking basic research with clinical evaluation and remediation. J. Int. Neuropsychol. Soc. 2006. 12 (2): 210–223. https://doi. https://doi.org/10.1017/S1355617706060334.
de Lima M.N., Laranja D.C., Bromberg E., Roesler R., Schroder N. Pre- or post-training administration of the NMDA receptor blocker MK-801 impairs object recognition memory in rats. Bеhav. Brain Res. 2005. 156 (1): 139–143. https://doi. https://doi.org/10.1016/j.bbr.2004.05.016.
Dissanayaka N.N., Sellbach A., Matheson S., O’Sullivan J.D., Silburn P.A., Byrne G.J., Marsh R., Mellick G.D. Anxiety disorders in Parkinson’s disease: prevalence and risk factors. Mov. Disord. 2010. 25 (7): 838–845. https://doi.https://doi.org/10.1002/mds.22833.
Dissanayaka N.N.W., Lawson R.A., Yarnall A.J., Duncan G.W., Breen D.P., Khoo T.K., Barker R.A., Burn D.J. ICICLE-PD study group. Anxiety is associated with cognitive impairment in newly-diagnosed Parkinson’s disease. Parkinsonism Relat. Disord. 2017. 36: 63–68. https:// doi.https://doi.org/10.1016/j.parkreldis.2017.01.001.
Dere E., Pause B., Pietrowsky R. Emotion and episodic memory in neuropsychiatric disorders. Behav. Brain Res. 2010. 215 (2): 162–171. https://doi. https://doi.org/10.1016/j.bbr.2010.03.017.
Elgh E., Domellof M., Linder J., Edstrom M., Stenlund H., Forsgren L. Cognitive function in early Parkinson’s disease: a population-based study. Eur. J. Neurol. 2009. 16 (12): 1278–1284. https://doi.https://doi.org/10.1111/j.1468-1331.2009.02707.x.
Fellini L., Morellini F. Mice Create What–Where–When Hippocampus-Dependent Memories of Unique Experiences. J. Neurosi. 2013. 33 (3): 1038–1043. https://doi. https://doi.org/10.1523/JNEUROSCI.2280-12.2013.
Flint J. Animal models of anxiety and their molecular dissection. Semin. Cell Dev. Biol. 2003. 14 (1): 37–42. https://doi.https://doi.org/10.1016/S1084-9521(02)00170-2
Floresco S.B. Prefrontal dopamine and behavioral flexibility: shifting from an “inverted-U” toward a family of functions. Front Neurosci. 2013. 7: 62. https://doi. https://doi.org/10.3389/fnins.2013.00062.
Fox S.H., Chuang R., Brotchie J.M. Serotonin and Parkinson’s disease: On movement, mood, and madness. Mov. Disord. 2009. 24 (9): 1255–1266. https://doi.https://doi.org/10.1002/mds.22473.
Goetz C.G. New developments in depression, anxiety, compulsiveness, and hallucinations in Parkinson’s disease. Mov. Disord. 2010. Suppl. 1: S104-109. https://doi.https://doi.org/10.1002/mds.22636.
Griffith H.R., Okonkwo O.C., O’Brien T., Hollander J.A. Reduced brain glutamate in patients with Parkinson’s disease. NMR Biomed. 2008. 2https://doi.org/1 (4): 381https://doi.org/10.1002/nbm.1203i.10.1002/nbm.1203.1
Halpin Z.T. Individual Odors among Mammals: Origins and Functions. Advances in the Study of Behavior. 1986. 16: 39–70. https://doi. https://doi.org/10.1016/S0065-3454(08)60187-4
Hidaka N., Suemaru K., Takechi K., Li B., Araki H. Inhibitory effects of valproate on impairment of Y-maze alternation behavior induced by repeated electroconvulsive seizures and c-Fos protein levels in rat brains. Acta Med. Okayama. 2011. 65 (4): 269–277. https://doi.https://doi.org/10.18926/AMO/46853.
Holmes A., Kinney J.W., Wrenn C.C., Li Q., Yang R.J., Ma L., Vishwanath J., Saavedra M.C., Innerfield C.E., Jacoby A.S., Shine J., Iismaa T.P., Crawley J.N. Galanin GAL-R1 receptor null mutant mice display increased anxiety-like behavior specific to the elevated plus-maze. Neuropsychopharmacology. 2003. 28 (6): 1031–1044. https://doi.https://doi.org/10.1038/sj.npp. 1300164.
Kerteszhttps://doi.org/ A., McMonagle P. Behavior and cognition in corticobasal degeneration and progressive supranuclear palsy. J. Neurol. Sci. 2010. 289 (1–2): 138https://doi.org/10.1016/j.jns.2009.08.036/j.jns.2009.08.036.
Laatu S., Revonsuo A., Pihko L., Portin R., Rinne J.O. Visual object recognition deficits in early Parkinson’s disease. Parkinsonism Relat. Disord. 2004. 10 (4): 227–233. https://doi.https://doi.org/10.1016/j.parkreldis.2004.02.001.
Lam H.A., Wu N., Cely I., Kelly R.L., Hean S., Richter F., Magen I., Cepeda C., Ackerson L.C., Walwyn W., Masliah E., Chesselet M.F., Levine M.S., Maidment N.T. Elevated tonic extracellular dopamine concentration and altered dopamine modulation of synaptic activity precede dopamine loss in the striatum of mice overexpressing human α-synuclein. J. Neurosci. Res. 2011. 89 (7): 1091–1102. https://doi.https://doi.org/10.1002/jnr.22611.
Le W., Sayana P., Jankovic J. Animal models of Parkinson’s disease: a gateway to the-rapeutics? Neurotherapeutics. 2014. 11 (1): 92–110. https://doi.https://doi.org/10.1007/s13311-013-0234-1.
Leentjens A.F., Dujadin K., Marsh L., Martinez-Martin P., Richard I.H., Starkstein S.E. Symptomatology and markers of anxiety disorders in Parkinson’s disease: a cross-sectional study. Mov. Disord. 2011. 26 (3): 484–492. https://doi. https://doi.org/10.1002/mds.23528.
Leger M., Quiedeville A., Bouet V., Haelewyn B., Boulouard M., Schumann-Bard P., Freret T. Object recognition test in mice. Nat. Protoc. 2013. 8 (12): 2531–2537. https://doi.https://doi.org/10.1038/nprot.2013.155.
Li X., Redus L., Chen C., Martinez P.A., Strong R., Li S., O’Connor J.C. Cognitive dysfunction precedes the onset of motor symptoms in the mitoPark mouse model of Parkinson’s disease. PLoS ONE. 2013. 8 (8): e71341. https://doi. https://doi.org/10.1371/journal.pone.0071341.
Li B., Arime Y., Hall F.S., Uhl G.R., Sora I. Impaired spatial working memory and decreased frontal cortex BDNF protein level in dopamine transporter knockout mice. Eur. J. Pharmacol. 2010. 628 (1–3): 104–107. https://doi.https://doi.org/10.1016/j.ejphar.2009.11.036.
Lister R.G. Ethologically-based animal models of anxiety disorders. Pharmacol. Ther. 1990. 46 (3): 321–340. https://doi. https://doi.org/10.1016/0163-7258(90)90021-S
Magenhttps://doi.org/ I., Fleming S.M., Zhu C., Garcia E.C., Cardiff K.M., Dinh D., De La Rosa K., Sanchez M., Torres E.R., Masliah E., Jentsch J.D., Chesselet M.F. Cognitive deficits in a mouse model of pre-manifest Parkinson’s disease. Eur. J. Neurosci. 2012. 35 (6): 870https://doi.org/10.1111/j.1460-9568.2012.08012.x-9568.2012.08012.x.
Maiti P., Manna J., Dunbar G.L. Current understanding of the molecular mechanisms in Parkinson’s disease: Targets for potential treatments. Transl. Neurodegener. 2017. 6: 28. https://doi.https://doi.org/ 10.1186/s40035-017-0099-z.
Mällo T., Alttoa A., Kõiv K., Tõnissaar M., Eller M. Rats with persistently low or high exploratory activity: Behaviour in tests of anxiety and depression, and extracellular level of dopamine. Behav. Brain Res. 2007. 177 (2): 269–281. https://doi.https://doi.org/10.1016/ j.bbr.2006.11.022
Mamikonyan Ehttps://doi.org/., Moberg P.J., Siderowf A., Duda J.E., Have T.T., Hurtig H.I., Stern M.B., Weintraub D. Mild cognitive impairment is common in Parkinson’s disease patients with normal Mini-Mental State Examination (MMSE) scores. Parkinsonism Relat. Disord. 2009. 15 (3): 226https://doi.org/10.1016/j.parkreldis.2008.05.006reldis.2008.05.006.
Marino M.J., Valenti O., Conn P.J. Glutamate receptors and Parkinson’s disease: opportunities for intervention. Drugs Aging. 2003. 20 (5): 377–397. https://doi.org/.https://doi.org/10.2165/00002512-200320050-00006
Mattila P.M., Röyttä M., Lönnberg P., Marjamäki P., Helenius H., Rinne J.O. Choline I (acetytransferase) activity and striatal dopamine receptors in Parkinson’s disease in relation to cognitive impairment. Acta Neuropathol. 2001. 102 (2): 160–166. https://doi.org/.https://doi.org/10.1007/s004010100372.
Meyerhttps://doi.org/ L., Caston J., Mensah-Nyagan A.G. Seasonal variation of the impact of a stressful procedure on open field behaviour and blood corticosterone in laboratory mice. Behav. Brain Res. 2006. 167 (2): 342https://doi.org/10.1016/j.bbr.2005.09.023/j.bbr.2005.09.023.
Mingazov E.R., Khakimova G.R., Kozina E.A., Medvedev A.E., Buneeva O.A., Bazyan A.S., Ugrumov M.V. MPTP Mouse Model of Preclinical and Clinical Parkinson’s Disease as an Instrument for Translational Medicine. Mol. Neurobiol. 2017. https://doi.https://doi.org/10.1007/s12035-017-0559-6.
Molewijk H.E., van der Poel A.M., Olivier B. The ambivalent behavior “stretched approach posture” in the rat as a paradigm to characterize anxiolytic drugs. Psychopharmacology. (Berl). 1995. 121 (1): 81–90 https://doi.org/.https://doi.org/10.1007/BF02245594.
Moriguchi S., Yabuki Y., Fukunaga K. Reduced calcium/calmodulin-dependent protein kinase II activity in the hippocampus is associated with impaired cognitive function in MPTP-treated mice. J. Neurochem. 2012. 120 (4): 541–551. https://doi. https://doi.org/10.1111/j.1471-4159.2011.07608.x.
Muslimovic D., Post B., Speelman J.D., Schmand B. Cognitive profile of patients with newly diagnosed Parkinson disease. Neurology. 2005. 65 (8): 1239–1245. https://doi.https://doi.org/10.1212/01.wnl.0000180516. 69442.95.
Nègre-Pagès L., Grandjean H., Lapeyre-Mestre M., Montastruc J.L., Fourrier A., Lepine J.P., Rascol OPaMiP Study Group. Anxious and depressive symptoms in Parkinson’s disease: the French cross-sectional DoPaMiP study. Mov. Disord. 2010. 25 (2): 157–166. https://doi.https://doi.org/10.1002/mds.22760.
Owen A.M. Cognitive dysfunction in Parkinson’s disease: The role of frontostriatal circuitry. Neuroscientist. 2004. 10 (6): 525–537. https://doi.https://doi.org/10.1177/1073858404266776.
Pellow S., Chopin P., File S., Briley M. Validation of open: Closed arms entries in an elevated plus maze as a measure of anxiety in the rat. J. Neurosci. Methods. 1985. 14: 149–167. https:// doi.https://doi.org/10.1016/0165-0270(85)90031-7.
Pfeiffer H., Løkkegaard A., Zoetmulder M., Friberg L., Werdelin L. Cognitive impairment in early-stage non-demented Parkinson’s disease patients. Acta Neurol. Scan. 2014. 129 (5): 307–318. https://doi.https://doi.org/10.1111/ane.12189.
Pirogovsky-Turk E., Filoteo J.V., Litvan I., Harrington D.L. Structural MRI Correlates of Episodic Memory Processes in Parkinson’s Disease Without Mild Cognitive Impairment. J. Parkinsons Dis. 2015. 5 (4): 971–981. https:// doi.https://doi.org/10.3233/JPD-150652.
Plaksina D.V., Chernyshev M.V., Karpenko M.N., Gazizova A.R., Pazi M.B., Ekimova I.V. Experimental modeling of a preclinical Parkinson`s disease stage in rats by intranasal lactacystin administration. Neurodegener. Dis. 2017. 17 (suppl. 1): 1655. https:// doi.https://doi.org/10.1159/000464378.
Ray N.J., Strafella A.P. The neurobiology and neural circuitry of cognitive changes in Parkinson’s disease revealed by functional neuroimaging. Mov. Disord. 2012. 27 (12): 1484–1492. https:// doi.https://doi.org/10.1002/mds.25173.
Rodgers R.J., Johnson N.J.T. Factor analysis of spatiotemporal and ethological measures in the murine elevated plus-maze test of anxiety. Pharmacol. Biochem. Behav. 1995. 52: 297–303. https://doi.https://doi.org/10.1016/0091-3057(95)00138-M.
Rosen J.B., Pagani J.H., Rolla K.L.G., Davis C. Analysis of behavioral constraints and the neuroanatomy of fear to the predator odor trimethylthiazoline: A model for animal phobias. Neurosci. Biobehav. Rev. 2008. 32: 1267–1276. https://doi. https://doi.org/10.1016/j.neubiorev.2008.05.006.
Rugg M.D., Otten L.J., Henson R.N. The neural basis of episodic memory: Evidence from functional neuroimaging. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2002. 357 (1424): 1097–1110. https://doi.https://doi.org/10.1098/rstb.2002.1102.
Sawada M., Imamura K., Nagatsu T. Role of cytokines in inflammatory process in Parkinson’s disease. J. Neural. Transm. Suppl. 2006. 70: 373–381. https://doi.org/.https://doi.org/10.1007/978-3-211-45295-0_57
Schneider J.S. Chronic exposure to low doses of MPTP. II. Neurochemical and pathological consequences in cognitively-impaired, motor asymptomatic monkeys. Brain Res. 1990. 534 (1–2): 25–36. https://doi.https://doi.org/10.1016/0006-8993(90)90108-N
Shiba M., Bower J.H., Maraganore D.M., McDonnell S.K., Peterson B.J., Ahlskog J.E., Schaid D.J., Rocca W.A. Anxiety disorders and depressive disorders preceding Parkinson’s disease: a case-control study. Mov. Disord. 2000. 15 (4): 669–677. https://doi.https://doi.org/10.1002/1531-8257(200007).
Sy H.N., Wu S.L., Wang W.F., Chen C.H., Huang Y.T., Liou Y.M., Chiou C.S., Pawlak C.R., Ho Y.J. MPTP-induced dopaminergic degeneration and deficits in object recognition in rats are accompanied by neuroinflammation in the hippocampus. Pharmacol. Biochem. Behav. 2010. 95 (2): 158–165. https://doi.https://doi.org/10.1016/j.pbb.2009.12.020.
Tadaiesky M.T., Dombrowski P.A., Fiqueiredo C.P., Cargnin-Ferreira E., Da Cunha C., Takahashi R.N. Emotional, cognitive and neurochemical alterations in a premotor stage model of Parkinson’s disease. Neuroscience. 2008. 156 (4): 830–840. https://doi.https://doi.org/10.1016/j.neuroscience.2008.08.035.
Tissingh G., Bergmans P., Booij J., Winogrodzka A., van Royen E.A., Stoof J.C., Wolters E.C. Drug-naive patients with Parkinson’s disease in Hoehn and Yahr stages I and II show a bilateral decrease in striatal dopamine transporters as revealed by [123I]beta-CIT SPECT. J. Neurol. 1998. 245 (1): 14–20. https://doi.org/https://doi.org/10.1007/s004150050168
Ugrumov M.V., Khaindrava V.G., Kozina E.A., Kucheryanu V.G., Bocharov E.V., Kryzhanovsky G.N., Kudrin V.S., Narkevich V.B., Klodt P.M., Rayevsky K.S., Pronina T.S. Modeling of presymptomatic and symptomatic stages of parkinsonism in mice. Neuroscience. 2011. 181: 175–188. https://doi. https://doi.org/10.1016/j.neuroscience.2011.03.007.
Vazey E.M., Aston-Jones G. The emerging role of norepinephrine in cognitive dysfunctions of Parkinson’s disease. Front. Behav. Neurosci. 2012. 6: 48. https://doi.https://doi.org/10.3389/fnbeh.2012.00048.
Verhave P.S., Jonqsma M.J., Van den Berg R.M., Vis J.C., Vanwersch R.A., Smit A.B., Van Someren E.J., Philippens I.H. REM sleep behavior disorder in the marmoset MPTP model of early Parkinson disease. Sleep. 2011. 34 (8): 1119–1125. https://doi.https://doi.org/10.5665/SLEEP.1174.
Walf A.A., Frye C.A. The use of the elevated plus maze as an assay of anxiety-related behavior in rodents. Nat Protoc. 2007. 2 (2): 322–328. https://doi. https://doi.org/10.1038/nprot.2007.44.
Wall P.M., Messier C. Infralimbic kappa opioid and muscarinic M1 receptor interactions in the concurrent modulation of anxiety and memory. Psychopharmacology (Berl). 2002. 160 (3): 233–244. https://doi.https://doi.org/10.1007/s00213-001-0979-9.
Weisskopf M.G., Chen H., Schwarzschild M.A., Kawachi I., Ascherio A. Prospective study of phobic anxiety and risk of Parkinson’s disease. Mov. Disord. 2003. 18 (6): 646–651. https://doi.https://doi.org/10.1002/mds.10425.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


