Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 3, стр. 382-392
НОВЫЙ ПОДХОД К ОЦЕНКЕ СТЕПЕНИ ДЕГРАДАЦИИ НИГРОСТРИАТНОЙ ДОФАМИНЕРГИЧЕСКОЙ СИСТЕМЫ НА ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ БОЛЕЗНИ ПАРКИНСОНА
В. В. Сафандеев 1, *, М. В. Угрюмов 1, 2
1 Институт биологии развития им. Н.К. Кольцова РАН
Москва, Россия
2 Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
* E-mail: visa.doc@mail.ru
Поступила в редакцию 21.05.2018
После доработки 24.09.2018
Принята к публикации 20.11.2018
Аннотация
Характерной особенностью болезни Паркинсона (БП) является ее диагностирование только на поздней “клинической” стадии по появлению моторных симптомов на фоне почти полной деградации дофаминергической нигростриатной системы. Это объясняет низкую эффективность существующей заместительной терапии (агонисты дофамина) и обусловливает необходимость разработки ранней (доклинической) диагностики и превентивной нейропротекторной терапии, направленной на замедление гибели нейронов. Очевидно, что на разных этапах доклинической стадии БП нейропротекторная терапия должна проводиться с учетом степени деградации ДА-ергической системы, что в настоящее время возможно только с помощью малодоступного метода – позитронно-эмиссионной томографии. Поэтому целью настоящей работы явилась экспериментальная разработка альтернативного легкодоступного малоинвазивного подхода для оценки степени деградации дофаминергической системы на модели доклинической стадии БП. Этот оригинальный подход основан на поиске минимальных доз α-метил-п-тирозина – обратимого ингибитора синтеза дофамина (ДА), способного на различных этапах доклинической стадии БП снижать содержание ДА в стриатуме до порога, при котором нарушается моторика. Для разработки были использованы оригинальные модели ранней и поздней доклинической стадии БП, воспроизводимые на мышах однократным или двукратным системным введением 1-метил-4-фенил-1,2,3,6-тетрагидропиридина – протоксина, превращающегося в организме в токсин дофаминергических нейронов. В первом случае уровень ДА в стриатуме снижен до 80%, а во втором – до 39% от контроля/нормы, принятой за 100%. На этих моделях были найдены минимальные дозы α-метил-п-тирозина, при которых уровень ДА снижался до порога (30%), что сопровождалось нарушением моторной и исследовательской активности. Для модели ранней доклинической стадии эта доза была равна 75 мг/кг, а для модели поздней доклинической стадии – 50 мг/кг. Таким образом показано, что степень деградации нигростриатной дофаминергической системы на доклинической стадии БП можно определить по минимальной дозе обратимого ингибитора синтеза ДА, в которой он вызывает снижение уровня ДА в стриатуме до порога (30%) и приводит к нарушению моторной и исследовательской активности.
ВВЕДЕНИЕ
В основе патогенеза болезни Паркинсона (БП) лежит гибель дофаминергических (ДА-ергических) нейронов нигростриатной системы мозга, играющей ключевую роль в регуляции двигательной (моторной) функции [Kalia, Lang, 2015]. Первые моторные симптомы, а следовательно, и возможность диагностировать заболевание, появляются только через 20–30 лет после начала снижения уровня дофамина (ДА) – ключевого нейротрансмиттера регуляции двигательной функции – в стриатуме примерно до 30% от нормы, принятой за 100% [Agid et al., 1991; Albin et al., 1989; Bezard, Gross, 1998; Bezard et al., 2001; 2003; 2009; Blesa et al., 2017; Ehringer, Hornykiewicz, 1960; Zigmond et al., 1997]. При этом погибает большая часть ДА-ергических нейронов и истощаются компенсаторные резервы мозга, что объясняет низкую эффективность традиционной заместительной терапии с использованием агонистов ДА [Agid et al., 1991; Blesa et al., 2017]. Поэтому одним из основных приоритетов современной неврологии является разработка ранней (далее – доклинической) диагностики БП задолго до появления моторных симптомов. Успешное решение поставленной задачи позволит разработать превентивную нейропротекторную терапию, направленную на замедление гибели нейронов и продление доклинической стадии, – периода комфортной жизни больного.
Очевидно, что разработка нейропротекторной терапии на доклинической стадии БП должна осуществляться с учетом степени деградации нигростриатной ДА-ергической системы. В настоящее время это может быть решено только с помощью позитронно-эмиссионной томографии (ПЭТ) – неинвазивного метода, малодоступного по техническим и экономическим причинам для широкого использования [Werner et al., 2015]. Поэтому целью настоящей работы явилась разработка на экспериментальных моделях БП альтернативного, легкодоступного малоинвазивного подхода к оценке степени деградации ДА-ергической системы на доклинической стадии. Этот подход основан на поиске минимальных доз α-метил-п-тирозина (αМПТ) – обратимого ингибитора синтеза катехоламинов, в которых он на моделях различных этапов доклинической стадии БП был бы способен понижать содержание ДА в стриатуме до порога (30% от 100% в норме), при котором нарушается моторная и исследовательская активность.
МЕТОДИКА
Животные
В работе использованы самцы мышей линии С57Bl/6 (n = 148) в возрасте 8–9 нед и массой 23 ± 2 г, полученные из питомника Столбовая. Мыши после рассадки из больших клеток (25 в клетке) были размещены группами по 4–5 особей в клетках меньшего размера (домашние клетки). Животных содержали в стандартных условиях терморегулируемого вивария (22 ± 2°С) с 12-часовым циклом “день/ночь” (800/2000) при неограниченном доступе к воде и пище. Эксперименты проводили с 12.00 до 16.00.
Все манипуляции с животными осуществляли в соответствии с Правилами надлежащей лабораторной практики [Приказ МЗ РФ от 1 апреля 2016 г. № 199н] и международной конвенцией [Directive 2010/63/EU] и положениями протокола, утвержденного комитетом по биоэтике Института биологии развития им Н.К. Кольцова РАН.
Введение фармацевтических субстанций
Для моделирования ранней и поздней доклинической стадии БП мышам подкожно вводили пронейротоксин – 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (МФТП, Sigma-Aldrich, США), который в мозге превращается в МФП+ – специфический токсин ДА-ергических нейронов [Przedborski et al., 2000]. При моделировании ранней доклинической стадии МФТП вводили в дозе 12 мг/кг однократно (1 × 12), а при моделировании поздней доклинической стадии – двукратно (2 × 12) с интервалом 2 ч между инъекциями [Ugrumov et al., 2011] (рис. 1). Контрольным животным по аналогичным схемам вводили физиологический раствор (0.9% NaCl).
Рис. 1.
Схема экспериментов по подбору минимальной дозы α-метил-п-тирозина (αМПТ), вызывающей снижение уровня дофамина в стриатуме до порога, при котором нарушается моторное поведение у мышей при моделировании ранней и поздней доклинической стадии болезни Паркинсона (БП) путем однократного (1 × 12) или двукратного (2 × 12) введения 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МФТП) в разовой дозе 12 мг/кг. В контроле вместо МФТП и αМПТ вводили 0.9% NaCl (NaCl). Разделение по поведению осуществляли по результатам пройденного пути в “Открытом поле”. Обозначения: n – число животных; * – дозы αМПТ: 125, 100, 75, 50 мг/кг; ** – дозы αМПТ: 125, 100, 75, 50 мг/кг и 50, 25 мг/кг; *** – дозы αМПТ: 50 и 25 мг/кг; эксперимент 1 – оценка концентрации дофамина в стриатуме у мышей через 1 нед после однократного или двукратного введения МФТП в дозе 12 мг/кг или в контроле; эксперимент 2 – оценка пройденного пути, скорости и вертикальных стоек в “Открытом поле”, концентрации дофамина в стриатуме у мышей на 16-й день после однократного введения МФТП/NaCl и через 4 ч после последующего введения αМПТ в дозе от 50 до 125 мг/кг; эксперимент 3 – оценка пройденного пути, скорости и вертикальных стоек в “Открытом поле”, концентрации дофамина в стриатуме у мышей на 16-й день после двукратного введения МФТП/NaCl и через 4 ч после последующего введения αМПТ в дозе от 25 до 50 мг/кг. На схеме указано общее число животных для подгрупп “NaCl1” и “NaCl2”. Во втором эксперименте n (NaCl1) = 8, n (NaCl2) = 20, в третьем эксперименте n (NaCl1) = 8, n (NaCl2) = 16.
Fig. 1. Scheme of the experiments on the selection of the minimum dose of α-methyl-p-tyrosine (αMPT), which causes a decrease in dopamine level in the striatum to the threshold at which motor behavior is disordered in mice at modeling the early and late preclinical stages of Parkinson’s disease (PD) by a single (1 × 12) or double (2 × 12) administration of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) in the individual dose of 12 mg/kg. In the control, 0.9% NaCl (NaCl) was injected instead of MPTP. Symbols: n – the number of animals; * – doses of αMPT: 125, 100, 75, 50 mg/kg; ** – doses of αMPT: 125, 100, 75, 50 mg/kg and 50, 25 mg/kg; *** – doses of αMPT: 50 and 25 mg/kg.
На 16-й день эксперимента животным, ранее получавшим однократную инъекцию МФТП, подкожно однократно вводили 0.9% NaCl (контроль) или αМПТ (Sigma-Aldrich, США) в дозе 125, 100, 75 или 50 мг/кг (рис. 1). Животным, ранее получавшим двукратную инъекцию МФТП, на 16-й день эксперимента вводили 0.9% NaCl или αМПТ в дозе 50 или 25 мг/кг. 0.9% NaCl или αМПТ также вводили животным, получавшим инъекции физиологического раствора вместо МФТП.
Исследование моторной и исследовательской активности
За трое суток до введения 0.9% NaCl или МФТП проводили “хэндлинг” мышей и под наркозом (изофлуран) метили пронумерованными ушными бирками. На следующий день животных делили на три эквивалентные группы по результатам пройденного пути в “Открытом поле” (первое тестирование). Далее им вводили 0.9% NaCl и однократно или двукратно МФТП (рис. 1).
Моторную (пройденный путь, см; скорость, см/с), исследовательскую активность (вертикальные стойки, количество) и уровень тревожности, определяемый по соотношению времени пребывания в центре камеры и на периферии (секунды), оценивали с помощью автоматизированной поведенческой установки PhenoMaster (ActiMot2, TSE-Systems GmbH, Bad Homburg, v.6.1, Германия) в течение 6 мин в “Открытом поле” при рассеянном освещении 25 лк. Считается, что 6 мин – минимальное время, необходимое для оценки моторной и исследовательской активности [Bailey, Crawley, 2009; Gould et al., 2009].
С целью адаптации за 2 ч до начала оценки моторной и исследовательской активности мышей в “домашних клетках” переносили в комнату для тестирования поведения.
Каждая арена для исследования поведения представляла собой площадку из плексигласа, поделенную на центральную и периферическую зоны, задаваемые автоматически. Арена окружена инфракрасной ИК-рамкой, регистрирующей каждое движение животного в трех измерениях. С помощью ИК-лучей с высоким временным (100 Гц) и пространственным (до 1 мм) разрешением по осям X и Y (нижняя ИК-рамка) регистрировали перемещение в горизонтальной плоскости, а по оси Z (верхняя ИК-рамка) – вертикальные стойки. Между тестированием каждого животного арены тщательно очищали антисептическим раствором.
Эксперимент 1. Влияние МФТП на уровень ДА в стриатуме, моторную и исследовательскую активность
Чтобы убедиться, что наши модели воспроизводят доклиническую, а не клиническую стадию БП, на восьмой день после введения МФТП оценивали моторную и исследовательскую активность в “Открытом поле” (второе тестирование) в трех группах: после введения 0.9% NaCl (n = 8), однократного (n = 8) или двукратного (n = 8) введения МФТП. У оставшихся животных (n = 124) в группах после введения 0.9% NaCl, однократного или двукратного введения МФТП на 15-й день эксперимента повторно оценивали моторную и исследовательскую активность в “Открытом поле” (третье тестирование). По пройденному пути животных в каждой из тестируемых групп (0.9% NaCl, МФТП) делили на 2 подгруппы с равными между собой средними межгрупповыми и внутригрупповыми дисперсиями: “NaCl1” и “NaCl2”, “МФТП1” и “МФТП2” [Сафандеев и др., 2017] (рис. 1). При этом мыши из подгрупп “NaCl1” и “МФТП1” находились в одних и тех же клетках, а мышей из подгрупп “NaCl2” и “МФТП2” рассаживали в разные клетки в соответствии с пройденным путем и последующим введением αМПТ в разных дозах (рис. 1).
Эксперимент 2. Дозозависимое влияние αМПТ на уровень ДА в стриатуме, моторную и исследовательскую активность после однократного введения 0.9% NaCl или МФТП
На 16-й день эксперимента мышам в подгруппах “NaCl1” (n = 8) и “МФТП1” (n = 8) подкожно вводили 0.9% NaCl, а мышам в подгруппах “NaCl2” (n = 20) и “МФТП2” (n = = 32) – αМПТ в дозе 125, 100, 75 или 50 мг/кг (рис. 1). Через 4 ч после этого повторно оценивали поведение (четвертое тестирование).
Эксперимент 3. Дозозависимое влияние αМПТ на уровень ДА в стриатуме, моторную и исследовательскую активность после двукратного введения 0.9% NaCl или МФТП
На 16-й день эксперимента мышам в подгруппах “NaCl1” (n = 8) и “МФТП1” (n = 16) подкожно вводили 0.9% NaCl, а мышам в подгруппах “NaCl2” (n = 16) и “МФТП2” (n = = 16) – αМПТ в дозе 50 или 25 мг/кг соответственно (рис. 1). Через 4 ч оценивали поведение (четвертое тестирование), моторную и исследовательскую активность.
Оценка содержания уровня ДА в стриатуме
В каждом из трех вышеуказанных экспериментов после оценки моторной и исследовательской активности мышей наркотизировали изофлураном, декапитировали и выделяли стриатум по атласу [Paxinos Franklin, 2012] согласно ранее описанной методике [Ким, Угрюмов, 2015]. Образцы стриатума замораживали в жидком азоте и хранили при –80°С до измерения содержания ДА с помощью высокоэффективной жидкостной хроматографии с электрохимической детекцией (ВЭЖХ с ЭД) [Сафандеев и др., 2017].
Статистический анализ
Нормальность распределения в группах оценивали с помощью теста Шапиро–Уилка при уровне значимости p < 0.01. Наличие/отсутствие выбросов определяли с помощью теста Граббса. Для статистического анализа содержания ДА в стриатуме, а также параметров моторной и исследовательской активности использовали однофакторный дисперсионный анализ (* – p < 0.05 – статистически значимый результат). Данные представлены как среднее ± стандартная ошибка среднего (mean ± SEM). Анализ выполнен в программе GraphPad Prism 6.0 (GraphPad Software, CA, США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Эксперимент 1. Влияние МФТП на уровень ДА в стриатуме, моторную и исследовательскую активность
Через неделю после однократного или двукратного введения МФТП у мышей не наблюдалось изменений по сравнению с соответствующими контролями (0.9% NaCl) длины пройденного пути (0.9% NaCl: 1958 ± 167; МФТП 1 × 12: 1967 ± 131; МФТП 2 × 12: 2115 ± ± 142; F2.51 = 0.03; p = 0.9683), скорости перемещения (0.9% NaCl: 27.6 ± 2.7; МФТП 1 × × 12: 28.8 ± 2.8; МФТП 2 × 12: 29.3 ± 1.9; F2.51 = 0.07; p = 0.9305) и количества вертикальных стоек (0.9% NaCl: 26.3 ± 4.6; МФТП 1 × 12: 26.7 ± 5.4; МФТП 2 × 12: 30.5 ± 4.6; F2.51 = 0.02; p = 0.9798).
Через 2 нед после однократного или двукратного введения МФТП у мышей также не было обнаружено изменений по сравнению с соответствующими контролями (0.9% NaCl) длины пройденного пути (0.9% NaCl: 1721 ± ± 169; МФТП 1 × 12: 1725 ± 121; МФТП 2 × 12: 1707 ± 160; F2.15 = 0.003; p = 0.9964), скорости перемещения (F2.15 = 1.120; p = 0.3520) и числом вертикальных стоек (0.9% NaCl: 26 ± 1.8; МФТП 1 × 12: 27 ± 1.8; МФТП 2 × 12: 31 ± 3.7; F2.15 = 1.660; p = 0.2180).
ВЭЖХ стриатума
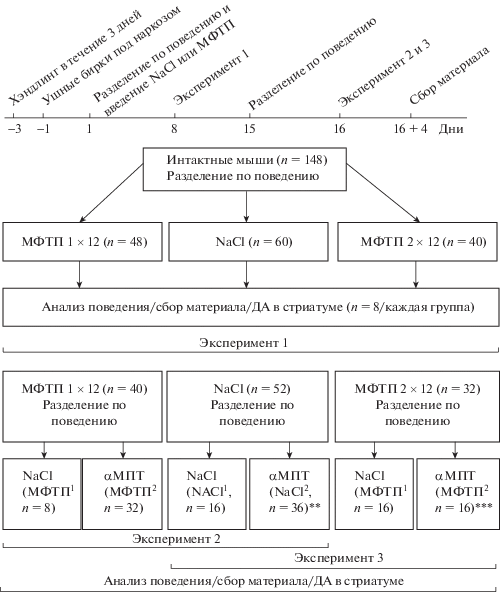
Через 1 нед после однократного или двукратного введения МФТП уровень ДА у животных в стриатуме был снижен до 70% и 36% от контроля/нормы, принятой за 100% (0.9% NaCl: 100.6 ± 5.82; МФТП 1 × 12: 70.01 ± ± 2.86; МФТП 2 × 12: 36.01 ± 4.44; F2.51 = = 81.34; p < 0.0001; рис. 2).
Рис. 2.
Эксперимент 1. Концентрация дофамина в стриатуме у мышей через 1 нед после однократного или двукратного введения 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (МФТП) в разовой дозе 12 мг/кг или в контроле 0.9% NaCl (NaCl). Данные представлены в виде M ± SE. * p < 0.05 – статистически значимые отличия по отношению к прочим группам. ∆p < 0.05 – статистически значимые отличия между МФТП 1 × 12 и МФТП 2 × 12.
Fig. 2. Experiment 1. The concentration of dopamine in the striatum in mice a week after a single (1 × 12) or double (2 × 12) administration of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) in the individual dose of 12 mg/kg or 0.9% NaCl (NaCl) in the control. 0.9% NaCl (NaCl). Data are presented as M ± SE. * p < 0.05 – statistically significant difference compared to the control. ∆p < 0.05 – statistically significant difference in the concentration of dopamine after a single (1 × 12) and double (2 × 12) administration of MPTP.
Эксперимент 2. Дозозависимое влияние αМПТ на уровень ДА в стриатуме, моторную и исследовательскую активность после однократного введения 0.9% NaCl или МФТП
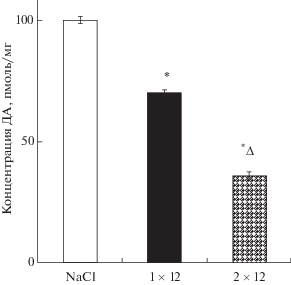
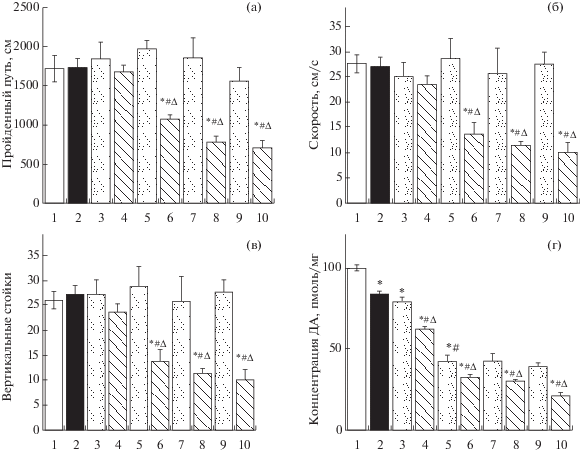
Инъекция αМПТ в дозе 50 мг/кг на 16-й день после однократного введения МФТП не вызвала у мышей изменения моторного и исследовательского поведения по сравнению с контролем (введение только МФТП) ни по одному из оцениваемых показателей (рис. 3 (а, б, в)). Напротив, αМПТ в дозе 75, 100 или 125 мг/кг вызывал снижение пройденного пути (F9.57 = 11.56; p < 0.0001; рис. 3 (а)), скорости перемещения (F9.57 = 9.670; p < 0.0001; рис. 3 (б)) и уменьшение числа вертикальных стоек (F9.57 = 7.479; p < 0.001; рис. 3 (в)) по сравнению с контролем. Введение αМПТ во всех дозах не изменяло соотношение времени пребывания в центре клетки по сравнению с пребыванием на периферии клетки (F9.57 = 0.989; p = 0.4607). Только один показатель – длина пройденного пути, снизился при введении αМПТ в дозе 75 мг/кг в меньшей степени, чем при более высоких дозах (рис. 3 (а)).
Рис. 3.
Эксперимент 2. Пройденный путь (а), скорость (б) и число вертикальных стоек (в), измеренные в “открытом поле”, а также концентрация дофамина в стриатуме (г) у мышей на 16-й день после введения 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (МФТП) в дозе 12 мг/кг (1 × 12) и через 4 часа α-метил-п-тирозина (αМПТ) в дозе от 50 до 125 мг/кг. В контроле вместо МФТП и αМПТ вводили 0.9% NaCl. Данные представлены в виде M ± SE. * p < 0.05 – статистически значимые отличия по отношению к подгруппе NaCl1 (NaCl + NaCl). # p < 0.05 – статистически значимые отличия по отношению к подгруппе NaCl2 (NaCl + αМПТ). ∆p < 0.05 – статистически значимые отличия по отношению к подгруппе МФТП1 (МФТП + + NaCl). Обозначения: 1 – NaCl + NaCl; 2 – МФТП 1 × 12 + NaCl; 3 – NaCl + αМПТ 50 мг/кг; 4 – МФТП 1 × 12 + αМПТ 50 мг/кг; 5 – NaCl + αМПТ 75 мг/кг; 6 – МФТП 1 × 12 + αМПТ 75 мг/кг; 7 – NaCl + αМПТ 100 мг/кг; 8 – МФТП 1 × 12 + αМПТ 100 мг/кг; 9 – NaCl + αМПТ 125 мг/кг; 10 – МФТП 1 × 12 + αМПТ 125 мг/кг.
Fig. 3. Experiment 2. The track length (a), speed (б) and the number of vertical rearings (в) measured in the “open field”, as well as the concentration of dopamine in the striatum (г) in mice on the 16th day after the administration of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) at the dose of 12 mg/kg (1 × 12) and after 4 hours α-methyl-p-tyrosine (αMPT) at the dose varying from 50 to 125 mg/kg. In the control, 0.9% NaCl was injected instead of MPTP and αMPT. Data are presented as M ± SE. * p < 0.05 – statistically significant difference compared with the subgroup NaCl1 (NaCl + NaCl). # p < 0.05 – statistically significant difference compared with the subgroup NaCl2 (NaCl + αMPT). ∆ p < 0.05 – statistically significant difference compared with the subgroup MPTP1 (MPTP + NaCl). Symbols: 1 – NaCl + NaCl; 2 – MPTP 1 × 12 + NaCl; 3 – NaCl + αMPT 50 mg/kg; 4 – MPTP 1 × 12 + αMPT 50 mg/kg; 5 – NaCl + αMPT 75 mg/kg; 6 – MPTP 1 × 12 + αMPT 75 mg/kg; 7 – NaCl + αMPT 100 mg/kg; 8 – MPTP 1 × 12 + αMPT 100 mg/kg; 9 – NaCl + αMPT 125 mg/kg; 10 – MPTP 1 × 12 + αMPT 125 mg/kg.
ВЭЖХ стриатума
На 16-й день после однократного введения МФТП и через 4 ч после последующего введения 0.9% NaCl концентрация ДА в стриатуме у животных в подгруппе “МФТП1” была снижена на 20% по сравнению с животными контрольной подгруппы “NaCl1” (F9,57 = 62.65; p < 0.0001; рис. 3 (г)). Введение по такой же схеме αМПТ мышам в подгруппе “МФТП2” в дозе 50, 75, 100 или 125 мг/кг приводило к еще большему снижению концентрации ДА в стриатуме – соответственно на 38, 68, 70 и 79% по сравнению с мышами подгруппы “NaCl1” (p < 0.05), и соответственно на 26, 61, 64 и 75% (p < 0.05) по сравнению с мышами подгруппы “МФТП1”. По мере увеличения дозы αМПТ уменьшалось содержание ДА в стриатуме за единственным исключением – концентрация ДА в стриатуме не изменилась при увеличении дозы αМПТ от 75 мг/кг до 100 мг/кг (рис. 3 (г)).
Эксперимент 3. Дозозависимое влияние αМПТ на уровень ДА в стриатуме, моторную и исследовательскую активность после двукратного введения 0.9% NaCl или МФТП
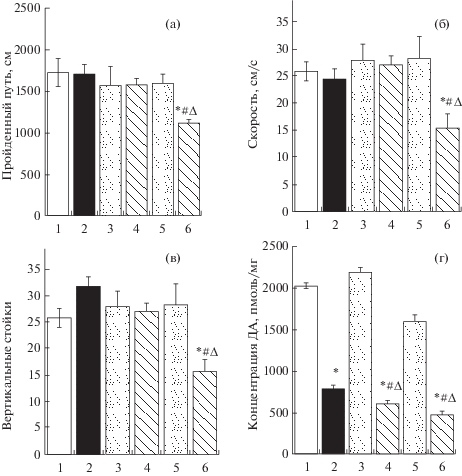
Инъекция αМПТ в дозе 25 мг/кг на 16-й день после двукратного введения МФТП не вызывала у мышей изменения моторной и исследовательской активности ни по одному из использованных показателей. Напротив, введение животным αМПТ в дозе 50 мг/кг приводило к уменьшению пройденного пути на 35% (F5.33 = 3.019; p = 0.0237; рис. 4 (а)), скорости на 41% (F5.33 = 8.180; p = = 0.0006; рис. 4 (б)) и снижению числа вертикальных стоек – на 40% (F5.33 = 4.367; p = 0.0037; рис. 4 (в)). При различных дозах αМПТ соотношение времени пребывания в центре клетки по сравнению с пребыванием на периферии клетки не изменялось (F5.33 = 0.8095; p = 0.5521).
Рис. 4.
Эксперимент 3. Пройденный путь (а), скорость (б) и вертикальные стойки (в) в “открытом поле”, а также концентрация дофамина в стриатуме (г) у мышей на 16-й день после двукратного введения 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (МФТП) в дозе 12 мг/кг (2 × 12) и через 4 часа α-метил-п-тирозина (αМПТ) в дозе от 25 до 50 мг/кг. В контроле вместо МФТП и αМПТ вводили 0.9% NaCl (NaCl). Данные представлены в виде M ± SE. * p < 0.05 – статистически значимые отличия по отношению к подгруппе NaCl1 (NaCl+ NaCl). # p < 0.05 – статистически значимые отличия по отношению к подгруппе NaCl2 (NaCl + αМПТ). ∆ p < 0.05 – статистически значимые отличия по отношению к подгруппе МФТП1 (МФТП + NaCl). Обозначения: 1 – NaCl + NaCl; 2 – МФТП 2 × 12 + NaCl; 3 – NaCl + αМПТ 25 мг/кг; 4 – МФТП 2 × 12 + αМПТ 25 мг/кг; 5 – NaCl + αМПТ 50 мг/кг; 6 – МФТП 2 × 12 + αМПТ 50 мг/кг.
Fig. 4. Experiment 3. The track length (a), speed (б) and the number of vertical rearings (в) measured in the “open field”, as well as the concentration of dopamine in the striatum (г) in mice on the 16th day after the double administration of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) at the individual dose of 12 mg/kg (1 × 12) and after 4 hours α-methyl-p-tyrosine (αMPT) at the dose varying from 25 to 50 mg/kg. In the control, 0.9% NaCl was injected instead of MPTP and αMPT. Data are presented as M ± SE. * p < 0.05 – statistically significant difference compared with the subgroup NaCl1 (NaCl + NaCl). # p < 0.05 – statistically significant difference compared with the subgroup NaCl2 (NaCl + αMPT). ∆ p < 0.05 – statistically significant difference compared with the subgroup MPTP1 (MPTP + NaCl). Symbols: 1 – NaCl + NaCl; 2 – MPTP 2 × 12 + NaCl; 3 – NaCl + αMPT 25 mg/kg; 4 – MPTP 2 × 12 + αMPT 25 mg/kg; 5 – NaCl + αMPT 50 mg/kg; 6 – MPTP 2 × 12 + αMPT 50 mg/kg.
ВЭЖХ стриатума
На 16-й день после двукратного введения МФТП и через 4 ч после дополнительного введения 0.9% NaCl концентрация ДА в стриатуме у животных в подгруппе “МФТП1” была снижена на 61%, по сравнению с подгруппой контрольных животных “NaCl1”, которым вместо МФТП вводили 0.9% NaCl (F5.33 = 138.3; p < 0.0001). При этом уменьшение концентрации ДА в стриатуме было ниже на 41%, чем при однократном введении МФТП (см. Эксперимент 2). Введение αМПТ в дозе 25 мг/кг в подгруппе “МФТП2” приводило к снижению содержания ДА в стриатуме на 68%, а введение αМПТ в дозе 50 мг/кг – на 76.5% по сравнению с подгруппой “NaCl1” (рис. 4 (г)).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Несмотря на значительные усилия нейробиологов и неврологов, направленные на усовершенствование лечения БП, это социально значимое заболевание до сих пор остается фатальным [Agid et al., 1991]. Единственная перспектива перевести БП из категории фатальных в категорию излечиваемых заболеваний связана с разработкой доклинической диагностики и превентивного лечения [Becker et al., 2002; Gaenslen, Berg, 2010]. Превентивное лечение должно быть направлено на замедление гибели нейронов и продление доклинической (бессимптомной) стадии заболевания. При наличии целого ряда механизмов нейродегенерации и соответствующих молекулярных мишеней превентивная терапия должна быть нейропротекторной и комплексной, обеспечивающей широкий спектр действия – антиоксидантное, антиапоптотическое, противовоспалительное и ряд других [Rehman et al., 2018].
Очевидно, что на различных этапах доклинической стадии схема превентивного лечения (вид нейропротектора, доза, частота применения и др.) должна специально подбираться, в первую очередь, в зависимости от степени деградации нигростриатной ДА-ергической системы. В настоящее время функциональную недостаточность ДА-ергической нигростриатной системы на доклинической стадии БП, которая по мере прогрессирования приводит к появлению моторных нарушений, удалось показать только с помощью ПЭТ [Cummings et al., 2011; Jadvar, Colletti, 2014; Tripathi et al., 2018; Verger et al., 2018; Werner et al., 2015]. В настоящей работе впервые была предпринята попытка создать альтернативный, легкодоступный подход для решения этой задачи. Этот подход основан на применении αМПТ – обратимого ингибитора тирозингидроксилазы – скорость-лимитирующего фермента синтеза катехоламинов [Engelman et al., 1968; Spector, 1965; Sjoerdsma et al., 1965], с помощью которого можно произвольно изменять уровень ДА в стриатуме, вмешиваясь в метаболизм ДА в выживших ДА-ергических нейронах и, опосредованно – в регуляцию моторной и исследовательской активности. Важно подчеркнуть, что ДА, синтезируемый в нигростратных ДА-ергических нейронах, играет ключевую роль в качестве нейротрансмиттера в регуляции двигательной функции на уровне терминалей аксонов стриатума, но не на уровне тел нейронов ЧС [Khakimova et al., 2017].
Принципиальная возможность использования αМПТ для снижения уровня ДА в стриатуме была показана в наших предыдущих исследованиях, направленных на создание новой технологии диагностики БП на доклинической стадии [Khakimova et al., 2017]. В этой серии работ определили максимальную дозу αМПТ (125 мг/кг), при которой ингибитор не вызывал нарушение моторной и исследовательской активности у интактных животных, но вызывал их нарушение у животных на моделях доклинической стадии БП независимо от уровня деградации нигростриатной ДА-ергической системы.
Важно отметить, что αМПТ оказывает обратимое и кратковременное действие на животных при отсутствии летальности [Khakimova et al., 2017]. Кроме того, как следует из литературы, αМПТ не токсичен или малотоксичен для человека, поскольку он давно используется в качестве лекарственного средства “Демсер” (“Demser”) для лечения таких хронических заболеваний, как злокачественная феохромоцитома [Bloemen, 2011] и шизофрения [Larsson et al., 1984].
Из вышеизложенного следует, что αМПТ может быть использован для разработки альтернативного ПЭТ нового подхода к оценке степени деградации нигростриатной ДА-ергической системы у человека на различных этапах доклинической стадии БП. Этот подход основан на определении минимальных доз αМПТ, в которых он на различных этапах доклинической стадии БП способен понижать содержание ДА в стриатуме до порога (30%), вызывая, таким образом, нарушение моторной и исследовательской активности. Для разработки были использованы оригинальные модели ранней и поздней доклинической стадий БП, воспроизводимые на мышах с помощью МФТП [Ugrumov et al., 2011].
В настоящей работе было показано, что для модели ранней доклинической стадии, характеризующейся снижением уровня ДА в стриатуме до 80%, минимальная доза αМПТ, при которой происходило снижение уровня ДА в стриатуме до порога – 30% и начинали проявляться нарушения моторно-исследовательской активности, была равна 75 мг/кг. Для модели поздней доклинической стадии БП, характеризующейся снижением уровня ДА в стриатуме до 39%, минимальная доза αМПТ, при которой происходило снижение уровня ДА в стриатуме до порога 30% и начинали проявляться нарушения моторного поведения, была 50 мг/кг. Полученные данные рассматриваются как доказательство того, что степень деградации нигростриатной дофаминергической системы на определенном этапе доклинической стадии БП можно определить по заранее рассчитанной минимальной дозе ингибитора синтеза ДА, в которой он вызывает снижение уровня ДА в стриатуме до порога, что сопровождается нарушением моторного поведения.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящей работе на экспериментальных моделях БП разработан новый легко воспроизводимый подход к оценке степени деградации нигростриатной ДА-ергической системы на определенных этапах доклинической (досимптомной) стадии.
Работа поддержана грантом Президиума РАН по программе “Фундаментальные исследования для разработки биомедицинских технологий” № 41 ФИМТ (проект № 0108-2018-0014).
Список литературы
Ким А.Р., Угрюмов М.В. Изменение концентрации катехоламинов в крови в условиях экспериментальных моделей болезни Паркинсона как биомаркёр ранней стадии заболевания. ДАН. 2015. 464 (4): 494–497.
Приказ Министерства здравоохранения РФ от 1 апреля 2016 г. № 199н “Об утверждении Правил надлежащей лабораторной практики”. Зарегистрировано в Минюсте РФ 15 августа 2016 г. Регистрационный № 43232.
Сафандеев В.В., Колачева А.А., Иванов Д.Е., Угрюмов М.В. Выявление латентной функциональной недостаточности дофаминергических нейронов нигростриатной системы на хронической модели болезни Паркинсона. Нейрохимия. 2017. 34 (4): 290–295.
Agid Y. Parkinson’s disease: pathophysiology. Lancet. 1991. 337 (8753): 1321–1324.
Albin R.L., Young A.B., Penney J.B. The functional anatomy of basal ganglia disorders. Trends Neurosci. 1989. 12 (10): 366–375.
Bailey K.R., Crawley J.N. Anxiety-Related Behaviors in Mice. Methods of Behavior Analysis in Neuroscience. 2-nd edition. Ch. 5. 2009.
Becker G., Muller A., Braune S. Early diagnosis of Parkinson’s disease. J. Neurol. 2002. 249. Suppl:III/40–III/48.
Bezard E., Gross C.E. Compensatory mechanisms in experimental and human parkinsonism: towards a dynamic approach. Prog. Neurobiol. 1998. 55 (2): 93–116.
Bezard E., Dovero S., Prunier C., Ravenscroft, Chalon S., Guilloteau D., Crossman A.R., Bioulac B., Brotchie J.M., Christian E. G. Relationship between the appearance of symptoms and the level of nigrostriatal degeneration in a progressive 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-lesioned macaque model of Parkinson’s disease. J. Neurosci. 2001. 21: 6853–6861.
Bezard E., Gross C.E., Brotchie J.M. Presymptomatic compensation in Parkinson’s disease is not dopamine-mediated. Trends Neurosci. 2003. 26: 215–221.
Bezard E., Porras C.G., Blesa J., Obeso J.A. Compensatory mechanisms in experimental and human parkinsonism: potential for new therapies. In: Steiner, H., Tseng, H.M. (Eds.). Handbook of Basal Ganglia Structure and Function: A Decade of Progress. 2010. Elsevier, San Diego.
Blesa J., Trigo-Damas I., Dileone M., Rey N.L.-G., Hernandez L.F., Obeso J.A. Compensatory mechanisms in Parkinson’s disease: Circuits adaptations and role in disease modification. Exp. Neurol. 2017. 298: 148–161.
Bloemen O.J. N. Brain markers of psychosis and autism: the brain in concert. 2011. 70–89.
Cummings J.L., Henchcliffe C., Schaier S., Simuni T., Waxman A., Kemp P. The role of dopaminergic imaging in patients with symptoms of dopaminergic system neurodegeneration. Brain. 2011. 134 (11): 3146–3166.
Directive 2010/63/EU OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL on the protection of animals used for scientific purposes. 22 September 2010.
Ehringer H., Hornykiewicz O. Distribution of noradrenaline and dopamine (3-hydroxytyramine) in the human brain and their behavior in diseases of the extrapyramidal system. Klin. Wochenschr. 1960. 4: 1236–1239.
Engelman K., Horwitz D., Jequer E., Sjoerdsma A. Biochemical and pharmacologic effects of a-methyltyrosine in man. J. Clin. Invest. 47 (1968): 577–594.
Gaenslen A., Berg D. Early diagnosis of Parkinson’s disease. Int. Rev. Neurobiol. 2010. 90: 81–92.
Gould T.D., Dao D.T., Kovacsics C.E. The Open Field Test. In: Gould T. (eds) Mood and Anxiety Related Phenotypes in Mice. Neuromethods. 42: 2009.
Jadvar H., Colletti P.M. Competitive advantage of PET/MRI. Eur. J. Radiol. 2014. 83: 84–94.
Kalia L.V., Lang A.E. Parkinson’s disease. Lancet. 2015. 386: 896–912.
Khakimova G.R., Kozina E.A., Kucheryanu V.G., Ugrumov M.V. Reversible Pharmacological Induction of Motor Symptoms in MPTP-Treated Mice at the Presymptomatic Stage of Parkinsonism: Potential Use for Early Diagnosis of Parkinson’s Disease. Mol. Neurobiol. 2017. 54 (5): 3618–3632.
Larsson M., Ohman R., Wallin L., Walinder J., Carlsson A. Antipsychotic treatment with alphamethyltyrosine in combination with thioridazine: prolactin response and interaction with dopaminergic precursor pools. J. Neural. Transm. 1984. 60: 115–132.
Paxinos G.F., Franklin K. The Mouse Brain In Stereotaxic Coordinates. Academic Press, San Diego. 2012.
Przedborski S., Jackson-Lewis V., Djaldetti R., Liberatore G., Vila M., Vukosavic S., Almer G. The parkinsonian toxin MPTP: action and mechanism. Restor. Neurol. Neurosci. 2000. 16 (2): 135–142.
Spector S., Sjoerdsma A., Udenfriend S. Blockade of endogenous norepinephrine synthesis by a-methyl-tyrosine, an inhibitor of tyrosine hydroxylase. J. Pharmacol. Exptl. Therap. 1965. 147–186.
Rehman M.U., Wali A.F., Ahmad A., Shakeel S., Rasool S., Ali R., Rashid S.M., Madkhali H., Ganaie M.A., Khan R. Neuroprotective Strategies for Neurological Disorders by Natural Products: An update. Curr. Neuropharmacol. 2018. [Epub ahead of print].
Sjoerdsma A., Engelman K., Spector S., Udenfriend S. Inhibition of catecholamine synthesis in man with alpha methyl-tyrosine, an inhibitor of tyrosine hydroxylase. Lancet. 1965. 2: 1092.
Tripathi M., Kumar A., Bal C. Neuroimaging in Parkinsonian Disorders. Neurol. India. 2018. 66 (7): 68–78.
Ugrumov M.V., Khaindrava V.G., Kozina E.A., Kuche-ryanu V.G., Bocharov E.V., Kryzhanovsky G.N., Kudrin V.S., Narkevich V.B., Klodt P.M., Rayevsky K.S., Pronina T.S. Modeling of presymptomatic and symptomatic stages of parkinsonism in mice. Neuroscience. 2011. 181: 175–188.
Verger A., Klesse E., Chawki M.B., Witjas T. Azulay J.P., Eusebio A., Guedj E. Brain PET substrate of impulse control disorders in Parkinson’s disease: A metabolic connectivity study. Hum. Brain Mapp. 2018. [Epub ahead of print].
Werner P., Barthel H., Drezezga A., Sabri O. Current status and future role of brain PET/MRI in clinical and research settings. Eur. J. Nucl. Med. Mol. Imaging. 2015. 42: 512–516.
Zigmond M.J. Do compensatory processes underlie the preclinical phase of neurodegenerative disease? Insights from an animal model of parkinsonism. Neurobiol. Dis. 1997. 4: 247–253.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


