Геохимия, 2023, T. 68, № 6, стр. 622-628
Термодинамические свойства кокимбита и алюминококимбита
Ю. Д. Гриценко a, b, *, Л. П. Огородова a, **, М. Ф. Вигасина a, Д. А. Косова c, С. К. Дедушенко d, Л. В. Мельчакова a, Д. А. Ксенофонтов a
a Московский Государственный Университет им. М.В. Ломоносова, Геологический факультет
119991 Москва, Ленинские Горы, 1, Россия
b Минералогический музей им. А.Е. Ферсмана РАН
119692 Москва, Ленинский пр., 18, Россия
c Московский Государственный Университет им. М.В. Ломоносова, Химический факультет
119991 Москва, Ленинские Горы, 1, Россия
d НИТУ МИСИС
119049 Москва, Ленинский пр., 4, Россия
* E-mail: ygritsenko@rambler.ru
** E-mail: logor48@mail.ru
Поступила в редакцию 21.09.2022
После доработки 07.11.2022
Принята к публикации 09.11.2022
- EDN: ELQGOT
- DOI: 10.31857/S0016752523050059
Аннотация
Исследован кокимбит ${\text{AlFe}}_{3}^{{3 + }}$[SO4]6(H2O)12⋅6H2O (рудник Хавьер, Перу) методами термического и электронно-микрозондового анализа, порошковой рентгенографии, КР и мёссбауэровской спектроскопии. Методом калориметрии растворения в расплаве бората свинца 2PbO∙B2O3 на микрокалориметре Кальве “Setaram” (Франция) определена энтальпия образования кокимбита из элементов ∆fH0(298.15 K) = –11 118 ± 40 кДж/моль. Оценено значение его абсолютной энтропии S0(298.15 K) = 1248.3 ± 3.0 Дж/(моль K), рассчитаны энтропия образования ∆fS0(298.15 K) = = ‒5714.0 ± 3.0 Дж/(моль K) и энергия Гиббса образования из элементов ∆fG0(298.15 K) = –9411 ± ± 40 кДж/моль. Оценены значения энтальпии и энергии Гиббса образования из элементов алюминококимбита ${\text{A}}{{{\text{l}}}_{2}}{\text{Fe}}_{2}^{{3 + }}$[SO4]6(H2O)12⋅6H2O: – 11 540 ± 29 и 9830 ± 29 кДж/моль соответственно.
ВВЕДЕНИЕ
Кокимбит, паракокимбит и алюминококимбит – вторичные минералы, встречающиеся в засушливых регионах в зоне окисления сульфидных месторождений, содержащих пирит, марказит или пирротин (Перу, Чили, штаты Калифорния и Юта в США, а также в Аргентине, Австралии, Боливии, Китае, Монголии, Греции, Иране, Марокко, Португалии, Южной Африке, Испании), реже в районах, связанных с фумарольной активностью вулканов (например, вулкан Шевелуч, Камчатка, Россия; остров Вулкано, Италия). Также кокимбит был обнаружен чувствительными спектральными дистанционными методами исследования среди водных сульфатов железа на поверхности Марса (Poitras et al., 2018; Turenne et al., 2022).
Кокимбит ${\text{AlFe}}_{3}^{{3 + }}$[SO4]6(H2O)12⋅6H2O (IMA list of minerals) и паракокимбит ${\text{Fe}}_{4}^{{3 + }}$[SO4]6(H2O)12⋅6H2O (IMA list of minerals) кристаллизуются в тригональной сингонии, пространственные группы $P\bar {3}1c$ и $R\bar {3}$ соответственно, причем в (Robinson, Fang, 1971) эти минералы рассматриваются как политипы. Для структур кокимбита и паракокимбита характерно наличие изолированных октаэдров [Fe(H2O)6]3+ и/или [Al(H2O)6]3+ и кластеров [Fe3(SO4)6(H2O)6]3–, в которых атом железа в одной позиции координирован шестью атомами кислорода, принадлежащими исключительно сульфат-ионам, а каждый из двух атомов железа в других позициях координирован тремя кислородными атомами сульфат-ионов и тремя атомами кислорода молекул Н2О. В структурах этих минералов также существует сложная система водородных связей между молекулами воды, входящими в состав кластеров, изолированных октаэдров и молекул, занимающих междоузельные позиции (Yang, Giester, 2018). Структура алюминококимбита ${\text{A}}{{{\text{l}}}_{2}}{\text{Fe}}_{2}^{{3 + }}$[SO4]6(H2O)12⋅6H2O (IMA list of minerals), кристаллизующегося в тригональной сингонии с пространственной группой $P\bar {3}1c,$ отличается от вышеописанной структуры кокимбита и содержит изолированные октаэдры ${\text{Al(}}{{{\text{H}}}_{2}}{\text{O}})_{6}^{{3 + }}$ и бесконечные колонки [Fe(SO4)3]∞, идущие вдоль [001] и состоящие из октаэдрически координированных атомов железа и сульфат-ионов, подобно структуре ферринатрита Na3(H2O)3[Fe(SO4)3]. Междоузельные молекулы H2O удерживаются водородными связями, как и в структуре кокимбита (Demartin et al., 2010а, б).
Известные к настоящему времени исследования кокимбита, паракокимбита и алюминококимбита относятся, главным образом, к изучению их структуры и определению параметров элементарной ячейки (Fang, Robinson, 1970; Robinson, Fang, 1971; Majzlan et al., 2010; Yang, Giester, 2018; Mauro et al., 2020). ИК и КР спектроскопическим исследованиям посвящены работы (Majzlan et al., 2011; Frost et al., 2014; Mauro et al., 2020). Термическая стабильность исследована в (Ackermann et al., 2009; Frost et al., 2014).
Практический и научный интерес к исследованию водных сульфатов железа и в частности кокимбита обусловлен их ролью в процессе выветривания горных пород, содержащих значительное количество сульфидных минералов (чаще всего пирита, марказита или пирротина), при котором взаимодействие сульфидов с водой и воздухом приводит к образованию водорастворимых сульфатов и серной кислоты, разрушающей окружающие горные породы, в результате чего металлы (в том числе и токсичные) выносятся кислыми дренажными растворами (кислотный дренаж пород, рудников, отвалов и шахт), загрязняя водные и почвенные горизонты, что представляет собой экологическую опасность при хозяйственном использовании этих территорий.
Решению проблем, связанных с загрязнением окружающей среды, может способствовать теоретическое моделирование физико-химических процессов в системе вода–порода, базирующееся на термодинамических данных минералов, объем которых в настоящее время недостаточен. Так, например, сейчас известна одна экспериментальная работа (Majzlan et al., 2006), в которой на основании данных метода кислотной калориметрии была определена энтальпия образования из элементов, оценена стандартная энтропия и рассчитана энергия Гиббса кокимбита состава (${\text{Fe}}_{{1.47}}^{{3 + }}$Al0.53)[SO4]3(H2O)9.65; а в работе (Hemingway et al.. 2002) представлены лишь оценочные значения основных термодинамических параметров паракокимбита состава ${\text{Fe}}_{2}^{{3 + }}$[SO4]3⋅9H2O, рассматриваемого в этой работе как кокимбит. Авторами исследования, выполненного методом кислотной калориметрии (Ackermann et al., 2009), определена энтальпия образования синтезированного аналога паракокимбита.
Целью настоящего исследования является экспериментальное получение для кокимбита его энтальпии образования из элементов методом расплавной калориметрии растворения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Описание образца и методы исследования
Был исследован образец кокимбита из коллекции Минералогического музея им. А.Е. Ферсмана РАН (рудник Хавьер, Перу). Образец представляет собой щетку прозрачных кристаллов густо-сиреневого цвета размером до 3 мм на мелкозернистой карбонатной породе.
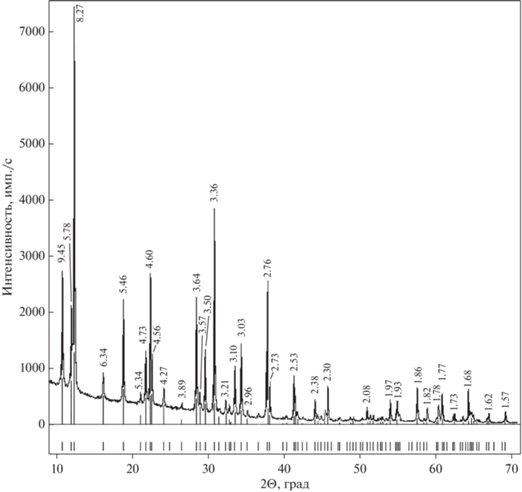
Рентгенографическое изучение было проведено на порошковом дифрактометре “STOE-STADI MP” (Германия) с изогнутым Ge (III) монохроматором, обеспечивающим строго монохроматическое CoKα1-излучение (λ = 0.178897 Å). Сбор данных осуществлялся в режиме поэтапного перекрывания областей сканирования с помощью позиционно-чувствительного линейного детектора с углом захвата 5° по углу 2Θ с шириной канала 0.02°.
Полученный спектр (рис. 1) согласно базам данных ICDD (The International Centre for Diffraction Data, 2013; карточка № 01-071-2380) соответствует спектру кокимбита (Перу).
Рис. 1.
Порошковая дифрактограмма изученного кокимбита, межплоскостные расстояния указаны в Å. Внизу приведены данные для кокимбита из ICDD (карточка № 01-071-2380).
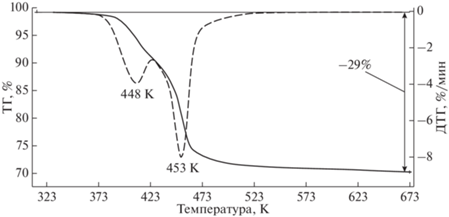
Термическое поведение минерала от комнатной температуры до Т = 673 K было изучено на установке “NETZSCH TG 209 F1” (Германия) в потоке азота (40 мл мин–1) со скоростью нагревания 10 K мин–1. Прибор был откалиброван по температуре плавления эталонных веществ, предоставленных фирмой–изготовителем (Ag, Al, Bi, In, Sn 99.999% чистоты). Измерения проводили в стандартных алюминиевых контейнерах с проколотой крышкой; масса образца составляла 14.70 мг.
На термогравиметрической кривой (рис. 2) зафиксирован процесс потери массы, связанный с дегидратацией минерала, происходящей в два этапа: на первом этапе в интервале от 348 до 424 K с максимумом при ~448 K потеря массы составляет 9.4%, что соответствует выделению около 6 молекул Н2О; второй этап с максимумом при ~453 K заканчивается при T = 648 K, при этом происходит удаление оставшиеся 19.6% массы, что соответствует 12 молекулам воды.
Химический анализ был выполнен на сканирующем электронном микроскопе с вольфрамовым термоэмиссионным катодом “JSM-6480LV” (Jeol Ltd., Япония), оборудованном энергодисперсионным спектрометром “X-Max-50” (Oxford Instruments Ltd., GB), при ускоряющем напряжении 20 кВ, силе тока 10.05 ± 0.05 нА. Обработка данных была произведена в программе INCA (Oxford Instruments, v. 22).
По данным микрозондового и термогравиметрического анализов был получен следующий химический состав изученного минерала (мас. %): Na2O 0.08, K2O 0.7, Al2O3 4.36, Fe2O3 21.58, SO3 43.19, H2O 29.00. Рассчитанная на 12 зарядов химическая формула минерала имеет вид Al0.97${\text{Fe}}_{{3.04}}^{{3 + }}$Na0.03K0.02[SO4]6.04(H2O)12⋅6H2O и близка к теоретической формуле, рекомендуемой Международной Минералогической Ассоциацией (IMA) ${\text{AlFe}}_{3}^{{3 + }}$[SO4]6(H2O)12·6H2O.
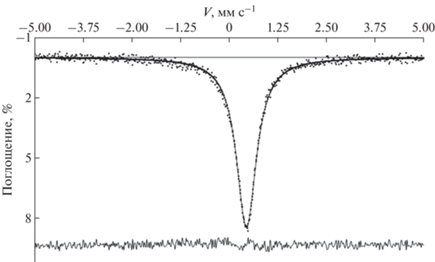
Гамма-резонансное исследование кокимбита было выполнено на мессбауэровском спектрометре ЯГРС-6 “Персей” (Россия) при комнатной температуре с использованием источника 57Co в матрице Rh активностью 8 мКи. Калибровку спектрометра проводили с помощью стандартного поглотителя α-Fe. Моделирование спектра осуществляли с применением российской компьютерной программы HappySloth (www.happysloth.ru).
Полученный спектр (рис. 3) согласуется со спектром кокимбита, представленным в (Dyar et al., 2013), и был удовлетворительно описан одиночной уширенной лоренцевой линией с параметрами: RTISα-Fe = 0.46 ± 0.01 мм с–1, FWHM = 0.85 ± ± 0.05 мм с–1, χ2 = 1.2. Измеренный изомерный сдвиг соответствует интервалу значений, обычно наблюдаемых для октаэдрических кислородных полиэдров трехвалентного железа [Fe3+O6], несколько превышая расчетное значение (Dedushenko, Perfiliev, 2022), что может быть объяснено поляризующим действием ионов S6+. Более детальная интерпретация спектра требует дополнительных исследований при низких температурах.
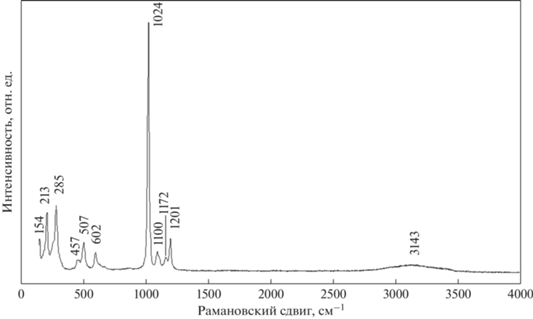
КР-спектроскопическое изучение было проведено на рамановском микроскопе “EnSpectr R532” (Россия). Длина волны лазерного излучения равнялась 532 нм, выходная мощность луча составляла 20 мВт, голографическая дисперсионная решетка имела 1800 штр./мм, спектральное разрешение – около 6 см–1, диаметр фокального пятна при увеличении 40× равнялся 7 мкм. Спектр был получен в диапазоне от 100 до 4000 см–1 на неориентированном образце в режиме накопления сигнала в течение 1 секунды при усреднении по 50 экспозициям.
Спектр комбинационного рассеяния изученного кокимбита (рис. 4) согласуется со спектрами этого минерала, опубликованными в (Frost et al., 2014; Mauro et al., 2020). Спектральная область от 2800 до 3600 см–1 соответствует валентным колебаниям гидроксильных групп молекул воды; в интервале 1000–1250 см–1 зарегистрированы линии, относящиеся к симметричному (самая интенсивная линия при 1024 см–1) и антисимметричным валентным колебаниям тетраэдров [SO4]2–; деформационные колебания SO4-тетраэдров зафиксированы в диапазоне 440–630 см–1; в спектральной области ниже 300 см–1 проявлены линии рассеяния так называемых решеточных мод (валентные колебания Fe–O и Al–O).
Термохимическое исследование было выполнено на высокотемпературном теплопроводящем микрокалориметре Тиана–Кальве “Setaram” (Франция). Методом калориметрии растворения в расплаве состава 2PbO∙B2O3 была определена энтальпия образования изученного образца кокомбита. Опыты по растворению осуществляли следующим образом: образцы массой 4–9 (±2 × 10–3) мг сбрасывали от комнатной температуры в калориметр с расплавом, находящимся при T = 973 К; зафиксированный при этом тепловой эффект содержал одновременно как приращение энтальпии образца [(H0(973 K) – H0(298.15 K)], так и энтальпию его растворения ΔраствH0(973 K). При проведении 6–8 экспериментов в одной порции расплава (30–35 г) соотношение растворенное вещество–растворитель можно было отнести к бесконечно разбавленному раствору с пренебрежимо малой энтальпией смешения. Калибровку микрокалориметра осуществляли методом “сброса” эталонного вещества – платины в расплав в условиях экспериментов по растворению, при этом измерялось только приращение энтальпии [(H0(973 K) – H0(298.15 K)], необходимые справочные данные заимствовались из (Robie, Hemingway, 1995).
Среднее значение величины [H0(973 K) – ‒ H0(298.15 K) + ΔраствH0(973 K)] из 7 экспериментов, проведенных на микрокалориметре Кальве на природном образце кокимбита, составило 1312.2 ± 7.3 Дж/г = 1437.1 ± 8.0 кДж/моль (М = = 1095.18 г/моль), погрешности определены с вероятностью 95%.
РЕЗУЛЬТАТЫ ТЕРМОХИМИЧЕСКОГО ИССЛЕДОВАНИЯ
Энтальпии образования из элементов
С использованием полученных калориметрических данных и термохимического цикла, включающего растворение минерала и составляющих его компонентов, по реакции (1) и уравнениям (2) и (3) была рассчитана энтальпия образования изученного кокимбита из элементов.
(1)
$\begin{gathered} {\text{3/2}}{\text{F}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\,{\text{ + 6}}{\text{CaS}}{{{\text{O}}}_{{\text{4}}}}\,{\text{ + 12Al}}{{\left( {{\text{OH}}} \right)}_{{\text{3}}}} = \\ {\text{ = 6CaO + 11/2}}{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\,{\text{ + }}\,{\text{Al}}{{\left[ {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right]}_{{\text{6}}}}{{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}_{{{\text{12}}}}} \cdot {\kern 1pt} {\text{6}}{{{\text{H}}}_{{\text{2}}}}{\text{O,}} \\ \end{gathered} $(2)
$\begin{gathered} {{\Delta }_{{\text{р}}}}{{_{{\text{ - }}}}_{{{\text{ции}}}}}_{{\left( 1 \right)}}{{H}^{0}}(298.15\,{\text{K}}) = 1.5{\text{ }}\Delta H{\text{F}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 6\Delta H{\text{CaS}}{{{\text{O}}}_{4}}\, + \\ + {\text{ }}12\Delta H{\text{Al}}{{\left( {{\text{OH}}} \right)}_{{\text{3}}}} - 6\Delta H{\text{CaO}} - 5.5\Delta H{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} - \\ - \,\,\Delta H{\text{Al}}{{\left[ {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right]}_{{\text{6}}}}{{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}_{{12}}} \cdot {\kern 1pt} 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(3)
$\begin{gathered} {{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K}}){\text{Al}}{{\left[ {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right]}_{6}}{{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}_{{12}}} \cdot {\kern 1pt} {\kern 1pt} 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {{\Delta }_{{\text{р}}}}{{_{{\text{ - }}}}_{{{\text{ции}}}}}{{_{(}}_{1}}_{)}{{H}^{0}}(298.15{\text{ K}}) + 1.5{{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K}}){\text{F}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + ~ \\ + \,\,~6{{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K}}){\text{CaS}}{{{\text{O}}}_{4}} + \\ + \,\,12{{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K}}){\text{Al}}{{\left( {{\text{OH}}} \right)}_{3}}-- \\ - \,\,6{{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K}}){\text{CaO}} - 5.5{{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K}}){\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}}, \\ \end{gathered} $Таблица 1.
Термохимические данные, использованные в расчетах энтальпии образования кокимбита и алюминококимбита (кДж/моль)
| Компонент | H0(973 K) – H0(298.15 K) + ΔраствH0(973 K) | – ΔfH0(298.15 K)а |
|---|---|---|
| Fe2O3(гематит) | 171.6 ± 1.9б | 826.2 ± 1.3 |
| Al2O3(корунд) | 107.38 ± 0.59в | 1675.7 ± 1.3 |
| CaO(к.) | –21.78 ± 0.29г | 635.1 ± 0.9 |
| CaSO4(ангидрит) | 131.3 ± 1.6д | 1434.4 ± 4.2 |
| Al(OH)3(гиббсит) | 172.6 ± 1.9е | 1293.1 ± 1.2 |
Примечания. а Справочные данные (Robie, Hemingway, 1995).
б–д Рассчитано с использованием справочных данных по [H0(973 K) – H0(298.15)] (Robie, Hemingway, 1995) и экспериментальных данных по растворению ΔраствH0(973 К): б(Киселева, 1976), в(Ogorodova et al., 2003), г(Киселева и др., 1979), д(Котельников и др., 2000).
Таблица 2.
Термодинамические свойства кокимбита и алюминококимбита, полученные в настоящей работе
| Состав минерала, молекулярная масса, г/моль |
–ΔfH0(298.15 K)а кДж/моль | S0(298.15 K)б, Дж/(моль K) | –ΔfS0(298.15 K)в, Дж/(моль K) | –ΔfG0(298.15 K)г, кДж/моль |
|---|---|---|---|---|
| Кокимбит | ||||
| ${\text{AlFe}}_{3}^{{3 + }}$[SO4]6(H2O)12⋅6H2O M = 1095.18 |
11118 ± 40д | 1248.3 ± 3.0 | 5714.0 ± 3.0 | 9411 ± 40 |
| Алюминококимбит | ||||
| ${\text{AlFe}}_{2}^{{3 + }}$[SO4]6(H2O)12⋅6H2O М = 1066.31 |
11537 ± 41е 11543 ± 41ж Среднее: 11 540 ± 29 |
1226.6 ± 2.9 | 5736.9 ± 2.9 | 9830 ± 29 |
Калориметрические данные по растворению природного образца кокимбита позволили рассчитать энтальпии образования из элементов алюминококимбита ${\text{A}}{{{\text{l}}}_{2}}{\text{Fe}}_{2}^{{3 + }}$[SO4]6(H2O)12⋅6H2O. Экспериментальные значения [H0(973 K) –‒ H0(298.15 K) + ΔраствH0(973 K)] пересчитывали на состав алюминококимбита путем введения поправок на отличие его состава от изученного кокимбита, а также с учетом его молекулярной массы. Результаты расчетов, выполненных по уравнениям, аналогичным (1), (2) и (3), представлены в табл. 2.
Энергии Гиббса образования из элементов
Необходимые для расчета энергии Гиббса минералов величины абсолютной энтропии были получены как средние значения из реакций (4), (5) и (6) для изученного кокимбита или аналогичных реакций для алюминококимбита с использованием справочных данных по S0(298.15 K) для компонентов этих реакций из (Robie, Hemingway, 1995); вклад воды был принят равным 39.3 Дж/(моль K) (Наумов и др., 1971).
(4)
$\begin{gathered} 3{\text{/}}2{\text{F}}{{{\text{e}}}_{{\text{2}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}} + 1{\text{/}}2{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{3}} + 18{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{AlFe}}_{3}^{{3 + }}{{\left[ {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right]}_{6}}{{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}_{{12}}} \cdot {\kern 1pt} 6{{{\text{H}}}_{{\text{2}}}}{\text{O,}} \\ \end{gathered} $(5)
$\begin{gathered} 3{\text{/}}2{\text{F}}{{{\text{e}}}_{{\text{2}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}} + 1{\text{/}}2{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{3}} + 3{\text{NiS}}{{{\text{O}}}_{4}} \cdot {\kern 1pt} 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{AlFe}}_{3}^{{3 + }}{{\left[ {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right]}_{{\text{6}}}}{{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}_{{12}}} \cdot {\kern 1pt} 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 3{\text{NiS}}{{{\text{O}}}_{4}}, \\ \end{gathered} $(6)
$\begin{gathered} 3{\text{/}}2{\text{F}}{{{\text{e}}}_{{\text{2}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}} + 1{\text{/}}2{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}} + 2{\text{MgS}}{{{\text{O}}}_{4}} \cdot {\kern 1pt} 7{{{\text{H}}}_{{\text{2}}}}{\text{O}} + \\ + \,\,4{\text{Mg}}{{\left( {{\text{OH}}} \right)}_{2}} = {\text{Al}}{{\left[ {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right]}_{{\text{6}}}}{{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}_{{12}}} \cdot {\kern 1pt} 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} + \\ + \,\,2{\text{MgS}}{{{\text{O}}}_{4}} + 4{\text{MgO}}. \\ \end{gathered} $Значения ΔfS0(298.15 K) минералов (табл. 2) были рассчитаны с использованием данных по S0(298.15 K) для элементов, входящих в их состав (Robie, Hemingway, 1995). Значения ΔfG0(298.15 K), вычисленные с учетом полученных данных по энтропии и энтальпии образования, приведены в табл. 2.
ЗАКЛЮЧЕНИЕ
Полученные термодинамические данные для кокимбита и алюминококимбита могут быть использованы при моделировании процессов выветривания горных пород, приводящих к развитию кислотного дренажа на сульфидсодержащих рудных месторождениях. Результаты моделирования могут быть полезными при разработке технологических схем извлечения из кислых дренажных растворов ценных компонентов, а также для оценки экологических последствий кислотного дренажа, разработки мер по минимизации негативного воздействия кислых вод на окружающую среду и способов нейтрализации и очистки вод от ионов токсичных металлов.
Термическая установка и мессбауэровский спектрометр находятся на химическом факультете МГУ, дифрактометр, сканирующий электронный микроскоп, рамановский микроскоп и микрокалориметр Кальве установлены на геологическом факультете МГУ.
Список литературы
Киселева И.А. (1976) Термодинамические свойства и устойчивость пиропа. Геохимия. (6), 845-854.
Киселева И.А., Огородова Л.П., Топор Н.Д., Чигарева О.Г. (1979) Термохимическое исследование системы СаО–MgO–SiO2. Геохимия. (12), 1811-1825.
Котельников А.Р., Кабалов Ю.К., Зезюля Т.Н., Мельчакова Л.В., Огородова Л.П. (2000) Экспериментальное изучение твердого раствора целестин-барит. Геохимия. (12), 1286-1293.
Kotel’nikov A.R., Kabalov Yu.K., Zezyulya T.N., Mel’chakova L.V., Ogorodova L.P. (2000) Experimental study of celestine-barite solid solution. Geochem. Int. (12), 1181-1187.
Наумов Г.Б., Рыженко Б.Н., Ходаковский И.Л. (1971) Справочник термодинамических величин (для геологов). М.: Атомиздат. 239 с.
Огородова Л.П., Киселева И.А., Мельчакова Л.В., Вигасина М.Ф., Спиридонов Э.М. (2011) Калориметрическое определение энтальпии образования пирофиллита. ЖФХ. (9), 1609-1611.
Ackermann S., Lazic B., Armbruster T., Doyle S., Grevel K.-D., Majzlan J. (2009) Thermodynamic and crystallographic properties of kornelite [Fe2(SO4)3 ~ 7.75H2O] and paracoquimbite [Fe2(SO4)3·9H2O]. Am. Mineral. 94, 1620-1628.
Dedushenko S.K., Perfiliev Yu.D. (2022) On the correlation of the 57Fe Mössbauer isomer shift and some structural parameters of a substance Hyperfine Interactions. 243, № 15.
Demartin F., Castellano C., Gramaccioli C.A., Campostrini I. (2010a) Aluminum-for-iron substitution, hydrogen bonding, and a novel structure-type in coquimbite-like minerals. Canad. Mineral. 48, 323-333.
Demartin F., Castellano C., Gramaccioli C.A., Campostrini I. (2010b) Aluminocoquimbite, AlFe (SO4)3·9H2O, a new aluminum iron sulfate from Grotta Dell’allume, Vulcano, Aeolian Islands, Italy. Canad. Mineral. 48, 1465-1468.
Dyar M.D., Jawin E.R., Breves E., Marchand G., Nelms M., Lane M.D., Mertzman S.A., Bish D.L., Bishop J.L. (2014) Mössbauer parameters of iron in phosphate minerals: Implications for interpretation of martian data. Am.Mineral. 99, 914-942.
Fang J.H., Robinson P.D. (1970) Crystal structure and mineral chemistry of hydrated ferric sulfates. I. The crystal structure of coquimbite. Am. Mineral. 55, 1534-1540.
Frost R.L., Gobac Ž.Ž., López A., Xi Y., Scholz R., Lana C., Lima R.M.F. (2014) Characterization of the sulphate mineral coquimbite, a secondary iron sulphate from Javier Ortega mine, Lucanas Province, Peru – Using infrared, Raman spectroscopy and thermogravetry. J. Mol. Struct. 1063, 251-258.
Hemingway B., Seal R.R., II, Chou I.-M. (2002) Thermodynamic data for modeling acid mine drainage problems: Compilation and estimation of data for selected soluble iron-sulfate minerals. U.S. Geol. Survey, Open-File Report, 02-161, 13 p.
IMA list of minerals. http://cnmnc.main.jp/IMA_Master_ List_(2021-11).pdf.
Majzlan J., Navrotsky A., McCleskey R.B., Alpers C.N. (2006) Thermodynamic properties and crystal structure refinement of ferricopiapite, coquimbite, rhomboclase, and Fe2(SO4)3(H2O)5. Eur. J. Mineral.
Majzlan J., Dordevié T., Kolitsch U. (2010) Hydrogen bonding in coquimbite, nominaly Fe2(SO4)3⋅9H2O, and the relationship between coquimbite and paracoquimbite. Miner. Petrol. 100, 241-248.
Majzlan J., Alpers C.N., Koch C.B., McCleskey R.B., Myneni S.C.B., Neil J.M. (2011) Vibrational, X-ray absorption, and Mőssbauer spectra of sulfate minerals from the weathered massive sulfide deposit at Iron Mountain, California. Chem. Geol. 284, 296-305.
Mauro D., Biagioni C., Pasero M., Skogby H., Zaccarini F. (2020) Redefinition of coquimbite, Al Fe3(SO4)6(H2O)12⋅6H2O. Mineral. Magaz. 84, 275-282.
Ogorodova L.P., Melchakova L.V., Kiseleva I.A., Belitsky I.A. (2003) Thermochemical study of natural pollucite. Thermochim. Acta 403, 251–256.
Poitras J.T., Cloutis E.A., Salvatore M.R., Mertzman S.A., Applin D.M., Mann P. (2018) Mars analog minerals’ spectral reflectance characteristics under Martian surface conditions. Icarus. 306, 50-73.
Robie R.A., Hemingway B.S. (1995) Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar (105 pascals) pressure and at higher temperatures. U S Geol. Surv. Bull. 2131.
Robinson P.D., Fang J.H. (1971) Crystal structure and mineral chemistry of hydrated ferric sulfates. II. The crystal structure of paracoquimbite. Am. Mineral. 56, 1567-1572.
Turenne N., Parkinson A., Applin D.M., Mann P., Cloutis E.A., Mertzman S.A. (2022) Spectral reflectance properties of minerals exposed to Martian surface conditions: Implications for spectroscopy-based mineral detection on Mars. Planet. Space Sci. 210, 105377.
www.happysloth.ru: Левин Д.М., Дедушенко С.К. Программа для ЭВМ “Happy Sloth”. Реестр программ для ЭВМ. № 2016660090.
Yang Z., Giester G. (2018) Structure refinement of coquimbite and paracoquimbite from the Hongshan Cu–Au deposit, NW China. Eur.J. Mineral. 30, 849-858.
Дополнительные материалы отсутствуют.