Геохимия, 2023, T. 68, № 6, стр. 608-621
Перенос металлов в гидротермальных условиях в виде коллоидных частиц и пересыщенных истинных растворов
В. А. Алексеев *
Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: alekseyev-v@geokhi.ru
Поступила в редакцию 27.10.2022
После доработки 16.11.2022
Принята к публикации 02.12.2022
- EDN: EGRHGQ
- DOI: 10.31857/S0016752523050023
Аннотация
Коллоиды металлов в гидротермальных растворах изучены значительно хуже, чем в поверхностных и подземных водах. Тем не менее из опубликованных работ следует, что коллоидные частицы, содержащие металлы, присутствуют в гидротермальных минералах, в геогазе и в подземных водах над рудными телами, во флюидных включениях минералов, в геотермальных растворах. Образование этих частиц обычно связывают с нуклеацией в пересыщенном растворе, который образуется в реакциях превращения минералов или при вскипании флюидов. Опубликованные экспериментальные данные подтверждают возможность образования коллоидных частиц и сохранения их стабильности в гидротермальных условиях. Для всесторонней оценки мобильности коллоидных частиц в этих условиях не хватает экспериментов по фильтрации пересыщенных и коллоидных растворов в пористых средах при повышенных температурах. Участие коллоидов в гидротермальном рудном процессе наиболее наглядно проявилось при формировании богатых эпитермальных Au месторождений. На примере кварцевого геотермометра показана возможность переноса металлов в истинном пересыщенном растворе, что может быть даже более эффективным, чем коллоидный перенос. Таким образом, перенос металлов в гидротермальном процессе возможен в значительно более высоких концентрациях, чем следует из традиционного подхода, основанного на равновесной термодинамике.
ВВЕДЕНИЕ
Коллоидами называются гетерогенные дисперсные системы, в которых дискретные частицы, капли или пузырьки дисперсной фазы равномерно распределены в дисперсионной среде, которая имеет другое агрегатное состояние и/или другой состав. В данной работе этот термин используется в более узком смысле как коллоидный раствор, в котором дисперсная фаза и дисперсионная среда представлены соответственно твердыми частицами и водой или водным раствором. Размер коллоидных частиц достаточно мал (от 1 нм до 1–10 мкм), поэтому они находятся в воде во взвешенном состоянии за счет броуновского движения (Baalousha et al., 2011; Gavrilescu, 2014; Wang et al., 2020). Самые мелкие коллоидные частицы (1–100 нм) называются наночастицами, которые из-за своих малых размеров имеют свойства, отличные от свойств более крупных частиц (Алексеев, 2019). Например, если частицы представлены металлами, уменьшение их размера меняет поведение электронов, что приводит к усилению квантового размерного эффекта (Roldughin, 2000).
Природные воды перед химическими анализами обычно фильтруются через фильтры с размером пор 0.2–0.5 мкм. Ранее полагали, что в отфильтрованной таким образом воде все элементы находятся в истинно растворенном виде. Позднее выяснилось, что для микрокомпонентов это не так, т.к. они часто входят в состав коллоидных частиц, которые проходят через поры фильтра. Прогресс в изучении коллоидов произошел с развитием и совершенствованием методов их разделения и анализа: ультрафильтрации, проточного фракционирования в поперечном силовом поле, электронной и атомно-силовой микроскопии, масс-спектрометрии с индуктивно связанной плазмой (ИСП-МС), методами светорассеяния, рентгеновской спектроскопии и др. (Иванеев и др., 2021; Baalousha et al., 2011; Wang et al., 2020). Опубликовано большое количество природных, экспериментальных и теоретических исследований состава и структуры коллоидов, распределения их по размеру, распространенности, условий стабильности и агрегации, особенностей коллоидов в морях, реках, озерах, болотах, в подземных водах с разными вмещающими породами и др. Эти исследования неоднократно обобщались в многочисленных обзорах (Baalousha et al., 2011; Doucet et al., 2007; Flury, Aramrak, 2017; Gavrilescu, 2014; Sen, Khilar, 2006; Wang et al., 2020; Zhang et al., 2012 и др.). Суть этих обобщений вкратце сводится к следующему.
Природные коллоидные частицы могут быть неорганическими (оксиды и гидроксиды Fe, Mn, Si, Al-филлосиликаты, карбонаты, сульфиды) или органическими (гуминовые и фульвокислоты, протеины, полисахариды, сахара, нуклеиновые и аминокислоты, вирусы, бактерии, споры). Характерен также смешанный состав, когда минеральные частицы покрываются органическим веществом. В последнее время в природных условиях все больше фиксируются антропогенные коллоидные частицы (Baalousha et al., 2011), которые представлены пластиком, лекарствами, гормонами, пестицидами, радиоактивными элементами, искусственными наночастицами (Au, Ag, Fe, оксиды Fe, Zn, Ti, Ce, квантовые точки и др.). Суммируются результаты природных исследований по содержаниям металлов в коллоидной форме в поверхностных и морских водах (Doucet et al., 2007), выделяются элементы (Al, Fe, Cr, U, Mo, Pb, Ti, Th), которые переносятся в основном в коллоидной форме (Gavrilescu, 2014), разрабатываются теоретические основы и математические модели взаимодействия коллоидов с тяжелыми металлами (Bin et al., 2011; Sposito, 2017). Большая удельная поверхность коллоидных частиц обеспечивает высокую сорбционную емкость труднорастворимых металлов, концентрация которых в растворе становится выше их термодинамической растворимости и металлы переносятся на расстояния, значительно превышающие предсказанный неколлоидный перенос. Экспериментально получены константы адсорбции или комплексообразования металлов на коллоидных частицах разного состава (Дину, Шкинев, 2020; Моисеенко и др., 2013; Doucet et al., 2007 и др.). Для дальнего переноса металлов в коллоидной форме благоприятна большая скорость адсорбции и малая скорость десорбции (Baalousha et al., 2011).
В работе (Sen, Khilar, 2006) обобщены результаты лабораторных и природных исследований, в которых оценивалась скорость и условия коллоидного переноса в насыщенной водой пористой среде, представлены значения критической концентрации соли и критической концентрации коллоидных частиц, необходимые для мобилизации коллоидов в пористой среде, обсуждаются механизмы блокировки коллоидов в порах при разных отношениях размеров коллоидов и пор. В работе (Zhang et al., 2012) обобщены лабораторные и природные исследования, касающиеся источников, механизмов захвата и переноса коллоидов в трещиноватых породах.
В работе (Wang et al., 2020) суммированы результаты экспериментов, природных наблюдений и математического моделирования по коллоидному переносу через гетерогенную (с микро- и макропорами) почву в ненасыщенных условиях нестационарного течения, которое характеризуется чередованием смачивания и высыхания. В этих условиях появляются капиллярные силы на границах вода–воздух и вода–воздух–твердое тело. Увеличение ионной силы раствора и гидрофобности коллоидных частиц усиливает прикрепление последних к этим границам. Циклы смачивания/высыхания меняют конфигурацию этих границ и толщину водных пленок, т.е. постоянно меняют соотношение различных сил, что приводит к большей мобилизации коллоидных частиц, чем при постоянном течении. Физическая неоднородность почвы усиливает влияние этих циклов. В работе (Flury, Aramrak, 2017) обсуждается теория взаимодействий на границе раздела коллоид–воздух–вода, основанная на термодинамике и действующих силах (ван-дер-ваальсовы, электростатические, гидрофобные, капиллярные). Теория подтверждена экспериментальными данными, которые показали, что в зависимости от гидродинамики смачивания или высыхания воды в пористой среде, а также от гидрофобности коллоидных частиц и стенок пор, коллоидные частицы могут прикрепляться к границе воздух–вода и к стенкам пор, или отсоединяться от них.
В отличие от поверхностных и подземных вод, для гидротермальных растворов данных по коллоидному переносу металлов мало, а обзорных работ, по-видимому, вообще нет за исключением старой работы (Chukhrov, 1966). Данная обзорная работа выполнена с целью частично восполнить этот пробел. Основное внимание уделено различным аспектам природных и экспериментальных исследований. Из-за дефицита данных использовались работы, в которых изучались не только коллоиды, но и частицы более крупного размера. Если для поверхностных вод металлы считаются потенциально вредными, то для гидротермальных растворов они считаются полезными элементами, способными концентрироваться в рудные тела.
ПРИРОДНЫЕ ИССЛЕДОВАНИЯ
Ранее присутствие коллоидов в гидротермальных рудных флюидах допускалось в основном на основании существования минералов с гладкой выпуклой поверхностью, которая напоминает искривление поверхности капли жидкости под действием поверхностного натяжения (Chukhrov, 1966). Предполагалось, что такая колломорфная или глобулярная текстура минералов возникала в результате старения гелей, которые, в свою очередь, образовались в результате коагуляции коллоидных частиц. Помимо этого критерия использовались и другие: неоднородность минералов (примеси), трещины усыхания, диффузионная полосчатость (Park, MacDiarmid, 1964). В обзорной работе (Chukhrov, 1966) приведены многочисленные примеры колломорфных и глобулярных агрегатов природных коллоидных и метаколлоидных минералов. Позднее список этих примеров неоднократно пополнялся. Обнаружены колломорфные полосы дендритоподобных глобулярных агрегатов электрума (Marinova et al., 2014), полифазный уран-титановый метагель (Алешин и др., 2016), метаколлоидные гель-пиритовые и гель-настурановые прожилки (Дымков и др., 2014). Следует отметить, что слово “гель” в этих работах ошибочно применяется к твердому веществу, что искажает его смысл.
Гель как полужидкая субстанция тоже встречается в природе. Например, в кальдере вулкана Головина (о. Кунашир) породы превращены в опаловые корки, из-под которых вытекала горячая сметаноподобная масса геля кремнезема (Набоко, 1959; Набоко, Сильниченко, 1957). При охлаждении этот гель превратился в сухой мелоподобный порошок (рентгеноаморфный силикагель) с высоким содержанием воды (52%). Колломорфная текстура при этом не образовывалась. В гидротермальных условиях порошок силикагеля превращается в халцедоновые сферолиты (Oehler, 1976), но это превращение протекает по механизму растворение–кристаллизация, т.е. через стадию полного растворения (исчезновения) исходного вещества (Williams, Crerar, 1985) и, соответственно, его текстуры. Таким образом, до сих пор нет убедительных доказательств образования колломорфных минералов путем уплотнения геля.
Однако имеются многочисленные свидетельства гидротермального образования минеральных коллоидных частиц. Например, с помощью электронной микроскопии (ТЭМ, СЭМ) высокого разрешения установлено, что очень богатые (бонанзовые) Au руды состоят из кристаллических частиц самородного золота или электрума размером 5–10 нм, которые часто образуют фрактальные агрегаты в кальците, кварце, сериците или адуляре (McLeish et al., 2021; Saunders, Burke, 2017; Saunders et al., 2020). Те же методы в сочетании с дифракцией электронов, аналитической электронной микроскопией и электронно-микрозондовым анализом позволили обнаружить мелкие (5–100 нм) включения Au, Ag, электрума, галенита, киновари, тетраэдрита, арсенопирита и других минералов в гидротермальном пирите (Deditius et al., 2011; Franchini et al., 2015; González-Jiménez et al., 2022; Tang et al., 2019), HgS в пирротине (Liu et al., 2020a).
Рудные тела гидротермальных месторождений содержат также мелкие частицы (от первых десятков до первых сотен нм), слабо сцепленные с окружающей средой. Под действием эманации геогаза (N2, O2, CO2, CO, CH4, NH3) они перемещаются вверх, проникают в подземные воды или выходят прямо на поверхность (Liu et al., 2019a). Для изучения с помощью ТЭМ, ЭДА (энерго-дисперсионный анализ) и дифракции электронов, наночастицы адсорбируются на металлические сеточки из геогаза или из скважинной воды. Эти исследования показали большое разнообразие их формы, размера и строения (аморфные, моно- и поликристаллические), но минеральный или элементный состав наночастиц всегда совпадал с составом рудных тел и месторождений, скрытых на глубине (Cao et al., 2009; Liu et al., 2019a, 2020b; Luo et al., 2015). Вдали от рудных тел наночастицы состояли из других, более распространенных элементов: Ca, Si, Fe, Al, Ti, Ba (Liu et al., 2019a). Этот факт может быть использован для поисков скрытых рудных тел.
Флюидные включения в кварце из золото-содержащих пород анализировались с помощью масс-спектрометрии с лазерной абляцией (Banks et al., 2019; Prokofiev et al., 2020). Сигнал золота в этих исследованиях не был плавным асимметричным, а состоял из серии всплесков, что означает присутствие Au не в растворенном виде, а в виде твердых частиц. Эти частицы, диагностированные также энерго-дисперсионным анализом, имели размер до 1 мкм и содержание Au до 1000 мг/кг. Свидетельством наличия коллоидных частиц может быть также рассеивание флюидными включениями луча лазера подобно тому, как это происходит в капилляре, заполненном золем кремнезема (Prokofiev et al., 2017).
В активных зонах спреддинга и субдукции гидротермальные растворы изливаются на дно океана, вскипают, смешиваются с морской водой и быстро охлаждаются. При этом удаляются летучие (H2, H2S, CO2), меняется рН, а на кипящей границе флюид/морская вода возникает пересыщение относительно ряда минералов и происходит их нуклеация (Gartman et al., 2019). В результате образуются взвеси твердых частиц черного или белого цвета (черные или белые “курильщики”). Исследования с использованием СЭМ, ТЭМ, рентгенографии, ЭДА, ИСП-МС и других методов показали, что размер твердых частиц “курильщиков” колеблется от нм до мкм, а в их составе преобладают сульфиды металлов: пирит, марказит, пирротин, борнит, халькопирит, сфалерит и др. (Cotte et al., 2015; Durán-Toro et al., 2019; Findlay et al., 2015; Gartman et al., 2014, 2019). С удалением от мест образования, крупные сульфидные частицы осаждаются, а мелкие окисляются до оксигидроксидов, адсорбируют органический углерод и распространяются на десятки км (Hoffman et al., 2018; Stewart et al., 2021).
Анализы растворов (ИСП-МС) геотермальных систем Новой Зеландии с глубины 1–1.5 км (ниже уровня кипения) показали пересыщение относительно халькопирита и сфалерита на 1–3 порядка (Simmons et al., 2016). Причиной пересыщения авторы считают присутствие коллоидных частиц этих минералов, которые дали дополнительный вклад в анализы растворов. Пересыщение относительно Au на порядок наблюдалось в геотермальном месторождении Исландии на глубине 1.6 км, что также объяснялось присутствием коллоидных частиц (Hannington et al., 2016). Позднее это предположение было подтверждено тем же методом ИСП-МС, но в режиме временного разрешения, когда регистрировались всплески интенсивности от отдельных коллоидных частиц Au (Hannington, Garbe-Schönberg, 2019). Концентрация этих частиц увеличилась с 3 до 14 мкг/кг за 7 лет в связи с падением давления при эксплуатации скважин, что усилило кипение раствора. С помощью СЭМ/ЭДА обнаружены коллоидные частицы Au размером от <50 нм до 2 мкм и с концентрацией до 26.7 нмоль/кг в кипящих гидротермальных растворах, изливающихся через “черные курильщики” на дно Тихого океана (Gartman et al., 2018).
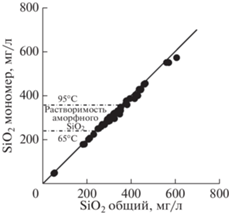
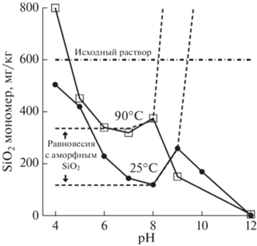
Природные гидротермальные растворы, изливающиеся на поверхность, содержат кремнезем в основном в мономерной форме. Однако содержание этой формы несколько меньше, чем общее содержание SiO2, особенно при более высоких концентрациях (рис. 1). Разность этих концентраций указывает на присутствие коллоидов SiO2 с содержанием до 30 мг/л (Fournier, Rowe, 1966). Вероятно, что эти коллоиды образовались на пути подъема гидротермальных растворов и двигались вместе с ними. После выхода гидротермальных растворов на поверхность они охлаждаются, что усиливает образование коллоидного кремнезема, который придает раствору синий цвет, сменяющийся молочно-белым (Ohsawa et al., 2002).
Рис. 1.
Содержание общего и мономерного кремнезема в горячих источниках Йеллоустонского национального парка (США) (Fournier, Rowe, 1966).
Возможность перемещения коллоидов гидротермальными растворами подтверждается также наличием коллоидов в подземных водах, которые фильтруются через аналогичное трещинно-пористое пространство горных пород. Исследования подземных вод (рассеяние света, ультрафильтрация, СЭМ, фотоакустическая спектроскопия и др.) с разной глубины из разных геологических формаций показали постоянное присутствие в них коллоидных частиц (кремнезем, оксигидроксид Fe, кальцит, глины с органикой) с концентрацией от 105 до 108 шт/мл (для частиц размером >100 нм) (Degueldre et al., 2000). Концентрация коллоидов увеличивалась с уменьшением содержания в растворе Na, K, Ca, Mg, а также с увеличением рН и содержания органики. Другой пример: вода, сочащаяся из аргиллитовых стенок в шахтах Японии, постоянно содержит отрицательно заряженные (стабильные) коллоидные частицы со средним размером 120 нм и с концентрацией до 4 мг/л (Sasamoto, Onda, 2019). Следует отметить, что измеренные концентрации коллоидов относятся к неизменным гидрогеохимическим условиям. Изменение давления, температуры, состава и скорости течения раствора может вызвать значительное увеличение концентрации коллоидов.
ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Твердые частицы коллоидного размера могут образоваться в результате измельчения более крупных частиц или зародышеобразования. Применительно к гидротермальному процессу, первый путь мог реализоваться, например, в долго живущих разломах, где происходили интенсивные перемещения блоков земной коры и образовалась глинка трения. Однако более распространенным и, соответственно, изученным является второй путь. Нуклеация происходит, когда раствор достигает определенной степени пересыщения относительно новой твердой фазы и по окончании индукционного периода, которое требуется для образования зародышей этой фазы. Пересыщение образуется при изменении температуры, рН, состава и массы раствора, что особенно характерно при гетерогенизации (вскипании) флюидов (Cline et al., 1992). Пересыщение раствора может возникнуть и при неизменных параметрах в реакциях превращения минералов, когда растворение первичных минералов протекает быстрее осаждения вторичных (Алексеев, 2019). По месту образования (в объеме раствора или на поверхности другой твердой фазы) различают гомогенную или гетерогенную нуклеацию, что приводит к различиям в подвижности зародышей (свободное перемещение с раствором или их неподвижность).
В гидротермальных системах, расположенных в земной коре, подвижность неприкрепленных коллоидных частиц зависит от соотношения их размеров и размеров пор или трещин, по которым фильтруется гидротермальный раствор. Более подвижными с этой точки зрения являются коллоидные частицы малого размера (Sen, Khilar, 2006). Подвижность коллоидов зависит также от соотношения ван-дер-ваальсовых сил притяжения и электростатических сил отталкивания между частицами, что частично решается в теории ДЛФО (Дерягина, Ландау, Фервея и Овербека). Расчеты по этой теории показали, что повышение давления и температуры соответственно стабилизирует и дестабилизирует коллоиды (Barton, 2019). Однако этот вывод может быть существенно скорректирован при учете сил, которые отсутствуют в теории ДЛФО: гидратация, гидрофобные, стерические и мостиковые силы (Baalousha et al., 2011). Наличие многих факторов затрудняет надежную теоретическую оценку стабильности и подвижности коллоидов, поэтому экспериментальные исследования в этой области приобретают решающее значение. Ниже приведены результаты некоторых опубликованных экспериментов, в которых изучались образование и устойчивость пересыщенных и коллоидных растворов при повышенных температурах.
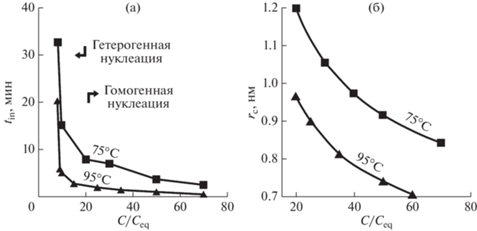
Нуклеация поливанадата аммония при 75–95°С инициировалась пересыщением, которое создавалось быстрым подкислением водного раствора метаванадата аммония (Zhan et al., 2019). Длительность индукционного периода перед началом нуклеации, определенная по резкому уменьшению электропроводности раствора, увеличивалась с уменьшением пересыщения раствора и температуры, а также с увеличением рН. Применение этих данных в классической теории нуклеации позволило определить области преобладания гомогенной и гетерогенной нуклеации и вычислить радиус критического зародыша (рис. 2), а также межфазное натяжение между поливанадатом аммония и пересыщенным раствором и энергию активации нуклеации. Примеси сульфата Na или фосфорной кислоты в растворе увеличивали индукционный период в десятки раз. Примеси могут действовать и в обратном направлении. Например, присутствие растворенного SiO2 ниже насыщения аморфным кремнеземом уменьшало время индукции зарождения CaCO3 и поверхностную свободную энергию, что объяснялось увеличением доли гетерогенного зарождения (Lakshtanov, Stipp, 2010).
Рис. 2.
Длительность индукционного периода нуклеации (а) и радиус критического зародыша (б) поливанадата аммония в зависимости от отношения фактической и равновесной концентрации (C/Ceq) при 75 и 95°С (Zhan et al., 2019).
Коллоидные растворы Au, полученные в реакции HAuCl4 с H2O2 и К2СО3, не давали осадок и не меняли свой красный цвет (были стабильными) до 350°С (Frondel, 1938). В сероводородном растворе коллоидные частицы Au с размером 10–20 нм и с концентрацией до 95 мг/кг были стабильны до 300°С (Liu et al., 2019b). Хотя длительность этих опытов была ограниченной (2.5 и 22 ч), в обоих случаях отмечалось стабилизирующее влияние коллоидов SiO2 на коллоиды Au.
Риолит, расплавленный в стекло после ядерных взрывов в Неваде, растворялся до 3 лет в водном растворе NaCl + NaHCO3 (рН 8) при 140 и 200°С (Zavarin et al., 2019). В результате реакции образовывались коллоиды смектита с размером частиц 0.02–15 мкм, с концентрацией 0.06–0.26 г/л и с радиоактивностью 500–1400 Бк/л (в основном от 137Cs), что превышало ПДК в 66–186 раз.
Рассмотрим подробнее кинетические и транспортные особенности коллоидов на примере наиболее изученных коллоидов кремнезема (SiO2), которые образуются в результате полимеризации мономерного (истинно растворенного) SiO2 в пересыщенных растворах. Длительность индукционного периода созревания критических зародышей перед началом полимеризации увеличивается с уменьшением степени пересыщения и ионной силы раствора, с увеличением температуры и с удалением рН от нейтрального значения (Dixit et al., 2016; Icopini et al., 2005). В экспериментах индукционный период обычно не превышает 2 ч (Dixit et al., 2016), но в природных водах геотермальных источников он может быть значительно больше (White et al., 1956). Устойчивость пересыщенных растворов в индукционном периоде используется для предсказания температуры глубинного геотермального резервуара по составу раствора, который изливается из него на поверхность. При этом используется температурная зависимость растворимости кварца (Arnórsson, 1975; Fournier, Potter, 1982), иногда с учетом потери пара при испарении воды (Verma, 2000). Недавние исследования подтвердили, что кварцевый геотермометр в ряде случаев действительно показывает температуру, близкую к измеренной другими геотермометрами или к температуре, измеренной непосредственно в геотермальном резервуаре (Abdelali et al., 2020; Huang et al., 2018; Kai et al., 2020; Rezaei et al., 2019). В других случаях отмечались сильные отклонения, вызванные смешением глубинных и поверхностных вод или восстановлением равновесия при медленном подъеме глубинных вод (Fowler et al., 2018; Glover, Mroczek, 1998). Кинетическое моделирование, выполненное с учетом скорости осаждения кварца, показало, что близкие к правильным показаниям кварцевого геотермометра возможны лишь при малом отношении площади поверхности кварца к массе воды и/или при большой скорости подъема (охлаждения) воды (правая сплошная кривая на рис. 3).
Рис. 3.
Изменение концентрации SiO2 в воде при подъеме к поверхности (Rimstidt, Barnes, 1980). S/M – отношение площади поверхности кварца к массе воды (м2/кг), v – скорость подъема воды (м/с). Штрих-пунктиром показана растворимость кварца (Qtz) и аморфного кремнезема (AS).
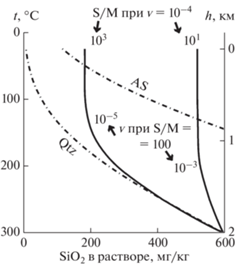
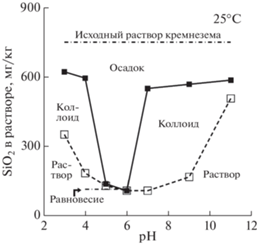
В этом моделировании, однако, не учитывалась возможность образования коллоидных частиц, когда раствор становится пересыщенным относительно аморфного кремнезема (AS на рис. 3). Этот процесс полимеризации кремнезема в близнейтральном растворе протекает быстро и завершается образованием осадка аморфного SiO2, но резко замедляется при отклонении рН в кислую или щелочную область (рис. 4). При рН 3, например, концентрация коллоидов была практически одинаковой в растворах с низкой и высокой ионной силой и не менялась до 4-х месяцев. Описан случай, когда золь SiO2 (30%) с частицами размером 15 нм сохранялся стабильным при 20–30°С и рН 9–10 в течение 20 лет (Iler, 1979).
Рис. 4.
Концентрации устойчивых форм SiO2 в искусственном растворе в зависимости от рН (Icopini et al., 2005). Ионная сила 0.01 М.
Полимеризация SiO2 в природном гидротермальном растворе при 90°С и рН 6–8 приводила к уменьшению концентрация истинно растворенного кремнезема (m) до равновесной концентрации (meq) уже через 9 ч (рис. 5). В отличии от чистой системы вода-кремнезем (рис. 4), здесь при рН > 8–9 величина m была значительно меньше meq, что объяснялось осаждением силикатов Са, а при рН 4 и 90°С величина m была выше исходной концентрации (рис. 5). Последнее обстоятельство объяснялось деполимеризацией SiO2, что означало присутствие коллоидного кремнезема в растворе еще до его извлечения из скважины, т.е. он поднимался вместе с раствором из глубинного геотермального резервуара.
Рис. 5.
Концентрация мономерного кремнезема (m) в природном растворе после 9 ч выдержки при разных температурах и рН (Dixit, 2014).
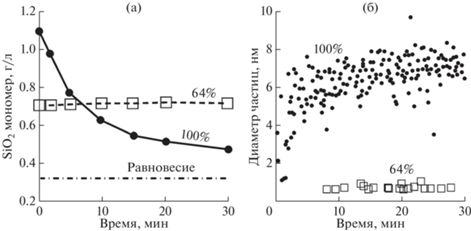
Рост наночастиц кремнезема при 90°С в природном геотермальном растворе, пересыщенном относительно аморфного SiO2, изучался с помощью динамического рассеяния света (Tamura et al., 2019). Уменьшение концентрации мономерного (истинно растворенного) кремнезема (рис. 6а) сопровождалось быстрым увеличением среднего диаметра частиц поликренмиевой кислоты с 1 до 6 нм в первые 5 мин с последующей стабилизацией на уровне 7 нм (рис. 6б). Разбавление раствора водой вызвало уменьшение его пересыщения, массы и размера наночастиц. Природный раствор, разбавленный до 64%, оставался еще пересыщенным в ∼2 раза относительно аморфного кремнезема, который, однако, практически не образовывался.
Рис. 6.
Концентрация мономерного кремнезема (а) и диаметр частиц SiO2 (б) в природном геотермальном растворе (100%, рН25 6.6, ионная сила 0.03) и в том же растворе, но разбавленном водой (64% исходного раствора), в зависимости от времени при 90°С (Tamura et al., 2019).
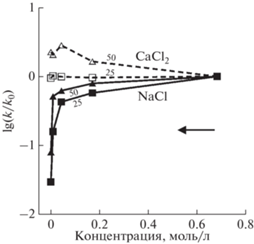
Коллоидный раствор, стабильный и, следовательно, мобильный в объеме раствора, может потерять мобильность в пористой среде в первую очередь из-за блокировки пор коллоидными частицами и уменьшения проницаемости среды. Например, пропускание водной суспензии каолинита через пористый песчаник при 125°С приводило к увеличению концентрации коллоидных частиц на выходе, а также к уменьшению проницаемости песчаника и скорости фильтрации суспензии (Kanimozhi et al., 2021). Увеличение температуры до 175°С усилило эти эффекты, вызванные высокой концентрацией (20–30 мг/л) коллоидных частиц каолинита. Коллоидные частицы, изначально расположенные в порах, тоже влияют на проницаемость песчаника. Например, последовательное пропускание растворов NaCl с уменьшающейся концентрацией через песчаник (содержание каолинита 7%) при 25°С приводило к сильному уменьшению проницаемости (рис. 7) и сопровождалось увеличением концентрации коллоидных частиц (каолинит, кварц, микроклин) на выходе. С увеличением температуры до 50 концентрация коллоидных частиц была меньше, а проницаемость больше за счет большего количества открытых пор. Проницаемость не менялась при фильтрации растворов CaCl2 с теми же концентрациями при 25°С, а при 50°С она даже увеличилась на 20% (рис. 7). Результаты опытов объясняются конкуренцией двух механизмов: 1) увеличение проницаемости в результате растворения минералов (усиливается с повышением температуры) и 2) уменьшение проницаемости в результате мобилизации коллоидных частиц и закупорки ими пор.
Рис. 7.
Отношения конечной и исходной проницаемости песчаника при фильтрации растворов NaCl и CaCl2 при 25 и 50°С (Wang et al., 2021). Стрелка показывает направление изменения состава фильтрующегося раствора.
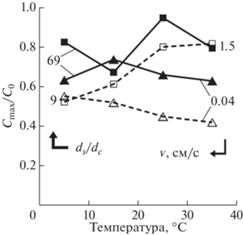
С увеличением длительности фильтрации воды, содержащей частицы кварца (18 или 41 мкм), через кварцевый песок (размер зерен 0.36 или 1.25 мм) содержание частиц на выходе сначала увеличивалось, а затем уменьшалось в результате блокировки ими пор песка (Cui et al., 2019). Максимумы этих кривых увеличивались с увеличением отношения размеров зерен песка и частиц (ds/dc), скорости фильтрации раствора (v) (рис. 8). Влияние температуры на максимумы было заметным только при низких значениях ds/dc = 9, причем с увеличением v отрицательная зависимость сменилась положительной.
Рис. 8.
Отношение максимальной концентрации кварцевого коллоида на выходе из кварцевой пористой среды (Cmax) к исходной его концентрации (С0 = = 0.2 г/л) в зависимости от температуры, отношения размеров частиц песка и коллоида (ds/dc) и скорости фильтрации раствора (v) (Cui et al., 2019).
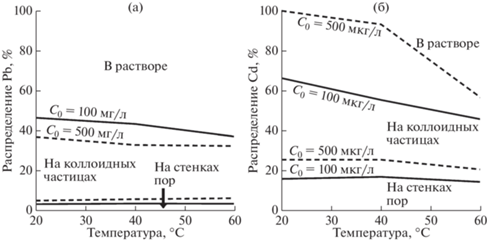
Фильтрация суспензии микрочастиц кварца в растворе нитрата Pb через кварцевый песок приводила к уменьшению концентрации растворенного Pb на выходе из реактора вдвое за счет адсорбции Pb на стенках пор и на коллоидных частицах (рис. 9а). В случае с Cd была похожая картина, но увеличение начальной концентрации C0 увеличило долю Cd на коллоидных частицах (рис. 9б). В обоих случаях эта доля несколько уменьшалась с увеличением температуры и слабо зависела от скорости фильтрации. Следует отметить, что размер частиц 2.8 мкм на рис. 9 был минимальным в работе (Bai et al., 2021). С его увеличением доля Pb и Cd на коллоидных частицах уменьшалась. Это значит, что с уменьшением размера частиц менее 2.8 мкм эта доля, по-видимому, должна возрастать. Положительное влияние температуры (25–75°С) на хемосорбцию стронция гематитом и бернесситом отмечалось в работах (Karasyova et al., 1999; Карасева и др., 2019).
Рис. 9.
Распределение Pb (а) и Cd (б) между разными формами после фильтрования водной суспензии, содержащей растворенный Pb или Cd и частицы кварца размером 2.8 мкм (2 г/л), через кварцевый песок с размером зерен 2.2 мм при разных температурах (Bai et al., 2021).
В присутствии затравок осаждение минерала из пересыщенного раствора ускоряется (Carroll et al., 1998), а роль затравок могут играть и стенки пор, по которым движутся гидротермальные растворы. В этом случае возможна смена механизмов нуклеации с гомогенного на гетерогенный, т.е. зародыши могут образовываться не в объеме раствора, а прикрепляться к поверхности пор, лишаясь способности перемещаться вместе с раствором. Это предположение, казалось бы, подтверждается работами, где природные гидротермальные растворы (70–130°С), пересыщенные относительно аморфного кремнезема, пропускались через длинные реакторы, заполненные песком или циркониевыми шариками диаметром 2 мм (Carroll et al., 1998; Kawahara et al., 2012; Mroczek et al., 2000). В этих экспериментах аморфный кремнезем осаждался, но коллоиды SiO2 не наблюдались из-за того, что, как считают авторы, время пребывания раствора в реакторе (3–5 мин) меньше индукционного периода, необходимого для начала гомогенной полимеризации кремнезема (0.5–2 ч) (Carroll et al., 1998). Здесь следует уточнить, что длительность индукционного периода зависит от рН, а при фактических значениях рН в этих экспериментах (∼8) индукционный период вообще отсутствует (Dixit et al., 2016). Это значит, что стадия полимеризации быстро сменилась агрегацией и осаждением сферических коллоидных частиц аморфного кремнезема на стенки пор (рис. 5). Именно сферическая форма этих частиц считается доказательством их гомогенной (в объеме раствора) нуклеации (Okamoto et al., 2010). Чтобы проследить стадию образования коллоидных частиц в этих условиях, нужно было замедлить полимеризацию кремнезема подкислением раствора. Действительно, уменьшение рН с 8.1 до 4.9 привело к прекращению осаждения SiO2 при 90 и 120°С (Kawahara et al., 2012), т.е. пересыщенный раствор просачивался через пористое пространство реактора при постоянной концентрации как общего, так и мономерного кремнезема, причем последняя концентрация была несколько ниже первой (в пределах погрешности анализов).
При закачивании в водоносный горизонт раствора, использованного в геотермальной электростанции, обычно возникает проблема закупорки пор пласта отложениями кремнезема. Одним из примеров успешного решения этой проблемы является натурный эксперимент на геотермальном месторождении Вайракей (Mroczek et al., 2017). Использованный раствор (рН 8.6, 700 мг/кг SiO2) при температуре 98°С поступал в пруд с температурой 30°С, где быстро охлаждался и подвергался старению в течение нескольких дней. За это время образовывались коллоидные частицы кремнезема со средним размером 32 нм и с концентрацией 540 мг/кг. Раствор из пруда закачивался (270 т/ч) через две скважины в водоносный горизонт с температурой 70°С. Согласно расчетам с учетом температурной зависимости растворимости аморфного кремнезема (рис. 3), увеличение температуры раствора в нагнетательных скважинах могло вызвать растворение части коллоидных частиц и уменьшить их концентрацию, но ненамного (до 420 мг/кг). На протяжении всего эксперимента (10 мес) приемистость скважин не менялась и закупорка пор отложениями кремнезема не фиксировалась. Причина этого заключалась в низкой исходной концентрации мономерного кремнезема (160 мг/кг), который в основном и отлагается на стенках скважин и пор. Таким образом, гидротермальные растворы даже с высокой концентрацией коллоидных частиц способны длительное время фильтроваться через вмещающие породы без блокировки пор.
ОБСУЖДЕНИЕ
Типичными реакциями с участием воды в земной коре являются те, в которых одни минералы превращаются в другие. Долгое время считалось, что скорость общей реакции минерального превращения определяется медленным растворением первичного минерала, а вторичные минералы осаждаются быстро после достижения равновесия их с раствором и не влияют на скорость общей реакции. Этот принцип частичных равновесий (Helgeson et al., 1984), исключающий возможность образования пересыщенных растворов, получил широкое распространение в термодинамических расчетах геохимических систем, стимулировал экспериментальное изучение кинетики растворения минералов, но сдерживал изучение кинетики осаждения минералов и, в частности, стадии нуклеации. Поэтому такой подход оказался сдерживающим фактором и в исследовании гидротермальных коллоидных растворов.
Тем не менее, природные исследования, приведенные в данной работе, убедительно показали, что коллоидные частицы в гидротермальном процессе действительно образуются. О способности перемещения коллоидных частиц в трещинно-пористом пространстве вмещающих пород свидетельствует их присутствие в растворах, которые поднимаются из глубинных геотермальных резервуаров, в эманациях геогаза и в подземных водах над скрытыми рудными телами. В подземных водах Японии, например, постоянно присутствуют коллоидные частицы малого размера (120 нм) с низкой концентрацией частиц (до 4 мг/л) (Sasamoto, Onda, 2019). Такая же низкая концентрация, но Cu и Zn в геотермальных резервуарах Новой Зеландии при 250–300°С соответствует высоким пересыщениям (до 3-х порядков) относительно халькопирита и сфалерита (Simmons et al., 2016). Если пересыщения обусловлены присутствием коллоидных частиц, как предполагают авторы, то эти частицы вполне могли свободно перемещаться в аналогичном трещинно-пористом пространстве без блокировки пор, имея такой же малый размер.
Экспериментальные исследования свидетельствуют о возможности образования стабильных коллоидных гидротермальных растворов в большом объеме (рис. 4–6). Изучение поведения коллоидных растворов в пористой среде при повышенных температурах, к сожалению, ограничено высокими концентрациями и большими размерами коллоидных частиц (рис. 7–9), что приводит к блокировке пор, уменьшению проницаемости пористой среды и прекращению коллоидного переноса. Однако для эффективного коллоидного переноса металлов достаточно низких концентраций коллоидных частиц при условии их малого размера (см. предыдущий абзац). Именно такие условия необходимы в будущих экспериментах, оценивающих возможность коллоидного переноса рудных элементов гидротермальными растворами в пористой среде. Важной целью этих экспериментов может быть также оценка соотношения гомогенной и гетерогенной нуклеации в поровом растворе и его влияние на подвижность коллоидных частиц. Другие факторы коллоидного переноса (электростатическое взаимодействие, адсорбция, химические реакции, рН, температура, ионная сила, степень насыщения, размер, форма и шероховатость коллоидных частиц и пор) для гидротермальных растворов сохраняются и тоже нуждаются в исследовании.
Согласно традиционным взглядам на образование гидротермальных рудных месторождений (Seward et al., 2014), рудоносные флюиды являются истинными растворами, которые переносят металлы к местам отложения в виде водных комплексов с различными лигандами. Гипотеза коллоидного переноса металлов гидротермальными растворами стала развиваться применительно в первую очередь к богатым Au месторождениям, т. к. в рамках старой концепции трудно было объяснить образование жил с очень высоким содержанием золота (целые %) при очень низких его концентрациях в рудных растворах (∼10–6%), содержащих сульфидные или хлоридные комплексы Au (McLeish et al., 2021). Современные геотермальные системы накапливают Au, Ag, Cu, Pb, Zn в зоне кипения, т.е. так же, как это происходило при образовании эпитермальных месторождений (Clark, Williams-Jones, 1990; Hamilton et al., 2019). Наличие коллоидов металлов в современных геотермальных системах дает основание предполагать участие коллоидов и в древних гидротермальных рудных процессах. Коллоидным частицам Au и SiO2 отводится важная роль в образовании эпитермальных месторождений Au не только в качестве промежуточной стадии осаждения, но также в перемещении Au и в концентрировании богатых рудных тел (Saunders, Burke, 2017). В частности, крупные поры и трещины способны быть путями транспорта коллоидных растворов, а мелкие поры и трещины могут выступать в роли фильтров, которые пропускают истинные растворы, но задерживают и накапливают коллоидные частицы Au.
Пересыщенные геотермальные растворы, поднимающиеся из глубинного резервуара к поверхности, могут оставаться истинными, т.е. без коллоидных частиц, которые еще не успели образоваться. Об этом свидетельствуют как результаты экспериментов (64% исходного раствора на рис. 6), так и природные данные, показывающие надежность кварцевого геотермометра во многих случаях (см. текст при обсуждении рис. 3). Подобная ситуация существует и для других геотермометров. Например, действие Na-K геотермометра основано на допущении, что константа равновесия реакции превращения альбита в калиевый полевой шпат (отношение Na/K в растворе) не меняется при подъеме (и охлаждении) раствора из геотермального резервуара к поверхности (Алексеев, 1997). В аналогичных условиях возможно образование пересыщенных растворов и для других реакций, в том числе для реакций осаждения рудных минералов. Это означает, что перенос металлов в виде пересыщенных истинных растворов может оказаться даже более эффективным, чем коллоидный перенос, т. к. он не ограничен размером частиц, поверхностным зарядом и многими другими сдерживающими параметрами, что обеспечивает более высокую “проникающую способность” раствора вплоть до мелких пор и трещин.
ЗАКЛЮЧЕНИЕ
Обзор природных исследований показал, что коллоидные частицы широко представлены в виде включений в минералах, образовавшихся гидротермальным путем, в эманациях геогаза и в подземных водах над рудными телами, во флюидных включениях минералов, в геотермальных растворах.
Обзор экспериментальных данных подтвердил возможность гидротермального образования коллоидных частиц минералов путем гомогенного зародышеобразования в пересыщенных растворах. При определенных условиях эти частицы способны сохранять стабильность, т.е. не осаждаться, а находиться в объеме раствора. Для оценки миграционной способности коллоидных частиц не хватает экспериментов по фильтрации пересыщенных растворов в пористых средах разного состава и структуры в условиях гомогенной нуклеации коллоидных частиц и невысоких их концентраций, которые, однако, могут соответствовать высоким пересыщениям относительно рудных минералов.
Современные и древние гидротермальные системы накапливают металлы в основном в результате кипения флюида, что благоприятно и для образования коллоидных частиц. Это послужило стимулом для разработки рядом исследователей гипотезы об участии коллоидных частиц в образовании богатых эпитермальных месторождений Au.
На примере механизма действия кварцевого геотермометра показано, что гидротермальные растворы, быстро фильтруясь через пористую среду, способны сохранять пересыщение неизменным без образования коллоидных частиц. Такой перенос металлов может быть даже более эффективным, чем коллоидный перенос. В обоих случаях (в коллоидной форме или в истинном пересыщенном растворе) перенос металлов возможен в значительно более высоких концентрациях, чем следует из традиционного подхода, основанного на равновесной термодинамике. Продолжение экспериментальных, теоретических и полевых исследований в этой области позволит более точно оценить роль коллоидов и пересыщенных растворов в переносе металлов и в образовании рудных месторождений.
Список литературы
Алексеев В.А. (1997) Кинетические особенности действия Na/K геотермометра. Геохимия. (11), 1128-1138.
Алексеев В.А. (2019) Наночастицы и нанофлюиды при взаимодействиях вода–порода. Геохимия. 64(4), 343-355.
Alekseyev V.A. (2019) Nanoparticles and Nanofluids in Water–Rock Interactions. Geochem Int. 57(4), 357-368.
Алешин А.П., Козырьков В.Д., Смирнов К.М., Комаров Вл.Б., Ивенченко М.М., Комаров Вик.Б., Грибоедова И.Г. (2016) Уран-титан-метагелевая минерализация золотоурановых месторождений Эльконского рудного района (Алдан) и особенности ее технологического передела. Изв. вузов. Геология и разведка. (4), 50-57.
Дину М.И., Шкинев В.М. (2020) Комплексообразование ионов металлов с органическими веществами гумусовой природы: методы исследования и структурные особенности лигандов, распределение элементов по формам. Геохимия. 65(2), 165-177.
Dinu M.I., Shkinev V.M. (2020) Complexation of Metal Ions with Organic Substances of Humus Nature: Methods of Study and Structural Features of Ligands, and Distribution of Elements between Species Geochem Int. 58(2), 200-211.
Дымков Ю.М., Салтыков А.С., Колпаков Г.А., К-ринов Д.И., Алёшин А.П., Хорозова О.Д., Прокопчик В.И. (2014) Метаколлоидные пирит-настурановые прожилки богатых гидротермальных руд Далматовского уранового месторождения (Зауралье, Россия). Новые данные о минералого-геохимических особенностях, возрасте их формирования и источниках урана. Геохимия. (5), 414-431.
Dymkov Yu.M., Saltykov A.S., Kolpakov G.A., Krinov D.I., Aleshin A.P., Khorozova O.D., Prokopchik V.I. (2014) Metacolloid Pyrite–Pitchblende Veinlets of High-Grade Hydrothermal Ores at the Dalmatovskoe Uranium Deposit, Transural Region, Russia: New Data on the Mineralogy, Geochemistry, Age, and Uranium Sources Geochem Int. 52(5), 372-387.
Иванеев А.И., Ермолин М.С., Федотов П.С. (2021) Разделение, характеризация и анализ нано- и микрочастиц окружающей среды: современные методы и подходы. Журн. аналитической химии. 76(4), 291-312.
Карасева О.Н., Иванова Л.И., Лакштанов Л.З. (2019) Адсорбция стронция на оксиде марганца (δ-MnO2) при повышенных температурах: эксперимент и моделирование. Геохимия. 64(10), 1091-1104.
Karaseva O.N., Ivanova L.I., Lakshtanov L.Z. (2019) Strontium Adsorption on Manganese Oxide (δ-MnO2) at Elevated Temperatures: Experiment and Modeling. Geochem Int. 57(10), 1107-1119.
Моисеенко Т.И., Дину М.И., Гашкина Н.А., Кремлева Т.А. (2013) Формы нахождения металлов в природных водах в зависимости от их химического состава. Водные ресурсы. 40(4), 375-385.
Набоко С.И. (1959) Вулканические эксгаляции и продукты их реакций. М.: АН СССР. 301 с.
Набоко С.И., Сильниченко В.Г. (1957) Образование силикагеля на сольфатарах вулкана Головнина на острове Кунашир. Геохимия. (3), 253-256.
Abdelali A., Nezli I.E., Kechiched R., Attalah S., Benhamida S.A., Pang Z. (2020) Geothermometry and geochemistry of groundwater in the Continental Intercalaire aquifer, southeastern Algeria: Insights from cations, silica and SO4–H2O isotope geothermometers. Appl. Geochem. 113, art. No. 104 492.
Adrian Y.F., Schneidewind U., Bradford S.A., Šimůnek J., Klumpp E., Azzam R. (2019) Transport and retention of engineered silver nanoparticles in carbonate-rich sediments in the presence and absence of soil organic matter. Environ. Pollut. 255, art. No. 113 124.
Arnórsson S. (1975) Application of the silica geothermometer in low temperature hydrothermal areas in Iceland. Am. J. Sci. 275(7), 763-784.
Baalousha M., Lead J.R., Ju-Nam Y. (2011) Natural colloids and manufactured nanoparticles in aquatic and terrestrial systems. Treatise on Water Sci. 3, 89-129.
Bai B., Nie Q., Zhang Y., Wang X., Hu W. (2021) Cotransport of heavy metals and SiO2 particles at different temperatures by seepage. J. Hydrol. 597, art. No 125771.
Banks D.A., Bozkaya G., Bozkaya O. (2019) Direct observation and measurement of Au and Ag in epithermal mineralizing fluids. Ore Geol. Rev. 111, art. No 102955.
Barton I. (2019) The effects of temperature and pressure on the stability of mineral colloids. Amer. J. Sci. 319(9), 737-753.
Bin G., Cao X., Dong Y., Luo Y., Ma L.Q. (2011) Colloid deposition and release in soils and their association with heavy metals. Crit. Rev. Environ. Sci. Technol. 41(4), 336-372.
Cao J., Hu R., Liang Z., Peng Z. (2009) TEM observation of geogas-carried particles from the Changkeng concealed gold deposit, Guangdong Province, South China. J. Geochem. Explor. 101(3), 247-253.
Carroll S., Mroczek E., Alai M., Ebert M. (1998) Amorphous silica precipitation (60 to 120°C): Comparison of laboratory and field rates. Geochim. Cosmochim. Acta, 62(8), 1379-1396.
Chukhrov, F.V. (1966) Present views on colloids in ore formation. Int. Geol. Rev. 8(3), 336-345.
Clark J.R., Williams-Jones A.E. (1990) Analogues of epithermal gold-silver deposition in geothermal well scales. Nature. 346(6285), 644-645.
Cline J.S., Bodnar R.J., Rimstidt J.D. (1992) Numerical simulation of fl uid fl ow and silica transport and deposition in boiling hydrothermal solutions; application to epithermal gold deposits. J. Geophys. Res. 97(B6), 9085-9103.
Cotte L., Waeles M., Pernet–Coudrier B., Sarradin P.-M., Cathalot Cé., Riso R.D. (2015) A comparison of in situ vs. ex situ filtration methods on the assessment of dissolved and particulate metals at hydrothermal vents. Deep-Sea Res. Part I Oceanogr. Res. Pap. 105, 186-194.
Cui X., Fan Y., Wang H., Huang S. (2019) Effects of temperature on the transport of suspended particles through sand layer during groundwater recharge. Water Air Soil Pollut. 230(10), art. No. 251.
Deditius A.P., Utsunomiya S., Reich M., Kesler S.E., Ewing R.C., Hough R., Walshe J. (2011) Trace metal nanoparticles in pyrite. Ore Geol. Rev. 42(1), 32-46.
Degueldre C., Triay I., Kim J.-I., Vilks P., Laaksoharju M., Miekeley N. (2000) Groundwater colloid properties: A global approach. Appl. Geochem. 15(7), 1043-1051.
Dixit C. (2014) Etude physico-chimique des fluides produits par la centrale géothermique de Bouillante (Guadeloupe) et des dépôts susceptibles de se former au cours de leur refroidissement. Ph.D. Thesis. Antilles-Guyane University, France (254 p).
Dixit C., Bernard M.-L., Sanjuan B., André L., Gaspard S. (2016) Experimental study on the kinetics of silica polymerization during cooling of the Bouillante geothermal fluid (Guadeloupe, French West Indies). Chem. Geol. 442, 97-112.
Doucet F.J., Lead J.R., Santschi P.H. (2007) Colloid-trace element interactions in aquatic systems. In: Environmental Colloids and Particles: Behaviour, Separation and Characterisation (eds. K.J. Wilkinson and J.R. Lead). IUPAC. P. 95-157.
Durán-Toro V.M., Price R.E., Maas M., Brombach C.-C., Pichler T., Rezwan K., Bühring S.I. (2019) Amorphous arsenic sulfide nanoparticles in a shallow water hydrothermal system. Mar. Chem. 211, 25-36.
Findlay A.J., Gartman A., Shaw T.J., Luther G.W., III (2015) Trace metal concentration and partitioning in the first 1.5m of hydrothermal vent plumes along the Mid-Atlantic Ridge: TAG, Snakepit, and Rainbow. Chem. Geol. 412, 117-131.
Flury M., Aramrak, S. (2017) Role of air-water interfaces in colloid transport in porous media: A review. Water Resour. Res. 53(7), 5247-5275.
Fournier R.O., Potter R.W. (1982) A revised and expanded silica (quartz) geothermometer. Geotherm. Resour. Council. Bull. 11, 3-12.
Fournier R.O., Rowe J.J. (1966) Estimation of underground temperatures from the silica content of water from hot springs and wet-steam wells. Am. J. Sci. 264(9), 685-697.
Fowler A.P.G., Ferguson C., Cantwell C.A., Zierenberg R.A., McClain J., Spycher N., Dobson P. (2018) A conceptual geochemical model of the geothermal system at Surprise Valley, CA. J. Volcanol. Geotherm. Res. 353, 132-148.
Franchini M., McFarlane C., Maydagán L., Reich M., Lentz D.R., Meinert L., Bouhier V. (2015) Trace metals in pyrite and marcasite from the Agua Rica porphyry-high sulfidation epithermal deposit, Catamarca, Argentina: Textural features and metal zoning at the porphyry to epithermal transition. Ore Geol. Rev. 66, 366-387.
Frondel C. (1938) Stability of colloidal gold under hydrothermal conditions. Econ. Geol. 33(1), 1-20.
Gartman A., Findlay A.J., Luther G.W. (2014) Nanoparticulate pyrite and other nanoparticles are a widespread component of hydrothermal vent black smoker emissions. Chem. Geol. 366, 32-41.
Gartman A., Hannington M., Jamieson J.W., Peterkin B., Garbe-Schönberg D., Findlay A.J., Fuchs S., Kwasnitschka T. (2018) Boiling-induced formation of colloidal gold in black smoker hydrothermal fluids. Geology. 46(1), 39-42.
Gartman A., Findlay A.J., Hannington M., Garbe-Schönberg D., Jamieson J.W., Kwasnitschka T. (2019) The role of nanoparticles in mediating element deposition and transport at hydrothermal vents. Geochim. Cosmochim. Acta. 261, 113-131.
Gavrilescu M. (2014) Colloid-mediated transport and the fate of contaminants in soils. In: The Role of Colloidal Systems in Environmental Protection (ed. M. Fanun). Elsevier. 397-451.
González-Jiménez J.M., Yesares L., Piña R., Sáez R., de Almodóvar G.R., Nieto F., Tenorio S. (2022) Polymetallic nanoparticles in pyrite from massive and stockwork ores of VMS deposits of the Iberian Pyrite Belt. Ore Geol. Rev. 145, art. No. 104875.
Glover R.B., Mroczek E.K. (1998) Changes in silica chemistry and hydrology across the Rotorua Geothermal Field, New Zealand. Geothermics. 27(2), 183-196.
Hamilton A.R., Campbell K.A., Rowland J.V., Barker S., Guido D. (2019) Characteristics and variations of sinters in the Coromandel Volcanic Zone: application to epithermal exploration. New Zealand J. Geol. Geophys. 62(4), 531-549.
Hannington M., Garbe-Schönberg D. (2019) Detection of gold nanoparticles in hydrothermal fluids. Econ. Geol. 114(2), 397-400.
Hannington M., Hardardóttir V., Garbe-Schönberg D., Brown K.L. (2016) Gold enrichment in active geothermal systems by accumulating colloidal suspensions. Nat. Geosci. 9(4), 299-302.
Helgeson H.C., Murphy W.M., Aagaard P. (1984) Thermodynamic and kinetic constaints on reaction rates among minerals and aqueous solutions. II: Rate constants, effective surface area, and the hydrolysis of feldspar. Geochim. Cosmochim. Acta. 48(12), 2405-2432.
Hoffman C.L., Nicholas S.L., Ohnemus D.C., Fitzsimmons J.N., Sherrell R.M., German C.R., Heller M.I., Lee J.-M., Lam P.J., Toner B.M. (2018) Near-field iron and carbon chemistry of non-buoyant hydrothermal plume particles, Southern East Pacific Rise 15° S. Mar. Chem. 201, 183-197.
Huang Y.-H., Liu H.-L., Song S.-R., Chen H.-F. (2018) An ideal geothermometer in slate formation: A case from the Chingshui geothermal field, Taiwan. Geothermics. 74, 319-326.
Icopini G.A., Brantley S.L., Heaney P.J. (2005) Kinetics of silica oligomerization and nanocolloid formation as a function of pH and ionic strength at 25°C. Geochim. Cosmochim. Acta. 69(2), 293-303.
Iler R.K. (1979) The Chemistry of Silica: Solubility, Polymerization, Colloid and Surface Properties and Biochemistry of Silica. N.Y.: Wiley.
Kai B., Xiaojun N., Weimin W., Xiaojun W., Yu P., Panchal B. (2020) Application of geothermal thermometric scale in the study of deep reservoir temperature. Energy Explor. Exploit. 38(6), 2618-2630.
Kanimozhi B., Rajkumar P., Kumar R.S., Mahalingam S., Thamizhmani V., Selvakumar A., Ravikumar S., Kesavakumar R., Pranesh V. (2021) Kaolinite fines colloidal-suspension transport in high temperature porous subsurface aqueous environment: Implications to the geothermal sandstone and hot sedimentary aquifer reservoirs permeability. Geothermics. 89, art. No. 101975.
Karasyova O.N., Ivanova L.I., Lakshtanov L.Z., Lövgren L. (1999) Strontium sorption on hematite at elevated temperatures. J. Colloid Interface Sci. 220(2), 419-428.
Kawahara Y., Fukuda D., Togoh F., Osada K., Maetou K., Kato O., Yokoyama T., Itoi R., Myogan I. (2012) Laboratory experiments on prevention and dissolution of silica deposits in a porous column (1): Solid deposition due to silica particle aggregation and inhibition by acid dosing. Trans. Geotherm. Resour. Counc. 36(2), 867-870.
Lakshtanov L.Z., Stipp S.L.S. (2010) Interaction between dissolved silica and calcium carbonate: 1. Spontaneous precipitation of calcium carbonate in the presence of dissolved silica. Geochim. Cosmochim. Acta. 74(9), 2655-2664.
Liu X., Cao J., Li Y., Hu G., Wang G. (2019a) A study of metal-bearing nanoparticles from the Kangjiawan Pb-Zn deposit and their prospecting significance. Ore Geol. Rev. 105, 375-386.
Liu W., Chen M., Yang Y., Mei Y., Etschmann B., Brugger J., Johannessen B. (2019b) Colloidal gold in sulphur and citrate-bearing hydrothermal fluids: An experimental study. Ore Geol. Rev. 114, art. No. 103142.
Liu X., Liu R., Chen G., Luo X., Lu M. (2020a) Natural HgS nanoparticles in sulfide minerals from the Hetai goldfield. Environ. Chem. Lett. 18(3), 941-947.
Liu X., Cao J., Dang W., Lin Z., Qiu J. (2020b) Nanoparticles in groundwater of the Qujia deposit, eastern China: Prospecting significance for deep-seated ore resources. Ore Geol. Rev. 120, art. No. 103417.
Luo S., Cao J., Yan H., Yi J. (2015) TEM observations of particles based on sampling in gas and soil at the Dongshengmiao polymetallic pyrite deposit, Inner Mongolia, Northern China. J. Geochem. Explor. 158, 95-111.
Marinova I., Ganev V., Titorenkova R. (2014) Colloidal origin of colloform-banded textures in the Paleogene low-sulfidation Khan Krum gold deposit, SE Bulgaria. Miner. Deposita. 49(1), 49-74.
McLeish D.F., Williams-Jones A.E., Vasyukova O.V., Clark J.R., Board W.S. (2021) Colloidal transport and flocculation are the cause of the hyperenrichment of gold in nature. Proc. Natl. Acad. Sci. USA. 118(20), art. No. e2100689118.
Mroczek E., Graham D., Siega C., Bacon L. (2017) Silica scaling in cooled silica saturated geothermal water: Comparison between Wairakei and Ohaaki geothermal fields, New Zealand. Geothermics. 69, 145-152.
Mroczek E.K., White S.P., Graham D.J. (2000) Deposition of amorphous silica in porous packed beds – predicting the lifetime of reinjection aquifers. Geothermics. 29(6), 737-757.
Oehler J.H. (1976) Hydrothermal crystallization of silica gel. Bull. Geol. Soc. Am. 87(8), 1143-1152.
Ohsawa S., Kawamura T., Takamatsu N., Yusa Y. (2002) Rayleigh scattering by aqueous colloidal silica as a cause for the blue color of hydrothermal water. J. Volcanol. Geotherm. Res. 113(1–2), 49-60.
Okamoto A., Saishu H., Hirano N., and Tsuchiya N. (2010) Mineralogical and textural variation of silica minerals in hydrothermal flow-through experiments: Implications for quartz vein formation. Geochim. Cosmochim. Acta. 74(13), 3692-3706.
Park C.F., MacDiarmid R.A. (1964) Ore Deposits. Freeman, London.
Prokofiev V.Y., Kamenetsky V.S., Selektor S.L., Rodemann T., Kovalenker V.A., Vatsadze S.Z. (2017) First direct evidence for natural occurrence of colloidal silica in chalcedony-hosted vacuoles and implications for ore-forming processes. Geology. 45(1), 71-74.
Prokofiev V.Y., Banks D.A., Lobanov K.V., Selektor S.L., Milichko V.A., Akinfiev N.N., Borovikov A.A., Lüders V., Chicherov M.V. (2020) Exceptional concentrations of gold nanoparticles in 1.7 Ga fluid inclusions from the Kola superdeep borehole, Northwest Russia. Sci. Rep. 10(1), art. No. 1108.
Rezaei A., Rezaeian M., Porkhial S. (2019) The hydrogeochemistry and geothermometry of the thermal waters in the Mouil Graben, Sabalan volcano, NW Iran. Geothermics. 78, 9-27.
Rimstidt J.D., Barnes H.L. (1980) The kinetics of silica–water reactions. Geochim. Cosmochim. Acta. 44(11), 1683-1699.
Roldughin V.I. (2000) Quantum-size colloid metal systems. Rus. Chem. Rev. 69(10), 821-843.
Sasamoto H., Onda S. (2019) Preliminary results for natural groundwater colloids in sedimentary rocks of the horonobe underground research laboratory, Hokkaido, Japan. Geol. Soc. Spec. Publ. 482(1), 191-203.
Saunders J.A., Burke M. (2017) Formation and aggregation of gold (Electrum) nanoparticles in epithermal ores. Minerals. 7(9), art. No. 163.
Saunders J.A., Burke M., Brueseke M.E. (2020) Scanning-electron-microscope imaging of gold (electrum) nanoparticles in middle Miocene bonanza epithermal ores from northern Nevada, USA. Miner. Deposita. 55(3), 389-398.
Sen T.K., Khilar K.C. (2006) Review on subsurface colloids and colloid-associated contaminant transport in saturated porous media. Adv. Colloid Interface Sci. 119(2–3), 71-96.
Seward T.M., Williams-Jones A.E., Migdisov A.A. (2014) The chemistry of metal transport and deposition by ore-forming hydrothermal fluids. In: Treatise on Geochemistry (Eds. Holland H.D., Turekian K.K.). Elsevier. P. 29-57.
Simmons S.F., Brown K.L., Tutolo B.M. (2016) Hydrothermal transport of Ag, Au, Cu, Pb, Te, Zn, and other metals and metalloids in New Zealand geothermal systems: Spatial Patterns, Fluid-mineral equilibria, and implications for epithermal mineralization. Econ. Geol. 111(3), 589-618.
Sposito G. (2017) Surface complexation of metals by natural colloids. In: Ion Exchange and Solvent Extraction: A Series of Advances (eds. J.A. Marinsky, Y. Marcus). V. 11. Taylor & Francis. P. 211-236.
Stewart B.D., Sorensen J.V., Wendt K., Sylvan J.B., German C.R., Anantharaman K., Dick G.J., Breier J.A., Toner B.M. (2021) A multi-modal approach to measuring particulate iron speciation in buoyant hydrothermal plumes. Chem. Geol. 560, art. No. 120018.
Tamura R., Inoue H., Hanajima E., Ikeda R., Osaka Y., Yanaze T., Kusakabe M., Yonezu K., Yokoyama T., Tsukamoto K., Marumo K., Ueda A. (2019) In situ observations of silica nanoparticle growth in geothermal brine at the Sumikawa geothermal station, Japan, by dynamic light scattering. Geothermics. 77, 304-312.
Tang Q., Di P., Yu M., Bao J., Zhao Y., Liu D., Wang Y. (2019) Mineralogy and geochemistry of pyrite and arsenopyrite from the Zaozigou gold deposit in West Qinling orogenic belt, central China: Implications for ore genesis. Resour. Geol. 69(3), 314-332.
Verma M.P. (2000) Chemical thermodynamics of silica: A critique on its geothermometer. Geothermics. 29(3), 323-346.
Wang C., Wang R., Huo Z., Xie E., Dahlke H.E. (2020) Colloid transport through soil and other porous media under transient flow conditions–A review. Wiley Interdiscip. Rev: Water. 7(4), art. No. e1439.
Wang Y., Yu M., Bo Z., Bedrikovetsky P., Le-Hussain F. (2021) Effect of temperature on mineral reactions and fines migration during low-salinity water injection into Berea sandstone. J. Pet. Sci. Eng. 202, art. No. 108482.
White D.E., Brannock W.W., Murata K.J. (1956) Silica in hot-spring waters. Geochim. Cosmochim. Acta. 10(1–2), 27-59.
Williams L.A., Crerar D.A. (1985) Silica diagenesis, II. General mechanisms. J. Sediment. Petrol. 55(3), 312-321.
Zavarin M., Zhao P., Joseph C., Begg J.D., Boggs M.A., Dai Z., Kersting A.B. (2019) Hydrothermal alteration of nuclear melt glass, colloid formation, and plutonium mobilization at the Nevada National Security Site, USA. Environ. Sci. Technol. 53(13), 7363-7370.
Zhan L., Zhang Y., Zheng S., Zhang Y., Fan B., Li P., Zhang Y. (2019) Crystallization kinetics of ammonium polyvanadate. J. Cryst. Growth. 526, art. No. 125218.
Zhang W., Tang X., Weisbrod N., Guan Z. (2012) A review of colloid transport in fractured rocks. J. Mount. Sci. 9(6), 770-787.
Дополнительные материалы отсутствуют.


