Геохимия, 2023, T. 68, № 11, стр. 1195-1204
Роль биогеохимических процессов при обезжелезивании подземных вод
З. Н. Литвиненко a, *, Л. М. Кондратьева a
a Институт водных и экологических проблем ДВО РАН
680000 Хабаровск, ул. Дикопольцева, 56, Россия
* E-mail: zoyana2003@mail.ru
Поступила в редакцию 01.03.2023
После доработки 28.03.2023
Принята к публикации 08.05.2023
- EDN: TNWLYB
- DOI: 10.31857/S0016752523100072
Аннотация
Статья посвящена биогеохимическим аспектам очистки железосодержащих подземных вод, которые связаны с образованием биопленок в поровом пространстве вокруг скважин после аэрации водоносного горизонта и на технологическом оборудовании. Представлены результаты исследования структуры и активности микробных комплексов в результате откачки подземных вод из эксплуатационных и наблюдательных скважин при изменении окислительно-восстановительных условий. С помощью сканирующей электронной микроскопии исследована микроструктура и элементный состав разновозрастных обрастаний (биопленок). Установлено, что аккумуляция железа и марганца микробной биомассой происходит за счет инкрустации поверхности бактериальных клеток, погруженных в полимерный матрикс, представленный постоянной основой из трех элементов: Al, Si и Ca. Выживаемость микробных комплексов в составе биообрастаний обусловлена высоким природным потенциалом и способностью осуществлять биогеохимические процессы при широком диапазоне концентраций кислорода (аэробные и анаэробные условия).
ВВЕДЕНИЕ
Одной из главных причин глобального экологического кризиса является технократический подход, который позволяет рассматривать биосферу, как источник ресурсов и место концентрирования отходов антропогенной деятельности. В результате такого интенсивного преобразования биосферы биоценозы вынуждены минимизировать воздействие критических факторов посредством коэволюции и участия во многих биогеохимических процессах, что в свою очередь обеспечивает повышение устойчивости экосистем (Вернадский, 1989; Кучер и др., 2011).
Стабильное функционирование водных систем, в том числе подземных, в большей степени обусловлено реализацией основных функций живого вещества: энергетической, транспортной, средообразующей, концентрационной, деструкционной и биогеохимической. Эти функции подразумевают биогенную трансформацию органических веществ и миграцию различных элементов при участии многообразных ферментных систем живых организмов.
Подземные воды – это сложная многокомпонентная система, формирующаяся под влиянием многочисленных природных и антропогенных факторов. Наблюдения, проведенные в последние десятилетия, свидетельствуют об общей тенденции к снижению качества подземных вод по ряду показателей, включая содержание аммиака, нитритов, нитратов, токсичных элементов, органических соединений различного строения и происхождения. Особое внимание уделяют подземным водам, содержащим повышенные концентрации железа и марганца, сероводород, гуминовые вещества, которые существенно осложняют процесс подготовки питьевой воды для населения (Квартенко, Говорова, 2013; Krupińska, 2015). Проводится поиск новых методов обезжелезивания с использованием разнообразных окислителей и их комбинаций (кислород, озон, хлор, перекись водорода и перманганат калия) (Krupińska, 2017; Ghernaout et al., 2020). Включение химического окисления в технологическую систему очистки подземных вод имеет свои ограничения и риски, если они связаны с образованием вредных неорганических и органических побочных продуктов окисления, например, хлорорганических соединений, и предусмотрено их удаление из воды (Wolska, 2018).
Согласно доминирующим взглядам на формирование качества природных вод при взаимодействии с горными породами, ведущее место занимают физико-химические процессы, для которых характерны следующие химические реакции (Рыженко и др., 2003): растворение-осаждение твердого вещества в водном растворе; электролитическая диссоциация-ассоциация растворенных в водной фазе частиц; окисление-восстановление компонентов переменной валентности водного раствора; сорбция-десорбция (ионный обмен) компонентов между твердой (газовой) и водными фазами.
Рассматривая реакцию деструкции органических веществ, в которых участвуют кислород и вода, иногда предполагают медленную кинетику реакций, которая может длиться от нескольких суток до многих лет. Чаще всего это связано с функционированием и адаптационными возможностями живых организмов, включая микроорганизмы и их ферментные системы. Несмотря на это, многие авторы не принимают во внимание важную роль биогеохимических процессов при участии микробных комплексов.
Особую роль в биогеохимическом преобразовании состава подземных вод при внедрении различных технологий водоподготовки играет цикл железа, который часто тесно связан с круговоротом углерода, азота, фосфора и марганца. В результате биогеохимических процессов, в том числе при растворении железосодержащих минералов, происходит изменение биодоступности железа (Wu et al., 2019).
В природных железосодержащих водах в присутствии органических веществ, при тех же значениях рН и растворенного O2 скорость окисления железа Fe(II) в несколько раз медленнее. По мнению некоторых исследователей, этот результат обусловлен стабилизацией Fe (II) органическими соединениями (Munter et al., 2008). Так, образование хелатных комплексов с гуминовыми веществами (ГВ) и железом происходит в результате реакции обмена между протоном карбоксильных и фенольных групп ГВ и гидроксокомплексов железа: $\left[ {{\text{Fe}}\left( {{\text{OH}}} \right)} \right]_{2}^{ + },$ [Fe(OH)2]+. Железо в таком органическом комплексе становится устойчивым к окислению и плохо удаляется фильтрованием (Khatri et al., 2017). Многовариантное моделирование процессов окисления железа разными концентрациями кислорода подтверждает вероятность влияния присутствующих органических веществ (Рыженко и др., 2019).
При увеличении содержания растворенных органических гидрофильных веществ, содержащих ароматические кольца, среди которых присутствуют фульво- и гуминовые кислоты, как правило, увеличивается процентное содержание Fe(II) и количество окрашенных железоорганических соединений в исходной воде. В результате экспериментальных испытаний выявлена важная закономерность – аэрация способствует фракционированию крупных частиц на более мелкие трудно осаждаемые железоорганические вещества, придающие воде повышенную цветность (окраску). Поэтому при очистке гумифицированной воды, процесс обезжелезивания может происходить медленно и неэффективно (Krupińska, 2020).
Широкий спектр подобных физико-химических процессов, происходящих при аэрации подземных вод, способствует усилению устойчивости к стресс-факторам и повышению адаптационного потенциала микробных комплексов, которые способны существовать в подземной гидросфере в виде сложно-структурированных консорциумов (Flemming, Wuertz, 2019). Именно такая форма жизни позволяет им выживать в постоянно меняющихся условиях и дополнительно оказывать влияние на функционирование процессов, связанных с водоподготовкой (кольматаж скважин и порового пространства, снижение удельных дебитов, коррозия оборудования, ухудшение органолептических показателей питьевых вод) (Liu et al., 2017; Makris et al., 2014; Peng et al., 2010).
Цель наших исследований состояла в оценке роли микроорганизмов в биогеохимическом преобразовании ионов железа при изменении окислительно-восстановительных условий в водоносном горизонте в результате аэрации и образовании слизистых обрастаний (биопленок) в технологическом оборудовании.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Тунгусское месторождение железосодержащих подземных вод, разведанное для водоснабжения г. Хабаровска в 2000 г., расположено в центральной части Среднеамурского артезианского бассейна в междуречье Амура и Тунгуски в 10 км западнее г. Хабаровска. Для очистки воды от повышенных концентраций железа была внедрена технология “Subterra”, основанная на осаждении железа и марганца в водоносном горизонте (ВГ) в результате формирования биогеохимических барьеров при закачке кислородсодержащей воды в скважины (Болдырев и др., 2012; Кулаков, Стеблевский, 2012). Аэрация ВГ приводит к изменению окислительно-восстановительных условий и постепенному снижению концентраций железа и марганца (Herlitzius et al., 2012). Химический состав подземных вод характеризуется следующими показателями: исходная подземная вода (pH 6.2; O2 0 мг/л; Fe 25–30 мг/л; Mn 2.1 мг/л), откачиваемая вода после аэрации (pH 5.9–7.7; O2 12 мг/л; Fe 0.1 мг/л; Mn 0.04 мг/л) (Кулаков, Кондратьева, 2008). Контроль за биогеохимическими процессами внутрипластовой очистки воды осуществляется с использованием эксплуатационных и наблюдательных скважин (рис. 1). Доочистка подземных вод после откачки продолжается на наземных сооружениях, где осуществляется дополнительная аэрация и декарбонизация. Очищенная вода поступает в накопительные резервуары.
Рис. 1.
Схема внутрипластовой очистки подземных вод по технологии “Subterra”: 1 – эксплуатационная, 2 – наблюдательная скважины (Herlitzius et al., 2012).
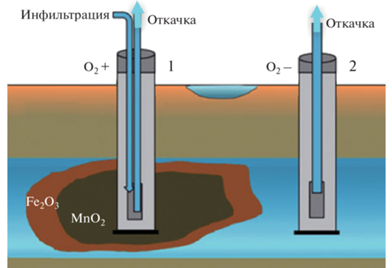
После нескольких месяцев эксплуатации водозабора с применением аэрации инфильтрационной воды, удельный дебит добывающих скважин начал снижаться и за год снизился почти до половины от первоначального значения (Paufler et al., 2018). Возникла проблема кольматажа скважин, вызванная появлением слизистых биообрастаний. Для предотвращения дальнейшего роста биомассы в инфильтрационную воду в качестве дезинфектанта стали периодически вводить гипохлорит натрия (NaOCl), несмотря на то, что его влияние на качество сырой воды и микробные характеристики было недостаточно изученными.
Объектами биогеохимических исследований являлись железосодержащие подземные воды Тунгусского месторождения после обогащения ВГ кислородом из двух типов скважин (эксплуатационные и наблюдательные) и биообрастания (биопленки) со стенок скважин с разным сроком эксплуатации, из декарбонизатора и резервуара с чистой водой (РЧВ).
Пробы воды и биопленок отбирали с соблюдением правил асептики, все манипуляции с микробными консорциумами проводили в стерильных условиях. Численность микробных сообществ определяли на селективных питательных средах: гетеротрофных бактерий – на рыбо-пептонном агаре, железо-марганцевых бактерий на среде Бромфильда (Литвиненко и др., 2022) и выражали в колонии образующих единицах (КОЕ/мл).
Исследование микроструктуры и элементного состава обрастаний (биопленок) проводили в аналитическом центре Института тектоники и геофизики ДВО РАН на сканирующем электронном микроскопе (СЭМ) EVO-40HV (“Carl Zeiss”, Германия) в режиме вторичных электронов с напылением платины, в сочетании с кремний-дрейфовым рентгеновским детектором X-MAX 80 мм2 (“Oxford Instruments”, Великобритания).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведенные исследования показали, что различные абиотические и биотические факторы оказывают большое влияние на функционирование микробных консорциумов подземных вод. Это проявлялось в смене микробного разнообразия сообщества в зависимости от режима работы скважин и изменения технологических характеристик, усилении их адаптационного потенциала при постоянно меняющихся биогеохимических процессах.
Влияние аэрации на структуру микробных комплексов подземных вод
В пробах воды, отобранных из наблюдательных и эксплуатационных скважинах Тунгусского месторождения, в структуру микробных комплексов (МК) входили различные группы гетеротрофных и хемолитотрофных бактерий. Доминирующими филумами в подземных водах выступали Proteobacteria, Actinobacteria, Bacteroidetes, Chloroflexi и др., которые были также идентифицированы в подземных водах других регионов мира (Braun et al., 2016). Формирование микробных консорциумов в поровом и прифильтровом пространстве является результатом сукцессионных преобразований после внедрения технологии обезжелезивания и деманганации в пласте с применением аэрации (табл. 1). В присутствии кислорода разнообразие МК существенно увеличивалось за счет представителей, предпочитающих аэробные условия.
Таблица 1.
Изменение доминирующих филумов микроорганизмов в пробах подземной воды на различных этапах управления скважиной (Braun et al., 2016)
| Состав воды | Режим управления скважиной/N (кол-во проб, шт.) | Доминирующие филумы, % | Режим аэрации |
|---|---|---|---|
| pH = 6.2 O2 = 0 мг/л Fe = 25–30 мг/л Mn = 2.1 мг/л |
Неэксплуатационные скважины/ N = 7 |
Proteobacteria ~95% Actinobacteria, Bacteroidetes ~5% |
Отсутствие аэрации |
| pH = 5.9…7.7 O2 = 12 мг/л Fe < 0.1 мг/л Mn < 0.05 мг/л |
Эксплуатационные скважины, в начале откачки/N = 8 | Proteobacteria ~50–70%, Actinobacteria, Bacteroidetes, Nitrospirae, Firmicutes, Verrucomicrobia и др. ~30–50% |
Аэрация 0.05–12.9 мг/л |
| Эксплуатационные скважины в конце откачки/N = 9 | Actinobacteria ~20–50% Proteobacteria ~30–50% Bacteroidetes, Nitrospirae, Firmicutes, Chloroflexi, Verrucomicrobia и др. ~20–50% |
Аэрация 0.04–1.7 мг/л |
Численность и активность микробных комплексов
Выделенные представители гетеротрофных бактерий, поступающие с подземными водами в конце цикла откачки, успешно потребляли как высокие, так и низкие концентрации органических веществ (ОВ). Большинство из них принимали участие в аммонификации азотсодержащих ОВ. При этом многие микроорганизмы были способны к синтезу защитных каротиноидных пигментов и экзополимерного матрикса. Известно, что слизистые полимеры отвечают за формирование трехмерной структуры биопленок (Flemming, Wuertz, 2019), которая стабилизирует бактериальные клетки, обеспечивая их контакт между собой, и защищает от сил гидродинамического сдвига на границе раздела фаз, а также увеличивает устойчивость микроорганизмов к дезинфицирующим агентам (Wang et al., 2006; Zhurina et al., 2014). Наиболее активно полимерный матрикс продуцируется в экспоненциальной фазе роста и служит в дальнейшем источником углерода и энергии в фазе голодания всего сообщества биопленки (Stewart, 2003).
В результате аэрации подземных вод in situ в экспериментальной скважине 1105 в течение 14 часов наблюдали рост численности гетеротрофных бактерий (ГБ) и железомарганцевых бактерий (ЖМБ). Динамику развития микроорганизмов в водоносном горизонте в первые часы после аэрации можно объяснить появлением более доступных ОВ, которые образовались в результате частичного окисления и трансформации природных гуминоподобных веществ. Затем наблюдали снижение численности обеих групп (табл. 2). В наблюдательных скважинах 1-2 и 2-2, расположенных на разном расстоянии от зоны аэрации также наблюдали постепенное снижение численности микроорганизмов.
Таблица 2.
Влияние аэрации водоносного горизонта на численность микроорганизмов в откачиваемой подземной воде
| Место отбора проб воды (тип скважины) | Время после аэрации, час | Численность ГБ, КОЕ/мл | Численность ЖМБ, КОЕ/мл | |
|---|---|---|---|---|
| Экспериментальная скважина |
1105 | 6 10 14 24 28 |
450 495 560 110 20 |
323 380 610 177 53 |
| Наблюдательные скважины |
1-2 | 6 30 52 |
410 243 180 |
313 197 77 |
| 2-2 | 6 30 48 |
73 57 40 |
77 70 40 |
|
| Декарбонизатор | 1960 | 713 | ||
Экспериментально было показано, что в удаленных от скважины слоях воды, МК проявляли свою активность в виде интенсивного обрастания стальной поверхности и образования охристых коллоидов. Активность МК постепенно увеличивалась и достигала максимальных значений через сутки после аэрации откачиваемой воды (рис. 2). Этот факт позволяет характеризовать зону распространения наиболее активных железомарганцевых бактерий в водоносном горизонте вокруг скважин.
Рис. 2.
Взаимодействие микроорганизмов подземных вод со стальной проволокой на разных этапах откачки после аэрации: 1 – через 1 ч; 5 – через 5 ч; 6 – через 9 ч; 7 – в начале откачки, 8 – вода из декарбонизатора (ДК); 10 – через 23 ч.
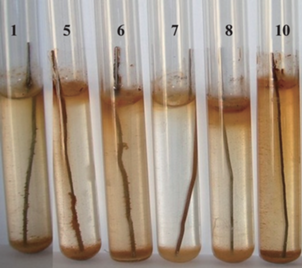
Несмотря на низкую численность ЖМБ в декарбонизаторе, по сравнению с другими группами гетеротрофных бактерий, их окислительная активность при длительной откачке увеличивалась и сохранялась довольно высокой. В декарбонизаторе происходит удаление свободной угольной кислоты до 96%. Во время протока воды в декарбонизаторе поднимаются пузырьки воздуха снизу вверх и покидают систему практически полностью из-за низких скоростей гидравлического потока (0.1 м/с). Затем скорость потока увеличивается до 0.4 м/с и он поступает в переливную емкость (лоток), где при этом происходит удаление остаточных газов (Кулаков, Стеблевский, 2012).
На наземном оборудовании в “застойных зонах” при низкой скорости протока воды наблюдается иммобилизация бактериальных клеток на твердой поверхности за счет образования слизистых полимеров. Как было показано другими исследователями, при аналогичном сочетании условий среды обитания происходит формирование слизистых сложно-структурированных консорциумов в виде биопленок (Desmond et al., 2022). При исследовании структуры микробных сообществ подземных вод на селективных агаризованных средах неоднократно наблюдали обильный рост слизистых колоний.
Микроструктура и элементный состав биообрастаний
В декарбонизаторе, при соответствующих гидравлических условиях и постоянном насыщении подземных вод кислородом, сформировались обрастания (рис. 3) в виде хлопьевидных оранжевых биопленок. Охристый цвет биомассе могли придавать бактерии, клетки которых были инкрустированы гидроксидами железа – окисленная форма растворенного железа, присутствующего в составе подземных вод. Структура биопленки поддерживалась слизистым матриксом (рис. 4). Согласно анализу элементного состава, овальные клетки в составе биопленки покрыты кальций-алюмосиликатной капсулой, а палочковидные клетки инкрустированы железом и магнием, они погружены в матрикс, представленный постоянной основой из трех элементов: Al, Si и Ca.
Рис. 4.
СЭМ-изображение биопленки из декарбонизатора: (а) – бактериальные клетки, инкрустированные ионами железа, образуют нитчатые скопления (в центре); (б) – овальные клетки (слева) погружены в слизистый матрикс.

При хранении воды в накопительных РЧВ, на их стенках и на дне также было отмечено формирование сложно-структурированных сообществ (биопленок), биомасса которых выступала в роли аккумуляторов разных элементов (рис. 5). В структуру этих биопленок входили микроорганизмы с высоким адаптационным потенциалом, которые сохраняли свою жизнеспособность на всех этапах водоподготовки.
Содержание основных элементов входящих в состав тяжей биопленки из резервуара с чистой водой (спектры 18-20,22) было представлено Al (1.55–1.98 ат. %); Si (2.06–3.75 ат. %); Ca (0.39–0.61 ат. %); Fe (1.37–2.99 ат. %). В других микроструктурах (спектры 21, 23, 24) кроме этих элементов присутствовали микропримеси K, Na или Mg.
Известно, что представители специализированной группы ЖМБ (Rhodoferax, Gallionella, Crenothrix, Geothrix) способны к инкрустации поверхности клеток гидроксидами железа и инициированию формирования слизистых биопленок. Внеклеточные органические матрицы в виде чехлов, стеблей, волокон и нитей играют важную роль в механизме осаждения Fe(III)-минералов (Hallberg, Ferris, 2004). Они выступают в качестве площадок или центров осаждения. Накопление окислов железа и марганца на поверхности бактериальных клеток — результат двух взаимосвязанных процессов: аккумуляции (поглощения) клетками этих металлов из раствора и окисления, сопровождающегося обильным отложением нерастворимых оксидов на поверхности бактериальных клеток (Li et al., 2013). Хотя процесс аккумуляции металлов из растворов в основе имеет физико-химическую природу, он в значительной мере обусловлен метаболизмом бактериальных клеток и их внеклеточными структурами (полимерный матрикс, капсулы, чехлы, филоменты).
Такой механизм преципитации был описан у многих видов нейтрофильных Fe(II)-окисляющих бактерий, включая Rhodobacter ferrooxidans, Gallionella spp., Leptothrix ochracea и др. (Kappler et al., 2005; Summers et al., 2013). Эта группа бактерий в составе биопленок активно участвует в процессах биоминерализации ОВ, кольматажа (цементации) порового пространства вокруг скважин за счет формирования таких минералов, как гетит и лепидокрокит, усиливающих эффект цементации (Голубева и др., 2017). В наших экспериментальных исследованиях было показано, что данные представители могли принимать участие в процессах кольматации порового пространства ВГ за счет продуцирования экзополимерного матрикса и аккумуляции ионов железа/ марганца на поверхности своих клеток.
Ранее в результате экспериментального моделирования было показано (Кондратьева и др., 2016), что основные процессы инкрустации происходят уже на 30 сут культивирования биопленки в присутствии ионов железа. Эта разница отчетливо видна, если сравнить 7-суточную и 30-суточную биопленки. На рис. 6 представлено электронное изображение разновозрастных биопленок из эксплуатационной скважины. На 7 сут легко просматриваются бактериальные клетки, погруженные в полимерный матрикс, а на 30 сутки в биопленке появляются различные минеральные образования, бактериальные клетки окружены чехлами, инкрустированными ионами железа. Это подтверждается анализом спектров нескольких локусов биопленки (табл. 3).
Рис. 6.
Инкрустация микробных клеток гидроксидами железа из эксперимента: (а) – 7 суточная, (б) – 30 суточная биопленка.

Таблица 3.
Динамика элементного состава (вес. %) микробной биомассы обрастаний из эксплуатационной скважины
| Элемент | 7 суток | 30 суток |
|---|---|---|
| C | 58.04–59.74 | 52.35–54.38 |
| N | 12.01–14.50 | 10.66–12.21 |
| O | 24.58–26.60 | 28.09–29.84 |
| Na | 0.18–0.24 | 0.18–0.22 |
| Mg | 0.11–0.17 | – |
| Si | 0.08–0.09 | 0.14–0.17 |
| P | 0.63–0.93 | – |
| S | 0.31–0.38 | 0.36–0.52 |
| K | 0.12–0.16 | 0.07–0.12 |
| Ca | 0.17–0.33 | – |
| Fe | 0.15 | 3.75–5.87 |
| Mn | – | 0.16–0.27 |
Железо используется бактериями в качестве энергетического источника. Благодаря нитчатым структурам (филаментам) происходит объединение микроорганизмов по принципу “клетка к клетке” и “клетка-субстрат”. При инкрустации и утолщении пленки появляются так называемые “sheet-like” структуры (Sudek et al., 2017), которые, по нашему мнению, являются предшественниками материала для кольматажа скважин.
Начало колонизации и заполнение порового пространства вокруг скважин микроорганизмами происходит в результате сложных биогеохимических процессов. Например, на базальтах бактерии начинали расти в виде тонких пленок, состоящих из связанных друг с другом клеток Pseudomonas stutzeri. Базальт может выступать как источник железа в виде двух структурно-связанных форм Fe(II) и Fe(III) и гидроксиоксидов, образующихся при взаимодействии кислорода с поверхностью базальта (Perez et al., 2016). Стоит отметить, что механизм изменения биодоступности железа в локальном и глобальном масштабе обеспечивается также микробной активностью при растворении железосодержащих минералов, например, за счет хелатирования Fe(III) органическими лигандами (Li et al., 2013), а также при образовании вторичных биогенных минералов (Голубева и др., 2017).
При помощи электронной сканирующей микроскопии в биопленках было зафиксировано образование различных марганцевых структур и кальцинированных глобул (рис. 7), которые способствуют агрегации клеток и уплотнению микробной биомассы, увеличивают вязкость и эластичность биополимерного геля. Такие процессы, с течением времени, как правило, приводят к цементированию порового пространства и колонизации микробными сообществами наземного оборудования (Das et al., 2014; Goode, Allen, 2011; Kokare et al., 2009).
ЗАКЛЮЧЕНИЕ
При дефиците и загрязнении поверхностных вод, для обеспечения населения качественной питьевой водой разрабатываются технологии по очистке железосодержащих подземных вод. В европейских странах получила широкое распространение технология обезжелезивания и деманганации подземных вод непосредственно в водоносном пласте – “Subterra”. Теоретически, основываясь на химических реакциях, предполагали, что при взаимодействии природных железосодержащих подземных вод с кислородом происходит окисление растворенных ионов железа. Однако, в зависимости от состава подземных вод, сопутствующих примесей органических веществ нужного эффекта обезжелезивания не получали и возникали проблемы кольматажа (цементации) скважин и порового пространства вокруг них. Долгое время кольматаж скважин объясняли только с химических позиций и игнорировали вероятность активных биогеохимических процессов при участии микроорганизмов. Считали, что образующиеся гидроокислы железа, являются причиной химического окисления растворенного железа и полностью игнорировали фактор образования биопленок, которые участвовали в окислении ОВ, изменяли миграционную способность многих элементов и аккумулировали их в своей биомассе.
Согласно проведенным исследованиям было показано, что цементация порового пространства связана с активизацией природного потенциала микробных комплексов, образованием биопленок при участии гетеротрофных и литотрофных микроорганизмов, включая железомарганцевые бактерии. Активный синтез полимерного матрикса защищает биообрастания от кислородного шока не только в водоносном горизонте, а также при наземной доочистке железосодержащих подземных вод на этапе декарбонизации. С помощью сканирующей электронной микроскопии исследованы разновозрастные обрастания, продемонстрирована инкрустация поверхности бактериальных клеток гидрооксидами железа, аккумуляция в полимерном матриксе широкого спектра химических элементов, которые способствуют уплотнению порового пространства и со временем вызывают его цементацию.
Предлагаемые технологии очистки подземных вод обязательно должны учитывать признанные научные концепции о роли живого вещества, его распространении, включая подземную гидросферу. Идеи В.И. Вернадского о роли живого вещества в биосфере чрезвычайно актуальны при разработке современных технологий очистки железосодержащих подземных вод. Формирование биопленок оказывает влияние на биогеохимические процессы не только в водоносном горизонте вокруг скважин, а также на разных этапах технологической линии очистки воды и влияет на органолептические свойства воды в накопительных резервуарах. “На земной поверхности нет химической силы, более постоянно действующей, а потому и более могущественной по своим конечным последствиям, чем живые организмы, взятые в целом. И чем более мы изучаем химические явления биосферы, тем более мы убеждаемся, что на ней нет случаев, где бы они были независимы от жизни” (Вернадский, 1989, с. 22).
Авторы выражают глубокую признательность В.В. Ермакову, Ж.М. Говоровой и В.Н. Башкину за ценные и конструктивные рекомендации по содержанию рукописи и предложения по оформлению материалов статьи.
Работа выполнена в рамках темы Государственного задания ИВЭП ДВО РАН № 121021500060-4.
Список литературы
Болдырев К.А., Кузьмин В.В., Куранов Н.П., Билек Ф. (2012) Геохимическое моделирование внутрипластового обезжелезивания и деманганации подземных вод. Водоснабжение и Санитарная Техника. (4), 49-55.
Вернадский В.И. (1989) Биосфера и ноосфера. М.: Наука, 261 с.
Голубева Е.М., Кондратьева Л.М., Комарова В.С., Абражевич А.В. (2017) Биогеохимические факторы формирования железосодержащих биоминералов. Литосфера. (2), 115-124.
Квартенко А.Н., Говорова Ж.М. (2013) Модернизированные технологии комплексного кондиционирования подземных вод. Вестник МГСУ. (5), 118-123.
Кондратьева Л.М., Голубева Е.М., Литвиненко З.Н. (2016) Микробиологические факторы формирования биоминералов. Сибирский экологический журн. (3), 377-389.
Кулаков В.В., Кондратьева Л.М. (2008) Биогеохимические аспекты очистки подземных вод Приамурья. Тихоокеанская геология. 27(1), 109-118.
Кулаков В.В., Стеблевский В.И. (2012) Ввод в эксплуатацию альтернативного подземного источника водоснабжения Хабаровска. Водоснабжение и санитарная техника. (7), 41-44.
Кучер М.И., Френкель Е.Э., Кучер С.Г. (2011) Коэволюция биосферы как фундаментальная экологическая концепция современности. Актуальные проблемы гуманитарных и социально-экономических наук. (5), 64-66.
Литвиненко З.Н. Кондратьева Л.М., Коновалова Н.С. (2022) Исследование формирования и состава в наземной системе водоподготовки железосодержащих подземных вод. Биотехнология. 38(3), 70-81.
Рыженко Б.Н., Крайнов С.Р., Шваров Ю.В. (2003) Физико-химические факторы формирования состава природных вод (верификация модели “порода-вода”). Геохимия. (6), 630-640.
Ryzhenko B.N., Krainov S.R., Shvarov Yu.V. (2003) Physicochemical Factors Forming the Composition of Natural Waters: Verification of the Rock–Water Model. Geochem. Int. 41(6), 565-575.
Рыженко Б.Н., Мироненко М.В., Лиманцева О.А. (2019) Равновесно-кинетическое моделирование обезжелезивания и деманганации подземных вод. Геохимия. (12), 1247-1260.
Ryzhenko B.N., Mironenko M.V., Limantseva O.A. (2019) Equilibrium and Kinetic Simulation of Groundwater Deironing and Demanganation. Geochem. Int. 57(12), 1306-1319.
Braun B., Schröder J., Knecht H., Szewzyk U. (2016) Unraveling the microbial community of a cold groundwater catchment system. Water Res. 107(15), 113-126.
Das T., Sehar S., Koop L., Wong Y.K., Ahmed S. (2014) Influence of calcium in extracellular DNA mediated bacterial aggregation and biofilm formation. Plos one. 9(3), 1-11.
Desmond P., Huisman K.T., Sanawar H., Farhat N.M., et al. (2022) Controlling the hydraulic resistance of membrane biofilms by engineering biofilm physical structure. Water Research. 210(e-118031). https://doi.org/10.1016/j.watres.2021.118031
Flemming H.-C., Wuertz S. (2019) Bacteria and archaea on Earth and their abundance in biofilms. Nat. Rev. Microbiol. 17(4), 247-260.
Ghernaout D., Elboughdiri N., Ghareba S. (2020) Fenton Technology for Wastewater Treatment: Dares and Trends. Open Access Libr. J. (7), 1-28.
Goode C., Allen D.G. (2011) Effect of calcium on moving-bed biofilm reactor biofilms. Water Environment Research. 83(3), 220-232.
Hallberg R., Ferris F.G. (2004) Biomineralization by Gallionella. Geomicrobiol. J. (21), 325-330.
Herlitzius J., Sumpf H., Grischek T. (2012) German-Russian cooperation for clean drinking water. Int. J. Water Manag. Bluefacts. 76-81.
Kappler A., Schink B., Newman D.K. (2005) Fe(III) mineral formation and cell encrustation by the nitrate-dependent Fe(II)-oxidizing strain BoFeN1. Geobiology. (3), 235-245.
Khatri N., Tyagi S., Rawtani D. (2017) Recent strategies for the removal of iron from water: A review. J. Water Process Eng. (19), 291-304.
Kokare C.R., Chakraborty S., Khopade A.N., Mahadik K.R. (2009) Biofilm: Importance and Applications. Indian J. Biotechnology. (8), 159-168.
Krupińska I. (2015) Importance of humic substances for methods of groundwater treatment. Pol. J. Soil Sci. (48), 161-172.
Krupińska I. (2017) Effect of organic substances on the efficiency of Fe(II) to Fe(III) oxidation and removal of iron compounds from groundwater in the sedimentation process. CEER. (26), 15-29.
Krupińska I. (2020) Impact of the oxidant type on the efficiency of the oxidation and removal of iron compounds from groundwater containing humic substances. Molecules. 25(15), 3380.
Li J., Peng X., Zhou H, Li J., and Sun Z. (2013) Molecular evidence for microorganisms participating in Fe, Mn and S biogeochemical cycling in two low-temperature hydrothermal fields at the Southwest Indian Ridge. J. Geophys. Res. Biogeosci. (118), 665-679.
Liu G., Zhang Y., Knibbe W.J., Feng C., Liu W., Medema G., van der Meer W. (2017) Potential impacts of changing supply-water quality on drinking water distribution: A review. Water Res. (116), 135-148.
Makris K.C., Andra S.S., Botsaris G. (2014) Pipe scales and biofilms in drinking-water distribution systems: undermining finished water quality. Crit. Rev. Environ. Sci. Technol. (44), 1477-1523.
Munter R., Overbeck P., Sutt J. (2008) Which is the Best Oxidant for Complexed Iron Removal from Groundwater: The Kogalym Case. Ozone-Sci. Eng. (30), 73-80.
Paufler S., Grischek T., Adomat Y., Herlitzius J., Hiller K., Metelica Y. (2018) Effective range of chlorine transport in an aquifer during disinfection of wells: from laboratory experiments to field application. J. Hydrology. (559), 711-720.
Peng C.Y., Korshin G.V., Valentine R.L., Hill A.S., Friedman M.J., Reiner S.H. (2010) Characterization of elemental and structural composition of corrosion scales and deposits formed in drinking water distribution systems. Water Res. 44(15), 4570-4580.
Perez A., Rossano S., Trcera N., Huguenot D., Fourdrin C., Vernery-Carron A., et al. (2016). Bioalteration of synthetic Fe(III)-, Fe(II)-bearing basaltic glasses and Fe-free glass in the presence of the heterotrophic bacteria strain Pseudomonas aeruginosa: impact of siderophores. Geochim. Cosmochim. Acta. (188), 147-162.
Stewart P.S. (2003) Diffusion in biofilms J. Bacteriol. (185), 1485-1491.
Sudek L.A., Wanger G., Templeton A.S., Staudigel H., Tebo B.M. (2017) Submarine Basaltic Glass Colonization by the Heterotrophic Fe(II)-Oxidizing and Siderophore-Producing Deep-Sea Bacterium Pseudomonas stutzeri VS-10: The Potential Role of Basalt in Enhancing Growth. Front. Microbiol. (8), 363.
Summers Z.M., Gralnick J.A., Bond D.R. (2013) Cultivation of an obligate Fe(II)-oxidizing lithoautotrophic bacterium using electrodes. MBio. (4), e 420-12.
Wang Z., Liu L., Yao J., Cai W. (2006) Effects of extracellular polymeric substances on aerobic granulation in sequencing batch reactors. Chemosphere. 63(10), 1728-1735.
Wolska M. (2018) Removal of precursors of chlorinated organic compounds in selected water treatment processes. Desalin. Water Treat. (52), 3938-3946.
Wu B., Amelung W., Xing Y., Bol R., Berns A.E. (2019) Iron cycling and isotope fractionation in terrestrial ecosystems. Earth-Science Reviews. (190), 323-352.
Zhurina M.V., Gannesen A.V., Plakunov V.K., Zdorovenko E.L. (2014) Composition and functions of the extracellular polymer matrix of bacterial biofilms. Microbiology. 83(6), 713-722.
Дополнительные материалы отсутствуют.





