Физиология растений, 2023, T. 70, № 7, стр. 866-874
Scutellaria baicalensis Georgi: проекция метаболома корня в культуре корневых волосков
Ю. Н. Елькин a, А. Ю. Маняхин b, А. Ю. Степанова c, *
a Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДВО РАН
Владивосток, Россия
b Федеральный научный центр биоразнообразия наземной биоты Восточной Азии ДВО РАН
Владивосток, Россия
c Институт физиологии растений им. К.А. Тимирязева РАН
Москва, Россия
* E-mail: step_ann@mail.ru
Поступила в редакцию 05.10.2023
После доработки 15.10.2023
Принята к публикации 15.10.2023
- EDN: BDXCOI
- DOI: 10.31857/S0015330323601061
Аннотация
Исследование посвящено сравнительной характеристике флавоноидов и фенилэтаноидов корня дикого растения шлемника байкальского (Scutellaria baicalensis) и культуры корневых волосков. Культура корневых волосков, полученная из семян дикого растения, демонстрирует практически идентичный с корнем набор метаболитов, при этом показывая различия в обильности метилированных и гликозилированных производных обоих классов соединений. Отмечено существенное накопление сахарозы корнями интактного растения. Метилированные флавоны, ответственные за защиту растения от биотических и абиотических стресс-факторов, более обильны в культуре корневых волосков. В обоих образцах впервые идентифицирован 7-сульфат 6-ОМе вогонин. Визуализация масс-спектрометрических данных метаболома посредством селективного ионного мониторинга показала себя как удобный инструмент обнаружения изменения метаболизма, вызванного факторами внешней среды или повреждением растения.
ВВЕДЕНИЕ
Метаболиты растений являются инструментом коммуникации с окружающей средой и ее стресс-факторами. Одной из важнейших их функций вторичных метаболитов является взаимодействие с почвенным микробиомом, который прямо или косвенно, оказывает влияние на метаболизм растений, а также на сохранение корневых почек. Гены, участвующие в путях биосинтеза этих специализированных метаболитов, занимают значительное место в большом массиве генома Scutellaria baicalensis [1, 2]. Корни Scutellaria baicalensis известны тем, что они обогащены определенными 4′-дезоксифлавонами. Различные модификации, в основном, метилирование и гликозилирование молекул обоих классов полифенолов доводят число метаболитов до 130 [3]. Среди всех культур in vitro, а именно суспензий и каллусов, культура корневых волосков устойчиво синтезирует фенилэтаноиды (ФЭ), каффеноил рутинозид гидрокситиразола и ряд его производных. Культура корневых волосков продуцирует метаболиты в сопоставимых с корнем растения весовых отношениях [4]. Среди них флавоны с высоким терапевтическим потенциалом (вогонин 4, ороксилин А 5 и байкалеин 3), благодаря которым сохраняется интерес к корневым волоскам, как к промышленному биотехнологическому продуценту этих трех флавонов.
Культура корневых волосков, полученная из семян дикого растения Забайкальского края России [5], продуцирует идентичную палитру из восьми метилированных флавонов (МФ), в которых кроме моно-метилированных флавонов 4 и 5, в сопоставимой доле синтезируются тетра- и пента-метилированные 8 и 9 [6]. Стоит отметить, что в составе метаболома корня растения, культивированного в Китае, из 132 веществ половина метилированы [3].
Масс-спектрометрический анализ сечения корня с применением лазерной абляции и ЖХ-МС экстрактов обнаружил локализацию МФ в коре [7, 8]. Этот факт стал толчком к изучению роли трех целевых флавонов 3, 4, 5 в физиологии самого растения [8]. Сходство состава МФ в корнях и волосках определяется единой природой происхождения в результате инфицирования проростков семян растения почвенным биомом и бактериальной культурой, соответственно [9]. Биосинтез и регуляция метаболитов корня частично расшифрованы [1, 10–13], однако, многие пробелы в знаниях еще предстоит заполнить. Образование специфических метаболитов в ответ на биоинвазию возникает вследствие вмешательства в важные клеточные механизмы и структуры растения. Безусловно, не может быть универсального набора веществ, учитывающего все типы вредителей и патогенов, эволюционируя, растение вырабатывает несколько типов метаболитов для борьбы с ними. Эти же вещества могут синтезироваться и культурой волосков, роль которых для противодействия биоинвазии еще предстоит установить [14]. Настоящее сообщение предлагает сравнительный анализ метаболитов дикого корня и его культуры корневых волосков в надежде, что новые знания приведут к большему пониманию механизмов зашиты растения и его физиологии.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал и условия роста. В качестве объекта исследования использовали корневые волоски S. baicalensis из коллекции ИФР РАН [5]. Корневые волоски культивировали в жидкой питательной среде В5 по Гамборгу [15] без гормонов по схеме, описанной ранее [16]. Такая схема подразумевает выращивание культуры в течение двух недель в колбах, объемом 100 мл с добавлением жидкой питательной среды – 40 мл, затем перенос их в колбы, объемом 300 мл с содержанием среды – 80 мл. Перекись водорода добавляли на 7 день культивирования, так как в течение этого времени происходила адаптация корней после перенесения на новую питательную среду. Корни дикорастущего растения S. baicalensis заготовлены в окрестностях пгт. Орловский Забайкальского края. Корни были высушены в тени.
Экстракция и подготовка проб к ЖХ-анализу. Отбор проб и экстракцию флавоноидов этанолом проводили по методу, описанному ранее [8]. Около 100 мг культуры корневых волосков и корней экстрагировали дважды этанолом 2 ч при 50°С. Объединенный экстракт центрифугировали 3 мин при 15 тыс. об/мин., супернатант отбирали для дальнейшего анализа методом ЖХ-МС (жидкостная хроматография с тандемной масс-спектрометрией). Фильтрацию проб проводили через шприцевые PTFE фильтр-насадки (“Phenomenex”, США) размер пор 0.45 мкм, диаметр – 13 мм.
ЖХ-МС анализ был проведен в центре коллективного пользования “Биотехнология и генетическая инженерия” Федерального научного центра наземного биоразнообразия Восточной Азии ДВО РАН. Идентификацию и количественное определение всех компонентов проводили с использованием аналитической ВЭЖХ-МС/МС системы Infinity 1260 (Agilent Technologies, “Santa Clara”, CA, США), оснащенной фотодиодным матричным детектором G1315D, насосом G1311C, термостатом колонки G1316A и автосамплером G1329B. Хроматографическая система была сопряжена с масс-спектрометром с ионной ловушкой (Bruker HCT ultra PTM Discovery System, “Bruker Daltonik GmbH”, Бремен, Германия), оснащенным электроспрей ионизирующим источником (ESI). МС-анализы проводились в режиме регистрации отрицательных ионов. Использовались следующие параметры прибора: диапазон детектирования m/z составлял 100–760, расход осушающего газа (N2) 10.0 л/мин, давление распыляемого газа (N2) 241 кПа, потенциал источника ионов составлял 4.0 кВ, температура осушающего газа 365°C. Тандемные масс-спектры были получены в режиме Auto-MS2 (интеллектуальная фрагментация) с использованием увеличения энергии столкновения. Амплитуда фрагментации была установлена равной 1 В. Данные собирались с помощью программного обеспечения Bruker Daltonics Compass 1.3 esqure control (версия 6.2.581.3) и обрабатывались с помощью программного обеспечения для анализа данных Bruker Daltonics Compass 1.3 (версия 4.0.234.0).
Для разделения использовали аналитическую колонку (Zorbax C18, 150 мм, i.d 2.1 мм, 3.5 мкм part size, “Agilent Technologies”, США). Разделение проводили при следующих условиях: температура колонки составляла 40°C, подвижная фаза состояла из 0.1% водного раствора муравьиной кислоты (А) и ацетонитрила (В). Использовали следующий градиент элюирования со скоростью потока 0.2 мл/мин: 0 мин 20% В; 3 мин 20% В; 25 мин 80% В, 30 мин 100% В, а затем элюент В до 40 мин.
РЕЗУЛЬТАТЫ
Представление ЖХ-МС данных
Методы тандемной масс-спектрометрии для изучения метаболома растений являются наиболее подходящими среди других методов, применяемых для анализа экстрактов, содержащих большое количество компонентов [17]. Такой подход не предусматривает обязательного определения строения молекул веществ, извлеченных из растения. Получаемый методом ЖХ-МС набор данных (время удерживания, спектрофотометрические данные, масс-спектр ионов и продуктов их фрагментации) позволяют идентифицировать и определить вещества и их принадлежность в составе метаболома.
Тщательно установленный биохимический состав корней, культивируемого в Китае растения Scutellaria baicalensis [3], дал возможность определить и сравнить по ЖХ-МС данным состав веществ, принадлежащих к классам углеводов, фенилэтаноидов (ФЭ), флавоноидов, корневых волосков и корней дикого растения. В источнике ионов масс-спектрометра вещества этих классов трансформируются в алкоголят-, фенолят-, а глюкурониды флавонов еще и в карбоксилат-анионы [М–Н]–. Таким образом, применение ЖХ-МС с электроспрей ионизацией в режиме регистрации отрицательных ионов позволяет оценить так же относительные содержания веществ, исключая углеводы, позволяя сопоставить соотношение флавонов и их гликозидов в волосках и корнях для понимания физиологии растения.
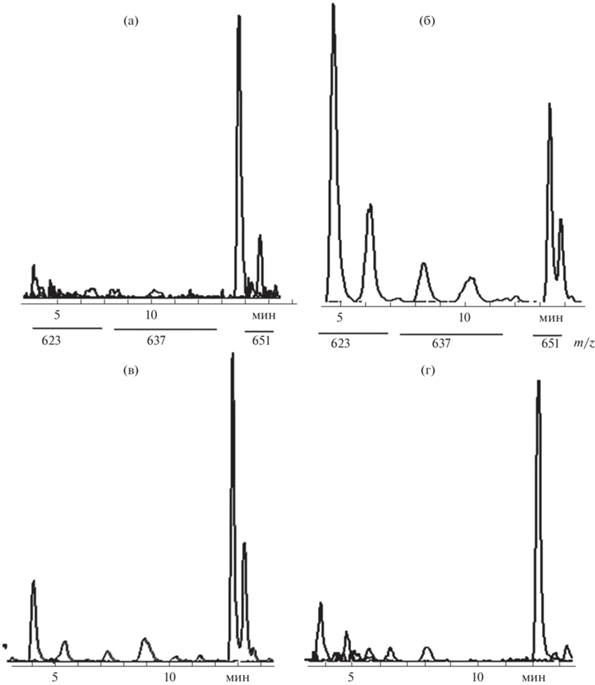
Вследствие различной полярности, метаболиты хроматографически разделяются на 4 условные фракции, представленные в виде полного ионного тока (ПИТ): углеводы (ф1), гликозиды фенилэтаноидов и флавонов (ф2), флавоны (ф3) и метилированные флавоны (ф4), представленные в виде полного ионного тока (ПИТ) (рис. 1). Класс и тип соединений был определен исходя из интегральных масс-спектров (иМС) фракций, продуктов фрагментации анализируемых ионов и времени удерживания. Детальные данные представлены в оригинальной форме [8].
Рис. 1.
Профиль хроматограммы полного ионного тока и полного масс-спектра экстрактов S. baicalensis. (а) – корень, (б) – культура корневых волосков. Ф1–Ф4 – условные фракции, отнесенные к углеводам, гликозидам фенилэтаноидов и флавоноидам, свободным флавонам и метилированным флавоном соответственно. С – сахароза.
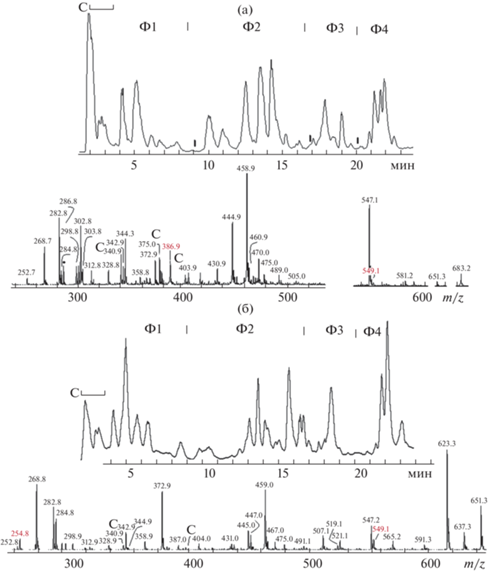
Полный масс-спектр (ПМС) элюированных метаболитов показывает относительное содержание флавоноидов и фенилэтаноидов. Сахароза, представляющая основное вещество первой фракции, отражается в ПИТ пиками алкоголят-аниона m/z 341, аддукт-ионами с хлором m/z 377/379, с муравьиной m/z 387 (корневые волоски) или уксусной кислотой 401 (корни) (рис. 1). Обилие сахарозы (ф1) и метилированных флавонов (ф4) сравнивать не совсем корректно из-за различия сечений ионизации этих классов веществ.
Профиль метилированных флавонов
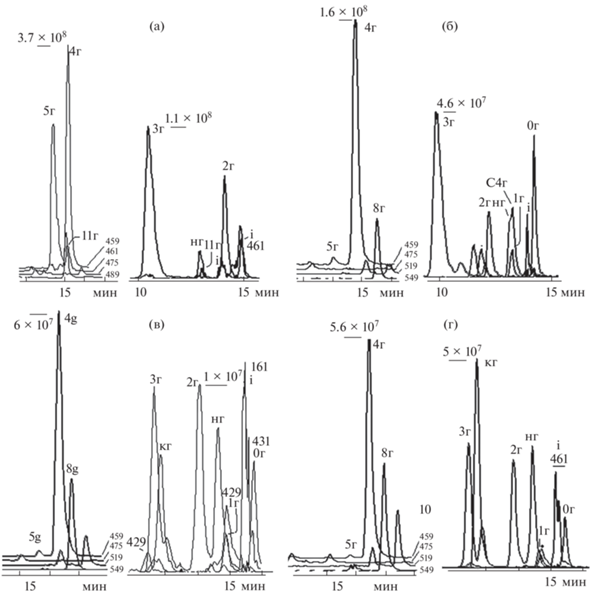
Палитра метилированных флавонов – финальных компонентов пути биосинтеза в корневых волосках и корне Scutellaria baicalensis, идентична по качественному составу, но отличается количественным соотношением веществ [6] (рис. 2а, 2б). Заметное многообразие МФ корней связано с формированием коры. Примечательна обильность моно- и тетра-метилированных флавонов 4 и 8 в корне и культуре корневых волосков партии 1. Профили их ионных хроматограмм (ИХ) показывают высокую чувствительность культуры корневых волосков к изменениям условий среды. Так, отмечено, что соотношение МФ при пересевах культуры волосков меняется. Если насыщенность МФ корневых волосков партии 1 напоминает палитру корня, то МФ партии 2 сохраняются заметными только три-ОМе флавона 6 и 7 (m/z 343), в то время как превалируют флавоны 4 и 8 (рис. 2б, слева).
Рис. 2.
3D-ионные хроматограммы 8 наиболее обильных метилированных флавонов S. baicalensis: (а) – корень, (б) – культура корневых волосков. 4 – (2,7-ди-ОН-8-ОМе-флавон) вогонин, 5 – 2,7-ди-ОН-6-ОМе-флавон (ороксилин А), 6 – 5-ОН-7,8,6'-три-ОМе флавон, 7 – 5,2'-ди-ОН-6,7,8-три-ОМе флавон, 8 – 5,2'-ди-ОН-6,7,8,6'-тетра-ОМе флавон, 10 – 2,7-ди-ОН-6,8-ди-ОМе флавон (6-ОМе вогонин), 11 – 2,6-ди-ОН-7,8-ди-ОМе флавон.
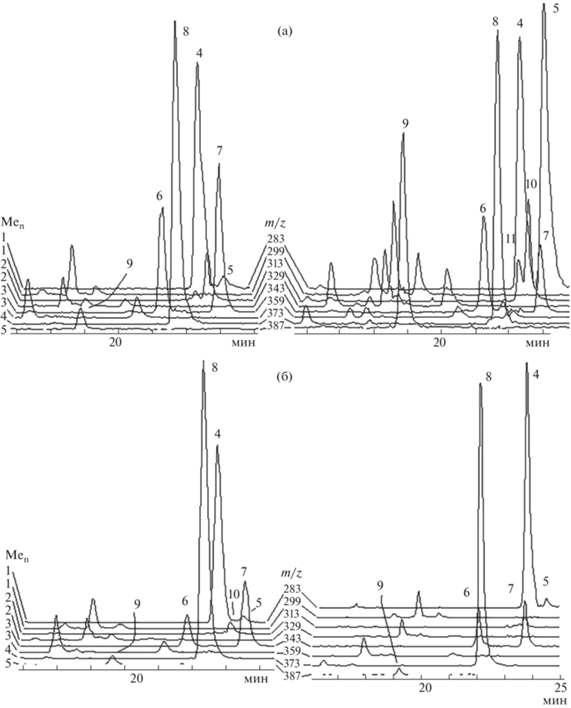
Оксидативный стресс, вызванный добавлением в среду 20 мкл 3% перекиси водорода, демонстрирует завидную устойчивость 8-О-метилтрансферазы и ее продукта – вогонина 4, партия 3 (рис. 2б, справа). Интересным представляется факт непременной потребности культуры волосков в МФ флавонах 4 и 8. Насыщенная палитра МФ корня и обилие в нем финального пента-ОМе флавона 9 характеризует защитную функцию коры корня [8] (рис. 2б).
Свободные или гидроксилированные флавоны
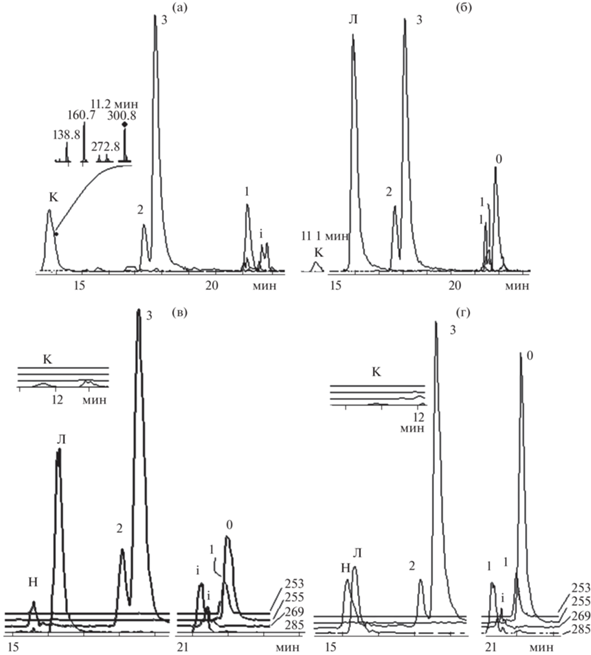
Биосинтез корнеспецифичных флавонов, начинающийся дегидрированием пиноцембрина 0 с превращением его в хризин 1, из которого в дальнейшем с помощью 6- и 8-гидроксилаз образуется байкалеин 3 и нор-вогонин 2, соответственно [1]. Однако все больше появляется данных, что данный путь не является исключительным. В корнях растений присутствуют и другие три-ОН-флавоны [3]. Так в корне интактного дикого растения нами было обнаружено вещество н, отнесенное к флавону № 97, ранее найденного в корнях шлемника, выращенного на плантации в Китае [3]. Состав и обилие гидрокси-флавонов корней и культуры корневых волосков от моно- до тетра- существенно отличаются (рис. 3). В корнях обнаружен известный набор свободных флавонов (1, 2, 3, к, н). Скутеляреин к, доля которого существенна в корне, ничтожна в корневых волосках 1, в которых обилен неизвестный тетра-ОН флавон л. Примечательно, что корневые волоски содержат предшественник синтеза флавонов, пиноцембрин 0 и флавон л, которые не найдены в корнях в сопоставимом количестве с байкалеином 3. Кроме того, культура корневых волосков не продуцирует скутеляреин к.
Рис. 3.
Ионные хроматограммы свободных флавонов S. baicalensis: (а) – корня. Вставка: мс2 спектр предположительно не флавоноидной молекулы, (б) – 2D, (в, г) – 3D культуры корневых волосков партии 1, 2, 3, соответственно. 0 – пиноцембрин, 1 – хризин, 2 – нор-вогонин, 3 – байкалеин, н – три-ОН-флавон, л – тетра ОН-флавон, к – 5,6.7,4'-тетра-ОН-флавон (скутелареин), I – 13С-изотопные ионы обильных флавонов 4 и 5.
Гликозиды метилированных флавонов
Монометилированные флавоны 4 и 5 обильно гликозилируются глюкуронозилтрансферазой и накапливаются в сердцевине корня как гликозиды 4г и 5г [8] (рис. 4а). На порядок менее обилен в корне гликозид 6-ОМе вогонина 10 г. Еще менее обильны гликозиды (m/z 475) многочисленных монометилированных флавонов (m/z 299) продуктов последующего гликозилирования. Интересен результат гликозилирования в волосках партии 1: доминирующий гликозид вогонина 4г сопровождается заметными гликозидами три- и тетра-метилированных флавонов 6г, 7г и 8г (ионы m/z 519 и m/z 549, соответственно) (рис. 4б). Их относительная доля в волосках партии 2 заметно больше (рис. 4в). Интересно, что их доля еще более возрастает в волосках партии 3 под действием оксидативного стресса (рис. 4г).
Рис. 4.
3D-ионные хроматограммы гликозидов (индекс г) метилированных и 2D на вставках свободных флавонов S. baicalensis: (а) – корня, (б, в, г) – культуры корневых волосков партий 1, 2, 3, соответственно. 0 –пиноцембрин,1 – хризин, 2 – нор-вогонин, 3 – байкалеин, н – три-ОН-флавон, л – тетра ОН-флавон, к – 5,6.7,4'-тетра-ОН-флавон (скутелареин), I – 13С-изотопные ионы обильных флавонов.
Гликозиды свободных флавонов
Синтез флавонов в корне сопровождается их гликозилированием с наиболее обильной продукцией гликозидов байкалеина 3г и нор-вогонина 2г (рис. 4а). Тогда как и следов гликозида скутеляреина кг не обнаружено. В волосках партии 1 снижается синтез байкалина 3г и особенно нор-вогонина 2г относительно предшественников 0 и 1. Вместе с гликозидом нг заметную долю в волосках составляет С-гликозид вогонина 4г. Поразительный синтез демонстрируют волоски партии 2 с обильным продуцированием гликозидов флавонона 0 и флавонов 1, 2, н, к (рис. 4в). Добавление же Н2О2 к этим волоскам на стадии воспроизводства стимулировало только синтез гликозида кг (рис. 4г).
Сульфаты флавонов
Замещение гидроксильных групп флавонов на метильные и ацильные широко распространено среди растений, гораздо реже встречаются случаи сульфатирования, как правило по С7 атому [18]. В литературе не описаны случаи обнаружения сульфатов флавонов в Scutellaria baicalensis, однако анализ продукт-ионов диссоциации иона m/z 393 при Rt 15 мин в МС корней свидетельствует об отщеплении фрагмент-иона массой 80 Да (рис. 3). В МС волосков партии 1 также обнаружен ион m/z 393. Он не был отобран в автоматически для МС2, но в режиме селективного мониторинга его продукт-ион m/z 313 был обнаружен. Обильность сульфатированного ди-метоксифлавона 10s даже больше, чем для самого его предшественника 10. Точное измерение иона m/z 393 дает значение для 32S 393.0258 (расчет 393.0286).
Кофеноил рутинозиды гидрокситиразола
Фенилэтаноиды широко распространены в растениях, особенно используемых в качестве лекарственных [19]. В волосках и корнях Scutellaria baicalensis ФЭ в разной степени метилированы одной и двумя группами. В результате эти производные обуславливают три серии ионов m/z 623, 637 и 651, соответственно (рис. 5). В корнях, точнее в камбии, доминируют метилированные (рис. 5а, 5г). В культуре корневых волосков сопоставимая часть ФЭ m/z 623 остается не метилированной (рис. 5б). При окислительном стрессе волоски расходуют значительную часть ФЭ не защищенных метильной группой (рис. 5в).
ОБСУЖДЕНИЕ
Приоритет синтеза и назначение метилированных флавонов в корнях растения ранее продемонстрированы на примере идентичности наиболее обильных компонентов [6]. Однако еще один обильно метилированный 5,7-ди-ОН-ди-6,8-ОМе флавон (m/z 345) не упоминался в роли компонента, участвующего в обеспечении безопасности корня растения (рис 1а). Его содержание в культуре корневых волосков крайне незначительно, поскольку он не является предшественником синтеза пентаметилированного флавона 9. В корнях Scutellaria baicalensis, выращенного в Китае, он также не был обнаружен. Действительно, в промышленной практике выращивания растения на юге Приморского края, корни культурных растений не имели ярко выраженной одревесневшей коры. Этот МФ является продуктом третьего эшелона гидроксилирования, который корневые волоски не синтезируют. Обильные флавоны 6 и 7, m/z 343, также могут быть предшественниками этого пента-метилированного флавона 9. Корневые волоски ограничиваются тетра-метилированным флавоном 8 (рис. 1б), при этом, в отличие от корней, они продуцируют гликозиды 6г, 7г и 8г (рис. 4а, 4в, 4г). Корни создают принципиальный запас гликозидов вогонина 4г и ороксилина 5г в сердцевине [8]. Следуя необходимости сохранения целостности тела корня, создается так же огромный запас байкалина 3г. Культура корневых волосков более обильно продуцирует фенилэтаноид, ион m/z 623, носителя двух катехол групп, для неотложной защиты от биоинвазии. Однако остается непонятным почему в культуре корневых волосков и в корнях они заметно метилированы.
ЗАКЛЮЧЕНИЕ
Представленные в предложенном формате ЖХ-МС данные о содержании веществ в культуре волосков и корнях растения показали практически полную идентичность метаболитов. Наиболее наглядной оказалась потребность синтезировать метилированные флавоны двух типов: моно- и полиметилированные. Результат проекции метаболома культуры корневых волосков на метаболом корня показал, что одни и те же молекулы флавоноидов и фенилэтаноидов синтезируются корневыми волосками почти в полном составе, демонстрируя упорный консерватизм генома в синтезе химической защиты независимо от природы агрессора.
Авторы заявляют об отсутствии конфликта интересов. Статья не содержит исследований с участием людей и животных в качестве объектов.
Авторы выражают глубокую признательность проф. А. М. Носову за предложение сравнить метаболомные профили культуры волосков и корня растения.
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (№ 121031000120-9, № 121050500047-5).
Список литературы
Cui M.Y., Lu A.R., Li J.X., Liu J., Fang Y.M., Pei T.L., Zhong X., Wei Y.-K., Kong Y., Wen-Qing Q., Hu Y.-H., Yang J., Chen X.-Y., Martin C., Zhao Q. Two types of O‑methyltransferase are involved in biosynthesis of anticancer methoxylated 4'-deoxyflavones in Scutellaria baicalensis Georgi. // Plant Biotech. J. 2022. V. 20. P. 129. https://doi.org/10.1111/PBI.13700
Fang Y., Liu J., Zheng M., Zhu S., Pei T., Cui M., Chang L., Xiao H., Yang J., Martin C., Zhao Q. SbMYB3 transcription factor promotes root-specific flavone biosynthesis in Scutellaria baicalensis // Horticulture Res. 2023. V. 10. uhac266. https://doi.org/10.1093/hr/uhac266
Qiao X., Li R., Song W., Miao W.-J., Liu J., Chen H.-B., Guo D.-A., Ye M. A targeted strategy to analyze untargeted mass spectral data: Rapid chemical profiling of Scutellaria baicalensis using ultra-high performance liquid chromatography coupled with hybrid quadrupole orbitrap mass spectrometry and key ion filtering // J. Chromatog. A. 2016. V. 1441. P. 83. https://doi.org/10.1016/j.chroma.2016.02.079
Stojakowska A., Malarz J. Flavonoid production in transformed root cultures of Scutellaria baicalensis // J. Plant Physiol. 2000. V. 156. P. 121. https://doi.org/10.1016/S0176-1617(00)80282-5
Kuzovkina I.N., Guseva A.V., Alterman I.E., Karnachuk R.A. Flavonoid production in transformed Scutellaria baicalensis roots and ways of its regulation // Russ. J. Plant Physiol. 2001. V. 48. P. 448. https://doi.org/10.1023/A:1016739010716
Elkin Y.N., Kulesh N.I., Stepanova A.Y., Solovieva A.I., Kargin V.M., Manyakhin A.Y. Methylated flavones of the hairy root culture Scutellaria baicalensis // J. Plant Physiol. 2018. V. 231. P. 277. https://doi.org/10.1016/j.jplph.2018.10.009
Sun C., Zhang M., Dong H., Liu W., Guo L., Wang X. A spatially-resolved approach to visualize the distribution and biosynthesis of flavones in Scutellaria baicalensis Georgi // J. Pharmac. Biomed. Anal. 2020. V. 179. P. 113014. https://doi.org/10.1016/J.JPBA.2019.113014
Elkin Y.N., Kulesh N.I., Shishmarev V.M., Kargin V.M., Manyakhin A.Y. Scutellaria baicalensis: the end of flavone biosynthesis pathway // Acta Biol. Cracoviensia Series Bot. 2022. V. 64. P. 39. https://doi.org/10.24425/abcsb.2021.136704
Gutierrez-Valdes N., Häkkinen S.T., Lemasson C., Guillet M., Oksman-Caldentey K.M., Ritala A., Cardon F. Hairy root cultures – a versatile tool with multiple applications. // Front. Plant Sci. 2020. V. 11. P. 33. https://doi.org/10.3389/FPLS.2020.00033/BIBTEX
Zhao Q., Zhang Y., Wang G., Hill L., Weng J.K., Chen X.-Y., Xue H., Martin C. A specialized flavone biosynthetic pathway has evolved in the medicinal plant Scutellaria baicalensis // Sci. Adv. 2016. V. 2. e1501780. https://doi.org/10.1126/sciadv.1501780
Zhao Q., Cui M.Y., Levsh O., Yang D., Liu J., Li J., Hill L., Yang L., Hu Y., Weng Y.-K., Cheng X.-Y, Martin C. Two CYP82D enzymes function as flavone hydroxylases in the biosynthesis of root-specific 4′-deoxyflavones in Scutellaria baicalensis // Molec. Plant. 2018. V. 11. P. 135. https://doi.org/10.1016/j.molp.2017.08.009
Zhao Q., Yang J., Cui M.Y., Liu J., Fang Y., Yan M., Qiu W., Shang H., Xu Z., Yidiresi R., Weng J.K., Pluskal T., Vigouroux M., Steuernagel B., Wei Y. et al. The reference genome sequence of scutellaria baicalensis provides isights into the evolution of wogonin biosynthesis // Molec. Plant. 2019. V. 12. P. 935. https://doi.org/10.1016/j.molp.2019.04.002
Zhao Q., Chen X.Y., Martin C. Scutellaria baicalensis, the golden herb from the garden of Chinese medicinal plants // Sci. Bull. 2016. V. 61. P. 1391. https://doi.org/10.1007/S11434-016-1136-5
Ramaroson M.L., Koutouan C., Helesbeux J.J., Le Clerc V., Hamama L., Geoffriau E., Briard M. Role of phenylpropanoids and flavonoids in plant resistance to pests and diseases // Molec. 2022. V. 27. P. 8371. https://doi.org/10.3390/molecules27238371
Gamborg O.L., Miller R.A., Ojima K. Nutrient requirements of suspension cultures of soybean root cells // Exp. Cell Res. 1968. V. 50. P. 151. https://doi.org/10.1016/0014-4827(68)90403-5
Solov’eva A.I., Evsyukov S.V., Sidorov R.A., Stepanova A.Y. Correlation of endogenous β-glucuronidase activity with differentiation of in vitro cultures of Scutellaria baicalensis // Acta Physiol. Plant. 2020. V. 42. P. 1. https://doi.org/10.1007/s11738-020-03159-0
Hu L., Liu J., Zhang W., Wang T., Zhang N., Lee Y.H., Lu H. Functional metabolomics decipher biochemical functional and associated mechanisms underlie small-molecule metabolism // Mass Spectr. Rev. 2020. V. 39. P. 417. https://doi.org/10.1002/MAS.21611
Teles Y.C.F., Souza M.S.R., De Souza M. de F.V. Sulphated flavonoids: biosynthesis, structures, and biological activities // Molec. 2018. V. 23. P. 480. https://doi.org/10.3390/MOLECULES23020480
Yang Y., Xi D., Wu Y., Liu T. Complete biosynthesis of the phenylethanoid glycoside verbascoside // Plant Commun. 2023. V. 4. P. 100592. https://doi.org/10.1016/J.XPLC.2023.100592
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений