Физиология растений, 2023, T. 70, № 7, стр. 915-922
Анализ провоспалительных свойств растительных оксилипинов, образующихся в гидропероксидлиазной ветви
Я. В. Радзюкевич a, К. Г. Тихонов a, Е. А. Дегтярёв a, В. И. Дегтярёва b, c, Т. В. Савченко a, *
a Институт фундаментальных проблем биологии, Федеральный исследовательский центр
“Пущинский научный центр биологических исследований Российской академии наук”
Пущино, Московская область, Россия
b Московский государственный университет имени М.В. Ломоносова,
биотехнологический факультет
Москва, Россия
c Филиал Института биоорганической химии имени академиков М.М. Шемякина и Ю.А. Овчинникова
Российской академии наук
Пущино, Московская область, Россия
* E-mail: savchenko_t@rambler.ru
Поступила в редакцию 30.09.2023
После доработки 15.10.2023
Принята к публикации 15.10.2023
- EDN: BJPMSQ
- DOI: 10.31857/S0015330323600948
Аннотация
Коротко- и среднецепочечные альдегиды и их производные, образующиеся из жирных кислот в результате активности ферментов гидропероксидлиаз, присутствуют во многих продуктах растительного происхождения. Их часто используют в качестве добавок к продуктам питания для увеличения срока годности и придания аромата свежести. Учитывая, что эти соединения могут всасываться клетками кишечника и поступать в системную циркуляцию, важно оценить их влияние на здоровье человека. В данной работе мы оценили потенциальную биологическую активность альдегидов и спиртов с длиной цепи от 6 до 9 углеродов и проверили их провоспалительную активность на экспериментальной системе, основанной на использовании цельной крови доноров. Анализ показал, что девятиуглеродные оксилипины стимулируют наработку провоспалительного цитокина TNF-α (фактор некроза опухоли-альфа), при этом альдегиды активировали синтез TNF-α в меньшей степени, чем спирты. Шести- и восьмиуглеродные оксилипины не проявляли провоспалительную активность. Полученная информация может быть полезна для разработки диетологических рекомендаций для людей, страдающих воспалительными заболеваниями.
ВВЕДЕНИЕ
Ненасыщенные жирные кислоты в аэробных организмах окисляются спонтанно или ферментативно с образованием оксилипинов ‒ разнообразных соединений, различающихся как по физико-химическим свойствам, так и по биологическим функциям. В растениях ферментативное образование оксилипинов чаще всего инициируется в результате взаимодействия липазы с липидами мембран, что приводит к освобождению полиненасыщенных жирных кислот, главным образом, линолевой и линоленовой. Далее липоксигеназы окисляют свободные жирные кислоты, образуя гидропероксиды, которые могут выступать субстратами для нескольких параллельных ветвей биосинтеза оксилипинов. Растительные липоксигеназы (ЛОГ) по стереоспецифичности делятся на 9- и 13-ЛОГ в зависимости от позиции окисляемого углерода в углеродной цепи жирной кислоты [1, 2]. Примечательно, что субстратами ЛОГ могут выступать не только свободные жирные кислоты, но и жирнокислотные остатки, входящие в состав липидов мембран [3, 4]. Один из путей дальнейшей модификации гидропероксидов жирных кислот ‒ гидропероксидлиазная (ГПЛ) ветвь, ведущая к образованию альдокислот и летучих альдегидов, а также их производных. Как и ЛОГ, ГПЛ могут использовать в качестве субстрата окисленные жирнокислотные остатки, входящие в состав липидов, что подтверждается тем, что 12-улеродные продукты ГПЛ, связанные с галактолипидами, были обнаружены в листьях Arabidopsis thaliana, капусты, табака, томатов и бобов [5].
ГПЛ относятся к атипичному семейству CYP74 суперсемейства цитохромов P450 монооксигеназ, которые не нуждаются в НАДФН в качестве донора электронов для ферментативной активности, а используют гидропероксиды жирных кислот и как донор кислорода, и как субстрат [6]. Как и другие CYP74 высших растений, ГПЛ осуществляет гомолитическое расщепление O–O связи гидроперекиси жирной кислоты с образованием алкокси-радикала, который присоединяется к рядом расположенной двойной связи, образуя эпоксиаллильный радикал. Его распад при участии ГПЛ происходит с образованием полуацеталя, который спонтанно распадается на альдегид и оксокислоту [7].
При участии 13-ГПЛ из 13-гидропероксида линоленовой кислоты образуются (3Z)-гексеналь и 12-оксо-(9Z)-додеценовая кислота, а из 13-гидропероксида линолевой кислоты вместо (3Z)-гексеналя образуется гексаналь [7, 8]. 12-оксо-(9Z)-додеценовая кислота изомеризуется в 12-оксо-(10E)-додеценовую кислоту, именуемую травматином или раневым гормоном. Дальнейшее окисление альдегидной группы приводит к образованию дикарбоновой травматиновой кислоты [9]. В растительных тканях были обнаружены несколько изомеров травматина и травматиновой кислоты и их производные [10]. Активность 13-ГПЛ также, как и 13-ЛОГ, связана с хлоропластами.
Из 9-гидропероксида линолевой и линоленовой кислот образуются летучие (3Z)-ноненаль и (3Z,6Z)-нонадиеналь, соответственно, и нелетучая 9-оксононановая кислота [11, 12]. 9-ЛОГ/9-ГПЛ путь скорее всего функционирует в цитоплазме.
Цис-3-гексеналь и цис-3-ноненаль могут быть изомеризованы с участием 3Z:2E-еналь-изомеразы [13, 14]. Шестиуглеродные альдегиды могут быть восстановлены до соответствующего спирта с участием алкогольдегидрогеназы или редуктазы [15, 16]. Известен также фермент, ацетилирующий спирты с формированием соответствующего сложного эфира [17]. Также нельзя исключать возможное окисление ненасыщенных альдегидов и гидрирование двойной связи. Нужно отметить, что каждая из указанных модификаций альдегида приводит к образованию более летучего продукта. Летучие альдегиды и их производные, так называемые “летучие соединения зеленых листьев” (Green Leaf Volatiles), являются основным компонентом аромата зеленых листьев и фруктов.
Из 20-углеродной арахидоновой кислоты, встречающейся у мхов и грибов, формируются 12-гидроперекиси, из которых могут образоваться 8-углеродные летучие соединения такие, как 1-октен-3-ол, а также их ацетилированные производные [18].
ГПЛ довольно широко распространены в природе. Они были обнаружены у многих, хотя и не у всех растений, при этом растения могут содержать как один, так и несколько ферментов, различающихся по специфичности к субстратам и внутриклеточной локализации [19]. Активность ГПЛ, а также продукты ферментативной активности, были обнаружены во многих пищевых и эфиромасличных культурах (табл. 1, Дополнительные материалы). Конститутивная экспрессия генов ГПЛ способствует быстрому образованию и накоплению продуктов ферментативной реакции в растительных тканях после их повреждения.
Таблица 1.
Физико-химические свойства молекул оксилипинов и оценка вероятностной биологической активности
| Вещество | Молярная масса, г/моль | Растворимость в воде, г/л | Показатель липофильности (lgP) | Площадь полярной поверхности, Å2 | Число вращательных связей | Вероятностная биологическая активность | ||
|---|---|---|---|---|---|---|---|---|
| агонист макрофагального колониестимулирующего фактора | противовоспалительная | ингибитор экспрессии TNF-α | ||||||
| 3-гексеналь | 98.1 | 5 | 1.432 | 17 | 3 | + | ‒ | ‒ |
| 2-гексеналь | 98.1 | 5.3 | 1.79 | 17 | 3 | + | ‒ | ‒ |
| 3-гексенол | 100.2 | 16 | 1.7 | 20 | 3 | + | ‒ | ‒ |
| 3-гексенилацетат | 142.2 | 0.9 | 2.415 | 26 | 5 | + | + | + |
| Травматиновая кислота | 228.3 | 0.23 | 2.686 | 75 | 10 | + | ‒ | + |
| Октанол | 130.2 | 0.54 | 3 | 20 | 6 | + | ‒ | + |
| 1-октенол | 128.2 | 1.84 | 2.52 | 20 | 5 | + | ‒ | + |
| 2-ноненаль | 140.2 | 0.093 | 3.17* | 17 | 6 | + | ‒ | ‒ |
| 2-ноненол | 142.2 | 0.62 | 3.184 | 20 | 6 | + | ‒ | + |
| 6-ноненаль | 140.2 | 0.2 | 3.113 | 17 | 6 | + | ‒ | ‒ |
| 6-ноненол | 142.2 | 0.62 | 3.014 | 20 | 6 | + | + | + |
Биологические функции оксилипинов, образующихся в ГПЛ ветви, до конца не понятны. Для некоторых метаболитов ГПЛ ветви показаны антимикробные свойства [20, 21] и продемонстрирована роль в формировании устойчивости растений к насекомым [22, 23]. Накопление в тканях метаболитов ГПЛ ветви в ответ на абиотические стрессы также было описано [24], однако, неизвестно, связано ли их накопление с адаптацией к стрессовым условиям или является результатом повреждения клеточных структур.
Оксилипины могут образовываться и в организме человека из полиненасыщенных жирных кислот растительной пищи. Оксилипины могут участвовать во множестве физиологических процессов, включая апоптоз, свертывание крови, болевую реакцию и воспаление [25].
Врожденный иммунитет отвечает за раннюю реакцию организма на чужеродный биоматериал. Компоненты бактериальной клеточной стенки, такие как липополисахарид (ЛПС), стимулируют выработку цитокинов моноцитами и макрофагами. Эти цитокины включают фактор некроза опухоли-альфа (TNF-α), интерлейкин (IL)-1 и IL-6, которые способствуют адгезии нейтрофилов и моноцитов в местах инфекции, за которым следует миграция, местное накопление и активация воспалительных клеток. Клетки воспаления неспецифически распознают бактерии и уничтожают их посредством фагоцитоза и/или продукции АФК. Воспалительные цитокины также обеспечивают связь между воспалительными клетками и специфическим иммунитетом, поскольку они могут стимулировать Т- и В-лимфоциты [26]. С учетом активного использования оксилипинов в производстве пищи, необходимо исследовать возможную провоспалительную активность этих молекул. Цель работы ‒ исследовать провоспалительную активность оксилипинов в экспериментальной системе, основанной на использовании цельной крови доноров.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали периферическую кровь условно здоровых доноров 23-35 лет. Образцы крови были предоставлены отделением аллергологии и иммунологии Больницы Пущинского научного центра РАН (БПНЦ РАН). Кровь брали из локтевой вены, в качестве антикоагулянта использовали гепарин. Информированное согласие было подписано всеми донорами.
Определение содержания цитокинов проводили по описанной ранее методике [27]. К клеткам крови добавляли растительные метаболиты, образующиеся в ГПЛ ветви пути биосинтеза оксилипинов. В качестве позитивного контроля использовали липополисахарид E. coli в конечной концентрации 100 нг/мл. Образцы крови инкубировали 6 ч при 37°C и 5% содержании СО2 в инкубаторе. После инкубации клетки крови осаждали в течение 10 мин при 1000 об/мин на специализированной центрифуге. Полученные супернатанты отбирали и хранили при температуре –20°С. Методом твердофазного иммуноферментного анализа оценивали содержание в сыворотке крови провоспалительного цитокина TNF-α (АО “Вектор-Бест”, Россия).
Методы фармакоинформатики: для получения информации о физико-химических свойствах оксилипинов были использованы ресурсы https://pubchem.ncbi.nlm.nih.gov, http://www.vcclab. org/lab/alogps и http://www.chemspider.com/. Для поиска возможных клеточных мишеней про- и противовоспалительного действия изучаемых оксилипинов была проведена оценка вероятностного профиля биологической активности данных молекул с помощью веб-ресурса PASS Online (http://www.way2drug.com/passonline).
Статистическая обработка результатов. Результаты представлены в виде медианных значений с квартилями (IQR). Достоверность различий между медианными значениями оценивали с помощью U-теста Манна–Уитни и критерия Вилкоксона. Различия медианных значений считались достоверными при уровне значимости Р < 0.05. Для статистического анализа и графического представления данных использовали программное обеспечение Microsoft Office Excel 2010 (плагин AtteStat), STATISTICA 10.1 и SigmaPlot 12.5.
РЕЗУЛЬТАТЫ
Предсказание биологической активности оксилипинов
Анализ литературных данных и наши собственные исследования показывают, что летучие метаболиты ГПЛ ветви встречаются во множестве пищевых и эфиромасличных культур, а также в лекарственных растениях (табл. 1, Дополнительные материалы). В табл. 1 представлены основные физико-химические свойства молекул, используемые для предварительной оценки биологической доступности соединений. Показателем липофильности (гидрофобности) служит десятичный логарифм коэффициента распределения (P) вещества между октанолом и водой. Чем он выше, тем больше накапливается в клеточных мембранах исследуемое вещество, а также тем выше сродство вещества к бычьему сывороточному альбумину [28]. Для большинства лекарственных веществ показатель липофильности находится между ‒2 и +5. Так как показатель липофильности измерен не для всех рассмотренных веществ, для 2-ноненаля приводится расчетный показатель липофильности по ACD/Labs (Advanced Chemistry Development, Inc.). Площадь полярной поверхности вычисляется как площадь участка молекулы, занимаемая электроотрицательными гетероатомами (O, N, S, P) и связанными с ними атомами водорода. Показано, что для пассивной диффузии сквозь мембраны нужно, чтобы площадь полярной поверхности была не более 140 Å2 [29]. Число связей, вокруг которых возможно свободное вращение частей молекулы, служит мерой ее конформационной изменчивости. Большая конформационная изменчивость препятствует диффузии сквозь мембрану и совмещению молекулы с ее мишенью, поэтому считается, что число вращательных связей должно быть не более 10 [29]. У всех исследованных нами веществ величины рассмотренных показателей находятся в пределах, благоприятствующих биологической доступности.
Предсказание биологической активности веществ в PASS Online основано на анализе взаимосвязей структура-активность для обширной обучающей выборки, включающей в себя: субстанции лекарственных препаратов; “кандидаты в препараты”, находящиеся на различных стадиях клинических и доклинических исследований; фармакологические вещества и биохимические реагенты, зонды; вещества, для которых имеется информация о специфической токсичности. Был получен список прогнозируемых типов активности с оценками вероятности наличия каждого вида активности (Pa) и вероятности отсутствия каждого вида активности (Pi). Чем больше для конкретной активности значение Pa, и чем меньше значение Pi, тем больше шанс обнаружить данную активность в эксперименте [30].
Нами были отобраны активности c Pa > 0.5. Для всех исследуемых оксилипинов была предсказана агонистическая активность по отношению к макрофагальному колониестимулирующему фактору, цитокину, который стимулирует генерацию подмножеств миелоидных клеток, включая нейтрофилы, моноциты, макрофаги и дендритные клетки в ответ на стресс, инфекции и раковые заболевания (табл. 1) [31]. Согласно предсказанию, противовоспалительной активностью обладают 3-гексенил-ацетат и 6-ноненол. Показана возможная активность ингибирования экспрессии TNF-α для 3-гексенил-ацетата, октанола, 1-октенола, 6-ноненола и 2-ноненола, а также травматиновой кислоты.
Исследование провоспалительной активности оксилипинов
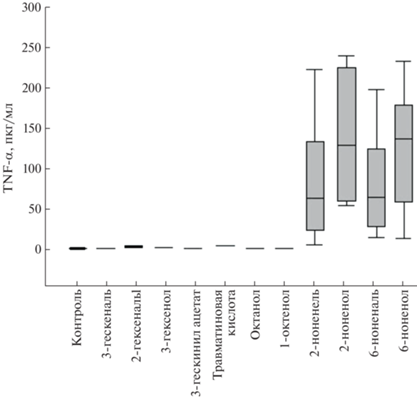
Нами была использована экспериментальная система, основанная на использовании цельной крови доноров, для оценки влияния оксилипинов на индукцию воспалительных ответов. Конечная концентрация оксилипинов в анализируемых образцах составляла 100 мкМ. У большинства шести- и восьмиуглеродных оксилипинов не обнаружена провоспалительная активность, так как различия с контролем не достигали статистической значимости (рис. 1).
Заметная наработка провоспалительного цитокина TNF-α наблюдалась в образцах с девятиуглеродными оксилипинами (рис. 1). Ответ клеток доноров на активацию этими оксилипинами варьировался в широких пределах, что указывает на важную роль других факторов крови в активации провоспалительного ответа на используемые оксилипины. Уровень TNF-α был немного выше при использовании спиртов, чем соответствующих альдегидов.
Для выяснения концентрационной зависимости наблюдаемого эффекта мы изучили влияние различных концентраций 6-ноненаля на индукцию синтеза TNF-α в экспериментальной системе. В качестве позитивного контроля был выбран широко известный активатор воспалительного ответа ‒ эндотоксин (липополисахарид, ЛПС) из E. coli. Результаты представлены на рис. 2.
Рис. 2.
Изменение синтеза TNF-α клетками крови здоровых доноров в ответ на различные концентрации 6-ноненаля. n = 4–8. Чертой обозначено среднее значение ответа на липополисахарид E. coli.
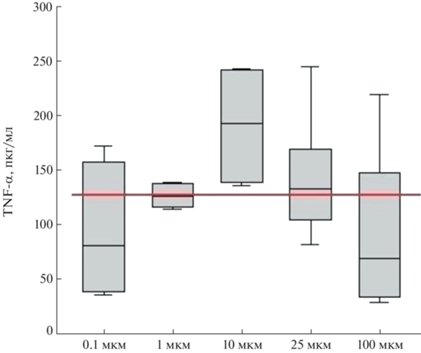
При активации клеток крови очень низкой и высокой концентрациями 6-ноненаля наблюдалась наименьшая провоспалительная активность. Концентрация 10 мкМ индуцировала наибольший синтез TNF-α, хотя и наблюдалась значительная индивидуальная вариативность, и различия в эффектах разных концентраций в большинстве случаев были статистически незначимы.
ОБСУЖДЕНИЕ
Физиологическая активность растительных оксилипинов, в том числе метаболитов ГПЛ ветви, в животной клетке была продемонстрирована во множестве работ, подробный обзор которых был опубликован недавно [32]. Среди метаболитов ГПЛ ветви внимание уделялось лишь нелетучей травматиновой кислоте. Однако, именно летучие альдегиды и их производные широко используются в пищевой промышленности для придания аромата свежести продуктам и для увеличения их сохранности [33–35]. До настоящего времени их влияние на здоровье человека мало изучено. Вместе с растительной пищей мы потребляем значительное количество альдегидов и спиртов с длиной цепи от 6 до 9 углеродов и их производных, образующихся в ГПЛ ветви пути биосинтеза оксилипинов (табл. 1, Дополнительные материалы). Поглощенные с пищей оксилипины могут не только воздействовать на клетки кишечника, но также всасываться и циркулировать в плазме крови [36–38]. Поэтому важно оценить влияние этих соединений на здоровье человека. В литературе активно обсуждается способность растительных экстрактов и содержащихся в них оксилипинов регулировать иммунную активность клеток крови человека [39, 40]. Несмотря на обнаруженную противовоспалительную активность нескольких оксилипинов, в ряде работ показаны провоспалительные свойства полиненасыщенных ω-6 жирных кислот, из которых образуются оксилипины [26].
Мы рассмотрели основные физико-химические свойства изучаемых веществ, используемые для предварительной оценки биологической доступности предполагаемых лекарств [28], для того, чтобы выявить возможную связь между химическим строением и биологической активностью исследуемых веществ. У всех веществ величины рассмотренных показателей находятся в пределах, благоприятствующих биологической доступности (табл. 1). Девятиуглеродные спирты и альдегиды отличаются повышенной липофильностью, а следовательно их действие на физиологический процесс может обуславливаться накоплением в липидных мембранах или связыванием с белками плазмы. Именно эти соединения проявили активность в использованной нами экспериментальной системе.
По результатам поиска возможных клеточных мишеней про- и противовоспалительного действия изучаемых оксилипинов, спрогнозированный спектр активности получился достаточно обширным. Возможно, в структуре этих довольно простых веществ не содержится каких-либо особенностей, обеспечивающих высокую селективность их биологического действия. Вероятность Pa отражает прежде всего сходство структуры молекул данного вещества со структурами молекул наиболее типичных в соответствующем подмножестве “активных” веществ в обучающей выборке. Поэтому никакой прямой корреляции значений Pa с количественными характеристиками активности, как правило, нет [30]. К результатам такого прогноза необходимо относиться с большой осторожностью.
Шестиуглеродные оксилипины часто встречаются в пищевых продуктах (см. табл. 1, Дополнительные материалы). Экспериментальная оценка их провоспалительной активности показала, что они не активируют клетки крови к наработке значительного количества провоспалительного цитокина TNF-α, тогда как девятиуглеродные оксилипины являются в значительной степени иммуногенными. При попадании в кровь девятиуглеродные оксилипины индуцируют значительную наработку провоспалительного цитокина TNF-α, тем самым запуская возможное развитие воспалительного ответа. Девятиуглеродные альдегиды активировали синтез TNF-α в меньшей степени, чем спирты. В парах 6-ноненол/2-ноненол и 6-ноненаль/2-ноненаль провоспалительная активность очень близка, что свидетельствует о том, что положение двойной связи в молекуле не сказывается на его провоспалительных свойствах. Результаты показывают, что для проявления иммуномодулирующей активности оксилипина имеет значение как длина углеродной цепи, так и наличие функциональной группы (гидроксильная или альдегидная). Девятиуглеродные оксилипины были обнаружены в огурце, арбузе, семенах миндаля и некоторых лекарственных растениях. Данные о провоспалительной активности этих соединений, полученные в нашей работе, могут быть полезны для разработки диетологических рекомендаций для людей, страдающих воспалительными заболеваниями.
Работа поддержана Российским научным фондом, грант № 22-24-00489.
Авторы заявляют об отсутствии конфликта интересов. Настоящая работа не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Liavonchanka A., Feussner I. Lipoxygenases: occurrence, functions and catalysis // J. Plant Physiol. 2006. V. 163. P. 348. https://doi.org/10.1016/j.jplph.2005.11.006
Andreou A., Feussner I. Lipoxygenases - structure and reaction mechanism // Phytochem. 2009. V. 70. P. 1504. https://doi.org/10.1016/j.phytochem.2009.05.008
Brash A.R., Ingram C.D., Harris T.M. Analysis of a specific oxygenation reaction of soybean lipoxygenase-1 with fatty acids esterified in phospholipids // Biochemistry. 1987. V. 26. P. 5465. https://doi.org/10.1021/bi00391a038
Leon J., Royo J., Vancanneyt G., Sanz C., Silkowski H., Griffiths G., Sanchez-Serrano J.J. Lipoxygenase H1 gene silencing reveals a specific role in supplying fatty acid hydroperoxides for aliphatic aldehyde production // J. Biol. Chem. 2002. V. 277. P. 416. https://doi.org/10.1074/jbc.M107763200
Nakashima A., von Reuss S.H., Tasaka H., Nomura M., Mochizuki S., Iijima Y., Aoki K., Shibata D., Boland W., Takabayashi J., Matsui K. Traumatin- and Dinortraumatin-containing Galactolipids in Arabidopsis: their formation in tissue-disrupted leaves as counterparts of green leaf volatiles // J. Biol. Chem. 2013. V. 288. P. 26078. https://doi.org/10.1074/jbc.M113.487959
Lee D.S., Nioche P., Hamberg M., Raman C.S. Structural insights into the evolutionary paths of oxylipin biosynthetic enzymes // Nature. 2008. V. 455. P. 363. https://doi.org/10.1038/nature07307
Grechkin A.N., Hamberg M. The “heterolytic hydroperoxide lyase” is an isomerase producing a short-lived fatty acid hemiacetal // Biochim. Biophys. Acta. 2004. V. 1636. P. 47. https://doi.org/10.1016/j.bbalip.2003.12.003
Matsui K., Kurishita S., Hisamitsu A., Kajiwara T. A lipid-hydrolysing activity involved in hexenal formation // Biochem. Soc. Trans. 2000. V. 28. P. 857.
Zimmerman D.C., Coudron C.A. Identification of traumatin, a wound hormone, as 12-oxo-trans-10-dodecenoic acid // Plant Physiol. 1979. V. 63. P. 536. https://doi.org/10.1104/pp.63.3.536
Kallenbach M., Gilardoni P.A., Allmann S., Baldwin I.T., Bonaventure G. C12 derivatives of the hydroperoxide lyase pathway are produced by product recycling through lipoxygenase-2 in Nicotiana attenuata leaves // New Phytol. 2011. V. 191. P. 1054. https://doi.org/10.1111/j.1469-8137.2011.03767.x
Stumpe M., Bode J., Göbel C., Wichard T., Schaaf A., Frank W., Frank M., Reski R., Pohnert G., Feussner I. Biosynthesis of C9-aldehydes in the moss Physcomitrella patens // Biochim. Biophys. Acta. 2006. V. 1761. P. 301. https://doi.org/10.1016/j.bbalip.2006.03.008
Tijet N., Schneider C., Muller B.L., Brash A.R. Biogenesis of volatile aldehydes from fatty acid hydroperoxides: molecular cloning of a hydroperoxide lyase (CYP74C) with specificity for both the 9- and 13-hydroperoxides of linoleic and linolenic acids // Arch Biochem Biophys. 2001. V. 386. P. 281. https://doi.org/10.1006/abbi.2000.2218
Noordermeer M.A., Veldink G.A., Vliegenthart J.F.G. Alfalfa contains substantial 9-hydroperoxide lyase activity and a 3Z:2E-enal isomerase // FEBS lett. 1999. V. 443. P. 201. https://doi.org/10.1016/S0014-5793(98)01706-2
Kunishima M., Yamauchi Y., Mizutani M., Kuse M., Takikawa H., Sugimoto Y. Identification of (Z)-3:(E)-2-hexenal isomerases essential to the production of the leaf aldehyde in plants // J. Biol. Chem. 2016. V. 291. P. 14023. https://doi.org/10.1074/jbc.M116.726687
Bate N.J., Riley J.C.M., Thompson J.E., Rothstein S.J. Quantitative and qualitative differences in C6-volatile production from the lipoxygenase pathway in an alcohol dehydrogenase mutant of Arabidopsis thaliana // Physiol. Plant. 1998. V. 104. P. 97. https://doi.org/10.1034/j.1399-3054.1998.1040113.x
Tanaka T., Ikeda A., Shiojiri K., Ozawa R., Shiki K., Nagai-Kunihiro N., Fujita K., Sugimoto K., Yamato K.T., Dohra H., Ohnishi T., Koeduka T., Matsui K. Identification of a hexenal reductase that modulates the composition of green leaf volatiles // Plant Physiol. 2018. V. 178. P. 552. https://doi.org/10.1104/pp.18.00632
D'Auria J.C., Pichersky E., Schaub A., Hansel A., Gershenzon J. Characterization of a BAHD acyltransferase responsible for producing the green leaf volatile (Z)-3-hexen-1-yl acetate in Arabidopsis thaliana // Plant J. 2007. V. 49. P. 194. https://doi.org/10.1111/j.1365-313X.2006.02946.x
Kihara H., Tanaka M., Yamato K.T., Horibata A., Yamada A., Kita S., Ishizaki K., Kajikawa M., Fukuzawa H., Kohchi T., Akakabe Y., Matsui K. Arachidonic acid-dependent carbon-eight volatile synthesis from wounded liverwort (Marchantia polymorpha) // Phytochemistry. 2014. V. 107. P. 42. https://doi.org/10.1016/j.phytochem.2014.08.008
Noordermeer M.A., Van Dijken A.J., Smeekens S.C., Veldink G.A., Vliegenthart J.F. Characterization of three cloned and expressed 13-hydroperoxide lyase isoenzymes from alfalfa with unusual N-terminal sequences and different enzyme kinetics // Eur. J. Biochem. 2000. V. 267. P. 2473. https://doi.org/10.1046/j.1432-1327.2000.01283.x
Matsui K., Minami A., Hornung E., Shibata H., Kishimoto K., Ahnert V., Kindl H., Kajiwara T., Feussner I. Biosynthesis of fatty acid derived aldehydes is induced upon mechanical wounding and its products show fungicidal activities in cucumber // Phytochemistry. 2006. V. 67. P. 649. https://doi.org/10.1016/j.phytochem.2006.01.006
Prost I., Dhondt S., Rothe G., Vicente J., Rodriguez M.J., Kift N., Carbonne F., Griffiths G., Esquerré-Tugayé M.-Th., Rosahl S., Castresana C., Hamberg M., Fournier J. Evaluation of the antimicrobial activities of plant oxylipins supports their involvement in defense against pathogens // Plant Physiol. 2005. V. 139. P. 1902. https://doi.org/10.1104/pp.105.066274
Matsui K. Green leaf volatiles: hydroperoxide lyase pathway of oxylipin metabolism // Curr. Opin. Plant Biol. 2006. V. 9. P. 274. https://doi.org/10.1016/j.pbi.2006.03.002
Savchenko T., Pearse I.S., Ignatia L., Karban R., Dehesh K. Insect herbivores selectively suppress the HPL branch of the oxylipin pathway in host plants // Plant J. 2013. V. 73. P. 653. https://doi.org/10.1111/tpj.12064
Loreto F., Barta C., Brilli F., Nogues I. On the induction of volatile organic compound emissions by plants as consequence of wounding or fluctuations of light and temperature // Plant Cell Environ. 2006. V. 29. P. 1820. https://doi.org/10.1111/j.1365-3040.2006.01561.x
Шипелин В.А., Сидорова Ю.С. Оксилипины – биологически активные вещества пищи // Вопросы питания. 2020. Т. 89. С.16 https://doi.org/10.24411/0042-8833-2020-10073
Thies F., Miles E.A., Nebe-von-Caron G., Powell J.R., Hurst T.L., Newsholme E.A., Calder P.C. Influence of dietary supplementation with long-chain n-3 or n-6 polyunsaturated fatty acids on blood inflammatory cell populations and functions and on plasma soluble adhesion molecules in healthy adults // Lipids. 2001. V. 36. P. 1183. https://doi.org/10.1007/s11745-001-0831-4
Radzyukevich Y.V., Kosyakova N.I., Prokhorenko I.R. Synergistic effect of Dermatophagoides pteronyssinus allergen and Escherichia coli lipopolysaccharide on human blood cells // PloS One. 2018. V. 13:e0207311. https://doi.org/10.1371/journal.pone.0207311
Barret R. Medicinal Chemistry: fundamentals. Elsevier. 2018. 172 p.
Veber D.F., Johnson S.R., Cheng H.-Y., Smith B.R., Ward K.W., Kopple K.D. Molecular properties that influence the oral bioavailability of drug candidates // J. Med. Chem. 2002. V. 45. P. 2615. https://doi.org/10.1021/jm020017n
Филимонов Д.А., Лагунин А.А., Глориозова Т.А., Рудик А.В., Дружиловский Д.С., Погодин П.В., Поройко В.В. Предсказание спектров биологической активности органических соединений с помощью веб-ресурса PASS ONLINE // Химия гетероциклических соединений. 2014. Т. 3. С. 483.
Kumar A., Taghi Khani A., Sanchez Ortiz A., Swaminathan S. GM-CSF: a double-edged sword in cancer immunotherapy // Front. Immunol. 2022. V. 13. P. 901277. https://doi.org/10.3389/fimmu.2022.901277
Savchenko T., Degtyaryov E., Radzyukevich Y., Buryak V. Therapeutic potential of plant oxylipins // Int. J. Mol. Sci. 2022. V. 23. P. 14627. https://doi.org/10.3390/ijms232314627
Lehtonen M., Kekäläinen S., Nikkilä I., Kilpeläinen P., Tenkanen M., Mikkonen K.S. Active food packaging through controlled in situ production and release of hexanal // Food Chem.: X. 2020. V. 5. P. 100074. https://doi.org/10.1016/j.fochx.2019.100074
Mussinan C.J., Mookherjee B.D., Vock M.H., Schmitt F.L., Granda E.J., Vinals J.F., Kiwala J. Flavoring with a mixture of cis-3-hexenal, trans-2-hexenal, cis-3-hexenyl formate, cis-3-hexenol and cis-3-hexenyl-cis-3-hexenoate. US Patent № 4241098. 1979.
Vincenti S., Mariani M., Alberti J.-C., Jacopini S., Brunini-Bronzini de Caraffa V., Berti L., Maury J. Biocatalytic synthesis of natural green leaf volatiles using the lipoxygenase metabolic pathway // Catalysts. 2019. V. 9. P. 873. https://doi.org/10.3390/catal9100873
Karg K., Dirsch V.M., Vollmar A.M., Cracowski J.L., Laporte F., Mueller M.J. Biologically active oxidized lipids (phytoprostanes) in the plant diet and parenteral lipid nutrition // Free Radic. Res. 2007. V. 41. P. 25. https://doi.org/10.1080/10715760600939734
Larsson K., Harrysson H., Havenaar R., Alminger M., Undeland I. Formation of malondialdehyde (MDA), 4‑hydroxy-2-hexenal (HHE) and 4-hydroxy-2-nonenal (HNE) in fish and fish oil during dynamic gastrointestinal in vitro digestion // Food Funct. 2016. V. 7. P. 1176. https://doi.org/10.1039/c5fo01401h
Goicoechea E., Brandon E.F., Blokland M.H., Guillén M.D. Fate in digestion in vitro of several food components, including some toxic compounds coming from omega-3 and omega-6 lipids // Food Chem. Toxicol. 2011. V. 49. P. 115. https://doi.org/10.1016/j.fct.2010.10.005
Salem M.L. Immunomodulatory and therapeutic properties of the Nigella sativa L. seed // Int. Immunopharmacol. 2005. V. 5. P. 1749. https://doi.org/10.1016/j.intimp.2005.06.008
Block K.I., Mead M.N. Immune system effects of echinacea, ginseng, and astragalus: a review // Integr. Cancer Ther. 2003. V. 2. P. 247. https://doi.org/10.1177/1534735403256419
Дополнительные материалы
- скачать ESM.zip
- Приложение 1.
Таблица 1. Встречаемость оксилипинов ГПЛ ветви в растениях
Инструменты
Физиология растений