Физиология растений, 2023, T. 70, № 7, стр. 765-773
Фенольные соединения растений Bidens tripartita (L.) и Bidens pilosa (L.) из разных мест обитания
Э. Бименьиндавьи a, *, Л. З. Хуснетдинова a, О. А. Тимофеева a
a Казанский федеральный университет
Казань, Россия
* E-mail: efredence@gmail.com
Поступила в редакцию 25.09.2023
После доработки 06.10.2023
Принята к публикации 06.10.2023
- EDN: BGLVUR
- DOI: 10.31857/S001533032360081X
Аннотация
Bidens tripartita L. и Bidens pilosa L. являются потенциальными источниками биологически активных веществ, обладающих противомикробной, антидиабетической, противораковой, противовоспалительной, антиоксидантной и другими активностями. Данные виды череды широко используются в разных странах в фитомедицине. Установлено, что изучаемые виды богаты разнообразными фенольными соединениями, причем растения, произрастающие в условиях умеренно-континентального (Татарстан) и тропического (Бурунди) климата, слабо различаются по содержанию фенольных соединений, что свидетельствует о генетически обусловленной узкой амплитуде изменчивости метаболизма этих видов. Качественный анализ фенольных соединений показал, что изученные виды растений синтезируют определенные группы соединений для адаптации в конкретных условиях обитания. Киримиро в Республике Бурунди и Спасский район в Республике Татарстан можно рассматривать как перспективные районы для выращиваний и сбора изучаемых видов растений. Температура, высота над уровнем моря, количество осадков и состав почвы являются ключевыми факторами, влияющими на содержание фенольных соединений растений B. pilosa и B. tripartita.
ВВЕДЕНИЕ
Bidens – один из родов семейства астровых (Asteraceae), включающий в себя около 280 видов, в том числе, B. tripartita и B. pilosa. Виды Bidens широко используются в народной и традиционной медицине для лечения различных заболеваний в разных странах мира.
Согласно литературным данным, растения рода Bidens содержат множество соединений, включая флавоноиды, фенилпропаноиды, тритерпеноиды, алкалоиды и органические кислоты, из которых флавоноиды являются основными эффективными компонентами [1].
Современные фармакологические исследования показывают, что именно эти соединения в растениях Bidens обладают противовоспалительными, антиоксидантными, обезболивающими, антибактериальными, противоопухолевыми, гиполипидемическими, антидиабетическими, гепопротекторными функциями [2].
В свою очередь, в растениях основной функцией вторичных метаболитов является защита от неблагоприятного воздействия различных факторов абиотической и биотической природы в течение всей жизни, обеспечивая, таким образом, приспособленность и выживание растений [3, 4]. Чтобы справиться со стрессом, растения вынуждены индуцировать или уменьшать синтез вторичных метаболитов в организме [5]. Различные исследования свидетельствуют о значительном влиянии отдельных факторов окружающей среды на накопление веществ вторичного метаболизма растений. Например, показано, что засуха вызывает окислительный стресс, при этом увеличиваются фенольные соединения и витамины в Amaranthus tricolor L. [6]. Повышенные температуры и высокая интенсивность света увеличивают синтез и накопление различных вторичных метаболитов, включая кверцетин, дубильные вещества, аскорбиновую кислоту, тритерпеноиды, многие из которых обладают антиоксидантными свойствами [7].
В связи с этим состав и количество биологически активных веществ, характеризующих эффективность лекарственных растений, различают в зависимости от вида и органа растения, срока сбора и условий места обитания (климатические условия, географическое положение, тип и состав почвы и т.д.) [8, 9].
Целью нашей работы было выявление совокупности факторов окружающей среды и перспективных регионов для выращивания и сбора лекарственных растений B. pilosa и B. tripartite с наиболее высоким содержанием биологически активных веществ. Для достижения данной цели было проведено сравнительное изучение содержания фенольных соединений двух видов растений (B. pilosa и B. tripartita), произрастающих в разных регионах Республики Бурунди и Республики Татарстан и проведена оценка степени влияния эколого-географических факторов на содержание биологически активных веществ в исследуемых растениях.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Объектом исследования служила надземная часть двух видов череды: череда трехраздельная (B. tripartita) и череда волосистая (B. pilosa) из разных районов Республики Бурунди (РБ) (табл. 1): Киримиро (место сбора растений – суходольный луг с высокой освещенностью, высота над уровнем моря 1603 м); Мугамба (место сбора растений – суходольный луг с высокой освещенностью, высота над уровнем моря 2097 м); Бурагане (место сбора растений – суходольный луг с высокой освещенностью, высота над уровнем моря 1550 м) и Республики Татарстан (РТ) (табл. 2): Спасский (место сбора растений – остепненный луг с высокой освещенностью) и Высокогорский район (место сбора растений – придорожная западина с высокой освещенностью). Растения собирали в июле 2019 г. на стадии цветения. Состав почв с места сбора растений РБ определяли в агрохимической лаборатории анализа почвы и пищевых продуктов Института агрономических наук Бурунди (ISABU). Высоту над уровнем моря на месте сбора определяли с помощью приложения offlinemaps. Температурные данные и количество осадков были предоставлены Географическим институтом Бурунди (IGEBU). Состав почв с места сбора растений РТ определяли в агрохимической лаборатории Россельхознадзора РТ.
Таблица 1.
Гео-экологические характеристики районов региона Киримиро, Мугамба и Бурагане (среднегодовые за 2019 г.)
| Район | Высота над уровнем моря, (м) | Количество осадков, (мм) | Средняя температура, (°C) | рН | Содержание минеральных элементов в почвах исследуемых регионов |
||||
|---|---|---|---|---|---|---|---|---|---|
| ${\text{NO}}_{3}^{ - }$ (%) |
${\text{PO}}_{4}^{{3 - }}$ (мд) | K+ (мЭкв/ 100 г) | Ca2+ (мЭкв/ 100 г) | Mg2+ (мЭкв/100 г) | |||||
| Киримиро | 1603 | 1321 | 19 | 4.9 | 0.13 | 5.94 | 0.36 | 4.7 | 0.63 |
| Мугамба | 2097 | 1598 | 15.7 | 4.0 | 0.11 | 7.56 | 0.24 | 0.45 | 0.19 |
| Бурагане | 1550 | 1233 | 21.5 | 5.7 | 0.19 | 8.45 | 0.57 | 3.44 | 0.58 |
Таблица 2.
Ландшафтные и климатические (осенне-весенний период 2019 г.) характеристики районов Татарстана. https://nuipogoda.ru/
| Район | Количеств осадков (мм) |
Средняя температура (°C) |
Климатиче ская зона |
pH | Содержание минеральных элементов в почвах исследуемых регионов |
||||
|---|---|---|---|---|---|---|---|---|---|
| ${\text{NO}}_{3}^{ - }$ (%) |
${\text{PO}}_{4}^{{3 - }}$ (мд) | K+ (мЭкв/ 100 г) | Ca2+ (мЭкв/ 100 г) | Mg2+ (мЭкв/100 г) | |||||
| Спасский | 189 | 12.5 | Лесостепь | 7.4 | 0.23 | 0.29 | 1.84 | 15.03 | 12.00 |
| Высокогорский | 261 | 14 | Хвойно-широколи ственная |
6.1 | 0.18 | 0.31 | 1.27 | 15.63 | 1.56 |
Растительный материал сушили в тени до воздушно-сухого состояния, образцы хранили в бумажных пакетах без воздействия прямых солнечных лучей. Листья растений измельчали до порошкообразного состояния. Далее полученное измельченное сырье использовали для приготовления экстрактов.
Определение суммарного содержания водорастворимых фенольных соединений. Суммарное содержание водорастворимых фенольных соединений (ВФС) определяли спектрофотометрическим методом с использованием реактива Фолина–Дениса в присутствии NaHСO3. Около 50 мг измельченного растительного сырья, помещали в пробирку Эппендорф, прибавляли 1.5 мл дистиллированной воды и инкубировали на водяной бане в течение 45 мин при температуре 70°С, после чего центрифугировали при 15 000 об/мин в течение 5 мин. Водный экстракт хранили при +4°С без доступа света для дальнейшего использования.
Для определения ВФС, отбирали 75 мкл водного экстракта в пробирки объемом 1.5 мл, добавляли 75 мкл реактива Фолина-Дениса, перемешивали, через 3 мин добавляли 120 мкл насыщенного раствора NaHСO3 (10%), перемешивали, добавляли 1.2 мл воды и через 45 мин центрифугировали при 16 000 об/мин в течение 2 мин. Оптическую плотность измеряли на спектрофотометре при длине волны 725 нм. В качестве контроля использовали 75 мкл воды вместо экстракта. Суммарное содержание растворимых фенольных соединений в изучаемом сырье рассчитывали по формуле:
где: C – концентрация фенольных соединений, мг/г сухой массы; E – оптическая плотность при 725 нм; К – коэффициент пересчета на эталонное вещество – (–)-эпикатехин (480); R – разведение; V – объем экстракта, мл; m – масса навески растительного материала, г [10].Определение содержания флавоноидов. Экстракт для определения флавоноидов в лекарственном сырье готовили по методике, описанной в работе [11]. Около 1 г измельченного растительного сырья, помещали в коническую колбу на 150 мл, прибавляли 30 мл 90% этилового спирта, содержащего 1% концентрированной соляной кислоты (HCl), нагревали на кипящей водяной бане в течение 30 мин. Затем колбу охлаждали до комнатной температуры и фильтровали полученный экстракт через бумажный фильтр. Экстракцию повторяли дважды. Фильтровали через тот же фильтр в ту же колбу, далее промывали фильтр 90% этиловым спиртом и доводили объем фильтрата до метки (раствор А).
Для определения помещали 2 мл раствора А в колбу, добавляли 1 мл 1% раствора алюминия хлорида (AlCl3) в 95% этиловом спирте и доводили объем раствора 95% этиловым спиртом до метки. Далее через 20 мин определяли оптическую плотность раствора на спектрофотометре при длине волны 430 нм. В качестве контроля использовали раствор, состоящий из 2 мл раствора А, доведенный 95% этиловым спиртом до заданного объема.
Содержание суммы флавоноидов в пересчете на кверцетин и абсолютно сухое сырье в процентах (X) рассчитывали по формуле:
где D – оптическая плотность исследуемого раствора; 764.6 – удельный показатель поглощения комплекса кверцетина с алюминия хлоридом при 430 нм; m – масса сырья в граммах, г; W – потеря массы при высушивании сырья, %.Определение суммы дубильных веществ в пересчете на танин. Содержание дубильных веществ определяли путем титрования раствором перманганата калия. Для экстракции дубильных веществ 2 г сухого измельченного сырья помещали в колбу на 500 мл, заливали 250 мл кипящей воды и нагревали с обратным холодильником на водяной бане в течение 30 мин при периодическом перемешивании. Охлаждали до комнатной температуры, фильтровали через вату, доводили водой до нужного объема. Затем отбирали 25.0 мл водного экстракта в колбу, добавляли 500 мл воды, 25 мл раствора индигосульфокислоты и титровали при постоянном перемешивании раствором перманганата калия (0.02 моль/л) до золотисто-желтого окрашивания. В качестве контрольного варианта к 525 мл воды добавляли 25 мл раствора индигосульфокислоты и титровали при постоянном перемешивании раствором перманганата калия (0.02 моль/л) до золотисто-желтого окрашивания.
Содержание суммы дубильных веществ в пересчете на танин в абсолютно сухом сырье в процентах (Х) рассчитывали по формуле:
Для приготовления раствора индигосульфокислоты, растворяли 1.0 г индигокармина в 25 мл концентрированной серной кислоты затем прибавляли дополнительно 25 мл серной кислоты и разбавляли водой до 1000 мл [12].
Определение содержания фенольных соединений методом ВЭЖХ. Для проведения хроматографического анализа первоначально проводили спиртовую экстракцию фенольных соединений в 70% этаноле на водяной бане в течение 90 мин [13]. Далее была проведена идентификация фенольных соединений методом высокоэффективной жидкостной хроматографии на хроматографической системе высокого давления (“BIO-RAD”, США). Использовали оригинальную колонку SN-421001911, 5 μм, 4 × 250 мм (США). Детекцию пиков осуществляли посредством двухволнового УФ ВЭЖХ детектора BioLogic QuadTec UV-Vis (“BIO-RAD”, США) при длине волны 260 нм. В качестве подвижной фазы использовали 98% воду, 1% уксусную кислоту, 1% ацетонитрил (раствор А) и 99% ацетонитрил, 1% уксусную кислоту (Б). Элюирование: линейный градиент подвижной фазы A в фазе B составлял 30–80% от 0 до 9 мин с последующим изократическим элюированием 80% фазы A в фазе B от 9 до 15 мин; скорость потока составляла 1 мл/мин. ВЭЖХ проводили при комнатной температуре (25 ± 2°С). Для идентификации пиков выявляемых, на хроматограмме, использовали рабочие стандартные растворы кверцетина (CAS 117–39–5, ≥95%, “Sigma Aldrich”, Германия), протокате́ховой кислоты (CAS 99–50–3, ≥98%, “Sigma Aldrich”, Германия), хлорогеновой кислоты (CAS 327–97–9, ≥95%, “Sigma Aldrich”, Германия), лютеолина (L9283-10MG, ≥98%, Израиль), кемпферола (CAS 520–18–3, ≥90%, “Sigma Aldrich”, Франция), кумаровой кислоты (CAS 501–98–4, ≥98%, “Sigma Aldrich”, Германия), бензойной кислоты (CAS 6585–0, ≥99.5%, “merck millipore”, Россия), феруловой кислоты (CAS 537–98–4, ≥98%, “Sigma Aldrich”, Германия), кофейной кислоты (CAS 331–39–5, ≥98%, “Sigma Aldrich”, Германия), синаповой кислоты (CAS 530–59–6, ≥98%, “Sigma Aldrich”, Германия).
Статистический анализ. Все эксперименты проводились минимум в 5-кратной повторности. Статистическая обработка данных проводилась в программе OriginPro 2021 используя двусторонний критерий Манна–Уитни с поправкой Бонферони для множественного сравнения при P < 0.05. Данные перед началом анализа связей между факторами окружающей среды и содержанием фенольных соединений подвергали тестированию на нормальность распределения с использованием критерия Шапиро–Уилка. Взаимосвязь между параметрами оценивали посредством корреляционного анализа Пирсона.
РЕЗУЛЬТАТЫ
Содержание фенольных соединений в исследуемых лекарственных растениях. В ходе нашей работы был проведен сравнительный анализ содержания ВФС, дубильных веществ и флавоноидов в исследуемых лекарственных растениях, собранных из разных мест обитаний. Было обнаружено, что содержание изученных фенольных соединений в исследуемых видах лекарственных растений, произрастающих в различных регионах РТ и РБ варьирует в широких пределах в зависимости от места произрастания и различается в разных органах растений (рис. 1). Установлено, что листья имеют более высокое содержание фенольных соединений, по сравнению с цветками и стеблями. Как видно из рис. 1, в растениях B. pilosa содержание ВФС варьировало от 23.66 до 32.01 мг/г в листьях и от 12.19 до 17.33 мг/г сухого веса в стеблях. Растения, которые были собраны в регионе Киримиро, имели наиболее высокое содержание ВФС, по сравнению с регионами Мугамба и Бурагане. Растения из Бурагане и Мугамба не отличались по содержанию данных соединений.
Рис. 1.
Содержание фенольных соединений в В. pilosa (а, б, в): I – Киримиро; II – Мугамба; III – Бурагане и B. tripartita (г, д, е): I – Высокогорский район; II – Спасский район; III – регион Киримиро; IV – регион Мугамба; V – регион Бурагане. 1 – листья; 2 – цветки; 3 – стебель. Одинаковыми буквами обозначено отсутствие статистически значимых отличий между образцами, собранными в разных районах при Р < 0.05.
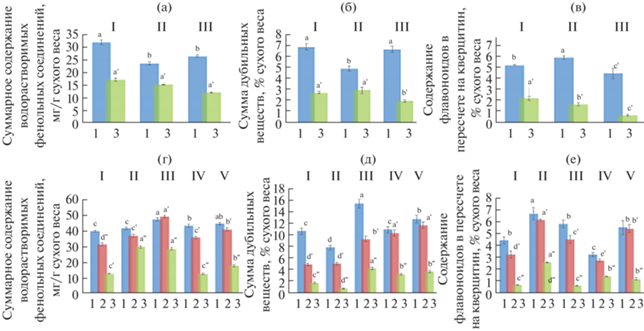
Содержание дубильных веществ составило от 5.04 до 7.04% сухого веса в листьях, а в стеблях – от 2.04 до 3.05% сухого веса. Как видно из рис. 1б, большее количество дубильных веществ накапливается в листьях, по сравнению со стеблями. При этом растения из Киримиро и Бурагане характеризовались более высоким содержанием дубильных веществ, чем растения из Мугамба.
Содержание флавоноидов в листьях B. pilosa было в пределах от 4.95 до 5.91% сухого веса (в пересчете на кверцетин). Самое большое количество кверцетина выявлено в растениях из Мугамба (рис. 1в). Таким образом, растения B. pilosa с самым высоким уровнем фенольных соединений обнаружены в регионах Киримиро, по сравнению с Бурагане и Мугамбе.
У растений B. tripartita содержание ВФС варьировало от 40.65 до 48.24 мг/г в листьях, 32.02 до 49.82 мг/г в цветках и 12.96 до 30.48 мг/г сухого веса в стеблях (рис. 1г). В целом, листья и цветки растения B. tripartita содержали примерно одинаковое количество ВФС. Растения, собранные в Высокогорском и Спасском районах РТ, статистически не отличались по этому показателю, как и растения из регионов Киримиро и Бурагане в РБ.
Самое высокое количество дубильных веществ обнаружено в листьях, самое низкое – в стеблях. В листьях растения B. tripartita количество дубильных веществ было в пределах от 8.04 до 15.68% сухого веса. Было выявлено что, в РТ растения из Высокогорского района, а в РБ – растения из региона Киримиро, содержали больше дубильных веществ, по сравнению с другими районами (рис. 1д).
Самое высокое значение флавоноидов наблюдалось в растениях, собранных из Спасского района РТ; Киримиро и Бурагане РБ. Больше всего их было в листьях и количество варьировалось от 3.29 до 6.77% сухого веса (в пересчете на кверцетин) (рис. 1е).
Следует отметить, что растения B. tripartita характеризуются более высокими количествами фенольных соединений, чем растения B. pilosa. При этом растения B. tripartita, произрастающие в условиях умеренно-континентального (Татарстан) и тропического (Бурунди) климата, имеют практически одинаковое содержание фенольных соединений.
Качественный состав фенольных соединений в исследуемых лекарственных растениях. При изучении профиля индивидуальных фенольных соединений методом ВЭЖХ в исследуемых растениях было установлено, что растения одного и того же вида не всегда синтезируют одни и те же вещества и в одинаковом количестве. Каждый вид растений имеет набор индивидуальных фенольных соединений, которые играют свои специфические роли в растении при адаптации и защите от абиотических и биотических стрессоров.
Как видно из рис. 2а–2в, растения B. pilosa богаты разными индивидуальными фенольными соединениями с преобладанием кемпферола в регионе Киримиро, кверцетина в регионе Мугамба и Бурагане. Стоит отметить, что растения B. pilosa в регионе Киримиро имеют самый разнообразный фенольный состав.
Рис. 2.
ВЭЖХ хроматограммы водно-спиртового экстракта растений B. pilosa из разных мест произрастания: а – регион Киримиро: 2 – галловая кислота, 4 – кверцетин, 5 – кемпферол, 7 – протокатехин, 10 – хлорогеновая кислота, 12 – цинарозид; б – регион Мугамба: 2 – галловая кислота, 4 – кверцетин, 5 – катехин, 8 – кофейная кислота; в – регион Бурагане: 3 – кверцетин, 4 – протокатехин, 5 – хлорогеновая кислота, 6 – лютеолин.
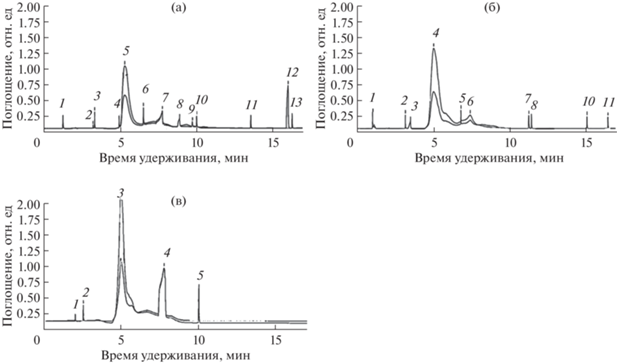
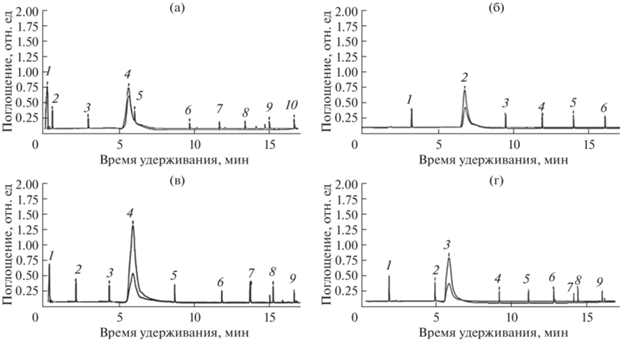
У B. tripartita качественный анализ показал наибольшее разнообразие фенольных соединений в растениях из лесостепной зоны Спасского района РТ, а также в растениях из региона Бурагане и Киримиро РБ (рис. 3а–3г). Было обнаружено преобладание синаповой кислоты в растениях из Спасского района и регионов Киримиро и Бурагане.
Рис. 3.
ВЭЖХ хроматограммы водно-спиртового экстракта растений B. tripartita из разных мест произрастания: а – Спасский район: 4 – синаповая кислота, 6 – хлорогенновая кислота, 7 – кофейная кислота, 10 – лютеолин; б – Высокогорский район: 2– катехин, 4 – кофейная кислота, 6 – цинарозид; в – регион Бурагане: 2 – коричная кислота, 4 – синаповая кислота, 5 – цис-5 кофеоилхиновая, 6 – кофейная кислота; г – регион Киримиро: 2 – кверцетин, 3 – синаповая кислота, 5– кофейная кислота, 7 – кумаровая кислота.
Влияние эколого-географических условий на содержание биологически активных веществ в исследуемых ресурсно-полезных растениях. Для выявления решающих эколого-географических факторов, влияющих на уровень изучаемых фенольных соединений в лекарственных растениях, был проведен корреляционный анализ по Пирсону.
У растений B. pilosa была обнаружена высокая корреляция между содержанием фенольных соединений и гео-климатическими факторами, а также минеральными элементами почвы. Согласно данным табл. 3, содержание азота в почвах и средняя годовая температура отрицательно коррелировали с содержанием кверцетина в данных растениях, в то время как высота над уровнем моря и количество осадков положительно. Содержание ВФС и дубильных веществ в растениях B. pilosa положительно коррелировало с содержанием кальция и магния в почве (табл. 3).
Таблица 3.
Значения коэффициента корреляции Пирсона между факторами окружающей среды и содержанием фенольных соединений в растениях B. рilosa
| БАВ | Эколого – геологические факторы места произрастаний | |||||||
|---|---|---|---|---|---|---|---|---|
| температура | осадки | высота | Mg2+ | Ca2+ | K+ | ${\text{NO}}_{3}^{ - }$ | ${\text{PO}}_{4}^{ - }$ | |
| ВФС | 0.69* | –0.70 | –0.43 | 0.92* | 0.99* | –0.08 | 0.07 | –0.67* |
| Кверцетин | –0.95* | 0.97* | 0.99* | –0.41 | –0.66 | 0.82 | –0.97* | –0.12 |
| Дубильные вещества | 0.94* | –0.58 | –0.78* | 0.99* | 0.98* | 0.55 | 0.61 | –0.26 |
У растений B. tripartita содержание кверцетина положительно коррелировало со средней температурой, содержанием в почве кальция и магния, высотой над уровнем моря и наблюдалась обратная корреляция с количеством осадков. Содержание дубильных веществ положительно коррелировало с содержанием кальция и магния в почве, а содержание ВРФ положительно коррелировало с содержанием магния в почве и отрицательно с содержанием фосфора (табл. 4).
Таблица 4.
Значения коэффициента корреляции Пирсона между факторами окружающей среды и содержанием фенольных соединений в растениях B. tripartita
| БАВ | Эколого – геологические факторы места произрастаний | |||||||
|---|---|---|---|---|---|---|---|---|
| температура | осадки | высота | Mg2+ | Ca2+ | K+ | ${\text{NO}}_{3}^{ - }$ | ${\text{PO}}_{4}^{ - }$ | |
| ВФС | 0.55 | –0.56 | –0.68 | 0.8* | 0.73* | –0.03 | 0.03 | –0.78* |
| Кверцетин | 0.85* | –0.94* | 0.99* | 1* | 0.98* | 0.56 | 0.61 | –0.27 |
| Дубильные вещества | 0.48 | –0.63 | –0.76* | 0.87* | 0.95* | 0.08 | 0.14 | –0.70 |
ОБСУЖДЕНИЕ
Факторы окружающей среды, такие, как высота над уровнем моря, свет, температура, количество осадков, влажность и состав почвы влияют на синтез и накопление фенольных соединений в изучаемых растениях. Исследования разных авторов [14] доказывают, что количество фенольных соединений может значительно увеличиваться под воздействием различных стрессовых факторов окружающей среды. Они являются мощными антиоксидантами, поэтому эффективно обеспечивают устойчивость растений к ряду биотических и абиотических стрессоров [15]. Их повышение сказывается на стрессоустойчивости растений. Предыдущие исследования показали, что температурный стресс увеличивает синтез фенольных соединений в растениях, но в разной степени, в зависимости от вида растений. В целом холодоустойчивые растения, по-видимому, накапливают более высокие количества фенольных соединений при низкой температуре, а жароустойчивые – при более высокой. Также известно, что высота над уровнем моря играет важную роль в образовании вторичных метаболитов, которые, в конечном итоге, нейтрализуют свободные радикалы. Увеличение высоты над уровнем моря создает определенный стресс для растения, в том числе, за счет повышения УФ-излучения и понижения температуры, которые ускоряют образование свободных радикалов [16].
Состав почвы – другой фактор, который может влиять на содержание фенольных соединений. По данным литературы, при высоких концентрациях калия (K+), магния (Mg2+) и фосфора (${\text{PO}}_{4}^{{3 - }}$) повышается активность фермента фенилаланинаммонийлиазы, ответственной за синтез полифенолов [17]. В других исследованиях сообщалось о влиянии длительного и постоянного азотного голодания на усиление синтеза углеродсодержащих соединений, в т.ч. и накопление фенолов [18–20]. Наши результаты, подтверждают влияние вышеперечисленных факторов на накопление фенольных соединений.
Действительно, регион Киримиро, который отличался высоким содержанием ВРФ и дубильных веществ в растениях B. pilosa, а также всех исследуемых групп фенольных соединений в растениях B. tripartita, характеризуется довольно кислыми почвами, низким содержанием азота и высоким содержанием кальция (Ca2+) и магния (Mg2+). А регион Мугамба, в котором обнаружили высокие значения флавоноидов в пересчете на кверцетин в растениях B. pilosa, находится на самой большой высоте над уровнем моря с низкими среднесуточными температурами, что подтверждает защитную функцию кверцетина в условиях стресса в качестве мощного антиоксиданта [21, 22].
В РТ в растениях В. tripartita Спасского района обнаружено наибольшее содержание фенольных соединений по сравнению с Высокогорским районом. Спасский район отличался от Высокогорского района более низкими температурами и слабощелочной почвой с высоким содержанием азота и калия. Хотя некоторые научные исследования показывают, что содержание полифенолов увеличивается в ответ на дефицит азота в растениях [24]. В работе [25] было показано, что содержание флавоноидов и водорастворимых фенольных соединений увеличивалось в листьях Brassica oleracea var. sabellica при внесении N : P : K. Также высокое содержание ФС в т.ч. флавоноидов, было обнаружено у растений Eleutherine palmifolia, обработанных N:K [26, 27]. Наблюдаемые противоречия влияния минеральных веществ на содержания фенольных соединений в растениях, могут быть связаны с наличием других факторов (поскольку в природной среде на растения оказывают влияние одновременно несколько факторов), количеством и доступностью минеральных веществ и особенностями растений.
Стоит отметить, что растения B. pilosa и B. tripartita, произрастающие в условиях умеренно-континентального (Татарстан) и тропического (Бурунди) климата, слабо различаются по содержанию фенольных соединений, что свидетельствует о генетически обусловленной узкой амплитуде изменчивости метаболизма этих видов.
В ходе изучения профиля индивидуальных фенольных соединений методом ВЭЖХ наблюдали наличие кемпферола и цинарозида только в растениях B. pilosa из Киримиро, кофейной кислоты и катехина – только в растениях из Мугамбы, а лютеолина – только в растениях из Бурагане. Кверцетин присутствовал во всех образцах. Можно полагать, что существует совокупность уникальных факторов окружающей среды, которые способствуют накоплению тех или иных фенольных соединений.
Как и в случае с B. pilosa, растения B. tripartita используют разные фенольные соединения (как например, хлорогенновая кислота и лютеолин в растениях из Спасского района, катехин и цинарозид в растениях из Высокогорского района; коричная кислота и 5 цис-кофеолхиновая кислота в растениях из Бурагане и кумаровая кислота в растениях из Киримро) для адаптации в разных местах обитания, что объясняет их широкое распространение. Кроме того, во всех образцах B. tripartita (кроме Высокогорского района) было обнаружено преобладание синаповой кислоты. Синаповая кислота является одной из наиболее распространенных гидроксикоричных кислот в растениях, проявляющей мощный антиоксидантный эффект. Антиоксидантная активность синаповой кислоты сравнима с кофейной кислотой [28].
Таким образом, установлено, что растения B. pilosa и B. tripartita из РБ и РТ, произрастающие в совершенно разных условиях, имеют близкое содержание биологически активных веществ. Вероятно, сходные механизмы адаптации изученных видов обеспечивают их выживание в совершенно разных условиях РТ и РБ.
Анализ условий произрастания растений в разных регионах РБ выявил, что наиболее благоприятно для накопления фенольных соединений у двух видов Bidens сочетание факторов внешней среды региона Киримиро. Регионы Киримиро и Бурагане находятся на одной высоте, количество осадков там примерно одинаковое, но при этом в регионе Кириморо немного ниже среднесуточные температуры, а почвы довольно кислые, с низким содержанием азота. По крайне мере, на содержание фенольных соединений мог оказать существенно низкий уровень азота в почвах этого региона (табл. 1 ).
Таким образом, почвенные условия (высокое содержание магния, низкое содержание азота и довольно кислые почвы) и относительно высокие средние температуры (19°C), характерные для региона Киримиро, способствуют накоплению биологически активных веществ в растениях B. pilosa и B. tripartita. Для растений в РТ, по-видимому, кроме вышеперечисленных, важным фактором является зональность (лесостепная зона, Спасский район).
Работа выполнена за счет средств программы стратегического академического лидерства Казанского (Приволжского) федерального университета (ПРИОРИТЕТ-2030).
Авторы заявляют об отсутствии конфликта интересов. Настоящая работа не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Chang S.L., Chiang Y.M., Chang C.L., Yeh H.H., Shyur L.F., Kuo Y.H., Wu T.K., Yang W.C. Flavonoids, centaurein and centaureidin, from Bidens pilosa, stimulate IFN-gamma expression // J Ethnopharmacol. 2007. V. 112. P. 232. https://doi.org/10.1016/j.jep.2007.03.001
Wu L., Nie L., Guo S., Wang Q., Wu Z., Lin Y., Wang Y., Li B., Gao T., Yao H. Identification of medicinal Bidens plants for quality control based on organelle genomes // Front. Pharmacol. 2022. V. 13. P. 1. https://doi.org/10.3389/fphar.2022.84213
Mohi U. Environmental factors on secondary metabolism of medicinal plants // Acta Scientific Pharmaceutical Sciences. 2019. V. 3. P. 34. https://doi.org/10.31080/ASPS.2019.03.0338
Ncube B., Finnie J.F., Van Staden J. Quality from the field: The impact of environmental factors as quality determinants in medicinal plants // S. Afr J. Bot. 2012. V. 82. P. 11. https://doi.org/10.1016/j.sajb.2012.05.009
Mohiuddin A.K. Impact of various environmental factors on secondary metabolism of medicinal plants // J. Pharm. ClinRes. 2019. V. 7. P. 1. https://doi.org/10.19080/JPCR.2019.07.555704
Sarker U., Oba S. Drought stress enhances nutritional and bioactive compounds, phenolic acids and antioxidant capacity of Amaranthus leafy vegetable // BMC Plant Biol. 2018. V. 18. P. 1. https://doi.org/10.1186/s12870-018-1484-1
Jan R., Asaf S., Numan M., Lubna Kim K.-M. Plant secondary metabolite biosynthesis and transcriptional regulation in response to biotic and abiotic stress conditions // Agronomy. 2021. V. 11. P. 1. https://doi.org/10.3390/agronomy11050968
Yuan Y., Tang X., Jia Z., Li C., Ma J., Zhang J. The Effects of ecological factors on the main medicinal components of Dendrobium officinale under different cultivation modes // Forests. 2020. V. 11. P. 1.
Issa A.M., Ambrose O.A., Mohammed M., Haruna K., Jacobus N.E. Effects of geographical location on the yield and bioactivity of Anoigeissus leiocarpus // J. Pharm. Biores. 2008. V. 5. P. 68.https://doi.org/10.4314/jpb. v5i2.52995
Запрометов М.Н. Фенольные соединения и методы их определения. Биохимические методы в физиологии растений. М.: Наука, 1971. 185 С.
Андреева В.Ю., Калинкина Г.И. “Разработка методики количественного определения флавоноидов в Манжетке обыкновенной Alchemilla vulgaris l.s.l” // Химия растительного сырья. 2000. №1. С. 85.
Сулейманов Ф.Ш. Определение дубильных веществ в траве Золотарника канадского (Solidago canadensis L.) // J. Sci. Articles “Health and Education Millennium”. 2017. V. 19. P. 302.
Хуснетдинова Л.З., Акулов А.Н., Дубровная С.А. Изучение спектра биологически активных флавоноидов травы Hypericum perforatum L. флоры Республики Татарстан методом высокоэффективной жидкостной хроматографии // Химия растительного сырья. 2017. №4. С. 175.
Šamec D., Karalija E., Šola I., Vujčić B.V., Salopek-Sondi B. The role of polyphenols in abiotic stress response: The influence of molecular structure // Plants. 2021. V. 10. P. 118. https://doi.org/10.3390/plants10010118. PMID: 33430128; PMCID: PMC7827553
Nicolas N., Bruno G., Michael N.C., María M.M., Renée H.F. The influence of environmental variations on the phenolic compound profiles and antioxidant activity of two medicinal Patagonian valerians (Valeriana carnosa Sm. and V. clarionifolia Phil.) // AIMS Agriculture and Food. 2021. V. 6. P. 106. https://doi.org/10.3934/agrfood.2021007
Ghasemi K., Ghasemi Y., Ehteshamnia A., Nabavi S.M., Nabavi S.F., Ebrahimzadeh M.A., Pourmorad F. Influence of environmental factors on antioxidant activity, phenol and flavonoids contents of walnut (Juglans regia L.) green husks // J. Medic. Plants Res. 2011. V. 5. P. 1128.
Ibrahim A.I., Jabbour A.A., Abdulmajeed A.M., Elhady M.E., Almaroai Y.A., Hashim A.M. Adaptive responses of four medicinal plants to high altitude oxidative stresses through the regulation of antioxidants and secondary metabolites // Agronomy. 2022. V. 12. P. 1. https://doi.org/10.3390/agronomy12123032
Singh P., Arif Y., Bajguz A., Hayat S. The role of quercetin in plants // Plant Physiol. Biochem. 2021. V. 66. P. 10. https://doi.org/10.1016/j.plaphy.2021.05.023
Oney-Montalvo J., Uc-Varguez A., Ramírez-Rivera E., Ramírez-Sucre M., Rodríguez-Buenfil I. Influence of soil composition on the profile and content of polyphenols in habanero peppers (Capsicum chinense Jacq) // Agronomy. 2020. V. 10. P. 1. https://doi.org/10.3390/agronomy10091234
Bénard C., Bourgaud F., Gautier H. Impact of temporary nitrogen deprivation on tomato leaf phenolics // Int. J. Mol. Sci. 2011. V. 12. P. 7971. https:// https://doi.org/10.3390/ijms12117971
Olsen K.M., Slimestad R., Lea U.S., Brede C., Løvdal T., Ruoff P., Verheul M., Lillo C. Temperature and nitrogen effects on regulators and products of the flavonoid pathway: experimental and kinetic model studies // Plant Cell Environ. 2009. V. 32. P. 286. https:// https://doi.org/10.1111/j.1365-3040.2008.01920
Scheible W.R., Morcuende R., Czechowski T., Fritz C., Osuna D., Palacios-Rojas N., Schindelasch D., Thimm O., Udvardi M.K., Stitt M. Genome-wide reprogramming of primary and secondary metabolism, protein synthesis, cellular growth processes, and the regulatory infrastructure of Arabidopsis in response to nitrogen // Plant Physiol. 2004. V. 136. P. 2483. https://doi.org/10.1104/pp.104.047019
Singh P. The role of quercetin in plants // Plant Physiol. Biochem. 2021. V. 166. P. 10. https://doi.org/10.1016/j.plaphy.2021.05.023
Jaakola L., Hohtola A. Effect of latitude on flavonoid biosynthesis in plants // Plant Cell Environ. 2010. V. 33. P. 1239. https://doi.org/10.1111/j.1365-3040.2010.02154
Narvekar A.S., Tharayil N. Nitrogen fertilization influences the quantity, composition, and tissue association of foliar phenolics in strawberries // Front. Plant Sci. 2021. V. 12. P. 1. https://doi.org/10.3389/fpls.2021.613839
Marlin M., Simarmat M., Salamah U., Nurcholis W. Effect of nitrogen and potassium application on growth, total phenolic, flavonoid contents, and antioxidant activity of Eleutherine palmifolia // AIMS Agricul. Food. 2022. V. 7. P. 580. https://doi.org/10.3934/agrfood.2022036
Anteh J.D., Timofeeva O.A., Mostyakova A.A. Assessment of mineral nutrient impact on metabolites accumulation in kale (Brassica oleracea var. sabellica) // Sib. J. Life Sci. Agricul. 2021. V. 13. P. 208. https://doi.org/10.12731/2658-6649-2021-13-3-208-224
Nagahama N., Gastaldi B., Clifford M.N., Manifesto M.M., Fortunato R.H. The influence of environmental variations on the phenolic compound profiles and antioxidant activity of two medicinal Patagonian valerians (Valeriana carnosa Sm. and V. clarionifolia Phil.) // AIMS Agricul. Food. 2021. V. 6. P. 106. https://doi.org/10.3934/agrfood.2021007
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


