Физиология растений, 2022, T. 69, № 5, стр. 551-560
Особенности адаптации пшеницы к морозу при низкотемпературных воздействиях разной интенсивности
Ю. В. Венжик a, *, В. В. Таланова b, А. А. Игнатенко b, Н. С. Репкина b, Е. С. Холопцева b, А. Ф. Титов b
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
b Институт биологии – обособленное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Карельский научный центр
Российской академии наук”
Петрозаводск, Россия
* E-mail: jul.venzhik@gmail.com
Поступила в редакцию 29.11.2021
После доработки 15.12.2021
Принята к публикации 16.12.2021
- EDN: CMNORY
- DOI: 10.31857/S0015330322040170
Аннотация
Представлены данные об особенностях адаптации озимой пшеницы (Triticum aestivum L., сорт Московская 39) к морозу в результате действия низких закаливающих температур разной интенсивности. Проведен сравнительный анализ динамики показателей, характеризующих морозоустойчивость, рост, скорость транспирации, интенсивность окислительных процессов, состояние фотосинтетического аппарата, структуру клеток листьев и уровень транскриптов гена WCOR15 (кодирующего белок холодового ответа) в процессе закаливания растений пшеницы при температуре 12, 8 и 4°С. Показано, что при холодовой адаптации происходит “перепрограммирование” растительного организма, степень и глубина которого определяются интенсивностью низкотемпературного воздействия: чем ближе закаливающая температура к повреждающим значениям, тем более быстрые и значительные адаптивные изменения она вызывает, и тем бóльшую морозоустойчивость способны развивать растения в процессе закаливания.
ВВЕДЕНИЕ
Холодостойкие и морозостойкие растения, в частности, озимые злаки, в процессе низкотемпературной адаптации переживают своеобразное “перепрограммирование” своей жизнедеятельности, которое затрагивает все уровни организации – от молекулярного до клеточного, тканевого и организменного [1–3]. Оно включает в себя широкий спектр структурных, функциональных и физиолого-биохимических изменений [1]. При этом на фоне происходящего снижения интенсивности основных физиологических процессов – роста, дыхания, фотосинтеза, водного обмена [4–6] – полностью изменяется метаболизм растений [1], “включаются” гены холодового ответа [6–8], в клетках и тканях накапливаются белки, углеводы и аминокислоты, необходимые для холодовой адаптации [5, 9, 10]. Вследствие этих событий существенно изменяются биохимический состав и свойства мембран, увеличивается число некоторых органелл, формируются хлоропласты “светового” типа, обеспечивающие работу фотосинтетического аппарата (ФСА) в условиях охлаждения [11, 12]. В этих хлоропластах накапливаются белки COR15, выполняющие криопротекторную функцию по отношению к мембранам, кроме того, в клетках активизируется работа антиоксидантной системы (АОС) и др. [5, 7].
В многочисленных работах, посвященных изучению процесса холодовой адаптации, чаще всего используется одна конкретная температура, которая, по мнению авторов, оказывает на растения максимальный закаливающий эффект. Однако для расширения представлений об особенностях адаптации растений важно исследовать их реакцию на низкотемпературные закаливающие воздействия разной интенсивности. Такие исследования могут раскрыть зависимость между интенсивностью проявления адаптивных изменений и уровнем морозоустойчивости, формируемой в процессе закаливания растений при разных температурах. Исходя из этого, цель настоящей работы заключалась в изучении комплекса адаптивных изменений, происходящих в клетках и тканях проростков озимой пшеницы при холодовом закаливании, начиная с первых часов и до 7 суток их нахождения в условиях действия температур 12, 8 и 4°С.
МАТЕРИАЛ И МЕТОДЫ
В качестве объекта исследования использовали проростки озимой пшеницы (Triticum aestivum L.) сорта Московская 39, выращенные в рулонах фильтровальной бумаги на модифицированном питательном растворе Кнопа в камере искусственного климата при температуре воздуха 22°С, относительной влажности 60–70%, освещенности ФАР 180 мкмоль/(м2 с) и 14-часовом фотопериоде. По достижении 7-дневного возраста растения разделяли на три группы и в течение 7 сут подвергали воздействию низких закаливающих температур 12, 8 и 4°С, сохраняя прочие условия неизменными. В качестве контроля использовали 7-дневные проростки, выращенные при 22°С.
О морозоустойчивости проростков пшеницы судили по температуре (ЛТ50), вызывающей гибель 50% палисадных клеток паренхимы листовых высечек после их 5-минутного промораживания в термоэлектрическом микрохолодильнике ТЖР-02/-20 (Интерм, Россия) при последовательном снижении температуры с интервалом 0.4°С [13]. Жизнеспособность клеток определяли с помощью светового микроскопа МИКМЕД-2 (ЛОМО, Россия) с объективом 40× по деструкции хлоропластов и коагуляции цитоплазмы.
Рост растений оценивали по накоплению сырой и сухой биомассы листьев. Для анализа брали по 5 листьев в каждом варианте опыта, опыт повторяли трижды. Сухую массу рассчитывали в процентах от сырого веса после высушивания образцов при 100°С до постоянного веса. Интенсивность транспирации и видимого фотосинтеза изучали с помощью портативной фотосинтетической системы НСМ-1000 (Walz, Германия). Уровень окислительного стресса определяли по содержанию в листьях МДА, как одного из конечных продуктов перекисного окисления липидов (ПОЛ) [14]. Содержание фотосинтетических пигментов анализировали с помощью спектрофотометра СФ-2000 (ОКБ Спектр, Россия) в спиртовой вытяжке [15]. Определение доли хлорофиллов в светособирающем комплексе (ССК) проводили с учетом того, что весь хлорофилл b находится в ССК, а отношение хлорофилла a/b в ССК равно 1.2 [16]. Размеры клеток мезофилла и количество хлоропластов в них определяли на фотоснимках ультратонких срезов листа, полученных по стандартной процедуре [17, 18]. Уровень транскриптов гена WCOR15 измеряли методом ОТ-ПЦР в режиме реального времени, как описано нами ранее [19, 20].
Все измерения проводили на первом листе проростков пшеницы. Повторность при оценке устойчивости и указанных выше физиолого-биохимических показателей в пределах одного варианта опыта 3–6-кратная. Каждый опыт повторяли не менее 3 раз. Структурные показатели изучали на 50 снимках для каждого варианта опыта. В таблицах и на графиках приведены средние арифметические значения и их стандартные ошибки. В статье обсуждаются величины, статистически значимые при Р < 0.05.
РЕЗУЛЬТАТЫ
Морозоустойчивость
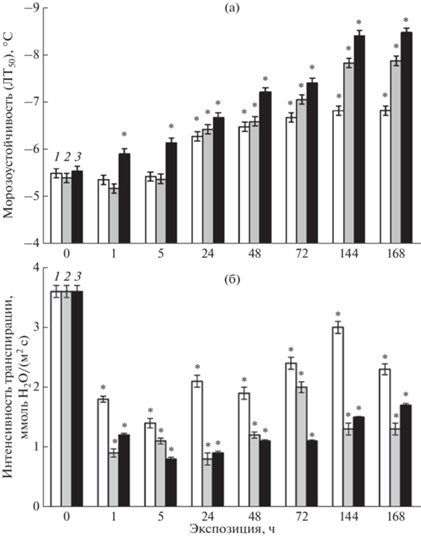
Как показали результаты опытов, морозоустойчивость проростков пшеницы существенно возрастала под влиянием температур 12, 8 и 4°С (рис. 1а). При этом в динамике этого процесса для каждого из низкотемпературных воздействий отмечены свои особенности. Так, при 4°С морозоустойчивость проростков резко повышалась уже в первые часы действия температуры и продолжала быстро нарастать в течение опыта, достигая к его окончанию 155% от исходного уровня (рис. 1а). При температуре 12 и 8°С морозоустойчивость проростков возрастала только к концу первых суток закаливания, далее она продолжала увеличиваться, но при 8°С быстрее, чем при 12°С (рис. 1а). Наибольший уровень морозоустойчивости проростков пшеницы наблюдали на 7 сут закаливания при 8°С, который составил 144%, а при 12°С – 123% от исходного.
Рост
Анализ результатов показал, что накопление сырой биомассы листьев пшеницы продолжалось в процессе закаливания и при 12, и при 8°С, но почти полностью прекращалось при 4°С, возобновляясь лишь на 6–7 сут опыта (табл. 1). Величина прироста сырой биомассы листьев зависела от интенсивности температурного воздействия и была тем выше, чем ближе температура к оптимальной (табл. 1). Накопление же сухой биомассы листьев активно продолжалось во всех вариантах опыта (табл. 1), при этом отношение сухой биомассы листьев к сырой увеличивалось только в процессе закаливания при 4°С (табл. 2 ).
Таблица 1.
Сырая и сухая биомасса листьев пшеницы после холодовой адаптации при 12, 8 и 4°С
| Экспозиция, ч | Сырая биомасса, мг | Сухая биомасса, мг | ||||
|---|---|---|---|---|---|---|
| 12°С | 8°С | 4°С | 12°С | 8°С | 4°С | |
| 0 | 107 ± 3 | 107 ± 3 | 107 ± 3 | 11 ± 0.3 | 11 ± 0.3 | 11 ± 0.3 |
| 24 | 127 ± 5* | 127 ± 5* | 109 ± 3 | 14 ± 0.2* | 14 ± 0.4* | 13 ± 0.4* |
| 48 | 134 ± 5* | 133 ± 5* | 111 ± 6 | 14 ± 0.2* | 14 ± 0.4* | 13 ± 0.4* |
| 72 | 161 ± 1* | 138 ± 1* | 112 ± 2 | 17 ± 0.1* | 16 ± 0.1* | 16 ± 0.4* |
| 144 | 152 ± 4* | 155 ± 1* | 114 ± 2 | 17 ± 0.1* | 19 ± 0.1* | 16 ± 0.5* |
| 168 | 180 ± 5* | 157 ± 3* | 120 ± 3* | 21 ± 0.3* | 19 ± 0.2* | 18 ± 0.4* |
Интенсивность транспирации
Интенсивность транспирации пшеницы резко снижалась уже через 1 ч охлаждения независимо от закаливающей температуры (рис. 1б). В дальнейшем транспирация несколько стабилизировалась и к концу опыта составляла около 40% от исходной у растений, закаленных при 4 и 8°С, и примерно 60% у растений, закаленных при 12°С.
Перекисное окисление липидов
Низкие закаливающие температуры (12, 8 и 4°С) вызывали увеличение содержания МДА в листьях пшеницы, но только через 48 ч воздействия (рис. 2а). Более того, этот показатель достигал максимального уровня через 3 сут охлаждения, затем снижался и к концу опыта оставался повышенным только у растений, закаленных при 4°С (рис. 2а).
Фотосинтетический аппарат
Интенсивность фотосинтеза пшеницы значительно снижалась уже в первые часы действия температур 8 и 4°С (рис. 2б). В дальнейшем, при 8°С процесс фотосинтеза стабилизировался на уровне 70% от исходного, а при 4°С до конца опыта оставался на стабильно низком уровне (рис. 2б). Температура 12°С практически не влияла на интенсивность фотосинтеза (рис. 2б).
Таблица 2.
Отношение сухая/сырая биомасса листьев пшеницы после холодовой адаптации при 12, 8 и 4°С
| Экспозиция, ч | 12°С | 8°С | 4°С |
|---|---|---|---|
| 0 | 0.11 | 0.11 | 0.11 |
| 24 | 0.10 | 0.11 | 0.12 |
| 48 | 0.10 | 0.11 | 0.13 |
| 72 | 0.10 | 0.11 | 0.14 |
| 144 | 0.11 | 0.12 | 0.15 |
| 168 | 0.11 | 0.12 | 0.15 |
Суммарное содержание хлорофиллов в листьях пшеницы под влиянием температуры 12°С увеличивалось на 23% в течение первых суток действия холода, оставаясь в дальнейшем на достигнутом уровне (рис. 3а). При 8°С этот показатель возрастал только в первые 3 сут закаливания, а затем снижался до исходных значений (рис. 3а). В процессе закаливания при 4°С содержание хлорофиллов начинало снижаться через 48 ч от начала охлаждения и к концу опыта этот показатель был на уровне 77% от исходного (рис. 3а). Доля хлорофилла в ССК увеличивалась только при 12°С, а при 8 и 4°С оставалась примерно одинаковой (табл. 3).
Рис. 3.
Содержание хлорофиллов a и b (а) и каротиноидов (б) в листьях пшеницы в процессе холодовой адаптации при 12°С (1), 8°С (2) и 4°С (3). Звездочкой обозначены отличия от исходного уровня, статистически значимые при P < 0.05.

Таблица 3.
Доля хлорофиллов в ССК и соотношение фотосинтетических пигментов в листьях пшеницы после холодовой адаптации при 12, 8 и 4°С
| Экспозиция, ч | Доля хлорофиллов в ССК, % от суммы хлорофиллов (a + b) |
Каротиноиды/хлорофиллы a + b | ||||
|---|---|---|---|---|---|---|
| 12°С | 8°С | 4°С | 12°С | 8°С | 4°С | |
| 0 | 58 | 58 | 58 | 0.13 | 0.13 | 0.13 |
| 1 | 58 | 61 | 54 | 0.13 | 0.13 | 0.14 |
| 5 | 61 | 59 | 57 | 0.13 | 0.14 | 0.14 |
| 24 | 60 | 63 | 55 | 0.12 | 0.13 | 0.17 |
| 48 | 59 | 57 | 57 | 0.12 | 0.15 | 0.17 |
| 72 | 63 | 59 | 55 | 0.12 | 0.14 | 0.19 |
| 144 | 65 | 60 | 57 | 0.13 | 0.15 | 0.21 |
| 168 | 67 | 60 | 62 | 0.12 | 0.15 | 0.21 |
Кроме того, увеличение содержания каротиноидов в листьях пшеницы происходило при всех изученных температурах, но при 4°С этот процесс начинался уже через 1 ч от начала опыта и был наиболее интенсивным (рис. 3б). Соотношение каротиноидов и хлорофиллов возрастало при 8 и 4°С, но почти не изменялось при 12°С (табл. 3).
Во всех вариантах опыта зафиксировано увеличение размеров клеток мезофилла, а также снижение отношения длинной оси клетки к короткой, то есть некоторое “округление” клеток под влиянием холода (табл. 4). Увеличение числа хлоропластов в клетках мезофилла происходило только при 4°С (табл. 4).
Таблица 4.
Некоторые структурные параметры клеток мезофилла пшеницы после холодовой адаптации при 12, 8 и 4°С
| Экспозиция, ч | Площадь клетки, мкм2 | L/W | Число хлоропластов в клетке, шт. |
|---|---|---|---|
| 12°C | |||
| 0 | 324.6 ± 9.7 | 1.9 | 10 ± 0.1 |
| 24 | 335.7 ± 13.2 | 2.0 | 10 ± 0.1 |
| 72 | 411.3 ± 12.4* | 1.6 | 10 ± 0.1 |
| 168 | 436.6 ± 20.4* | 1.8 | 11 ± 0.1 |
| 8°C | |||
| 24 | 342.8 ± 10.1 | 1.8 | 10 ± 0.1 |
| 72 | 471.4 ± 15.5* | 1.6 | 10 ± 0.1 |
| 168 | 440.8 ± 9.1* | 1.6 | 11 ± 0.1 |
| 4°C | |||
| 24 | 367.3 ± 21.7 | 1.6 | 10 ± 0.3 |
| 72 | 505.9 ± 11.4* | 1.5 | 13 ± 0.3* |
| 168 | 462.1 ± 9.7* | 1.5 | 12 ± 0.2* |
Уровень транскриптов гена WCOR15
Под влиянием всех трех низких закаливающих температур уже в первые часы происходило увеличение уровня транскриптов гена WCOR15 (рис. 4). Причем повышение экспрессии гена WCOR15 наблюдалось через 1 ч от начала действия температуры 4 и 8°С, а при 12°С накопление транскриптов указанного гена отмечено через 5 ч. На 7 сут эксперимента температура 4°С вызывала наибольший, а 12°С – наименьший прирост содержания транскриптов гена WCOR15 по отношению к исходному уровню.
ОБСУЖДЕНИЕ
При выборе интенсивности закаливающих воздействий мы опирались на ранее полученные данные о зональном влиянии температуры на растения [13]. Согласно им, озимая пшеница, которая относится к морозостойким культурам, способна выдерживать без повреждений даже действие температур близких к 0°С. Зона низких закаливающих температур, вызывающих увеличение ее морозоустойчивости, находится в диапазоне от 0 до 14°С [13]. Температуры ниже 0°С относятся к повреждающим, под их влиянием в клетках растений появляются необратимые повреждения. Температура в диапазоне от 14 до 28°С является для пшеницы “фоновой” (физиологически нормальной). При этих температурах осуществляется нормальный рост и развитие растений, а колебания температуры в этом диапазоне не влекут за собой изменение их холодоустойчивости [13]. В данной работе мы использовали три температуры из зоны холодового закаливания растений: температура 12°С близка к фоновой зоне, температура 4°С близка к границе с зоной повреждения, а температура 8°С занимает некоторое промежуточное положение между ними. Для исследования были отобраны показатели, важные для формирования повышенной морозоустойчивости и затрагивающие разные стороны многокомпонентного процесса адаптации – рост, водный обмен, активность ФСА, структура клеток мезофилла, уровень окислительного стресса и экспрессия одного из генов холодового ответа.
В результате исследования установлено, что температуры 12, 8 и 4°С вызывают существенное увеличение морозоустойчивости пшеницы, причем этот процесс сопровождается целым рядом изменений, скорость, особенности динамики и степень проявления которых зависят от интенсивности температурного воздействия. С учетом этого важного обстоятельства интересно, на наш взгляд, обсудить, во-первых, изменения, происходящие в растительном организме на начальном этапе холодового закаливания при 12, 8 и 4°С, а во-вторых, изменения, происходящие в растениях на заключительном этапе холодового закаливания под воздействием указанных температур.
Анализ результатов воздействия изученных температур на физиологические процессы в растениях озимой пшеницы на начальном этапе закаливания позволил установить, что под влиянием температуры 4°С уже в течение первых 24 ч от начала ее действия происходит торможение роста (табл. 1), уменьшается интенсивность транспирации (рис. 1б) и фотосинтеза (рис. 2б), увеличивается содержание каротиноидов в листьях (рис. 3б) и площадь клеток мезофилла (табл. 4), снижается отношение длинной оси клетки к короткой, возрастает число хлоропластов в клетках мезофилла (табл. 4) и уровень транскриптов гена WCOR15 (рис. 4). Все эти изменения, затрагивающие разные стороны жизнедеятельности растений, сопровождались ростом их морозоустойчивости (рис. 1а). На основании этих данных можно утверждать, что уже в первые часы воздействия температуры 4°С запускается каскад реакций, обеспечивающих “перепрограммирование” жизнедеятельности проростков озимой пшеницы.
В отличие от этого, температуры 12 и 8°С вызывали увеличение морозоустойчивости проростков только к концу первых суток своего действия (рис. 1а), но и они инициировали определенные изменения в растительном организме. Так, при температуре 12°С у проростков уже в течение 24 ч снижалась интенсивность транспирации (рис. 1б) и возрастал уровень транскриптов гена WCOR15 (рис. 4). При 8°С к этим изменениям добавились уменьшение интенсивности фотосинтеза (рис. 2б), увеличение площади клеток мезофилла и снижение отношения длинной оси клетки к короткой (табл. 4).
Таким образом, температура 12°С (близкая к фоновым) вызывала наименьшие изменения в проростках озимой пшеницы на начальном этапе холодового закаливания, тогда как температура 4°С (близкая к повреждающим) – наибольшие, а температура 8°С – занимала в этом плане промежуточное положение. Отметим, что самые чувствительные из изученных нами показателей – интенсивность транспирации и уровень транскриптов гена WCOR15 – реагировали на понижение температуры уже в течение первого часа независимо от интенсивности холодового воздействия на растения.
Для оценки степени проявления адаптивных изменений в период максимально развиваемой морозоустойчивости у растений пшеницы, закаливаемых при 12, 8 и 4°С, мы проанализировали заключительный этап (6–7 сут.) их холодовой адаптации. Сопоставление изученных параметров показало, что по мере снижения температуры от 12 к 4°С возрастает величина максимально достигаемого в результате закаливания уровня морозоустойчивости (табл. 5). Сходная картина наблюдалась и в отношении степени проявления других показателей: чем ближе была температура к зоне повреждения и дальше от оптимальных значений, тем более выражены были изменения в растительном организме (табл. 5). Так, у проростков пшеницы, закаленных при 12°С, на заключительном этапе закаливания была снижена транспирация листьев (табл. 5), увеличен уровень транскрипции гена WCOR15 (рис. 4) и размеры клеток мезофилла (табл. 5). Температура 8°С, кроме перечисленных выше изменений, вызывала у них некоторое торможение роста, а также интенсивности фотосинтеза (табл. 5). Под влиянием температуры 4°С у проростков пшеницы формировался максимальный уровень морозоустойчивости и была наиболее ярко выражена степень проявления указанных изменений (табл. 5). К отмеченным выше изменениям добавились увеличение содержания МДА и каротиноидов в листьях, а также рост числа хлоропластов в клетках мезофилла (табл. 5).
Таблица 5.
Количественная оценка изменения морозоустойчивости и некоторых структурных и физиолого-биохимических показателей на 7 сутки холодовой адаптации проростков пшеницы (% от контроля)
| Показатель | Температура закаливания | ||
|---|---|---|---|
| 12°С | 8°С | 4°С | |
| Морозоустойчивость | 123 | 144 | 155 |
| Сырая масса листьев | 168 | 146 | 112 |
| Сухая масса листьев | 184 | 166 | 158 |
| Сухая/сырая биомасса листьев | 100 | 109 | 136 |
| Интенсивность транспирации | 60 | 39 | 40 |
| Содержание МДА | 106 | 134 | 163 |
| Интенсивность фотосинтеза | 95 | 72 | 30 |
| Содержание хлорофиллов (a + b) | 123 | 95 | 77 |
| Содержание каротиноидов | 117 | 113 | 126 |
| Каротиноиды/хлорофиллы a + b | 92 | 125 | 175 |
| Площадь клеток мезофилла | 134 | 136 | 142 |
| Длинная/короткая ось клетки | 95 | 84 | 79 |
| Число хлоропластов в клетке | 110 | 110 | 120 |
Отдельно следует остановиться на анализе характера изменений, наблюдаемых в процессе холодового закаливания. Из полученных данных следует, что у растений пшеницы под влиянием низких закаливающих температур снижаются интенсивность накопления сырой биомассы листьев (показатель роста), транспирации (показатель водного баланса) и фотосинтеза, но растет содержание в клетках МДА, т.е. увеличивается интенсивность окислительных процессов (рис. 1 б; рис. 2; табл. 1; табл. 2 ). С одной стороны, перечисленные изменения могут быть прямым следствием негативного воздействия холода на растения. С другой стороны, закрытие устьиц и снижение транспирации, как первая реакция на холод, необходимы для предотвращения дегидратации тканей в условиях охлаждения. Однако в результате этого уменьшаются доступность СО2 и фиксация углерода в цикле Кальвина [9, 10, 21], что, в свою очередь, вызывает усиление генерации активных форм кислорода (АФК) [9, 21]. Избыточное накопление АФК приводит к интенсификации процессов ПОЛ, повреждению белков и нуклеиновых кислот, уменьшению активности ферментов, нарушению структуры мембран и органелл [21, 22]. Но вместе с тем, АФК являются важным сигнальным звеном в цепи адаптивных реакций растительной клетки на стрессовые воздействия [23, 24]. В частности, они участвуют в регуляции ростовых процессов, движения устьиц, светоиндуцированного передвижения хлоропластов и др. [25, 26]. Более того, накопление АФК и продуктов ПОЛ в клетках растений вызывает активацию работы АОС [21, 22, 27]. Добавим, что АФК выступают в роли одного из индукторов ICE-CBF/DREB1 ((ICE)-C-Repeat Binding Factor/Dehydration Responsive Element Binding Factor1) сигнального пути холодовой адаптации растений [4, 6, 21].
Подчеркнем, что для выживания в условиях действия холода растениям крайне необходима способность быстро реагировать на понижение температуры, своевременно перестраивая метаболизм, меняя скорость и направленность биохимических реакций [4, 5, 7, 10, 27]. При этом скорость основных физиологических процессов замедляется, но по своей сути, это – защитная реакция, направленная на уменьшение затрат энергии и пластических веществ [9, 10, 28]. В первую очередь низкие температуры тормозят рост растений и деление клеток [4]. Поддержание стабильной фотосинтетической активности на фоне торможения роста позволяет холодостойким растениям накапливать углеводы, выполняющие различные функции, в том числе криопротекторную и антиоксидантную [1, 2, 10]. Одновременно с этим в хлоропластах происходит гидролиз крахмала до моносахаров [10], а также активизируется синтез осмолитов – моносахаров и аминокислот [6, 7, 9, 22]. Накапливаясь в цитоплазме и строме пластид, осмолиты не только предотвращают дегидратацию тканей, но и выступают в качестве снижающих температуру замерзания криопротекторов, защищают клеточные структуры от окислительного стресса, а также являются “энергетическим запасом”, необходимым для энергоемкого процесса адаптации [10, 14, 21]. Кроме того, для осуществления быстрой адаптации растений к холоду запускается синтез de novo стрессовых (шоковых) белков, в том числе дегидринов, связывающих воду и предотвращающих ее потери в условиях действия холода [6, 7]. Отмеченное в наших опытах увеличение сухой биомассы листьев (табл. 1; табл. 2) может свидетельствовать о накоплении определенных метаболитов в тканях [22], а увеличение уровня транскриптов гена WCOR15 (рис. 4) – о запуске синтеза de novo белков холодового ответа. Отметим, что белок COR 15, синтез которого контролируется этим геном, накапливается в строме хлоропластов и участвует в защите фотосинтетических мембран от дегидратации [22, 28].
Стабильность работы ФСА в условиях охлаждения является важным звеном в цепи адаптивных реакций растений [2, 9]. В наших опытах о стабильности ФСА пшеницы свидетельствуют данные о стабильном содержании хлорофиллов в ССК и повышенном отношении каротиноиды/хлорофиллы (табл. 3). Последний показатель свидетельствует о преобладании доли каротиноидов в листьях пшеницы, которые не только выполняют светособирающую функцию, но и защищают хлорофиллы и липиды мембран от фотодеструкции, участвуя в рассеивании тепловой энергии, избыточной в условиях охлаждения [29].
Важно также отметить, что адаптация ФСА пшеницы к холоду реализуется и на структурном уровне. В наших опытах показано, что под влиянием низких температур увеличиваются размеры клеток мезофилла и число хлоропластов в них (табл. 4). Эта типичная “структурная реакция” на холод связана с тем, что при охлаждении наряду с замедлением деления клеток происходит их растяжение и увеличение объема цитоплазмы вследствие выхода воды из вакуоли, а также интенсивного накопления в цитоплазме белков, моносахаров и других осмолитов [11, 12, 30]. В результате снижается отношение длинной оси клетки к короткой, то есть наблюдается своеобразное “округление” клеток (табл. 4). При этом стимулируется образование новых хлоропластов, и многие холодостойкие растения используют подобную “количественную стратегию” для поддержания фотосинтетической активности в условиях холода [11, 12].
Таким образом, проведенные нами исследования позволили установить, что формирование повышенной морозоустойчивости пшеницы происходит под влиянием любых закаливающих температур, независимо от их интенсивности. Причем этот процесс сопровождается “перепрограммированием” растительного организма, степень и глубина которого определяются интенсивностью низкотемпературного воздействия. Поэтому чем сильнее температура отклоняется от оптимальных (фоновых) значений и чем ближе она к зоне повреждающих температур, тем быстрее происходят и ярче проявляются адаптивные изменения в растительном организме, и соответственно, более высокую морозоустойчивость развивают растения.
Исследования выполнены на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”. Работа выполнена в рамках государственных заданий Министерства науки и высшего образования Российской Федерации (темы № FMEN-2022-0004 и 121040800153-1).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Hurry V. Metabolic reprogramming in response to cold stress is like real estate, it’s all about location // Plant Cell Environ. 2017. V. 40. P. 599. https://doi.org/10.1111/pce.12923
Herrmann H.A., Schwartz J.-M., Johnson G.N. Metabolic acclimation – a key to enhancing photosynthesis in changing environments? // J. Exp. Bot. 2019. V. 70. P. 3043. https://doi.org/10.1093/jxb/erz157
Chang C.Y.Y., Bräutigam K., Hüner N.P.A., Ensminger I. Champions of winter survival: cold acclimation and molecular regulation of cold hardiness in evergreen conifers // New Phytol. 2021. V. 229. P. 675. https://doi.org/10.1111/nph.16904
John R., Anjum N.A., Sopory S.K., Akram N.A., Ashraf M. Some key physiological and molecular processes of cold acclimation // Biol. Plant. 2016. V. 60. P. 603. https://doi.org/10.1007/s10535-016-0648-9
Rihan H.Z., Al-Issawi M., Fuller M.P. Advances in physiological and molecular aspects of plant cold tolerance // J. Plant Interact. 2017. V. 12. P. 143. https://doi.org/10.1080/17429145.2017.1308568
Ding Y., Shi Y., Yang S. Advances and challenges in uncovering cold tolerance regulatory mechanisms in plants // New Phytol. 2019. V. 222. P. 1690. https://doi.org/10.1111/nph.15696
Chen L.-J., Xiang H.-Z., Miao Y., Zhang L., Guo Z.-F., Zhao X.-H., Lin J.-W., Li T.-L. An overview of cold resistance in plants // J. Agr. Crop. Sci. 2014. V. 200. P. 237. https://doi.org/10.1111/jac.12082
Ritonga F.N., Chen S. Physiological and molecular mechanism involved in cold stress tolerance in plants // Plants. 2020. V. 9. P. 560. https://doi.org/10.3390/plants9050560
Ensminger I., Busch F., Huner N. Photostasis and cold acclimation: sensing low temperature through photosynthesis // Physiol. Plant. 2006. V. 126. P. 28. https://doi.org/10.1111/j.1399-3054.2006.00627.x
Fürtauer L., Weiszmann J., Weckwerth W., Nägele Th. Dynamics of plant metabolism during cold acclimation // Int. J. Mol. Sci. 2019. V. 20. P. 5411. https://doi.org/10.3390/ijms20215411
Kratsch H.A., Wise R.R. The ultrastructure of chilling stress // Plant Cell Environ. 2002. V. 23. P. 337. https://doi.org/10.1046/j.1365-3040.2000.00560.x
Venzhik Yu.V., Shchyogolev S.Yu., Dykman L.A. Ultrastructural reorganization of chloroplasts during plant adaptation to abiotic stress factors // Russ. J. Plant Phys. 2019. V. 66. P. 850. https://doi.org/10.1134/S102144371906013X
Титов А.Ф., Акимова Т.В., Таланова В.В., Топчиева Л.В. Устойчивость растений в начальный период действия неблагоприятных температур. Москва: Наука, 2006. 143 с.
Heath R.L., Packer L. Photoperoxidation in isolated chloroplasts. I. Kinetics and stoichiometry of fatty acid peroxidation // Arch. Biochem. Biophys. 1968. V. 125. P. 189. https://doi.org/10.1016/0003-9861(68)90654-1
Lichtenthaler H.K. Chlorophylls and carotenoids – pigments of photosynthetic biomembranes // Methods Enzymol. 1987. V. 148. P. 350. https://doi.org/10.1016/0076-6879(87)48036-1
Lichtenthaler H.K., Wellburn A.L. Determination of total carotenoides and chlorophylls a and b of leaf exacts in different solvents // Biochem. Soc. Trans. 1983. V. 11. P. 591.
Venzhik Yu.V., Titov A.F., Talanova V.V., Miroslavov E.A., Koteeva N.K. Structural and functional reorganization of the photosynthetic apparatus in adaptation to cold of wheat plants // Cell Tissue Biol. 2013. V. 7. P. 168.
Venzhik Yu.V., Talanova V.V., Titov A.F. The effect of abscisic acid on cold tolerance and chloroplasts ultrastructure in wheat under optimal and cold stress conditions // Acta Physiol. Plant. 2016. V. 38. P. 63. https://doi.org/10.1007/s11738-016-2082-1
Talanova V.V., Titov A.F., Topchieva L.V., Malysheva I.E., Venzhik Yu.V., Frolova S.A. Expression of WRKY transcription factor and stress protein genes in wheat plants during cold hardening and ABA treatment // Russ. J. Plant Physiol. 2009. V. 56. P. 702. https://doi.org/10.1134/S1021443709050173
Таланова В.В., Титов А.Ф., Топчиева Л.В., Венжик Ю.В. Особенности экспрессии температурорегулируемых генов у растений озимой и яровой пшеницы при холодовой адаптации // Доклады Российской академии сельскохозяйственных наук. 2011. № 3. С. 3.
Theocharis A., Clement Ch., Barka E.A. Physiological and molecular changes in plants grown at low temperature // Planta. 2012. V. 235. P. 1091. https://doi.org/10.1007/s00425-012-1641-y
Crosatti C., Rizza F., Badeck F.W., Mazzucotelli E., Cattivelli L. Harden the chloroplast to protect the plant // Physiol. Plant. 2013. V. 147. P. 55. https://doi.org/10.1111/j.1399-3054.2012.01689.x
Foyer C.H., Noctor G. Redox regulation in photosynthetic organisms: signaling, acclimation, and practical implications // Antioxid. Redox Signal. 2009. V. 11. P. 861. https://doi.org/10.1089/ars.2008.2177
Kolupaev Yu.E, Karpets Yu.V., Kabashnikova L.F. Antioxidative system of plants: cellular compartmentalization, protective and signaling functions, mechanisms of regulation (review) // Appl. Biochem. Microbiol. 2019. V. 55. P. 441. https://doi.org/10.1134/S0003683819050089
Swanson S., Gilroy S. ROS in plant development // Physiol. Plant. 2010. V. 138. P. 384. https://doi.org/10.1111/j.1399-3054.2009.01313.x
Kreslavski V.D., Los D.A., Allakhverdiev S.I., Kuznetsov Vl.V. Signaling role of reactive oxygen species in plants under stress // Russ. J. Plant Physiol. 2012. V. 59. P. 141. https://doi.org/10.1134/S1021443712020057
Arora K. Mechanism of freeze-thaw injury and recovery: a cool retrospective and warming up to new ideas // Plant Sci. 2018. V. 270. P. 301 https://doi.org/10.1016/j.plantsci.2018.03.002
Bychkov I.A., Kudryakova N.V., Kuznetsov Vl.V., Kusnetsov V.V. Cold stress activates the expression of genes of the chloroplast transcription apparatus in Arabidopsis thaliana plants // Dokl. Biochem. Biophys. 2020. V. 494. P. 235. https://doi.org/10.1134/S160767292005004X
Swapnil P., Meena M., Singh S.K., Dhuldhaj U.P., Harish, Marwal A. Vital roles of carotenoids in plants and humans to deteriorate stress with its structure, biosynthesis, metabolic engineering and functional aspects // Curr. Plant Biol. 2021. V. 26. P. 100203. https://doi.org/10.1016/j.cpb.2021.100203
Strand A., Hurry V., Henkes S., Huner N., Gustafsson P., Gardeström P., Stitt M. Acclimation of Arabidopsis leaves developing at low temperatures. Increasing cytoplasmic volume accompanies increased activities of enzymes in the Calvin cycle and in the sucrose-biosynthesis pathway // Plant Physiol. 1999. V. 119. P. 1387. https://doi.org/10.1104/pp.119.4.1387
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений