Журнал физической химии, 2020, T. 94, № 9, стр. 1297-1302
Термическая стабильность Nd1 – хАхMnO3 (х = 0; 0.15) (А = Ba, Sr)
Л. Б. Ведмидь a, b, *, О. М. Федорова a
a Российская академия наук, Институт металлургии
Екатеринбург, Россия
b Уральский федеральный университет
Екатеринбург, Россия
* E-mail: elarisa100@mail.ru
Поступила в редакцию 14.11.2019
После доработки 14.11.2019
Принята к публикации 21.01.2020
Аннотация
Рассмотрено влияние частичного замещения неодима барием или стронцием на термические свойства манганитов Nd0.85А0.15MnO3 (А = Ba, Sr). Изучены температурные особенности трансформации их кристаллической структуры под воздействием различного давления кислорода газовой атмосферы. Определена последовательность фазовых превращений при термической диссоциации соединений в условиях пониженного давления кислорода, их термодинамические характеристики и значения изменения стандартных энтальпии и энтропии образования соединений из элементов. Установлено, что замена части неодима на барий или стронций оказывает влияние на термодинамическое состояние системы Nd–Mn–O.
Манганиты со структурой перовскита типа Ln1 – xАxMnO3 ± δ (Ln3+ = ион лантаноида, А2+ = = щелочноземельный ион) обладают специфичной природой взаимосвязи магнитных и электрических состояний, обусловливающей комплекс их физико-химических свойств [1–4]. Представители базовых соединений семейства LnMnO3 к настоящему времени исследованы достаточно детально. Также, обширный круг работ посвящен изучению влияния замещения в подрешетке лантаноида, поскольку свойства таких соединений зависят как от типа редкоземельного иона, так и от типа и концентрации замещающего его иона А [5–15]. Различие ионных радиусов лантаноида и допанта (Ba, Sr) оказывает влияние на формирование ян-теллеровского искажения в этих манганитах [16]. Замещение приводит к появлению ионов Mn4+, согласно модели двойного обмена Зенера [17] происходит одновременный переход электрона по связи Mn3+ → O2– → Mn4+, изменяется электрон-фононное состояние, связанное с эффектом Яна-Теллера [18]. При замещении иона Ln на ион А образуются твердые растворы Ln1 – xАxMnO3 ± δ, пределы замещения в которых определяются и типом допанта и изменением условий синтеза [19]. В твердых растворах Ln1 ‒ xАxMnO3 ± δ (Ba, Sr) на воздухе при температуре 1100°С концентрационный интервал допанта ограничен пределами 0 ≤ х ≤ 0.3 [19], но может быть расширен до x ≤ 0.5 при повышении температуры и понижении давления кислорода. Дальнейшее понижение давления кислорода приводит к образованию фаз гомологического семейства Руддлесдена–Поппера Lnn + 1MnnO3n + 1 для Sr-содержащих систем, либо двойных перовскитов LnBaMn2O5 + δ для Ba-содержащих систем [19]. Изучению фазовых равновесий отдельных составов Ln1 – xMMnO3 ± δ посвящен ряд работ [6–9, 19–21], но комплексного исследования эволюции фазовых равновесий при изменении температуры и давления кислорода для различных типов допанта не проводилось. Данная работа посвящена изучению особенностей фазовых превращений и окислительно-восстановительных процессов в соединениях Nd0.85А0.15MnO3 (А = Ba, Sr) при изменении внешних условий – температуры и давления кислорода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединений Nd1 – хАхMnO3 (х = 0, 0.15) (А = Ba, Sr) осуществлен по керамической технологии из оксидов Nd2O3 марки НдО-Е, Mn2O3, BaCO3 и SrCO3 квалификации “ос.ч.”, при температуре 1400°C (х = 0) и 1250°C (х = 0.15) в течение 70 ч на воздухе с последующим охлаждением с печью. Фазовый состав исходных образцов и продуктов их диссоциации исследовали на дифрактометре XRD-7000 (Shimadzu), в CuKα-излучении в диапазоне углов 20°–70° по 2θ с шагом 0.03° и выдержкой в точке 2 с. Высокотемпературные рентгеновские исследования проведены с помощью приставки НА-1001 (Shimadzu) при нагреве в интервале температур 20–1150°С (скорость нагрева 10 K/мин), выдержке при каждой температуре 10 мин и последующей съемке в диапазоне углов 20–60° по 2θ с шагом 0.02° и выдержкой 1.5 с. Изучение особенностей термических свойств соединений выполнено на приборе синхронного термического анализа STA 449 F3 (NETZSCH), с одновременной регистрацией тепловых эффектов и изменения массы образцов. Прибор дополнен приставкой для создания газовых атмосфер с варьированием в них давления кислорода [22]. Эксперимент проведен в условии линейного нагрева со скоростью 10°/мин от комнатной температуры до 1200°C. Для исследования использовали тигли из сплава Pt-Rh c крышками, средняя навеска образцов не превышала 50 мг, погрешность измерения температуры составляет не более ±1.5°С. Последовательность фазовых равновесий при удалении из Nd1 – хАхMnO3 (х = 0, 0.15) (А = Ba, Sr) фиксированных порций кислорода изучена статическим методом с использованием вакуумной циркуляционной установки [23]. Использованная экспериментальная установка обеспечивала поддержание температуры с точностью ±2°С, определение парциального давления кислорода – lg(${{P}_{{{{{\text{O}}}_{2}}}}}$ Па–1) ± 0.1, количества кислорода, удаляемого из исходного образца, m = ±1.0 ат. %. Также с помощью вакуумной циркуляционной установки установлена абсолютная кислородная нестехиометрия исходных соединений путем их восстановления до простых оксидов. В качестве восстановителя использовали водород. Определение кислородной нестехиометрии проведено гравиметрическим методом, при этом принято допущение об отсутствии в условиях нашего эксперимента значимой кислородной нестехиометрии продуктов диссоциации.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
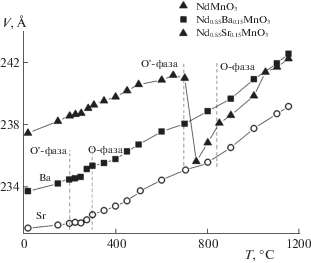
Синтезированные гомогенные соединения по данным рентгенофазового анализа обладают орбитально упорядоченной О'-орторомбической структурой (Pbnm), для которой соотношение параметров элементарной ячейки отвечает условию с/√2 < a < b (табл. 1). Термическая стабильность соединений на воздухе изучена методами высокотемпературного рентгенофазового анализа (ВРФА) и синхронного термического анализа (ТА). При исследовании методам ВРФА установлено, что недопированный манганит неодима NdMnO3±δ сохраняет исходную структуру до температуры 680°С, затем интенсивность пиков упорядоченной фазы понижается, появляются пики, соответствующие орбитально разупорядоченной О-фазе. В интервале температур 740–790°С наблюдается сосуществование двух фаз О' и О с орторомбической структурой. Эти данные подтверждаются методом ТА (рис. 1). На кривой ДСК (№ 1) в этом температурном диапазоне фиксируется эндоэффект. При последующем нагреве идентифицируется орбитально разупорядоченная фаза NdMnO3 ± δ, соотношение параметров элементарной ячейки (Å) соответствует условию а < с/√2 < b. Объем элементарной ячейки при этом изменяется скачкообразно (рис. 2). Особенностью термического поведения допированных манганитов Nd0.85А0.15MnO3±δ (А = Ba, Sr) является то, что изменение соотношения параметров элементарной ячейки и объема V решетки начинается при более низкой температуре, около 250°С (рис. 2), это свидетельствует о ян-теллеровском переходе в них, проявляющемся на кривых ДСК № 2 и ДСК № 3 (рис. 1) эндоэффектами в интервале 250–310°С. В допированных манганитах неодима переход О' → О менее выражен, поскольку в них меньше количество ян-теллеровских ионов марганца Mn3+, соответственно, меньше искажения решетки [24]. Вследствие этого, резкого изменения объема элементарной ячейки при переходе О' → О не наблюдается. Дальнейшее повышение температуры свыше 950°С приводит к переходу О-фазы в квазикубическую с соотношением параметров b ≈ c/√2 ≈ a. На рис. 1 температурные интервалы переходов О → О и О → квазикубическая отмечены штриховыми линиями. На первом этапе нагрева (до 200°С) образцы демонстрируют незначительную потерю массы, обусловленную удалением адсорбированных газов (физическая десорбция). Потеря массы недопированного манганита неодима наблюдается до температуры 550°С, затем начинается стадия его доокисления, связанная с поглощением кислорода из газовой среды, что вызывает прирост массы. У допированных манганитов потеря массы при низких температурах менее значительна, прирост массы, связанный с их окислением заканчивается для всех образцов при температуре перехода в квазикубическую структуру. Возможность большего окисления допированных манганитов неодима по сравнению с недопированным обусловлена химической природой допантов.
Таблица 1.
Кислородная нестехиометрия и кристаллографические параметры соединений Nd1 – хАхMnO3 (х = 0, 0.15) (А = Ba, Sr)
| Соединение | Кислородная нестехиометрия δ при Т = 20°С | Параметры ячейки | |||
|---|---|---|---|---|---|
| а, Å | b, Å | c, Å | V, Å3 | ||
| NdMnO3 ± δ | 0.02 | 5.4091(2) | 5.8173(3) | 7.5482(3) | 237.25(3) |
| Nd0.85Sr0.15MnO3 ± δ | 0.04 | 5.4373(3) | 5.5701(6) | 7.6282(6) | 231.03(6) |
| Nd0.85Ba0.15MnO3 ± δ | 0.01 | 5.4627(4) | 5.5012(5) | 7.7616(6) | 233.25(6) |
Рис. 1.
Кривые ТГ и ДСК образцов Nd1 – хАхMnO3 (х = 0, 0.15) (А = Ba, Sr) при нагреве в атмосфере воздуха: № 1 – NdMnO3, № 2 – Nd0.85Ba0.15MnO3, № 3 – Nd0.85Sr0.15MnO3.
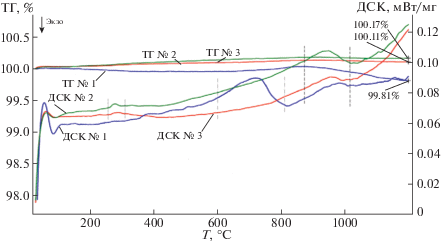
Рис. 2.
Температурные зависимости объема элементарной ячейки образцов Nd1 – хАхMnO3 (х = 0, 0.15) (А = Ba, Sr).
Использование статического метода с применением вакуумной циркуляционной установки позволяет проследить последовательность фазовых равновесий при удалении из оксидов Nd1 ‒ хАхMnO3 (х = 0, 0.15) (А = Ba, Sr) фиксированных порций кислорода [25, 26]. Поэтапное понижение давления кислорода в газовой фазе при постоянстве температуры (Т = 830°С) приводит на первом этапе к изменению кислородной нестехиометрии оксидов, затем – к диссоциации. Исходный манганит неодима диссоциирует при давлении ${{P}_{{{{{\text{O}}}_{2}}}}}$ = 10–14 атм одностадийно по схеме:
(1)
${\text{NdMn}}{{{\text{O}}}_{3}} \to {\text{N}}{{{\text{d}}}_{{\text{2}}}}{{{\text{О}}}_{3}} + {\text{MnO}} + {{{\text{О}}}_{2}}{\kern 1pt} \uparrow {\kern 1pt} .$Для допированных манганитов при этом давлении фиксируется разложение на продукты по первой стадии согласно схемам:
(2)
$\begin{gathered} {\text{N}}{{{\text{d}}}_{{{\text{0}}{\text{.85}}}}}{\text{B}}{{{\text{a}}}_{{{\text{0}}{\text{.15}}}}}{\text{Mn}}{{{\text{O}}}_{3}} \to {\text{N}}{{{\text{d}}}_{{{\text{0}}{\text{.7}}}}}{\text{B}}{{{\text{a}}}_{{{\text{0}}{\text{.3}}}}}{\text{Mn}}{{{\text{O}}}_{3}} + \\ + \;{\text{NdMn}}{{{\text{O}}}_{3}} + {{{\text{О}}}_{2}}{\kern 1pt} \uparrow \; \to {\text{BaO}} + \\ + \;{\text{N}}{{{\text{d}}}_{{\text{2}}}}{{{\text{О}}}_{3}} + {\text{MnO}} + {{{\text{О}}}_{2}}{\kern 1pt} \uparrow , \\ \end{gathered} $(3)
$\begin{gathered} {\text{N}}{{{\text{d}}}_{{0.85}}}{\text{S}}{{{\text{r}}}_{{0.15}}}{\text{Mn}}{{{\text{O}}}_{3}} \to {\text{S}}{{{\text{r}}}_{{(2--y)}}}{\text{N}}{{{\text{d}}}_{y}}{\text{Mn}}{{{\text{O}}}_{4}} + \\ + \;{\text{N}}{{{\text{d}}}_{{\text{2}}}}{{{\text{О}}}_{3}} + {\text{MnO}} + {{{\text{О}}}_{2}}{\kern 1pt} \uparrow \; \to {\text{S}}{{{\text{r}}}_{{\text{2}}}}{\text{Mn}}{{{\text{O}}}_{4}} + \\ + \;{\text{N}}{{{\text{d}}}_{{\text{2}}}}{{{\text{О}}}_{3}} + {\text{MnO}} + {{{\text{О}}}_{2}}{\kern 1pt} \uparrow , \\ \end{gathered} $Рис. 3.
Кривые ТГ и ДСК образцов Nd1 – хАхMnO3 (х = 0,0.15) (А = Ba, Sr) при нагреве в газовой атмосфере с пониженным давлением кислорода ${{P}_{{{{{\text{O}}}_{2}}}}}$ = 10–22.5 атм: № 1 – NdMnO3, № 2 – Nd0.85Ba0.15MnO3, № 3 – Nd0.85Sr0.15MnO3.
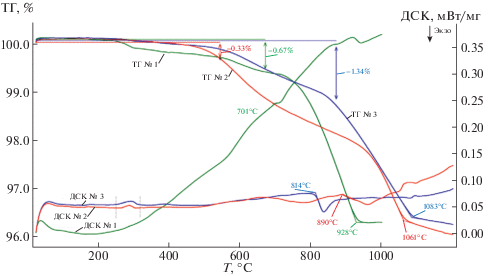
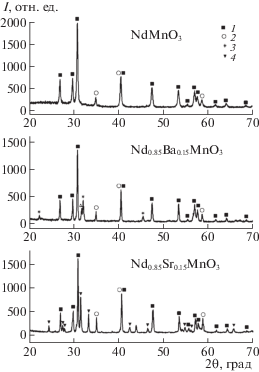
Рис. 4.
Дифрактограммы образцов Nd1 – хАхMnO3 (х = 0, 0.15) (А = Ba, Sr) после термической обработки в атмосфере с пониженным давлением кислорода ${{P}_{{{{{\text{O}}}_{2}}}}}$ = 10–22.5 атм. Обозначения фаз: 1 – Nd2O3, 2 – MnO, 3 – BaO, 4 – Sr2MnO4.
Равновесной термической диссоциации кристаллических веществ при конкретной температуре соответствует определенная величина равновесного давления диссоциации [28]. В настоящей работе статическим методом экспериментально получены температурные зависимости равновесного парциального давления кислорода при диссоциации NdMnO3 и Nd1 – хАхMnO3 (А = Ba, Sr) в температурном интервале 700–900°С, по уравнениям реакций соответственно:
(4)
${\text{NdMn}}{{{\text{O}}}_{3}} = 0.5{\text{N}}{{{\text{d}}}_{{\text{2}}}}{{{\text{О}}}_{3}} + {\text{MnO}} + 0.25{{{\text{О}}}_{2}},$(5)
$\begin{gathered} 2{\text{N}}{{{\text{d}}}_{{0.85}}}{\text{B}}{{{\text{a}}}_{{0.15}}}{\text{Mn}}{{{\text{O}}}_{3}} = 0.85{\text{N}}{{{\text{d}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + \\ + \;0.3{\text{BaO}} + 2{\text{MnO}} + 0.575{{{\text{O}}}_{{\text{2}}}}, \\ \end{gathered} $(6)
$\begin{gathered} 2{\text{N}}{{{\text{d}}}_{{{\text{0}}{\text{.85}}}}}{\text{S}}{{{\text{r}}}_{{{\text{0}}{\text{.15}}}}}{\text{Mn}}{{{\text{O}}}_{3}} = 0.85{\text{N}}{{{\text{d}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + \\ + \;0.15{\text{S}}{{{\text{r}}}_{{\text{2}}}}{\text{Mn}}{{{\text{O}}}_{4}} + 1.85{\text{MnO}} + 0.5{{{\text{O}}}_{2}}, \\ \end{gathered} $Рис. 5.
Температурные зависимости равновесного парциального давления кислорода реакций диссоциации: a – NdMnO3, б – Nd0.85Ba0.15MnO3, c – Nd0.85Sr0.15MnO3.
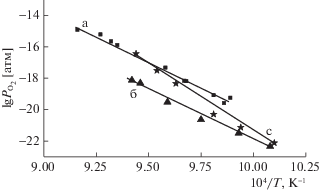
Таким образом, замещение части неодима барием или стронцием оказывает влияние на термические свойства этих оксидов. Термическая обработка полученных оксидов Nd1 – xАxMnO3 ± δ (x = 0, 0.15) (А = Ba,Sr) на воздухе приводит к изменению их структуры в последовательности: О' → O → квазикубическая. Понижение парциального давления кислорода в газовой среде при термической обработке оксидов определяет последовательность фазовых превращений в них. Исходный оксид NdMnO3 диссоциирует в одну стадию, замещенные манганиты претерпевают двухстадийный процесс разложения. Получены значения термодинамических характеристик реакций диссоциации оксидов и их образования из элементов.
Работа выполнена по Государственному заданию ИМЕТ УрО РАН в рамках Программы фундаментальных исследований государственных академий на оборудовании ЦКП “Урал-М”.
Авторы благодарят Димитрова В.М. за помощь в проведении эксперимента и обсуждение результатов.
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Список литературы
Kundu A.K., Selkh M.M., Ramesha K., Rao C.N.R. // J. Phys. Condens Matter. 2005. V. 17. P. 4171.
Dagotto E., Hotto T., Moreo A. // Physica Report. 2001. V. 344. P. 1–153.
Tokura Y. // Rep. Prog. Phys. 2006. V. 69. P. 797.
Belozorov D.P., Girich A.A., Tarapov S.I. et al. // AIP Advances. 2014. V. 4. 037116.
Дунаевский С.М. // Физика твердого тела. 2004. Т. 46. Вып. 2. С. 193.
Cherepanov V.A., Filonova E.A., Voronin V.I. et al. // J. Solid State Chem. 2000. V. 153. № 2. P. 205.
Radaelli P.G., Marezio M., Hwang H.Y. et al. // Ibid. 1996. V. 122. № 2. P. 444.
Woodward P.M., Vogt T., Cox D.E. et al. // Chem. Mater. 1998. V. 10. P. 3652.
Atsumi T., Kamegashira N. // J. Alloys and Comp. 1997. V. 257. P. 161.
Филонова Е.А., Петров А.Н. // Журн. физ. химии. 2009. Т. 83. № 11. С. 2020.
Germov A.Y., Mikhalev K.N., Verkhovskii S.V. et al. // JETP Letters. 2015. V. 102. Is. 11. P. 727.
Kostogloudis G.Ch., Ftikos Ch. // J. Mater. Sci. 1999. V. 34. P. 2169.
Trukhanov S.V., Khomchenko V.A., Lobanovski L.S. et al. // J. Exp. and Theor. Phys. 2006. V. 103. № 3. P. 398.
Frozandeh-Mehr E., Malekzadeh A., Ghiasi M. et al. // Catalysis Communication. 2012. V. 28. P. 32.
Abdel-Latif I.A., Hassen A., Zybill C. et al. // J. Alloys and Comp. 2008. V. 452. P. 245.
Kamegashira N., Miyazaki Y. // Mat. Res. Bull. 1984. V. 19. P. 1201.
Zener C. // Phys. Rev. 1951. V. 82. P. 403.
Kalmykova T., Vakula A., Nedukh S. et al. // Functional Materials. 2018.V. 25. Is. 2.P. 241.
Черепанов В.А., Гаврилова Л.Я., Волкова Н.Е. и др. // Chimica Techno Acta. 2015. № 4. С. 289.
Филонова Е.А., Кузьмина Е.А., Петров А.Н. // Журн. физ. химии. 2003. Т. 77. № 2. С. 199.
Barnabe A., Millange F., Maignan A. et al. // Chem. Mater. 1998. V. 10. P. 252.
Янкин А.М., Ведмидь Л.Б. Изобарическая приставка к синхронному термоанализатору. Пат. РФ. № 88452. Опубл. 10.11.2009.
Янкин А.М., Балакирев В.Ф., Ведмидь Л.Б. и др. Статический метод исследования гетерогенных равновесий // Журн. физ. химии. 2003. Т. 77. № 11. С. 2108.
Alonso J.A., Martínez-Lope M.J., Casais M.T. et al. // Inorg. Chem. 2000. V. 39. № 5. P. 917.
Федорова О.М., Ведмидь Л.Б., Димитров В.М. // Неорган. материалы. 2019. Т. 55. № 10. С. 1087.
Ведмидь Л.Б., Янкин А.М., Федорова О.М. и др. // Неорган. материалы. 2015. Т. 51. № 3. С. 338.
Ведмидь Л.Б., Янкин А.М., Козин В.М. и др. // Журн. физ. химии. 2017. Т. 91. № 8. С. 1273.
Витвицкий А.И. // Журн. прикл. химии. 2016. Т. 89. Вып. 2. С. 185.
Портной К.И., Тимофеева Н.И. Кислородные соединения редкоземельных элементов. М.: Металлургия. 1986. 480 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


